一株耐药性肺炎克雷伯菌噬菌体RDP-KP-20004及其应用的制作方法
一株耐药性肺炎克雷伯菌噬菌体rdp
‑
kp
‑
20004及其应用
技术领域
1.本发明涉及生物技术领域,特别是涉及一株耐药性肺炎克雷伯菌噬菌体rdp
‑
kp
‑
20004及其在禽类动物致病性肺炎克雷伯菌感染中的应用。
背景技术:
2.抗生素的发现及应用,是人类的一大革命。自面世以来,就一直扮演着重要的角色,它对细菌性感染的特殊疗效,推动了人类的医疗水平实现迅速飞跃。但是,抗生素的不规范使用,导致细菌耐药性甚至多重耐药性成为日益突出的问题。医学研究者指出,每年在全世界大约有超过50%的抗生素被滥用,而中国这一比例甚至接近80%。除医疗领域外,种植、养殖业过量使用抗生素的情况也比较严重,这将直接影响到食品安全,威胁的是整个人类的健康。
3.噬菌体又称细菌病毒,是一种在细菌体内完成增殖,通过裂解细菌将自身释放到环境中的微生物。噬菌体在1896年被发现并引起广泛关注,但随着后来抗生素的发现和应用使得噬菌体的研究处于停滞状态。直到20世纪80年代,由于多重耐药菌的出现,研究者们又开始重视噬菌体的研究。与抗生素治疗相比,噬菌体治疗具有代谢效率低、杀死细菌的最低剂量低、高度的特异性、高效的杀菌效果、筛选速度快等优势。近年来,有关噬菌体的研究有了巨大的发展,国内外对噬菌体的应用研究范围很广,包括针对人类疾病的防治、动物疾病的防治、食品中病原菌的清除、农作物的细菌感染防治、细菌生物被膜的裂解等方面。
4.肺炎克雷伯菌是革兰氏阴性菌,在水和土壤中广泛存在,在人和动物的肠道和呼吸道内,可引发多种组织发生病变。β
‑
内酰胺类、喹诺酮类等抗生素是临床常用抗菌药物。面对这些抗菌药物的大量使用,肺炎克雷伯菌产生多种耐药机制。
技术实现要素:
5.本发明的目的在于提供一株耐药性肺炎克雷伯菌噬菌体rdp
‑
kp
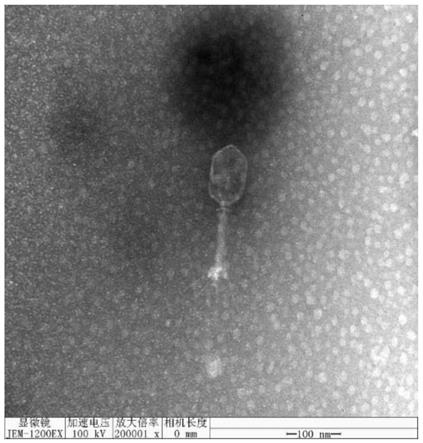
‑
20004,旨在解决养殖场禽类因感染肺炎克雷伯菌,发病急而治疗不及时,且因致病菌耐药性而导致用药无效等问题。
6.为实现上述目的,本发明采用如下技术方案:
7.一株耐药性肺炎克雷伯菌噬菌体rdp
‑
kp
‑
20004,该噬菌体有一个多面体立体对称的头部,包裹着核酸,直径约70nm,有一个长约170nm的尾,有尾鞘,颈部连着头部和尾部,为有尾病毒目肌尾病毒科,该噬菌体于2020年12月17日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为:北京市朝阳区北辰西路1号院3号,保藏编号cgmcc no.21407。
8.进一步地,该噬菌体在ph在5
‑
9范围内能维持较好的活性,其效价在1
×
106pfu/ml之上,在ph为7时,效价最高,适宜生长在中性环境中;在ph=12以及ph=3时,仍有噬菌体存活,该噬菌体的酸碱耐受范围宽。
9.进一步地,该噬菌体在35
‑
55℃的温度范围内,效价稳定,保持在10
10
pfu/ml以上,
在80℃高温条件下作用30min,依然具有生物活性,对温度有较好的耐受性。
10.进一步地,该噬菌体rdp
‑
kp
‑
20004可高效感染肺炎克雷伯菌,其最佳感染复数为0.1。
11.本发明还提供了肺炎克雷伯菌噬菌体rdp
‑
kp
‑
20004在制备预防和或治疗肺炎克雷伯菌引起的疾病的药物中的用途。
12.本发明还提供了肺炎克雷伯菌噬菌体rdp
‑
kp
‑
20004在制备预防和或治疗肺炎克雷伯菌引起的疾病的饲料中的用途。
13.本发明还提供了一种用于防治肺炎克雷伯菌的杀菌组合物,包括有效量的肺炎克雷伯菌噬菌体rdp
‑
kp
‑
20004。
14.进一步地,还包括用于抗肺炎克雷伯菌的抗生素。
15.本发明还提供了一种预防和或治疗肺炎克雷伯菌引起的疾病的添加剂,其有效成分包括肺炎克雷伯菌噬菌体rdp
‑
kp
‑
20004。
16.本发明还提供了一种清洁剂或消毒剂,包括本发明的肺炎克雷伯菌噬菌体rdp
‑
kp
‑
20004。
17.本发明的有益效果体现在:
18.(1)本发明从青岛即墨田横的一养殖场病鸡肝脏内分离得到肺炎克雷伯菌bk
‑
20004,并通过实验确定了bk
‑
20004的致病性和耐药性,以bk
‑
20004为宿主,从环境中分离得到一株肺炎克雷伯菌噬菌体,该噬菌体rdp
‑
kp
‑
20004对禽类养殖环境中致病性肺炎克雷伯菌bk
‑
20004具有强裂解效用,为工业化生产噬菌体用于禽类养殖环境中致病性肺炎克雷伯菌bk
‑
20004的防治提供了噬菌体来源;
19.(2)本发明所提供的肺炎克雷伯菌噬菌体rdp
‑
kp
‑
20004在治疗感染肺炎克雷伯菌后的疾病具有很好的优势,效价较高,防治效果好。
20.(3)本发明所提供的肺炎克雷伯菌噬菌体rdp
‑
kp
‑
20004在防控禽类致病性变形杆菌中具有良好的应用前景。
附图说明
21.本发明上述的以及其他的特征、性质和优势将通过下面结合附图和实施例的描述而变的更加明显:
22.图1为本发明噬菌体rdp
‑
kp
‑
20004的电镜图;
23.图2为本发明噬菌体rdp
‑
kp
‑
20004一步生产曲线的示意图;
24.图3为本发明噬菌体rdp
‑
kp
‑
20004酸碱稳定性实验的示意图;
25.图4为本发明噬菌体rdp
‑
kp
‑
20004热稳定性实验的示意图;
26.图5为本发明噬菌体rdp
‑
kp
‑
20004遗传稳定性实验的示意图;
27.图6为本发明噬菌体rdp
‑
kp
‑
20004对宿主菌bk
‑
20004的裂解曲线示意图;
具体实施方式
28.下面结合附图和实施例对本发明作进一步说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发
明的保护范围。
29.实施例1肺炎克雷伯菌bk
‑
20004的分离与保存
30.本宿主从从青岛即墨田横的一养殖场采样,无菌操作取病鸡肝脏,在选择性培养基上划线,37℃培养18
‑
24h,病菌在lb培养基上形成浓厚、灰白色、圆凸、表面湿润的光滑型菌落;在麦康凯琼脂培养基上形成浓厚而丰盛的粉红色粘稠菌落,具有扩散性;在lb肉汤中形成白色粘稠沉淀,振摇后呈均匀浑浊;挑取典型菌落继续划线纯化3~5次,直至菌落形态一致,然后挑取单菌落接种于5ml的lb肉汤培养基中,37℃,200rpm振荡培养12h,得到均匀浑浊的细菌悬浮液。再通过16srna分子鉴定和血清型鉴定,确定为致病性肺炎克雷伯菌,将其中一株命名为bk
‑
20004,鉴定好的菌株在lb培养基平板上划线,培养12h,将全部菌落用接种环刮至30%甘油
‑
lb液体中,保存于
‑
80℃冰箱。
31.实施例2宿主菌bk
‑
20004药物敏感试验
32.根据抗生素敏感性试验执行标准m100
‑
s17clsi对临床常用抗生素氨苄西林、头孢他啶、头孢哌酮、卡那霉素、头孢吡肟、环丙沙星六种药物进行敏感性试验,以escherichia coli atcc 25922作为做抗性谱试验的质控菌株。具体方法如下:
33.(1)制备mha培养基:将灭菌后的mha培养基融化,冷却至50℃左右倒入平板,平板厚度约4mm,静置半小时,使培养基凝固。
34.(2)制备菌液:用移液器分别吸取10μl宿主bk
‑
20004和质控菌株加入到5ml液体lb中,于37℃,200rpm振荡培养12h。
35.(3)取6
‑
6.5ml加热融化的液体琼脂粉,加入到10ml灭菌后的ep管中,再吸取200μl的待测菌液加入到ep管中,颠倒充分摇匀之后,直接倾倒在mha平板的培养基表面上,盖上盖子,水平放置在培养箱中,待菌液完全被培养基吸收即可。
36.(4)在mha平板背面标记好放置抗生素纸片的位置,并标明抗生素名称。对超净工作台进行紫外消毒,用酒精灯外火焰灼烧摄子尖部,再用缓子夹取灭菌后的小纸片(圆形滤纸)平铺在mha培养基表面,取1μl相应的抗生素加在每个小纸片上,静置,待抗生素完全浸入纸片即可(为了能准确的观察结果,要求纸片中也的间距≥24mm,可用綴子轻压纸片,保证其与培养基紧密贴合)。每组设置平行实验。
37.(5)将mha平板倒置于37℃培养箱,培养12h左右。
38.(6)培养完成后,用游标卡尺测量抑菌圈直径,根据直径大小判断细菌对抗生素敏感程度,判断标准依据肠杆菌科细菌抑菌圈直径执行(判断标准见表1、耐药性实验结果见表2)。
39.表1肠杆菌科细菌抑菌圈直径判断标准
[0040][0041]
表2宿主菌耐药性实验结果
[0042][0043]
由表2可知,肺炎克雷伯菌bk
‑
20004对临床常用的头孢菌素类表现出较强耐药作用,对卡那霉素、环丙沙星药物敏感度也不高。
[0044]
实施例3噬菌体rdp
‑
kp
‑
20004的分离及鉴定
[0045]
(1)病料处理:从养殖场取病鸡,解剖留取肝脏,无菌操作剪取2g肝脏组织,加入2ml灭菌lb液体,将肝脏充分研磨,然后10000rpm离心30min,取上清液过0.22μm滤器,将滤出液备用;
[0046]
(2)制备噬菌体富集液:取0.2ml菌悬液和1ml滤出液加入5ml lb肉汤中,37℃,100rpm振荡培养过夜,然后10000rpm离心5min,取上清液过0.22μm滤器,滤出液备用;
[0047]
(3)噬菌体分离:采用双层平板法进行噬菌体的分离,取噬菌体富集液滤出液0.1ml和宿主克雷伯菌菌悬液0.2ml混合均匀后,37℃水浴10min,然后铺双平板,放于37℃培养箱培养6
‑
8h后,挑取透明斑于1ml sm缓冲液中4℃浸泡12h,取0.1ml浸出液和0.2ml菌
悬液37℃水浴10min,铺双平板,37℃培养箱培养4
‑
6h纯化,照此步骤纯化5次,即得。rdp
‑
kp
‑
20004在双平板形成的噬菌斑直径在3mm
‑
5mm。
[0048]
噬菌体rdp
‑
kp
‑
20004保存方法:将噬菌体增殖液与60%的甘油按照1:1的比例混合,保存于
‑
80℃冰箱或液氮中均可。
[0049]
实施例4噬菌体的电镜观察
[0050]
取20μl含噬菌体粗制颗粒的液体滴于铜网上,自然沉淀15min,并用滤纸从侧面吸去多余液体,加一滴2%的磷钨酸(pta)于铜网上对噬菌体染色10min,然后用滤纸从侧面吸去染色液,待样品干燥后用电子显微镜观察噬菌体形态,如图1所示。
[0051]
噬菌体rdp
‑
kp
‑
20004有一个多面体立体对称的头部,包裹着核酸,直径约70nm,有一个长约170nm的尾,有尾鞘,颈部连着头部和尾部。根据国际病毒分类学组织病毒分类第九次报告,该噬菌体归类为有尾病毒目肌尾病毒科。
[0052]
实施例5噬菌体最佳感染复数测定
[0053]
按照感染复数为100、10、1、0.1、0.01的比例将噬菌体增殖液和宿主加入lb肉汤中,并且确保培养体系的总体积相同。于37℃200rpm振荡培养8h后,常温下12000r/min离心5min,取上清液铺双平板测定其效价。具体参见表3。
[0054]
表3最佳感染复数的测定结果
[0055][0056]
由表3数据显示,当感染复数为0.1时,培养8h后,增殖液较为清澈,效价最高,说明rdp
‑
kp
‑
20004的最佳感染复数为0.1。
[0057]
实施例6一步生长曲线测定
[0058]
取对数生长期的肺炎克雷伯菌悬液,按照最佳感染复数的比例接种肺炎克雷伯菌bk
‑
20004和噬菌体rdp
‑
kp
‑
20004,在37℃的条件下,水浴10min,然后常温下12000r/min离心5min,弃上清液,除去未吸附在宿主上的游离噬菌体,如此用lb肉汤培养基洗涤两次。再将沉淀重悬于37℃的lb肉汤培养基中,迅速置于37℃200r/min的摇床中振荡培养并计时。前30min每隔5min取样计数,30
‑
60min每隔20min计数,60
‑
300min每隔30min计数,以时间为横坐标,噬菌体效价对数值为纵坐标,绘制生长曲线,如图2所示。并得出噬菌体的潜伏期、裂解期,并计算出平均裂解量。平均裂解量=暴发末期噬菌体滴度/感染初期宿主菌浓度。
[0059]
由图2可以看出,噬菌体感染宿主菌后的60min内效价没有明显变化,表明其潜伏期约60min,感染后60
‑
120min内噬菌体的效价明显上升,之后趋于稳定,表明噬菌体裂解期约为60min。通过计算,噬菌体裂解量约为160pfu/感染细胞,表明噬菌体具有极强的裂解和复制能力。
[0060]
实施例7ph稳定性测定
[0061]
制备105cfu/ml的指数期宿主菌液,将噬菌体液按最佳感染复数调整浓度。调整lb液体培养基的ph值分别为2、3、4、5、6、7、8、9、10、11、12,取噬菌体液加入到等体积的不同ph值下的lb液体培养基混匀,37℃培养箱静置2h后,取100μl混合液与等体积的菌液混合,通过双层板法测效价,每个ph值三个平行,绘制ph
‑
效价曲线,确定最高点的ph范围。如图3所示。
[0062]
由图3可知,噬菌体rdp
‑
kp
‑
20004在ph5.0
‑
9.0范围能维持较好的活性,噬菌体能保持较高的效价,在ph为7.0时,噬菌体效价最高。随着ph值的升高或降低,噬菌体的效价下降明显;表明噬菌体rdp
‑
kp
‑
20004虽不能耐受强酸强碱,但可以很好地耐受弱酸弱碱。
[0063]
实施例8最适生长温度测定
[0064]
制备105cfu/ml指数期宿主菌液,将噬菌体原液按照最佳感染复数稀释到适合浓度,取100μl与等体积菌液混合,倒双层平板,分别置于35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃和80℃下培养30min和60min,通过双层板法测噬菌体效价,每个温度三个平行,绘制温度
‑
效价曲线,确定最高点的温度范围。如图4所示。
[0065]
由图4可知,噬菌体在35
‑
55℃的温度范围内,效价稳定,保持在10
10
pfu/ml以上,在80℃高温条件下作用30min,依然具有生物活性,说明在短时间内噬菌体能够耐受较高的温度。
[0066]
实施例9遗传稳定性实验
[0067]
将rdp
‑
kp
‑
20004连续传代29次,每代培养基中加入等量的rdp
‑
kp
‑
20004和kp
‑
20004,每代培养时间6h,然后倒双平板,测定其效价。如图5所示。
[0068]
由图5可知,噬菌体rdp
‑
kp
‑
20004在传代29次的过程中,始终保持较高的效价,没有出现明显波动,说明该噬菌体可以稳定遗传
[0069]
实施例10噬菌体对宿主裂解曲线
[0070]
在细菌悬液中加入噬菌体,由于噬菌体对宿主的裂解作用,导致od600的值产生变化,由此得到噬菌体对宿主的裂解曲线。将培养6h的宿主菌悬液以1:100的比例接种到100ml lb培养基中,以最佳感染复数,向其中加入噬菌体增殖液,同时以不加噬菌体的作为对照,每组设置3个平行,结果取其平均值。结果如图6所示。
[0071]
由图6可以看出,没有加入噬菌体的宿主,随着宿主的增殖,其od600在40min内逐渐增加,60min
‑
120min内呈指数增加,在240min后趋于稳定,而加入噬菌体的宿主,在前40min,噬菌体处于对宿主的吸附、侵染阶段,od600有所增加,随着宿主菌指数级增加,噬菌体的增长也呈现指数式,随着噬菌体裂解宿主,100min内其od600没有明显的提升,但随着时间的延长,噬菌体裂解率达到顶峰,未被裂解的宿主菌继续繁殖,其od600逐渐增大。
[0072]
应当指出的是,具体实施方式只是本发明比较由代表性的例子,显然本发明的技术方案不限于上述实施例,还可以有很多变形。本领域的普通技术人员,以本发明所明确公开的或根据文件的书面描述毫无异议的得到的,均应认为是本专利所要保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1