含有特异性分子靶标的空肠弯曲菌标准菌株及其检测和应用的制作方法
60859,分 类名为:campylobacter jejuni。上述分离获得的空肠弯曲菌菌株346
‑
1c、3853
‑
1a、 542
‑
1a均保藏于广东省微生物菌种保藏中心,地址:中国广州市先烈中路100 号省微生物所实验楼五楼,保藏日期:2019年10月27日。
5.本发明采用的技术方案为:
6.本发明提供了用于检测空肠弯曲菌的特异性分子靶标,所述分子靶标为:
7.(a)如seq id no:1~3所示的任意一种或几种核苷酸序列;或者,
8.(b)在(a)中的核苷酸序列经过取代、缺失或添加一个或几个核苷酸且 与(a)中核苷酸具有90%以上同源性的核苷酸序列。在发现3株新的空肠弯曲 菌的同时还发现这三株菌分别含有一段特异的分子靶标,能使其区别与其他菌 株,具有较强的特异性。
9.本发明提供了检测所述的特异性分子靶标的引物,针对如seq id no:1所 示的核苷酸序列扩增的pcr引物包括:如seq id no:4所示的上游引物和如 seq id no:5所示的下游引物;针对如seq id no:2所示的核苷酸序列扩增的 pcr引物包括:如seq id no:6所示的上游引物和如seq id no:7所示的下游 引物;针对如seq id no:3所示的核苷酸序列扩增的pcr引物包括如seq idno:8所示的上游引物和如seq id no:9所示的下游引物。发明人针对上述特异 性分子靶标设计了引物,能特异扩增出上述片段,因此,可作为检测上述分子 靶标的特异性引物。
10.本发明还提供了一种空肠弯曲菌(campylobacter jejuni),是(a)、(b)或 (c):
11.(a)菌株346
‑
1c含有如seq id no:1所示的核苷酸序列;
12.(b)菌株3853
‑
1a含有如seq id no:2所示的核苷酸序列;
13.(c)菌株542
‑
1a含有如seq id no:3所示的核苷酸序列。
14.优选地,所述菌株346
‑
1c还包含了以下毒力基因:cdtb、cdtc、ciab、plda、 flig、dnaj、racr、cadf、cdta、doca、imaa、rpon和ceue;并且对以下抗生素 具有耐药性:头孢哌酮、环丙沙星、四环素、萘啶酸和万古霉素。
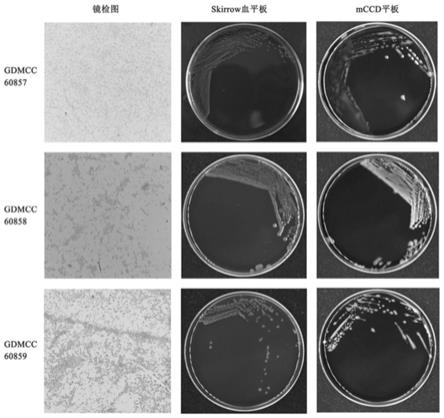
15.优选地,所述菌株3853
‑
1a还包含了以下毒力基因:cdtb、cdtc、ciab、plda、 flig、dnaj、racr、cadf、cdta、doca、imaa、rpon、flaa、wlan和ceue;并且 对以下抗生素具有耐药性:头孢哌酮、环丙沙星、四环素、萘啶酸和万古霉素。
16.优选地,所述菌株542
‑
1a还包含了以下毒力基因:cdtb、cdtc、ciab、plda、 flig、dnaj、racr、cadf、cdta、doca、imaa、rpon、flaa和ceue;并且对以下 抗生素具有耐药性:头孢哌酮、克林霉素、阿莫西林、环丙沙星、四环素、链 霉素、卡那霉素、氨苄西林、奈啶酸和万古霉素。
17.优选地,所述菌株346
‑
1c的保藏编号为:gdmcc 60857;所述菌株3853
‑
1a 的保藏编号为:gdmcc 60858;所述菌株542
‑
1a的保藏编号为gdmcc 60859。
18.本发明还提供了所述的空肠弯曲菌在研究空肠弯曲菌抗生素耐药性中的应 用。优选地,所述菌株
‑
1的抗生素耐药性为对头孢哌酮、环丙沙星、四环素、 萘啶酸和万古霉素的耐药性;所述菌株
‑
2的抗生素耐药性为对头孢哌酮、环丙 沙星、四环素、萘啶酸和万古霉素的耐药性;所述菌株
‑
3的抗生素耐药性为对 头孢哌酮、克林霉素、阿莫西林、环丙沙星、四环素、链霉素、卡那霉素、氨 苄西林、奈啶酸和万古霉素的耐药性。
19.优选地,所述抗生素包括以下抗生素中的任意一种或几种:头孢哌酮、环 丙沙星、四环素、奈啶酸、万古霉素、链霉素、卡那霉素、氨苄西林、克林霉 素或和阿莫西林。
20.本发明还提供了所述的空肠弯曲菌在提高检验空肠弯曲菌显色平板的准确 性中的应用。
21.本发明还提供了一种用于制备定量空肠弯曲菌质控菌的冻干保护剂,包括 以下重量份的组分:胎牛血清2~7份、脱脂奶粉5~20份、乳酸钾0.2
‑
5份、肌 醇1
‑
4份、l
‑
半胱氨酸盐酸盐0.1
‑
2份。
22.优选地,包括以下重量份的组分:胎牛血清5份、脱脂奶粉20份、乳酸钾 5份、肌醇2份、l
‑
半胱氨酸盐酸盐1份。
23.本发明之所以选择上述组分是由于肌醇具有很强的亲水性,在冷冻或干燥 过程中,可与菌体细胞膜磷脂中的磷酸基团或与菌体蛋白质极性基团形成氢键, 保护细胞膜和蛋白质结构与功能的完整性,脱脂奶粉能够包裹在菌体细胞外层 保护菌体。胎牛血清对菌悬液起到稳定作用,乳酸钾和l
‑
半胱氨酸盐酸盐在冷 冻干燥过程和长期储存中降低细胞氧化酶的活性,防止冻干品的氧化变质。
24.本发明的有益效果为:本发明空肠弯曲菌gdmcc 60857、gdmcc 60858、 gdmcc 60859,具有标准的空肠弯曲菌的菌体显微形态和生理生化特征,可用 于检验空肠弯曲菌显色平板的准确性,以及相关试剂验证的标准菌株。这些菌 株为中国国内本土的食品来源菌株,且来源清晰可靠,遗传背景清晰。从api campy反应的结果可见,所述菌株为空肠弯曲菌,但从典型值t可知,其性状 和api所选择的标准菌株差别较大,是具有中国地区遗传背景和典型性状的菌 株,因此这些菌株可以作为中国空肠弯曲菌检测的特异性的参考菌株。gdmcc 60857和gdmcc 60858具有特异性的分子靶标位点,可以使用pcr直接鉴定, 具有快速、便宜、易操作等特点。gdmcc 60859具有一个较大的耐药岛,也可 以通过pcr或者测序鉴定。
25.另外,针对本发明的空肠弯曲菌,发明人提供了一种空肠弯曲菌冻干保护 剂,所述保护剂具有以下优点:成型好,外观漂亮且水溶性好,1
‑
2秒内能够完 全溶解;冻干存活率能达到40%以上;在
‑
20℃条件下可以保存至少一年以上, 能够保证其数量级不发生变化,可用于长期储存质控菌株。
附图说明
26.图1为空肠弯曲菌在skirrow血平板和改良ccd平板上菌落形态图,及其 革兰氏染色后镜检观察形态图;
27.图2为空肠弯曲菌中靶标位点具有特异性示意图(a:图中编号346
‑
5和346
‑
7 能扩增出目的条带,其他编号的空肠弯曲菌菌株无目的条带,编号346
‑
5和346
‑
7 为保藏号gdmcc 60857的菌株(菌株
‑
1);b:图中编号24(+)能扩增出目的 条带,其他编号的空肠弯曲菌菌株无目的条带,编号24为保藏号gdmcc 60858 的菌株(菌株
‑
2);c:图中“+”能扩增出目的条带,其他编号的空肠弯曲菌菌 株无目的条带,编号“+”为保藏号gdmcc 60859的菌株(菌株
‑
3)
28.图3为本发明保藏号gdmcc 60857的空肠弯曲菌菌株与其他种属相比具有 特异性的示意图,图中显示其他菌属(包括苏云金杆菌、蜡样芽胞杆菌、大肠 杆菌、小肠结肠炎耶尔森氏菌、金黄色葡萄球菌、单增李斯特氏菌、克罗诺杆 菌、副溶血性弧菌和沙门氏菌)没有扩增出目的大小条带(279bp),而本发明 的空肠弯曲菌具有目的条带。
29.图4为本发明保藏号gdmcc 60857的空肠弯曲菌菌株与其他机构保存的标 准菌株相比具有特异性的示意图,图中显示其他菌属(单核增生李斯特菌 [lm19115、lm54002、lm54004]、金黄色葡萄球菌[sa25923]、铜绿假单胞菌 [pa9027、pa27853、pa10104]、沙门氏菌[sal150335、sal1402]、大肠杆菌[ec25922]、 小肠结肠炎耶尔森氏菌[ye5402、jc2、y802、c009]、蜡样芽胞杆菌[bc2068]和 空肠弯曲菌[cj33291])没有扩增出目的条带,而本发明的空肠弯曲菌具有目的 条带。
[0030]
图5为空肠弯曲杆菌定量质控菌储存期内的变化示意图。
具体实施方式
[0031]
为了更加简洁明了的展示本发明的技术方案、目的和优点,下面结合具体 实施例和附图详细说明本发明的技术方案。
[0032]
实施例1空肠弯曲菌标准菌株的分离、鉴定和培养
[0033]
取25g(ml)样品(水果、蔬菜或水产品为50g)加入盛有225ml bolton 肉汤的有滤网的均质袋中(若为无滤网均质袋可使用无菌纱布过滤),用拍击式 均质器均质1min~2min,经滤网或无菌纱布过滤,将滤过液进行培养。在微 需氧条件下,36℃
±
1℃培养4h,如条件允许配以100r/min的速度进行振荡。 必要时测定增菌液的ph值并调整至7.4
±
0.2,42℃
±
1℃继续培养24h~48 h。将24h增菌液、48h增菌液及对应的1:50稀释液分别划线接种于skirrow 血琼脂与mccda琼脂平板上,微需氧条件下42℃
±
1℃培养24h~48h。另 外可选择使用空肠弯曲菌显色平板作为补充。观察24h培养与48h培养的琼 脂平板上的菌落形态,空肠弯曲菌显色培养基上的可疑菌落按照说明进行判定。 挑取5个(如少于5个则全部挑取)或更多的可疑菌落接种到哥伦比亚血琼 脂平板上,微需氧条件下42℃
±
1℃培养24h~48h。按照gb4789.9
‑
2014进 行鉴定。将目标菌落从血平板上,用布氏肉汤进行重悬,加入新鲜的甘油肉汤 (终浓度为25%),并加入0.025%fbp,保存于
‑
80℃冰箱。纯化后的菌株可进 行形态特征、生理生化和分子生物学等鉴定
[0034]
实施例2空肠弯曲菌标准菌株的生理生化特征鉴定
[0035]
(1)选择性培养基生长状况
[0036]
mccda琼脂平板上的可疑菌落通常为淡灰色,有金属光泽、潮湿、扁平, 呈扩散生长的倾向。skirrow血琼脂平板上的第一型可疑菌落为灰色、扁平、湿 润有光泽,呈沿接种线向外扩散的倾向;第二型可疑菌落常呈分散凸起的单个 菌落,边缘整齐、发亮,结果如图1所示。
[0037]
(2)镜检
[0038]
染色镜检:将可疑菌落涂片,进行革兰氏染色,镜检观察形态。所有空肠 弯曲菌为革兰氏阴性,染色为红色,菌体轻度弯曲呈逗点状,无芽孢和荚膜, 有鞭毛,结果如图1所示。
[0039]
(3)api campy鉴定
[0040]
从空肠弯曲菌从skirrow平板上上刮取菌落,用生理盐水制备成浊度适当的 细胞悬浮液,使用api campy生化鉴定试剂条鉴定,鉴定结果如表1所示:
[0041]
表1:api campy鉴定结果
[0042][0043]
从表1api campy反应的结果可知,上述筛选出的菌株为空肠弯曲菌,但 从典型值t可知,其性状和api所选择的标准菌株差别较大,是具有中国地区 遗传背景和典型性状的菌株,因此这些菌株可以作为中国空肠弯曲菌检测的特 异性的参考菌株。
[0044]
实施例3空肠弯曲菌标准菌株的毒力因子携带特征的鉴定
[0045]
采用pcr的方法鉴定菌株携带的毒力基因。所使用的引物由上海生工生物有 限公司合成(引物序列见表2)。
[0046]
pcr扩增体系(25μl)包含:2
×
ferment pcr mix,12.5μl;0.4μm上下 游引物;ddh2o,8.5μl和基因组dna,2μl。8
‑
10μl的pcr产物上样于2.0% 琼脂糖凝胶进行电泳分离(120v,40min),使用2000pb dna marker。
[0047]
经过pcr及凝胶电泳确认,所述菌株gdmcc 60857携带的毒力因子有:
[0048]
cdtb
‑
cdtc
‑
ciab
‑
plda
‑
flig
‑
dnaj
‑
racr
‑
cadf
‑
cdta
‑
doca
‑
imaa
‑
rpon
‑
ceue;
[0049]
gdmcc 60859携带的毒力因子为:
[0050]
cdtb
‑
cdtc
‑
ciab
‑
plda
‑
flig
‑
dnaj
‑
racr
‑
cadf
‑
cdta
‑
doca
‑
imaa
‑
rpon
‑
flaa
‑
ceue;gdmcc
[0051]
60858携带的毒力因子为:
[0052]
cdtb
‑
cdtc
‑
ciab
‑
plda
‑
flig
‑
dnaj
‑
racr
‑
cadf
‑
cdta
‑
doca
‑
imaa
‑
rpon
‑
flaa
‑
wlan
‑
ceue。
[0053]
表2.毒力相关基因引物
[0054][0055]
实施例4空肠弯曲菌标准菌株的药敏特征鉴定
[0056]
空肠弯曲菌在布氏肉汤中培养约40小时后,调整od
600
为0.1~0.3,吸取100 μl的菌液,涂布于含5%羊血的mh平板,待菌液干了之后将抗生素纸片贴在 培养基表面,42℃培养24h。采用游标卡尺测定抑菌圈大小,精确至0.01mm。 选用的抗生素如下:头孢哌酮、红霉素、克林霉素、庆大霉素、链霉素、卡那 霉素、环丙沙星、萘啶酸、阿莫西林、氨苄西林、四环素、万古霉素。escherichiacoli atcc25922和atcc25922作为质控菌株。空肠弯曲菌gdmcc 60857的耐 药谱为cfp(头孢哌酮)
‑
cip(环丙沙星)
‑
te(四环素)
‑
na(萘啶酸)
‑
va(万 古霉素);gdmcc 60858的耐药谱为cfp(头孢哌酮)
‑
cip(环丙沙星)
‑
te(四 环素)
‑
na(萘啶酸)
‑
va(万古霉素);gdmcc 60859的耐药谱为cfp(头孢 哌酮)
‑
da(克林霉素)
‑
aml(阿莫西林)
‑
cip(环丙沙星)
‑
te(四环素)
‑
s (链霉素)
‑
k(卡那霉素)
‑
amp(氨苄西林)
‑
na(奈啶酸)
‑
va(万古霉素)。
[0057]
实施例5空肠弯曲菌标准菌株的多位点序列(mlst)分型分析
[0058]
采用mlst官网所述的实验方案,所使用的7对引物由上海生工生物有限 公司合成(引物序列见表3)。多位点序列分型的试剂为takara的hsdna polymerase,pcr的反应体系总50μl:5
×
primestar buffer(mg2+plus) 10μl,dntp mixture 4μl,引物各1μl,模板1μl,primestar hs dnapolymerase(2.5u/μl)1μl,加超纯水补齐。pcr反应条件:95℃预变性,5min; 94℃变性,2min;50℃退火,1min;72℃延伸,1min;共进行35循环;最后72℃ 终延伸,10min。pcr结束之后进行凝胶电泳,确认产物大小正确,将产物交 赛默飞世尔科技(中国)有限公司进行双向测序。将测序结果与mlst数据库 中进行匹配分析,分别获取七个管家基因位点的等位基因数值,并形成相应的 等位基因谱,判断其序列型,分型结果如表4所示。
[0059]
表3:空肠弯曲菌mlst分型引物序列
[0060][0061]
表4:mlst分型结果
[0062][0063][0064]
使用上述7个管家基因进行mlst分型,其st型结果如表4所示,其中 st9558以及9560均为st新的型别。
[0065]
实施例6空肠弯曲菌标准菌株的特征序列分析
[0066]
主要根据空肠弯曲菌的泛基因组分析结果获得菌株特有的非必需基因。共 选取了74株空肠弯曲菌(含gdmcc 60857、gdmcc 60858、gdmcc 60859 菌株)的基因组序列来进行泛基因组分析。泛基因组采用原核生物泛基因组自 动化分析软件(pan
‑
genomics analysis pipeline,pgap)中的gf方法来分析, 通过本地perl脚本对分析结果进行处理,得到所有菌株的核心基因及非核心基 因信息。
[0067]
提取空肠弯曲菌特有的非核心基因蛋白序列,通过本地blast分别将其比对 回空肠弯曲菌的蛋白总库及ncbi非冗余蛋白数据库(nr),去除能mapping到 nr库的序列,剩余序列即为特异性序列。gdmcc 60857_00919的特异序列如 seq id no:1所示,gdmcc 60858_02046的特异序列如seq id no:2所示。 使用primer 5针对这些特异性序列设计引物,由上海生工合成引物(引物序列 见表5),其反应条件和体系见表6和表7。特有基因通过pcr扩增检验其特异 性,包括该分子序列在空肠弯曲菌中的特异性,其他菌株中的特异性,其他机 构保存菌株中的特异性,具体pcr结果见附图2
‑
4。
[0068]
菌株gdmcc 60859中发现了较为特殊的耐药基因岛,该耐药岛携带有9 种耐药相关基因,该耐药岛在空肠弯曲菌中首次发现,其具体信息见特异序列 seq id no:3。
[0069]
表5:特异性靶标位点引物
[0070][0071][0072]
表6.特异性标签的pcr反应体系
[0073][0074]
注:a所使用mix为thermofisher k8081
[0075]
表7特异性分子标签分子鉴定pcr反应程序
[0076][0077]
本发明还提供一种空肠弯曲菌定量保存的冻干保护剂,不同实施例以及对 比例中冻干保护剂的组分如表8所示:
[0078]
表8:各组冻干保护剂的组分
[0079][0080]
在对比例中增加脱脂奶粉的重量份以补足由于其缺少组分的总分量。
[0081]
将以实施例7~9与对比例1~3保护剂的冻干菌种(gdmcc 60857)其冻干 存活率,具体方法如下:
[0082]
将菌种复苏后接入培养基中培养至对数后期至稳定期前期选取合适的菌量 加入到实施例7~9与对比例1~3保护剂中,混合均匀后分装至西林瓶中,并取 样进行稀释计数,为冻干前含菌量a0。将分装好的西林瓶半加塞转入冻干机中 进行预冻,预冻温度为
‑
40℃,时间为3小时,开启主干燥,时间20
‑
25h,之后 进入解析干燥阶段,时间为6
‑
8小时,结束干燥,在真空状态下压塞并移出冻干 机,进行自动轧盖,保证样品的完全真空状态,并置于
‑
20℃低温保存。取冻干 后的样品进行稀释计数,计数结果为冻干后含菌量a,冻干存活率为a与a0 的百分比,结果如表9所示:
[0083]
表9:不同组成的冻干保护剂冻干存活率的比较
[0084][0085][0086]
由表9可以看出,实施例9的冻干保护剂是本发明的最佳实施例,因此, 以实施例9
为比较对象,制备了对比例1~3冻干保护剂,结果如表9所示,由 于对比例1~3分别缺少本发明冻干保护剂的其中一种组分,其保护效果均比实 施例要差,由此说明本发明的冻干保护剂的中的组分乳酸钾、肌醇和l
‑
半胱氨 酸盐酸盐之间存在协同增效效应,缺少其中任何一种均不能达到本发明保护剂 的效果。
[0087]
将以实施例7~9与对比例1~3保护剂的冻干菌种比较其冻干稳定性,具体 方法如下:
[0088]
按照实施例7的制备方法使用不同的保护剂进行制备定量质控菌,并置于
ꢀ‑
20℃条件下储存,每个月抽取3支按照前述计数方法进行检验含菌量。为了更 好的比较各保护剂在长期储存过程中的效果,在制备定量质控菌时按照各保护 剂的冻干存活率进行计算冻干前的活菌数,使各保护剂冻干后,菌含量均约为 3000cfu/瓶。
[0089]
由附图5可知,经12个月储存后由实施例7~9的冻干保护剂保护的含菌量 无显著变化,而由对比例1~3冻干保护剂保护的含菌量在经2个月后菌含量显 著下降,到12个月后菌含量接近0。
[0090]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细, 但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的 普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改 进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权 利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1