一种检测PGR基因表达的引物、探针、试剂盒和检测方法与流程
本发明属于医学分子生物学技术领域,具体地,涉及一种检测pgr基因表达的引物、探针、试剂盒和检测方法。
背景技术:
erα、pr、her-2和ki-67状态是判断早期浸润性乳腺癌(非特殊类型)分子分型的重要指标,根据其不同的状态可以分为luminal型(luminala和luminalb)、her-2过表达型或基底样型(basal-like)。现有的研究表明,与原发灶相比,部分晚期乳腺癌转移灶的erα、pr和her2状态均可能发生变化,导致晚期乳腺癌治疗策略随之改变。统计显示,原发灶er、pr、her2为阳性而转移灶为阴性乳腺癌病例的发生比例分别为12%~24%、22%~41%、3%~16%,由原发灶阴性而转移灶阳性病例比例依次为5%~9%、7%~19%、1%~5%。由于乳腺癌肿瘤本身的异质性,即使早期乳腺癌同一瘤体内部肿瘤异质性的存在,有可能在肿瘤进展出现优势克隆,从而出现和原发肿瘤不同的基因表达谱。
erα介导的信号通路可导致her2表达下调,erα表达水平越高乳腺癌复发风险越低。pr的表达很大程度上依赖于erα,肿瘤组织中表达pr而不表达erα的概率不到1%,乳腺癌复发时erα及pr表达均降低,且乳腺癌hr+/her2+亚型发生转移后更易转变为hr-/her2+亚型(p=0.006)。研究表明化疗和内分泌治疗与erα状态改变可能相关,erα状态在原发灶和转移灶检测前后不一致的患者较两者一致的患者预后更差,尤其是erα阳性转阴性的患者。复发/转移性乳腺癌再活检明确erα、pr、her2状态,对进一步治疗至关重要。专家建议在临床可能的情况下对于所有晚期乳腺癌患者进行复发/转移灶erα、pr和her2状态再活检,根据再活检erα、pr和her2状态,结合临床及影像学特征综合考虑选择复发/转移性乳腺癌的治疗策略。指南建议应对所有的乳腺浸润性癌和非浸润性癌进行激素受体状态检测。
目前常用的基因状态检测方法是利用免疫组织化学(ihc)这种在病理科进行的半定量的方法,用抗体对肿瘤组织中蛋白进行检测。但根据美国临床肿瘤学会(asco)和美国病理医生协会(cap)的联合研究,由于受免疫组织化学技术本身所限,每五个乳腺癌患者就有一个可能由于ihc检测不准确而接受了错误的治疗方案。因此,临床上亟需一种准确性高的基因表达检测方法。
技术实现要素:
为了解决上述技术问题中的至少一个,本发明采用的技术方案如下:
本发明第一方面提供一种用于检测pgr基因表达的引物对组合,包括用于扩增pgr基因的第一引物对,所述第一引物对的上下游引物分别具有seqidno.1和seqidno.2所示核苷酸序列。
pgr基因编码孕酮受体(progesteronereceptor,pr)。pr也被称为nr3c3,nuclearreceptorsubfamily3,groupc,member3,即核受体第三亚族c组成员3)是一种细胞内蛋白质,由甾体激素孕酮激活。
进一步地,所述引物对组合还包括分别用于扩增内参基因actb和pgk1的第二引物对和第三引物对,其中,所述第二引物对的上下游引物分别具有seqidno.3和seqidno.4所示核苷酸序列;所述第三引物对的上下游引物分别具有seqidno.5和seqidno.6所示核苷酸序列。
actb基因是一个管家基因,在大多数细胞中表达水平相对稳定,编码β-actin,是细胞骨架肌动蛋白之一。磷酸甘油酸激酶基因(pgk1)编码磷酸甘油酸激酶(pgk)。pgk是糖酵解的关键酶,也是每种生物得以生存的必须酶,属于保守基因。
本发明的第二方面提供一种探针组合,包括本发明第一方面所述第一引物对的扩增产物的第一探针,所述第一探针具有seqidno.7所示核苷酸序列。
在本发明的一些实施方案中,所述第一探针利用荧光基团进行标记。在本发明的一些具体实施方案中,所述第一探针5'端利用fam进行标记,3'利用bhq1进行标记。
进一步地,所述探针组合进一步包括靶向本发明第一方面所述第二引物对的扩增产物的第二探针,和靶向本发明第一方面所述第三引物对的扩增产物的第三探针。
在本发明的一些实施方案中,所述第二探针和所述第三探针利用不同荧光基团进行标记。在本发明的一些具体实施方案中,所述第二探针5'端利用vic进行标记,3'利用bhq2进行标记;所述第三探针5'端利用cy5进行标记,3'利用bhq2进行标记。
本发明的第三方面提供一种用于检测pgr基因表达的试剂盒,所述试剂盒包括本发明第一方面所述的引物组合对和第发明第二方面所述的探针组合。
在本发明的一些实施方案中,所述试剂盒包括所述第一引物对和所述第一探针。进一步地,所述第一探针利用荧光基团进行标记。在本发明的一些具体实施方案中,所述第一探针5'端利用fam进行标记,3'利用bhq1进行标记。
在本发明的一些实施方案中,所述试剂盒包括所述第一引物对、所述第二引物对和所述第三引物对,以及所述第一探针、所述第二探针和所述第三探针。进一步地,所述第二探针和所述第三探针利用不同荧光基团进行标记。在本发明的一些具体实施方案中,所述第一探针5'端利用fam进行标记,3'利用bhq1进行标记;所述第二探针5'端利用vic进行标记,3'利用bhq2进行标记;所述第三探针5'端利用cy5进行标记,3'利用bhq2进行标记。
在本发明的一些其他实施方案中,所述探针可以利用其他的荧光基团和淬灭基团进行标记,只要能够实现相同的检测目的即可。
进一步地,所述引物对组合和所述探针组合以引物探针混合液的形式存在。在本发明的一些具体实施方案中,所述引物探针混合液为含有0.2~1μm各引物、0.1~0.2μm各探针、3mmmgcl2和0.25mmdntp的pcr缓冲液。
更进一步地,所述试剂盒还包括酶混合液、阳性对照品和/或阴性对照品。
在本发明的一些实施方案中,所述酶混合液包括逆转录酶和dna聚合酶,其可以是任何商业化的逆转录酶和dna聚合酶组成的酶混合液。在本发明的一些具体实施方案中,酶混合液包含2400u逆转录酶和24-30udna聚合酶。
在本发明的一些实施方案中,所述阳性对照品为体外转录的pgr基因、actb基因和pgk1基因片段rna混合液。
在本发明的一些实施方案中,所述阴性对照品为无核酸酶水。
本发明的第四方面提供一种检测pgr基因表达的方法,包括以下步骤:
s1,获得待测样本的核酸样本;
s2,利用本发明第一方面所述第一引物对、所述第二引物对和所述第三引物对,以及所述第一探针、所述第二探针和所述第三探针对所述核酸样本进行rt-qpcr扩增,其中,所述第一探针、所述第二探针和所述第三探针利用不同荧光基团进行标记;
s3,分别得到pgr和内参基因actb、pgk1基因的ct值,并利用下述公式获得δct值:
δct=ctpgr-(ctactb+ctpgk1)/2
根据δct值,判断pgr基因表达情况:δct<5阳性,pgr基因表达阳性;
δct≥5阴性,pgr基因表达阴性。
在本发明的一些实施方案中,所述第一探针5'端利用fam进行标记,3'利用bhq1进行标记;所述第二探针5'端利用vic进行标记,3'利用bhq2进行标记;所述第三探针5'端利用cy5进行标记,3'利用bhq2进行标记。
在本发明的一些实施方案中,步骤s2中,进行扩增rt-qpcr扩增的体系如下:
20μl体系:引物探针混合液19μl,酶混合液1μl,其中,
所述引物探针混合液为含有0.2~1μm各引物、0.1~0.2μm各探针、3mmmgcl2和0.25mmdntp的pcr缓冲液,
所述酶混合液包含2400u逆转录酶和24~30udna聚合酶;
扩增程序如下:
50℃20分钟;
95℃3分钟;
95℃10秒,60℃30秒,收集荧光信号,45个循环。
在本发明中,所述待测样本为肿瘤组织样本,所述核酸样本为rna样本。
在本发明的一些实施方案中,所述方法基于非诊断或治疗目的对所述pgr基因进行检测。
本发明的其他方面还提供:
本发明第一方面所述第一引物对、所述第二引物对和所述第三引物对,或其与所述第一探针、所述第二探针和所述第三探针在制备用于检测患者生物样本中pgr基因表达的试剂盒中的应用。
在本发明的一些实施方案中,患者为肿瘤患者。在本发明的一些具体实施方案中,所述肿瘤患者为乳腺癌患者,相应地,所述样本为乳腺肿瘤样本。
本发明的有益效果
本发明相对于现有技术,具有以下有益效果:
本发明利用引物探针对pgr基因表达进行rt-qpcr检测,检测样本类型不局限于石蜡包埋组织,新鲜组织、冰冻组织均能检测。
利用本发明进行pgr基因表示检测,所需样本量少,无需稀释rna使用多重荧光pcr技术进行检测。
本发明的试剂盒含有内控系统,能更加准确、稳定地对样本进行检测,确保结果真实可信。
本发明的检测方法检测周期短,4个小时就能完成检测。可以连续检测,结果判读简单客观,人为误差小,重复性好,较ihc更加灵敏可靠。操作简便,可以实现自动化、经济省时、可批量操作。
附图说明
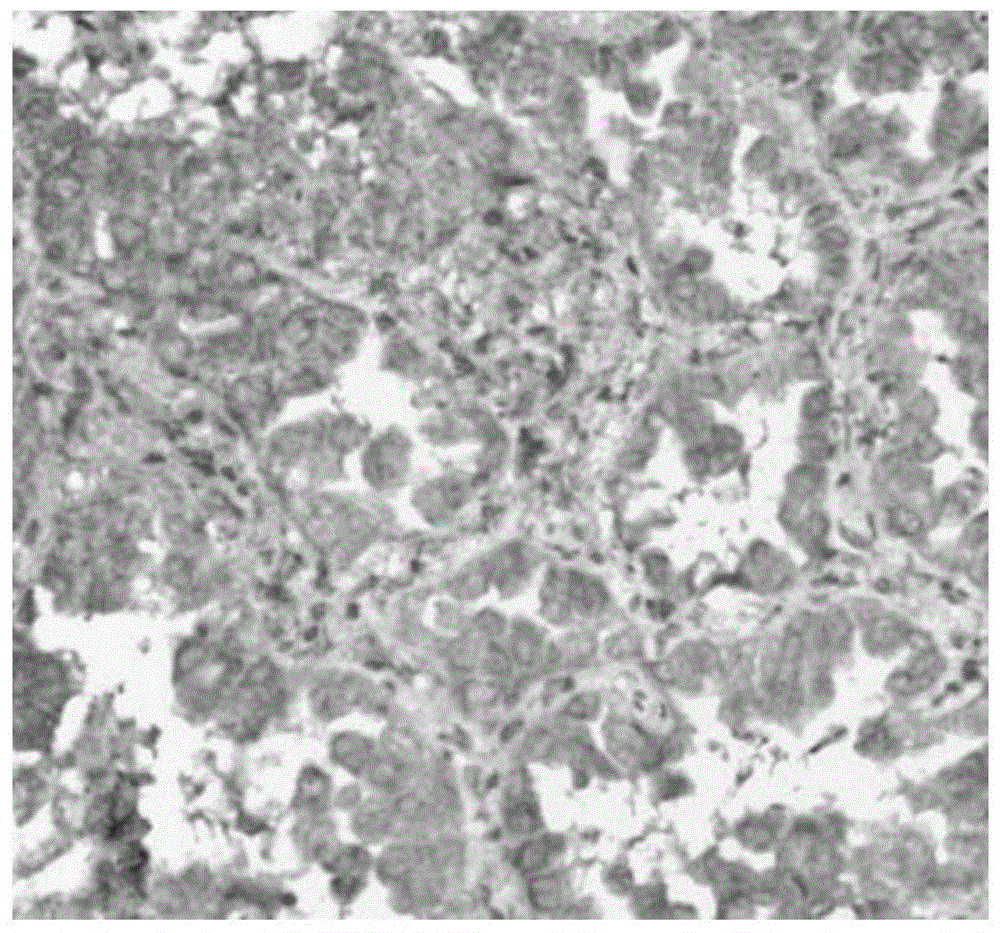
图1示出了本发明实施例3中肿瘤组织免疫组化结果。
图2示出了本发明实施例3中阳性对照品rt-qpcr检测扩增曲线。
图3示出了本发明实施例3中肿瘤组织rna样本rt-qpcr检测扩增曲线。
具体实施方式
为了使本发明所解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。
实施例
以下例子在此用于示范本发明的优选实施方案。本领域内的技术人员会明白,下述例子中披露的技术代表发明人发现的可以用于实施本发明的技术,因此可以视为实施本发明的优选方案。但是本领域内的技术人员根据本说明书应该明白,这里所公开的特定实施例可以做很多修改,仍然能得到相同的或者类似的结果,而非背离本发明的精神或范围。
除非另有定义,所有在此使用的技术和科学的术语,和本发明所属领域内的技术人员所通常理解的意思相同,在此公开引用及他们引用的材料都将以引用的方式被并入。
那些本领域内的技术人员将意识到或者通过常规试验就能了解许多这里所描述的发明的特定实施方案的许多等同技术。这些等同将被包含在权利要求书中。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的仪器设备,如无特殊说明,均为实验室常规仪器设备;下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
实施例1一种检测pgr基因表达引物、探针和rt-qpcr试剂盒
根据目标基因序列设计特异性引物,设计的引物和探针可以按照现有方法进行人工合成。具体引物如下所示:
pgr-fo:ttacctgtgggagctgtaagg(seqidno.1)
pgr-re:agtcatttcttccagcacataag(seqidno.2)
actb-fo:ttctacaatgagctgcgtgtg(seqidno.3)
actb-re:ggtgttgaaggtctcaaacatga(seqidno.4)
pgk1-fo:tccttagagccagttgctgtag(seqidno.5)
pgk1-re:gcacaggctttctccactt(seqidno.6)
探针序列如下:
pgr-pr:ttgtgctgcccttccattgccct(seqidno.7)
其中,5'端利用fam进行标记,3'利用bhq1进行标记。
actb-pr:ccgtgctgctgaccgaggcc(seqidno.8)
其中,5'端利用vic进行标记,3'利用bhq2进行标记。
pgk1-pr:tctctgctgggcaaggatgttctgttc(seqidno.9)
其中,5'端利用cy5进行标记,3'利用bhq2进行标记。
利用上述引物可探针可制备得到检测pgr基因表达的rt-qpcr检测试剂盒,该试剂盒包含以下四组分,分别为:
pgr探针引物混合液:包含上述用于检测pgr、actb和pgk1基因表达的特异性引物(0.2-1μm)和探针(0.1-0.2μm),以及pcr缓冲液、3mmmgcl2和0.25mmdntp。
酶混合液:包括2400u逆转录酶和24-30udna聚合酶。
阳性对照品:为体外转录的pgr基因、actb和pgk1基因片段rna混合液。
阴性对照品:为无核酸酶水。
利用rt-qpcr检测pgr基因的优点包括:
(1)检测样本类型不局限于石蜡包埋组织,新鲜组织、冰冻组织均能检测;所需样本量少,使用多重荧光pcr技术进行检测,含有内控系统,能更加准确、稳定地对样本进行检测,确保结果真实可信;
(2)以连续检测,结果判读简单客观,人为误差小,重复性好,较ihc更加灵敏可靠
(3)操作简便,可以实现自动化、经济省时、可批量操作。
实施例2pgr基因表达rt-qpcr检测方法
分别采用免疫组化试剂盒和方法及上述rt-qpcr试剂盒和rt-qpcr检测方法检测pgr基因表达,
rt-qpcr检测包括以下步骤:
(1)待测肿瘤样本rna提取和样本rna定量;
取肿瘤组织按照商业化提取试剂盒说明书提取rna。提取的rna进行定量,浓度不低于10ng/μl,样本rna直接作为pcr模板。
(2)反应混合液配制
将实施例1制备的试剂盒中所有组分平衡至室温融化,根据待检测样本数,计算并配制反应混合液,20μl体系配制表如表2所示。
表2反应混合液配制表
将反应混合液按照20μl/孔加入到八联pcr反应管中,将待检样本rna、阳性对照品和阴性对照品分别以5μl/孔加入到对应pcr反应管中,进行pcr扩增。
(3)pcr扩增
pcr扩增程序
50℃20分钟;
95℃3分钟;
95℃10秒,60℃30秒(收集fam、vic、cy5荧光信号),45个循环。
利用上述步骤,检测周期不超过4个小时,方便快捷。
(4)结果分析
①阈值设定:根据不同机型设定阈值。ct值确定:选择阳性对照品反应管,阴性对照品和样品反应管一并划定阈值,分别得到pgr和内参基因actb、pgk1基因的ct值。
②阴性对照品孔(ntc)应无扩增曲线升起;
③阳性对照品孔(pc)各荧光信号均有扩增曲线,且ct值<30。
④pgr基因检测结果以δct进行分析,根据δct值判定样本中pgr基因的表达情况。
δct样本=ct样本pgr-ct样本内参平均值
ct样本内参平均值=(ct样本actb+ct样本pgk1)/2
若δct<5,则表示检测结果阳性,即pgr基因表达阳性;若δct≥5,则表示检测结果阴性,即pgr基因表达阴性。
实施例3rt-qpcr检测试剂盒和rt-qpcr检测方法的实际应用
采用实施例1的rt-qpcr检测试剂盒和实施例2的rt-qpcr检测方法检测乳腺癌患者肿瘤组织中pgr基因表达,所用样本为石蜡包埋的乳腺癌肿瘤组织样本。
免疫组化的检测方法如下:
采用商业化孕酮受体抗体试剂(孕酮受体抗体试剂(免疫组织化法),国食药监械(进)字2014第3403112号,roche)、ventana检测试剂盒(ultraviewdabdetectionkit,roche)在ventanabenchmarkxt自动切片染色仪上进行乳腺癌肿瘤石蜡包埋组织切片样本中表达的雌激素受体(er)抗原检测,按照试剂盒中的操作说明书进行检测:
(1)使用与待实施的抗体规程相对应的载片条形码标签;
(2)把一抗、相应的检测试剂盒分配器和要用到的辅助试剂放到试剂托盘上,并把试剂托盘放到自动切片染色仪上;
(3)检查散装液体及废弃物;
(4)把载片放到自动切片染色仪上;
(5)开始染色测定;
(6)在完成测定后,从自动切片染色仪上取下载片;
(7)用温和的洗涤剂或酒精清洗,去除盖玻片溶液;
(8)按常规方式,用永久性封固介质对载片脱水、清洗和盖片。
检测结果如图1所示,由图1可知,该肿瘤组织样本esr表达呈阳性。
rt-qpcr检测方法如下:
(1)待测肿瘤样本rna提取和样本rna定量
采用商业化试剂盒(rneasyffpekit,73504,qiagen)提取样本rna,按照试剂盒说明书操作提取得到样本rna。
(2)反应混合液配制
将实施例1制备的试剂盒中所有组分平衡至室温融化,根据待检测样本数,计算并配制反应混合液,如表3所示:
表3反应混合液配制表
将反应混合液按20μl/孔加入到pcr反应管,将待检的肿瘤组织rna、阳性对照品和阴性对照品分别以5μl/孔加入到对应pcr反应管中,进行pcr扩增。
(3)pcr扩增
pcr扩增程序
50℃20分钟;
95℃3分钟;
95℃10秒,60℃30秒(收集fam、vic、cy5荧光信号),45个循环。
(4)结果分析
阳性对照品及肿瘤组织样本检测结果见图2和图3,具体检测ct见表4。按照下面公式计算:
δct=ctpgr-(ctactb+ctpgk1)/2
表4检测ct值结果
由此,按照上述公式计算得到阳性对照品δct=-0.6605<5;样本δct=0.8135<5。根据δct值判定该样本为pgr表达阳性,结果与免疫组化结果符合。
实施例4rt-qpcr检测试剂盒和rt-qpcr检测方法的实际应用
采用实施例1的rt-qpcr检测试剂盒和实施例2的rt-qpcr检测方法检测其它乳腺癌患者肿瘤组织中pgr基因表达,所用样本为肿瘤组织样本。
rt-qpcr检测方法如下:
(1)待测肿瘤样本rna提取和样本rna定量
采用商业化试剂盒(rneasyffpekit,73504,qiagen)提取样本rna,按照试剂盒说明书操作提取得到样本rna。
(2)反应混合液配制
将实施例1制备的试剂盒中所有组分平衡至室温融化,根据待检测样本数,计算并配制反应混合液,如表5所示:
表5反应混合液配制表
将反应混合液按20μl/孔加入到pcr反应管,将待检的肿瘤组织rna、阳性对照品和阴性对照品分别以5μl/孔加入到对应pcr反应管中,进行pcr扩增。
(3)pcr扩增
pcr扩增程序
50℃20分钟;
95℃3分钟;
95℃10秒,60℃30秒(收集fam、vic、cy5荧光信号),45个循环。
(4)结果分析
具体检测ct见表5,其中,δct值按照下面公式计算:
δct=ctpgr-(ctactb+ctpgk1)/2
表5检测ct值结果
其中,对于样本5,进一步重复检测验证,证明pgr基因表达确实呈现阳性结果,表明本发明的检测试剂盒和检测方法的检测准确性高于ihc检测。
以上结果表明,本发明的检测试剂盒和检测方法对肿瘤组织尤其是乳腺癌肿瘤组织的pgr基因表达水平检测具有非常高的灵敏性和准确性。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110>杭州联川基因诊断技术有限公司
<120>一种检测pgr基因表达的引物、探针、试剂盒和检测方法
<130>aj2010298
<160>9
<170>siposequencelisting1.0
<210>1
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>1
ttacctgtgggagctgtaagg21
<210>2
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>2
agtcatttcttccagcacataag23
<210>3
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>3
ttctacaatgagctgcgtgtg21
<210>4
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>4
ggtgttgaaggtctcaaacatga23
<210>5
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>5
tccttagagccagttgctgtag22
<210>6
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>6
gcacaggctttctccactt19
<210>7
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>7
ttgtgctgcccttccattgccct23
<210>8
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>8
ccgtgctgctgaccgaggcc20
<210>9
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>9
tctctgctgggcaaggatgttctgttc27
- 还没有人留言评论。精彩留言会获得点赞!