一种通用型TRUCK-T细胞、其制备方法以及用途与流程
一种通用型truck
‑
t细胞、其制备方法以及用途
技术领域
1.本发明涉及基于car
‑
t技术的免疫治疗领域,具体涉及一种通用型truck
‑
t细胞(即,u
‑
truck
‑
t细胞)。
背景技术:
2.作为肿瘤免疫治疗的主要手段之一,car
‑
t细胞治疗在白血病、淋巴瘤、多发性骨髓瘤的治疗中展现出惊艳的治疗效果。目前全球car
‑
t领先的几大巨头公司:诺华、kite、juno、cellectis在靶点、共刺激区域、转染方式等方面设计各具特色,诺华ctl019即将成为全球首个上市的car
‑
t产品。国内car
‑
t治疗发展紧随美国,百花齐放,开展的car
‑
t临床试验已上百项。
3.随着2017年两款针对cd19的car
‑
t产品入市,car
‑
t在血液肿瘤中的应用也得到了世界认可。但血液肿瘤病人只占肿瘤病人的23%,其余大多为实体肿瘤,而现如今实体瘤的治疗手段有限,甚至一些实体瘤没有靶向药及治疗手段。car
‑
t在实体瘤上的应用也越来越广泛,目前有国内外针对实体瘤开展了近200多例临床,主要集中在黑色素瘤、肝癌、肺癌、乳腺癌等高发性癌症。虽然car
‑
t在实体瘤中应用取得了一定的进展,但肿瘤微环境仍为导致许多临床效果不理想的主要原因之一。因此如何让car
‑
t细胞更好的作用于肿瘤病灶已到达抑制肿瘤,乃至消灭肿瘤是目前急待解决的问题。
4.介于car
‑
t在治疗肿瘤中的广泛应用,结合基因编辑,在第三代car
‑
t的基础上,引入外源细胞因子,将car
‑
t改造为能够招募其他天然免疫细胞,增加杀伤性因子释放,降低肿瘤血管的生成,清除细胞外基质等作用第四代car
‑
t细胞,即通用型truck
‑
t,用于难治复发性实体瘤的治疗。
5.由于car
‑
t在实体瘤中有了广泛的应用,并取得了一定了疗效,但治疗效果不尽人意,使得car
‑
t在治疗实体瘤方面受到限制。基于car
‑
t在实体瘤治疗上无法达到血液瘤的治疗效果的因素研究,肿瘤微环境及car
‑
t未能重复的进入实体瘤等因素为限制car
‑
t在实体瘤中疗效的主要原因。针对以上主要因素,结合基因编辑,在第三代car
‑
t的基础上,引入外源细胞因子,将car
‑
t改造为能够招募其他天然免疫细胞、增加杀伤性因子释放、降低肿瘤血管的生成、清除细胞外基质等作用的第四代car
‑
t细胞,即通用型truck
‑
t,用于难治复发性实体瘤的治疗。
6.根据现有技术报道,car
‑
t临床研究大都采用二代car
‑
t技术,而采用第四代car
‑
t技术在临床上研究报道不多。传统的truck
‑
t制备的t细胞主要来源于患者自身,在洁净室(good manufacture practice,gmp)环境下经过体外分离t细胞、激活、car和细胞因子利用慢病毒随机插入基因组、培养扩增,最后经过质控回输回患者体内。由于患者自身条件的影响导致不适合采血或采血分离t细胞后扩增难的问题会随之而来。当患者病情危急,从t细胞的分离到car
‑
t的回输,整个流程的等待时间也将是自体回输要面临的重大问题。这些问题给car
‑
t技术的广泛应用带来了局限性,因此目前car
‑
t细胞治疗的一个重要研究方向是如何使用一个健康献血者的t细胞制备大量的car
‑
t细胞,满足患者的临床使用。这一技术
的建立将极大降低car
‑
t疗法的成本,可以更好的保证统一制备的细胞质量,而且患者在需要时可以马上得到car
‑
t细胞进行治疗。
7.利用基因编辑技术,将trac和b2m敲除掉的同时,将靶向癌细胞的car基因片段和表达外源细胞因子的基因片段分别插入到trac和b2m启动子后面,利用t细胞原有的trac的启动子调控car的表达,使得t细胞更加接近自然未进行基因修饰的t细胞。同时,利用活化t细胞核因子(nuclear factor of activated t cells,nfat)调控外源细胞因子的表达,避免了利用慢病毒随机插入和随时高表达外源细胞因子而引起因子综合征的风险。当car识别抗原后,t细胞被激活,外源细胞因子此时释放,外源细胞因子的释放如il12,能够招募其他天然免疫细胞,增加杀伤性因子释放,降低肿瘤血管的生成,清除细胞外基质,可以使得冷肿瘤变为热肿瘤,可以使得更多的肿瘤细胞及抗原释放出来,在car
‑
t和天然细胞作用下,使得肿瘤细胞可以更好的被识别并消除,大大加强了疗效。
8.发明概述
9.1.一种制备通用型人类truck
‑
t细胞的方法,包括:
10.(i)从淋巴系统健康的受试者获得t细胞,通过基因编辑技术破坏所述人类t细胞中:
11.14号染色体的trac基因区域;和
12.15号染色体的b2m基因区域;并且
13.(ii)利用同源重组原理把car分子和外源细胞因子基因序列分别插入到trac和b2m切割位点,以利用t细胞自身的trac的启动子和nfat进行表达。
14.2.根据项1所述的方法,其中,car分子利用t细胞自身的trac的启动子启动表达,外源细胞因子基因序列还包括nfat序列。
15.3.根据项1所述的方法,其中,所述trac基因区域为14号染色体第23016448位至第23016490位;所述b2m基因区域为15号染色体第45003745位至第45003788位。
16.4.根据项1所述的方法,其中,利用同源重组原理把car分子插入到trac切割位点;把外源细胞因子基因序列插入到b2m切割位点。
17.5.根据项1所述的方法,其中,所述基因编辑技术包括基于锌指核酸酶的基因编辑技术、talen基因编辑技术或crrispr/cas基因编辑技术。
18.6.根据项5所述的方法,其中,所述crrispr/cas基因编辑技术包括crrispr/cas9技术。
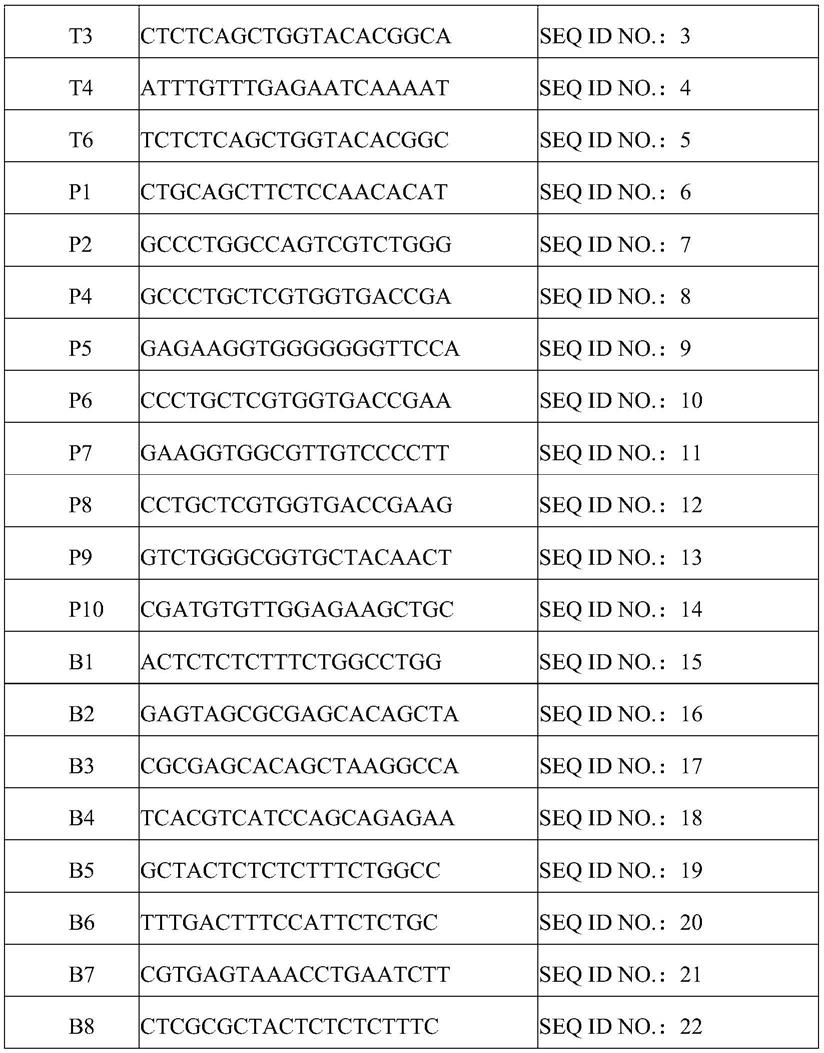
19.7.根据项6所述的方法,其中,在使用所述crrispr/cas9技术时,针对待编辑的目标trac基因区域所使用的sgrna包括seq id no.:2~5的sgrna,而针对待编辑的目标b2m基因区域所使用的sgrna包括seq id no.:15~22的sgrna。
[0020][0021][0022]
8.根据项6所述的方法,其中,在使用所述crrispr/cas9技术时,针对待编辑的目标trac基因区域所使用的sgrna包括seq id no.:2的sgrna,而针对待编辑的目标b2m基因区域所使用的sgrna包括seq id no.:20的sgrna。
[0023]
9.根据项1所述的方法,其中,所述car靶向的靶标包括间皮素、cd19、cd123、cd20、gpc3、her2、egfr、ny
‑
eso
‑
1、muc1、ebv、pmsa、gd2、taa。
[0024]
10.根据项1或9所述的方法,其中,所述外源细胞因子包括:il
‑
12、il17、ccl19。
[0025]
11.使用根据项1至10中任一项所述的方法制成的通用型truck
‑
t细胞。
[0026]
12.根据项11所述通用型truck
‑
t细胞在制备用于治疗患者中的癌症的药物的用
途。
[0027]
13.根据项12所述的用途,其中所述癌症是实体瘤。
[0028]
14.根据项13所述的用途,其中所述实体瘤是高表达间皮素的实体瘤,包括卵巢癌、胃癌和肺癌。
附图说明
[0029]
图1为u
‑
truck
‑
t的il12表达量检测。
[0030]
图2为通用型truck
‑
t的car表达量检测。
[0031]
图3展示了通用型truck
‑
t的敲除效率。
[0032]
图4为cd4/cd8比例的检测。
[0033]
图5为记忆型细胞的表达检测。
[0034]
图6为细胞扩增实验。
[0035]
图7为il12在基因组中的敲入(knock in,ki)检测。
[0036]
图8为car在基因组中的敲入(knock in,ki)检测。
[0037]
图9为细胞杀伤实验。
具体实施方式
[0038]
本发明一方面提供了制备通用truck
‑
t细胞的方法。在一些实施方案中,该方法包括将car分子的编码核苷酸或载体导入本发明所描述的任何基因改造的t细胞(如通用t细胞)。
[0039]
在一些实施方案中,提供了一种制备通用truck
‑
t细胞的方法,包括:
[0040]
(i)将包含靶向14号染色体第23016448位至第23016490位的trac基因的sgrna导入t细胞以破坏所述trac基因区域;和/或
[0041]
(ii)将包含靶向15号染色体第45003745位至第45003788位的b2m基因的sgrna导入该t细胞以破坏所述b2m基因区域;和/或
[0042]
(iii)将包含靶向2号染色体第242800936位至第242800978位的pd
‑
1基因区域的sgrna,或靶向2号染色体第242795009位至第242795051位的pd
‑
1基因区域的sgrna,导入该t细胞以破坏所述pd
‑
1基因区域;以及
[0043]
(iv)将嵌合抗原受体(car)的编码核酸导入该t细胞。
[0044]
car分子或其编码核酸以及靶向trac的sgrna,靶向b2m的sgrna和car分子或其编码核苷酸可以以任何适合的顺序导入t细胞。在一些实施方案中,靶向trac的sgrna,靶向b2m的sgrna和car分子或其编码核苷酸同时导入该t细胞。在一些实施方案中,car分子或其编码核苷酸先于靶向trac的sgrna,靶向b2m的sgrna导入该t细胞。在一些实施方案中,car分子的编码核苷酸导入已经实现基因编辑的t细胞中,该t细胞的trac,b2m基因区域已经通过编辑被破坏。在一些实施方案中,该方法还包括将cas9或其编码核苷酸与所述sgrna一并导入该t细胞。
[0045]
在一些实施方案中,所述car分子是指表达嵌合抗原受体的基因,可与“car基因片段”、互换使用。
[0046]
trac基因是指编码t细胞受体α链恒定区的基因,对其进行破坏能够阻止αβ型tcr
表达。在破坏t细胞的天然tcr表达的同时,让car转基因在trac基因的位点表达,接受天然tcr基因启动子的调控。
[0047]
b2m基因是指编码β2微球蛋白(b2m)的基因,该蛋白是人体白细胞抗原i类分子(hla
‑
i)的一个β轻链。其主要功能是参与淋巴细胞与靶细胞表面抗原的识别,因此b2m与组织相容性密切相关。体内几乎所有有核细胞均能合成β2微球蛋白,附着于细胞表面。β2微球蛋白的缺失会导致hla
‑
i类分子聚合异常,从而不能形成完整的功能分子。通过基因编辑技术敲除car
‑
t细胞中的b2m基因,从而使其不能表达正常的hla
‑
i类分子,进而降低car
‑
t细胞的移植排斥效应。
[0048]
在一些实施方案中,本发明的通用型truck
‑
t细胞所表达的car可以是靶向任意一个靶点,进而发挥杀伤作用。
[0049]
在一些实施方案中,本发明的通用型truck
‑
t细胞中表达的car包含顺序连接的信号肽、胞外结合区、铰链区、跨膜区和胞内信号区。本文使用的术语"信号肽"是指引导新合成的蛋白质向分泌通路转移的短(例如长度5
‑
30个氨基酸)肽链。在本发明中,可以使用人体内的各种蛋白质的信号肽,例如体内分泌的细胞因子蛋白、白细胞分化抗原(cd分子)的信号肽。
[0050]
在一些实施方案中,所述信号肽为cd8信号肽,例如其氨基酸序列如发明专利申请us20140271635a1中所示。
[0051]
在一些实施方案中,所述绞链区可以使用各种不同抗体或抗原受体的铰链区,特别是cd分子的铰链区。在一个具体的实施方案中,所述铰链区可以选自cd8或cd28等蛋白的铰链区。所述cd8或cd28是t细胞表面的天然标记物。
[0052]
在本发明中,可以使用各种人体内蛋白的跨膜区,特别是各种不同抗原受体的跨膜区。优选使用的跨膜区是cd分子的跨膜区。在一个实施方案中,所述跨膜区选自cd8蛋白的跨膜区。
[0053]
在一些实施方案中,所述铰链区为cd8α铰链区(cd8
‑
hinge),其氨基酸序列如发明专利申请us20140271635a1中所示。
[0054]
所述"胞外结合区"是指包含特异性识别靶抗原的区域。在一些实施方案中,该胞外结合区包含特异性识别靶肿瘤细胞表面抗原的区域。例如这个区域可以是scfv或其他抗体的抗原结合片段。本文使用的术语"scfv"是指通过连接区(linker)连接的重链可变区(variable region of heavy chain,vh和轻链可变区(variable region of light chain,vl)的重组蛋白,连接区使得这两个结构域相关联,最终形成抗原结合位点。scfv通常是由一条核苷酸链编码的氨基酸序列。上述scfv还可以包括其衍生物。
[0055]
本发明使用的car及其各结构域可通过单独或联合使用本领域己知的常规技术,例如氨基酸缺失、插入、取代、增加,和/或重组以及/或其他修饰方法作进一步修饰。根据一种抗体的氨基酸序列在其dna序列中引入这种修饰的方法对本领域技术人员来说是公知的(参见例如,sambrook分子克隆:实验手册,cold spring harbor laboratory(1989)n.y.)。所述修饰优选在核酸水平上进行。
[0056]
本文使用的术语"特异性识别"意指本发明的抗原识别区不与或基本上不与目标抗原以外的任意多肽交叉反应。其特异性的程度可以通过免疫学技术来判断,包括但不限于免疫印迹、免疫亲和层析、流式细胞分析等。
[0057]
在一些实施方案中,所述胞外结合区为特异性识别间皮素的抗原结合区域。
[0058]
在本发明中,所述胞内信号区为cd137(4
‑
1bb)蛋白的胞内信号区。cd3分子由五个亚单位组成,其中cd3ζ亚单位(又称cd3 zeta,简称ζ)含有3个免疫受体酪氨酸活化基序(immunoreceptor tyrosine
‑
based activation motif,itam),该基序是tcr(t cell receptor)
‑
cd3复合体中重要的信号转化区。fcεriγ主要分布在肥大细胞和嗜碱性粒细胞表面,其含有一个itam基序,在结构、分布及功能上与cd3ζ类似。此外如前所述,cd137是共剌激信号分子,在与各自配体结合后其胞内信号区段产生的共刺激作用引起t细胞的持续增殖,并能够提高t细胞分泌il
‑
2和ifn
‑
γ等细胞因子的水平,同时提高car
‑
t细胞在体内的存活周期和抗肿瘤效果。在某些实施方案中,由单独car产生的信号不足以完全活化天然t细胞,需要通过tcr起始抗原依赖性初次活化的序列(初级细胞内信号传导结构域)以及以不依赖于抗原的方式作用以提供共刺激信号的序列(共刺激性结构域)。初级信号传导结构域以刺激性方式或以抑制性方式调控tcr复合物的初次活化。以刺激性方式作用的初级细胞内信号传导结构域可以含有信号传导基序,称为免疫受体酪氨酸活化基序(itam)。本发明中的含有itam的初级细胞质信号传导序列为cd3ζ。在一个实施方案中,初级信号传导结构域包含修饰的itam结构域,例如活性相较于天然itam结构域有所改变(例如增加或降低)的突变的itam结构域,或截短的itam的初级细胞内信号传导结构域。在一个实施方案中,初级信号传导结构域包含一个或多个itam基序。
[0059]
共刺激信号传导结构域是指tcr中包含共刺激分子细胞内结构域的部分。共刺激分子是淋巴细胞对抗原高效反应所需的除抗原受体或其配体外的细胞表面分子。本发明的共刺激分子区域为4
‑
1bb(cd137)。
[0060]
在一些实施方案中,本发明提到的外源细胞因子可以为任意细胞因子。在实施例中,本发明插入的外源细胞因子可以为白介素12(il12),il12利用nfat作为转录因子进行il12蛋白的转录与表达。在此,il12起到示例的作用而非限制的作用,此处的细胞因子也可以为任何其他的对于肿瘤治疗有利的细胞因子,例如为il17、ccl19。
[0061]
在一些实施方案中,本发明提供了一种制备truck
‑
t细胞,例如通用型truck
‑
t细胞的方法,所述方法包括如下步骤:
[0062]
1)在t细胞中引入sgrna分子和cas9分子:
[0063]
在一些实施方案中,所述sgrna分子包含与来自tcr的α链恒定编码区(即trac)基因、hla恒定编码区b2m基因以及可选:pd
‑
1的恒定编码区基因的靶区域互补的靶向结构域。
[0064]
2)在所述t细胞中引入car分子及外源细胞因子基因序列;
[0065]
car分子可以插入trac切割位点;
[0066]
外源细胞因子基因序列可以插入b2m切割位点,可选插入pd
‑
1切割位点。
[0067]
truck
‑
t细胞是指伴有转基因的“有效载荷”的car
‑
t细胞,是第四代的car
‑
t细胞技术,其通过转基因免疫调节剂的诱导释放来塑造肿瘤微环境。这种truck
‑
t细胞技术在癌症治疗之外,包括治疗病毒感染,自体免疫疾病或代谢性疾病等疾病的治疗中都是可以应用的。
[0068]
在一些实施方案中,利用同源重组原理把car分子及外源细胞因子基因序列分别插入到trac和b2m切割位点,分别利用t细胞自身的trac的启动子及nfat进行表达。
[0069]
在一些实施方案中,所述sgrna分子是指一段包含与待敲除的基因的靶区域互补
的靶向结构域的核酸序列,其能识别靶标dna序列并引导cas9分子剪切靶位点,其可以实现一步高效(敲除效率84%以上)敲除相应位点。
[0070]
在一些实施方案中,所述cas9分子是指cas9 mrna,其能够在sgrna的引导下对靶位点进行剪切。
[0071]
在一些具体的实施方案中,所述sgrna分子所包含的靶向结构域的序列如表1中之一所示。在一些优选的实施方案中,所述靶向结构域的序列如t2、b6所示(表1)。
[0072]
表1
[0073][0074][0075]
在一些优选的实施方案中,通过电转技术将所述sgrna分子和编码cas9的mrna引
入所述t细胞中。
[0076]
在一些实施方案中,通过例如线相关病毒转染技术将所述car分子及外源细胞因子基因序列引入所述t细胞中,分别定向地插入到trac及b2m敲除位点。在一些具体的实施方案中,包括分离和/或激活来自健康人外周血或脐带血的t细胞的步骤;优选地,所述方法在上述步骤2)之后还包括对通用型truck
‑
t细胞进行分选的步骤;更优选地,分选之后再对所得的truck
‑
t细胞,例如通用型truck
‑
t细胞进行功能性验证。
[0077]
在一些实施方案中,本发明提供了上述truck
‑
t细胞用于制备治疗疾病(如肿瘤)的用途。
[0078]
本发明在一个方面提供了一种治疗受试者疾病的方法,包括给药受试者有效量的本发明所述的truck
‑
t细胞。治疗对象可以包括癌症和/或hiv/aids。在一些实施方案中,该疾病为肿瘤。在一些实施方案中,所述car靶向间皮素,治疗卵巢癌、胃癌和肺癌等一些高表达间皮素的实体瘤。在一些实施方案中,所述t细胞不是从受试者得到的。例如,所述t细胞可以来源于健康的捐助者。
[0079]
本发明涉及的通用型truck
‑
t细胞可以通过给药包含细胞成分的医药制品常规使用的途径,例如静脉输注途径,给药有此需要的受试者。给药剂量可以基于受试者的病情和一般健康状况具体确定。
[0080]
t细胞来源
[0081]
在进行扩增和基因修饰之前,从受试者获得t细胞来源。术语“受试者”意图包括能够引起免疫反应的活生物体(例如哺乳动物)。受试者的实例包括人。t细胞可以从多种来源获得,包括外周血单核细胞、骨髓、淋巴结组织、脐血、胸腺组织、来自感染部位的组织、腹水、胸膜积液、脾组织及肿瘤(t系淋巴瘤除外)。本发明的t细胞还可来源于各个分化阶段的造血干细胞。在定向分化培养条件下,造血干细胞向t细胞分化。在本发明的某些方面,可以使用本领域中可得到的多种t细胞系。
[0082]
在本发明的某些方面,t细胞可以使用熟练技术人员已知的多种技术,如ficoll
tm
分离从受试者收集的血液获得。也可以通过单采血液成分术(apheresis)从个体的循环血获得细胞。单采血液成分术产物典型地含有淋巴细胞,包括t细胞、单核细胞、粒细胞、b细胞、其它有核白细胞、红细胞及血小板。在一个方面,可以对通过单采血液成分术收集的细胞进行洗涤以去除血浆部分并将细胞放入适当缓冲液或介质中用于后续加工步骤。
[0083]
可以通过将红细胞溶解并例如经percoll
tm
梯度离心或逆流离心淘选耗尽单核细胞,从外周血淋巴细胞分离出t细胞。特定t细胞亚群,如cd3+、cd28+、cd4+、cd8+、cd45ra+、ccr7+、cd62l+及cd45ro+t细胞可以通过阳性或阴性选择技术进一步分离。举例来说,在一个方面,t细胞通过与抗cd3/抗cd28(例如3
×
28)偶联珠粒,如dynabeads
tm m
‑
450cd3/cd28t一起孵育一段足以对所希望的t细胞进行阳性选择的时间来分离。可以从肿瘤组织分离肿瘤浸润淋巴细胞(til)。
[0084]
sgrna
[0085]
本发明一个方面,提供了靶向trac的sgrna,靶向b2m的sgrna。所述sgrna含有选自seq id no.:2
‑
5或15
‑
22的任一核苷酸序列。在一些实施方案中,所述sgrna是经化学修饰的。
[0086]
本发明的还包括sgrna组合物,试剂盒或制品,其包括本发明涉及的sgrna或其载
体。在一些实施方案中,该试剂盒包括:(i)包含选自seq id no.:2
‑
5中任一序列的sgrna;(ii)包含选自seq id no.:6
‑
14中任一序列的sgrna;和/或(iii)包含选自seq id no.:15
‑
22中任一序列的sgrna。在一些实施方案中,该试剂盒包括:(i)包含seq id no.:3序列的sgrna;(ii)包含选自seq id no.:16序列的sgrna;和(iii)包含seq id no.:7序列的sgrna。在一些实施方案中,该试剂盒还包括cas6编码核酸或其载体。在一些实施方案中,所述sgrna是经化学修饰的。
[0087]
seq id no.:6
‑
14是针对pd
‑
1的恒定编码区基因的靶区域互补的靶向结构域。
[0088]
seq id no.:2
‑
5是针对trac的恒定编码区基因的靶区域互补的靶向结构域。
[0089]
seq id no.:15
‑
22是针对b2m的恒定编码区基因的靶区域互补的靶向结构域。
[0090]
在一些实施方案中,本发明中的t细胞基因改造方法使用化学修饰的sgrna。本申请采用的经过化学修饰的sgrna认为具有以下两个优点。第一、由于sgrna是单链形式的rna,其半衰期非常短,进入到细胞后,会迅速降解(最长不超过12小时),而cas9蛋白结合sgrna发挥基因编辑作用则至少需要48h。因此,采用经过化学修饰的sgrna,进入细胞后,稳定表达,与cas9蛋白结合后,能高效基因编辑基因组,产生插入缺失(indels)。第二、未经修饰的sgrna穿透细胞膜能力差,无法有效进入细胞或组织发挥相应功能。而经过了化学修饰的sgrna穿透细胞膜的能力通常是增强的。在本发明中可以采用本领域中常用的化学修饰方法,只要能够提高sgrna稳定性(延长半衰期)和提升进入细胞膜能力,均可以使用。除了实施例中使用的具体的化学修饰之外,还包括采用其它的修饰方法,例如,deleavey gf1,damha mj.designing chemically modified oligonucleotides for targeted gene silencing.chem biol.2012年8月24日;19(8):937
‑
54,以及hendel等chemically modified guide rnas enhance crispr
‑
cas genome editing in human primary cells.nat biotechnol.2015年9月;33(9):985
‑
989文献中报道的化学修饰方法。
[0091]
本发明将经过化学修饰的sgrna与cas9编码基因共同电转进入t细胞,产生高效的基因编辑效率(如,以tcrα/β
‑
/b2m
‑
%表示),本发明利用同源重组原理把car分子及外源细胞因子基因序列分别插入到trac和b2m切割位点,分别利用t细胞自身的trac的启动子及nfat进行表达。
[0092]
以下通过具体实施例来说明本发明的内容。应理解,所述具体实施例仅为说明目的,并不意味着本发明的内容仅限于具体实施例。
[0093]
在本说明书的整篇文本中引用了数篇文件。此处的每篇文件(包括任何期刊文章或摘要、公开或未公开的专利申请、授权专利、制造商的说明书、使用说明等)通过提述并入本文。然而,并非认可此处引用的文件事实上是本发明的现有技术。
[0094]
实施例
[0095]
实施例1:通用型truck
‑
t细胞的制备
[0096]
1.健康供者t细胞的分离与激活
[0097]
健康供者脐血的采集:从血库拿到脐血后放到4℃冰箱暂存,24h内,经由配备有恒温设备的转运车运至gmp实验室进行t细胞的分离。
[0098]
1.1脐血单个核细胞的制备:用10毫升移液管(生产商:corning,货号:4488,批号:32317601)吸取生理盐水(医疗用)加入到步骤(1)运输来的脐血中,脐血与生理盐水按照1:1(v/v)稀释,将血细胞稀释液缓慢加入淋巴细胞分离离管(生产商:达科为;货号:dkw
‑
lst
‑
25050sk)中,以800g离心20分钟后,吸取淋巴细胞分离液上方的白膜层细胞,转入一个新的50毫升离心管(生产商:corning,货号:430828)中,加入lonza x
‑
vivo 15培养基(生产商:lonza,货号:04
‑
418q)400g离心5分钟后弃上清,保留离心管底部的细胞沉淀,即得到外周血单个核细胞。
[0099]
1.2t细胞的分离和激活:将得到的脐血单个核细胞用细胞技术仪(nexcelom,型号:cellometer auto t4)进行计数,选用stemcell easysep human t cell iso kit(生产商:stemcell,货号:17951)进行t细胞分选,具体步骤如下:
[0100]
1.2.1.将细胞沉淀用easy缓冲液(生产商:stemcell,货号:16f72331)调整密度为5
×
107/ml,用5毫升移液管将细胞移至5ml流式管中;
[0101]
1.2.2.加入lsolation cocktail(生产商:stemcell,货号:17951),其浓度为50μl/ml,加完后在室温下孵育5分钟;
[0102]
1.2.3.加分选磁珠(生产商:stemcell,货号:17951),30s内混匀磁珠,加入浓度为40μl/ml;
[0103]
1.2.4用easy缓冲液将细胞液补至2.5毫升,加完后直接放在磁柱上3分钟,然后将细胞倒入15毫升离心管,得到的即为t细胞;
[0104]
1.2.5.分选完后,用1000μl移液器(生产商:thermo,型号:4642090)混匀取计数,离心(400g,5min)后去上清,即得t细胞沉淀。
[0105]
将t细胞沉淀重悬到完全培养基(lonza x
‑
vivo 15+il
‑
2)(lonza x
‑
vivo15培养基(生产商:lonza,货号:04
‑
418q);il
‑
2(生产商:北京四环生物,批次:20170745a))中,按照1:1的比例加入dynabeads human t
‑
activator cd3/cd28(生产商:gibco,货号:602101),此时的t细胞处于激活状态,将t细胞放入到培养箱中继续扩增培养。
[0106]
2.tcr及b2m基因的敲除
[0107]
利用crispr/cas9基因编辑技术进行敲除由步骤1.2获得的t细胞中的tcr、b2m基因,具体操作步骤如下所示:
[0108]
2.1针对tcr的α链恒定编码区(即trac)基因及hla恒定编码区(b2m)基因的恒定编码区基因的sgrna设计和质粒构建。
[0109]
针对trac及b2m设计的sgrna均通过crispr rgen tools设计,根据最高评分所选取的sgrna序列见表1。
[0110]
2.2利用化学方法对sgrna进行2
’‑
o
‑
甲基类类似物和/或核苷酸间3’硫代的修饰,制得具备高敲除效率及稳定性的sgrna。
[0111]
2.3利用电转技术,将sgrna和cas9 mrna导入到t细胞中,利用含有car分子的线相关病毒按照moi为3e5、6e5、9e5和1.2e6以及含有il12序列的线相关病毒按照moi为3e5、8e5和1e6,将目的片段分别带入到编辑后的t细胞中,进行定点插入,car分子插入到trac切割位点,il12插入到b2m切割位点,获得u
‑
truck
‑
t细胞。
[0112]
2.4取敲除后的t细胞,利用抗体检测其tcr、b2m、car及il12的表达量,根据图3结果可以看出,dko效率稳定维持在84%左右,il12的表达量如图1所示,约在50%。在该体系下,利用crispr/cas9技术可以成功对tcr的trac基因、hla的b2m基因进行编辑,包括插入突变和缺失突变,两者都造成了移码突变,从而从基因水平抑制了tcr、hla的表达。同时利用同源重组机理,将表达car的基因序列和表达il12的基因序列同时加上同源臂,可将序列定
点的插入到固定的位点。
[0113]
2.5同时对于trac
‑
sg3(t3)及b2m
‑
sg2(b6)潜在的人全基因组上的脱靶位点进行预测,并对预测的可能影响其他基因表达的脱靶位点区域进行扩增分析,目的是为了从分子水平确认tcr、hla的敲除并没有引入脱靶(off
‑
target)的非特异基因的敲除,结果如表2所示,可以看出trac及b2m的基因并没有发生任何突变,说明该体系特异性满足需求。
[0114]
为了后续进行对照实验,保留了一部分健康供者的t细胞;并利用crispr/cas9基因编辑技术对由步骤1.2获得的t细胞中的tcr、b2m基因进行敲除,同时制备了u
‑
t细胞;利用腺病毒转染技术将car分子分别导入t细胞以及u
‑
t细胞中,获得car
‑
t细胞和u
‑
car
‑
t细胞。类似地,将il12序列导入u
‑
t细胞中,获得u
‑
il12
‑
t细胞。
[0115]
表2
[0116][0117][0118]
以上结果显示,利用trac
‑
sg2(t2)及b2m
‑
sg6(b6)作为sgrna对t细胞进行基因编辑完成后并对其进行筛选而得到的通用型t细胞中的tcr、hla基因被完全敲除,同时,没有发现潜在脱靶位点处的基因突变。
[0119]
3.通用型car
‑
t细胞的扩增
[0120]
利用偶联cd3/cd28抗体的dynabeads human t
‑
activator cd3/cd28(生产商:gibco,货号:602101)对分选后的t细胞进行激活,然后用lonza x
‑
vivo15(生产商:lonza,货号:04
‑
418q)培养基将细胞密度调至1
×
106个细胞/ml。72h后观察细胞的状态,收集细胞悬液,去除dynabeads human t
‑
activator cd3/cd28后,以300g离心7min,弃上清,用dpbs(生产商:gibco;货号:1924294)清洗2遍,然后用opti
‑
mem培养基将细胞密度调至2.5
×
107个细胞/ml。使用hiscribe tm t7 arca mrna kit(加尾(with tailing))(生产商:neb,货号:目录号e2060s)制备的cas9 mrna及合成的sgrna,将t细胞和rna混合,使其最终浓度达到每100μl中含2.5
×
106个细胞和8μg rna(cas9 mrna和sgrna各4μg),然后利用电转仪btx agile pulse max将rna导入细胞中后进行培养。电转后2h内按照moi为8的比例加入包装有car分子的线相关病毒(car的结构由scfv:间皮素、链接区(linker)、cd8α铰链区(cd8 alpha hinge)、cd8跨膜区(cd8 transmemberane domain)、4
‑
11bb信号区(4
‑
11bb signaling domain)及cd3ζ组成)和包装有il12序列的线相关病毒(il12序列前面加有nfat),其序列如表3。
[0121]
表3
[0122]
[0123]
[0124][0125]
将目的基因递送到电转的t细胞中。每天观察细胞的生长状况,每隔一天进行细胞计数补液,并对基因编辑后的t细胞进行表型分析,如图3所示,敲除tcr及b2m的效率约为84%,图1和图2结果说明,car分子敲入效率约16%,il12序列敲入效率约为50%,细胞培养14天后,对所得的t细胞进行质量控制(即qc)监测。通过技术可以监测细胞生长状态,如图6所示,培养2周后,t细胞和car
‑
t细胞未进行基因编辑,长势最好,而经过基因编辑的细胞样本,则扩增比未进行基因编辑的细胞略差。
[0126]
图1是u
‑
truck
‑
t il12的表达量检测。如图所示,t细胞培养到第3天的时候,利用电转的方式进行tcr和hla的敲除,电转后2小时向基因编辑细胞中加入不同moi(moi=3e5,8e5,10e5)的线相关病毒,该病毒中带有需要插入的外源基因,将car序列插入到trac的启动子后面,将il12序列插入到b2m敲除位点后面,得到通用型truck
‑
t。加入刺激剂后,通用型truck
‑
t高表达il12,来达到招募巨噬细胞,自然杀伤性细胞及其他防止血管生成等作用。
[0127]
图2展示了通用型truck
‑
t的car的表达量。如图所示,t细胞培养到第3天的时候,利用电转的方式进行tcr和hla的敲除,电转后2小时向基因编辑细胞中加入不同moi(moi=3e5,6e5,9e5,12e5)的线相关病毒,该病毒中带有需要插入的外源基因,将car序列插入到trac的启动子后面,将il12序列插入到b2m敲除位点后面,得到通用型truck
‑
t。当moi为9e5时,car表达量最高,达到约16%。
[0128]
图3展示了通用型truck
‑
t的敲除效率。如图所示,t细胞培养到第3天的时候,利用电转的方式进行tcr和hla的敲除,在编辑后第4天进行表型的检测,可以看出cd3
‑
/tcr
‑
比例占84.4%,敲除效率稳定且高效。
[0129]
4.通用型truck
‑
t细胞的筛选
[0130]
通过如下对tcr和/或hla
‑
i阴性、cd4和cd8阳性的t细胞进行筛选。
[0131]
利用免疫磁珠技术筛选出tcr和/或hla
‑
i阴性,同时cd4和cd8阳性的t细胞,并通过t细胞活率监测被编辑后的t细胞状态,具体步骤如下:
[0132]
第一步,在第12
‑
14天将电转后的t细胞收集,400g,离心5min,弃上清,用easy缓冲液把细胞定溶为1
×
108个/ml,然后把细胞转移至5ml流式管中,利用easysep human pe positive selection kit(生产商:easy sep,货号:17g81322)去除掉t细胞中仍表达cd3(tcr)、hla
‑
i的细胞,筛选得到终产品即通用型truck
‑
t细胞。
[0133]
第二步,取少量t细胞,进行流式检测t细胞的亚群,例如图4,同时染cd4、cd8细胞表面生物标记物,实验结果表明,基因编辑于体外培养对cd4和cd8比例改变无显著差异。据研究报道,记忆型t细胞对治疗效果起着重要作用,因此该实施例中,如图5所示,同时染cd62l和ccr 7,如图所示,相比于未进行基因编辑的t细胞和car
‑
t细胞,进行过基因编辑的
通用型t细胞、敲入car分子的通用型t细胞,敲入il12序列的通用型t细胞以及通用型truck
‑
t细胞,记忆型细胞有较高的比例,表明基因编辑对记忆型细胞的亚群无明显影响。
[0134]
图4是cd4/cd8比例的监测。通过监测不同天数的cd4和cd8,培养到第5天和第10天,cd4/cd8比例几乎不变,均约为1.6:1。该结果表明基因编辑于体外培养对cd4和cd8比例改变无显著差异。
[0135]
图5是记忆型细胞的表达检测。如图所示,相比于未进行基因编辑的t细胞和car
‑
t细胞,进行过基因编辑的通用型t细胞、敲入car分子的通用型t细胞,敲入il12序列的通用型t细胞以及通用型truck
‑
t细胞,记忆型细胞有较高的比例,表明基因编辑对记忆型细胞的亚群无明显影响。
[0136]
第三步,将最后收获的成品细胞,提基因组后,对敲入的片段进行基因水平检测,结果如图7和图8所示,敲入il12和car的基因片段通过特异性扩增,在凝胶电泳图上显示出特异性条带。进一步说明,敲入的基因定点插入到基因敲除双链断裂位点。该方法有效的避免了病毒随机插入基因组导致潜在的安全性问题,同时利用t细胞自身的启动子,避免引入外来启动子基因,使得制得的产品更接近于自然状态下的t细胞。
[0137]
图6是细胞扩增实验。如图所示,培养2周后,t细胞和car
‑
t细胞未进行基因编辑,长势最好,而经过基因编辑的细胞样本,则扩增比未进行基因编辑的细胞略差。
[0138]
图7是il12在基因组中的ki检测。1号为t细胞样本,即未做任何处理的样本;2号和3号为通用型truck
‑
t样本,即同时敲入car及il12基因片段。2号的moi为3e5,3号的moi为8e5;4号和5号为只敲入car基因片段的样本,4号样本moi为12e5,5号样本moi为6e5;m号为dna标志物。通过凝胶电泳可以看出,敲入il12序列的两组细胞样本都有il12序列条带的表达,说明il12序列稳定的敲入进细胞基因组中。
[0139]
图8是car在基因组中的ki检测。1号为通用型t细胞样本;2号为只敲入il12基因片段的样本;3号为只敲入car基因片段的样本;4号为含有car分子的慢病毒侵染的样本;5号为通用型truck
‑
t样本,即同时敲入car及il12基因片段;6号为t细胞样本,即未做任何处理的样本;m号为dna标志物。通过凝胶电泳可以看出,敲入car分子的两组细胞样本都有car分子条带的表达,说明car分子稳定的敲入进细胞基因组中。
[0140]
实施例2:通用型truck
‑
t功能验证
[0141]
观察实施例1得到的通用型truck
‑
t细胞(即效应细胞)对高表达间皮素癌细胞的杀伤作用。
[0142]
一、对特异性肿瘤细胞的体外杀伤作用
[0143]
本发明实验步骤如下:
[0144]
第一步:靶细胞接种
[0145]
1.将靶细胞(a549高表达间皮素的稳转细胞系,所有细胞来自atcc)按照10000个细胞接种到含有r1640+10%fbs培养液的实时细胞分析仪(real
‑
time cell analyzers,rtca(厂家:艾森))杀伤检测仪器的96孔板里面,体积为100μl,让靶细胞正好铺满板子底部。
[0146]
2.实时观察细胞增殖曲线,当细胞增殖达到对数期后,将上述步骤获得的效应t细胞、通用型t细胞、car
‑
间皮素t细胞、通用型间皮素t细胞、通用型il12 t细胞及通用型truck
‑
t细胞按照效靶比(e:t=10:1;5:1;2.5:1;1.25:1;0.625:1)放入加有靶细胞的孔板
中,体积为100μl,留其余三孔作为阴性对照,不加效应细胞,只补充含有r1640+10%fbs培养基,最终培养体积为200μl。然后放入rtca进行观察。此过程要准确快速,保证培养基温度在37℃。
[0147]
3.通过实时监测共培养细胞,37℃、5%co2培养100小时,结果如图9所示,通用型truck
‑
t相较与其他的t细胞,在对特异性靶细胞的杀伤作用上效果最好,同时对非特异性靶细胞的几乎无杀伤功能。另外,通过rtca的实时监测,可以很好的追踪效应细胞对靶细胞的杀伤效果及作用起始时间。
[0148]
图9是细胞杀伤实验。如图所示,根据不同的效靶比(效应细胞t细胞样本:靶细胞huh
‑
7=10:1、5:1、2.5:1、1.25:1、0.625:1)共培养100小时,实时监测效应细胞的杀伤效果,可以看出10:1的高效靶比的样品对靶细胞杀伤最好。根据细胞杀伤曲线,可以看出杀伤效果:truck
‑
msln>dko
‑
trac
‑
msln>car
‑
t
‑
msln>dko
‑
b2m
‑
il12 t细胞≥dko细胞,且杀伤效果随着效靶比的降低而减小。相对与不加任何t细胞的空白对照nc组,huh
‑
7长势正常。
[0149]
二、通用型truck
‑
t对特异性肿瘤细胞的体内杀伤作用
[0150]
1.细胞系:huh7
‑
间皮素(荧光素酶
‑
gfp)
[0151]
huh7人肝癌细胞系是由naka bayashi等人建立的,细胞源自一个日本男性高分化肝细胞肝癌,通过慢病毒导入间皮素及荧光素酶
‑
gfp表达基因,建立稳转细胞系,其间皮素表达为99%阳性,可以作为car
‑
t细胞的靶细胞。huh7
‑
间皮素(荧光素酶
‑
gfp)经过修饰同时表达gfp与荧光素酶。可以通过腹部皮下注射方式构建小鼠的人高表达间皮素实体瘤癌变模型,通过xenolight d
‑
荧光素钾盐(生产商:perkinelmer;货号:122799)配合小动物活体成像仪呈现的荧光统计成瘤面积。
[0152]
2.huh7
‑
间皮素(荧光素酶
‑
gfp)细胞培养
[0153]
huh7
‑
间皮素(荧光素酶
‑
gfp)细胞系为贴壁细胞系,在含有10%fbs的rpmi 1640培养基(生产商:hyclone,货号:sh30809.01)中可以快速生长。细胞铺满平皿底部90%时需要传代。传代时,用胰酶进行消化1分钟,用含有10%fbs的rpmi 1640培养基进行中和,取细胞悬液于离心管中,以300g离心6分钟,弃上清。将细胞密度调整到1
×
105个细胞/ml,加入10ml到10cm的培养皿中,继续培养。
[0154]
3.小鼠造模
[0155]7‑
10周龄的npg雌性小鼠25只,单次皮下注射肿瘤细胞(huh7
‑
间皮素(荧光素酶
‑
gfp))5
×
105个细胞/只,隔天称重,每天观察一次,接种肿瘤细胞3
‑
5天后,通过xenolight d
‑
荧光素钾盐(生产商:perkinelmer;货号:122799)配合小动物活体成像仪呈现的成瘤面积及肿瘤富集度为指标进行随机分成6组:生理盐水组、t细胞组、car
‑
t细胞组、u
‑
car
‑
t组、u
‑
il12
‑
t组、u
‑
truck
‑
t组。
[0156]
4.小鼠淋巴瘤模型给药
[0157]
记录造模当天为d0。通过尾静脉注射的方式进行细胞输生理盐水200μl、人t细胞200μl(总计2
×
106个细胞/只)、car
‑
t细胞200μl(总计2
×
106/只)、u
‑
car
‑
t细胞200μl(总计2
×
106/只)、u
‑
il12
‑
t细胞200μl(总计2
×
106/只)、u
‑
truck
‑
t细胞200μl(总计2
×
106/只)所有小鼠均单次给药。
[0158]
5.小鼠给药后监测
[0159]
对给药后的小鼠每天进行监测,包括小鼠体重,皮肤完整度,毛发,精神状态、活动
频率及活动协调度等每2天对小鼠进行体重记录,连续观察37天,以肿瘤面积的消除及肿瘤富集的减少为效应细胞功能的评判指标,以皮肤完整度,毛发,精神状态、活动频率及活动协调度评判通用型truck
‑
t的安全性。如图8所示小鼠并没有体重上的下降,皮肤毛发完整,精神活跃,活动协调,没有出现gvhd反应。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1