化合物和包含其的有机发光器件的制作方法
1.本技术要求基于于2019年11月29日向韩国知识产权局提交的韩国专利申请第10
‑
2019
‑
0156840号和于2020年5月20日向韩国知识产权局提交的韩国专利申请第10
‑
2020
‑
0060597号的优先权和权益,其全部内容通过引用并入本文。
2.本说明书涉及化合物和包含其的有机发光器件。
背景技术:
3.有机发光现象通常是指使用有机材料将电能转换成光能的现象。利用有机发光现象的有机发光器件通常具有包括阳极、阴极和其间的有机材料层的结构。在此,有机材料层通常形成为由不同材料形成的多层结构以提高有机发光器件的效率和稳定性,并且例如,可以由空穴注入层、空穴传输层、发光层、电子传输层、电子注入层等形成。当在这样的有机发光器件结构中的两个电极之间施加电压时,空穴和电子分别从阳极和阴极注入到有机材料层中,并且当注入的空穴和电子相遇时,形成激子,并且当这些激子落回基态时发光。
4.持续需要开发用于这样的有机发光器件的新材料。
技术实现要素:
5.技术问题
6.本说明书旨在提供化合物和包含其的有机发光器件。
7.技术方案
8.本说明书的一个实施方案提供了由以下化学式1表示的化合物。
9.[化学式1]
[0010][0011]
在化学式1中,
[0012]
a1为经取代或未经取代的并且包含含有o或s的5元环的单环或多环杂环,以及
[0013]
r1至r7、r
′
和r
″
彼此相同或不同,并且各自独立地为氢;氘;卤素基团;氰基;经取代或未经取代的烷基;经取代或未经取代的卤代烷基;经取代或未经取代的环烷基;经取代或未经取代的烷氧基;经取代或未经取代的卤代烷氧基;经取代或未经取代的烷基硫基;经取代或未经取代的芳氧基;经取代或未经取代的芳基硫基;经取代或未经取代的烯基;经取代或未经取代的硼基;经取代或未经取代的胺基;经取代或未经取代的芳基烷基;经取代或
未经取代的甲硅烷基;经取代或未经取代的烃环基;或者经取代或未经取代的杂环基,或者与相邻基团键合以形成经取代或未经取代的环。
[0014]
本说明书的另一个实施方案提供了有机发光器件,其包括第一电极;与第一电极相对设置的第二电极;以及设置在第一电极与第二电极之间的一个或更多个有机材料层,其中有机材料层的一个或更多个层包含所述化合物。
[0015]
有益效果
[0016]
本说明书中描述的化合物可以用作有机发光器件的有机材料层的材料。根据另一个实施方案的化合物能够在有机发光器件中提高效率、降低驱动电压和/或提高寿命特性。特别地,本说明书中描述的化合物可以用作空穴注入、空穴传输、空穴注入和空穴传输、电子阻挡、发光、空穴阻挡、电子传输或电子注入材料。此外,根据本说明书的一个实施方案的有机发光器件在获得低驱动电压、高效率或长寿命方面是有效的。
附图说明
[0017]
图1至图3各自示出了根据本说明书的一个实施方案的有机发光器件的实例。
[0018]
图4为示出根据本说明书的实验例1的光致发光分析图的图。
[0019]
图5为示出根据本说明书的实验例3的化合物19的热重分析图的图。
[0020]
图6为示出根据本说明书的实验例3的化合物bd
‑
a的热重分析图的图。
[0021]
图7为示出根据本说明书的实验例3的化合物bd
‑
c的热重分析图的图。
[0022]
附图标记
[0023]
1:基底
[0024]
2:第一电极
[0025]
3:发光层
[0026]
4:第二电极
[0027]
5:空穴注入层
[0028]
6:空穴阻挡层
[0029]
7:电子注入和传输层
[0030]
8:空穴传输层
[0031]
9:电子阻挡层
[0032]
10:第一电子传输层
[0033]
11:第二电子传输层
[0034]
12:电子注入层
具体实施方式
[0035]
在下文中,将更详细地描述本说明书。
[0036]
现有的硼化合物具有约23nm至30nm的半峰全宽并且基本核结构具有约453nm的波长,但是与胺化合物相比,由于材料稳定性相对差而具有减少的寿命的限制。因此,需要通过控制硼化合物的取代基来提高材料稳定性,从而在保持优异的光学特性的同时确保长寿命的方法。
[0037]
根据本说明书的一个实施方案的化学式1的化合物具有其中a1包括经取代或未经
取代的并且包含含有o或s的5元环的单环或多环杂环的结构,并且化合物的结构稳定性和优异的电化学特性可以利用足够的电子来确保。
[0038]
在本技术的整个说明书中,马库什类型表述中包括的术语“其组合”意指选自马库什类型表述中描述的构成要素中的一者或更多者的混合物或组合,并且意指包括选自所述构成要素中的一者或更多者。
[0039]
下面描述本说明书中的取代基的实例,然而,取代基不限于此。
[0040]
在本说明书中,意指连接位点。
[0041]
术语“取代”意指与化合物的碳原子键合的氢原子变为另一取代基,并且取代的位置没有限制,只要该位置是氢原子被取代的位置(即,取代基可以取代的位置)即可,并且当两个或更多个取代基取代时,两个或更多个取代基可以彼此相同或不同。
[0042]
在本说明书中,术语“经取代或未经取代的”意指经选自以下的一个或更多个取代基取代:氘;卤素基团;氰基;烷基;环烷基;烷氧基;芳氧基;烷基硫基;芳基硫基;烯基;卤代烷基;卤代烷氧基;芳基烷基;甲硅烷基;硼基;胺基;芳基;芳族烃和脂族烃的稠环基;以及杂环基,或者经以上所例示的取代基中的两个或更多个取代基相连接的取代基取代,或者没有取代基。
[0043]
在本说明书中,两个或更多个取代基相连接是指任一个取代基的氢与另一取代基相连接。例如,两个取代基相连接可以包括苯基和萘基被连接成的取代基。此外,三个取代基相连接不仅包括(取代基1)
‑
(取代基2)
‑
(取代基3)连续连接,而且包括(取代基2)和(取代基3)与(取代基1)连接。例如,苯基、萘基和异丙基可以被连接成的取代基。以上描述的相同规则适用于四个或更多个取代基相连接的情况。
[0044]
在本说明书中,卤素基团的实例可以包括氟、氯、溴或碘。
[0045]
在本说明书中,烷基可以为线性或支化的,并且虽然不特别地限于此,但是碳原子数优选地为1至30。其具体实例可以包括甲基、乙基、丙基、正丙基、异丙基、丁基、正丁基、异丁基、叔丁基、仲丁基、1
‑
甲基
‑
丁基、1
‑
乙基
‑
丁基、戊基、正戊基、异戊基、新戊基、叔戊基、己基、正己基、1
‑
甲基戊基、2
‑
甲基戊基、4
‑
甲基
‑2‑
戊基、3,3
‑
二甲基丁基、2
‑
乙基丁基、庚基、正庚基、1
‑
甲基己基、环戊基甲基、环己基甲基、辛基、正辛基、叔辛基、1
‑
甲基庚基、2
‑
乙基己基、2
‑
丙基戊基、正壬基、2,2
‑
二甲基庚基、1
‑
乙基
‑
丙基、1,1
‑
二甲基
‑
丙基、异己基、2
‑
甲基戊基、4
‑
甲基己基、5
‑
甲基己基等,但不限于此。
[0046]
在本说明书中,环烷基没有特别限制,但是优选地具有3至30个碳原子。其具体实例可以包括环丙基、环丁基、环戊基、3
‑
甲基环戊基、2,3
‑
二甲基环戊基、环己基、3
‑
甲基环
己基、4
‑
甲基环己基、2,3
‑
二甲基环己基、3,4,5
‑
三甲基环己基、4
‑
叔丁基环己基、环庚基、环辛基、金刚烷基、双环[2.2.1]辛基、降冰片基等,但不限于此。
[0047]
在本说明书中,烷氧基可以为线性、支化或环状的。烷氧基的碳原子数没有特别限制,但是优选地为1至30。其具体实例可以包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、叔丁氧基、仲丁氧基、正戊氧基、新戊氧基、异戊氧基、正己氧基、3,3
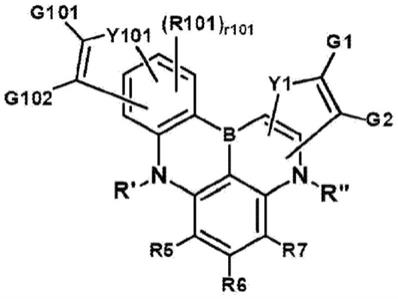
‑
二甲基丁氧基、2
‑
乙基丁氧基、正辛氧基、正壬氧基、正癸氧基、苄氧基、对甲基苄氧基等,但不限于此。
[0048]
在本说明书中,烯基可以为线性或支化的,并且虽然不特别限于此,但是碳原子数优选地为2至30。其具体实例可以包括乙烯基、1
‑
丙烯基、异丙烯基、1
‑
丁烯基、2
‑
丁烯基、3
‑
丁烯基、1
‑
戊烯基、2
‑
戊烯基、3
‑
戊烯基、3
‑
甲基
‑1‑
丁烯基、1,3
‑
丁二烯基、烯丙基、1
‑
苯基乙烯基
‑1‑
基、2
‑
苯基乙烯基
‑1‑
基、2,2
‑
二苯基乙烯基
‑1‑
基、2
‑
苯基
‑2‑
(萘基
‑1‑
基)乙烯基
‑1‑
基、2,2
‑
双(二苯基
‑1‑
基)乙烯基
‑1‑
基、茋基、苯乙烯基等,但不限于此。
[0049]
在本说明书中,卤代烷基意指:在烷基的限定中,烷基的氢经至少一个卤素基团取代。
[0050]
在本说明书中,卤代烷氧基意指:在烷氧基的限定中,烷氧基的氢经至少一个卤素基团取代。
[0051]
在本说明书中,芳基没有特别限制,但是优选地具有6至30个碳原子,并且芳基可以为单环或多环的。
[0052]
当芳基是单环芳基时,碳原子数没有特别限制,但是优选地为6至30。单环芳基的具体实例可以包括苯基、联苯基、三联苯基等,但不限于此。
[0053]
当芳基是多环芳基时,碳原子数没有特别限制,但是优选地为10至30。多环芳基的具体实例可以包括萘基、蒽基、菲基、三亚苯基、芘基、非那烯基、苝基、基、芴基等,但不限于此。
[0054]
在本说明书中,芴基可以是经取代的,并且相邻基团可以彼此键合以形成环。
[0055]
当芴基为经取代的时,可以包括当芴基为经取代的时,可以包括等,然而,结构不限于此。
[0056]
在本说明书中,“相邻”基团可以意指对与被相应取代基取代的原子直接连接的原子进行取代的取代基、位于空间上最接近相应取代基的取代基、或者对被相应取代基取代的原子进行取代的另一取代基。例如,在苯环中的邻位进行取代的两个取代基和对脂族环中的同一个碳进行取代的两个取代基可以被解释为彼此“相邻”的基团。
[0057]
在本说明书中,芳基烷基意指经芳基取代的烷基,并且上述芳基和烷基的实例可以适用于芳基烷基的芳基和烷基。
[0058]
在本说明书中,芳氧基意指:在烷氧基的限定中,烷氧基的烷基经芳基取代。芳氧基的实例可以包括苯氧基、对甲苯氧基、间甲苯氧基、3,5
‑
二甲基
‑
苯氧基、2,4,6
‑
三甲基苯氧基、对叔丁基苯氧基、3
‑
联苯氧基、4
‑
联苯氧基、1
‑
萘氧基、2
‑
萘氧基、4
‑
甲基
‑1‑
萘氧基、5
‑
甲基
‑2‑
萘氧基、1
‑
蒽氧基、2
‑
蒽氧基、9
‑
蒽氧基、1
‑
菲氧基、3
‑
菲氧基、9
‑
菲氧基等,但不限于此。
[0059]
在本说明书中,烷基硫基的烷基与上述烷基的实例相同。烷基硫基的具体实例可以包括甲基硫基、乙基硫基、叔丁基硫基、己基硫基、辛基硫基等,但不限于此。
[0060]
在本说明书中,芳基硫基中的芳基与上述芳基的实例相同。芳基硫基的具体实例可以包括苯基硫基、2
‑
甲基苯基硫基、4
‑
叔丁基苯基硫基等,但不限于此。
[0061]
在本说明书中,杂环基为包含一个或更多个非碳的原子(即,杂原子)的基团,并且具体地,杂原子可以包括选自o、n、se、s等中的一个或更多个原子。碳原子数没有特别限制,但是优选地为2至30,并且杂环基可以为单环或多环的。杂环基的实例可以包括噻吩基、呋喃基、吡咯基、咪唑基、噻唑基、唑基、二唑基、吡啶基、联吡啶基、嘧啶基、三嗪基、三唑基、吖啶基、哒嗪基、吡嗪基、喹啉基、喹唑啉基、喹喔啉基、酞嗪基、吡啶并嘧啶基、吡啶并吡嗪基、吡嗪并吡嗪基、异喹啉基、吲哚基、咔唑基、苯并唑基、苯并咪唑基、苯并噻唑基、苯并咔唑基、苯并噻吩基、二苯并噻吩基、苯并呋喃基、菲啶基、菲咯啉基、异唑基、噻二唑基、二苯并呋喃基、二苯并噻咯基、吩噻基、吩嗪基、吩噻嗪基、二氢茚并咔唑基、螺芴呫吨基、螺芴噻吨基、四氢萘并噻吩基、四氢萘并呋喃基、四氢苯并噻吩基、四氢苯并呋喃基等,但不限于此。
[0062]
在本说明书中,甲硅烷基可以为烷基甲硅烷基、芳基甲硅烷基、烷基芳基甲硅烷基、杂芳基甲硅烷基等。作为烷基甲硅烷基中的烷基,可以应用上述烷基的实例,以及作为芳基甲硅烷基中的芳基,可以应用上述芳基的实例。作为烷基芳基甲硅烷基中的烷基和芳基,可以应用烷基和芳基的实例,以及作为杂芳基甲硅烷基中的杂芳基,可以应用杂环基的实例。
[0063]
在本说明书中,硼基可以为
‑
br
100
r
101
。r
100
和r
101
彼此相同或不同,并且可以各自独立地选自氢;氘;卤素;腈基;经取代或未经取代的具有3至30个碳原子的单环或多环环烷基;经取代或未经取代的具有1至30个碳原子的线性或支化的烷基;经取代或未经取代的具有6至30个碳原子的单环或多环芳基;以及经取代或未经取代的具有2至30个碳原子的单环或多环杂环基。硼基的具体实例可以包括三甲基硼基、三乙基硼基、叔丁基二甲基硼基、三苯基硼基、苯基硼基等,但不限于此。
[0064]
在本说明书中,胺基可以选自
‑
nh2、烷基胺基、n
‑
烷基芳基胺基、芳基胺基、n
‑
芳基杂芳基胺基、n
‑
烷基杂芳基胺基和杂芳基胺基,并且虽然不特别限于此,但是碳原子数优选地为1至30。胺基的具体实例可以包括甲基胺基、二甲基胺基、乙基胺基、二乙基胺基、苯基胺基、萘基胺基、联苯基胺基、蒽基胺基、9
‑
甲基
‑
蒽基胺基、二苯基胺基、二甲苯基胺基、n
‑
苯基甲苯基胺基、三苯基胺基、n
‑
苯基联苯基胺基、n
‑
苯基萘基胺基、n
‑
联苯基萘基胺基、n
‑
萘基芴基胺基、n
‑
苯基菲基胺基、n
‑
联苯基菲基胺基、n
‑
苯基芴基胺基、n
‑
苯基三联苯基胺基、n
‑
菲基芴基胺基、n
‑
联苯基芴基胺基等,但不限于此。
[0065]
在本说明书中,n
‑
烷基芳基胺基意指其中胺基的n经烷基和芳基取代的胺基。n
‑
烷基芳基胺基中的烷基和芳基与上述烷基和芳基的实例相同。
[0066]
在本说明书中,n
‑
芳基杂芳基胺基意指其中胺基的n经芳基和杂芳基取代的胺基。n
‑
芳基杂芳基胺基中的芳基和杂芳基与上述芳基和杂环基的实例相同。
[0067]
在本说明书中,n
‑
烷基杂芳基胺基意指其中胺基的n经烷基和杂芳基取代的胺基。n
‑
烷基杂芳基胺基中的烷基和杂芳基与上述烷基和杂环基的实例相同。
[0068]
在本说明书中,烷基胺基的实例包括经取代或未经取代的单烷基胺基、或者经取代或未经取代的二烷基胺基。烷基胺基中的烷基可以为线性或支化的烷基。包含两个或更多个烷基的烷基胺基可以包含线性烷基、支化烷基、或线性烷基和支化烷基二者。例如,烷基胺基中的烷基可以选自上述烷基的实例。
[0069]
在本说明书中,杂芳基胺基的实例包括经取代或未经取代的单杂芳基胺基、或者经取代或未经取代的二杂芳基胺基。包含两个或更多个杂芳基的杂芳基胺基可以包含单环杂芳基、多环杂芳基、或者单环杂芳基和多环杂芳基二者。例如,杂芳基胺基中的杂芳基可以选自上述杂环基的实例。
[0070]
在本说明书中,“取代基中的相邻两者彼此键合以形成环”的含义是相邻的基团彼此键合以形成经取代或未经取代的烃环;或者经取代或未经取代的杂环。
[0071]
在本说明书中,通过彼此键合形成的经取代或未经取代的环中的“环”意指经取代或未经取代的烃环;或者经取代或未经取代的杂环。
[0072]
在本说明书中,烃环基可以为芳族烃环、脂族烃环、或者芳族烃和脂族烃的稠环基,并且可以选自环烷基、芳基、和其组合的实例。烃环基的实例可以包括苯基、环己基、金刚烷基、四氢萘基、四氢蒽基等,但不限于此。
[0073]
在本说明书中,烃环可以为芳族烃环、脂族烃环、或者芳族烃和脂族烃的稠环,并且可以选自环烷基和芳基的实例,不同之处在于烃环不是一价的。烃环的实例可以包括苯、环己烷、金刚烷、四氢萘、四氢蒽等,但不限于此。
[0074]
在本说明书中,杂环包含一个或更多个非碳的原子(即,杂原子),并且具体地,杂原子可以包括选自o、n、se、s等中的一个或更多个原子。杂环可以为单环或多环的,可以为芳族的、脂族的、或者芳族和脂族的稠环,并且芳族杂环可以选自杂环基的实例,不同之处在于芳族杂环不是一价的。
[0075]
在本说明书中,脂族杂环意指包含一个或更多个杂原子的脂族环。脂族杂环的实例可以包括环氧乙烷、四氢呋喃、1,4
‑
二烷、吡咯烷、哌啶、吗啉、氧杂环庚烷、氮杂环辛烷、硫杂环辛烷、四氢萘并噻吩、四氢萘并呋喃、四氢苯并噻吩、四氢苯并呋喃等,但不限于此。
[0076]
在本说明书中,亚芳基意指具有两个键合位点的芳基,即,二价基团。以上提供的关于芳基的描述可以适用于亚芳基,不同之处在于亚芳基各自为二价基团。
[0077]
在本说明书中,亚杂芳基意指具有两个键合位点的杂芳基,即,二价基团。以上提供的关于杂环基的描述可以应用于亚杂芳基,不同之处在于亚杂芳基各自为二价基团。
[0078]
根据本说明书的一个实施方案,化学式1包含至少一个未经取代或经烷基取代的稠合脂族烃环。
[0079]
根据本说明书的一个实施方案,a1为经取代或未经取代的并且包含o或s的5元单
环杂环;或者经取代或未经取代的并且包含含有o或s的5元杂环的多环杂环。
[0080]
根据本说明书的一个实施方案,a1为经取代或未经取代的并且包含o或s的5元芳族或脂族单环杂环;或者经取代或未经取代的并且包含含有o或s的5元杂环的芳族、脂族、或稠合的芳族和脂族的多环杂环。
[0081]
根据本说明书的一个实施方案,化学式a1由以下化学式a1
‑
1或a1
‑
2表示。
[0082]
[化学式a1
‑
1]
[0083][0084]
[化学式a1
‑
2]
[0085][0086]
在化学式a1
‑
1和a1
‑
2中,
[0087]
y1和y3彼此相同或不同,并且各自独立地为o;或s,
[0088]
g1、g2和g7至g10彼此相同或不同,并且各自独立地为氢;氘;卤素基团;氰基;经取代或未经取代的烷基;经取代或未经取代的卤代烷基;经取代或未经取代的环烷基;经取代或未经取代的烷氧基;经取代或未经取代的卤代烷氧基;经取代或未经取代的烷基硫基;经取代或未经取代的芳氧基;经取代或未经取代的芳基硫基;经取代或未经取代的烯基;经取代或未经取代的硼基;经取代或未经取代的胺基;经取代或未经取代的芳基烷基;经取代或未经取代的甲硅烷基;经取代或未经取代的烃环基;或者经取代或未经取代的杂环基,或者与相邻基团键合以形成经取代或未经取代的环,以及
[0089]
意指与化学式1键合的位点。
[0090]
根据本说明书的一个实施方案,a1为由以下化学式a1
‑
3至a1
‑
5中的任一者表示的结构。
[0091]
[化学式a1
‑
3]
[0092][0093]
[化学式a1
‑
4]
[0094][0095]
[化学式a1
‑
5]
[0096][0097]
在化学式a1
‑
3至a1
‑
5中,
[0098]
y2、y4和y5彼此相同或不同,并且各自独立地为o;或s,
[0099]
g3至g6和g11至g28彼此相同或不同,并且各自独立地为氢;氘;卤素基团;氰基;经取代或未经取代的烷基;经取代或未经取代的卤代烷基;经取代或未经取代的环烷基;经取代或未经取代的烷氧基;经取代或未经取代的卤代烷氧基;经取代或未经取代的烷基硫基;经取代或未经取代的芳氧基;经取代或未经取代的芳基硫基;经取代或未经取代的烯基;经取代或未经取代的硼基;经取代或未经取代的胺基;经取代或未经取代的芳基烷基;经取代或未经取代的甲硅烷基;经取代或未经取代的烃环基;或者经取代或未经取代的杂环基,或者与相邻基团键合以形成经取代或未经取代的环,
[0100]
n11和n12各自为0至2的整数,
[0101]
当n11和n12为2时,两个括号中的结构彼此相同或不同,以及
[0102]
意指与化学式1键合的位点。
[0103]
根据本说明书的一个实施方案,化学式a1
‑
1由以下化学式a1
‑1‑
1或a1
‑1‑
2表示。
[0104]
[化学式a1
‑1‑
1]
[0105][0106]
[化学式a1
‑1‑
2]
[0107][0108]
在化学式a1
‑1‑
1和a1
‑1‑
2中,
[0109]
y1为o;或s,
[0110]
z1为o;s;cr201r202;或nr203,
[0111]
g301至g304和r201至r203彼此相同或不同,并且各自独立地为氢;氘;卤素基团;氰基;经取代或未经取代的烷基;经取代或未经取代的卤代烷基;经取代或未经取代的环烷基;经取代或未经取代的烷氧基;经取代或未经取代的卤代烷氧基;经取代或未经取代的烷基硫基;经取代或未经取代的芳氧基;经取代或未经取代的芳基硫基;经取代或未经取代的烯基;经取代或未经取代的硼基;经取代或未经取代的胺基;经取代或未经取代的芳基烷基;经取代或未经取代的甲硅烷基;经取代或未经取代的烃环基;或者经取代或未经取代的杂环基,或者与相邻基团键合以形成经取代或未经取代的环,以及
[0112]
意指与化学式1键合的位点。
[0113]
根据本说明书的一个实施方案,化学式1由以下化学式1
‑
1至1
‑
5中的任一者表示。
[0114]
[化学式1
‑
1]
[0115][0116]
[化学式1
‑
2]
[0117][0118]
[化学式1
‑
3]
[0119][0120]
[化学式1
‑
4]
[0121][0122]
[化学式1
‑
5]
[0123][0124]
在化学式1
‑
1至1
‑
5中,
[0125]
r
′
、r
″
和r1至r7具有与化学式1中相同的限定,
[0126]
y1至y5彼此相同或不同,并且各自独立地为o;或s,
[0127]
g1至g28彼此相同或不同,并且各自独立地为氢;氘;卤素基团;氰基;经取代或未经取代的烷基;经取代或未经取代的卤代烷基;经取代或未经取代的环烷基;经取代或未经取代的烷氧基;经取代或未经取代的卤代烷氧基;经取代或未经取代的烷基硫基;经取代或未经取代的芳氧基;经取代或未经取代的芳基硫基;经取代或未经取代的烯基;经取代或未经取代的硼基;经取代或未经取代的胺基;经取代或未经取代的芳基烷基;经取代或未经取代的甲硅烷基;经取代或未经取代的烃环基;或者经取代或未经取代的杂环基,或者与相邻基团键合以形成经取代或未经取代的环,
[0128]
n11和n12各自为0至2的整数,并且
[0129]
当n11和n12为2时,两个括号中的结构彼此相同或不同。
[0130]
根据本说明书的一个实施方案,化学式1由以下化学式1
‑1‑
1、1
‑1‑
2、1
‑1‑
3、1
‑1‑
4、1
‑1‑
5、1
‑1‑
6、1
‑2‑
1、1
‑2‑
2、1
‑3‑
1、1
‑3‑
2、1
‑4‑
1、1
‑4‑
2、1
‑5‑
1和1
‑5‑
2中的任一者表示。
[0131]
[化学式1
‑1‑
1]
[0132][0133]
[化学式1
‑1‑
2]
[0134][0135]
[化学式1
‑1‑
3]
[0136][0137]
[化学式1
‑1‑
4]
[0138][0139]
[化学式1
‑1‑
5]
[0140][0141]
[化学式1
‑1‑
6]
[0142][0143]
[化学式1
‑2‑
1]
[0144][0145]
[化学式1
‑2‑
2]
[0146][0147]
[化学式1
‑3‑
1]
[0148][0149]
[化学式1
‑3‑
2]
[0150][0151]
[化学式1
‑4‑
1]
[0152][0153]
[化学式1
‑4‑
2]
[0154][0155]
[化学式1
‑5‑
1]
[0156][0157]
[化学式1
‑5‑
2]
[0158][0159]
在化学式1
‑1‑
1、1
‑1‑
2、1
‑1‑
3、1
‑1‑
4、1
‑1‑
5、1
‑1‑
6、1
‑2‑
1、1
‑2‑
2、1
‑3‑
1、1
‑3‑
2、1
‑4‑
1、1
‑4‑
2、1
‑5‑
1和1
‑5‑
2中,
[0160]
r
′
、r
″
和r1至r7具有与化学式1中相同的限定,
[0161]
y1至y5彼此相同或不同,并且各自独立地为o;或s,
[0162]
z1为o;s;cr201r202;或nr203,
[0163]
g1至g28、g301至g304和r201至r203彼此相同或不同,并且各自独立地为氢;氘;卤素基团;氰基;经取代或未经取代的烷基;经取代或未经取代的卤代烷基;经取代或未经取代的环烷基;经取代或未经取代的烷氧基;经取代或未经取代的卤代烷氧基;经取代或未经取代的烷基硫基;经取代或未经取代的芳氧基;经取代或未经取代的芳基硫基;经取代或未经取代的烯基;经取代或未经取代的硼基;经取代或未经取代的胺基;经取代或未经取代的芳基烷基;经取代或未经取代的甲硅烷基;经取代或未经取代的烃环基;或者经取代或未经取代的杂环基,或者与相邻基团键合以形成经取代或未经取代的环,
[0164]
n11和n12各自为0至2的整数,并且
[0165]
当n11和n12为2时,两个括号中的结构彼此相同或不同。
[0166]
根据本说明书的一个实施方案,r1至r4中的相邻基团彼此键合以形成经取代或未经取代的5元单环杂环;或者经取代或未经取代的并且包含5元杂环的多环杂环。
[0167]
根据本说明书的一个实施方案,r1至r4中的相邻基团彼此键合以形成经取代或未经取代的并且包含n、o或s的5元单环杂环;或者经取代或未经取代的并且包含含有n、o或s的5元杂环的多环杂环。
[0168]
根据本说明书的一个实施方案,r1至r4中的相邻基团彼此键合以形成经取代或未经取代的并且包含n、o或s的5元芳族或脂族单环杂环;或者经取代或未经取代的并且包含含有n、o或s的5元杂环的芳族、脂族、或稠合的芳族和脂族的多环杂环。
[0169]
根据本说明书的一个实施方案,r1至r4中的相邻基团彼此键合以形成由以下b1
‑
1或b1
‑
2表示的环。
[0170]
[b1
‑
1]
[0171]
[0172]
[b1
‑
2]
[0173][0174]
在b1
‑
1和b1
‑
2中,
[0175]
y101和y103彼此相同或不同,并且各自独立地为o;s;或nr
″′
,
[0176]
r
″′
、g101、g102和g107至g110彼此相同或不同,并且各自独立地为氢;氘;卤素基团;氰基;经取代或未经取代的烷基;经取代或未经取代的卤代烷基;经取代或未经取代的环烷基;经取代或未经取代的烷氧基;经取代或未经取代的卤代烷氧基;经取代或未经取代的烷基硫基;经取代或未经取代的芳氧基;经取代或未经取代的芳基硫基;经取代或未经取代的烯基;经取代或未经取代的硼基;经取代或未经取代的胺基;经取代或未经取代的芳基烷基;经取代或未经取代的甲硅烷基;经取代或未经取代的烃环基;或者经取代或未经取代的杂环基,或者与相邻基团键合以形成经取代或未经取代的环,以及
[0177]
意指与化学式1键合的位点。
[0178]
根据本说明书的一个实施方案,r1至r4中的相邻基团彼此键合以形成由以下b1
‑
3至b1
‑
5中的任一者表示的环。
[0179]
[b1
‑
3]
[0180][0181]
[b1
‑
4]
[0182][0183]
[b1
‑
5]
[0184][0185]
在b1
‑
3至b1
‑
5中,
[0186]
y102、y104和y105彼此相同或不同,并且各自独立地为o;s;或nr
″′
,
[0187]
r
″′
、g103至g106和g111至g128彼此相同或不同,并且各自独立地为氢;氘;卤素基团;氰基;经取代或未经取代的烷基;经取代或未经取代的卤代烷基;经取代或未经取代的环烷基;经取代或未经取代的烷氧基;经取代或未经取代的卤代烷氧基;经取代或未经取代的烷基硫基;经取代或未经取代的芳氧基;经取代或未经取代的芳基硫基;经取代或未经取代的烯基;经取代或未经取代的硼基;经取代或未经取代的胺基;经取代或未经取代的芳基烷基;经取代或未经取代的甲硅烷基;经取代或未经取代的烃环基;或者经取代或未经取代的杂环基,或者与相邻基团键合以形成经取代或未经取代的环,
[0188]
n111和n112各自为0至2的整数,
[0189]
当n111和n112为2时,两个括号中的结构彼此相同或不同,以及
[0190]
意指与化学式1键合的位点。
[0191]
根据本说明书的一个实施方案,化学式b1
‑
1由以下化学式b1
‑1‑
1或b1
‑1‑
2表示。
[0192]
[化学式b1
‑1‑
1]
[0193][0194]
[化学式b1
‑1‑
2]
[0195][0196]
在化学式b1
‑1‑
1和b1
‑1‑
2中,
[0197]
y101为o;s;或nr304,
[0198]
z101为o;s;cr301r302;或nr303,
[0199]
g401至g404和r301至r304彼此相同或不同,并且各自独立地为氢;氘;卤素基团;氰基;经取代或未经取代的烷基;经取代或未经取代的卤代烷基;经取代或未经取代的环烷基;经取代或未经取代的烷氧基;经取代或未经取代的卤代烷氧基;经取代或未经取代的烷基硫基;经取代或未经取代的芳氧基;经取代或未经取代的芳基硫基;经取代或未经取代的烯基;经取代或未经取代的硼基;经取代或未经取代的胺基;经取代或未经取代的芳基烷基;经取代或未经取代的甲硅烷基;经取代或未经取代的烃环基;或者经取代或未经取代的杂环基,或者与相邻基团键合以形成经取代或未经取代的环,以及
[0200]
意指与化学式1键合的位点。
[0201]
根据本说明书的一个实施方案,化学式1由以下化学式1
‑
6至1
‑
30中的任一者表示。
[0202]
[化学式1
‑
6]
[0203][0204]
[化学式1
‑
7]
[0205][0206]
[化学式1
‑
8]
[0207][0208]
[化学式1
‑
9]
[0209][0210]
[化学式1
‑
10]
[0211][0212]
[化学式1
‑
11]
[0213][0214]
[化学式1
‑
12]
[0215][0216]
[化学式1
‑
13]
[0217][0218]
[化学式1
‑
14]
[0219][0220]
[化学式1
‑
15]
[0221][0222]
[化学式1
‑
16]
[0223][0224]
[化学式1
‑
17]
[0225][0226]
[化学式1
‑
18]
[0227][0228]
[化学式1
‑
19]
[0229][0230]
[化学式1
‑
20]
[0231][0232]
[化学式1
‑
21]
[0233][0234]
[化学式1
‑
22]
[0235][0236]
[化学式1
‑
23]
[0237][0238]
[化学式1
‑
24]
[0239][0240]
[化学式1
‑
25]
[0241][0242]
[化学式1
‑
26]
[0243][0244]
[化学式1
‑
27]
[0245][0246]
[化学式1
‑
28]
[0247][0248]
[化学式1
‑
29]
[0249][0250]
[化学式1
‑
30]
[0251][0252]
在化学式1
‑
6至1
‑
30中,
[0253]
r
′
、r
″
和r1至r7具有与化学式1中相同的限定,
[0254]
y1至y5彼此相同或不同,并且各自独立地为o;或s,
[0255]
y101至y105彼此相同或不同,并且各自独立地为o;s;或nr
″′
,
[0256]
r
″′
、r101、g1至g28和g101至g128彼此相同或不同,并且各自独立地为氢;氘;卤素基团;氰基;经取代或未经取代的烷基;经取代或未经取代的卤代烷基;经取代或未经取代的环烷基;经取代或未经取代的烷氧基;经取代或未经取代的卤代烷氧基;经取代或未经取代的烷基硫基;经取代或未经取代的芳氧基;经取代或未经取代的芳基硫基;经取代或未经取代的烯基;经取代或未经取代的硼基;经取代或未经取代的胺基;经取代或未经取代的芳基烷基;经取代或未经取代的甲硅烷基;经取代或未经取代的烃环基;或者经取代或未经取代的杂环基,或者与相邻基团键合以形成经取代或未经取代的环,以及
[0257]
n11、n12、n111和n112各自为0至2的整数,
[0258]
r101为1或2,并且
[0259]
当r101、n11、n12、n111和n112为2时,两个括号中的结构彼此相同或不同。
[0260]
根据本说明书的一个实施方案,y2为o或s。
[0261]
根据本说明书的一个实施方案,r1至r4中的相邻基团不形成经取代或未经取代的环的基团为氢。
[0262]
根据本说明书的一个实施方案,r1至r4为氢。
[0263]
根据本说明书的一个实施方案,r101为氢。
[0264]
根据本说明书的一个实施方案,r1至r7彼此相同或不同,并且各自独立地为氢;氘;氰基;经取代或未经取代的具有1至30个碳原子的线性或支化的烷基;经取代或未经取代的具有3至30个碳原子的单环或多环环烷基;经取代或未经取代的具有1至30个碳原子的线性或支化的烷基甲硅烷基;经取代或未经取代的具有1至30个碳原子的线性或支化的卤代烷基;经取代或未经取代的具有1至30个碳原子的线性或支化的卤代烷氧基;经取代或未经取代的具有6至30个碳原子的芳基烷基;经取代或未经取代的具有6至30个碳原子的单环或多环二芳基胺基;经取代或未经取代的具有6至30个碳原子的单环或多环芳基;或者经取代或未经取代的具有2至30个碳原子的单环或多环杂环基。
[0265]
根据本说明书的一个实施方案,r1至r7彼此相同或不同,并且各自独立地为氢;氘;氰基;具有1至30个碳原子的线性或支化的烷基;具有3至30个碳原子的单环或多环环烷
基;具有1至30个碳原子的线性或支化的烷基甲硅烷基;具有1至30个碳原子的线性或支化的卤代烷基;具有1至30个碳原子的线性或支化的卤代烷氧基;具有6至30个碳原子的芳基烷基;具有6至30个碳原子的单环或多环二芳基胺基;具有6至30个碳原子的单环或多环芳基;或者具有2至30个碳原子的单环或多环杂环基,并且取代基未经取代或经选自以下中的一者或更多者取代:氘、卤素基团、氰基、具有1至30个碳原子的线性或支化的烷基、具有1至30个碳原子的线性或支化的烷基甲硅烷基、具有6至30个碳原子的单环或多环芳基、和其组合。
[0266]
根据本说明书的一个实施方案,r1至r7彼此相同或不同,并且各自独立地为氢;氘;氰基;甲基;叔丁基;
‑
cd3;
‑
cf3;
‑
ocf3;枯基;三甲基甲硅烷基;二苯基胺基;环己基;苯基;金刚烷基;或咔唑基,并且取代基未经取代或经选自以下中的一者或更多者取代:氘、
‑
f、氰基、甲基、三甲基甲硅烷基、叔丁基、和其组合。
[0267]
根据本说明书的一个实施方案,r6为氘;氰基;甲基;叔丁基;
‑
cd3;
‑
cf3;
‑
ocf3;枯基;三甲基甲硅烷基;二苯基胺基;环己基;苯基;金刚烷基;或咔唑基,并且取代基未经取代或经选自以下中的一者或更多者取代:氘、
‑
f、氰基、甲基、三甲基甲硅烷基、叔丁基、和其组合。
[0268]
根据本说明书的一个实施方案,当为化学式1的核的硼核的对位的r6经官能团取代时,官能团可以向化合物中电子不足的杂原子硼贡献电子以提高化合物的稳定性,并且化合物的光学特性可以通过适当有效地调节homo和lumo能级来容易地控制。
[0269]
根据本说明书的一个实施方案,r1至r5和r7彼此相同或不同,并且各自独立地为氢;氘;氰基;甲基;叔丁基;
‑
cd3;
‑
cf3;
‑
ocf3;枯基;三甲基甲硅烷基;二苯基胺基;环己基;苯基;金刚烷基;或咔唑基,并且取代基未经取代或经选自以下中的一者或更多者取代:氘、
‑
f、氰基、甲基、三甲基甲硅烷基、叔丁基、和其组合。
[0270]
枯基意指
[0271]
根据本说明书的一个实施方案,r1至r7彼此相同或不同,并且各自独立地为由以下组c的结构中的任一者表示的基团。
[0272]
<组c>
[0273][0274]
在所述结构中,
[0275]
r10和r11彼此相同或不同,并且各自独立地为氢;氘;卤素基团;氰基;经取代或未经取代的烷基;经取代或未经取代的烷氧基;经取代或未经取代的卤代烷氧基;经取代或未经取代的烯基;经取代或未经取代的甲硅烷基;经取代或未经取代的芳基烷基;经取代或未经取代的硼基;经取代或未经取代的芳基;或者经取代或未经取代的杂环基,或者与相邻基团键合以形成经取代或未经取代的环,
[0276]
r10为1至10的整数,
[0277]
r11为1至8的整数,
[0278]
当r10和r11各自为2或更大时,两个或更多个括号中的结构彼此相同或不同,
[0279]
r1为0或1,
[0280]
r2为0或1,以及
[0281]
为与化学式1键合的位点。
[0282]
根据本说明书的一个实施方案,r1至r7彼此相同或不同,并且各自独立地为由以下组d的结构中的任一者表示的基团。
[0283]
<组d>
[0284][0285]
在所述结构中,
[0286]
r100至r115彼此相同或不同,并且各自独立地为氢;氘;卤素基团;氰基;经取代或未经取代的烷基;经取代或未经取代的烷氧基;经取代或未经取代的卤代烷氧基;经取代或未经取代的烯基;经取代或未经取代的甲硅烷基;经取代或未经取代的芳基烷基;经取代或未经取代的硼基;经取代或未经取代的芳基;或者经取代或未经取代的杂环基,
[0287]
r100、r101、r108和r109各自为1至8的整数,
[0288]
r102和r107各自为1至12的整数,
[0289]
r103和r104各自为1至10的整数,
[0290]
r105为1至6的整数,
[0291]
r106和r110至r113各自为1至4的整数,
[0292]
r114为1至14的整数,
[0293]
r115为1至18的整数,
[0294]
当r100和r115各自为2或更大时,两个或更多个括号中的结构彼此相同或不同,以及
[0295]
为与化学式1键合的位点。
[0296]
根据本说明书的一个实施方案,组d中的r100至r115彼此相同或不同,并且各自独立地为氢;氘;经取代或未经取代的烷基;经取代或未经取代的环烷基;经取代或未经取代的甲硅烷基;或者经取代或未经取代的芳基。
[0297]
根据本说明书的一个实施方案,组d中的r100至r115彼此相同或不同,并且各自独立地为氢;氘;经取代或未经取代的具有1至30个碳原子的线性或支化的烷基;经取代或未经取代的具有3至30个碳原子的单环或多环环烷基;经取代或未经取代的具有1至30个碳原子的线性或支化的烷基甲硅烷基;或者经取代或未经取代的具有6至30个碳原子的单环或多环芳基。
[0298]
根据本说明书的一个实施方案,组d中的r100至r115彼此相同或不同,并且各自独立地为氢;氘;经取代或未经取代的具有1至20个碳原子的线性或支化的烷基;经取代或未经取代的具有3至20个碳原子的单环或多环环烷基;经取代或未经取代的具有1至20个碳原子的线性或支化的烷基甲硅烷基;或者经取代或未经取代的具有6至20个碳原子的单环或多环芳基。
[0299]
根据本说明书的一个实施方案,组d中的r100至r115彼此相同或不同,并且各自独立地为氢;氘;未经取代或经氘取代的具有1至30个碳原子的线性或支化的烷基;未经取代或经氘取代的具有3至30个碳原子的单环或多环环烷基;未经取代或经氘取代的具有1至30个碳原子的线性或支化的烷基甲硅烷基;或者未经取代或经氘取代的具有6至30个碳原子的单环或多环芳基。
[0300]
根据本说明书的一个实施方案,组d中的r100至r115彼此相同或不同,并且各自独立地为氢;氘;未经取代或经氘取代的具有1至20个碳原子的线性或支化的烷基;未经取代或经氘取代的具有3至20个碳原子的单环或多环环烷基;未经取代或经氘取代的具有1至20个碳原子的线性或支化的烷基甲硅烷基;或者未经取代或经氘取代的具有6至20个碳原子的单环或多环芳基。
[0301]
根据本说明书的一个实施方案,组d中的r100至r115彼此相同或不同,并且各自独立地为氢;氘;甲基;
‑
cd3;叔丁基;环己基;三甲基甲硅烷基;或者未经取代或经氘取代的苯基。
[0302]
根据本说明书的一个实施方案,r1至r4中的相邻基团彼此键合以形成经取代或未经取代的烃环;或者经取代或未经取代的杂环。
[0303]
根据本说明书的一个实施方案,r1至r4中的相邻基团彼此键合以形成经取代或未经取代的具有3至30个碳原子的单环或多环烃环;或者经取代或未经取代的具有2至30个碳原子的单环或多环杂环。
[0304]
根据本说明书的一个实施方案,r1至r4中的相邻基团彼此键合以形成经取代或未经取代的具有3至30个碳原子的单环或多环脂族、芳族、或稠合的脂族和芳族的烃环;或者经取代或未经取代的具有2至30个碳原子的单环或多环脂族杂环。
[0305]
根据本说明书的一个实施方案,r1至r4中的相邻基团彼此键合以形成具有3至30
个碳原子的单环或多环脂族、芳族、或稠合的脂族和芳族的烃环;或者具有2至30个碳原子的单环或多环脂族杂环,并且所述环未经取代或经选自具有1至30个碳原子的线性或支化的烷基和具有1至30个碳原子的线性或支化的卤代烷基中的一者或更多者取代。
[0306]
根据本说明书的一个实施方案,r1至r4中的相邻基团彼此键合以形成环戊烷环;环己烷环;环庚烷环;双环[2.2.1]辛烷环;降莰烷环;金刚烷环;茚环;菲环;四氢呋喃环;四氢噻吩环;吡咯烷环;四氢苯并呋喃环;四氢苯并噻吩环;八氢苯并呋喃环;八氢苯并噻吩环;八氢环庚吲哚环;八氢环庚吡咯环;八氢茚环;苯环;菲环;苯并呋喃环;芴环;二氢吖啶环;四氢喹啉环;二氢蒽环;色满环;咔唑环;或吲哚并咔唑环,并且所述环未经取代或经选自甲基、叔丁基和
‑
cf3中的一者或更多者取代。
[0307]
根据本说明书的一个实施方案,r
′
为经取代或未经取代的具有1至30个碳原子的线性或支化的烷基;经取代或未经取代的具有6至30个碳原子的芳基烷基;经取代或未经取代的具有3至30个碳原子的单环或多环烃环基;或者经取代或未经取代的具有2至30个碳原子的单环或多环杂环基。
[0308]
根据本说明书的一个实施方案,r
′
为具有1至30个碳原子的线性或支化的烷基;具有6至30个碳原子的芳基烷基;具有3至30个碳原子的单环或多环烃环基;或者具有2至30个碳原子的单环或多环杂环基,并且取代基未经取代或经选自以下中的一者或更多者取代:氘、卤素基团、氰基、具有1至30个碳原子的线性或支化的烷基、具有3至30个碳原子的单环或多环环烷基、具有1至30个碳原子的线性或支化的烷基甲硅烷基、具有3至30个碳原子的芳基甲硅烷基、具有1至30个碳原子的线性或支化的烷氧基、具有1至30个碳原子的线性或支化的卤代烷基、具有1至30个碳原子的线性或支化的卤代烷氧基、具有6至30个碳原子的芳氧基、具有6至30个碳原子的单环或多环芳基烷基、具有6至30个碳原子的单环或多环二芳基胺基、具有6至30个碳原子的单环或多环芳基、具有2至30个碳原子的单环或多环杂环基、具有6至30个碳原子的单环或多环芳族烃和具有3至30个碳原子的单环或多环脂族烃的稠环基、和其组合。
[0309]
根据本说明书的一个实施方案,r
′
为甲基;叔丁基;苯基;联苯基;三联苯基;萘基;芴基;三亚苯基;二苯并呋喃基;枯基;金刚烷基;四氢萘基;或六氢二苯并呋喃基,并且取代基未经取代或经选自以下中的一者或更多者取代:氘、f、氰基、甲基、叔丁基、
‑
cd3、
‑
cf3、
‑
ocf3、环己基、苯基、二苯基胺基、吡啶基、嘧啶基、甲氧基、异丙基、苯氧基、三苯基甲硅烷基、三甲基甲硅烷基、四氢萘基、和其组合。
[0310]
根据本说明书的一个实施方案,r
″
为经取代或未经取代的具有1至30个碳原子的线性或支化的烷基;经取代或未经取代的具有6至30个碳原子的芳基烷基;经取代或未经取代的具有3至30个碳原子的单环或多环烃环基;或者经取代或未经取代的具有2至30个碳原子的单环或多环杂环基。
[0311]
根据本说明书的一个实施方案,r
″
为具有1至30个碳原子的线性或支化的烷基;具有6至30个碳原子的芳基烷基;具有3至30个碳原子的单环或多环烃环基;或者具有2至30个碳原子的单环或多环杂环基,并且取代基未经取代或经选自以下中的一者或更多者取代:氘、卤素基团、氰基、具有1至30个碳原子的线性或支化的烷基、具有3至30个碳原子的单环或多环环烷基、具有1至30个碳原子的线性或支化的烷基甲硅烷基、具有3至30个碳原子的芳基甲硅烷基、具有1至30个碳原子的线性或支化的烷氧基、具有1至30个碳原子的线性或
支化的卤代烷基、具有1至30个碳原子的线性或支化的卤代烷氧基、具有6至30个碳原子的芳氧基、具有6至30个碳原子的单环或多环芳基烷基、具有6至30个碳原子的单环或多环二芳基胺基、具有6至30个碳原子的单环或多环芳基、具有2至30个碳原子的单环或多环杂环基、具有3至30个碳原子的单环或多环脂族烃和具有6至30个碳原子的单环或多环芳族烃的稠环基、和其组合。
[0312]
根据本说明书的一个实施方案,r
″
为甲基;叔丁基;苯基;联苯基;三联苯基;萘基;芴基;三亚苯基;二苯并呋喃基;枯基;金刚烷基;四氢萘基;或六氢二苯并呋喃基,并且取代基未经取代或经选自以下中的一者或更多者取代:氘、f、氰基、甲基、叔丁基、
‑
cd3、
‑
cf3、
‑
ocf3、环己基、苯基、二苯基胺基、吡啶基、嘧啶基、甲氧基、异丙基、苯氧基、三苯基甲硅烷基、三甲基甲硅烷基、四氢萘基、和其组合。
[0313]
根据本说明书的一个实施方案,y1为o。
[0314]
根据本说明书的一个实施方案,y1为s。
[0315]
根据本说明书的一个实施方案,y2为o。
[0316]
根据本说明书的一个实施方案,y2为s。
[0317]
根据本说明书的一个实施方案,y3为o。
[0318]
根据本说明书的一个实施方案,y3为s。
[0319]
根据本说明书的一个实施方案,y4为o。
[0320]
根据本说明书的一个实施方案,y4为s。
[0321]
根据本说明书的一个实施方案,y5为o。
[0322]
根据本说明书的一个实施方案,y5为s。
[0323]
根据本说明书的一个实施方案,y101为o。
[0324]
根据本说明书的一个实施方案,y101为s。
[0325]
根据本说明书的一个实施方案,y101为nr
″′
。
[0326]
根据本说明书的一个实施方案,y102为o。
[0327]
根据本说明书的一个实施方案,y102为s。
[0328]
根据本说明书的一个实施方案,y102为nr
″′
。
[0329]
根据本说明书的一个实施方案,y103为o。
[0330]
根据本说明书的一个实施方案,y103为s。
[0331]
根据本说明书的一个实施方案,y103为nr
″′
。
[0332]
根据本说明书的一个实施方案,y104为o。
[0333]
根据本说明书的一个实施方案,y104为s。
[0334]
根据本说明书的一个实施方案,y104为nr
″′
。
[0335]
根据本说明书的一个实施方案,y105为o。
[0336]
根据本说明书的一个实施方案,y105为s。
[0337]
根据本说明书的一个实施方案,y105为nr
″′
。
[0338]
根据本说明书的一个实施方案,r1和g2彼此键合以形成经取代或未经取代的杂环。
[0339]
根据本说明书的一个实施方案,r1和g2彼此键合以形成经取代或未经取代的包含b和n的杂环。
[0340]
根据本说明书的一个实施方案,r1和g2彼此键合以形成经取代或未经取代的包含b和n的6元杂环。
[0341]
根据本说明书的一个实施方案,r1和g2彼此键合以形成经芳基取代的杂环。
[0342]
根据本说明书的一个实施方案,r1和g2彼此键合以形成包含b和n并且经芳基取代的杂环。
[0343]
根据本说明书的一个实施方案,r1和g2彼此键合以形成包含b和si并且经苯基取代的6元杂环。
[0344]
根据本说明书的一个实施方案,r4和r
′
彼此键合以形成由以下组a表示的结构中的任一环。
[0345]
<组a>
[0346][0347]
在所述结构中,
[0348]
r10至r14彼此相同或不同,并且各自独立地为氢;氘;卤素基团;氰基;经取代或未经取代的烷基;经取代或未经取代的烷氧基;经取代或未经取代的卤代烷氧基;经取代或未经取代的烯基;经取代或未经取代的甲硅烷基;经取代或未经取代的芳基烷基;经取代或未经取代的硼基;经取代或未经取代的芳基;或者经取代或未经取代的杂环基,或者与相邻基团键合以形成经取代或未经取代的环,
[0349]
r10为1至10的整数,
[0350]
r11为1至8的整数,
[0351]
r12为1至6的整数,
[0352]
当r10至r12各自为2或更大时,两个或更多个括号中的结构彼此相同或不同。
[0353]
r1为0或1,以及
[0354]
r2为0或1。
[0355]
根据本说明书的一个实施方案,r4和r
′
彼此键合以形成由以下组b表示的结构中的任一环。
[0356]
<组b>
[0357][0358]
在所述结构中,
[0359]
r100至r120彼此相同或不同,并且各自独立地为氢;氘;卤素基团;氰基;经取代或未经取代的烷基;经取代或未经取代的烷氧基;经取代或未经取代的卤代烷氧基;经取代或未经取代的烯基;经取代或未经取代的甲硅烷基;经取代或未经取代的芳基烷基;经取代或未经取代的硼基;经取代或未经取代的芳基;或者经取代或未经取代的杂环基,
[0360]
r100、r101、r108、r109和r116至r118各自为1至8的整数。
[0361]
r102和r107各自为1至12的整数,
[0362]
r103和r104各自为1至10的整数,
[0363]
r105为1至6的整数,
[0364]
r106和r110至r113各自为1至4的整数,
[0365]
r114为1至14的整数,
[0366]
r115为1至18的整数,以及
[0367]
当r100至r118各自为2或更大时,两个或更多个括号中的结构彼此相同或不同。
[0368]
根据本说明书的一个实施方案,组b中的r100至r120彼此相同或不同,并且各自独立地为氢;氘;经取代或未经取代的烷基;经取代或未经取代的环烷基;经取代或未经取代的甲硅烷基;或者经取代或未经取代的芳基。
[0369]
根据本说明书的一个实施方案,组b中的r100至r120彼此相同或不同,并且各自独立地为氢;氘;经取代或未经取代的具有1至30个碳原子的线性或支化的烷基;经取代或未
经取代的具有3至30个碳原子的单环或多环环烷基;经取代或未经取代的具有1至30个碳原子的线性或支化的烷基甲硅烷基;或者经取代或未经取代的具有6至30个碳原子的单环或多环芳基。
[0370]
根据本说明书的一个实施方案,组b中的r100至r120彼此相同或不同,并且各自独立地为氢;氘;经取代或未经取代的具有1至20个碳原子的线性或支化的烷基;经取代或未经取代的具有3至20个碳原子的单环或多环环烷基;经取代或未经取代的具有1至20个碳原子的线性或支化的烷基甲硅烷基;或者经取代或未经取代的具有6至20个碳原子的单环或多环芳基。
[0371]
根据本说明书的一个实施方案,组b中的r100至r120彼此相同或不同,并且各自独立地为氢;氘;未经取代或经氘取代的具有1至30个碳原子的线性或支化的烷基;未经取代或经氘取代的具有3至30个碳原子的单环或多环环烷基;未经取代或经氘取代的具有1至30个碳原子的线性或支化的烷基甲硅烷基;或者未经取代或经氘取代的具有6至30个碳原子的单环或多环芳基。
[0372]
根据本说明书的一个实施方案,组b中的r100至r120彼此相同或不同,并且各自独立地为氢;氘;未经取代或经氘取代的具有1至20个碳原子的线性或支化的烷基;未经取代或经氘取代的具有3至20个碳原子的单环或多环环烷基;未经取代或经氘取代的具有1至20个碳原子的线性或支化的烷基甲硅烷基;或者未经取代或经氘取代的具有6至20个碳原子的单环或多环芳基。
[0373]
根据本说明书的一个实施方案,组b中的r100至r120彼此相同或不同,并且各自独立地为氢;氘;甲基;
‑
cd3;叔丁基;环己基;三甲基甲硅烷基;或者未经取代或经氘取代的苯基。
[0374]
根据本说明书的一个实施方案,g1至g28和g101至g128彼此相同或不同,并且各自独立地为氢;氘;氰基;经取代或未经取代的具有1至30个碳原子的线性或支化的烷基;经取代或未经取代的具有1至30个碳原子的线性或支化的卤代烷基;经取代或未经取代的具有3至30个碳原子的单环或多环环烷基;经取代或未经取代的具有1至30个碳原子的线性或支化的烷基甲硅烷基;经取代或未经取代的具有6至30个碳原子的单环或多环芳基甲硅烷基;经取代或未经取代的具有6至30个碳原子的芳基烷基;经取代或未经取代的具有6至30个碳原子的单环或多环二芳基胺基;经取代或未经取代的具有6至30个碳原子的单环或多环芳基;或者经取代或未经取代的具有2至30个碳原子的单环或多环杂环基。
[0375]
根据本说明书的一个实施方案,g1至g28和g101至g128彼此相同或不同,并且各自独立地为氢;氘;氰基;具有1至30个碳原子的线性或支化的烷基;具有1至30个碳原子的线性或支化的卤代烷基;具有3至30个碳原子的单环或多环环烷基;具有1至30个碳原子的线性或支化的烷基甲硅烷基;具有6至30个碳原子的单环或多环芳基甲硅烷基;具有6至30个碳原子的芳基烷基;具有6至30个碳原子的单环或多环二芳基胺基;具有6至30个碳原子的单环或多环芳基;或者具有2至30个碳原子的单环或多环杂环基,并且取代基未经取代或经选自氘、卤素基团、具有1至30个碳原子的线性或支化的烷基、和其组合中的一者或更多者取代。
[0376]
根据本说明书的一个实施方案,g1至g28和g101至g128彼此相同或不同,并且各自独立地为氢;氘;氰基;甲基;异丙基;叔丁基;
‑
cf3;金刚烷基;三甲基甲硅烷基;三苯基甲硅
烷基;二苯基胺基;苯基;萘基;枯基;吡啶基;或咔唑基,并且取代基未经取代或经选自氘、f、甲基、叔丁基、和其组合中的一者或更多者取代。
[0377]
根据本说明书的一个实施方案,r
″′
为经取代或未经取代的具有1至30个碳原子的线性或支化的烷基;经取代或未经取代的具有6至30个碳原子的单环或多环脂族、芳族、或稠合的脂族和芳族的烃环基;或者经取代或未经取代的具有2至30个碳原子的单环或多环杂环基。
[0378]
根据本说明书的一个实施方案,r
″′
为具有1至30个碳原子的线性或支化的烷基;具有6至30个碳原子的单环或多环脂族、芳族、或稠合的脂族和芳族的烃环基;或者具有2至30个碳原子的单环或多环杂环基,并且取代基未经取代或经选自氘、卤素基团、具有1至30个碳原子的线性或支化的烷基、具有1至30个碳原子的线性或支化的卤代烷基、和其组合中的一者或更多者取代。
[0379]
根据本说明书的一个实施方案,r
″′
为叔丁基;苯基;联苯基;四氢苯并呋喃基;吡啶基;或三嗪基,并且取代基未经取代或经选自氘、f、
‑
cf3、甲基、叔丁基、和其组合中的一者或更多者取代。
[0380]
根据本说明书的一个实施方案,g1至g28和g101至g128彼此相同或不同,并且各自独立地为由以下组c的结构中的任一者表示的基团。
[0381]
<组c>
[0382][0383]
在所述结构中,
[0384]
r10和r11彼此相同或不同,并且各自独立地为氢;氘;卤素基团;氰基;经取代或未经取代的烷基;经取代或未经取代的烷氧基;经取代或未经取代的卤代烷氧基;经取代或未经取代的烯基;经取代或未经取代的甲硅烷基;经取代或未经取代的芳基烷基;经取代或未经取代的硼基;经取代或未经取代的芳基;或者经取代或未经取代的杂环基,或者与相邻基团键合以形成经取代或未经取代的环,
[0385]
r10为1至10的整数,
[0386]
r11为1至8的整数,
[0387]
当r10和r11各自为2或更大时,两个或更多个括号中的结构彼此相同或不同,
[0388]
r1为0或1,
[0389]
r2为0或1,以及
[0390]
为与化学式1键合的位点。
[0391]
根据本说明书的一个实施方案,g1至g28和g101至g128彼此相同或不同,并且各自独立地为由以下组d的结构中的任一者表示的基团。
[0392]
<组d>
[0393][0394]
在所述结构中,
[0395]
r100至r115彼此相同或不同,并且各自独立地为氢;氘;卤素基团;氰基;经取代或未经取代的烷基;经取代或未经取代的烷氧基;经取代或未经取代的卤代烷氧基;经取代或未经取代的烯基;经取代或未经取代的甲硅烷基;经取代或未经取代的芳基烷基;经取代或未经取代的硼基;经取代或未经取代的芳基;或者经取代或未经取代的杂环基,
[0396]
r100、r101、r108和r109各自为1至8的整数,
[0397]
r102和r107各自为1至12的整数,
[0398]
r103和r104各自为1至10的整数,
[0399]
r105为1至6的整数,
[0400]
r106和r110至r113各自为1至4的整数,
[0401]
r114为1至14的整数,
[0402]
r115为1至18的整数,
[0403]
当r100至r115各自为2或更大时,两个或更多个括号中的结构彼此相同或不同,以及
[0404]
为与化学式1键合的位点。
[0405]
根据本说明书的一个实施方案,组d中的r100至r115彼此相同或不同,并且各自独立地为氢;氘;经取代或未经取代的烷基;经取代或未经取代的环烷基;经取代或未经取代的甲硅烷基;或者经取代或未经取代的芳基。
[0406]
根据本说明书的一个实施方案,组d中的r100至r115彼此相同或不同,并且各自独立地为氢;氘;经取代或未经取代的具有1至30个碳原子的线性或支化的烷基;经取代或未
经取代的具有3至30个碳原子的单环或多环环烷基;经取代或未经取代的具有1至30个碳原子的线性或支化的烷基甲硅烷基;或者经取代或未经取代的具有6至30个碳原子的单环或多环芳基。
[0407]
根据本说明书的一个实施方案,组d中的r100至r115彼此相同或不同,并且各自独立地为氢;氘;经取代或未经取代的具有1至20个碳原子的线性或支化的烷基;经取代或未经取代的具有3至20个碳原子的单环或多环环烷基;经取代或未经取代的具有1至20个碳原子的线性或支化的烷基甲硅烷基;或者经取代或未经取代的具有6至20个碳原子的单环或多环芳基。
[0408]
根据本说明书的一个实施方案,组d中的r100至r115彼此相同或不同,并且各自独立地为氢;氘;未经取代或经氘取代的具有1至30个碳原子的线性或支化的烷基;未经取代或经氘取代的具有3至30个碳原子的单环或多环环烷基;未经取代或经氘取代的具有1至30个碳原子的线性或支化的烷基甲硅烷基;或者未经取代或经氘取代的具有6至30个碳原子的单环或多环芳基。
[0409]
根据本说明书的一个实施方案,组d中的r100至r115彼此相同或不同,并且各自独立地为氢;氘;未经取代或经氘取代的具有1至20个碳原子的线性或支化的烷基;未经取代或经氘取代的具有3至20个碳原子的单环或多环环烷基;未经取代或经氘取代的具有1至20个碳原子的线性或支化的烷基甲硅烷基;或者未经取代或经氘取代的具有6至20个碳原子的单环或多环芳基。
[0410]
根据本说明书的一个实施方案,组d中的r100至r115彼此相同或不同,并且各自独立地为氢;氘;甲基;
‑
cd3;叔丁基;环己基;三甲基甲硅烷基;或者未经取代或经氘取代的苯基。
[0411]
根据本说明书的一个实施方案,g1至g28和g101至g128中的相邻基团彼此键合以形成经取代或未经取代的烃环;或者经取代或未经取代的杂环。
[0412]
根据本说明书的一个实施方案,g1至g28和g101至g128中的相邻基团彼此键合以形成经取代或未经取代的具有3至30个碳原子的单环或多环烃环;或者经取代或未经取代的具有2至30个碳原子的单环或多环杂环。
[0413]
根据本说明书的一个实施方案,g1至g28和g101至g128中的相邻基团彼此键合以形成经取代或未经取代的具有3至30个碳原子的单环或多环脂族、芳族、或稠合的脂族和芳族的烃环;或者经取代或未经取代的具有2至30个碳原子的单环或多环脂族杂环。
[0414]
根据本说明书的一个实施方案,g1至g28和g101至g128中的相邻基团彼此键合以形成具有3至30个碳原子的单环或多环脂族、芳族、或稠合的脂族和芳族的烃环;或者具有2至30个碳原子的单环或多环脂族杂环,并且所述环未经取代或经选自以下中的一者或更多者取代:未经取代或经具有1至30个碳原子的线性或支化的烷基取代的具有6至30个碳原子的单环或多环芳基;具有1至30个碳原子的线性或支化的烷基;和具有1至30个碳原子的线性或支化的卤代烷基。
[0415]
根据本说明书的一个实施方案,g1至g28和g101至g128中的相邻基团彼此键合以形成环戊烷环;环己烷环;环庚烷环;双环[2.2.1]辛烷环;降莰烷环;金刚烷环;茚环;菲环;四氢呋喃环;四氢噻吩环;四氢萘并呋喃环;四氢萘并噻吩环;吡咯烷环;八氢苯并呋喃环;八氢苯并噻吩环;八氢茚环;苯环;菲环;苯并呋喃环;芴环;二氢蒽环;色满环;咔唑环;苯并
咪唑;四氢苯并吲哚环;吲哚环;或吲哚并咔唑环,并且所述环未经取代或经选自以下中的一者或更多者取代:经叔丁基取代的苯基;甲基;叔丁基和
‑
cf3。
[0416]
根据本说明书的一个实施方案,r
″′
和g102彼此键合以形成经取代或未经取代的杂环。
[0417]
根据本说明书的一个实施方案,r
″′
和g102彼此键合以形成经取代或未经取代的包含b和n的杂环。
[0418]
根据本说明书的一个实施方案,r
″′
和g102彼此键合以形成经取代或未经取代的包含b和n的6元杂环。
[0419]
根据本说明书的一个实施方案,r
″′
和g102彼此键合以形成杂环。
[0420]
根据本说明书的一个实施方案,r
″′
和g102彼此键合以形成包含b和n的杂环。
[0421]
根据本说明书的一个实施方案,r
″′
和g102彼此键合以形成包含b和n的6元杂环。
[0422]
根据本说明书的一个实施方案,化学式1为选自以下化合物中的任一者。
[0423]
[0424]
[0425][0426]
[0427]
[0428]
[0429]
[0430]
[0431]
[0432]
[0433]
[0434]
[0435]
[0436]
[0437]
[0438]
[0439]
[0440]
[0441]
[0442]
[0443]
[0444][0445]
在所述化合物中,ph意指苯基。
[0446]
根据本说明书的一个实施方案,当在化学式1中,a1为经叔丁基取代的苯并呋喃或经叔丁基取代的苯并噻吩,r
′
和r
″
各自独立地为经叔丁基或异丙基取代的苯基或者经叔丁基取代的联苯基,以及r2或r3为叔丁基或氢时,排除其中r6为叔丁基、苯基或金刚烷基的化
合物。
[0447]
根据本说明书的一个实施方案,当在化学式1中,a1为苯并呋喃或二苯并呋喃时,排除其中r2为未经取代或经叔丁基取代的二苯基胺基的化合物。
[0448]
根据本说明书的一个实施方案,当在化学式1中,a1为苯并呋喃或二苯并呋喃,r
′
和r
″
各自独立地为经叔丁基取代的苯基,以及r3为叔丁基时,排除其中r6为甲基或环己基的化合物。
[0449]
根据本说明书的一个实施方案,当在化学式1中,a1为苯并呋喃或二苯并呋喃,r
′
和r
″
各自独立地为经叔丁基取代的联苯基,以及r3为经叔丁基取代的苯基时,排除其中r6为甲基的化合物。
[0450]
根据本说明书的一个实施方案,当在化学式1中,a1为苯并呋喃或二苯并呋喃,r
′
和r
″
各自独立地为联苯基或经二苯基胺基取代的苯基,以及r1至r4为氢时,排除其中r6为环己基的化合物。
[0451]
根据本说明书的一个实施方案,当化学式1的a1包含5元脂族或芳族杂环,并且化学式1的a1包含5元芳族杂环时,化学式1包含至少一个稠合脂族烃环。
[0452]
本说明书的一个实施方案提供了包含上述化合物的有机发光器件。
[0453]
在本说明书中,某个构件放置在另一构件“上”的描述不仅包括一个构件与另一构件接触的情况,而且包括在这两个构件之间存在又一构件的情况。
[0454]
在本说明书中,某部分“包括”某些构成要素的描述意指还能够包括其他构成要素,并且除非特别相反地说明,否则不排除其他构成要素。
[0455]
在本说明书中,“层”具有与本领域主要使用的“膜”一致的含义,并且意指覆盖目标区域的涂层。“层”的尺寸没有限制,并且各个“层”可以具有相同或不同的尺寸。根据一个实施方案,“层”的尺寸可以与整个器件相同,可以对应于特定功能区域的尺寸,或者可以与单个子像素一样小。
[0456]
在本说明书中,特定a材料包含在b层中的含义包括以下二者:i)一种或更多种类型的a材料包含在一个b层中,以及ii)b层形成为一个或更多个层,并且a材料包含在为多层的b层的一个或更多个中。
[0457]
在本说明书中,特定a材料包含在c层或d层中的含义包括:i)包含在一个或更多个c层的一个或更多个层中,ii)包含在一个或更多个d层的一个或更多个层中,或者iii)分别包含在一个或更多个c层和一个或更多个d层中的每一个中。
[0458]
本说明书的一个实施方案提供了有机发光器件,其包括:第一电极;与第一电极相对设置的第二电极;以及设置在第一电极与第二电极之间的一个或更多个有机材料层,其中有机材料层中的一个或更多个层包含由化学式1表示的化合物。
[0459]
本说明书的有机发光器件的有机材料层可以以单层结构形成,但是也可以以其中层合有两个或更多个有机材料层的多层结构形成。例如,本说明书的有机发光器件可以具有包括空穴注入层、空穴传输层、发光层、电子传输层、电子注入层、电子阻挡层、空穴阻挡层等的结构。然而,有机发光器件的结构不限于此,并且可以包括较少数量的有机层。
[0460]
在本说明书的一个实施方案中,有机材料层包括发光层,并且发光层包含由化学式1表示的化合物。
[0461]
在本说明书的一个实施方案中,有机材料层包括发光层,并且发光层包含由化学
式1表示的化合物作为发光层的掺杂剂。
[0462]
在本说明书的一个实施方案中,有机材料层包括发光层,并且发光层包含由化学式1表示的化合物作为发光层的蓝色荧光掺杂剂。
[0463]
在本说明书的一个实施方案中,有机发光器件还包括选自以下中的一个、两个或更多个层:空穴注入层、空穴传输层、发光层、电子传输层、电子注入层、空穴阻挡层和电子阻挡层。
[0464]
在本说明书的一个实施方案中,发光层还包含主体化合物。
[0465]
在本说明书的一个实施方案中,发光层还包含主体化合物,并且在主体化合物中,在可取代位置处的至少一个氢经氘取代。
[0466]
在本说明书的一个实施方案中,当主体化合物经氘取代时,主体化合物经氘取代30%或更多。在另一个实施方案中,主体化合物经氘取代40%或更多。在另一个实施方案中,主体化合物经氘取代60%或更多。在另一个实施方案中,主体化合物经氘取代80%或更多。在另一个实施方案中,主体化合物经氘取代100%。
[0467]
在本说明书的一个实施方案中,发光层还包含由以下化学式h表示的化合物。
[0468]
[化学式h]
[0469][0470]
在化学式h中,
[0471]
l20和l21彼此相同或不同,并且各自独立地为直接键;经取代或未经取代的亚芳基;或者经取代或未经取代的亚杂芳基,
[0472]
ar20和ar21彼此相同或不同,并且各自独立地为氢;氘;经取代或未经取代的芳基;或者经取代或未经取代的杂环基,以及
[0473]
r20为氢;氘;卤素基团;经取代或未经取代的烷基;经取代或未经取代的环烷基;经取代或未经取代的芳基;或者经取代或未经取代的杂环基。
[0474]
在本说明书的一个实施方案中,l20和l21彼此相同或不同,并且各自独立地为直接键;具有6至30个碳原子的单环或多环亚芳基;或者具有2至30个碳原子的单环或多环亚杂芳基。
[0475]
在本说明书的一个实施方案中,l20和l21彼此相同或不同,并且各自独立地为直接键;具有6至20个碳原子的单环或多环亚芳基;或者具有2至20个碳原子的单环或多环亚杂芳基。
[0476]
在本说明书的一个实施方案中,l20和l21彼此相同或不同,并且各自独立地为直接键;亚苯基;亚联苯基;亚萘基;二价二苯并呋喃基;或者二价二苯并噻吩基。
[0477]
在本说明书的一个实施方案中,ar20和ar21彼此相同或不同,并且各自独立地为经取代或未经取代的具有6至30个碳原子的单环或多环芳基;或者经取代或未经取代的具
有2至30个碳原子的单环或多环杂环基。
[0478]
在本说明书的一个实施方案中,ar20和ar21彼此相同或不同,并且各自独立地为经取代或未经取代的具有6至20个碳原子的单环或多环芳基;或者经取代或未经取代的具有2至20个碳原子的单环或多环杂环基。
[0479]
在本说明书的一个实施方案中,ar20和ar21彼此相同或不同,并且各自独立地为经取代或未经取代的具有6至20个碳原子的单环至四环的芳基;或者经取代或未经取代的具有6至20个碳原子的单环至四环的杂环基。
[0480]
在本说明书的一个实施方案中,ar20和ar21彼此相同或不同,并且各自独立地为经取代或未经取代的苯基;经取代或未经取代的联苯基;经取代或未经取代的三联苯基;经取代或未经取代的萘基;经取代或未经取代的蒽基;经取代或未经取代的菲基;经取代或未经取代的非那烯基;经取代或未经取代的芴基;经取代或未经取代的苯并芴基;经取代或未经取代的呋喃基;经取代或未经取代的噻吩基;经取代或未经取代的二苯并呋喃基;经取代或未经取代的萘并苯并呋喃基;经取代或未经取代的二苯并噻吩基;或者经取代或未经取代的萘并苯并噻吩基。
[0481]
在本说明书的一个实施方案中,ar20和ar21彼此相同或不同,并且各自独立地为未经取代或经氘或具有6至20个碳原子的单环或多环芳基取代的苯基;未经取代或经具有6至20个碳原子的单环或多环芳基取代的联苯基;未经取代或经氘或具有6至20个碳原子的单环或多环芳基取代的萘基;未经取代或经具有6至20个碳原子的单环或多环芳基取代的二苯并呋喃基;未经取代或经具有6至20个碳原子的单环或多环芳基取代的萘并苯并呋喃基;未经取代或经具有6至20个碳原子的单环或多环芳基取代的二苯并噻吩基;或者未经取代或经具有6至20个碳原子的单环或多环芳基取代的萘并苯并噻吩基。
[0482]
在本说明书的一个实施方案中,ar20和ar21彼此相同或不同,并且各自独立地为未经取代或经氘取代的苯基;联苯基;未经取代或经氘取代的萘基;二苯并呋喃基;萘并苯并呋喃基;二苯并噻吩基;或者萘并苯并噻吩基。
[0483]
在本说明书的一个实施方案中,ar20为经取代或未经取代的杂环基,以及ar21为经取代或未经取代的芳基。
[0484]
在本说明书的一个实施方案中,r20为氢;氘;卤素基团;经取代或未经取代的具有1至30个碳原子的线性或支化的烷基;经取代或未经取代的具有3至30个碳原子的单环或多环环烷基;经取代或未经取代的具有6至30个碳原子的单环或多环芳基;或者经取代或未经取代的具有2至30个碳原子的单环或多环杂环基。
[0485]
根据本说明书的一个实施方案,r20为氢;氘;氟;经取代或未经取代的具有1至10个碳原子的线性或支化的烷基;经取代或未经取代的具有3至10个碳原子的单环或多环环烷基;经取代或未经取代的具有6至30个碳原子的单环或多环芳基;或者经取代或未经取代的具有2至30个碳原子的单环或多环杂环基。
[0486]
在本说明书的一个实施方案中,r20为氢;氘;未经取代或经氘、苯基或萘基取代的苯基;未经取代或经氘或苯基取代的萘基;联苯基;二苯并呋喃基;或者二苯并噻吩基。
[0487]
在本说明书的一个实施方案中,当由化学式h表示的化合物经氘取代时,在可取代位置处的氢可以经氘取代30%或更多。在另一个实施方案中,在化学式h的结构中,在可取代位置处的氢经氘取代40%或更多。在另一个实施方案中,在化学式h的结构中,在可取代
位置处的氢经氘取代60%或更多。
[0488]
在另一个实施方案中,在化学式h的结构中,在可取代位置处的氢经氘取代80%或更多。在另一个实施方案中,在化学式h的结构中,在可取代位置处的氢经氘取代100%。
[0489]
在本说明书的一个实施方案中,由化学式h表示的化合物为选自以下化合物中的任一者。
[0490]
[0491]
[0492][0493]
在本说明书的一个实施方案中,在发光层中,使用由化学式1表示的化合物作为掺杂剂,以及使用由化学式h表示的化合物作为主体。
[0494]
在本说明书的一个实施方案中,当发光层包含主体和掺杂剂时,基于100重量份的发光层,掺杂剂的含量可以在0.01重量份至10重量份的范围内选择,然而,所述含量不限于此。
[0495]
在本说明书的一个实施方案中,发光层包含主体和掺杂剂,并且主体和掺杂剂以99:1至1:99的重量比,优选地以99:1至70:30的重量比,并且更优选地以99:1至90:10的重量比包含在内。
[0496]
发光层还可以包含主体材料,并且主体包括稠合芳族环衍生物、含杂环的化合物等。具体地,作为稠合芳族环衍生物,可以包括蒽衍生物、芘衍生物、萘衍生物、并五苯衍生物、菲化合物、荧蒽化合物等,以及作为含杂环的化合物,可以包括咔唑衍生物、二苯并呋喃衍生物、梯子型呋喃化合物、嘧啶衍生物、三嗪衍生物等,并且可以包含稠合芳族环衍生物和含杂环的化合物的两种或更多种类型的混合物,然而,主体材料不限于此。
[0497]
根据本说明书的一个实施方案,有机材料层包括发光层,并且发光层包含主体和一种或更多种类型的掺杂剂。
[0498]
根据本说明书的一个实施方案,有机材料层包括发光层,并且发光层包含主体和两种或更多种类型的混合掺杂剂。
[0499]
根据本说明书的一个实施方案,两种或更多种类型的混合掺杂剂中的一者或更多者包含化学式1,以及主体包含由化学式h表示的化合物。两种或更多种类型的混合掺杂剂中的一者或更多者包含化学式1,并且作为其余部分,可以使用本领域已知的掺杂剂材料,然而,掺杂剂不限于此。
[0500]
根据本说明书的一个实施方案,两种或更多种类型的混合掺杂剂中的一者或更多者包含化学式1,并且作为其余部分,可以使用与化学式1不同的基于硼的化合物、基于芘的化合物和基于延迟荧光的化合物中的一者或更多者,然而,掺杂剂不限于此。
[0501]
根据本说明书的一个实施方案,有机材料层包括发光层,并且发光层包含一种或更多种类型的主体。
[0502]
根据本说明书的一个实施方案,有机材料层包括发光层,并且发光层包含两种或更多种类型的混合主体。
[0503]
根据本说明书的一个实施方案,两种或更多种类型的混合主体中的一者或更多者为由化学式h表示的化合物。
[0504]
根据本说明书的一个实施方案,两种或更多种类型的混合主体彼此不同,并且各自独立地为由化学式h表示的化合物。
[0505]
根据本说明书的一个实施方案,有机材料层包括发光层,并且发光层包含两种类型的混合主体。
[0506]
根据本说明书的一个实施方案,有机材料层包括发光层,发光层包含两种类型的混合主体,两种类型的混合主体彼此不同,并且两种类型的主体为由化学式h表示的化合物。
[0507]
根据本说明书的一个实施方案,有机材料层包括发光层,发光层包含由化学式h表示的第一主体;和由化学式h表示的第二主体,并且第一主体和第二主体彼此不同。
[0508]
根据本说明书的一个实施方案,第一主体:第二主体以95:5至5:95的重量比,并且优选地以70:30至30:70的重量比包含在内。
[0509]
根据本说明书的一个实施方案,有机材料层包括发光层,并且发光层包含一种或更多种类型的主体、和掺杂剂。
[0510]
根据本说明书的一个实施方案,有机材料层包括发光层,发光层包含掺杂剂和一种或更多种类型的主体,主体包含由化学式h表示的化合物,以及掺杂剂包含由化学式1表示的化合物。
[0511]
根据本说明书的一个实施方案,有机材料层包括发光层,并且发光层包含掺杂剂和两种或更多种类型的混合主体。
[0512]
根据本说明书的一个实施方案,两种或更多种类型的混合主体中的一者或更多者包含由化学式h表示的化合物,以及掺杂剂包含由化学式1表示的化合物。
[0513]
在本说明书中,混合主体的两种或更多种类型彼此不同。
[0514]
根据本说明书的一个实施方案,有机材料层包括发光层,并且发光层包含两种类型的混合主体、和掺杂剂。
[0515]
根据本说明书的一个实施方案,混合主体的两种类型彼此不同,并且各自独立地
包含由化学式h表示的化合物,以及掺杂剂包含由化学式1表示的化合物。
[0516]
根据本说明书的一个实施方案,有机材料层包括发光层,发光层包含由化学式h表示的第一主体;由化学式h表示的第二主体;和由化学式1表示的掺杂剂,并且第一主体和第二主体彼此不同。
[0517]
根据本说明书的一个实施方案,有机材料层使用一种或更多种类型的主体和一种或更多种类型的掺杂剂,一种或更多种类型的主体包含由化学式h表示的化合物,以及一种或更多种类型的掺杂剂包含由化学式1表示的化合物。
[0518]
根据本说明书的一个实施方案,有机材料层使用两种或更多种类型的混合主体和两种或更多种类型的混合掺杂剂,两种或更多种类型的混合主体可以使用与上述相同的材料,以及两种或更多种类型的混合掺杂剂可以使用与上述相同的材料。
[0519]
在本说明书的一个实施方案中,有机发光器件包括:第一电极;第二电极;设置在第一电极与第二电极之间的发光层;以及设置在发光层与第一电极之间或发光层与第二电极之间的两个或更多个有机材料层,其中两个或更多个有机材料层中的至少一者包含由化学式1表示的化合物。
[0520]
在本说明书的一个实施方案中,作为两个或更多个有机材料层,两者或更多者可以选自发光层、空穴传输层、空穴注入层、同时进行空穴传输和空穴注入的层、和电子阻挡层。
[0521]
在本说明书的一个实施方案中,有机发光器件可以包括两个或更多个电子传输层,但不限于此。
[0522]
在本说明书的一个实施方案中,有机材料层包括两个或更多个电子传输层,并且两个或更多个电子传输层中的至少一者包含由化学式1表示的化合物。具体地,在本说明书的一个实施方案中,由化学式1表示的化合物可以包含在两个或更多个电子传输层的一者中,或者可以包含在两个或更多个电子传输层的每一者中。
[0523]
此外,当所述化合物包含在本说明书的一个实施方案中的两个或更多个电子传输层的每一者中时,除了由化学式1表示的化合物之外的材料可以彼此相同或不同。
[0524]
当包含由化学式1表示的化合物的有机材料层为电子传输层时,电子传输层还可以包含n型掺杂剂。作为n型掺杂剂,可以使用本领域已知的那些,并且例如,可以使用金属或金属配合物。例如,包含由化学式1表示的化合物的电子传输层还可以包含喹啉锂(liq)。
[0525]
在本说明书的一个实施方案中,有机材料层包括两个或更多个空穴传输层,并且两个或更多个空穴传输层中的至少一者包含由化学式1表示的化合物。具体地,在本说明书的一个实施方案中,由化学式1表示的化合物可以包含在两个或更多个空穴传输层的一者中,或者可以包含在两个或更多个空穴传输层的每一者中。
[0526]
此外,当由化学式1表示的化合物包含在本说明书的一个实施方案中的两个或更多个空穴传输层的每一者中时,除了由化学式1表示的化合物之外的材料可以彼此相同或不同。
[0527]
在本说明书的一个实施方案中,除了包含由化学式1表示的化合物的有机材料层之外,有机材料层还可以包括包含含有芳基胺基、咔唑基或苯并咔唑基的化合物的空穴注入层或空穴传输层。
[0528]
在本说明书的一个实施方案中,第一电极为阳极或阴极。
[0529]
在本说明书的一个实施方案中,第二电极为阴极或阳极。
[0530]
在本说明书的一个实施方案中,有机发光器件可以为具有其中阳极、一个或更多个有机材料层和阴极顺序层合在基底上的结构(正常型)的有机发光器件。
[0531]
在本说明书的一个实施方案中,有机发光器件可以为具有其中阴极、一个或更多个有机材料层和阳极顺序层合在基底上的反向结构(倒置型)的有机发光器件。
[0532]
例如,根据本说明书的一个实施方案的有机发光器件的结构示于图1至图3中。图1至图3示出了有机发光器件,并且有机发光器件不限于此。
[0533]
图1示出了其中顺序层合有基底1、第一电极2、发光层3和第二电极4的有机发光器件的结构。在这样的结构中,所述化合物可以包含在发光层3中。
[0534]
图2示出了其中顺序层合有基底1、第一电极2、空穴注入层5、空穴传输层8、电子阻挡层9、发光层3、空穴阻挡层6、电子注入和传输层7以及第二电极4的有机发光器件的结构。在这样的结构中,所述化合物可以包含在发光层3、空穴阻挡层6、电子注入和传输层7以及空穴注入层8中的一者或更多者中。
[0535]
图3示出了其中顺序层合有基底1、第一电极2、空穴注入层5、空穴传输层8、电子阻挡层9、发光层3、第一电子传输层10、第二电子传输层11、电子注入层12和第二电极4的有机发光器件的结构。在这样的结构中,所述化合物可以包含在发光层3中。
[0536]
本说明书的有机发光器件可以使用本领域已知的材料和方法来制造,不同之处在于有机材料层的一个或更多个层包含所述化合物,即,由化学式1表示的化合物。
[0537]
当有机发光器件包括复数个有机材料层时,有机材料层可以由相同材料或不同材料形成。
[0538]
例如,本说明书的有机发光器件可以通过将第一电极、有机材料层和第二电极顺序地层合在基底上来制造。在此,有机发光器件可以通过以下来制造:通过使用物理气相沉积(pvd)法例如溅射或电子束蒸镀沉积金属、具有导电性的金属氧化物、或其合金而在基底上形成阳极,并且在阳极上形成包括空穴注入层、空穴传输层、发光层和电子传输层的有机材料层,然后在有机材料层上沉积可用作阴极的材料。除了这样的方法之外,有机发光器件还可以通过将阴极材料、有机材料层和阳极材料顺序地沉积在基底上来制造。
[0539]
此外,在制造有机发光器件时,可以使用溶液涂覆法以及真空沉积法来使由化学式1表示的化合物形成为有机材料层。在此,溶液涂覆法意指旋涂、浸涂、刮涂、喷墨印刷、丝网印刷、喷洒法、辊涂等,但不限于此。
[0540]
除了这样的方法之外,有机发光器件还可以通过将阴极材料、有机材料层和阳极材料顺序地层合在基底上来制造(国际专利申请特许公开第2003/012890号)。然而,制造方法不限于此。
[0541]
作为第一电极材料,通常优选具有大功函数的材料,使得空穴顺利地注入到有机材料层中。其实例包括:金属,例如钒、铬、铜、锌和金,或其合金;金属氧化物,例如氧化锌、氧化铟、氧化铟锡(ito)和氧化铟锌(izo);金属和氧化物的组合,例如zno:al或sno2:sb;导电聚合物,例如聚(3
‑
甲基噻吩)、聚[3,4
‑
(亚乙基
‑
1,2
‑
二氧)噻吩](pedot)、聚吡咯和聚苯胺,但不限于此。
[0542]
作为第二电极材料,通常优选具有小功函数的材料,使得电子顺利地注入到有机材料层中。其实例包括:金属,例如镁、钙、钠、钾、钛、铟、钇、锂、钆、铝、银、锡和铅,或其合
金;多层结构材料,例如lif/al或lio2/al;等等,但不限于此。
[0543]
发光层可以包含主体材料和掺杂剂材料。主体材料包括稠合芳族环衍生物、含杂环的化合物等。具体地,稠合芳族环衍生物包括蒽衍生物、芘衍生物、萘衍生物、并五苯衍生物、菲化合物、荧蒽化合物等,含杂环的化合物包括二苯并呋喃衍生物、梯子型呋喃化合物、嘧啶衍生物等,然而,材料不限于此。
[0544]
除了由化学式1表示的化合物之外,掺杂剂材料包括芳族胺衍生物、苯乙烯基胺化合物、硼配合物、荧蒽化合物、金属配合物等。具体地,芳族胺衍生物为具有经取代或未经取代的芳基胺基的稠合芳族环衍生物,并且包括含有芳基胺基的芘、蒽、二茚并芘(peryflanthene)等。此外,苯乙烯基胺化合物是其中经取代或未经取代的芳基胺经至少一个芳基乙烯基取代的化合物,并且选自芳基、甲硅烷基、烷基、环烷基和芳基胺基中的一个、两个或更多个取代基经取代或未经取代。具体地,包括苯乙烯基胺、苯乙烯基二胺、苯乙烯基三胺、苯乙烯基四胺等,然而,苯乙烯基胺化合物不限于此。此外,金属配合物包括铱配合物、铂配合物等,但不限于此。
[0545]
在本说明书中,当由化学式1表示的化合物包含在除了发光层之外的有机材料层中,或者提供另外的发光层时,作为能够通过接收分别来自空穴传输层和电子传输层的空穴和电子并使空穴和电子结合而发射在可见光区域中的光的材料,发光层的发光材料优选为对荧光或磷光具有良好的量子效率的材料。其具体实例包括8
‑
羟基
‑
喹啉铝配合物(alq3);基于咔唑的化合物;二聚苯乙烯基化合物;balq;10
‑
羟基苯并喹啉
‑
金属化合物;基于苯并唑、基于苯并噻唑和基于苯并咪唑的化合物;基于聚(对亚苯基亚乙烯基)(ppv)的聚合物;螺环化合物;聚芴;红荧烯等,但不限于此。
[0546]
空穴注入层是注入来自电极的空穴的层。空穴注入材料通过具有传输空穴的能力而优选地在第一电极中具有空穴注入效应并且对发光层或发光材料具有优异的空穴注入效应。此外,空穴注入材料优选地为具有防止发光层中产生的激子移动至电子注入层或电子注入材料的优异能力的材料。此外,优选具有优异的薄膜形成能力的材料。此外,空穴注入材料的最高占据分子轨道(homo)优选地在第一电极材料的功函数与周围有机材料层的homo之间。空穴注入材料的具体实例包括金属卟啉;低聚噻吩;基于芳基胺的有机材料;基于咔唑的有机材料;基于腈的有机材料;基于六腈六氮杂苯并菲的有机材料;基于喹吖啶酮的有机材料;基于苝的有机材料;基于聚噻吩的导电聚合物例如蒽醌或聚苯胺,所述实例的两者或更多者的混合物等,但不限于此。
[0547]
空穴传输层是接收来自空穴注入层的空穴并将空穴传输至发光层的层。作为空穴传输材料,优选具有高空穴迁移率的材料作为能够接收来自第一电极或空穴注入层的空穴并使空穴移动至发光层的材料。其具体实例包括基于芳基胺的有机材料、基于咔唑的有机材料、导电聚合物、同时具有共轭部分和非共轭部分的嵌段共聚物等,但不限于此。
[0548]
电子传输层是接收来自电子注入层的电子并将电子传输至发光层的层。作为电子传输材料,优选能够良好地接收来自第二电极的电子,使电子移动至发光层,并且具有高电子迁移率的材料。其具体实例包括8
‑
羟基喹啉的al配合物;包含alq3的配合物;有机自由基化合物;羟基黄酮
‑
金属配合物;三嗪衍生物;liq等,但不限于此。电子传输层可以与如本领域中所使用的任何期望的第一电极材料一起使用。特别地,合适的第一电极材料为具有低
功函数且后接有铝层或银层的常见材料。具体地,包括铯、钡、钙、镱、钐等,并且在每种情况下,都后接铝层或银层。
[0549]
电子注入层是注入来自电极的电子的层。作为电子注入材料,优选具有优异的电子传输能力、具有来自第二电极的电子注入效应以及对发光层或发光材料具有优异的电子注入效应的材料。此外,优选防止发光层中产生的激子移动至空穴注入层并且具有优异的薄膜形成能力的材料。其具体实例包括芴酮、蒽醌二甲烷、联苯醌、噻喃二氧化物、唑、二唑、三唑、三嗪、咪唑、苝四羧酸、亚芴基甲烷、蒽酮等,和其衍生物,金属配合物化合物,含氮5元环衍生物等,所述实例的两者或更多者的混合物等,但不限于此。
[0550]
金属配合物化合物包括8
‑
羟基喹啉锂、双(8
‑
羟基喹啉)锌、双(8
‑
羟基喹啉)铜、双(8
‑
羟基喹啉)锰、三(8
‑
羟基喹啉)铝、三(2
‑
甲基
‑8‑
羟基喹啉)铝、三(8
‑
羟基喹啉)镓、双(10
‑
羟基苯并[h]喹啉)铍、双(10
‑
羟基苯并[h]喹啉)锌、双(2
‑
甲基
‑8‑
喹啉)氯镓、双(2
‑
甲基
‑8‑
喹啉)(邻甲苯酚)镓、双(2
‑
甲基
‑8‑
喹啉)(1
‑
萘酚)铝、双(2
‑
甲基
‑8‑
喹啉)(2
‑
萘酚)镓等,但不限于此。
[0551]
电子阻挡层是能够通过防止从电子注入层注入的电子穿过发光层并且进入空穴注入层来提高器件的寿命和效率的层。可以没有限制地使用已知的材料,并且电子阻挡层可以形成在发光层与空穴注入层之间、或者发光层与同时进行空穴注入和空穴传输的层之间。
[0552]
空穴阻挡层是阻挡空穴穿过发光层并且到达阴极的层,并且通常可以在与电子注入层相同的条件下形成。其具体实例可以包括二唑衍生物、三唑衍生物、菲咯啉衍生物、铝配合物、吡啶、嘧啶或三嗪衍生物等,但不限于此。
[0553]
根据所使用的材料,根据本说明书的有机发光器件可以为顶部发射型、底部反射型或双发射型。
[0554]
在本说明书的一个实施方案中,除了有机发光器件之外,由化学式1表示的化合物还可以包含在有机太阳能电池或有机晶体管中。
[0555]
根据本说明书的化合物还可以用于在所述有机发光器件中使用的类似原理下的有机发光器件(包括有机磷光器件、有机太阳能电池、有机光导体、有机晶体管等)中。例如,有机太阳能电池可以具有包括阴极、阳极和设置在阴极与阳极之间的光活性层的结构,并且光活性层可以包含所述化合物。
[0556]
发明实施方式
[0557]
本说明书的有机发光器件可以使用常见的有机发光器件制造方法和材料来制造,不同之处在于使用上述化合物形成有机材料层的一个或更多个层。
[0558]
在下文中,将参照实施例、比较例等详细地描述本说明书。然而,根据本说明书的实施例和比较例可以被修改成各种其他形式,并且本说明书的范围不应被解释为限于以下描述的实施例和比较例。提供本说明书的实施例和比较例以向本领域普通技术人员更完整地描述本说明书。
[0559]
[合成例]
[0560]
合成例1:化合物1的合成
[0561]
步骤1)化合物1
‑
a的合成
[0562][0563]
在三颈烧瓶中,将1
‑
溴
‑3‑
氯
‑5‑
甲基苯(146mmol,30g)和双(4
‑
(叔丁基)苯基)胺(146mmol,41.1g)溶解在甲苯(0.2m,730ml)中之后,向其中引入叔丁醇钠(219mmol,21g)和双(三叔丁基膦)钯(0)(1.46mmol,0.75g),并将所得物在氩气气氛下在回流下搅拌1小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物1
‑
a(49g,产率83%,ms[m+h]+=405)。
[0564]
步骤2)化合物1
‑
b的合成
[0565][0566]
在三颈烧瓶中,将3
‑
溴苯并呋喃(101.5mmol,20g)和苯胺(101.5mmol,9.45g)溶解在甲苯(0.2m,508ml)中之后,向其中引入叔丁醇钠(152mmol,14.6g)和双(三叔丁基膦)钯(0)(1.0mmol,0.51g),并将所得物在氩气气氛下在回流下搅拌3小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物1
‑
b(14.8g,产率70%,ms[m+h]+=209)。
[0567]
步骤3)化合物1
‑
c的合成
[0568][0569]
在三颈烧瓶中,将化合物1
‑
a(49.3mmol,20g)和化合物1
‑
b(49.3mmol,13.7g)溶解在甲苯(0.2m,246ml)中之后,向其中引入叔丁醇钠(73.4mmol,7.1g)和双(三叔丁基膦)钯(0)(0.49mmol,0.25g),并将所得物在氩气气氛下在回流下搅拌4小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物1
‑
c(18.4g,产率65%,ms[m+h]+=579)。
[0570]
步骤4)化合物1的合成
[0571][0572]
在三颈烧瓶中,将化合物1
‑
c(31.8mmol,18.4g)溶解在1,2
‑
二氯苯(0.1m,320ml)中之后,向其中引入三碘化硼(50.9mmol,19.9g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(286mmol,37g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物1(3.1g,产率17%,ms[m+h]+=587)。
[0573]
合成例2:化合物2的合成
[0574]
步骤1)化合物2
‑
a的合成
[0575][0576]
在三颈烧瓶中,将1
‑
金刚烷胺(132.2mmol,20g)和6
‑
叔丁基
‑3‑
溴苯并呋喃(132.2mmol,33.5g)溶解在甲苯(0.2m,661ml)中之后,向其中引入叔丁醇钠(198mmol,19g)和双(三叔丁基膦)钯(0)(1.32mmol,0.68g),并将所得物在氩气气氛下在回流下搅拌6小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物2
‑
a(31.2g,产率73%,ms[m+h]+=323)。
[0577]
步骤2)化合物2
‑
b的合成
[0578][0579]
在三颈烧瓶中,将化合物1
‑
a(61.6mmol,25g)和化合物2
‑
a(61.6mmol,19.9g)溶解在甲苯(0.2m,307ml)中之后,向其中引入叔丁醇钠(92.4mmol,8.9g)和双(三叔丁基膦)钯(0)(0.62mmol,0.31g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物2
‑
b(24.4g,产率57%,ms[m+h]+=693)。
[0580]
步骤3)化合物2的合成
[0581][0582]
在三颈烧瓶中,将化合物2
‑
b(30.8mmol,22.4g)溶解在1,2
‑
二氯苯(0.1m,308ml)中之后,向其中引入三碘化硼(49.3mmol,19.3g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(277mmol,36g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物2(3.4g,产率16%,ms[m+h]+=701)。
[0583]
合成例3:化合物3的合成
[0584]
步骤1)化合物3
‑
a的合成
[0585][0586]
在三颈烧瓶中,将4
‑
叔丁基
‑2‑
(1
‑
萘基)
‑
苯胺(56.5mmol,15.5g)和5
‑
叔丁基
‑3‑
溴苯并呋喃(56.5mmol,14.3g)溶解在甲苯(0.2m,282ml)中之后,向其中引入叔丁醇钠(85mmol,8.2g)和双(三叔丁基膦)钯(0)(0.56mmol,0.29g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,然后使用硅胶柱色谱法将样品纯化以获得化合物3
‑
a(21.7g,产率86%,ms[m+h]+=448)。
[0587]
步骤2)化合物3
‑
b的合成
[0588][0589]
在三颈烧瓶中,将化合物1
‑
a(46.8mmol,19g)和化合物3
‑
a(46.8mmol,20.9g)溶解在甲苯(0.2m,234ml)中之后,向其中引入叔丁醇钠(70.2mmol,6.7g)和双(三叔丁基膦)钯(0)(0.47mmol,0.24g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取
物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物3
‑
b(24.7g,产率65%,ms[m+h]+=817)。
[0590]
步骤3)化合物3的合成
[0591][0592]
在三颈烧瓶中,将化合物3
‑
b(30.2mmol,24.7g)溶解在1,2
‑
二氯苯(0.1m,303ml)中之后,向其中引入三碘化硼(48.4mmol,19g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(272mmol,35g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物3(3.9g,产率16%,ms[m+h]+=825)。
[0593]
合成例4:化合物4的合成
[0594]
步骤1)化合物4
‑
a的合成
[0595][0596]
在三颈烧瓶中,将1,3
‑
二溴
‑5‑
氯苯(111mmol,30g)和双(4
‑
叔丁基苯基)胺(111mmol,31.2g)溶解在甲苯(0.2m,555ml)中之后,向其中引入叔丁醇钠(166.5mmol,16g)和双(三叔丁基膦)钯(0)(1.1mmol,0.58g),并将所得物在氩气气氛下在回流下搅拌1小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物4
‑
a(30.6g,产率59%,ms[m+h]+=471)。
[0597]
步骤2)化合物4
‑
b的合成
[0598][0599]
在三颈烧瓶中,将3,5,5,8,8
‑
五甲基
‑
,6,7,8
‑
四氢萘
‑2‑
胺(79.1mmol,21.7g)和5
‑
叔丁基
‑3‑
溴苯并呋喃(79.1mmol,20g)溶解在甲苯(0.2m,395ml)中之后,向其中引入叔丁醇钠(118.6mmol,11.4g)和双(三叔丁基膦)钯(0)(0.79mmol,0.40g),并将所得物在氩气气氛下在回流下搅拌6小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将
反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物4
‑
b(25.3g,产率82%,ms[m+h]+=390)。
[0600]
步骤3)化合物4
‑
c的合成
[0601][0602]
在三颈烧瓶中,将化合物4
‑
a(63.7mmol,39g)和化合物4
‑
b(63.7mmol,24.8g)溶解在甲苯(0.2m,319ml)中之后,向其中引入叔丁醇钠(95.6mmol,9.2g)和双(三叔丁基膦)钯(0)(0.64mmol,0.33g),并将所得物在氩气气氛下在回流下搅拌3小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物4
‑
c(27.7g,产率56%,ms[m+h]+=780)。
[0603]
步骤4)化合物4
‑
d的合成
[0604][0605]
在三颈烧瓶中,将化合物4
‑
c(35.5mmol,27.7g)溶解在1,2
‑
二氯苯(0.1m,355ml)中之后,向其中引入三碘化硼(56.9mmol,22.3g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(320mmol,41g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物4
‑
d(6.2g,产率22%,ms[m+h]+=787)。
[0606]
步骤5)化合物4的合成
[0607][0608]
在三颈烧瓶中,将化合物4
‑
d(7.9mmol,6.2g)和9,9
‑
二甲基
‑
9,10
‑
二氢吖啶(9.4mmol,2g)溶解在甲苯(0.2m,47ml)中之后,向其中引入叔丁醇钠(11.8mmol,1.1g)和双(三叔丁基膦)钯(0)(0.08mmol,0.04g),并将所得物在氩气气氛下在回流下搅拌18小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化
以获得化合物4(24.7g,产率77%,ms[m+h]+=960)。
[0609]
合成例5:化合物5的合成
[0610]
步骤1)化合物5
‑
a的合成
[0611][0612]
在三颈烧瓶中,将1
‑
溴
‑3‑
氯
‑5‑
叔丁基苯(121mmol,30g)和4
‑
叔丁基
‑
n
‑
(4
‑
叔丁基苯基)
‑
2,6
‑
二甲基苯胺(121mmol,37.5g)溶解在甲苯(0.2m,605ml)中之后,向其中引入叔丁醇钠(182mmol,17.5g)和双(三叔丁基膦)钯(0)(1.2mmol,0.62g),并将所得物在氩气气氛下在回流下搅拌4小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物5
‑
a(51.2g,产率89%,ms[m+h]+=476)。
[0613]
步骤2)化合物5
‑
b的合成
[0614][0615]
在三颈烧瓶中,将3
‑
溴
‑
5,5,8,8
‑
四甲基
‑
5,6,7,8
‑
四氢萘并[2,3
‑
b]呋喃(97.6mmol,30g)和4
‑
叔丁基苯胺(97.6mmol,14.6g)溶解在甲苯(0.2m,488ml)中之后,向其中引入叔丁醇钠(146.5mmol,14.1g)和双(三叔丁基膦)钯(0)(0.98mmol,0.5g),并将所得物在氩气气氛下在回流下搅拌6小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物5
‑
b(35.4g,产率97%,ms[m+h]+=376)。
[0616]
步骤3)化合物5
‑
c的合成
[0617][0618]
在三颈烧瓶中,将化合物5
‑
a(44.1mmol,21g)和化合物5
‑
b(44.1mmol,16.6g)溶解在甲苯(0.2m,220ml)中之后,向其中引入叔丁醇钠(66.2mmol,6.4g)和双(三叔丁基膦)钯(0)(0.44mmol,0.23g),并将所得物在氩气气氛下在回流下搅拌6小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物
用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物5
‑
c(21.8g,产率61%,ms[m+h]+=815)。
[0619]
步骤4)化合物5的合成
[0620][0621]
在三颈烧瓶中,将化合物5
‑
c(26.7mmol,21.8g)溶解在1,2
‑
二氯苯(0.1m,267ml)中之后,向其中引入三碘化硼(42.8mmol,16.8g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(241mmol,31g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物5(3.4g,产率15%,ms[m+h]+=823)。
[0622]
合成例6:化合物6的合成
[0623]
步骤1)化合物6
‑
a的合成
[0624][0625]
在三颈烧瓶中,将1,4,6
‑
三甲基苯胺(74.0mmol,10g)和3
‑
溴
‑
5,8
‑
二甲基
‑
5,6,7,8
‑
四氢
‑
5,8
‑
桥亚乙基萘并[2,3
‑
b]呋喃(74.0mmol,22.6g)溶解在甲苯(0.2m,370ml)中之后,向其中引入叔丁醇钠(111mmol,10.7g)和双(三叔丁基膦)钯(0)(0.740mmol,0.378g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物6
‑
a(21.9g,产率82%,ms[m+h]+=360)。
[0626]
步骤2)化合物6
‑
b的合成
[0627][0628]
在三颈烧瓶中,将化合物1
‑
a(36.9mmol,15.0g)和化合物2
‑
a(36.9mmol,13.3g)溶解在甲苯(0.2m,185ml)中之后,向其中引入叔丁醇钠(55.4mmol,5.33g)和双(三叔丁基膦)钯(0)(0.369mmol,0.189g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将
萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物6
‑
b(21.5g,产率80%,ms[m+h]+=729)。
[0629]
步骤3)化合物6的合成
[0630][0631]
在三颈烧瓶中,将化合物6
‑
b(29.5mmol,21.5g)溶解在1,2
‑
二氯苯(0.1m,295ml)中之后,向其中引入三碘化硼(47.2mmol,18.5g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(265mmol,34.3g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物6(4.2g,产率19%,ms[m+h]+=737)。
[0632]
合成例7:化合物7的合成
[0633]
步骤1)化合物7
‑
a的合成
[0634][0635]
在三颈烧瓶中,将4
‑
叔丁基苯胺(33.5mmol,5g)和9
‑
(3
‑
溴苯并呋喃
‑6‑
基)
‑
4a,9a
‑
二甲基
‑
2,3,4,4a,9,9a
‑
六氢
‑
1h
‑
咔唑(33.5mmol,13.3g)溶解在甲苯(0.2m,168ml)中之后,向其中引入叔丁醇钠(50.3mmol,4.83g)和双(三叔丁基膦)钯(0)(0.335mmol,0.171g),并将所得物在氩气气氛下在回流下搅拌3小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物7
‑
a(13.2g,产率85%,ms[m+h]+=465)。
[0636]
步骤2)化合物7
‑
b的合成
[0637][0638]
在三颈烧瓶中,将化合物1
‑
a(25.9mmol,10.5g)和化合物7
‑
a(25.9mmol,12.0g)溶解在甲苯(0.2m,129ml)中之后,向其中引入叔丁醇钠(38.8mmol,3.73g)和双(三叔丁基膦)
钯(0)(0.259mmol,0.132g),并将所得物在氩气气氛下在回流下搅拌6小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物7
‑
b(19.4g,产率90%,ms[m+h]+=834)。
[0639]
步骤3)化合物7的合成
[0640][0641]
在三颈烧瓶中,将化合物7
‑
b(23.3mmol,19.4g)溶解在1,2
‑
二氯苯(0.1m,233ml)中之后,向其中引入三碘化硼(37.2mmol,14.6g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(209mmol,27.1g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物7(3.7g,产率19%,ms[m+h]+=842)。
[0642]
合成例8:化合物8的合成
[0643]
步骤1)化合物8
‑
a的合成
[0644][0645]
在三颈烧瓶中,将双(4
‑
叔丁基苯基)胺(46.2mmol,13g)和3
‑
溴
‑4′‑
叔丁基
‑5‑
氯
‑
1,1
′‑
联苯(46.2mmol,15g)溶解在甲苯(0.2m,231ml)中之后,向其中引入叔丁醇钠(69.3mmol,6.66g)和双(三叔丁基膦)钯(0)(0.462mmol,0.236g),并将所得物在氩气气氛下在回流下搅拌2小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物8
‑
a(19.4g,产率80%,ms[m+h]+=524)。
[0646]
步骤2)化合物8
‑
b的合成
[0647][0648]
在三颈烧瓶中,将2
‑
溴
‑
5,5,8,8
‑
四甲基
‑
5,6,7,8
‑
四氢萘并[2,3
‑
b]呋喃(78.1mmol,24g)和4
‑
叔丁基苯胺(78.1mmol,11.7g)溶解在甲苯(0.2m,390ml)中之后,向其中引入叔丁醇钠(117.2mmol,11.3g)和双(三叔丁基膦)钯(0)(0.781mmol,0.4g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物8
‑
b(20.6g,产率70%,ms[m+h]+=376)。
[0649]
步骤3)化合物8
‑
c的合成
[0650][0651]
在三颈烧瓶中,将化合物8
‑
a(37.0mmol,19.4g)和化合物8
‑
b(37.0mmol,13.9g)溶解在甲苯(0.2m,185ml)中之后,向其中引入叔丁醇钠(55.5mmol,5.33g)和双(三叔丁基膦)钯(0)(0.37mmol,0.189g),并将所得物在氩气气氛下在回流下搅拌18小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物8
‑
c(22.0g,产率69%,ms[m+h]+=863)。
[0652]
步骤4)化合物8的合成
[0653][0654]
在三颈烧瓶中,将化合物8
‑
c(25.5mmol,22.0g)溶解在1,2
‑
二氯苯(0.1m,255ml)中之后,向其中引入三碘化硼(40.8mmol,16.0g),并将所得物在氩气气氛下在140℃下搅拌
3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(229mmol,30g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物8(2.9g,产率13%,ms[m+h]+=871)。
[0655]
合成例9:化合物9的合成
[0656]
步骤1)化合物9
‑
a的合成
[0657][0658]
在三颈烧瓶中,将5
‑
叔丁基
‑
n
‑
(3
‑
(2
‑
苯基丙烷
‑2‑
基)苯基)
‑
[1,1
′‑
联苯]
‑2‑
胺(71.5mmol,30g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(71.5mmol,14.7g)溶解在甲苯(0.2m,357ml)中之后,向其中引入叔丁醇钠(107mmol,10.3g)和双(三叔丁基膦)钯(0)(0.715mmol,0.365g),并将所得物在氩气气氛下在回流下搅拌6小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物9
‑
a(34.6g,产率89%,ms[m+h]+=544)。
[0659]
步骤2)化合物9
‑
b的合成
[0660][0661]
在三颈烧瓶中,将2
‑
溴
‑
4,4
‑
二甲基
‑
4h
‑
茚并[2,3
‑
b]呋喃(144mmol,38g)和4
‑
叔丁基苯胺(144mmol,21.6g)溶解在甲苯(0.2m,722ml)中之后,向其中引入叔丁醇钠(217mmol,20.8g)和双(三叔丁基膦)钯(0)(1.44mmol,0.738g),并将所得物在氩气气氛下在回流下搅拌18小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物9
‑
b(35.8g,产率75%,ms[m+h]+=376)。
[0662]
步骤3)化合物9
‑
c的合成
[0663][0664]
在三颈烧瓶中,将化合物9
‑
a(51.3mmol,27.9g)和化合物9
‑
b(51.3mmol,17g)溶解
在甲苯(0.2m,256ml)中之后,向其中引入叔丁醇钠(76.9mmol,7.39g)和双(三叔丁基膦)钯(0)(0.513mmol,0.262g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物9
‑
c(27.3g,产率63%,ms[m+h]+=839)。
[0665]
步骤4)化合物9的合成
[0666][0667]
在三颈烧瓶中,将化合物9
‑
c(32.5mmol,27.3g)溶解在1,2
‑
二氯苯(0.1m,325ml)中之后,向其中引入三碘化硼(52.1mmol,20.4g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(293mmol,37.8g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物9(4.2g,产率15%,ms[m+h]+=847)。
[0668]
合成例10:化合物10的合成
[0669]
步骤1)化合物10
‑
a的合成
[0670][0671]
在三颈烧瓶中,将5
‑
三甲基甲硅烷基
‑
n
‑
(4
‑
三甲基甲硅烷基苯基)
‑
[1,1
′‑
联苯]
‑2‑
胺(51.3mmol,20g)和1
‑
溴
‑3‑
氯
‑5‑
叔丁基苯(51.3mmol,12.7g)溶解在甲苯(0.2m,257ml)中之后,向其中引入叔丁醇钠(77.0mmol,7.40g)和双(三叔丁基膦)钯(0)(0.513mmol,0.262g),并将所得物在氩气气氛下在回流下搅拌4小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物10
‑
a(26.7g,产率94%,ms[m+h]+=556)。
[0672]
步骤2)化合物10
‑
b的合成
[0673][0674]
在三颈烧瓶中,将3
‑
溴
‑
8,8
‑
二甲基
‑
8h
‑
茚并[2,1
‑
b]呋喃(76.0mmol,20g)和4
‑
叔丁基苯胺(76.0mmol,11.3g)溶解在甲苯(0.2m,380ml)中之后,向其中引入叔丁醇钠(114mmol,11.0g)和双(三叔丁基膦)钯(0)(0.760mmol,0.388g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物10
‑
b(17.3g,产率69%,ms[m+h]+=331)。
[0675]
步骤3)化合物10
‑
c的合成
[0676][0677]
在三颈烧瓶中,将化合物10
‑
a(41.3mmol,23g)和化合物10
‑
b(41.3mmol,13.7g)溶解在甲苯(0.2m,207ml)中之后,向其中引入叔丁醇钠(62.0mmol,6.00g)和双(三叔丁基膦)钯(0)(0.413mmol,0.211g),并将所得物在氩气气氛下在回流下搅拌18小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物10
‑
c(23.7g,产率67%,ms[m+h]+=839)。
[0678]
步骤4)化合物10的合成
[0679][0680]
在三颈烧瓶中,将化合物10
‑
c(27.8mmol,23.7g)溶解在1,2
‑
二氯苯(0.1m,280ml)中之后,向其中引入三碘化硼(44.5mmol,17.4g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(251mmol,32.4g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物10(3.5g,产率15%,ms[m+h]+=859)。
[0681]
合成例11:化合物11的合成
[0682]
步骤1)化合物11
‑
a的合成
[0683][0684]
在三颈烧瓶中,将n1,n1‑
双(苯基
‑
d5)
‑
n3‑
(4
‑
三甲基甲硅烷基苯基)苯
‑
1,3
‑
二胺(47.8mmol,20g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(47.8mmol,9.82g)溶解在甲苯(0.2m,240ml)中之后,向其中引入叔丁醇钠(71.7mmol,6.89g)和双(三叔丁基膦)钯(0)(0.478mmol,0.244g),并将所得物在氩气气氛下在回流下搅拌2小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物11
‑
a(24.5g,产率94%,ms[m+h]+=543)。
[0685]
步骤2)化合物11
‑
b的合成
[0686][0687]
在三颈烧瓶中,将3
‑
溴
‑
4,4,7,7
‑
四甲基
‑
4,5,6,7
‑
四氢呋喃(38.9mmol,10g)和4
‑
叔丁基苯胺(38.9mmol,5.80g)溶解在甲苯(0.2m,195ml)中之后,向其中引入叔丁醇钠(58.3mmol,5.60g)和双(三叔丁基膦)钯(0)(0.389mmol,0.200g),并将所得物在氩气气氛下在回流下搅拌4小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物11
‑
b(11.2g,产率88%,ms[m+h]+=331)。
[0688]
步骤3)化合物11
‑
c的合成
[0689][0690]
在三颈烧瓶中,将化合物11
‑
a(33.1mmol,18g)和化合物11
‑
b(33.1mmol,10.8g)溶解在甲苯(0.2m,165ml)中之后,向其中引入叔丁醇钠(49.7mmol,4.78g)和双(三叔丁基膦)钯(0)(0.331mmol,0.169g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将
萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物11
‑
c(21.2g,产率77%,ms[m+h]+=832)。
[0691]
步骤4)化合物11的合成
[0692][0693]
在三颈烧瓶中,将化合物11
‑
c(25.5mmol,21.2g)溶解在1,2
‑
二氯苯(0.1m,255ml)中之后,向其中引入三碘化硼(40.8mmol,16.0g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(229mmol,29.6g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物11(2.9g,产率14%,ms[m+h]+=859)。
[0694]
合成例12:化合物12的合成
[0695]
步骤1)化合物12
‑
a的合成
[0696][0697]
在三颈烧瓶中,将5
‑
叔丁基
‑
n
‑
(3
‑
叔丁基苯基)
‑
[1,1
′‑
联苯]
‑2‑
胺(55.9mmol,20g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(55.9mmol,11.5g)溶解在甲苯(0.2m,280ml)中之后,向其中引入叔丁醇钠(83.9mmol,8.06g)和双(三叔丁基膦)钯(0)(0.559mmol,0.286g),并将所得物在氩气气氛下在回流下搅拌5小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物12
‑
a(23.8g,产率88%,ms[m+h]+=482)。
[0698]
步骤2)化合物12
‑
b的合成
[0699][0700]
在三颈烧瓶中,将4
‑
溴
‑2‑
(4
‑
叔丁基苯基)呋喃(53.7mmol,15g)和4
‑
三甲基甲硅烷基苯胺(53.7mmol,8.88g)溶解在甲苯(0.2m,270ml)中之后,向其中引入叔丁醇钠(80.6mmol,7.75g)和双(三叔丁基膦)钯(0)(0.537mmol,0.275g),并将所得物在氩气气氛下在回流下搅拌10小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品
纯化以获得化合物12
‑
b(17.4g,产率89%,ms[m+h]+=331)。
[0701]
步骤3)化合物12
‑
c的合成
[0702][0703]
在三颈烧瓶中,将化合物12
‑
a(41.5mmol,20g)和化合物12
‑
b(41.5mmol,19.1g)溶解在甲苯(0.2m,305ml)中之后,向其中引入叔丁醇钠(62.2mmol,6.00g)和双(三叔丁基膦)钯(0)(0.415mmol,0.212g),并将所得物在氩气气氛下在回流下搅拌18小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,然后使用硅胶柱色谱法将样品纯化以获得化合物12
‑
c(24.7g,产率74%,ms[m+h]+=832)。
[0704]
步骤4)化合物12的合成
[0705][0706]
在三颈烧瓶中,将化合物12
‑
c(30.5mmol,24.7g)溶解在1,2
‑
二氯苯(0.1m,305ml)中之后,向其中引入三碘化硼(48.8mmol,19.1g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(275mmol,35.5g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物12(4.3g,产率17%,ms[m+h]+=817)。
[0707]
合成例13:化合物13的合成
[0708]
步骤1)化合物13
‑
a的合成
[0709]
[0710]
在三颈烧瓶中,将n
‑
(4
‑
叔丁基苯基)
‑5′‑
甲基
‑
[1,1
′
,3
′
,1
″‑
三联苯]
‑2′‑
胺(76.6mmol,30g)和1
‑
溴
‑3‑
氯
‑5‑
叔丁基苯(76.6mmol,19.0g)溶解在甲苯(0.2m,380ml)中之后,向其中引入叔丁醇钠(115mmol,11.0g)和双(三叔丁基膦)钯(0)(0.766mmol,0.392g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物13
‑
a(26.4g,产率62%,ms[m+h]+=558)。
[0711]
步骤2)化合物13
‑
b的合成
[0712][0713]
在三颈烧瓶中,将3
‑
溴
‑
5,5
‑
二甲基
‑
5,6
‑
二氢
‑
4h
‑
环戊[b]呋喃(93.0mmol,20g)和苯胺
‑
d5(93.0mmol,9.13g)溶解在甲苯(0.2m,465ml)中之后,向其中引入叔丁醇钠(139mmol,13.4g)和双(三叔丁基膦)钯(0)(0.93mmol,0.475g),并将所得物在氩气气氛下在回流下搅拌3小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物13
‑
b(19.3g,产率89%,ms[m+h]+=232)。
[0714]
步骤3)化合物13
‑
c的合成
[0715][0716]
在三颈烧瓶中,将化合物13
‑
a(44.8mmol,25g)和化合物13
‑
b(44.8mmol,10.4g)溶解在甲苯(0.2m,225ml)中之后,向其中引入叔丁醇钠(67.2mmol,6.46g)和双(三叔丁基膦)钯(0)(0.448mmol,0.229g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物13
‑
c(24.3g,产率72%,ms[m+h]+=754)。
[0717]
步骤4)化合物13的合成
[0718][0719]
在三颈烧瓶中,将化合物13
‑
c(32.2mmol,24.3g)溶解在1,2
‑
二氯苯(0.1m,322ml)中之后,向其中引入三碘化硼(51.6mmol,20.2g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(290mmol,37.5g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物13(4.5g,产率18%,ms[m+h]+=762)。
[0720]
合成例14:化合物14的合成
[0721]
步骤1)化合物14
‑
a的合成
[0722][0723]
在三颈烧瓶中,将4
‑
叔丁基
‑
n
‑
(4
‑
叔丁基苯基)
‑2‑
(1,5,5,8,8
‑
五甲基
‑
5,6,7,8
‑
四氢萘
‑2‑
基)苯胺(31.1mmol,15g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(31.1mmol,6.40g)溶解在甲苯(0.2m,155ml)中之后,向其中引入叔丁醇钠(46.7mmol,4.49g)和双(三叔丁基膦)钯(0)(0.311mmol,0.159g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物14
‑
a(16.4g,产率87%,ms[m+h]+=606)。
[0724]
步骤2)化合物14
‑
b的合成
[0725][0726]
在三颈烧瓶中,将3
‑
溴
‑
4,4
‑
二甲基
‑7‑
三氟甲基
‑
4h
‑
茚并[1,2
‑
b]呋喃
(75.5mmol,25g)和4
‑
叔丁基苯胺(75.5mmol,11.3g)溶解在甲苯(0.2m,380ml)中之后,向其中引入叔丁醇钠(113mmol,10.9g)和双(三叔丁基膦)钯(0)(0.755mmol,0.386g),并将所得物在氩气气氛下在回流下搅拌3小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物14
‑
b(26.9g,产率89%,ms[m+h]+=399)。
[0727]
步骤3)化合物14
‑
c的合成
[0728][0729]
在三颈烧瓶中,将化合物14
‑
a(26.4mmol,16g)和化合物14
‑
b(26.4mmol,10.5g)溶解在甲苯(0.2m,130ml)中之后,向其中引入叔丁醇钠(39.6mmol,3.80g)和双(三叔丁基膦)钯(0)(0.264mmol,0.135g),并将所得物在氩气气氛下在回流下搅拌18小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物14
‑
c(20.4g,产率80%,ms[m+h]+=969)。
[0730]
步骤4)化合物14的合成
[0731][0732]
在三颈烧瓶中,将化合物14
‑
c(21.0mmol,20.4g)溶解在1,2
‑
二氯苯(0.1m,210ml)中之后,向其中引入三碘化硼(33.7mmol,13.2g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(189mmol,24.5g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物14(3.2g,产率16%,ms[m+h]+=977)。
[0733]
合成例15:化合物15的合成
[0734]
步骤1)化合物15
‑
a的合成
[0735][0736]
在三颈烧瓶中,将n
‑
(4
‑
三联苯基)
‑
1,5,5,8,8
‑
五甲基
‑
5,6,7,8
‑
四氢萘
‑2‑
胺(114mmol,40g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(114mmol,23.5g)溶解在甲苯(0.2m,572ml)中之后,向其中引入叔丁醇钠(172mmol,16.5g)和双(三叔丁基膦)钯(0)(1.14mmol,0.585g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物15
‑
a(42.3g,产率78%,ms[m+h]+=474)。
[0737]
步骤2)化合物15
‑
b的合成
[0738][0739]
在三颈烧瓶中,将4
‑
溴
‑
2,2,3,3
‑
四甲基
‑
2,3
‑
二氢呋喃(73.1mmol,15g)和[1,1
′‑
联苯]
‑4‑
胺(73.1mmol,12.4g)溶解在甲苯(0.2m,370ml)中之后,向其中引入叔丁醇钠(110mmol,10.5g)和双(三叔丁基膦)钯(0)(0.731mmol,0.374g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物15
‑
b(13.6g,产率63%,ms[m+h]+=293)。
[0740]
步骤3)化合物15
‑
c的合成
[0741][0742]
在三颈烧瓶中,将化合物15
‑
a(42.2mmol,20g)和化合物15
‑
b(42.2mmol,12.4g)溶解在甲苯(0.2m,210ml)中之后,向其中引入叔丁醇钠(63.3mmol,3.80g)和双(三叔丁基膦)钯(0)(0.422mmol,0.216g),并将所得物在氩气气氛下在回流下搅拌3小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物15
‑
c(19.2g,产率
62%,ms[m+h]+=731)。
[0743]
步骤4)化合物15的合成
[0744][0745]
在三颈烧瓶中,将化合物15
‑
c(26.3mmol,19.2g)溶解在1,2
‑
二氯苯(0.1m,263ml)中之后,向其中引入三碘化硼(42.0mmol,16.5g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(236mmol,30.5g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物15(3.8g,产率20%,ms[m+h]+=739)。
[0746]
合成例16:化合物16的合成
[0747]
步骤1)化合物16
‑
a的合成
[0748][0749]
在三颈烧瓶中,将4
‑
叔丁基苯胺(134mmol,20g)和3
‑
溴
‑5‑
叔丁基苯并[b]噻吩(134mmol,36.1g)溶解在甲苯(0.2m,670ml)中之后,向其中引入叔丁醇钠(201mmol,19.3g)和双(三叔丁基膦)钯(0)(1.34mmol,0.685g),并将所得物在氩气气氛下在回流下搅拌3小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物16
‑
a(40.7g,产率90%,ms[m+h]+=338)。
[0750]
步骤2)化合物16
‑
b的合成
[0751][0752]
在三颈烧瓶中,将化合物1
‑
a(73.4mmol,30g)和化合物16
‑
a(73.4mmol,24.9g)溶解在甲苯(0.2m,370ml)中之后,向其中引入叔丁醇钠(111mmol,10.7g)和双(三叔丁基膦)钯(0)(0.734mmol,0.378g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束
时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物16
‑
b(38.7g,产率74%,ms[m+h]+=707)。
[0753]
步骤3)化合物16的合成
[0754][0755]
在三颈烧瓶中,将化合物16
‑
b(54.7mmol,38.7g)溶解在1,2
‑
二氯苯(0.1m,550ml)中之后,向其中引入三碘化硼(87.6mmol,34.3g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(493mmol,63.7g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物16(6.4g,产率16%,ms[m+h]+=715)。
[0756]
合成例17:化合物17的合成
[0757]
步骤1)化合物17
‑
a的合成
[0758][0759]
在三颈烧瓶中,将4
‑
叔丁基
‑
n
‑
(4
‑
叔丁基苯基)
‑2‑
(5,5,8,8
‑
四甲基
‑
5,6,7,8
‑
四氢萘
‑1‑
基)苯胺(42.8mmol,20g)和1
‑
溴
‑3‑
氯
‑5‑
叔丁基苯(42.8mmol,10.6g)溶解在甲苯(0.2m,215ml)中之后,向其中引入叔丁醇钠(64.1mmol,6.16g)和双(三叔丁基膦)钯(0)(0.428mmol,0.219g),并将所得物在氩气气氛下在回流下搅拌6小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物17
‑
a(22.9g,产率84%,ms[m+h]+=634)。
[0760]
步骤2)化合物17
‑
b的合成
[0761]
[0762]
在三颈烧瓶中,将3
‑
溴
‑5‑
叔丁基苯并[b]噻吩(149mmol,40g)和4
‑
叔丁基苯胺(149mmol,22.2g)溶解在甲苯(0.2m,745ml)中之后,向其中引入叔丁醇钠(223mmol,21.4g)和双(三叔丁基膦)钯(0)(1.49mmol,0.759g),并将所得物在氩气气氛下在回流下搅拌18小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物17
‑
b(45.6g,产率91%,ms[m+h]+=338)。
[0763]
步骤3)化合物17
‑
c的合成
[0764][0765]
在三颈烧瓶中,将化合物17
‑
a(26.8mmol,17g)和化合物17
‑
b(26.8mmol,9.05g)溶解在甲苯(0.2m,135ml)中之后,向其中引入叔丁醇钠(40.2mmol,3.87g)和双(三叔丁基膦)钯(0)(0.268mmol,0.137g),并将所得物在氩气气氛下在回流下搅拌18小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物17
‑
c(20.1g,产率80%,ms[m+h]+=935)。
[0766]
步骤4)化合物17的合成
[0767][0768]
在三颈烧瓶中,将化合物17
‑
c(21.5mmol,20.1g)溶解在1,2
‑
二氯苯(0.1m,215ml)中之后,向其中引入三碘化硼(34.4mmol,13.5g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(193mmol,25g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物17(3.4g,产率17%,ms[m+h]+=943)。
[0769]
合成例18:化合物18的合成
[0770]
步骤1)化合物18
‑
a的合成
[0771][0772]
在三颈烧瓶中,将5
‑
叔丁基
‑
n
‑
(4
‑
叔丁基苯基)
‑
[1,1
′‑
联苯]
‑2‑
胺(140mmol,50g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(140mmol,28.7g)溶解在甲苯(0.2m,700ml)中之后,向其中引入叔丁醇钠(210mmol,20.2g)和双(三叔丁基膦)钯(0)(1.40mmol,0.715g),并将所得物在氩气气氛下在回流下搅拌4小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物18
‑
a(57.1g,产率85%,ms[m+h]+=482)。
[0773]
步骤2)化合物18
‑
b的合成
[0774][0775]
在三颈烧瓶中,将3
‑
溴
‑5‑
三甲基甲硅烷基苯并[b]噻吩(70.1mmol,20g)和4
‑
叔丁基苯胺(70.1mmol,10.5g)溶解在甲苯(0.2m,350ml)中之后,向其中引入叔丁醇钠(105mmol,10.1g)和双(三叔丁基膦)钯(0)(0.701mmol,0.358g),并将所得物在氩气气氛下在回流下搅拌18小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物18
‑
b(19.2g,产率77%,ms[m+h]+=354)。
[0776]
步骤3)化合物18
‑
c的合成
[0777][0778]
在三颈烧瓶中,将化合物18
‑
a(51.9mmol,25g)和化合物18
‑
b(51.9mmol,18.3g)溶解在甲苯(0.2m,260ml)中之后,向其中引入叔丁醇钠(77.9mmol,7.47g)和双(三叔丁基膦)钯(0)(0.519mmol,0.265g),并将所得物在氩气气氛下在回流下搅拌18小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物18
‑
c(33.2g,产率80%,ms[m+h]+=799)。
[0779]
步骤4)化合物18的合成
[0780][0781]
在三颈烧瓶中,将化合物18
‑
c(41.5mmol,33.2g)溶解在1,2
‑
二氯苯(0.1m,415ml)中之后,向其中引入三碘化硼(66.5mmol,26.0g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(374mmol,48.3g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物18(6.1g,产率18%,ms[m+h]+=807)。
[0782]
合成例19:化合物19的合成
[0783]
步骤1)化合物19
‑
a的合成
[0784][0785]
在三颈烧瓶中,将5
‑
叔丁基
‑
[1,1
′‑
联苯]
‑2‑
胺(66.6mmol,15g)和3
‑
溴
‑
5,5,8,8
‑
四甲基
‑
5,6,7,8
‑
四氢萘并[2,3
‑
b]噻吩(66.6mmol,21.5g)溶解在甲苯(0.2m,335ml)中之后,向其中引入叔丁醇钠(99.9mmol,9.60g)和双(三叔丁基膦)钯(0)(0.666mmol,0.340g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物19
‑
a(24.2g,产率78%,ms[m+h]+=468)。
[0786]
步骤2)化合物19
‑
b的合成
[0787][0788]
在三颈烧瓶中,将化合物1
‑
a(49.3mmol,20g)和化合物19
‑
a(49.3mmol,23.0g)溶解在甲苯(0.2m,250ml)中之后,向其中引入叔丁醇钠(73.9mmol,7.10g)和双(三叔丁基膦)钯(0)(0.493mmol,0.252g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束
时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物19
‑
b(36.1g,产率88%,ms[m+h]+=837)。
[0789]
步骤3)化合物19的合成
[0790][0791]
在三颈烧瓶中,将化合物19
‑
b(43.1mmol,36.1g)溶解在1,2
‑
二氯苯(0.1m,430ml)中之后,向其中引入三碘化硼(69.0mmol,27.0g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(388mmol,50.2g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物19(7.1g,产率19%,ms[m+h]+=603)。
[0792]
合成例20:化合物20的合成
[0793]
步骤1)化合物20
‑
a的合成
[0794][0795]
在三颈烧瓶中,将4
‑
叔丁基胺(36.7mmol,5.48g)和3
‑
溴
‑
n,n
‑
二
‑
邻甲苯基苯并[b]噻吩
‑5‑
胺(36.7mmol,15g)溶解在甲苯(0.2m,185ml)中之后,向其中引入叔丁醇钠(55.1mmol,5.29g)和双(三叔丁基膦)钯(0)(0.367mmol,0.188g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物20
‑
a(15.9g,产率91%,ms[m+h]+=477)。
[0796]
步骤2)化合物20
‑
b的合成
[0797][0798]
在三颈烧瓶中,将化合物1
‑
a(29.6mmol,12g)和化合物20
‑
a(29.6mmol,14.1g)溶解在甲苯(0.2m,150ml)中之后,向其中引入叔丁醇钠(44.3mmol,4.26g)和双(三叔丁基膦)钯(0)(0.296mmol,0.151g),并将所得物在氩气气氛下在回流下搅拌18小时。当反应结束
时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物20
‑
b(19.1g,产率76%,ms[m+h]+=846)。
[0799]
步骤3)化合物20的合成
[0800][0801]
在三颈烧瓶中,将化合物20
‑
b(22.6mmol,19.1g)溶解在1,2
‑
二氯苯(0.1m,226ml)中之后,向其中引入三碘化硼(36.1mmol,14.1g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(203mmol,26.3g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物20(3.2g,产率17%,ms[m+h]+=854)。
[0802]
合成例21:化合物21的合成
[0803]
步骤1)化合物21
‑
a的合成
[0804][0805]
在三颈烧瓶中,将n,n
‑
双(2
‑
氟苯基)
‑
4a,9a
‑
二甲基
‑
2,3,4,4a,9,9a
‑
六氢
‑
1h
‑
咔唑
‑5‑
胺(34.1mmol,13.8g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(34.1mmol,7g)溶解在甲苯(0.2m,170ml)中之后,向其中引入叔丁醇钠(51.1mmol,4.91g)和双(三叔丁基膦)钯(0)(0.341mmol,0.174g),并将所得物在氩气气氛下在回流下搅拌4小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物21
‑
a(15.3g,产率85%,ms[m+h]+=15.3)。
[0806]
步骤2)化合物21
‑
b的合成
[0807][0808]
在三颈烧瓶中,将化合物21
‑
a(28.4mmol,15g)和化合物17
‑
b(28.4mmol,9.57g)溶解在甲苯(0.2m,140ml)中之后,向其中引入叔丁醇钠(42.5mmol,4.09g)和双(三叔丁基膦)钯(0)(0.284mmol,0.145g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物21
‑
b(18.4g,产率78%,ms[m+h]+=830)。
[0809]
步骤3)化合物21的合成
[0810][0811]
在三颈烧瓶中,将化合物21
‑
b(22.2mmol,18.4g)溶解在1,2
‑
二氯苯(0.1m,220ml)中之后,向其中引入三碘化硼(35.5mmol,13.9g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(199mmol,25.8g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物21(3.8g,产率20%,ms[m+h]+=838)。
[0812]
合成例22:化合物22的合成
[0813]
步骤1)化合物22
‑
a的合成
[0814][0815]
在三颈烧瓶中,将4
′‑
叔丁基
‑5‑
三甲基甲硅烷基
‑
[1,1
′‑
联苯]
‑2‑
胺(43.6mmol,13g)和3
‑
溴
‑
5,8
‑
二甲基
‑
5,6,7,8
‑
四氢
‑
5,8
‑
桥亚乙基萘并[2,3
‑
b]噻吩(43.6mmol,14g)溶解在甲苯(0.2m,220ml)中之后,向其中引入叔丁醇钠(65.4mmol,6.28g)和双(三叔丁基
膦)钯(0)(0.436mmol,0.223g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物22
‑
a(14.6g,产率62%,ms[m+h]+=538)。
[0816]
步骤2)化合物22
‑
b的合成
[0817][0818]
在三颈烧瓶中,将化合物1
‑
a(24.6mmol,10g)和化合物22
‑
a(24.6mmol,13.2g)溶解在甲苯(0.2m,125ml)中之后,向其中引入叔丁醇钠(36.9mmol,3.55g)和双(三叔丁基膦)钯(0)(0.246mmol,0.126g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物22
‑
b(16.5g,产率74%,ms[m+h]+=907)。
[0819]
步骤3)化合物22的合成
[0820][0821]
在三颈烧瓶中,将化合物22
‑
b(18.2mmol,16.5g)溶解在1,2
‑
二氯苯(0.1m,180ml)中之后,向其中引入三碘化硼(29.1mmol,11.4g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(164mmol,21.1g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物22(2.8g,产率17%,ms[m+h]+=915)。
[0822]
合成例23:化合物23的合成
[0823]
步骤1)化合物23
‑
a的合成
[0824][0825]
在三颈烧瓶中,将双
‑
(4
‑
叔丁基苯基)
‑
胺(107mmol,30g)和1
‑
溴
‑3‑
氯
‑5‑
(甲基
‑
d
‑
3)苯(107mmol,22.2g)溶解在甲苯(0.2m,535ml)中之后,向其中引入叔丁醇钠(160mmol,15.4g)和双(三叔丁基膦)钯(0)(1.07mmol,0.545g),并将所得物在氩气气氛下在回流下搅拌4小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物23
‑
a(36.2g,产率83%,ms[m+h]+=409)。
[0826]
步骤2)化合物23
‑
b的合成
[0827][0828]
在三颈烧瓶中,将7
‑
溴
‑
3,3
‑
二甲基
‑
2,3
‑
二氢噻吩并[2,3
‑
f]苯并呋喃(53.0mmol,15g)和4
‑
叔丁基苯胺(53.0mmol,7.9g)溶解在甲苯(0.2m,265ml)中之后,向其中引入叔丁醇钠(79.5mmol,7.64g)和双(三叔丁基膦)钯(0)(0.530mmol,0.271g),并将所得物在氩气气氛下在回流下搅拌18小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物23
‑
b(12.7g,产率68%,ms[m+h]+=352)。
[0829]
步骤3)化合物23
‑
c的合成
[0830][0831]
在三颈烧瓶中,将化合物23
‑
a(34.2mmol,14g)和化合物23
‑
b(34.2mmol,12g)溶解在甲苯(0.2m,170ml)中之后,向其中引入叔丁醇钠(51.3mmol,4.93g)和双(三叔丁基膦)钯(0)(0.342mmol,0.175g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物23
‑
c(20.3g,产率82%,ms[m+h]+=724)。
[0832]
步骤4)化合物23的合成
[0833][0834]
在三颈烧瓶中,将化合物23
‑
c(28.0mmol,20.3g)溶解在1,2
‑
二氯苯(0.1m,280ml)中之后,向其中引入三碘化硼(44.9mmol,17.6g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(252mmol,32.6g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物23(4.1g,产率20%,ms[m+h]+=732)。
[0835]
合成例24:化合物24的合成
[0836]
步骤1)化合物24
‑
a的合成
[0837][0838]
在三颈烧瓶中,将5
‑
叔丁基
‑
[1,1
′‑
联苯]
‑2′
,3,3
′
,4,4
′
,5
′
,6,6
′‑
d8
‑2‑
胺(40.2mmol,9.38g)和2
‑
溴
‑
5,5,8,8
‑
四甲基
‑
5,6,7,8
‑
四氢萘并[2,3
‑
b]噻吩(40.2mmol,13g)溶解在甲苯(0.2m,200ml)中之后,向其中引入叔丁醇钠(60.3mmol,5.80g)和双(三叔丁基膦)钯(0)(0.402mmol,0.206g),并将所得物在氩气气氛下在回流下搅拌4小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物24
‑
a(18.2g,产率95%,ms[m+h]+=476)。
[0839]
步骤2)化合物24
‑
b的合成
[0840][0841]
在三颈烧瓶中,将化合物1
‑
a(36.9mmol,15g)和化合物24
‑
a(36.9mmol,17.6g)溶
解在甲苯(0.2m,185ml)中之后,向其中引入叔丁醇钠(55.4mmol,5.33g)和双(三叔丁基膦)钯(0)(0.369mmol,0.189g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物24
‑
b(18.4g,产率59%,ms[m+h]+=845)。
[0842]
步骤3)化合物24的合成
[0843][0844]
在三颈烧瓶中,将化合物24
‑
b(21.8mmol,18.4g)溶解在1,2
‑
二氯苯(0.1m,220ml)中之后,向其中引入三碘化硼(34.8mmol,13.6g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(196mmol,25.3g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物24(3.2g,产率17%,ms[m+h]+=853)。
[0845]
合成例25:化合物25的合成
[0846]
步骤1)化合物25
‑
a的合成
[0847][0848]
在三颈烧瓶中,将双
‑
(4
‑
叔丁基苯基)
‑
胺(142mmol,40g)和(3r,5r,7r)
‑1‑
(3
‑
溴
‑5‑
氯苯基)金刚烷(142mmol,46.3g)溶解在甲苯(0.2m,710ml)中之后,向其中引入叔丁醇钠(213mmol,20.5g)和双(三叔丁基膦)钯(0)(1.42mmol,0.726g),并将所得物在氩气气氛下在回流下搅拌3小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物25
‑
a(63.8g,产率85%,ms[m+h]+=526)。
[0849]
步骤2)化合物25
‑
b的合成
[0850][0851]
在三颈烧瓶中,将3
‑
溴
‑
4,4,7,7
‑
四甲基
‑
4,5,6,7
‑
四氢苯并[b]噻吩(54.9mmol,15g)和3,5
‑
双(三氟甲基)苯胺(54.9mmol,12.6g)溶解在甲苯(0.2m,275ml)中之后,向其中引入叔丁醇钠(82.3mmol,7.91g)和双(三叔丁基膦)钯(0)(0.549mmol,0.281g),并将所得物在氩气气氛下在回流下搅拌18小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物25
‑
b(16.7g,产率72%,ms[m+h]+=421)。
[0852]
步骤3)化合物25
‑
c的合成
[0853][0854]
在三颈烧瓶中,将化合物25
‑
a(38.0mmol,20g)和化合物25
‑
b(38.0mmol,16g)溶解在甲苯(0.2m,190ml)中之后,向其中引入叔丁醇钠(57.0mmol,5.48g)和双(三叔丁基膦)钯(0)(0.380mmol,0.194g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物25
‑
c(22.7g,产率66%,ms[m+h]+=911)。
[0855]
步骤4)化合物25的合成
[0856][0857]
在三颈烧瓶中,将化合物25
‑
c(24.9mmol,22.7g)溶解在1,2
‑
二氯苯(0.1m,250ml)中之后,向其中引入三碘化硼(39.9mmol,15.6g),并将所得物在氩气气氛下在140℃下搅拌
3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(224mmol,29.0g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物25(3.9g,产率17%,ms[m+h]+=919)。
[0858]
合成例26:化合物26的合成
[0859]
步骤1)化合物26
‑
a的合成
[0860][0861]
在三颈烧瓶中,将双
‑
(5,5,8,8
‑
四甲基
‑
5,6,7,8
‑
四氢萘
‑2‑
基)胺(77.0mmol,30g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(77.0mmol,15.8g)溶解在甲苯(0.2m,385ml)中之后,向其中引入叔丁醇钠(115mmol,11.1g)和双(三叔丁基膦)钯(0)(0.77mmol,0.393g),并将所得物在氩气气氛下在回流下搅拌6小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物26
‑
a(36.6g,产率92%,ms[m+h]+=514)。
[0862]
步骤2)化合物26
‑
b的合成
[0863][0864]
在三颈烧瓶中,将2
‑
溴
‑7‑
叔丁基
‑
4,4
‑
二甲基
‑
4h
‑
茚并[1,2
‑
b]噻吩(35.8mmol,12g)和4
‑
叔丁基
‑2‑
甲基苯胺(35.8mmol,5.84g)溶解在甲苯(0.2m,180ml)中之后,向其中引入叔丁醇钠(53.7mmol,5.16g)和双(三叔丁基膦)钯(0)(0.358mmol,0.183g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物26
‑
b(13.4g,产率90%,ms[m+h]+=418)。
[0865]
步骤3)化合物26
‑
c的合成
[0866][0867]
在三颈烧瓶中,将化合物26
‑
a(29.2mmol,15g)和化合物26
‑
b(29.2mmol,12.2g)溶解在甲苯(0.2m,145ml)中之后,向其中引入叔丁醇钠(43.8mmol,4.21g)和双(三叔丁基膦)钯(0)(0.292mmol,0.149g),并将所得物在氩气气氛下在回流下搅拌15小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物26
‑
c(19.2g,产率74%,ms[m+h]+=895)。
[0868]
步骤4)化合物26的合成
[0869][0870]
在三颈烧瓶中,将化合物26
‑
c(21.4mmol,19.2g)溶解在1,2
‑
二氯苯(0.1m,215ml)中之后,向其中引入三碘化硼(34.3mmol,13.4g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(193mmol,24.9g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物26(4.5g,产率23%,ms[m+h]+=903)。
[0871]
合成例27:化合物27的合成
[0872]
步骤1)化合物27
‑
a的合成
[0873][0874]
在三颈烧瓶中,将4
‑
叔丁基苯胺(80.4mmol,12g)和4
‑
溴
‑2‑
叔丁基噻吩
(80.4mmol,17.6g)溶解在甲苯(0.2m,400ml)中之后,向其中引入叔丁醇钠(121mmol,11.6g)和双(三叔丁基膦)钯(0)(0.804mmol,0.411g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物27
‑
a(19.2g,产率83%,ms[m+h]+=287)。
[0875]
步骤2)化合物27
‑
b的合成
[0876][0877]
在三颈烧瓶中,将化合物4
‑
a(38.2mmol,18g)和化合物27
‑
a(38.2mmol,11g)溶解在甲苯(0.2m,190ml)中之后,向其中引入叔丁醇钠(57.3mmol,5.51g)和双(三叔丁基膦)钯(0)(0.382mmol,0.195g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物27
‑
b(21.4g,产率83%,ms[m+h]+=677)。
[0878]
步骤3)化合物27
‑
c的合成
[0879][0880]
在三颈烧瓶中,将化合物27
‑
b(31.6mmol,21.4g)溶解在1,2
‑
二氯苯(0.1m,315ml)中之后,向其中引入三碘化硼(50.5mmol,19.8g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(284mmol,36.7g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物27
‑
c(4.4g,产率20%,ms[m+h]+=685)。
[0881]
步骤4)化合物27的合成
[0882]
[0883]
在三颈烧瓶中,将化合物27
‑
c(6.42mmol,4.4g)和二苯胺(7.7mmol,1.30g)溶解在甲苯(0.2m,40ml)中之后,向其中引入叔丁醇钠(9.63mmol,0.926g)和双(三叔丁基膦)钯(0)(0.06mmol,0.033g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物27(4.1g,产率78%,ms[m+h]+=818)。
[0884]
合成例28:化合物28的合成
[0885]
步骤1)化合物28
‑
a的合成
[0886][0887]
在三颈烧瓶中,将4
‑
叔丁基
‑2‑
甲基苯胺(30.6mmol,5g)和4
‑
溴
‑
2,3
‑
二
‑
邻甲苯基噻吩(30.6mmol,10.5g)溶解在甲苯(0.2m,155ml)中之后,向其中引入叔丁醇钠(45.9mmol,4.41g)和双(三叔丁基膦)钯(0)(0.306mmol,0.157g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物28
‑
a(10.4g,产率80%,ms[m+h]+=426)。
[0888]
步骤2)化合物28
‑
b的合成
[0889][0890]
在三颈烧瓶中,将化合物4
‑
a(23.4mmol,11g)和化合物28
‑
a(23.4mmol,9.94g)溶解在甲苯(0.2m,120ml)中之后,向其中引入叔丁醇钠(35.0mmol,3.37g)和双(三叔丁基膦)钯(0)(0.234mmol,0.119g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物28
‑
b(11.8g,产率62%,ms[m+h]+=816)。
[0891]
步骤3)化合物28
‑
c的合成
[0892][0893]
在三颈烧瓶中,将化合物28
‑
b(14.5mmol,11.8g)溶解在1,2
‑
二氯苯(0.1m,145ml)中之后,向其中引入三碘化硼(23.1mmol,9.06g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(130mmol,16.8g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,通过硅胶柱色谱法将样品纯化以获得化合物28
‑
c(2.9g,产率24%,ms[m+h]+=823)。
[0894]
步骤4)化合物28的合成
[0895][0896]
在三颈烧瓶中,将化合物28
‑
c(3.52mmol,2.9g)和10h
‑
吩嗪(4.23mmol,0.774g)溶解在甲苯(0.2m,21ml)中之后,向其中引入叔丁醇钠(5.28mmol,0.508g)和双(三叔丁基膦)钯(0)(0.035mmol,0.018g),并将所得物在氩气气氛下在回流下搅拌18小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物28(2.9g,产率85%,ms[m+h]+=970)。
[0897]
合成例29:化合物29的合成
[0898]
步骤1)化合物29
‑
a的合成
[0899][0900]
在三颈烧瓶中,将5
‑
叔丁基
‑
n
‑
(4
‑
三苯基甲硅烷基苯基)
‑
[1,1
′‑
联苯]
‑2‑
胺(53.6mmol,30g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(53.6mmol,11.0g)溶解在甲苯(0.2m,270ml)中之
后,向其中引入叔丁醇钠(80.4mmol,7.72g)和双(三叔丁基膦)钯(0)(0.536mmol,0.274g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物29
‑
a(27.1g,产率74%,ms[m+h]+=684)。
[0901]
步骤2)化合物29
‑
b的合成
[0902][0903]
在三颈烧瓶中,将3
‑
溴噻吩并[2,3
‑
b]苯并呋喃(39.5mmol,10g)和4
‑
叔丁基
‑2‑
甲基苯胺(39.5mmol,6.45g)溶解在甲苯(0.2m,200ml)中之后,向其中引入叔丁醇钠(59.3mmol,5.70g)和双(三叔丁基膦)钯(0)(0.358mmol,0.183g),并将所得物在氩气气氛下在回流下搅拌15小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物29
‑
b(9.8g,产率74%,ms[m+h]+=335)。
[0904]
步骤3)化合物29
‑
c的合成
[0905][0906]
在三颈烧瓶中,将化合物29
‑
a(29.2mmol,20g)和化合物29
‑
b(29.2mmol,9.80g)溶解在甲苯(0.2m,145ml)中之后,向其中引入叔丁醇钠(43.8mmol,4.21g)和双(三叔丁基膦)钯(0)(0.292mmol,0.149g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物29
‑
c(23.1g,产率80%,ms[m+h]+=983)。
[0907]
步骤4)化合物29的合成
[0908][0909]
在三颈烧瓶中,将化合物29
‑
c(23.5mmol,23.1g)溶解在1,2
‑
二氯苯(0.1m,235ml)中之后,向其中引入三碘化硼(37.6mmol,14.7g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(211mmol,27.3g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物29(3.7g,产率16%,ms[m+h]+=991)。
[0910]
合成例30:化合物30的合成
[0911]
步骤1)化合物30
‑
a的合成
[0912][0913]
在三颈烧瓶中,将6
‑
叔丁基
‑
4a,9a
‑
二甲基
‑
2,3,4,4a,9,9a
‑
六氢
‑
1h
‑
咔唑(194mmol,50g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(194mmol,39.9g)溶解在甲苯(0.2m,970ml)中之后,向其中引入叔丁醇钠(291mmol,28.0g)和双(三叔丁基膦)钯(0)(1.94mmol,0.993g),并将所得物在氩气气氛下在回流下搅拌8小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物30
‑
a(67.2g,产率91%,ms[m+h]+=382)。
[0914]
步骤2)化合物30
‑
b的合成
[0915][0916]
在三颈烧瓶中,将3
‑
溴
‑
3a,7a
‑
二甲基
‑
3a,4,5,6,7,7a
‑
六氢[b]噻吩(56.6mmol,14g)和[1,1
′
:3
′
,1
″‑
三联苯]
‑5′‑
胺(56.6mmol,13.9g)溶解在甲苯(0.2m,280ml)中之后,向其中引入叔丁醇钠(85.0mmol,8.16g)和双(三叔丁基膦)钯(0)(0.566mmol,0.289g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物30
‑
b(17.4g,产率75%,ms[m+h]+=412)。
[0917]
步骤3)化合物30
‑
c的合成
[0918][0919]
在三颈烧瓶中,将化合物30
‑
a(39.3mmol,15g)和化合物30
‑
b(39.3mmol,16.2g)溶解在甲苯(0.2m,200ml)中之后,向其中引入叔丁醇钠(58.9mmol,5.66g)和双(三叔丁基膦)钯(0)(0.393mmol,0.2g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物30
‑
c(24.8g,产率83%,ms[m+h]+=757)。
[0920]
步骤4)化合物30的合成
[0921][0922]
在三颈烧瓶中,将化合物30
‑
c(32.8mmol,24.8g)溶解在1,2
‑
二氯苯(0.1m,330ml)
中之后,向其中引入三碘化硼(52.4mmol,20.5g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(295mmol,38.1g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物30(4.1g,产率16%,ms[m+h]+=765)。
[0923]
合成例31:化合物31的合成
[0924]
步骤1)化合物31
‑
a的合成
[0925][0926]
在三颈烧瓶中,将3
‑
溴
‑
4,4
‑
二甲基
‑
4h
‑
茚并[1,2
‑
b]噻吩(36.1mmol,10g)和4
‑
(2
‑
苯基丙
‑2‑
基)苯胺(36.1mmol,8g)溶解在甲苯(0.2m,180ml)中之后,向其中引入叔丁醇钠(54.2mmol,5.21g)和双(三叔丁基膦)钯(0)(0.361mmol,0.185g),并将所得物在氩气气氛下在回流下搅拌4小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物31
‑
a(12.5g,产率84%,ms[m+h]+=410)。
[0927]
步骤2)化合物31
‑
b的合成
[0928][0929]
在三颈烧瓶中,将化合物1
‑
a(29.6mmol,12g)和化合物31
‑
a(29.6mmol,12.1g)溶解在甲苯(0.2m,150ml)中之后,向其中引入叔丁醇钠(44.3mmol,4.26g)和双(三叔丁基膦)钯(0)(0.296mmol,0.151g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物31
‑
b(17.3g,产率75%,ms[m+h]+=779)。
[0930]
步骤3)化合物31的合成
[0931]
[0932]
在三颈烧瓶中,将化合物31
‑
b(22.2mmol,17.3g)溶解在1,2
‑
二氯苯(0.1m,220ml)中之后,向其中引入三碘化硼(35.5mmol,13.9g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(200mmol,25.8g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物31(3.8g,产率22%,ms[m+h]+=787)。
[0933]
合成例32:化合物32的合成
[0934]
步骤1)化合物32
‑
a的合成
[0935][0936]
在三颈烧瓶中,将8
‑
叔丁基
‑
10,10
‑
二甲基
‑
5,10
‑
二氢茚并[1,2
‑
b]吲哚(104mmol,30g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(104mmol,21.3g)溶解在甲苯(0.2m,520ml)中之后,向其中引入叔丁醇钠(155mmol,14.9g)和双(三叔丁基膦)钯(0)(1.04mmol,0.530g),并将所得物在氩气气氛下在回流下搅拌4小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物32
‑
a(39.2g,产率91%,ms[m+h]+=414)。
[0937]
步骤2)化合物32
‑
b的合成
[0938][0939]
在三颈烧瓶中,将4
‑
溴
‑
2,3
‑
二甲基
‑
2,3
‑
二苯基
‑
2,3
‑
二氢噻吩(57.9mmol,20g)和4
‑
叔丁基苯胺(57.9mmol,8.64g)溶解在甲苯(0.2m,290ml)中之后,向其中引入叔丁醇钠(86.9mmol,8.35g)和双(三叔丁基膦)钯(0)(0.579mmol,0.296g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物32
‑
b(12.3g,产率51%,ms[m+h]+=414)。
[0940]
步骤3)化合物32
‑
c的合成
[0941][0942]
在三颈烧瓶中,将化合物32
‑
a(29.0mmol,12g)和化合物32
‑
b(29.0mmol,12g)溶解在甲苯(0.2m,145ml)中之后,向其中引入叔丁醇钠(43.5mmol,4.18g)和双(三叔丁基膦)钯(0)(0.290mmol,0.148g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物32
‑
c(18.8g,产率82%,ms[m+h]+=791)。
[0943]
步骤4)化合物32的合成
[0944][0945]
在三颈烧瓶中,将化合物32
‑
c(23.8mmol,18.8g)溶解在1,2
‑
二氯苯(0.1m,240ml)中之后,向其中引入三碘化硼(38.0mmol,14.9g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(214mmol,27.6g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物32(3.1g,产率16%,ms[m+h]+=799)。
[0946]
合成例33:化合物33的合成
[0947]
步骤1)化合物33
‑
a的合成
[0948][0949]
在三颈烧瓶中,将4
‑
叔丁基苯胺(67.0mmol,10g)和4
′‑
溴
‑3′
h
‑
螺[芴
‑
9,2
′‑
噻吩](67.0mmol,21.1g)溶解在甲苯(0.2m,335ml)中之后,向其中引入叔丁醇钠(101mmol,9.66g)和双(三叔丁基膦)钯(0)(0.670mmol,0.342g),并将所得物在氩气气氛下在回流下
搅拌15小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物33
‑
a(16.8g,产率65%,ms[m+h]+=384)。
[0950]
步骤2)化合物33
‑
b的合成
[0951][0952]
在三颈烧瓶中,将化合物4
‑
a(42.5mmol,20g)和化合物33
‑
a(42.5mmol,16.3g)溶解在甲苯(0.2m,210ml)中之后,向其中引入叔丁醇钠(63.7mmol,6.12g)和双(三叔丁基膦)钯(0)(0.425mmol,0.217g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物33
‑
b(23.0g,产率70%,ms[m+h]+=774)。
[0953]
步骤3)化合物33
‑
c的合成
[0954][0955]
在三颈烧瓶中,将化合物33
‑
b(29.7mmol,23g)溶解在1,2
‑
二氯苯(0.1m,300ml)中之后,向其中引入三碘化硼(47.5mmol,18.6g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(268mmol,34.6g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物33
‑
c(3.9g,产率17%,ms[m+h]+=781)。
[0956]
步骤4)化合物33的合成
[0957][0958]
在三颈烧瓶中,将化合物33
‑
c(4.99mmol,3.9g)和9h
‑
咔唑(5.99mmol,1.00g)溶解
在甲苯(0.2m,30ml)中之后,向其中引入叔丁醇钠(7.49mmol,0.719g)和双(三叔丁基膦)钯(0)(0.05mmol,0.026g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物33(3.7g,产率81%,ms[m+h]+=912)。
[0959]
合成例34:化合物34的合成
[0960]
步骤1)化合物34
‑
a的合成
[0961][0962]
在三颈烧瓶中,将3
‑
溴萘并[2,3
‑
b]噻吩(88.8mmol,23.4g)和5
‑
叔丁基
‑
[1,1
′‑
联苯]
‑2‑
胺(88.8mmol,20g)溶解在甲苯(0.2m,445ml)中之后,向其中引入叔丁醇钠(133mmol,12.8g)和双(三叔丁基膦)钯(0)(0.888mmol,0.454g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物34
‑
a(21.9g,产率61%,ms[m+h]+=408)。
[0963]
步骤2)化合物34
‑
b的合成
[0964][0965]
在三颈烧瓶中,将化合物1
‑
a(24.6mmol,10g)和化合物34
‑
a(24.6mmol,10g)溶解在甲苯(0.2m,125ml)中之后,向其中引入叔丁醇钠(36.9mmol,3.55g)和双(三叔丁基膦)钯(0)(0.246mmol,0.126g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物34
‑
b(16.3g,产率85%,ms[m+h]+=777)。
[0966]
步骤3)化合物34的合成
[0967][0968]
在三颈烧瓶中,将化合物34
‑
b(21.0mmol,16.3g)溶解在1,2
‑
二氯苯(0.1m,210ml)中之后,向其中引入三碘化硼(33.6mmol,13.1g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(189mmol,24.4g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物34(4.8g,产率29%,ms[m+h]+=785)。
[0969]
合成例35:化合物35的合成
[0970]
步骤1)化合物35
‑
a的合成
[0971][0972]
在三颈烧瓶中,将3
‑
溴
‑5‑
甲基苯酚(53.5mmol,10g)和n
‑
(4
‑
叔丁基苯基)
‑3‑
氯苯胺(53.5mmol,13.9g)溶解在甲苯(0.2m,270ml)中之后,向其中引入叔丁醇钠(80.2mmol,7.71g)和双(三叔丁基膦)钯(0)(0.535mmol,0.273g),并将所得物在氩气气氛下在回流下搅拌4小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物35
‑
a(17.6g,产率90%,ms[m+h]+=366)。
[0973]
步骤2)化合物35
‑
b的合成
[0974][0975]
在三颈烧瓶中,将化合物35
‑
a(48.1mmol,17.6g)和碳酸钾(144mmol,20g)溶解在四氢呋喃和水(0.1m,480ml)中之后,向其中引入全氟
‑1‑
丁烷砜氟化物(144mmol,43.6g),并将所得物在室温下搅拌5小时。当反应结束时,向其中引入甲苯和水,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物35
‑
b(30.2g,产率97%,ms[m+h]+=648)。
[0976]
步骤3)化合物35
‑
c的合成
[0977][0978]
在三颈烧瓶中,将化合物35
‑
b(46.6mmol,30.2g)和n
‑
(5
‑
叔丁基
‑
[1,1
′‑
联苯]
‑2‑
基)
‑
5,5,8,8
‑
四甲基
‑
5,6,7,8
‑
四萘并[2,3
‑
b]噻吩
‑3‑
胺(46.6mmol,21.8g)溶解在甲苯(0.2m,233ml)中之后,向其中引入叔丁醇钠(69.9mmol,6.72g)和双(三叔丁基膦)钯(0)(0.466mmol,0.238g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物35
‑
c(27.4g,产率72%,ms[m+h]+=816)。
[0979]
步骤4)化合物35
‑
d的合成
[0980][0981]
在三颈烧瓶中,将化合物35
‑
c(33.6mmol,27.4g)溶解在1,2
‑
二氯苯(0.1m,335ml)中之后,向其中引入三碘化硼(53.8mmol,21.0g),并将所得物在氩气气氛下在140℃下搅拌8小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(302mmol,39.1g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物35
‑
d(5.3g,产率19%,ms[m+h]+=824)。
[0982]
步骤5)化合物35的合成
[0983][0984]
在三颈烧瓶中,将化合物35
‑
d(6.44mmol,5.3g)和双(5,5,8,8
‑
四甲基
‑
5,6,7,8
‑
四氢萘
‑2‑
基)胺(7.72mmol,3g)溶解在甲苯(0.2m,39ml)中之后,向其中引入叔丁醇钠(9.66mmol,0.928g)和双(三叔丁基膦)钯(0)(0.064mmol,0.033g),并将所得物在氩气气氛下在回流下搅拌6小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应
溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物35(4.1g,产率54%,ms[m+h]+=1177)。
[0985]
合成例36:化合物36的合成
[0986]
步骤1)化合物36
‑
a的合成
[0987][0988]
在三颈烧瓶中,将3
‑
溴
‑
5,5,8,8
‑
四甲基
‑
5,6,7,8
‑
四氢萘并[2,3
‑
b]噻吩(155mmol,50g)和5,5,8,8
‑
四甲基
‑
5,6,7,8
‑
四氢萘
‑2‑
胺(155mmol,31.4g)溶解在甲苯(0.2m,775ml)中之后,向其中引入叔丁醇钠(232mmol,22.3g)和双(三叔丁基膦)钯(0)(1.55mmol,0.79g),并将所得物在氩气气氛下在回流下搅拌4小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物36
‑
a(47.6g,产率69%,ms[m+h]+=446)。
[0989]
步骤2)化合物36
‑
b的合成
[0990][0991]
在三颈烧瓶中,将化合物5
‑
a(35.7mmol,17g)和化合物36
‑
a(35.7mmol,15.9g)溶解在甲苯(0.2m,180ml)中之后,向其中引入叔丁醇钠(53.6mmol,5.15g)和双(三叔丁基膦)钯(0)(0.357mmol,0.182g),并将所得物在氩气气氛下在回流下搅拌13小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物36
‑
b(22.1g,产率70%,ms[m+h]+=886)。
[0992]
步骤3)化合物36的合成
[0993][0994]
在三颈烧瓶中,将化合物36
‑
b(25.0mmol,22.1g)溶解在1,2
‑
二氯苯(0.1m,250ml)中之后,向其中引入三碘化硼(39.9mmol,15.6g),并将所得物在氩气气氛下在140℃下搅拌8小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(225mmol,29g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物36(2.9g,产率13%,ms[m+h]+=893)。
[0995]
合成例37:化合物37的合成
[0996]
步骤1)化合物37
‑
a的合成
[0997][0998]
在三颈烧瓶中,将3
‑
溴
‑
5,5,8,8
‑
四甲基
‑
5,6,7,8
‑
四氢萘[2,3
‑
b]噻吩(46.4mmol,15g)和二苯并[b,d]呋喃
‑1‑
胺(46.4mmol,8.5g)溶解在甲苯(0.2m,230ml)中之后,向其中引入叔丁醇钠(69.6mmol,6.69g)和双(三叔丁基膦)钯(0)(0.464mmol,0.237g),并将所得物在氩气气氛下在回流下搅拌10小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物37
‑
a(17.4g,产率88%,ms[m+h]+=426)。
[0999]
步骤2)化合物37
‑
b的合成
[1000][1001]
在三颈烧瓶中,将化合物4
‑
a(36.1mmol,17g)和化合物37
‑
a(36.1mmol,15.4g)溶
解在甲苯(0.2m,180ml)中之后,向其中引入叔丁醇钠(54.2mmol,5.2g)和双(三叔丁基膦)钯(0)(0.361mmol,0.185g),并将所得物在氩气气氛下在回流下搅拌9小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物37
‑
b(24.6g,产率84%,ms[m+h]+=816)。
[1002]
步骤3)化合物37
‑
c的合成
[1003][1004]
在三颈烧瓶中,将化合物37
‑
b(30.2mmol,24.6g)溶解在1,2
‑
二氯苯(0.1m,300ml)中之后,向其中引入三碘化硼(48.3mmol,18.9g),并将所得物在氩气气氛下在140℃下搅拌6小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(271mmol,35g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物37
‑
c(5.2g,产率21%,ms[m+h]+=823)。
[1005]
步骤4)化合物37的合成
[1006][1007]
在三颈烧瓶中,将化合物37
‑
c(6.32mmol,5.2g)和二苯胺(7.58mmol,1.3g)溶解在甲苯(0.2m,38ml)中之后,向其中引入叔丁醇钠(9.47mmol,0.91g)和双(三叔丁基膦)钯(0)(0.06mmol,0.032g),并将所得物在氩气气氛下在回流下搅拌12小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物37(3.3g,产率55%,ms[m+h]+=956)。
[1008]
合成例38:化合物38的合成
[1009]
步骤1)化合物38
‑
a的合成
[1010][1011]
在三颈烧瓶中,将9,9
‑
二甲基
‑
9h
‑
芴
‑4‑
胺(92.8mmol,30g)和3
‑
溴
‑
5,5,8,8
‑
四甲基
‑
5,6,7,8
‑
四氢萘并[2,3
‑
b]噻吩(92.8mmol,19.4g)溶解在甲苯(0.2m,465ml)中之后,向其中引入叔丁醇钠(139mmol,13.4g)和双(三叔丁基膦)钯(0)(0.928mmol,0.474g),并将所得物在氩气气氛下在回流下搅拌4小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物38
‑
a(37.4g,产率89%,ms[m+h]+=452)。
[1012]
步骤2)化合物38
‑
b的合成
[1013][1014]
在三颈烧瓶中,将1
‑
溴
‑3‑
氯
‑5‑
甲基苯(29.2mmol,6g)和5,5,8,8
‑
四甲基
‑3‑
苯基
‑
n
‑
(5,5,8,8
‑
四甲基
‑
5,6,7,8
‑
四氢萘
‑2‑
基)
‑
5,6,7,8
‑
四氢萘
‑2‑
胺(29.2mmol,13.6g)溶解在甲苯(0.2m,150ml)中之后,向其中引入叔丁醇钠(30.5mmol,2.93g)和双(三叔丁基膦)钯(0)(0.292mmol,0.15g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物38
‑
b(12.3g,产率71%,ms[m+h]+=590)。
[1015]
步骤3)化合物38
‑
c的合成
[1016][1017]
在三颈烧瓶中,将化合物38
‑
a(20.3mmol,9.18g)和化合物38
‑
b(20.3mmol,12g)溶解在甲苯(0.2m,100ml)中之后,向其中引入叔丁醇钠(30.5mmol,2.93g)和双(三叔丁基膦)钯(0)(0.2mmol,0.1g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将
所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物38
‑
c(14.2g,产率69%,ms[m+h]+=1006)。
[1018]
步骤4)化合物38的合成
[1019][1020]
在三颈烧瓶中,将化合物38
‑
c(14.1mmol,14.2g)溶解在1,2
‑
二氯苯(0.1m,140ml)中之后,向其中引入三碘化硼(22.6mmol,8.85g),并将所得物在氩气气氛下在140℃下搅拌10小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(127mmol,16.5g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物38(2.6g,产率18%,ms[m+h]+=1013)。
[1021]
合成例39:化合物39的合成
[1022]
步骤1)化合物39
‑
a的合成
[1023][1024]
在三颈烧瓶中,将n
‑
(4
‑
叔丁基苯基)
‑
7,7,10,10
‑
四甲基
‑
7,8,9,10
‑
四氢萘并[2,3
‑
b]苯并呋喃(35.2mmol,15g)和1
‑
溴
‑3‑
氯
‑5‑
叔丁基苯(35.2mmol,8.7g)溶解在甲苯(0.2m,175ml)中之后,向其中引入叔丁醇钠(52.9mmol,5.08g)和双(三叔丁基膦)钯(0)(0.352mmol,0.18g),并将所得物在氩气气氛下在回流下搅拌6小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物39
‑
a(18.2g,产率87%,ms[m+h]+=592)。
[1025]
步骤2)化合物39
‑
b的合成
[1026][1027]
在三颈烧瓶中,将化合物39
‑
a(30.7mmol,18.2g)和n
‑
(4
‑
叔丁基苯基)
‑5‑
(2
‑
苯基丙烷
‑2‑
基)苯并[b]噻吩
‑3‑
胺(41.6mmol,19.6g)溶解在甲苯(0.2m,155ml)中之后,向其中引入叔丁醇钠(46.1mmol,4.43g)和双(三叔丁基膦)钯(0)(0.307mmol,0.157g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物39
‑
b(21.5g,产率73%,ms[m+h]+=955)。
[1028]
步骤3)化合物39的合成
[1029][1030]
在三颈烧瓶中,将化合物39
‑
b(22.5mmol,21.5g)溶解在1,2
‑
二氯苯(0.1m,225ml)中之后,向其中引入三碘化硼(36mmol,14.1g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(203mmol,26.2g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物39(3.8g,产率18%,ms[m+h]+=963)。
[1031]
合成例40:化合物40的合成
[1032]
步骤1)化合物40
‑
a的合成
[1033]
[1034]
在三颈烧瓶中,将2
‑
(全氟苯基)
‑
n
‑
苯基苯并呋喃
‑6‑
胺(53.3mmol,20g)和1
‑
溴
‑3‑
氯
‑5‑
碘苯(79.9mmol,7.68g)溶解在甲苯(0.2m,270ml)中之后,向其中引入叔丁醇钠(80mmol,7.68g)和双(三叔丁基膦)钯(0)(0.532mmol,0.272g),并将所得物在氩气气氛下在回流下搅拌3小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物40
‑
a(20.7g,产率69%,ms[m+h]+=565)。
[1035]
步骤2)化合物40
‑
b的合成
[1036][1037]
在三颈烧瓶中,将化合物40
‑
a(35.6mmol,20.1g)和化合物17
‑
b(35.6mmol,12g)溶解在甲苯(0.2m,180ml)中之后,向其中引入叔丁醇钠(53.3mmol,5.12g)和双(三叔丁基膦)钯(0)(0.356mmol,0.182g),并将所得物在氩气气氛下在回流下搅拌6小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物40
‑
b(26.1g,产率89%,ms[m+h]+=821)。
[1038]
步骤3)化合物40
‑
c的合成
[1039][1040]
在三颈烧瓶中,将化合物40
‑
b(31.8mmol,26.1g)溶解在1,2
‑
二氯苯(0.1m,320ml)中之后,向其中引入三碘化硼(50.8mmol,20g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(286mmol,37g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物40
‑
c(4.6g,产率17%,ms[m+h]+=829)。
[1041]
步骤4)化合物40的合成
[1042][1043]
在三颈烧瓶中,将化合物40
‑
c(5.55mmol,4.6g)和4a,9a
‑
二甲基
‑
2,3,4,4a,9,9a
‑
六氢
‑
1h
‑
咔唑(6.66mmol,1.34g)溶解在甲苯(0.2m,33ml)中之后,向其中引入叔丁醇钠(8.32mmol,0.8g)和双(三叔丁基膦)钯(0)(0.055mmol,0.028g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物40(3.8g,产率69%,ms[m+h]+=994)。
[1044]
合成例41:化合物41的合成
[1045]
步骤1)化合物41
‑
a的合成
[1046][1047]
在三颈烧瓶中,将n
‑
(4
‑
叔丁基苯基)
‑
5a,9a
‑
二甲基
‑
5a,6,7,8,9,9a
‑
六氢二苯并[b,d]呋喃
‑2‑
胺(51.5mmol,18g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(51.5mmol,10.6g)溶解在甲苯(0.2m,260ml)中之后,向其中引入叔丁醇钠(77.2mmol,7.42g)和双(三叔丁基膦)钯(0)(0.515mmol,0.263g),并将所得物在氩气气氛下在回流下搅拌2小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物41
‑
a(20.5g,产率84%,ms[m+h]+=474)。
[1048]
步骤2)化合物41
‑
b的合成
[1049][1050]
在三颈烧瓶中,将化合物41
‑
a(43.2mmol,20.5g)和n
‑
(4
‑
叔丁基苯基)
‑3′
h
‑
螺
[芴
‑
9,2
′‑
噻吩]
‑4′‑
胺(43.2mmol,16.6g)溶解在甲苯(0.2m,220ml)中之后,向其中引入叔丁醇钠(64.9mmol,6.23g)和双(三叔丁基膦)钯(0)(0.432mmol,0.221g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物41
‑
b(22.9g,产率64%,ms[m+h]+=821)。
[1051]
步骤3)化合物41的合成
[1052][1053]
在三颈烧瓶中,将化合物41
‑
b(27.9mmol,22.9g)溶解在1,2
‑
二氯苯(0.1m,280ml)中之后,向其中引入三碘化硼(44.6mmol,17.5g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(251mmol,32.4g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物41(4.1g,产率18%,ms[m+h]+=829)。
[1054]
合成例42:化合物42的合成
[1055]
步骤1)化合物42
‑
a的合成
[1056][1057]
在三颈烧瓶中,将5a,9a
‑
二甲基
‑
n
‑
苯基
‑
5a,6,7,8,9,9a
‑
六氢苯并[b,d]噻吩
‑2‑
胺(48.5mmol,15g)和1
‑
溴
‑3‑
氯
‑5‑
碘苯(48.5mmol,15.4g)溶解在甲苯(0.2m,240ml)中之后,向其中引入叔丁醇钠(72.7mmol,7g)和双(三叔丁基膦)钯(0)(0.485mmol,0.248g),并将所得物在氩气气氛下在回流下搅拌3小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物42
‑
a(15.6g,产率65%,ms[m+h]+=499)。
[1058]
步骤2)化合物42
‑
b的合成
[1059][1060]
在三颈烧瓶中,将化合物42
‑
a(31.3mmol,15.6g)和n
‑
([1,1
′‑
联苯]
‑2‑
基)
‑
6,6,9,9
‑
四甲基
‑
6,7,8,9
‑
四氢萘并[1,2
‑
b]噻吩
‑2‑
胺(31.3mmol,12.9g)溶解在甲苯(0.2m,160ml)中之后,向其中引入叔丁醇钠(46.9mmol,4.51g)和双(三叔丁基膦)钯(0)(0.313mmol,0.16g),并将所得物在氩气气氛下在回流下搅拌4小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物42
‑
b(19.2g,产率74%,ms[m+h]+=830)。
[1061]
步骤3)化合物42
‑
c的合成
[1062][1063]
在三颈烧瓶中,将化合物42
‑
b(23.1mmol,19.2g)溶解在1,2
‑
二氯苯(0.1m,230ml)中之后,向其中引入三碘化硼(37.0mmol,14.5g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(208mmol,27g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物42
‑
c(2.7g,产率14%,ms[m+h]+=837)。
[1064]
步骤4)化合物42的合成
[1065]
[1066]
在三颈烧瓶中,将化合物42
‑
c(3.22mmol,2.7g)和3
‑
叔丁基
‑
10h
‑
苯并[4,5]噻吩并[3,2
‑
b]吲哚(3.87mmol,1.08g)溶解在甲苯(0.2m,19ml)中之后,向其中引入叔丁醇钠(4.84mmol,0.46g)和双(三叔丁基膦)钯(0)(0.032mmol,0.016g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物42(2.5g,产率72%,ms[m+h]+=1080)。
[1067]
合成例43:化合物43的合成
[1068]
步骤1)化合物43
‑
a的合成
[1069][1070]
在三颈烧瓶中,将n,2,3
‑
三苯基苯并[b]噻吩
‑6‑
胺(53.0mmol,20g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(53.0mmol,10.9g)溶解在甲苯(0.2m,265ml)中之后,向其中引入叔丁醇钠(79.5mmol,7.64g)和双(三叔丁基膦)钯(0)(0.53mmol,0.271g),并将所得物在氩气气氛下在回流下搅拌6小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物43
‑
a(19.7g,产率74%,ms[m+h]+=502)。
[1071]
步骤2)化合物43
‑
b的合成
[1072][1073]
在三颈烧瓶中,将化合物43
‑
a(39.2mmol,19.7g)和化合物16
‑
a(39.2mmol,8.84g)溶解在甲苯(0.2m,200ml)中之后,向其中引入叔丁醇钠(58.9mmol,5.66g)和双(三叔丁基膦)钯(0)(0.392mmol,0.2g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物43
‑
b(23.4g,产率86%,ms[m+h]+=691)。
[1074]
步骤3)化合物43的合成
[1075][1076]
在三颈烧瓶中,将化合物43
‑
b(33.9mmol,23.4g)溶解在1,2
‑
二氯苯(0.1m,340ml)中之后,向其中引入三碘化硼(54.2mmol,21.2g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(305mmol,39.4g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物43(5.2g,产率22%,ms[m+h]+=699)。
[1077]
合成例44:化合物44的合成
[1078]
步骤1)化合物44
‑
a的合成
[1079][1080]
在三颈烧瓶中,将8
‑
叔丁基
‑
n
‑
(4
‑
叔丁基苯基)二苯并[b,d]噻吩
‑4‑
胺(38.7mmol,15g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(38.7mmol,8g)溶解在甲苯(0.2m,195ml)中之后,向其中引入叔丁醇钠(58.1mmol,5.58g)和双(三叔丁基膦)钯(0)(0.387mmol,0.198g),并将所得物在氩气气氛下在回流下搅拌2小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物44
‑
a(18.8g,产率95%,ms[m+h]+=512)。
[1081]
步骤2)化合物44
‑
b的合成
[1082][1083]
在三颈烧瓶中,将化合物44
‑
a(36.7mmol,18.8g)和5
‑
叔丁基
‑
n
‑
(4
‑
叔丁基苯基)苯并[b]噻吩
‑2‑
胺(36.7mmol,12.4g)溶解在甲苯(0.2m,180ml)中之后,向其中引入叔丁醇
钠(55.1mmol,5.29g)和双(三叔丁基膦)钯(0)(0.367mmol,0.187g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物44
‑
b(27.4g,产率92%,ms[m+h]+=813)。
[1084]
步骤3)化合物44的合成
[1085][1086]
在三颈烧瓶中,将化合物44
‑
b(33.7mmol,27.4g)溶解在1,2
‑
二氯苯(0.1m,340ml)中之后,向其中引入三碘化硼(53.9mmol,21.1g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(303mmol,39.2g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物44(4.6g,产率17%,ms[m+h]+=821)。
[1087]
合成例45:化合物45的合成
[1088]
步骤1)化合物45
‑
a的合成
[1089][1090]
在三颈烧瓶中,将n
‑
基
‑
5a,10a
‑
二甲基
‑5‑
苯基
‑
5,5a,6,7,8,9,10,10a
‑
八氢环戊[b]吲哚
‑2‑
胺(47.1mmol,20g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(47.1mmol,9.68g)溶解在甲苯(0.2m,235ml)中之后,向其中引入叔丁醇钠(70.6mmol,6.79g)和双(三叔丁基膦)钯(0)(0.471mmol,0.241g),并将所得物在氩气气氛下在回流下搅拌8小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物45
‑
a(21.5g,产率83%,ms[m+h]+=549)。
[1091]
步骤2)化合物45
‑
b的合成
[1092][1093]
在三颈烧瓶中,将化合物45
‑
a(39.1mmol,21.5g)和n
‑
(4
‑
叔丁基苯基)
‑
4,4,6,6
‑
四甲基
‑
5,6
‑
二氢
‑
4h
‑
环戊[b]噻吩
‑3‑
胺(39.1mmol,12.8g)溶解在甲苯(0.2m,195ml)中之后,向其中引入叔丁醇钠(58.7mmol,5.64g)和双(三叔丁基膦)钯(0)(0.391mmol,0.2g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物45
‑
b(21.9g,产率67%,ms[m+h]+=840)。
[1094]
步骤3)化合物45的合成
[1095][1096]
在三颈烧瓶中,将化合物45
‑
b(26.1mmol,21.9g)溶解在1,2
‑
二氯苯(0.1m,260ml)中之后,向其中引入三碘化硼(41.7mmol,16.3g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(235mmol,30.3g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物45(3.5g,产率16%,ms[m+h]+=848)。
[1097]
合成例46:化合物46的合成
[1098]
步骤1)化合物46
‑
a的合成
[1099][1100]
在三颈烧瓶中,将6
‑
叔丁基
‑9‑
苯基
‑
n
‑
(5,5,8,8
‑
四甲基
‑
5,6,7,8
‑
四氢萘
‑2‑
基
‑
9h
‑
咔唑
‑3‑
胺(39.9mmol,20g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(39.9mmol,8.21g)溶解在甲苯(0.2m,200ml)中之后,向其中引入叔丁醇钠(60mmol,5.76g)和双(三叔丁基膦)钯(0)(0.4mmol,0.204g),并将所得物在氩气气氛下在回流下搅拌5小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物46
‑
a(20.9g,产率84%,ms[m+h]+=625)。
[1101]
步骤2)化合物46
‑
b的合成
[1102][1103]
在三颈烧瓶中,将化合物46
‑
a(33.4mmol,20.9g)和6
‑
叔丁基
‑
n
‑
(5,5,8,8
‑
四甲基
‑
5,6,7,8
‑
四氢萘
‑2‑
基)苯并[b]噻吩
‑2‑
胺(33.4mmol,13.1g)溶解在甲苯(0.2m,170ml)中之后,向其中引入叔丁醇钠(50.1mmol,4.82g)和双(三叔丁基膦)钯(0)(0.334mmol,0.171g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物46
‑
b(25.2g,产率77%,ms[m+h]+=980)。
[1104]
步骤3)化合物46的合成
[1105][1106]
在三颈烧瓶中,将化合物46
‑
b(25.7mmol,25.2g)溶解在1,2
‑
二氯苯(0.1m,260ml)中之后,向其中引入三碘化硼(41.1mmol,16.1g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(231mmol,30g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物46(4.1g,产率16%,ms[m+h]+=988)。
[1107]
合成例47:化合物47的合成
[1108]
步骤1)化合物47
‑
a的合成
[1109][1110]
在三颈烧瓶中,将9
‑
(2,6
‑
二氟苯基)
‑
1,1,4,4
‑
四甲基
‑
n
‑
(3,5,5,8,8
‑
五甲基
‑
5,6,7,8
‑
四氢萘
‑2‑
基)
‑
2,3,4,9
‑
四氢
‑
1h
‑
咔唑
‑7‑
胺(36.1mmol,20g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(36.1mmol,7.41g)溶解在甲苯(0.2m,180ml)中之后,向其中引入叔丁醇钠(54.1mmol,5.20g)和双(三叔丁基膦)钯(0)(0.36mmol,0.184g),并将所得物在氩气气氛下在回流下搅拌8小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物47
‑
a(21.7g,产率89%,ms[m+h]+=679)。
[1111]
步骤2)化合物47
‑
b的合成
[1112][1113]
在三颈烧瓶中,将化合物47
‑
a(31.9mmol,21.7g)和5
‑
氟
‑
n
‑
(苯基
‑
d5)苯并[b]噻吩
‑3‑
胺(31.9mmol,7.93g)溶解在甲苯(0.2m,160ml)中之后,向其中引入叔丁醇钠(47.9mmol,4.6g)和双(三叔丁基膦)钯(0)(0.319mmol,0.163g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物47
‑
b(20.1g,产率71%,ms[m+h]+=891)。
[1114]
步骤3)化合物47的合成
[1115][1116]
在三颈烧瓶中,将化合物47
‑
b(22.6mmol,20.1g)溶解在1,2
‑
二氯苯(0.1m,225ml)中之后,向其中引入三碘化硼(36.1mmol,14.1g),并将所得物在氩气气氛下在140℃下搅拌
3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(203mmol,36.2g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物47(2.5g,产率12%,ms[m+h]+=899)。
[1117]
合成例48:化合物48的合成
[1118]
步骤1)化合物48
‑
a的合成
[1119][1120]
在三颈烧瓶中,将9
‑
(2,6
‑
二氟苯基)
‑
1,1,4,4
‑
四甲基
‑
n
‑
(3,5,5,8,8
‑
五甲基
‑
5,6,7,8
‑
四氢萘
‑2‑
基)
‑
2,3,4,9
‑
四氢
‑
1h
‑
咔唑
‑7‑
胺(53.1mmol,20g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(53.1mmol,10.9g)溶解在甲苯(0.2m,265ml)中之后,向其中引入叔丁醇钠(79.7mmol,10.9g)和双(三叔丁基膦)钯(0)(0.531mmol,0.271g),并将所得物在氩气气氛下在回流下搅拌2小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物48
‑
a(22.8g,产率86%,ms[m+h]+=501)。
[1121]
步骤2)化合物48
‑
b的合成
[1122][1123]
在三颈烧瓶中,将化合物48
‑
a(45.5mmol,22.8g)和4,4,6,6
‑
四甲基
‑
n
‑
苯基
‑
5,6
‑
二氢
‑
4h
‑
环戊[b]呋喃
‑3‑
胺(45.5mmol,11.6g)溶解在甲苯(0.2m,230ml)中之后,向其中引入叔丁醇钠(68.3mmol,6.56g)和双(三叔丁基膦)钯(0)(0.455mmol,0.233g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物48
‑
b(23.1g,产率71%,ms[m+h]+=720)。
[1124]
步骤3)化合物48的合成
[1125][1126]
在三颈烧瓶中,将化合物48
‑
b(32.1mmol,23.1g)溶解在1,2
‑
二氯苯(0.1m,320ml)中之后,向其中引入三碘化硼(51.3mmol,20.1g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(289mmol,37.3g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物48(3.6g,产率15%,ms[m+h]+=728)。
[1127]
合成例49:化合物49的合成
[1128]
步骤1)化合物49
‑
a的合成
[1129][1130]
在三颈烧瓶中,将n
‑
(4
‑
叔丁基
‑2‑
甲基苯基)二苯并[b,d]噻吩
‑3‑
胺(43.4mmol,15g)和3
‑
溴
‑5‑
氯
‑
1,1
′‑
联苯(43.4mmol,11.6g)溶解在甲苯(0.2m,220ml)中之后,向其中引入叔丁醇钠(65.1mmol,6.26g)和双(三叔丁基膦)钯(0)(0.434mmol,0.222g),并将所得物在氩气气氛下在回流下搅拌2小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物49
‑
a(20.1g,产率87%,ms[m+h]+=532)。
[1131]
步骤2)化合物49
‑
b的合成
[1132][1133]
在三颈烧瓶中,将化合物49
‑
a(37.8mmol,20.1g)和6
‑
叔丁基
‑
n
‑
(4
‑
叔丁基
‑2‑
甲基苯基)苯并呋喃
‑2‑
胺(37.8mmol,12.7g)溶解在甲苯(0.2m,190ml)中之后,向其中引入叔丁醇钠(56.7mmol,5.4g)和双(三叔丁基膦)钯(0)(0.378mmol,0.193g),并将所得物在氩气气氛下在回流下搅拌24小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物49
‑
b(21.7g,产率69%,ms[m+h]+=831)。
[1134]
步骤3)化合物49的合成
[1135][1136]
在三颈烧瓶中,将化合物49
‑
b(26.1mmol,21.7g)溶解在1,2
‑
二氯苯(0.1m,260ml)中之后,向其中引入三碘化硼(41.8mmol,16.4g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(235mmol,30.4g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物49(3.3g,产率15%,ms[m+h]+=839)。
[1137]
合成例50:化合物50的合成
[1138]
步骤1)化合物50
‑
a的合成
[1139]
[1140]
在三颈烧瓶中,将n
‑
(4
‑
叔丁基苯基)
‑
6,6,9,9
‑
四甲基
‑
6,7,8,9
‑
四氢二苯并[b,d]呋喃
‑2‑
胺(39.9mmol,15g)和1
‑
溴
‑3‑
氯
‑5‑
甲基苯(39.9mmol,8.21g)溶解在甲苯(0.2m,200ml)中之后,向其中引入叔丁醇钠(59.9mmol,5.76g)和双(三叔丁基膦)钯(0)(0.399mmol,0.204g),并将所得物在氩气气氛下在回流下搅拌4小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物50
‑
a(18.5g,产率93%,ms[m+h]+=500)。
[1141]
步骤2)化合物50
‑
b的合成
[1142][1143]
在三颈烧瓶中,将化合物50
‑
a(37.0mmol,18.5g)和n
‑
(4
‑
叔丁基苯基)
‑
4,4,7,7
‑
四甲基
‑
4,5,6,7
‑
四氢苯并呋喃
‑2‑
胺(37.0mmol,12.0g)溶解在甲苯(0.2m,185ml)中之后,向其中引入叔丁醇钠(55.5mmol,5.33g)和双(三叔丁基膦)钯(0)(0.370mmol,0.189g),并将所得物在氩气气氛下在回流下搅拌15小时。当反应结束时,将所得物冷却至室温,然后向其中引入h2o,将反应溶液转移至分液漏斗并进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化以获得化合物50
‑
b(22.8g,产率78%,ms[m+h]+=789)。
[1144]
步骤3)化合物50的合成
[1145][1146]
在三颈烧瓶中,将化合物50
‑
b(28.9mmol,22.8g)溶解在1,2
‑
二氯苯(0.1m,290ml)中之后,向其中引入三碘化硼(46.2mmol,18.1g),并将所得物在氩气气氛下在140℃下搅拌3小时。将反应物质冷却至0℃,并且在向其中添加n,n
‑
二异丙基乙基胺(260mmol,33.6g)之后,将所得物搅拌1小时。在分液漏斗中使用甲苯和h2o对所得物进行萃取。将萃取物用mgso4干燥并浓缩,使用硅胶柱色谱法将样品纯化,然后进行升华纯化以获得化合物50(4.1g,产率18%,ms[m+h]+=797)。
[1147]
实验例1:光致发光分析的实验
[1148]
根据韩国专利第10
‑
2030309号,当硼化合物经包含氧或硫的芳族5元环以对称结构取代时,可以制备具有与经三个6元芳族环取代的硼化合物相比更平坦的结构的硼化合物,并且看出,使用其可以获得具有高色纯度、高效率和长寿命的器件。
[1149]
确定,通过在有机发光器件的有机材料层中包括包含根据本说明书的一个实施方案的化学式1的化合物(即,包含一个芳族5元环的不对称硼化合物)的层,获得了具有与韩国专利第10
‑
2030309号相比更优异的效果的有机发光器件。
[1150]
通过以下光致发光分析的实验,确定本领域中的对称化合物和根据本说明书的一个实施方案的化学式1的化合物(即,不对称化合物)的荧光光谱。在光致发光分析的实验中,使用其中硼取代有三个苯环的bd
‑
a、为其中硼取代有两个苯并噻吩和一个苯环的对称化合物的bd
‑
c、以及为根据本说明书的一个实施方案的化学式1的由合成例16合成的化合物16。
[1151][1152]
在光致发光分析的实验中使用jasco fp
‑
8600荧光分光光度计,并且使用以下方法测量最大发射波长。
[1153]
使用甲苯作为溶剂,将为待测量的化合物的bd
‑
a、bd
‑
c和化合物16各自以1
×
10
‑5m的浓度溶解以制备用于测量的样品。将样品溶液引入石英池中并使用氮气(n2)进行脱气以除去溶液中的氧,并且使用测量装置在室温(300k)下测量荧光光谱。在本文中,获得了最大发射峰的波长值(nm),并且获得了图的在最大发射峰的高度的一半处的扩展宽度(fwhm,半峰全宽,nm)。结果示于下表1中,以及测量图示于图4中。
[1154]
[表1]
[1155][1156]
从表1和图4确定,在化合物bd
‑
a、bd
‑
c和化合物16的每一者中,随着杂环基增加一个,在比主峰更长的波长区域中形成的第二峰变得更强。随着第二峰变得更强,存在有机发光器件中的色纯度变差的缺点,本说明书的化学式1的不对称化合物16与化合物bd
‑
c相比具有更弱的第二峰。因此看出,由于发光特性,用为不对称化合物的根据本说明书的一个实施方案的化学式1的化合物与用对称化合物相比形成了具有高色纯度和高效率的器件。
[1157]
实验例2:量子化学计算的实验
[1158]
为了确定实验例1的光致发光分析实验的结果的原因,对对称的噻吩
‑
硼化合物(以下dabna和bd
‑
f)和根据本说明书的一个实施方案的化学式1的化合物(即,不对称的噻吩
‑
硼化合物(以下bd
‑
e))进行量子计算。量子计算基于schrodinger material science suite程序的密度泛函理论(density functional theory,dft)计算和含时密度泛函理论计算来进行,并且在本文中,使用b3lyp作为泛函数,使用6
‑
31g*作为基函数。参照先前的文
献,使用schrodinger material science suite程序来进行发射波长的franck
‑
condon分析,并且结果示于下表2至4中(例如,参照文献「santoro,f.,lami,a.,improta,r.,bloino,j.,barone,v.j.chem.phys.128,224311(2008).」和文献「kondo,y.,yoshiura,k.,kitera,s.等.nat.photonics 13,678(2019).」)。
[1159][1160]
[表2]
[1161][1162]
[表3]
[1163][1164]
[表4]
[1165][1166]
从表2至4确定,与包含芳族烃环(苯)的dabna相比,包含杂环基的化合物bd
‑
e和
bd
‑
f在更长的波长区域内形成了具有更高强度的第二峰。然而,预期不对称的bd
‑
e(根据本说明书的一个实施方案的化合物)的第二峰与bd
‑
f的第二峰相比似乎具有更低的强度,该结果表明实验例1中的化合物16与bd
‑
c之间的色纯度差异的原因。从实验例1和2的结果确定,当在有机发光器件的有机材料层中使用为不对称硼化合物的根据本说明书的一个实施方案的化学式1时,与当使用对称硼化合物相比,获得了具有更加优异的发光特性的器件。
[1167]
实验例3:热重分析的实验
[1168]
热重分析仪(tga)是在对样品施加温度之后测量样品的作为时间或温度的函数的质量变化的设备。材料的质量损失是由产生气态产物的蒸发或化学反应引起的。使用q
‑
500,将完成升华纯化的3mg或更多且小于5mg的下表5的化合物分别放在pt盘上并以10℃/分钟的速率从室温加热至700℃。在本文中,测量化合物的质量相对于总重量减少5%(=td
‑
5%损失)的温度和在加热至700℃之后保留在盘上的残余物的量(百分比)。在合成例19中制备的化合物19的热重分析图示于图5中,以及bd
‑
a和bd
‑
c的热重分析图分别示于图6和图7中。
[1169]
[表5]
[1170]
化合物分子量td(5%损失)残余(%)bd
‑
a658.783680.3bd
‑
c770.9545930.1化合物19845.053754.2
[1171]
从表5和图5至图7确定,与为包含含有o或s的5元环但具有对称结构的硼化合物的bd
‑
c相比,根据本说明书的一个实施方案的化学式1(即,为包含含有o或s的5元环的不对称硼化合物的化合物19)即使具有较高的分子量也具有较低的td
‑
5%损失值。此外,在分析之后保留在盘上的化合物的百分比也在5%以内,这与为不具有杂芳基的硼化合物的bd
‑
a类似。通过该实验确定,根据本说明书的一个实施方案的化学式1(即,包含含有o或s的5元环的不对称硼化合物)由于与具有类似分子量的化合物相比具有低的td
‑
5%损失值而在热稳定性方面是优异的,从而具有低升华温度,并且也是适合用于沉积设备的有机材料。
[1172]
实验例4.有机发光器件的制造
[1173]
实施例1
[1174]
将其上涂覆有厚度为的氧化铟锡(ito)作为薄膜的玻璃基底放入溶解有清洁剂的蒸馏水中并进行超声波清洗。在本文中,使用fischer co.的产品作为清洁剂,并且作为蒸馏水,使用由millipore co.制造的过滤器过滤两次的蒸馏水。在将ito清洗30分钟之后,使用蒸馏水重复进行两次超声清洗10分钟。在用蒸馏水清洗完成之后,将基底用异丙醇、丙酮和甲醇溶剂进行超声清洗,然后干燥,然后将其转移至等离子体清洗器。此外,使用氧等离子体将基底清洗5分钟,然后转移至真空沉积装置。
[1175]
在如上准备的透明ito电极上,将以下hi
‑
a和lg
‑
101分别热真空沉积至和的厚度以形成空穴注入层。在空穴注入层上,通过将以下ht
‑
a真空沉积至的厚度来形成空穴传输层。在空穴传输层上将以下ht
‑
b真空沉积至的厚度以形成电子阻挡层。随后,在电子阻挡层上,基于100重量份的发光层使用4重量份的合成例1的化合物1
作为蓝色发光掺杂剂并且真空沉积以下bh
‑
a作为主体来形成厚度为a作为主体来形成厚度为的发光层。然后,在发光层上,将以下化合物et
‑
a真空沉积至作为第一电子传输层,随后,将以下et
‑
b和liq以1∶1的重量比真空沉积至的厚度以形成第二电子传输层。在第二电子传输层上通过真空沉积liq至的厚度来形成电子注入层。在电子注入层上,通过将铝和银以10:1的重量比沉积至的厚度,然后在其上沉积铝至的厚度来形成阴极。
[1176]
在上述过程中,将有机材料的沉积速率保持在秒至秒,将阴极的铝的沉积速率保持在秒,并且将沉积期间的真空度保持在5
×
10
‑8托至1
×
10
‑7托,因此,制造了有机发光器件。
[1177][1178]
实施例2至50和比较例1至3
[1179]
以与实施例1中相同的方式分别制造实施例2至实施例50和比较例1至比较例3的有机发光器件,不同之处在于分别使用下表6中描述的化合物代替化合物1作为发光层的掺杂剂。
[1180]
[1181]
对于实施例1至50和比较例1至3的各有机发光器件,测量当施加10ma/cm2的电流密度时的电压和效率以及当施加20ma/cm2的电流密度时的寿命(t95),并且结果示于下表6中。在本文中,t95意指当采用在20ma/cm2的电流密度下的初始亮度作为100%时,亮度降低至95%所花费的时间,并且基于比较例1(100%)示出了百分比。
[1182]
[表6]
[1183]
[1184]
[1185][1186]
实施例51至54和比较例4
[1187]
以与实施例1中相同的方式分别制造实施例51至54和比较例4的有机发光器件,不同之处在于使用下表7中描述的化合物代替化合物1作为发光层的掺杂剂,以及使用下表7中描述的化合物代替bh
‑
a作为主体材料。
[1188]
在发光层中,第一主体和第二主体的重量比为50:50。
[1189]
对于实施例51至54和比较例4的各有机发光器件,测量当施加10ma/cm2的电流密度时的电压和效率以及当施加20ma/cm2的电流密度时的寿命(t95),并且结果示于下表7中。在本文中,t95意指当采用在20ma/cm2的电流密度下的初始亮度作为100%时,亮度降低至95%所花费的时间,并且基于表6的比较例1(100%)示出了百分比。
[1190][1191]
[表7]
[1192][1193]
实施例55至57和比较例5
[1194]
以与实施例1中相同的方式分别制造实施例55至57和比较例5的有机发光器件,不同之处在于使用下表8中描述的化合物代替化合物1作为发光层的掺杂剂,以及使用下表8中描述的化合物代替bh
‑
a作为主体材料。
[1195]
在发光层中,第一掺杂剂和第二掺杂剂的重量比为50:50。
[1196][1197]
对于实施例55至57和比较例5的各有机发光器件,测量当施加10ma/cm2的电流密度时的电压和效率以及当施加20ma/cm2的电流密度时的寿命(t95),并且结果示于下表8中。在本文中,t95意指当采用在20ma/cm2的电流密度下的初始亮度作为100%时,亮度降低至95%所花费的时间,并且基于表6的比较例1(100%)示出了百分比。
[1198]
[表8]
[1199][1200]
在表6至8中,看出与包含具有对称结构的硼化合物的比较例1至5相比,在有机发光器件中包含根据本说明书的一个实施方案的化学式1(即,包含含有o或s的5元环的不对称硼化合物)的实施例1至57有效地获得了更低的驱动电压、优异的效率、有利的色纯度和长寿命。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1