通过使用角质酶改善关于聚酯纺织品的护理特性的制作方法
1.本发明涉及酶技术,特别是具有抗起球特性的酶,其例如用于洗涤试剂或清洁试剂中。本发明涉及洗涤试剂或清洁试剂,特别是液体去污试剂,该试剂包含如本文定义的角质酶。进一步地,本发明涉及通过使用此类洗涤试剂或清洁试剂用于清洁纺织品的方法,以及根据本发明的洗涤试剂或清洁试剂用于去除污物的用途。此外,本发明涉及角质酶在洗涤试剂或清洁试剂中的用途,其用于减少对纺织品的起球作用,并且用于改善此类试剂的抗发灰效应。
背景技术:
2.如果衣服或其它纺织品洗了好几次,则随着时间过去,它们将显示起球。这种现象适用于所有类型的纺织品,并且对于消费者是不期望的,因为由于起球,服饰或纺织品显得更旧且难看。术语“起球”用于描述织物中的结节或绒毛形成。这些小绒毛尤其出现在短纤维织物中。另一方面,起球对于长纤维织物和加捻纤维不太严重。一般而言,这些结节由织物中的松弛纤维或已从织物中松弛的纤维引起。由于其光滑的表面,合成纤维比天然纤维更易于起球,因为合成纤维可以比粗糙的天然纤维更快地从织物中松散。在羊毛织物中,这些纤维主要由于机械摩擦而“起毡(felt)”,并且在表面上形成结节。
3.起球的主要效应是光学损伤。由于在表面上的结节形成,织物看起来相对较早使用,并且比它们实际上更旧。另外,彩色纺织品的颜色显得不太鲜艳。另一方面,织物的功能性几乎没有或根本没有受损。起球尤其发生在机械应力区域,主要是肩膀和腰带区域。此外,由于织物的连续变薄,这些应力区域特别处于形成孔或甚至裂开的风险中。由于不期望的纺织品起球和/或变薄,消费者比基于纺织品的功能性所需的更快地分类且丢弃它们。
4.此外,纺织品在洗涤时倾向于变灰。这是因为在洗涤过程期间,污垢以及从彩色纺织品中脱离的色素被释放。尽管尝试通过使用各种去污试剂成分将其保留在洗涤液中,但仍然经常不可能防止污垢/色素沉积在纺织品上并保留在其上。这就是所谓的“发灰效应”。这对于某些合成纤维例如聚酰胺以及聚酯特别明显。
5.迄今为止,用于减少起球效应的技术解决方案仅适用于棉纺织品。纤维素酶用于去污试剂中,以减少起球效应(参见例如,de 69632910 t3)。这意味着在去污试剂中使用纤维素酶,以赋予抗起球和/或抗灰色效应,并且因此确保纺织品看起来像新的更长时间。然而,纤维素酶仅对棉纺织品起作用。对于其它纺织品,例如聚酯纺织品,还不存在减少此类纺织品上的起球效应的可比较方式。因此,期望并且需要解决方案来减少纺织品,尤其是含有合成纤维如聚酯的纺织品上的起球,以便使纺织品尽可能长时间看起来像新的,即颜色应该保持坚挺,形状应该得到保持,并且表面应该保持光滑且完全无损。
6.pet酯酶将聚合的聚对苯二甲酸乙二醇酯(pet)降解成其低聚物、二聚体和单体,或者甚至降解成对苯二甲酸(tpa)和乙二醇(eg)。已发现了其为水解酶的几种pet降解酶,大多数具有α
‑
β
‑
水解酶类型的折叠。在其中包括具有已知功能的酶,如例如脂肪酶、酯酶、角质酶等等。由于其pet降解能力,此类酶也命名为pet酶。这些酶本质上是非常稳定的,且
因此适合于其在技术过程中的应用。特别地,角质酶源自真菌,所述真菌使用以其天然功能的酶来降解叶的角质层,以便到达下面的叶结构。因此,该酶已经历了自然进化的过程,这使其能够在外界天气条件下保持功能。该酶是蛋白质,并且因此是完全可生物降解的生物材料。
7.最近发现,在叶堆肥中通过宏基因组学方法鉴定的角质酶(sulaiman等人(2011)“isolation of a novel cutinase homolog with polyester
‑
degrading activity from leaf
‑
branch compost by using a metagenomic approach”,appl.environ.microbiol.78(5):1556
‑
1562),显示了在50℃下的快速聚酯(pet)降解,并且此外,在洗涤工艺条件下是活性的,并且对于聚酯纺织品具有各种护理特性(申请人的未公开的国际专利申请pct/ep2018/072173)。就先前已知的角质酶和pet酯酶在较高温度(>=60℃)下更具活性,并且此外,仅能够非常缓慢地降解聚酯而言,这是令人惊讶的。
8.令人惊讶地,本发明的发明人目前已发现与野生型角质酶相比,上述角质酶的某些变体具有显著改善的性能。
9.发现这些角质酶提供了改善的pet降解,并且此外,一方面,它们防止了新聚酯纺织品上的起球,和/或与聚酯/棉混纺织品上的纤维素酶组合支持了这种效应。另一方面,可以减少已经形成的毛球,即它可以引起所谓的“更新”效应。此外,根据本发明的角质酶防止了白色衣物的发灰和彩色衣物的褪色/发灰。另外,根据本发明的角质酶对聚酯纺织品上的污渍显示了直接的清洁作用。还发现,以适当的试剂量,实现了所有这些积极的洗涤特性,而不显著损坏纤维。尤其是在处理含有聚酯的纺织品时,另一个重要方面是持续性。由于纺织品看起来完好如新更长时间,因此它们穿着更长时间,并且更不频繁地替换为新近购买的。由于在新纺织品的生产中使用了更少的聚酯,这导致了co2足迹中的减少。
技术实现要素:
10.因此,在第一个方面,本发明涉及洗涤试剂或清洁试剂,其特征在于它含有角质酶,所述角质酶在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且就根据seq id no:1的编号而言,具有在对应于位置61、63、66、89、90、92、155、177、208和211的至少一个位置处的至少一个氨基酸取代,特别是氨基酸取代t61s、d63e、d63t、s66a、s66c、r89l、r89k、f90i、y92d、y92c、y92a、w155a、w155y、v177p、f208e、f208q、f208y、n211e、n211d和n211q中的至少一个。
11.在一个进一步方面,本发明涉及用于清洁纺织品的方法,其特征在于在至少一个方法步骤中,施加根据本发明的试剂。纺织品优选是含聚酯的纺织品或由聚酯组成。
12.在再一个方面,本发明还涉及如本文所述的试剂,优选洗涤试剂或清洁试剂,尤其是液体洗涤试剂,去除污渍和污物的用途。
13.另外,本发明的一个进一步方面包括本文所述的角质酶用于减少起球效应、和/或用于改善抗灰色效应、和/或用于改善试剂的清洁性能的用途,所述试剂优选洗涤试剂或清洁试剂,特别优选液体洗涤试剂,该试剂含有根据本发明的角质酶之一。
具体实施方式
14.通过研究下述详述和权利要求,本发明的这些和其它方面、特点和优点对于技术
人员变得显而易见。来自本发明的一个方面的每个特点都可以用于本发明的任何其它方面。此外,明确的是本文提供的实施例预期描述且示出本发明,但并不限制本发明,并且特别地,本发明并不限于这些实施例。
15.以格式“从x到y”指定的数值范围包括指定的值。如果以此格式指定了几个优选的数值范围,则当然应理解,也将包括起因于不同端点的组合的所有范围。
16.如本文使用的,“至少一个”意指一个或多个,即1、2、3、4、5、6、7、8、9、10个或更多。
17.如本文使用的,“液体”包括液体和凝胶以及糊状组合物。优选液体组合物在室温下是可流动和可倾倒的,但它们具有屈服点也是可能的。
18.角质酶(ec 3.1.1.74),也称为角质水解酶,是属于α/β
‑
水解酶并水解角质的酶。角质酶由多种植物致病性真菌和细菌产生(角质酶使真菌能够分解植物表皮中的角质的酯键,并且因此穿透植物)。
19.所观察到的角质酶益处是多方面的。特别地,角质酶提供了改善的pet降解。此外,一方面,该酶防止了新聚酯纺织品上的毛球形成,或与聚酯/棉混纺纺织品上的纤维素酶组合支持了这种效应。另一方面,可以减少已经形成的毛球,其对应于所谓的“更新”效应,所述效应当前在羊毛护理产品中广为宣传,并且由纤维素酶技术对棉纺织品引起。另外,角质酶防止了白色衣物的发灰和彩色衣物的褪色/发灰。另外,角质酶对含有聚酯的纺织品上的污物具有直接的清洁作用。通过在根据本发明的洗涤试剂和清洁试剂中使用角质酶,羊毛护理产品中已知的“更新”效应也可以转移到聚酯纺织品护理产品。
20.在本发明的上下文中,清洁性能应理解为意指对特别是在聚酯纺织品上的一种或多种污物的减轻性能。在本发明的范围内,包含角质酶的洗涤试剂或清洁试剂以及由这种试剂形成的洗涤液或清洁液具有分别的清洁性能。
21.洗涤液应理解为含有洗涤试剂或清洁试剂的工作溶液,所述溶液作用于纺织品或织物,并且因此与纺织品或织物上存在的污物接触。在洗涤过程或清洁过程开始,并且例如在洗衣机或另一个合适的容器中,用水稀释洗涤试剂或清洁试剂时,照惯例出现洗涤液。
22.在本发明的各个实施方案中,角质酶是可自由获得的酶。这意味着角质酶可以与试剂的所有组分直接作用,并且如果试剂是液体,则角质酶与本发明的溶试剂(例如水)直接接触。在进一步的实施方案中,本发明可以含有角质酶,其与其它分子形成相互作用复合物或包含“涂层”。单个或多个角质酶分子可以通过周围结构与试剂的其它组分分开。此类分开结构可以由囊泡形成,但不限于其,所述囊泡例如胶束或脂质体。周围结构也可以是病毒颗粒、细菌细胞或真核细胞。
23.本发明基于发明人的以下令人惊讶的发现:在本文所述的角质酶的位置处的氨基酸取代改善了根据本发明的洗涤试剂和清洁试剂的总体性能。
24.在本发明的各个优选实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且就根据seq id no:1的编号而言,具有在对应于位置61、63、66、89、90、92、155、177、208和211的至少一个位置处的至少一个氨基酸取代,特别是氨基酸取代t61s、d63e、d63t、s66a、s66c、r89l、r89k、f90i、y92d、y92c、y92a、w155a、w155y、v177p、f208e、f208q、f208y、n211e、n211d和n211q中的至少一个。
25.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质
酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置61的位置处的氨基酸取代t61s。
26.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置63的位置处的氨基酸取代d63e。
27.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置63的位置处的氨基酸取代d63t。
28.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置66的位置处的氨基酸取代s66a。
29.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置66的位置处的氨基酸取代s66c。
30.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置89的位置处的氨基酸取代r89l。
31.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置89的位置处的氨基酸取代r89k。
32.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置90的位置处的氨基酸取代f90i。
33.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置92的位置处的氨基酸取代y92d。
34.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置92的位置处的氨基酸取代y92c。
35.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置92的位置处的氨基酸取代y92a。
36.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置155的位置处的氨基酸取代w155a。
37.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置155的位置处的氨基酸取代w155y。
38.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置177的位置处的氨基酸取代v177p。
39.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置208的位置处的氨基酸取代f208e。
40.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置208的位置处的氨基酸取代f208q。
41.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置208的位置处的氨基酸取代f208y。
42.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置211的位置处的氨基酸取代n211e。
43.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置211的位置处的氨基酸取代n211d。
44.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置211的位置处的氨基
酸取代n211q。
45.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于seq id no:1的位置61和208、63和211、66和177、66和211、89和155、90和211、以及92和177的位置处的氨基酸取代对t61s和f208e、d63t和n211e、s66a和v177p、s66c和n211d、r89l和w155y、r89k和w155a、f90i和n211q,、以及y92d和v177p中的至少一个。
46.在本发明的进一步实施方案中,用于根据本发明的试剂中的角质酶是这样的角质酶,其在其整个长度上,与seq id no:1中所示的氨基酸序列具有至少65%的序列同一性,并且基于根据seq id no:1的编号,具有氨基酸取代t61s、d63e、d63t、s66a、s66c、r89l、r89k、f90i、y92d、y92c、y92a、w155a、w155y、v177p、f208e、f208q、f208y、n211e、n211d和n211q的任何组合。
47.在本发明的进一步实施方案中,本发明还包含例如通过诱变,衍生自seq id no:1中所示的氨基酸序列的角质酶。
48.在各个进一步实施方案中,根据本发明的试剂还可以含有可通过根据seq id no:2的核苷酸序列表达获得的角质酶。在本发明的一个方面,本发明还包含seq id no:2中所示的核苷酸序列、以及与这些核苷酸序列有关的核苷酸序列,其在其整个长度上具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、90.5%、91%、91.5%、92%、92.5%、93%、93.5%、94%、94.5%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、98.8%、99.0%、99.2%、99.4%或99.6%的序列同一性,前提是排除编码天然角质酶的序列。
49.在本发明的各个实施方案中,角质酶包含这样的氨基酸序列,其与seq id no:1中所示的氨基酸序列具有至少66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、90.5%、91%、91.5%、92%、92.5%、93%、93.5%、94%、94.5%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、98.8%、99.0%、99.2%、99.4%或99.6%的序列同一性,并且基于根据seq id no:1的编号,具有在对应于位置61、63、66、89、90、92、155、177、208和211的至少一个位置处的至少一个氨基酸取代,优选地选自t61s、d63e、d63t、s66a、s66c、r89l、r89k、f90i、y92d、y92c、y92a、w155a、w155y、v177p、f208e、f208q、f208y、n211e、n211d和n211q的至少一个氨基酸取代。
50.在各个进一步实施方案中,该试剂的特征在于
51.(a)角质酶可以通过单个或多重保守氨基酸取代,从作为起始分子的如上定义的角质酶获得;和/或
52.(b)角质酶可以通过片段化、缺失诱变、插入诱变或取代诱变,从作为起始分子的如上定义的角质酶获得,并且包含在至少169、170、180、190、200、210、220、230、240、245、250、251、252、253、254、255、256、257、258、259或260个相互连接的氨基酸的长度上,与起始分子相匹配的氨基酸序列,所述起始分子中包含的至少一个氨基酸取代仍然存在于选自对应于seq id no:1中的位置61、63、66、89、90、92、155、177、208和211的位置的至少一个位置中。
53.根据本发明的试剂优选地包含在每种情况下,基于活性蛋白质以0.00001至1重量%的量,更优选以0.0001至0.5重量%的量,更特别优选以0.001至0.1重量%的量的角质酶。
54.在本发明的上下文中,角质酶具有至少一个指定的氨基酸取代的特点意指,它在分别的位置处含有一个(或多个)指定的氨基酸取代,即至少指定的位置并不以其它方式,例如通过角质酶的片段化而突变或缺失。
55.核酸序列或氨基酸序列的同一性通过序列比较进行确定。通过在核苷酸序列或氨基酸序列中分配彼此相似的序列来完成此类比较。优选地基于现有技术中建立的照常规使用的blast算法,来进行这种序列比较(参照例如,altschul等人(1990)“basic local alignment search tool”,j.mol.biol.215:403
‑
410,以及altschul等人(1997)“gapped blast and psi
‑
blast:a new generation of protein database search programs”;nuc.acids res.25:3389
‑
3402),并且原则上,通过在核酸序列或氨基酸序列中分配彼此相似的核苷酸或氨基酸序列来完成。所讨论的位置的表格分配称为比对。现有技术中可用的进一步算法是fasta算法。照常规使用计算机软件来创建序列比较(比对),特别是多重序列比较。经常使用例如clustal系列(参照例如,chenna等人(2003)“multiple sequence alignment with the clustal series of programs”,nuc.acids res.31:3497
‑
3500),t
‑
coffee(参照例如,notredame等人(2000)“t
‑
coffee:a novel method for multiple sequence alignments”,j.mol.biol.302:205
‑
217),或者基于这些程序或算法的程序。为了本发明的目的,序列比较和比对优选用计算机程序vectorsuite 10.3(invitrogen corporation,1600faraday avenue,carlsbad,california,usa),使用预设的缺省参数来进行。
56.此类比较允许作出关于比较序列的相似性的陈述。它照常规以同一性百分比陈述,即其中或相互对应位置的比对中的等同核苷酸或氨基酸残基的比例。更广义的术语“同源性”还包括考虑氨基酸序列中保守的氨基酸取代,因此具有相似特征的氨基酸,因为它们一般在蛋白质内具有相似的活性或功能。因此,比较序列的相似性也可以以同源性百分比或相似性百分比来陈述。关于同一性和/或同源性的陈述可以在整个多肽或基因上,或者仅在个别结构域上作出。因此,通过序列中的匹配来限定各种核酸序列或氨基酸序列的同源结构域或等同结构域。它们经常具有等同或相似的功能。它们可能很小,并且仅包含几个核苷酸或氨基酸。此类小结构域经常行使对于蛋白质的总体活性必要的功能。因此,将序列匹配仅与个别的、任选地小结构域相关可能是有意义的。然而,如果没有另外说明,则本技术中关于同一性或同源性的陈述,在每种情况下涉及指示的核酸序列或氨基酸序列的整个长度。
57.在本发明的上下文中,氨基酸位置对应于seq id no:1中的数字上指定位置的指示意指:相应位置与seq id no:1中的数字上指定位置在如上定义的比对方面相关。
58.在本发明的一个进一步实施方案中,角质酶的特征在于,与包含的氨基酸序列对应于seq id no:1中所示的氨基酸序列的角质酶相比,它的抗起球性能得到显著改善,即,它具有至少105%、110%、115%、120%、125%、130%、140%、150%、160%、170%、180%、190%、200%、210%、220%、230%、240%、250%、260%、270%、280%、290%或300%的参比抗起球性能。可以在含有试剂量为4.5至7.0克的去污试剂/升洗涤液和角质酶的洗涤系
统中测定抗起球性能,其中待比较的角质酶以相等的浓度(相对于活性蛋白质)使用,并且如本文所述确定抗起球性能。例如,洗涤过程可以在40℃的温度下进行60分钟,并且水具有15.5至16.5
°
dh(德国硬度)的水硬度。基于活性的纯化蛋白质,预期用于这种洗涤系统的去污试剂中的角质酶浓度为0.00001至1重量%,优选0.0001至0.5重量%,特别优选0.001至0.1重量%。
59.用于此类洗涤系统的示例性液体参比去污试剂如下组成(所有数据都按重量%计):4.4%烷基苯磺酸、5.6%阴离子表面活性试剂、2.4%脂肪酸的c
12
‑
c
18 na盐(肥皂)、4.4%非离子表面活性试剂、0.2%膦酸盐、1.4%柠檬酸、0.95%naoh、0.01%消泡试剂、2%丙三醇、0.08%防腐试剂、1%乙醇、1.6%酶混合物(蛋白酶、淀粉酶、纤维素酶、甘露聚糖酶),剩余部分为软化水。液体去污试剂的优选试剂量为4.5至6.0克/升洗涤液,例如4.7、4.9或5.9克/升洗涤液。优选在ph 8至ph 10.5之间,优选在ph 8至ph 9之间的ph范围内洗涤。
60.在本发明的上下文中,优选通过洗涤60分钟,使用如上文指示的液体去污试剂在40℃下测定抗起球性能。
61.作为清洁性能的量度的白度,即污物的变浅,通过光学测量方法,优选通过光度测量方法进行测定。对于此合适的仪器例如是分光计minolta cm508d。通常,用于测量的仪器预先用白度标准进行校准,所述白度标准优选与仪器一起供应的白度标准。
62.抗起球性能可以通过视觉评估来确定。在这种情况下,检查组将在1
‑
5的量表上的值分配给待检查的衣物。值=1代表严重剥离的衣物,而值=5分配给未剥离的衣物。
63.使用具有相同活性水平的分别的角质酶确保了,在活性物质与总蛋白质的比率(比活性的值)中的任何不一致的情况下,比较了分别的酶促特性,例如对某些污物的清洁性能或抗起球性能。一般而言,可以通过添加大量的蛋白质来补偿低的比活性。此外,如果待调查的酶与活性测试中的测试底物具有不同的亲和力,则待调查的酶也可以以相等的物质量或重量使用。在该上下文中,术语“相等的物质量”指待测试酶的摩尔当量使用。术语“按重量计相等的数量”指待测试酶的相等使用。
64.通过与抗血清或特异性抗体反应,可以将一起蛋白质分组成免疫相关蛋白质。此类组成员的特征在于它们具有被抗体识别的相同抗原决定簇。因此,它们在结构上的相似之处在于它们被抗血清或某些抗体识别。因此,本发明的一个进一步方面涉及角质酶,其特征在于它们与用于根据本发明的试剂中的角质酶具有至少一个,以及递增地更为优选的两个、三个或四个等同的抗原决定簇。由于其免疫学相似性,此类角质酶在结构上类似于根据本发明的试剂中使用的角质酶,因为可以假定它们也具有相似的功能。
65.可以用于根据本发明的试剂中的进一步角质酶可以是这样的角质酶,与seq id no:1中所示的角质酶相比,其进一步包含另外的氨基酸修饰,特别是氨基酸取代、插入或缺失,并且在对应于seq id no:1的位置61、63、66、89、90、92、155、177、208和211的至少一个位置处,具有氨基酸取代t61s、d63e、d63t、s66a、s66c、r89l、r89k、f90i、y92d、y92c、y92a、w155a、w155y、v177p、f208e、f208q、f208y、n211e、n211d和n211q中的至少一个。此类角质酶例如通过靶向遗传修饰,即通过诱变而进一步开发,并且对于具体应用或就特殊性质而言(例如就其催化活性、稳定性等而言)进行优化。此外,可以将编码所使用的角质酶的核酸引入重组方法内,并且因此用于生成全新的角质酶或其它多肽。
66.由此,目的是将特异性突变例如取代、插入或缺失引入已知分子内,以便例如改善根据本发明的酶的清洁性能。为此目的,可以特别修饰分子的表面电荷和/或等电点,并且因此修饰其与底物的相互作用。例如,可以修饰酶的净电荷,以便影响底物结合,尤其是对于在去污试剂中的用途。可替代地或另外地,角质酶的稳定性可以通过一个或多个相应的突变而进一步增加,从而改善其清洁性能。个别突变例如个别取代的有利特性可以彼此互补。因此,在本发明的范围内可以进一步开发角质酶,其已经就某些特性而言,例如就其活性和/或其抗起球性能而言进行优化。
67.关于与确切地一个氨基酸位置相关的取代(氨基酸交换)的描述,应用下述约定:首先以国际通用的单字母代码形式指定天然存在的氨基酸,然后指定有关的序列位置且最后指定插入的氨基酸。同一条多肽链内的几个取代通过斜杠分开。就插入而言,在序列位置之后指定了另外的氨基酸。就缺失而言,将缺失的氨基酸替换为符号,例如星号或破折号,或者在相应位置之前指示δ。例如,n58q描述了在位置58处的天冬酰胺由谷氨酰胺的取代,n58na描述了在位置58处的氨基酸天冬酰胺之后的丙氨酸插入,而n58*或δn58描述了在位置58处的天冬酰胺的缺失。这种命名法是酶技术领域中的专家已知的。
68.因此,本发明的一个进一步方面涉及含有角质酶的试剂,所述角质酶的特征在于它可通过单个或多重保守氨基酸取代,从作为起始分子的如上所述的角质酶获得。术语“保守氨基酸取代”意指一个氨基酸残基由另一氨基酸残基的替换(取代),所述替换并不导致在替换氨基酸的位置处的极性或电荷中的变化,例如非极性氨基酸残基由另一个非极性氨基酸残基的替换。本发明中的保守氨基酸取代包括例如:g=a=s、i=v=l=m、d=e、n=q、k=r、y=f、s=t、g=a=i=v=l=m=y=f=w=p=s=t。
69.可替代地或另外地,用于根据本发明的试剂中的角质酶的特征在于,它可通过片段化、缺失、插入或取代诱变,从作为起始分子的角质酶获得,并且包含具有至少169、170、180、190、200、210、220、230、240、245、250、251、252、253、254、255、256、257、258、259或260个相互连接的氨基酸的长度的氨基酸序列,所述角质酶具有在对应于位置61、63、66、89、90、92、155、177、208和211的至少一个位置处的至少一个氨基酸取代。在不同的实施方案中,即使在诱变/取代后,因此可获得的角质酶,仍然与根据seq id no:1的序列具有本文定义的至少65%的序列同一性。
70.例如,能够从酶的末端或环中缺失个别氨基酸,而不丧失或减少水解活性。此外,此类片段化、缺失、插入或取代诱变还可以减少酶的致敏性,并且因此改善其总体可用性。有利的是,即使在诱变后,酶仍保留其水解活性,即它们的水解活性至少对应于起始酶的水解活性,即在一个优选实施方案中,水解活性为起始酶的活性的至少80%,优选至少90%。其它取代也可能具有有益效应。单个和几个相互连接的氨基酸两者均可以被其它氨基酸取代。
71.通过在根据本发明的试剂中包含的角质酶的氨基酸序列、与seq id no:1中所示的角质酶的氨基酸序列的比对,来限定进一步的氨基酸位置。此外,位置的分配取决于成熟蛋白质。如果根据本发明的角质酶的氨基酸序列包含比根据seq id no:1的角质酶更多数目的氨基酸残基,则这种分配也是特别适用的。从根据seq id no:1的角质酶的氨基酸序列中提到的位置开始,在根据本发明的试剂中包含的角质酶中的变化位置是在比对中分配给这些位置的那些。
72.关于角质酶的序列修饰,特别是取代的有利位置,其在转移至根据本发明的角质酶的同源位置时是优选显著的,并且对角质酶赋予有利的功能特性,因此是在比对中与本文所述的位置相对应的位置,即基于seq id no:1中所示的氨基酸序列的编号。在根据seq id no:1的角质酶的野生型分子中提到的位置处存在下述氨基酸残基:t61、d63、s66、r89、f90、y92、w155、v177、f208、n211。
73.在各个实施方案中,除seq id no:1中所示的序列之外,角质酶还可以具有在n末端或c末端处的一个或多个进一步氨基酸。在某些实施方案中,此类n末端肽可以是关于角质酶的天然存在的信号肽或单个甲硫氨酸残基。
74.可以通过比较实验来提供待修饰的氨基酸的正确分配的进一步确认,即特别是其功能对应性,根据所述比较实验,基于比对而彼此分配的两个位置在彼此比较的两种角质酶中以相同方式进行修饰,并且观察酶促活性或抗起球性能是否在两者中以相同的方式进行修饰。如果例如在根据seq id no:1的角质酶的某个位置中的氨基酸取代伴随着酶促参数中的变化,例如k
m
值中的增加,并且如果在根据本发明的试剂中包含的角质酶变体中,观察到酶促参数中的相应变化,例如k
m
值中的同样增加,所述角质酶变体的氨基酸取代通过相同的引入氨基酸来实现,则这被看作正确分配的确认。
75.除非另有明确说明,否则与本文所述的组合物/试剂结合给出的所有百分数,都指分别组合物/试剂的重量百分比(重量%)。
76.在本发明的上下文中,除非另有说明,否则脂肪酸或脂肪醇或其衍生物分别代表优选具有6至22个碳原子、分支或未分支的羧酸或醇或其衍生物。特别地,例如也可以相应地使用分别在例如roelen的羰基合成之后可获得的羰基合成醇或其衍生物。
77.在下文中每当提到碱土金属作为一价阴离子的抗衡离子时,这意指碱土金属当然仅以足以平衡电荷的材料(例如阴离子)的一半的量存在。
78.本发明包括所有可设想类型的洗涤试剂或清洁试剂,浓缩物以及待以未稀释形式使用的试剂两者,用于在商业规模上使用、用于洗衣机或手洗中。这些包括例如术语去污试剂对于其使用的,用于纺织品、地毯或天然纤维的去污试剂。本发明还包括这样的洗涤试剂和清洁试剂,其加入手动或机器衣服洗涤中的实际去污试剂中,以便达到进一步的效应。此外,在本发明的范围内的洗涤试剂和清洁试剂还包括纺织品预处理试剂和后处理试剂,即衣物在实际洗涤之前与之接触,例如用于清除顽固污渍的试剂,以及在实际纺织品洗涤过程之后的步骤中,给予衣物进一步的期望特性(如令人愉悦的手感、抗皱性或低静电荷)的试剂。后者包括例如织物柔顺试剂。
79.本发明的实施方案包括根据本发明的试剂的所有固体、粉状、液体、凝胶或糊状试剂型,其可以由几个相组成,并且可以为压缩形式或非压缩形式。试剂可以作为自由流动的粉末获得,特别是具有300g/l至1200g/l,特别是500g/l至900g/l或600g/l至850g/l的堆积密度。试剂的固体试剂型还包括挤出物、颗粒、片试剂或小袋。可替代地,试剂也可以是液体、凝胶或糊状,例如以非水性液体去污试剂或非水性糊试剂的形式,或者以水性液体去污试剂或含水糊试剂的形式。一般优选液体。试剂也可以作为单组分系统存在。此类试剂由一个相组成。可替代地,试剂也可以由几个相组成。因此,将此类试剂分成几个组分(多组分系统)。
80.根据本发明的洗涤试剂或清洁试剂,其可以作为粉状固体,以压实颗粒形式,作为
均质溶液、凝胶或悬浮液存在,除上述的角质酶之外,还可以含有常用于此类试剂中的所有已知成分,优选存在于试剂中的至少一种进一步成分。根据本发明的试剂可以特别含有表面活性试剂、助洗试剂、漂白试剂特别是过氧化合物或漂白活化试剂。它们还可以含有水混溶性有机溶试剂、进一步的酶、掩蔽试剂、电解质、ph调节试剂和/或进一步的助试剂,例如荧光增白试剂、变灰抑制试剂、泡沫调节试剂以及着色试剂和香精及其组合。
81.特别地,根据本发明的试剂与一种或多种进一步成分的组合是有利的,因为在根据本发明的优选实施方案中,由于所得到的协同作用,此类试剂显示出改善的清洁性能。特别地,此类协同作用可以通过将根据本发明的试剂与表面活性试剂和/或助洗试剂和/或过氧化合物和/或漂白活化试剂组合来实现。
82.根据本发明的试剂的有益成分公开于国际专利申请wo 2009/121725 a1中,在其中的第5页上的倒数第二段开始,并且在其中的第13页上的第二段后结束。明确参考本公开内容,并且公开的内容包括在本专利申请中。
83.除角质酶之外,根据本发明的试剂优选还含有来自表面活性试剂类别的至少一种化合物,特别地选自阴离子表面活性试剂和非离子表面活性试剂,以及阳离子表面活性试剂、两性离子表面活性试剂或两性表面活性试剂。
84.在本发明的一个优选实施方案中,基于试剂的总重量,根据本发明的试剂包含总量为2至70重量%,特别优选5至65重量%,更优选7.5至60重量%,最优选10至60重量%的表面活性试剂。在本发明的各个实施方案中,基于试剂的总重量,根据本发明的试剂包含总量为2至30重量%,优选5至25重量%,更优选10至20重量%,最优选14至18重量%的表面活性试剂。
85.合适的表面活性试剂是例如式(i)的阴离子表面活性试剂
86.r
‑
so3‑
y
+
ꢀꢀ
(i)。
87.在该式(i)中,r是直链或支链的未取代的烷基芳基残基。y
+
代表一价阳离子或n价阳离子的第n部分,优选碱金属离子,并且在其中有na
+
或k
+
,na
+
是最优选的。进一步的阳离子y
+
可以选自nh
4+
、1/2zn
2+
、1/2mg
2+
、1/2ca
2+
、1/2mn
2+
及其混合物。
88.如本文使用的,“烷基芳基”指由烷基残基和芳香族残基组成的有机残基。此类残基的典型实例包括但不限于烷基苯残基,例如苄基、丁基苯、壬基苯、癸基苯、十一烷基苯、十二烷基苯、十三烷基苯等等。
89.在各个实施方案中,此类表面活性试剂选自式a
‑
1的直链或支链的烷基苯磺酸盐
[0090][0091]
其中r
′
和r
″
一起包含9至19,优选11至15,且特别是11至13个碳原子。特别优选的代表可以由式a
‑
1a描述:
[0092][0093]
在各个实施方案中,式(i)的化合物优选为直链烷基苯磺酸盐的钠盐。
[0094]
在根据本发明的试剂中,洗涤试剂或清洁试剂含有来自式(i)的阴离子表面活性
试剂类别的至少一种化合物,在每种情况下,基于清洁试剂的总重量,其量为0.1至35重量%,优选为1至30重量%,更优选为21至10重量%,更优选为2至6重量%,甚至更优选为3至5重量%。
[0095]
在各个实施方案中,本发明的试剂优选包含至少一种下式的阴离子表面活性试剂
[0096]
r1‑
o
‑
(ao)
n
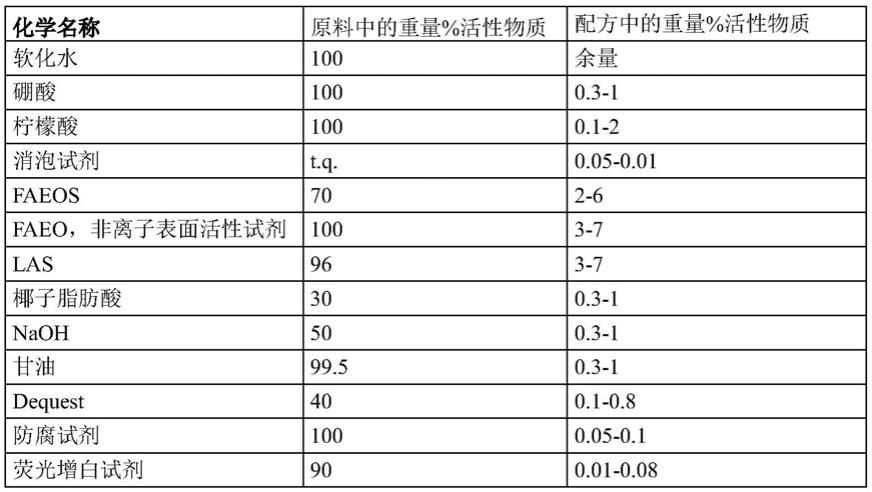
‑
so3‑
x
+
ꢀꢀ
(ii)。
[0097]
在该式(ii)中,r1代表直链或支链、取代或未取代的烷基、芳基或烷基芳基残基,优选直链、未取代的烷基残基,特别优选脂肪醇残基。优选的r1残基选自癸基、十一烷基、十二烷基、十三烷基、十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基残基及其混合物,优选具有偶数碳原子的代表。特别优选的残基r1衍生自c
12
‑
c
18
脂肪醇,例如椰子脂肪醇,皮脂脂肪醇,月桂醇、肉豆蔻醇、鲸蜡醇或硬脂醇,或者衍生自c
10
‑
c
20
羰基合成醇。
[0098]
ao代表环氧乙烷(eo)或环氧丙烷(po)基团,优选环氧乙烷基团。指数n代表1至50的整数,优选1至20,且特别是2至10。特别优选地,n代表数字2、3、4、5、6、7或8。x
+
代表一价阳离子或n价阳离子的第n部分,优选碱金属离子,并且在其中有na
+
或k
+
,na
+
是最优选的。进一步的阳离子x
+
可以选自nh
4+
、1/2zn
2+
、1/2mg
2+
、1/2ca
2+
、1/2mn
2+
及其混合物。
[0099]
总之,各个实施方案中的试剂因此包含选自式a
‑
2的脂肪醇醚硫酸盐的至少一种阴离子表面活性试剂
[0100][0101]
其中k=11至19,n=2、3、4、5、6、7或8。特别优选的代表是具有2个eo的na
‑
c
12
‑
14
脂肪醇醚硫酸盐(式a
‑
2中的k=11
‑
13,n=2)。
[0102]
在各个实施方案中,试剂包含至少一种式(ii)的阴离子表面活性试剂,基于试剂的总重量,其量为2至10重量%,优选为3至8重量%。
[0103]
可以使用的其它阴离子表面活性试剂是式(iii)的烷基硫酸盐
[0104]
r2‑
o
‑
so3‑
x
+
ꢀꢀ
(iii)。
[0105]
在该式(iii)中,r2代表直链或支链、取代或未取代的烷基残基,优选直链、未取代的烷基残基,特别优选脂肪醇残基。优选的r2残基选自癸基、十一烷基、十二烷基、十三烷基、十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基残基及其混合物,优选具有偶数c原子的代表。特别优选的残基r2衍生自c
12
‑
c
18
脂肪醇,例如椰子脂肪醇,皮脂脂肪醇,月桂醇、肉豆蔻醇、鲸蜡醇或硬脂醇,或者衍生自c
10
‑
c
20
羰基合成醇。x
+
代表一价阳离子或n价阳离子的第n部分,优选碱金属离子,并且在其中有na
+
或k
+
,由此na
+
是最优选的。进一步的阳离子x
+
可以选自nh
4+
、1/2zn
2+
、1/2mg
2+
、1/2ca
2+
、1/2mn
2+
及其混合物。
[0106]
在各个实施方案中,这些表面活性试剂选自式a
‑
3的脂肪醇硫酸盐
[0107][0108]
其中k=11至19。特别优选的代表是na
‑
c
12
‑
14
脂肪醇硫酸盐(式a
‑
3中的k=11
‑
13)。
[0109]
在各个实施方案中,除上述阴离子表面活性试剂之外,试剂还可以含有至少一种进一步的表面活性试剂,特别是式(i)至(iii)的那些,或可替代地至少一种进一步的表面
活性试剂。进一步的阴离子表面活性试剂、非离子表面活性试剂及其混合物,以及阳离子表面活性试剂、两性离子表面活性试剂和两性表面活性试剂可以用作替代或另外的表面活性试剂。
[0110]
在各个实施方案中,试剂包括至少一种非离子表面活性试剂,特别是至少一种脂肪醇烷氧基化物。
[0111]
在本发明的一个优选实施方案中,基于试剂的总重量,根据本发明的试剂包含0.1至30重量%,还优选0.1至7重量%,特别优选7至25重量%,还特别优选3至7重量%的非离子表面活性试剂。
[0112]
合适的非离子表面活性试剂是式(iv)的那些
[0113]
r3‑
o
‑
(ao)
m
‑
h
ꢀꢀ
(iv),
[0114]
其中r3代表直链或支链、取代或未取代的烷基残基,ao代表环氧乙烷(eo)或环氧丙烷(po)基团,m代表1至50的整数。
[0115]
在上式(iv)中,r3代表直链或支链、取代或未取代的烷基残基,优选直链、未取代的烷基残基,特别优选脂肪醇残基。优选的r3残基选自癸基、十一烷基、十二烷基、十三烷基、十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基残基及其混合物,优选具有偶数c原子的代表。特别优选的残基r3衍生自c
12
‑
c
18
脂肪醇,例如椰子脂肪醇,皮脂脂肪醇,月桂醇、肉豆蔻醇、鲸蜡醇或硬脂醇,或者衍生自c
10
‑
c
20
羰基合成醇。
[0116]
ao代表环氧乙烷(eo)或环氧丙烷(po)基团,优选环氧乙烷基团。指数m代表1至50的整数,优选1至20,且特别是2至10。特别优选地,m代表数字2、3、4、5、6、7或8。。
[0117]
总之,优选使用的脂肪醇烷氧基化物是式(v)的化合物
[0118][0119]
其中k=11至19,m=2、3、4、5、6、7或8。特别优选的代表是具有7个eo的c
12
‑
18
脂肪醇(在式(v)中k=11
‑
17,m=7)。
[0120]
可以包含在根据本发明的所述试剂中的进一步的非离子表面活性试剂包括但不限于烷基糖苷、烷氧基化的脂肪酸烷基酯、氧化胺、脂肪酸链烷醇酰胺、羟基混合醚、脱水山梨糖醇脂肪酸酯、多羟基脂肪酸酰胺和烷氧基化醇。
[0121]
合适的两性表面活性试剂是例如式(r
iii
)(r
iv
)(r
v
)n
+
ch2coo的甜菜碱,其中r
iii
是具有8至25个,优选10至21个碳原子的烷基残基,任选地被杂原子或杂原子基团中断,并且r
iv
和r
v
代表具有1至3个碳原子的等同或不同的烷基残基,特别是c
10
‑
c
18
烷基二甲基羧甲基甜菜碱和c
11
‑
c
17
烷基酰胺基丙基二甲基羧甲基甜菜碱。
[0122]
合适的阳离子表面活性试剂包括式(r
vi
)(r
vii
)(r
viii
)(r
viii
)(r
ix
)n
+
x的季铵化合物,其中r
vi
至r
ix
代表四个等同或不同,特别是两个长链和两个短链的烷基残基,并且x代表阴离子,特别是卤化物离子,例如二癸基二甲基氯化铵、烷基苄基二癸基氯化铵及其混合物。其它合适的阳离子表面活性试剂是季表面活性化合物,尤其是具有锍、鎓、碘鎓或砷鎓基的那些,其也已知作为抗微生物试剂。通过使用具有抗微生物效应的季表面活性化合物,可以设计具有抗微生物效应的试剂,或者可以改善其抗微生物效应由于其它成分已经存在的试剂。
[0123]
在各个实施方案中,基于试剂的重量,表面活性试剂的总量为2至30重量%,优选
为5至25重量%,更优选为10至20重量%,最优选为14至18重量%,其中基于试剂的重量,(线性)烷基苯磺酸盐以0.001至30重量%,优选0.001至10重量%,更优选2至6重量%,更优选3至5重量%的量存在。
[0124]
根据本发明的洗涤试剂或清洁试剂还可以含有除了角质酶之外的进一步酶。这些可以是其浓度对于试剂的有效性适当的水解酶或其它酶。因此,本发明的一个实施方案代表包含一种或多种酶的试剂。待使用的优选酶是能够在本发明中发挥催化活性的所有酶,特别是蛋白酶、淀粉酶、纤维素酶、半纤维素酶、甘露聚糖酶、鞣酸酶、木聚糖酶、黄原酶、木葡聚糖酶、β
‑
葡糖苷酶、果胶酶、卡拉胶酶、过水解酶、氧化酶、氧化还原酶、水解酶、pet酶或脂肪酶、以及其混合物。基于活性蛋白质,酶有利地以1x 10
‑8至5重量%的量存在于试剂中。递增地更为优选的,基于活性蛋白质,每种酶以1x 10
‑7至3重量%、0.00001至1重量%、0.00005至0.5重量%、0.0001至0.1重量%,且特别优选0.0001至0.05重量%的量包含在根据本发明的试剂中。酶显示了就某些污物或污渍而言特别优选的协同清洁性能,即,介质组合物中包含的酶在其清洁性能方面彼此支持。协同效应不仅可以在不同的酶之间发生,而且还可以在一种或多种酶和根据本发明的试剂的其它成分之间发生。
[0125]
特别优选的,根据本发明的角质酶可以与纤维素酶组合用于聚酯/棉混纺织品上。角质酶防止聚酯纤维起球,而纤维素酶对棉纤维具有相同的作用。纤维素酶优选是纤维素酶混合物或单组分纤维素酶,优选地或占优势地是内切葡聚糖酶和/或纤维二糖水解酶。
[0126]
淀粉酶优选为α
‑
淀粉酶。半纤维素酶优选是β
‑
葡聚糖酶、果胶酶、支链淀粉酶和/或甘露聚糖酶。氧化还原酶优选是氧化酶,特别是胆碱氧化酶或过水解酶。
[0127]
所使用的蛋白酶优选是碱性丝氨酸蛋白酶。它们充当非特异性内肽酶,即它们水解位于肽或蛋白质内部的任何酰胺键,并且因此导致清洁材料上含有蛋白质的污物的降解。它们的最佳ph通常在明显的碱性范围内。
[0128]
蛋白质浓度可以使用已知方法进行测定,所述方法例如bca法(二辛可宁酸;2,2'
‑
联喹啉基
‑
4,4'
‑
二羧酸)或双缩脲法。通过使用合适的不可逆抑制试剂(例如用于蛋白酶的苯甲基磺酰氟(pmsf))来滴定活性中心,并且确定残留活性来确定活性蛋白质浓度(参见m.bender等人,j.am.chem.soc.88,24(1966),第5890
‑
5913页)。
[0129]
在本文所述的去污试剂中,待使用的酶也可以与例如来自发酵的伴随物质一起包装。在液体制试剂中,酶优选作为液体酶制试剂使用。
[0130]
酶通常并不以纯蛋白质的形式提供,而是以可以贮存且运输的稳定制试剂的形式提供。这些预合成(pre
‑
confectioned)的制试剂包括例如通过制粒、挤出或冻干而获得的固体制试剂,或者特别是在液体或凝胶制试剂的情况下,有利地尽可能浓缩、低水和/或与稳定试剂或其它添加试剂混合的酶溶液。
[0131]
可替代地,酶可以对于固体试剂型和液体试剂型两者进行包封,例如通过将酶溶液连同优选地天然聚合物一起喷雾干燥或挤出,或者以胶囊的形式,例如其中酶包附在固化凝胶中的那些胶囊、或具有核
‑
壳类型的那些胶囊中,其中含酶的核涂布有对水、空气和/或化学制品不可渗透的保护层。另外的活性物质,例如稳定试剂、乳化试剂、色素、漂白试剂或染料也可以施加在沉积层中。根据本身已知的方法,例如通过摇动或辊压制粒或在流化床工艺中,应用此类胶囊。有利地,例如通过应用聚合物成膜试剂,此类颗粒的粉尘低,并且由于涂层而是贮存稳定的。
[0132]
此外,能够将两种或更多种酶组装在一起,使得单个颗粒具有几种酶活性。
[0133]
酶也可以掺入水溶性薄膜内,例如以单位试剂量形式的去污试剂包装中使用的那些。此类薄膜在与水接触后允许酶的释放。如本文使用的,“水溶性”指优选完全水溶性的薄膜结构。优选地,此类膜由(完全或部分水解的)聚乙烯醇(pva)组成。
[0134]
在各个实施方案中,本发明可以含有一种或多种酶稳定试剂。因此,本发明还可以含有选自甲酸钠、硫酸钠、低级脂肪族醇和硼酸及其酯和盐的酶稳定试剂。当然,这些化合物中的两种或更多种也可以组合使用。这些化合物的盐也可以以水合物的形式使用,例如十水合硫酸钠。
[0135]
如本文使用的,术语“低级脂肪族醇”包括一元醇、二元醇和具有至多6个碳原子的高级醇。在该上下文中,作为属于低级脂肪族醇的组,特别提到多元醇例如甘油、(单)乙二醇、(单)丙二醇或山梨糖醇,但本发明并不限于此。
[0136]
除选自上述组的至少一种酶稳定试剂之外,根据本发明的试剂还可以含有至少一种进一步稳定试剂。此类稳定试剂是现有技术中已知的。
[0137]
通过可逆地抑制试剂中包含的蛋白酶的酶促活性,可逆蛋白酶抑制试剂保护洗涤试剂或清洁试剂中包含的酶免于蛋白酶解降解。苄脒盐酸盐、硼酸或其盐或酯频繁地用作可逆蛋白酶抑制试剂,在其中主要是具有芳香族基团的衍生物,例如邻、间或对位取代的苯硼酸,特别是4
‑
甲酰基苯硼酸,或者所提到的化合物的盐或酯。肽醛,即具有还原c末端的寡肽,特别是由2至50个单体组成的那些,也用于这个目的。肽可逆蛋白酶抑制试剂包括卵类粘蛋白和亮抑酶肽。
[0138]
进一步的酶稳定试剂是氨基醇,例如单、二、三乙醇和丙醇胺及其混合物,至多c
12
的脂肪族羧酸,例如琥珀酸,其它二羧酸或这些酸的盐。封端的脂肪酸酰胺烷氧基化物也适合于这个目的。用作助洗试剂的一些有机酸也能够充当酶稳定试剂。钙盐和/或镁盐例如乙酸钙也用于这个目的。
[0139]
聚酰胺低聚物或聚合化合物,例如木质素、水溶性乙烯基共聚物或纤维素醚、丙烯酸聚合物和/或聚酰胺,使酶制试剂稳定,尤其不受物理影响或ph波动。含有多胺
‑
n
‑
氧化物的聚合物同时充当酶稳定试剂和颜色转移抑制试剂。其它聚合物稳定试剂是直链c8‑
c
18
聚氧化烯。烷基多糖苷也可以稳定根据本发明的试剂的酶促组分,并且优选能够另外地增加其性能。交联的含n化合物优选实现作为污垢释放试剂和酶稳定试剂的双重功能。疏水的非离子聚合物特别地使可能存在的纤维素酶稳定。
[0140]
还原试剂和抗氧化试剂增加酶针对氧化降解的稳定性;为此,含硫的还原试剂如亚硫酸钠和还原糖是常见的。
[0141]
在一个实施方案中,根据本发明的试剂是液体,并且含有水作为主要溶试剂,即它们是水性试剂。根据本发明的水性试剂的含水量通常为1至70重量%,优选为3至65重量%,更优选为5至60重量%。在各个实施方案中,在每种情况下,基于试剂的总量,含水量多于5重量%,优选多于15重量%,且特别优选多于50重量%。
[0142]
另外,可以将非水溶试剂加入试剂中。合适的非水溶试剂包括一元醇或多元醇、链烷醇胺或乙二醇醚,条件是它们在指定的浓度范围内与水是易混溶的。溶试剂应该优选地选自乙醇、正丙醇、异丙醇、丁醇、乙二醇、丙二醇、丁二醇、甲基丙二醇、甘油、二甘醇、丙基二甘醇、丁基二甘醇、己二醇、乙二醇甲醚、乙二醇乙醚、乙二醇丙醚、乙二醇单正丁醚、二甘
醇甲醚、二甘醇乙醚、丙二醇甲醚、丙二醇乙醚、丙二醇丙醚、二丙二醇单甲醚、二丙二醇单甲醚、甲氧基三甘醇、乙氧基三甘醇、丁氧基三甘醇、1
‑
丁氧基乙氧基
‑2‑
丙醇、3
‑
甲基
‑3‑
甲氧基丁醇、丙二醇叔丁基醚、二正辛基醚和这些溶试剂的混合物。
[0143]
基于试剂的总量,一种或多种非水溶试剂通常以0.1至25重量%,优选0.5至10重量%,更优选1至8重量%的量包含。
[0144]
除上文提到的组分之外,根据本发明的试剂还可以含有其它成分,其进一步改善去污试剂的技术应用和/或美学特性。这些包括例如用于改善流出和干燥行为、用于调节粘度和/或用于稳定化的添加试剂,以及去污试剂中常用的其它助试剂和添加试剂,例如uv稳定试剂、香料、珠光试剂、染料、缓蚀试剂、防腐试剂、苦味物质、有机盐、消毒试剂、结构化聚合物、去沫试剂、包封成分(例如包封香料)、ph调节试剂以及皮肤感觉改善或护理添加试剂。
[0145]
根据本发明的试剂,特别是洗涤试剂或清洁试剂,优选含有至少一种水溶性和/或水不溶性的有机和/或无机助洗试剂(多种助洗试剂)。
[0146]
特别地,氨基羧酸及其盐、沸石、硅酸盐、碳酸盐、有机(共)助洗试剂以及
–
当不存在针对其使用的生态偏见时
‑
磷酸盐在一般可用的助洗试剂中。然而,优选地,这些试剂是不含磷酸盐的。
[0147]
水溶性有机助洗试剂包括多元羧酸,尤其是柠檬酸和糖酸,单体和聚合氨基多元羧酸,尤其是甲基甘氨酸二乙酸、次氮基三乙酸和乙二胺四乙酸,以及聚天冬氨酸,聚膦酸,尤其是氨基三(亚甲基膦酸)、乙二胺四(亚甲基膦酸)和1
‑
羟乙烷
‑
1,1
‑
二膦酸,聚合羟基化合物例如糊精和聚合(多元)羧酸、聚合丙烯酸、甲基丙烯酸、马来酸及其共聚物,其也可能含有小比例的以共聚形式的不含羧酸官能团的可聚合物质。合适的,尽管较不优选的,这类化合物是丙烯酸或甲基丙烯酸与乙烯基醚的共聚物,例如乙烯基甲醚、乙烯基酯、乙烯、丙烯和苯乙烯,其中酸的比例为至少50重量%。有机助洗试剂可以以水溶液的形式,优选以30至50重量%水溶液的形式使用,尤其是用于液体试剂的生产。所有提到的酸一般都以其水溶性盐,特别是其碱金属盐的形式使用。
[0148]
需要时,有机助洗试剂可以以至多40重量%,特别是至多25重量%,且优选1至8重量%的量存在。接近于上述上限的数量优选用于根据本发明的糊样或液体,特别是含水的试剂中。根据本发明的衣物后处理试剂,如织物柔顺试剂,也可能不含有机助洗试剂。
[0149]
水溶性无机助洗试剂材料尤其是碱金属硅酸盐和聚磷酸盐,优选三磷酸钠。需要时,可以使用水不溶性的、水可分散的无机助洗试剂材料,特别是结晶或无定形的碱金属铝硅酸盐,其数量为至多50重量%,优选不多于40重量%,并且在液体组合物中,特别是1至5重量%。在其中,优选以去污试剂质量的结晶铝硅酸钠,特别是沸石a、p和任选的x。接近于上述上限的数量优选用于固体微粒去污试剂中。合适的铝硅酸盐特别地不具有粒径大于30μm的颗粒,并且优选由至少80重量%的尺寸小于10μm的颗粒组成。
[0150]
关于上述铝硅酸盐的合适替代物或部分替代物是结晶碱金属硅酸盐,其可以单独存在或与无定形硅酸盐混合存在。可以在根据本发明的试剂中用作助洗试剂的碱金属硅酸盐,优选具有低于0.95,特别是1:1.1至1:12的碱金属氧化物与sio2的摩尔比,并且可以是无定形或结晶的。优选的碱金属硅酸盐是硅酸钠,特别是无定形硅酸钠,具有1:2至1:2.8的na2o:sio2摩尔比。可以单独存在或与无定形硅酸盐混合存在的结晶硅酸盐,优选为通式
na2si
x
o
2x+1
·
y h2o的结晶层状硅酸盐,其中所谓的模量x为1.9至4的数目,并且y为0至20的数目,并且关于x的优选值为2、3或4。优选的结晶层硅酸盐是其中x在所提到的通式中具有值2或3的那些。特别地,β
‑
和δ
‑
二硅酸钠(na2si2o5·
y h2o)两者均为优选的。也可以在根据本发明的试剂中使用这样的结晶碱金属硅酸盐,其实际上是无水的,并且由无定形碱金属硅酸盐制备,并且具有上述通式,其中x为1.9至2.1的数目,并且也由无定形碱金属硅酸盐制备。在本发明的另一个优选实施方案中,使用模量为2至3的结晶钠层硅酸盐,因为它可以由砂和苏打灰生产。具有在1.9至3.5范围内的模量的结晶硅酸钠用于本发明的另一个优选实施方案中。如果还存在碱金属铝硅酸盐,特别是沸石作为另外的助洗试剂,则在每种情况下,基于无水活性物质,铝硅酸盐与硅酸盐的重量比优选为1:10至10:1。在含有无定形和结晶碱金属硅酸盐两者的试剂中,无定形碱金属硅酸盐与结晶碱金属硅酸盐的重量比优选为1:2至2:1,且特别是1:1至2:1。
[0151]
需要时,助洗试剂优选以至多60重量%,特别是5至40重量%的量存在于根据本发明的试剂中。水溶性助洗试剂在液体制试剂中是特别优选的。根据本发明的衣物后处理试剂,例如织物柔顺试剂,优选不含无机助洗试剂。
[0152]
在本发明的意义上,聚合物增稠试剂是充当聚电解质的聚羧酸盐,优选丙烯酸的均聚物和共聚物,特别是丙烯酸共聚物,例如丙烯酸
‑
甲基丙烯酸共聚物,以及多糖,特别是杂多糖,以及其它常规的增稠聚合物。
[0153]
合适的多糖或杂多糖是多糖橡胶,例如阿拉伯树胶、琼脂、海藻酸盐、角叉菜胶及其盐、瓜尔胶、半乳甘露聚糖、黄蓍胶、结冷胶、ramsan、右旋糖酐或黄原胶及其衍生物,例如丙氧基化瓜尔胶以及其混合物。可替代地,但优选地,除多糖橡胶之外,还可以使用进一步的多糖增稠试剂,例如淀粉或纤维素衍生物,例如不同起源的淀粉和淀粉衍生物,例如羟乙基淀粉、淀粉磷酸酯或淀粉乙酸盐,或羧甲基纤维素或其钠盐,甲基、乙基、羟乙基、羟丙基、羟丙基甲基或羟乙基甲基纤维素或乙酸纤维素。
[0154]
适合作为聚合物增稠试剂的丙烯酸聚合物是例如丙烯酸与聚烯基聚醚,特别是蔗糖、季戊四醇或丙烯的烯丙基醚交联的高分子均聚物(inci卡波姆),其也被称为羧乙烯基聚合物。
[0155]
然而,下述丙烯酸共聚物是特别合适的聚合物增稠试剂:(i)选自丙烯酸、甲基丙烯酸及其单酯的两种或更多种单体的共聚物,优选由c1‑4链烷醇形成(inci丙烯酸酯共聚物),例如甲基丙烯酸、丙烯酸丁酯和甲基丙烯酸甲酯的共聚物(cas 25035 69 2),或者丙烯酸丁酯和甲基丙烯酸甲酯的共聚物(cas 25852 37 3);(ii)交联的高分子丙烯酸共聚物,包括例如c
10
‑
30
烷基丙烯酸酯与蔗糖或季戊四醇的烯丙基醚交联的共聚物,其中一种或多种单体选自丙烯酸、甲基丙烯酸及其单酯(inci丙烯酸酯/c
10
‑
30
烷基丙烯酸酯交联聚合物),优选由c1‑4链烷醇形成。
[0156]
基于试剂的总重量,聚合物增稠试剂的含量通常不多于8重量%,优选0.1至7重量%,特别优选0.5至6重量%,特别是1至5重量%,且最优选1.5至4重量%,例如2至2.5重量%。
[0157]
可以添加如例如可以商品名dsc获得的,一种或多种二羧酸和/或其盐,特别是己二酸、琥珀酸和戊二酸的na盐的组合物,以稳定特别是具有高表面活性试剂含量的根据本发明的试剂。基于试剂的总重量,它有利地以0.1至8重量%,优选0.5至7重量%,
特别是1.3至6重量%,且特别优选2至4重量%的数量在此处使用。
[0158]
然而,如果可以省去其使用,则本发明优选不含二羧酸(盐)。
[0159]
本发明的一个进一步方面涉及用于清洁纺织品的方法,其特征在于至少一个方法步骤涉及根据本发明的试剂的使用。纺织品优选地含有聚酯或由聚酯组成。
[0160]
在各个实施方案中,上述方法的特征在于本发明在0
‑
100℃,优选0
‑
80℃,进一步优选20
‑
60℃且最优选20
‑
40℃的温度下使用。
[0161]
这包括手动方法和机械方法两者,其中机械方法是优选的。用于清洁纺织品的方法的特征一般在于,在许多方法步骤中,将各种去污试剂活性物质施加于待清洁的材料,并且在接触时间后洗去,或者待清洁的材料以其它方式用洗涤试剂或这种试剂的溶液分别稀释物进行处理。通过施加根据本发明的洗涤试剂或清洁试剂,所有可设想的洗涤或清洁方法可以在至少一个方法步骤中富集,然后代表本发明的实施方案。关于根据本发明的试剂描述的所有事实、目的和实施方案也适用于本发明的这个方面。因此,在适当的地方明确地参考本公开内容,并且注意该公开内容也适用于根据本发明的上述方法。
[0162]
由于酶天然地已经具有催化活性,并且在否则没有清洁能力的介质中(如例如在纯缓冲液中)也显示了这种活性,因此此类方法的单个步骤和/或唯一步骤可以由以下组成:优选在缓冲溶液或水中,使作为唯一的活性清洁组分的角质酶与污物接触。这是本发明的另一个实施方案。
[0163]
本发明的这个方面的替代方案也是用于处理纺织品原料或用于纺织品护理的方法,其中至少一个方法步骤活化了根据本发明的试剂。这些包括用于纺织品原料,具有合成组分的纤维或纺织品,且尤其是具有聚酯的那些的方法。
[0164]
此外,本发明还包括本文所述的试剂,例如作为如上所述的洗涤试剂或清洁试剂,用于例如来自纺织品,特别是聚酯纺织品的污渍的(改善)去除的用途。
[0165]
最后,本发明还涉及角质酶改善洗涤试剂或清洁试剂,优选去污试剂,特别优选液体去污试剂的抗起球效应和/或用于改善抗灰色效应的用途,该试剂含有角质酶。角质酶是如本文定义的角质酶。在其用途的各个实施方案中,角质酶以0.00001至1重量%的量,优选以0.0001至0.5重量%的量,特别优选以0.001至0.1重量%的量存在于试剂中。在进一步的实施方案中,将导致起球效应减少的角质酶施加于纺织品,特别是由聚酯组成或包含聚酯的纺织品。
[0166]
关于根据本发明的试剂和角质酶描述的所有事实、目的和实施方案也适用于本发明的其它方面。因此,在此处明确地在适当的地方参考本公开内容,并且注意该公开内容也适用于根据本发明的上述方法和根据本发明的用途。
[0167]
实施例
[0168]
实施例1:克隆和表达
[0169]
可以在选自大肠杆菌(escherichia coli)(大肠杆菌(e.coli))、枯草芽孢杆菌(bacillus subtilis)和地衣芽孢杆菌(bacillus licheniformis)的系统中,进行用于根据本发明的试剂中的角质酶的克隆和表达。
[0170]
在大肠杆菌中的表达
[0171]
大肠杆菌bl21(plys)和bl21 de3
[0172]
载体(6,162bp):pet_22b
[0173]
亚克隆位点:ndei/xhoi(802bp)
[0174]
表达载体的制备
[0175]
合成了编码具有角质酶样酯酶活性的蛋白质的核苷酸序列,并且将其亚克隆到pet_22b载体主链中的限制性位点ndei和xhoi处。该序列也包括在c末端处的his标签进行亚克隆。该序列对于其在大肠杆菌中的表达进行密码子优化。原始序列先前从基因文库中分离,所述基因文库使用衍生自叶堆肥的宏基因组构建。(wo 2012/099018 a1)。将载体转化到大肠杆菌bl21 de3内。通过限制性酶切图谱和测序来确认质粒的序列。
[0176]
大肠杆菌表达
[0177]
在使用由pet_22b
‑
酯酶3
‑
13转化的大肠杆菌bl21 de3的摇瓶中的培养条件:使菌株在3ml具有氨苄青霉素(100μg/ml)的lb培养基(1%(w/v)bacto胰蛋白胨、0.5%(w/v)酵母提取物和1%(w/v)nacl)中,在37℃和180rpm下培养12小时。将1ml这种培养物用于接种在500ml摇瓶中的100ml lb氨苄青霉素。一旦培养物在600nm处的od达到0.9,则使用在0.9的od(600nm)下进行的0.5mm iptg诱导表达。将温度降低至30℃,并且将培养物诱导4小时。
[0178]
角质酶样酯酶的活性通过p
‑
npc的水解以分光光度法进行测定。在37℃下监控在410nm处增加的吸光度5分钟。经过测量期间,吸收率的变化必须是线性的。
[0179]
在大肠杆菌中的变体生产
[0180]
两者均在大肠杆菌bl21de3中表达的角质酶样酯酶变体在5l生物反应器中生产,所述生物反应器以3l工作体积操作。在48小时分批补料发酵后,收获细胞,并且通过离心来分开上清液级分和团块级分(生物质)。
[0181]
下游加工
[0182]
使用超声波和进一步的离心(20分钟,8,000rpm,4℃)来破坏生物质。将上清液在70℃下加热10分钟,并且在15,000rpm、4℃下离心20分钟,以去除不溶性级分。
[0183]
实施例2:洗涤测试
[0184]
使用的去污试剂基质
[0185]
商购可得的去污试剂基质(不含香料和染料)已用于洗涤测试:
[0186]
[0187][0188]
确定酶的抗起球性能的洗涤测试
[0189]
在商购可得的洗衣机中,已相继进行了20次等同测试。各种聚酯和混合纺织品已用作待评估的纺织品,所述纺织品已相对于新的预起球。在20个测试洗涤循环后,已目视评价了预起球织物的起球减少和新织物的起球形成。
[0190]
预起球织物已通过在商购可得的洗衣机中在40℃下的10倍重复洗涤循环而产生。
[0191]
在每个洗涤循环后,完成的衣物已在烘干机中进行干燥。
[0192]
洗涤条件
[0193]
具有16
°
dh的水,2.5kg干净衣物,40℃标准程序,50ml如上的去污试剂/机器
[0194]
待评估的角质酶的试剂量:50mg活性酶/洗衣机
[0195]
样品1:仅如上所述的去污试剂(比较实施例)
[0196]
样品2:去污试剂+50mg变体1(本发明实施例)
[0197]
样品3:去污试剂+50mg变体2(本发明实施例)
[0198]
样品4:去污试剂+50mg根据seq id no:1的野生型角质酶
[0199]
关于新的100%聚酯纺织品在20个洗涤循环后的结果:
[0200]
起球形成的目视确定,等级1
‑
5,非常高的起球形成=1,无起球=5
[0201]
样品1:1.0
[0202]
样品2:4.4
[0203]
样品3:4.4
[0204]
样品4:2.6
[0205]
0.5个单位的变化被视为有意义的。
[0206]
关于预起球的100%聚酯纺织品在20个洗涤循环后的结果:
[0207]
起球形成的目视确定,等级1
‑
5,非常高的起球形成=1,无起球=5
[0208]
样品1:1.0
[0209]
样品2:2.8
[0210]
样品3:2.7
[0211]
样品4:1.1
[0212]
0.5个单位的变化被视为有意义的。
[0213]
根据本发明的角质酶显著改善了起球外观。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1