包含互补部分的修饰寡核苷酸的制造方法与流程
discriminates rna versus dnadamage.molecular cell,16(2),211
‑
221.非专利文献4:nandakumar j,ho ck,lima cd,shuman s.2004.rna substrate specificity and structure
‑
guided mutational analysis ofbacteriophage t4 rna ligase 2.j biol chem 279:31337
‑
31347.非专利文献5:jayaprakash k.nair,et al.(2014),multivalent n
‑
acetylgalactosamine
‑
conjugated sirna localizes in hepatocytes and elicits robust rnai
‑
mediated gene silencing.j.am.chem.soc.,136,16958
‑
16961.非专利文献6:mihaela
‑
carmen unciuleac and stewart shuman(2019),rna21:824
‑
832。
技术实现要素:
6.发明所要解决的技术问题本发明的目的是提供sirna、异源双链寡核苷酸等含互补部分的寡核苷酸的有效的制造方法。
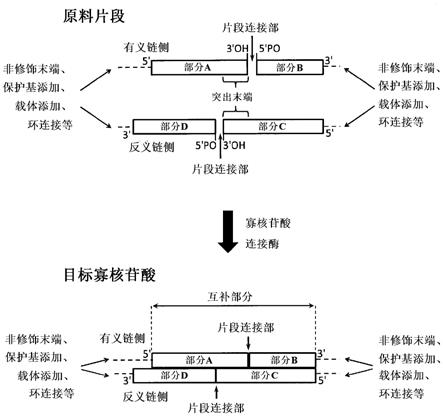
7.解决技术问题所采用的技术方案本发明人等进行了认真探讨后,结果发现,通过用寡核苷酸连接酶对与将作为目标的含互补部分的寡核苷酸的两个互补部分切割而得的片段对应的4个以上的寡核苷酸原料片段进行处理,可直接构建双链等的含互补部分的寡核苷酸,与固相合成等串联合成法相比,能够以更高的制造效率、更高的纯度进行制造等,从而完成了本发明。
8.以往,sirna等较短的双链寡核苷酸,因为化学合成容易且简便,所以通过化学合成来制造。具体来说,通过对构成的2条寡核苷酸链分别进行化学合成(例如,固相合成),将它们纯化后,使两条链退火来进行制造。因此,使用酶法缩合的方法鲜有报道,其中,由4个以上的寡核苷酸原料片段进行酶法合成的方法仅报道有制造长度为28个碱基以上的较长链的双链寡核苷酸的方法。对于较短的寡核苷酸,用于其制造的寡核苷酸原料片段的碱基长度也自然会变短,但认为碱基长度较短的寡核苷酸原料片段退火能力也下降。如果构成的核苷酸被修饰,则还认为退火能力会进一步下降。因此,对于使用连接酶的酶法寡核苷酸合成方法,寡核苷酸原料片段的退火能力被认为很重要,所以以往没有人尝试过使用连接酶合成作为4个以上的寡核苷酸原料片段的长度少于28个碱基等更短链的寡核苷酸的方法。但是,本发明人等进行了认真探讨后,结果发现,与预想相反,使用连接酶和4个以上的寡核苷酸原料片段的情况下,不受退火能力影响,可首尾完好地制造长度少于28个碱基的双链寡核苷酸。此外,短链寡核苷酸的情况下,还发现所制造的寡核苷酸的纯度也提高等,从而完成了本发明。
9.即,本发明如下;[1]包含长度为11~27个碱基的互补部分的修饰寡核苷酸的制造方法,其中,该方法包括:在寡核苷酸连接酶的存在下,对合计4个以上的寡核苷酸原料片段进行处理,该合计4个以上的寡核苷酸原料片段相当于将该修饰寡核苷酸在满足下述条件(i)~(v)的片段连接部进行切割的情况下得到的寡核苷酸原料片段:(i)在互补部分的各链侧中分别存在1个以上的片段连接部,并且在该修饰寡核苷酸中存在合计2个以上的片段连接部;
(ii)将该修饰寡核苷酸在片段连接部进行切割的情况下,在互补部分中形成突出末端,并且该突出末端的长度为1~10个碱基;(iii)至少1个寡核苷酸原料片段包含修饰核苷酸;(iv)该合计4个以上的寡核苷酸原料片段中的4个寡核苷酸原料片段包含长度为5~25个碱基的互补部分;并且(v)与寡核苷酸原料片段的互补部分的各链侧对应的碱基长度的合计均为11~27个碱基长度;[2]根据[1]的方法,其中,(ii)中的突出末端的长度为2~6个碱基;[3]根据[1]或[2]的方法,其中,(iv)中规定的4个寡核苷酸原料片段的互补部分中的除突出末端以外的部分的长度为4~16个碱基;[4]根据[1]~[3]中任一项的方法,其中,寡核苷酸连接酶为rna连接酶;[5]根据[4]的方法,其中,寡核苷酸连接酶为双链rna连接酶;[6]根据[5]的方法,其中,双链rna连接酶为rnl2家族或rnl5家族的rna连接酶;[7]根据[1]~[6]中任一项的方法,其中,修饰寡核苷酸包含修饰型核苷酸残基;[8]根据[7]的方法,其中,修饰型核苷酸残基为:1'、2'、3'或4'化学修饰型核苷酸残基、5'
‑
或3'
‑
磷酸基修饰型核苷酸残基、交联型修饰型核苷酸残基、载体(carrier)添加修饰型核苷酸残基、或者糖骨架取代型核苷酸残基;[9]根据[8]的方法,其中,修饰型核苷酸残基为下列残基:i)1'、2'、3'或4'位被c
1~6
烷基氧基c
1~6
亚烷基、
‑
o
‑
c
1~6
烷基、
‑
o
‑
c
6~14
芳基、
‑
c
‑
芳基、卤素原子、
‑
o
‑
c
1~6
烷基n
‑
酰胺c
1~6
亚烷基、
‑
o
‑
c
1~6
烷基
‑
(c
1~6
烷基
‑
)氨基
‑
c
1~6
亚烷基、或
‑
o
‑
氨基c
1~6
烷基(例如是
‑
o
‑
氨基丙基、
‑
o
‑
ap)取代的1'、2'、3'或4'化学修饰型核苷酸残基;ii)羟基可被保护基取代的、被
‑
o
‑
p(s)(oh)2、
‑
nh
‑
p(o)(oh)2、或
‑
nh
‑
p(s)(oh)2取代的5'
‑
或3'
‑
磷酸基修饰型核苷酸残基;iii)2'位和4'位被2'
‑
o
‑
c
1~6
亚烷基
‑
4'、2'
‑
o
‑
亚乙基
‑
4'、2'
‑
o
‑
甲基取代亚甲基
‑
4'、2'
‑
o
‑
c
1~6
亚烷基
‑
o
‑
c
1~6
亚烷基
‑
4'、2'
‑
o
‑
n(r)
‑
c
1~6
亚烷基
‑
4'(在此,r表示甲基、氢原子或苄基)、2'
‑
n(r)
‑
c(o)
‑
4'、2'
‑
nh
‑
c
1~6
亚烷基
‑
4'、或2'
‑
c
1~6
亚烷基
‑
4'取代,或者3'位和5'位被3'
‑
c
1~6
亚烷基
‑
5'取代的交联型修饰型核苷酸残基;或者iv)己糖醇核酸(hna)残基、环己烯基核酸(cena)残基、或吗啉代核酸(pmo)残基;[10]根据[1]~[9]中任一项的方法,其中,选自合计4个以上的寡核苷酸原料片段中的任意的2个寡核苷酸原料片段的总摩尔比为0.5~2;[11]根据[1]~[10]中任一项的方法,其中,在10mm以下的一价阳离子盐浓度下处理寡核苷酸原料片段;[12]根据[1]~[11]中任一项的方法,其中,在进行所述处理之前,不进行将寡核苷酸原料片段混合溶液置于高温下并在其后进行冷却的操作;[13]根据[1]~[12]中任一项的方法,其中,所述修饰寡核苷酸的杂质的生成被抑制;[14]根据[1]~[13]中任一项的方法,其中,进一步包括纯化所述修饰寡核苷酸。
[0010]
发明的效果
根据本发明的方法,可有效地以高纯度制造sirna、异源双链寡核苷酸等修饰寡核苷酸。
[0011]
附图的简单说明[图1]图1是表示本发明的结构的一例的示意图;[图2
‑
1]图2
‑
1~图2
‑
6是表示实施例1中利用t4 rna连接酶2使得用于生成相同sirna的6种模式(pattern)(组合编号1~6)的4个片段的短链天然型rna的组合进行反应时的对应于t4 rna连接酶2浓度的sirna的生成量的图表;[图2
‑
2]图2
‑
1~图2
‑
6如上所述;[图2
‑
3]图2
‑
1~图2
‑
6如上所述;[图2
‑
4]图2
‑
1~图2
‑
6如上所述;[图2
‑
5]图2
‑
1~图2
‑
6如上所述;[图2
‑
6]图2
‑
1~图2
‑
6如上所述;[图3
‑
1]图3
‑
1~图3
‑
4是表示实施例2中利用t4 rna连接酶2使4个片段的短链天然型rna的组合进行反应时的各反应温度下的sirna的生成量的经时变化的图表;[图3
‑
2]图3
‑
1~图3
‑
4如上所述;[图3
‑
3]图3
‑
1~图3
‑
4如上所述;[图3
‑
4]图3
‑
1~图3
‑
4如上所述;[图4]图4是表示实施例3中各t4 rna连接酶2浓度下由修饰型rna生成的sirna和寡核苷酸可信制品(標品,真实制品)的基于hplc分析的确认的图;[图5]图5是表示实施例5中的不存在酶、以及在来源于耐放射异常球菌(deinococcus radiodurans)的rna连接酶(drarnl)存在下的反应产物以及rna可信制品(有义链和反义链)的基于hplc的分析图谱的图;[图6]图6是表示实施例6中的反应产物的示意图、以及不存在酶和在t4 rna连接酶2的存在下的反应产物的基于hplc的分析图谱的图;[图7]图7是表示4个寡核苷酸原料片段(包括含错配碱基对的寡核苷酸原料片段)与由其生成的双链修饰寡核苷酸的关系的图;[图8]图8是表示5个或6个寡核苷酸原料片段与由其生成的双链修饰寡核苷酸的关系的图;[图9]图9是表示对于使用5个或6个寡核苷酸原料片段的反应中的双链修饰寡核苷酸的生成的基于hplc分析的确认的图;[图10]图10是表示包括在5'末端添加有dmtr基的寡核苷酸原料片段的4个寡核苷酸原料片段与由其生成的双链修饰寡核苷酸的关系的图;[图11]图11是表示包括在5'末端添加有载体的寡核苷酸原料片段的4个寡核苷酸原料片段与由其生成的双链修饰寡核苷酸的关系的图;[图12]图12是表示将核苷酸残基的连接部的磷酸基替换为硫代磷酸基的4个寡核苷酸原料片段与由其生成的双链修饰寡核苷酸的关系的图;[图13]图13是表示4个寡核苷酸原料片段与由其生成的发夹型修饰寡核苷酸的关系的图;[图14]图14是表示用于比较寡核苷酸原料片段中的突出末端的碱基长度对反应
性的影响的4个寡核苷酸原料片段与由其生成的双链修饰寡核苷酸的关系的图;[图15]图15是表示用于比较产物的碱基长度对反应性的影响的4个寡核苷酸原料片段与由其生成的双链修饰寡核苷酸的关系的图;[图16]图16是表示用于探讨高浓度底物时的反应初速度的4个寡核苷酸原料片段与由其生成的双链修饰寡核苷酸的关系的图;[图17]图17是表示用于比较产物的碱基长度的4个寡核苷酸原料片段与由其生成的双链修饰寡核苷酸的关系的图。
具体实施方式
[0012]
(本发明的概要)以下,对本发明进行说明。为了方便本发明的说明,将本发明的结构的一例示于图1的示意图。但是,该示意图仅仅是用于说明本发明的示例,并不对本发明进行限定。
[0013]
本发明提供含长度为11~27个碱基的互补部分的修饰寡核苷酸(以下也称为“目标修饰寡核苷酸”等)的制造方法。本发明的方法包括:在寡核苷酸连接酶的存在下,对作为原料的合计4个以上的寡核苷酸原料片段进行处理,生成目标修饰寡核苷酸。以下,对通过本发明的方法制造的目标修饰寡核苷酸、用于本发明的方法的寡核苷酸原料片段和寡核苷酸连接酶、以及、用于实施本发明的方法的处理的各条件等进行详细说明。
[0014]
(目标修饰寡核苷酸)通过本发明的方法制造的目标修饰寡核苷酸为包含长度为11~27个碱基的互补部分的修饰寡核苷酸。
[0015]“寡核苷酸”是指包含核苷酸残基作为单体单元的寡聚物。作为“寡核苷酸”,可列举例如寡聚rna、寡聚dna、和rna
‑
dna杂合寡核苷酸。
[0016]
寡核苷酸可分类成“天然型寡核苷酸”和“修饰寡核苷酸”。“天然型寡核苷酸”是指由构成细胞中包含的多聚核苷酸(rna和dna)的核苷酸残基(腺苷(a)、鸟苷(g)、胞苷(c)、尿苷(u)、脱氧腺苷(da)、脱氧鸟苷(dg)、脱氧胞苷(dc)、胸苷(dt),以下称为“天然核苷酸残基”)构成的寡核苷酸。“修饰寡核苷酸”是指除“天然型寡核苷酸”以外的寡核苷酸,是包含除天然型核苷酸残基以外的构成要素(以下称为“修饰残基”)的寡核苷酸。作为修饰残基,可列举例如修饰型核苷酸残基、氨基酸残基、接头(linker)。作为修饰型核苷酸残基,可列举例如包含后述的修饰的核苷酸残基。氨基酸中包括氨基酸的衍生物。作为氨基酸,可列举甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、甲硫氨酸、苯丙氨酸、色氨酸、丝氨酸、苏氨酸、天冬酰胺、谷氨酰胺、酪氨酸、半胱氨酸、天冬氨酸、谷氨酸、组氨酸、赖氨酸、精氨酸、及它们的衍生物。氨基酸的衍生物是指氨基酸中的任意的原子或基团被其他的原子或基团取代而得的氨基酸,可列举例如:氨基酸中的氢原子、羧基中的氢原子、氧原子、羟基、侧链中的任意的原子或基团、或者与骨架碳原子(例如,α
‑
、β
‑
、γ
‑
、δ
‑
碳原子)结合的氢原子被其他的原子(例如,氟原子、氯原子、溴原子、碘原子等卤素原子)或基团(例如,后述的化学修饰中的取代后的取代基)取代而得的氨基酸。
[0017]“修饰型核苷酸残基”中的“修饰”包括:核苷酸残基的糖部分(核糖或脱氧核糖)的取代基的取代、核苷酸残基的糖部分本身(糖骨架)的取代、以及核苷酸残基的核酸碱基部分的修饰(例如,核酸碱基部分的取代基的取代)。
[0018]
作为“核苷酸残基的糖部分的取代基的取代”,可列举例如:1'
‑
h、2'
‑
oh(仅核糖)、2'
‑
h、3'
‑
oh、3'
‑
nh2、3'
‑
h、3'
‑
磷酸基、4'
‑
h、5'
‑
磷酸基、或它们的组合的取代。在此,“磷酸基”不仅限于
‑
o
‑
p(o)(oh)2,还包括氧原子替换为硫原子或nh的基团(例如,
‑
o
‑
p(s)(oh)2、
‑
nh
‑
p(o)(oh)2、
‑
nh
‑
p(s)(oh)2)。此外,磷酸基中的羟基(
‑
oh)置换为or
*
(式中,r
*
表示磷酸基的保护基等有机基团)的基团(例如被保护的磷酸基)也包括在上述“磷酸基”内。作为这样的取代(置换),可列举例如:1'、2'、3'或4'
‑
化学修饰(在1'、2'、3'或4'
‑
位取代为其他取代基)、5'
‑
或3'
‑
磷酸基修饰(5'
‑
或3'
‑
磷酸基取代为其他取代基)、交联型修饰(将1'、2'、3'或4'位的2个相互交联的取代)、和载体添加修饰(在1'、2'、3'、4'或5'位取代为载体)。
[0019]
例如可为了使寡核苷酸的耐分解性提高而引入化学修饰。作为化学修饰中的取代后的取代基,可列举例如:c
1~6
烷基氧基c
1~6
亚烷基(例如,甲氧基乙基:moe)、
‑
o
‑
c
1~6
烷基(例如,
‑
o
‑
me)、
‑
o
‑
c
6~14
芳基(例如,
‑
o
‑
苯基)、
‑
c
‑
芳基(例如,
‑
c
‑
苯基)、卤素原子(例如,氟原子)、
‑
o
‑
c
1~6
烷基n
‑
酰胺c
1~6
亚烷基(例如,
‑
o
‑
n
‑
甲基乙酰胺、
‑
o
‑
nma)、
‑
o
‑
c
1~6
烷基
‑
(c
1~6
烷基
‑
)氨基
‑
c
1~6
亚烷基(例如,
‑
o
‑
二甲基氨基乙氧基乙基、
‑
o
‑
dmaeoe)、和
‑
o
‑
氨基c
1~6
烷基(例如,
‑
o
‑
氨基丙基、
‑
o
‑
ap)。化学修饰较好是2'
‑
化学修饰(2'位的取代)、3'
‑
化学修饰(3'位的取代),其中,更好是2'
‑
化学修饰(2'位的取代)。作为2'
‑
化学修饰中的取代后的取代基,可列举例如2'
‑
c
1~6
烷基氧基c
1~6
亚烷基(例如,2'
‑
甲氧基乙基)、2'
‑
o
‑
c
1~6
烷基(例如,2'
‑
o
‑
me)、2'
‑
o
‑
c
6~14
芳基(例如,2'
‑
o
‑
苯基)、2'
‑
c
‑
芳基(例如,2'
‑
c
‑
苯基)、2'
‑
卤素原子(例如,2'
‑
f)、2'
‑
o
‑
c
1~6
烷基n
‑
酰胺c
1~6
亚烷基(例如,2'
‑
o
‑
n
‑
甲基乙酰胺、2'
‑
o
‑
nma)、2'
‑
o
‑
c
1~6
烷基
‑
(c
1~6
烷基
‑
)氨基
‑
c
1~6
亚烷基(例如,2'
‑
o
‑
二甲基氨基乙氧基乙基、2'
‑
o
‑
dmaeoe)、和2'
‑
o
‑
氨基c
1~6
烷基(例如,2'
‑
o
‑
氨基丙基、2'
‑
o
‑
ap)。作为3'
‑
化学修饰中的取代后的取代基,可列举例如3'
‑
o
‑
p(o)(oh)2、3'
‑
o
‑
p(s)(oh)2、3'
‑
nh
‑
p(o)(oh)2、3'
‑
nh
‑
p(s)(oh)2、和磷酸基中的羟基(
‑
oh)被置换为or
*
(式中,r
*
表示后述的磷酸基的保护基等有机基团)的基团。
[0020]
5'
‑
或3'
‑
磷酸基修饰可为了例如使寡核苷酸的耐分解性提高而引入。作为5'
‑
或3'
‑
磷酸基修饰,可列举例如,由磷酸基(
‑
o
‑
p(o)(oh)2),向磷酸基中氧原子被替换为硫原子或nh的基团的取代。作为这样的基团,可列举例如:
‑
o
‑
p(s)(oh)2(硫代磷酸基:硫代磷酸酯型修饰)、
‑
nh
‑
p(o)(oh)2、
‑
nh
‑
p(s)(oh)2。此外,5'
‑
或3'
‑
磷酸基修饰中也包括磷酸基中的羟基(
‑
oh)置换为or
*
(式中,r
*
表示磷酸基的保护基等有机基团)的基团(例如被保护的磷酸基)。作为磷酸基的保护基,可列举例如:三苯甲基(tr)、对甲氧基苯基二苯基甲基(mmtr)、二(对甲氧基苯基)苯基甲基(dmtr)、氰基乙基(cn
‑
c2h4‑
)。
[0021]
交联型修饰(bridging modification,桥连修饰)可为了例如使核苷酸残基的立体结构稳定性提高而引入。作为交联型修饰,可列举例如:2'4'
‑
交联型修饰(将2'
‑
oh与4'
‑
h交联的取代)、3'5'
‑
交联型修饰(将3'
‑
h与5'
‑
h交联的取代)等。作为2'4'
‑
交联型修饰,可列举例如:2'
‑
oh与4'
‑
h取代为2'
‑
o
‑
c
1~6
亚烷基
‑
4'(例如,2'
‑
o
‑
亚甲基
‑
4'(锁核酸:lna)、2'
‑
o
‑
亚乙基
‑
4'(亚乙基交联核酸(ethylene
‑
bridged nucleic acid):ena)、2'
‑
oh与4'
‑
h取代为2'
‑
o
‑
甲基取代亚甲基
‑
4'(约束的乙基交联化核酸(constrained ethyl bridged nucleic acid):bna的一种(cet
‑
bna))、2'
‑
oh与4'
‑
h取代为2'
‑
o
‑
c
1~6
亚烷基
‑
o
‑
c
1~6
亚烷基
‑
4'(例如,2'
‑
o
‑
亚甲基
‑
o
‑
亚甲基
‑
4'(交联化核酸:bna的一种(bna
coc
))、2'
‑
oh与4'
‑
h取代为2'
‑
o
‑
n(r)
‑
c
1~6
亚烷基
‑
4'(例如,2'
‑
o
‑
n(r)
‑
亚甲基
‑
4'(交联化核酸:bna的一种
(bna
nc
),在此,r表示甲基、氢原子或苄基)、2'
‑
nh2与4'
‑
h取代为2'
‑
n(r)
‑
c(o)
‑
4'(例如,2'
‑
n(甲基)
‑
c(o)
‑
4'(酰胺交联核酸:amna))、2'
‑
nh2与4'
‑
h取代为2'
‑
nh
‑
c
1~6
亚烷基
‑
4'(例如,2'
‑
nh
‑
亚甲基
‑
4')、2'
‑
h与4'
‑
h取代为2'
‑
c
1~6
亚烷基
‑
4'(例如,2'
‑
甲基取代亚乙基
‑
4')。此外,作为3'5'
‑
交联型修饰,可列举例如3'
‑
h与5'
‑
h取代为3'
‑
c
1~6
亚烷基
‑
5'(例如,3'
‑
亚乙基
‑
5'(双环核酸:bc核酸),bc核酸的一种:tc核酸等))。
[0022]
载体添加修饰中的载体可以是用于对目标的修饰寡核苷酸提高或赋予稳定性、靶向性、药效等性能的载体。这样的载体可根据使用目的从公知的载体中适当选择。作为载体,可举出例如:n
‑
乙酰半乳糖胺(galnac)、肽、磷酸、胆固醇、生育酚、脂肪链、叶酸。载体添加修饰中的添加部位较好是:相当于目标的修饰寡核苷酸的末端的3'或5'位(部位)。
[0023]
作为包含“核苷酸残基的糖部分本身的取代”的修饰型核苷酸残基(糖骨架取代型核苷酸残基),可列举例如:己糖醇核酸(hna)、环己烯基核酸(cena)等包含寡核苷酸中的五元环的糖向六元环的拟糖(pseudo
‑
sugar)的取代的核苷酸残基。此外,作为包含“核苷酸残基的糖部分本身的取代”的修饰型核苷酸残基,还可列举作为具有不被生物体内的酶(例如,rnase等核酸酶)分解且不诱导免疫应答的吗啉环结构的核苷酸类似人工化合物的吗啉代核酸(pmo)残基。
[0024]
作为“核苷酸残基的核酸碱基部分的修饰”,可列举例如核苷酸残基的核酸碱基部分进行了烷基取代的修饰(例如,胞嘧啶基的5位取代为甲基的修饰)。
[0025]“包含互补部分的寡核苷酸”是指包含互补核苷酸序列相互配对的结构的寡核苷酸。作为“包含互补部分的寡核苷酸”,可列举例如:双链寡核苷酸、包含双链样结构的单链寡核苷酸(例如,发夹型寡核苷酸、哑铃型寡核苷酸等环(loop)型寡核苷酸)。双链寡核苷酸可以是各链为上述寡核苷酸的双链寡核苷酸,可列举例如:双链寡聚rna、双链寡聚dna、由寡聚rna和寡聚dna形成的异源双链寡核苷酸、由寡聚rna和rna
‑
dna杂合寡核苷酸形成的双链寡核苷酸、由寡聚dna和rna
‑
dna杂合寡核苷酸形成的双链寡核苷酸、以及由rna
‑
dna杂合寡核苷酸相互形成的双链寡核苷酸。作为双链寡核苷酸,可列举例如sirna、异源双链寡核苷酸。包含互补部分的寡核苷酸中,将互补核苷酸序列相互配对的部分称为“互补部分”。术语“互补部分”不仅是包含互补部分的寡核苷酸中的互补部分,还指将包含互补部分的寡核苷酸切割为寡核苷酸原料片段的情况下与包含互补部分的寡核苷酸中的互补部分对应的寡核苷酸原料片段中的部分。为了方便,有时将互补部分中的任意一方的互补核苷酸序列称为“有义链”,另一方的互补核苷酸序列称为“反义链”。本发明中,术语“有义”和“反义”仅仅是便于指向互补部分的任意一方及另一方的称呼,并没有生物学上的意义(特别是rnai中的意义)。包含互补部分的寡核苷酸可含环部分,也可不含。“环部分”是指将互补部分的有义侧与反义侧在同一末端侧(例如5'末端和3'末端)连接的接头。包含互补部分的寡核苷酸特别是用于转录后基因沉默(例如,rna干扰(rnai))作用。
[0026]
目标修饰寡核苷酸在互补部分中包含上述的修饰残基。作为目标修饰寡核苷酸,可列举例如:包含修饰型核苷酸残基的双链寡核苷酸或环型寡核苷酸(例如,在互补部分包含修饰型核苷酸残基的双链寡核苷酸或环型寡核苷酸)、在环型部分包含修饰型核苷酸残基或除核苷酸残基以外的残基(例如,氨基酸残基和接头等)的环型寡核苷酸(例如,国际公开第2012/005368号)。目标修饰寡核苷酸中,可以是部分核苷酸残基为修饰型核苷酸残基,也可以是所有核苷酸残基为修饰型核苷酸残基,“修饰型核苷酸残基”为吗啉代核酸(pmo)
残基的情况下,目标修饰寡核苷酸中,较好是部分核苷酸残基为吗啉代核酸(pmo)残基。此外,目标修饰寡核苷酸中包括:作为在其序列两端具有修饰型核苷酸残基且在其序列中央部具有接受rnase的识别的间隙(gap)区域的寡核苷酸的间隙体(gapmer),进而还包括:作为在其序列中混杂有修饰型核苷酸残基的寡核苷酸的混合体(mixmer)、作为其序列中的全部核苷酸残基为修饰型核苷酸残基的寡核苷酸的全修饰型寡核苷酸等的不诱导rnase活性的寡核苷酸。
[0027]
本发明中,目标修饰寡核苷酸中的互补部分的长度为11~27个碱基长度,例如,12~27个碱基长度、15~27个碱基长度、或者18~27个碱基长度。例如,目标修饰寡核苷酸为仅由互补部分形成的双链修饰寡核苷酸的情况下,长度可以为11~27个碱基长度。或者,目标修饰寡核苷酸除具有互补部分之外还具有非互补部分。该情况下,非互补部分的长度可以为1~16个碱基长度,例如1~10个碱基长度,较好是1~5个碱基长度,更好是1、2或3个碱基长度。除具有长度11~27个碱基的互补部分之外还具有非互补部分的目标修饰寡核苷酸中,长度11~27个碱基的互补部分可以是连续形态,也可以是被作为非互补部分的错配碱基对隔断的非连续形态。
[0028]
目标修饰寡核苷酸的合计残基数可根据目标修饰寡核苷酸的功能、本发明的方法中的各条件而适当选择。目标修饰寡核苷酸的合计残基数例如可为24~74。
[0029]
(寡核苷酸原料片段)本发明的方法中用作原料的合计4个以上的寡核苷酸原料片段,可按照对应于将目标修饰寡核苷酸在满足下述条件(i)~(v)的片段连接部(也称“切割部位”)进行切割时所得的寡核苷酸原料片段的方式设计:(i)在互补部分的各链侧中分别存在1个以上的片段连接部,并且在该修饰寡核苷酸中存在合计2个以上的片段连接部;(ii)将该修饰寡核苷酸在片段连接部进行切割的情况下,在互补部分中形成突出末端(也称“粘性末端”),并且该突出末端的长度为1~10个碱基;(iii)至少1个寡核苷酸原料片段包含修饰核苷酸;(iv)该合计4个以上的寡核苷酸原料片段中的4个寡核苷酸原料片段包含长度为5~25个碱基的互补部分;并且(v)与寡核苷酸原料片段的互补部分的各链侧对应的碱基长度的合计均为11~27个碱基长度。
[0030]
寡核苷酸原料片段的数量为4个以上,较好是4~6个(4、5、6个)。寡核苷酸原料片段的数量也可从构成主要与目标修饰寡核苷酸(主要为双链核酸)的有义链和反义链对应的数量的观点进行表征。根据上述条件(i),可理解为这样的主要与有义链和反义链对应的寡核苷酸原料片段的数量分别为2个以上。这样的与有义链和反义链对应的寡核苷酸原料片段的数量可分别为3个片段或4个片段,较好是2个片段或3个片段。上述条件(ii)中的突出末端可以是5'突出末端或3'突出末端中的任何。上述条件(iv)中的“互补部分”是指与目标修饰寡核苷酸中的互补部分对应的寡核苷酸原料片段中的部分。本发明中,术语“片段连接部”与“切割部位”具有相同含义。“片段连接部”(“切割部位”)是指为了便于设计寡核苷酸原料片段的组合而设定的部位,并不是指本发明的方法中实际被切割的部位。上述(iv)中的4个寡核苷酸原料片段可以按照目标修饰寡核苷酸包含长度较好是5~25个碱基长度、
更好是5~20个碱基长度、进一步更好是5~17个碱基长度的互补部分的方式设计。
[0031]
上述条件(iv)中的“互补部分”的碱基长度,只要是可形成配对的碱基长度即可,长度1个碱基以上即可。此外,由于寡核苷酸合成中产物的纯度、收量、制造效率会随着碱基长度的增加而下降,因此较好是全部寡核苷酸原料片段中的4个寡核苷酸原料片段被设计成互补部分的长度为17个碱基以下。构成互补部分的2条链的长度较好是5~25个碱基长度,例如5~22个碱基长度、5~20个碱基长度、5~17个碱基长度、8~25个碱基长度、8~22个碱基长度、8~20个碱基长度、8~17个碱基长度。
[0032]
突出末端的长度例如为1~10个碱基长度,较好是1~8个碱基长度,更好是1~6个碱基长度,进一步更好是2~6个碱基长度、3~6个碱基长度或4~6个碱基长度。
[0033]
上述条件(iv)中的“互补部分”的碱基长度的数值和突出末端的碱基长度的数值设定为满足上述的范围且相互整合(匹配)的值。例如,突出末端的长度为5个碱基的情况下,为了形成突出末端,互补部分的长度可为6~25个碱基;例如,突出末端的长度为6个碱基的情况下,为了形成突出末端,互补部分的长度可为7~25个碱基。
[0034]
上述条件(iv)中所规定的4个寡核苷酸原料片段的“互补部分”中的除突出末端以外的部分的长度较好是4~24个碱基长度、4~21个碱基长度、4~19个碱基长度、或4~16个碱基长度。
[0035]
特定的实施方式中,上述条件(iv)中所规定的4个寡核苷酸原料片段的长度分别可为5个碱基长度以上,较好是6个碱基长度以上,更好是7个碱基长度以上,进一步更好是8个碱基长度以上,特别好是9个碱基长度以上。这样的4个寡核苷酸原料片段的长度还可为19个碱基长度以下,较好是18个碱基长度以下,更好是17个碱基长度以下,进一步更好是16个碱基长度以下,特别好是15个碱基长度以下。这样的4个寡核苷酸原料片段的长度还可为5~19个碱基长度,较好是6~18个碱基长度,更好是7~17个碱基长度,进一步更好是8~16个碱基长度,特别好是9~15个碱基长度。
[0036]
与目标修饰寡核苷酸的5'末端对应的寡核苷酸原料片段的5'末端,可保持为5'
‑
磷酸基,可取代为5'
‑
oh,也可引入有5'
‑
磷酸基修饰,或者可具有与目标修饰寡核苷酸的5'末端相同的结构。作为5'
‑
磷酸基修饰,可列举例如上述的例子。从采用寡核苷酸连接酶的连接反应的观点来看,除此以外的寡核苷酸原料片段的5'末端较好是保持为5'
‑
磷酸基。与目标修饰寡核苷酸的3'末端对应的寡核苷酸原料片段的3'末端,可保持为3'
‑
oh,可引入有3'
‑
磷酸基修饰,或者可具有与目标修饰寡核苷酸的3'末端相同的结构。作为3'
‑
磷酸基修饰,可列举例如上述的例子。从采用寡核苷酸连接酶的连接反应的观点来看,除此以外的寡核苷酸原料片段的3'末端较好是保持为3'
‑
oh。
[0037]
寡核苷酸原料片段可以是游离的形态,也可以复合物化,还可以固定化。
[0038]
寡核苷酸原料片段可通过公知的化学合成法或酶合成法制造。作为公知的化学合成法,可列举固相合成法或液相合成法、例如国际公开第2012/157723号、国际公开第2005/070859号中记载的方法等。
[0039]
希望向目标修饰寡核苷酸添加功能性部分的情况下,寡核苷酸原料片段可在其对应部分添加有功能性部分。
[0040]
(连接酶处理)寡核苷酸连接酶是使寡核苷酸原料片段相互连接的酶。本发明的方法中,通过寡
核苷酸连接酶的催化作用,寡核苷酸原料片段彼此在“切割部位”(也称“连接部位”)连接,生成目标修饰寡核苷酸。作为寡核苷酸连接酶,可列举例如rna连接酶和dna连接酶。rna连接酶可以是单链rna连接酶或双链rna连接酶中的任何,较好是双链rna连接酶。作为双链rna连接酶,可列举例如rnl2家族的rna连接酶(也称“rna连接酶2”)、rnl5家族的rna连接酶。作为rna连接酶,只要实现本发明的目的,可使用来源于任何生物种或病毒种的rna连接酶,可使用例如来源于t4噬菌体的rna连接酶(t4 rna连接酶1、t4rna连接酶2)。作为dna连接酶,只要实现本发明的目的,可使用来源于任何生物种或病毒种的dna连接酶,可使用例如来源于t4噬菌体的dna连接酶。
[0041]
在寡核苷酸连接酶的存在下的处理(以下称为“连接酶处理”)是通过寡核苷酸连接酶的催化作用使寡核苷酸原料片段连接的反应。连接酶处理的操作是将寡核苷酸原料片段与寡核苷酸连接酶混合。连接酶处理中,可将全部的寡核苷酸原料片段与寡核苷酸连接酶混合,以一步进行连接反应。此外,连接酶处理中,可作为多步连接反应,将部分的寡核苷酸原料片段与寡核苷酸连接酶混合而进行连接反应后,将剩余的寡核苷酸原料片段与反应物混合而进行下一步的连接反应。关于混合,可以是:将寡核苷酸原料片段添加至寡核苷酸连接酶;将寡核苷酸原料片段添加至含寡核苷酸连接酶的体系中;或者,将寡核苷酸原料片段和寡核苷酸连接酶添加至用于反应的体系中。
[0042]
作为进行连接酶处理的体系,可使用水溶液。作为水溶液,较好是缓冲液。作为缓冲液,可列举例如:磷酸缓冲液、tris缓冲液、碳酸缓冲液、乙酸缓冲液、柠檬酸缓冲液。ph可以为例如约5~9。例如,连接酶处理中的寡核苷酸原料片段的浓度高的情况下,ph可为7.5~9.0,例如8.0~8.5。
[0043]
连接酶处理中的各寡核苷酸原料片段的浓度,只要是寡核苷酸原料片段溶解且足以生成目标修饰寡核苷酸的浓度即可。各寡核苷酸原料片段的浓度可为例如1μm以上、10μm以上、50μm以上、100μm以上、300μm以上、500μm以上或1000μm以上。各寡核苷酸原料片段的浓度还可为例如1m、100mm、或10mm以下。特别希望目标修饰寡核苷酸的有效的大量生产的情况下,较好是以上述浓度中的100μm以上的浓度和上述ph范围中的7.5~9.0的ph范围使用各寡核苷酸原料片段。
[0044]
从通过减少未反应的寡核苷酸原料片段量而使制造效率提高的观点来看,连接酶处理中的全部寡核苷酸原料片段的摩尔数较好是基本上等量。为了使全部寡核苷酸原料片段的摩尔数基本上等量,选自合计4个以上的寡核苷酸原料片段中的任意2个寡核苷酸原料片段的总摩尔比可在例如0.5~2、较好是1/1.8~1.8、更好是1/1.5~1.5、进一步更好是1/1.2~1.2、特别好是1/1.1~1.1的范围内。
[0045]
连接酶处理中的寡核苷酸原料片段的浓度只要是足以生成目标修饰寡核苷酸的浓度即可。寡核苷酸连接酶的浓度可为例如0.01u/μl以上,较好是0.02u/μl以上,更好是0.03u/μl以上,进一步更好是0.04u/μl以上。寡核苷酸连接酶的浓度可为例如1u/μl以下,较好是0.5u/μl以下,更好是0.2u/μl以下,进一步更好是0.1u/μl以下。更具体来说,寡核苷酸连接酶的浓度可为例如0.01~1u/μl,较好是0.02~0.5u/μl,更好是0.03~0.2u/μl,进一步更好是0.04~0.1u/μl。
[0046]
进行连接酶处理的体系可包含寡核苷酸连接酶的辅因子。作为寡核苷酸连接酶的辅因子,可列举例如atp、二价金属盐(例如,氯化镁等镁盐)。进行处理的体系可包含寡核苷
酸连接酶的稳定剂。作为寡核苷酸连接酶的稳定剂,可列举例如抗氧化剂(例如,二硫苏糖醇、巯基乙醇等还原剂)。为了保持酶稳定和提高反应速度,进行连接酶处理的体系可包含表面活性剂。作为表面活性剂,可列举例如:非离子性表面活性剂(例如,triton x
‑
100等triton系列的表面活性剂)、以及离子性表面活性剂。作为离子性表面活性剂,可列举例如阳离子性表面活性剂、阴离子性表面活性剂、两性离子表面活性剂。此外,为了提高反应速度,进行连接酶处理的体系可包含聚乙二醇。
[0047]
进行连接酶处理的体系可具有低浓度的一价阳离子盐浓度,或实质上不含一价阳离子盐。进行处理的体系的一价阳离子盐浓度可为例如10mm以下,较好是1mm以下,更好是0.1mm以下,进一步更好是0.01mm以下。特别好是进行处理的体系可实质上不含一价阳离子盐。作为一价阳离子盐,可列举例如锂离子、钠离子、钾离子、铷离子、铯离子、铵离子等一价阳离子与氟离子、氯离子、溴离子、碘离子等阴离子的盐。
[0048]
连接酶处理中的温度只要是足以使寡核苷酸连接酶活化的温度即可。这样的温度可以为例如2~50℃,较好是16~50℃,更好是25~50℃。
[0049]
进行连接酶处理的时间只要是足以生成目标修饰寡核苷酸的时间即可。这样的时间可以为例如1~72小时。
[0050]
根据本发明,对于目标修饰寡核苷酸,可以抑制n
‑
1聚体或n+1聚体等具有目标碱基长度以外的碱基长度的杂质的生成和混入。例如,本发明中,目标修饰寡核苷酸作为单一的双链核酸(例如,sirna、异源双链寡核苷酸)制造。构成这样的单一的双链核酸的有义链和反义链分别为n个和m个的碱基长度。n个和m个的碱基长度分别独立为11~30个碱基长度(例如,18~30个碱基长度)。n个和m个的碱基长度还可分别独立为11~27个碱基长度(例如,18~27个碱基长度)。本发明中,目标修饰寡核苷酸的杂质是指除上述目标修饰寡核苷酸以外的核酸夹杂物。构成这样的核酸夹杂物的有义链和反义链分别不为n个和m个的碱基长度,由(n
±
α)个和m个的碱基长度、n个和(m
±
β)个的碱基长度、或者(n
±
α)个和(m
±
β)个的碱基长度形成。在此,n个和m个与上述相同,α个和β个例如为1个、2个或3个。
[0051]
(其他任意工序)本发明的方法可包括合成寡核苷酸原料片段的工序(例如,固相合成等化学合成)。本发明的方法可抑制除目标修饰寡核苷酸以外的核酸夹杂物的生成,所以可省略从所合成的寡核苷酸原料片段的试样中的目标修饰寡核苷酸的纯化。但是,对于本发明的方法而言,即使在进行了目标修饰寡核苷酸的纯化的情况下,也可抑制因该纯化后可能残存的少量除目标以外的寡核苷酸原料片段导致的双链核酸夹杂物(杂质)的生成,因此也可进行目标修饰寡核苷酸的纯化。这样的纯化例如可通过层析(例如,hplc、iex)、凝胶过滤等方法进行。
[0052]
本发明的方法可在连接酶处理工序之后包括反应停止工序。作为反应停止工序,可列举例如高温处理(例如80℃)和基于酸、碱、有机溶剂的添加的寡核苷酸连接酶失活处理、基于添加edta等螯合剂的辅因子的金属离子的除去。此外,还可列举将酶固定于载体进行反应,通过膜分离将酶从反应液中除去的方法。
[0053]
本发明的方法可在连接酶处理工序之后包括纯化目标修饰寡核苷酸的工序。例如,本工序可通过层析(例如,hplc)、凝胶过滤等任意的适当方法进行。
[0054]
使寡核苷酸原料片段退火(复性)的情况下,一般来说,大多进行下述操作:为了使
寡核苷酸原料片段呈变性状态(非配对状态),将寡核苷酸原料片段混合溶液加热至高温,然后为了形成互补核苷酸序列彼此的配对,通过空冷等将高温的寡核苷酸原料片段混合溶液缓慢冷却。但是,本发明的方法中,在连接酶处理工序之前,不进行这样的为了变性而加热至高温的操作和为了形成配对而进行冷却的处理(加热
‑
冷却处理),可通过简化的操作制造目标修饰寡核苷酸。作为置于高温,可列举例如将寡核苷酸原料片段混合溶液在65℃以上、70℃以上、75℃以上、80℃以上、85℃以上、90℃以上、95℃以上、或100℃以上的温度下保持(例如5分钟以上、或10分钟以上)。作为冷却,可列举例如将寡核苷酸原料片段混合溶液在室温(例如15~25℃、或20~25℃)或者规定的温度(例如37℃)下静置(例如5小时以上),将寡核苷酸原料片段混合溶液在规定的温度(例如37℃)下保持(例如15分钟以上)。
[0055]
为了省略加热
‑
冷却处理,连接酶处理工序之前寡核苷酸原料片段混合溶液置于高温的时间可控制为例如低于5分钟、4.5分钟以下、4分钟以下、3.5分钟以下、3分钟以下、2.5分钟以下、2分钟以下、1.5分钟以下、1分钟以下、或0.5分钟以下。
[0056]
为了省略加热
‑
冷却处理,本发明的方法中,从将寡核苷酸原料片段在溶液中相互混合起至进行连接酶处理工序为止,含寡核苷酸原料片段的溶液可保持于2~50℃。即,本发明的方法中,上述组合所含的全部寡核苷酸原料片段和寡核苷酸连接酶的任何混合和任何混合间的间歇、以及连接酶反应可在2~50℃的条件下进行。这样的实施方式中,本发明的方法包含以下操作:(1)对于存在于不同体系中的上述组合所含的全部寡核苷酸原料片段和寡核苷酸连接酶,全部的混合在2~50℃进行且全部的混合间的间歇中混合物在保持于2~50℃的条件下混合,获得混合溶液;以及(2)将混合溶液在保持于2~50℃的状态下使其反应,获得含目标修饰寡核苷酸的溶液。
[0057]
该实施方式中,上述组合所含的全部寡核苷酸原料片段在不同的体系中获得。该实施方式中,本发明可通过例如将该寡核苷酸原料片段在2~50℃混合而获得寡核苷酸原料片段混合物,将该寡核苷酸原料片段混合物与寡核苷酸连接酶在2~50℃混合来进行。该实施方式中,本发明可通过例如向含寡核苷酸连接酶的溶液中依次在2~50℃添加该寡核苷酸原料片段来进行。
[0058]
本发明的方法可用于例如大规模的目标修饰寡核苷酸的工业化制造。实施例
[0059]
以下,示出实施例对本发明进行更详细的说明,但本发明并不限定于以下的实施例。
[0060]
[实施例1]使用天然型rna的片段的组合模式的比较1)底物和产物可信制品的合成在由4个片段的短链天然型rna以酶法合成sirna的反应中,对该片段的碱基长度的影响进行了评价。作为目标的sirna采用表1的由rna1
‑
s(21聚体)和rna1
‑
a(23聚体)形成的双链(以下分别称为有义链、反义链)。合成表1所示的18种rna片段,使用它们对表2所示的6个模式的片段的组合进行了评价。
[0061]
[表1]表1.供于评价的天然型rna
英文大写字母:表示rna,pho:表示基于磷酸基的5'末端的修饰。
[0062]
[表2]表2.天然型rna的片段的组合1)表示突出末端部位中的有义链侧的序列。
[0063]
2)采用t4 rna连接酶2的连接反应使用4个片段的寡核苷酸通过t4 rna连接酶2(新英格兰生物实验室(new england biolabs))进行了反应。反应液的组成为50mm tris
‑
hcl、2mm mgcl2、1mm二硫苏糖醇、400μm atp、ph7.5,rna片段各10μm,反应液量为10μl。将酶的添加浓度设为0.025、0.05、0.1、0.2u/μl对产物的浓度进行了比较。使用热循环仪在25℃反应1小时后,在80℃加热5分钟而停止反应。
[0064]
3)采用hplc的分析将反应液通过采用xbridge oligonucleotide beh c18柱(沃特世公司(waters),2.5μm,4.6mm
×
50mm)的hplc进行了分析。分析条件设为柱温60℃、检测波长254nm、注射量10μl、流速0.4ml/分钟。流动相通过采用洗脱液a(六氟异丙醇
‑
三乙胺)和洗脱液b(甲醇)的线性梯度进行了分析。有义链和反义链的可信制品也同样地进行分析,从而对连接产物的浓度进行了定量。
[0065]
4)结果各片段的碱基长度的组合中的有义链和反义链的累积示于图2。组合3中连接产物几乎未累积,但其他组合中观察到连接产物的累积随着酶浓度的增加而增大。
[0066]
[实施例2]天然型rna的连接反应中的反应温度的影响的评价对短链的连接反应中反应温度产生的影响进行了探讨。作为底物采用表2的1的寡核苷酸,通过t4 rna连接酶2进行了反应。反应液的组成为50mm tris
‑
hcl、2mm mgcl2、1mm二硫苏糖醇、400μm atp、ph7.5,酶浓度0.2u/μl,rna片段各10μm,反应液量为10μl。反应温度设为16℃、25℃、30℃和37℃,分别反应1、2和4小时后,在80℃加热5分钟而停止反应。按照实施例1中记载的条件通过hplc对反应液所含的连接产物的浓度进行了分析。
[0067]
结果示于图3。反应温度25℃以上时,反应1小时后,有义链、反义链均累积了约10μm的连接产物。另一方面,与25℃以上相比,在16℃时,特别是有义链的连接产物的生成速度低。
[0068]
[实施例3]采用修饰型rna的反应进行(反应进展)的确认1)底物和产物可信制品的合成对由修饰型寡核苷酸中的4个片段开始的sirna的酶法连接反应的进展进行了评价。目标sirna采用由表3所示的有义链(mod1
‑
s)和反义链(mod1
‑
a)形成的双链。该sirna的碱基序列与实施例1和2中使用的天然型rna相同,但所有的残基通过2'
‑
f或2'
‑
o
‑
甲基进行了修饰,部分的磷酸基替换为(取代为)硫代磷酸基。此外,作为各片段,合成了表3所示的4个片段。这4个片段的碱基序列与表2的编号1的组合相同。
[0069]
[表3]表3.用于评价的修饰型rna
英文大写字母:表示rna,pho:表示基于磷酸基的5'末端的修饰,(f):表示基于2'
‑
氟基的修饰,(me):表示基于2'
‑
o
‑
甲基的修饰,^:表示磷酸基替换为硫代磷酸基。
[0070]
2)采用t4 rna连接酶2的连接反应使用4个片段的修饰型rna通过t4 rna连接酶2进行了反应。反应液的组成为50mm tris
‑
hcl、2mm mgcl2、1mm二硫苏糖醇、400μm atp、ph7.5,修饰型rna片段各10μm,反应液量为50μl。将酶的添加浓度设为0.2或1.0u/μl,作为阴性对照在未添加酶的条件下也进行了反应。使用热循环仪在25℃反应1小时后,在80℃加热5分钟而停止反应。
[0071]
3)采用hplc和lc
‑
tof/ms的分析将反应液通过采用acquity uplc oligonucleotide beh c18柱(沃特世公司,2.1
×
100mm,1.7μm)的hplc进行了分析。分析条件设为柱温80℃、检测波长260nm、注射量10μl、流速0.4ml/分钟。流动相通过采用a液(六氟异丙醇
‑
三乙胺)和b液(甲醇)的线性梯度进行了分析。有义链和反义链的可信制品也同样地进行分析,从而确认了连接产物的生成。此外,通过安捷伦6230tof lc/ms系统(安捷伦科技公司)对连接产物进行了质谱分析。
[0072]
4)结果采用hplc的分析的结果示于图4。采用hplc的分析中,通过酶的添加,在与可信制品一致的保留时间获得连接产物的峰,并且与阴性对照相比,底物的修饰型rna的峰面积减少。此外,连接产物的峰面积也随着酶添加量的增加而增加。进而,反应液的采用lc
‑
tof/ms的分析中,在添加酶的条件下观察到有义链和反义链的生成;有义链lc/ms m/z:计算值2266.13,实测值2265.9703[m
‑
3h]3‑
反义链lc/ms m/z:计算值2531.04,实测值2531.0199[m
‑
3h]3‑
。
[0073]
由以上结果显示,采用t4 rna连接酶2,可以由修饰型rna的4个片段生成sirna。
[0074]
[实施例4]采用dna连接酶的反应进行的确认对由修饰型寡核苷酸中的4个片段开始的sirna的酶法连接反应的进行(进展)使
用dna连接酶进行了评价。作为dna连接酶,采用t4 dna连接酶(新英格兰生物实验室)。
[0075]
反应液的组成为dna连接酶50mm tris
‑
hcl、10mm mgcl2、10mm二硫苏糖醇、1mm atp、ph7.5。酶浓度为470nm,寡核苷酸片段分别为10μm,反应液量为30μl。寡核苷酸片段采用表3所示的组合。使用热循环仪在25℃反应,4小时后采集10μl,在80℃加热5分钟而停止反应。按照实施例3中记载的条件通过hplc对反应液所含的连接产物的浓度进行了分析。可信制品也同样地进行分析,从而对连接产物的浓度进行了定量。
[0076]
采用hplc进行了分析,结果确认了连接产物的累积,反应4小时后的累积为有义链为0.58μm,反义链为5.1μm。如上所述,从4个片段的修饰型rna生成sirna的反应在dna连接酶的情况下也进行。
[0077]
[实施例5]耐放射异常球菌(deinococcus radiodurans)rna连接酶的制备和连接反应(1)采用e.coli的重组表达株的构建构建以e.coli表达来源于耐放射异常球菌(deinococcus radiodurans)的属于rnl5家族的rna连接酶drarnl的株,制备纯化酶。首先,通过基因全合成而制成具有将drarnl的氨基酸序列(seq id no:17)以e.coli密码子最优化的碱基序列的质粒,接着将该序列亚克隆于pet16b载体的ndei/bamhi位点。将该表达质粒在e.coli bl21(de3)转化,获得drarnl的表达株。该表达株中,表达在n末端带有his标签(his
‑
tag)的drarnl。
[0078]
(2)重组酶的制备使各表达株在含100mg/l氨苄西林的lb琼脂培养基中于37℃生长(培养)一夜。将所得的菌落接种于含100mg/l氨苄西林的lb培养基100ml,使用坂口烧瓶(sakaguchi flask)进行振荡培养。在37℃培养2小时后,按照以最终浓度计分别达到0.1mm或2%的条件添加iptg和乙醇。进而在17℃培养16小时。
[0079]
培养结束后,从所得的培养液通过离心分离收集菌体,悬浮于由50mm tris
‑
hcl(ph7.6)、250mm nacl、10%蔗糖、15mm咪唑、1%溶菌酶、0.1%triton
‑
x100形成的缓冲液中,进行了超声波破碎。通过离心分离从破碎液中除去菌体残渣,将所得的上清液作为可溶性组分。
[0080]
将所得的可溶性组分供于用所述缓冲液平衡了的带his标签的蛋白质纯化柱histalon superflow cartridge(takara bio inc.),使其吸附于载体。将未吸附于载体的蛋白质(未吸附蛋白质)用由50mm tris
‑
hcl(ph7.6)、250mm nacl、10%蔗糖、15mm咪唑形成的缓冲液冲洗后,用由50mm tris
‑
hcl(ph8.0)、250mm nacl、10%甘油、200mm咪唑形成的缓冲液进行吸附的蛋白质的洗脱。
[0081]
收集含酶的洗脱组分,使用amicon ultra
‑
1510kda(默克密理博公司),将缓冲液置换为由50mm tris
‑
hcl(ph8.0)、200mm nacl、2mm dtt、2mm edta、10%甘油、0.1%tritonx
‑
10形成的缓冲液,制成纯化酶溶液。
[0082]
(3)采用drarnl的连接反应使用4个片段的修饰型rna通过drarnl进行了反应。反应液的组成为50mm tris
‑
hcl(ph7.5)、10mm mnso4、1mm二硫苏糖醇、400μm atp,修饰型rna片段各10μm,反应液量为25μl。修饰型rna片段采用表3的组合。将酶的添加浓度设为72μg/ml,作为阴性对照在未添加酶的条件下也进行了反应。使用热循环仪在25℃反应3小时后,按照最终浓度成为1mm的条件加入edta而停止反应。
[0083]
(4)采用hplc的分析将反应液通过采用acquity hplc oligonucleotide beh c18柱(沃特世公司,2.1
×
100mm,1.7μm)的hplc进行了分析。分析条件设为柱温60℃、检测波长260nm、注射量10μl、流速0.4ml/分钟。流动相通过采用a液六氟异丙醇
‑
三乙胺和b液(甲醇)的线性梯度进行了分析。有义链和反义链的可信制品也同样地进行分析,从而确认了连接产物的生成。
[0084]
采用hplc的分析的结果示于图5。采用hplc的分析中,通过酶的添加,在与可信制品一致的保留时间获得连接产物的峰,并且与阴性对照相比,底物的修饰型rna的峰面积减少。由以上结果显示,采用drarnl,可以由修饰型rna的4个片段生成目标修饰寡核苷酸。
[0085]
[实施例6]具有环结构的修饰寡核苷酸的生成对由4个片段的寡核苷酸通过酶法连接来生成具有环结构的修饰寡核苷酸的反应的进展进行了评价。目标产物和合成的底物片段的序列示于表4。
[0086]
[表4]表4.产物和底物的序列英文大写字母:表示rna,pho:表示基于磷酸基的5'末端的修饰,(f):表示基于2'
‑
氟基的修饰,(me):表示基于2'
‑
o
‑
甲基的修饰,^:表示磷酸基替换为硫代磷酸基,t:表示胸苷;产物为自5'末端向3'末端方向底物片段按照
①②③④
的顺序连接而成的序列。
[0087]
使用表4的4个片段的底物寡核苷酸通过t4 rna连接酶2(新英格兰生物实验室)进行了反应。反应液的组成为50mm tris
‑
hcl、2mm mgcl2、1mm二硫苏糖醇、400μm atp、ph7.5,寡核苷酸片段各10μm,反应液量为100μl。将酶的添加浓度设为17.8μg/μl对产物的浓度进行了比较。作为阴性对照在未添加酶的条件下也进行了反应。使用热循环仪在25℃反应3小时后,在80℃加热5分钟而停止反应。以实施例5的条件通过hplc和lc
‑
tof/ms对反应液进行了分析。
[0088]
采用hplc的分析中,如图6所示,通过酶的添加,与阴性对照相比,底物的修饰型rna的峰面积减少,在保留时间比底物长的位置检出了峰(5.6分钟附近)。进而,反应液的采用lc
‑
tof/ms的分析中,在添加酶的条件下观察到目标产物;lc/ms m/z:计算值2727.33,实测值2727.21[m
‑
6h]6‑
。
[0089]
由以上结果显示,通过t4 rna连接酶2,可以由4个片段生成具有环结构的目标修饰寡核苷酸。
[0090]
[实施例7]由dna链和rna链形成的异源双链的生成通过双链rna连接酶,生成了由修饰型dna链和修饰型rna链形成的异源双链。作为双链rna连接酶,采用t4 rna连接酶2(新英格兰生物实验室)。
[0091]
反应液的组成为50mm tris
‑
hcl、2mm mgcl2、1mm二硫苏糖醇、400μm atp、ph7.5。酶浓度为3.56μg/ml,底物采用表5所示的4个片段的寡核苷酸各10μm,反应液量为40μl。使用热循环仪在37℃反应,18小时后,按照最终浓度成为10mm的条件加入edta而停止反应。作为阴性对照在未添加酶的条件下也进行了反应。按照实施例5中记载的条件通过hplc和lc
‑
tof/ms对反应液所含的连接产物的浓度进行了分析。
[0092]
采用hplc的分析中,通过酶的添加,与阴性对照相比,各底物的峰面积减少,可以新检出2个峰。进而,反应液的采用lc
‑
tof/ms的分析中,添加酶的条件下观察到修饰型dna链和修饰型rna链的生成;修饰型dna链lc/ms m/z:计算值2119.50,实测值2119.34[m
‑
2h]2‑
修饰型rna链lc/ms m/z:计算值2126.89,实测值2126.36[m
‑
2h]2‑
。
[0093]
由以上结果显示,通过t4 rna连接酶2,可以生成由修饰型dna链和修饰型rna链形成的异源双链。
[0094]
[表5]表5.产物和底物的序列英文小写字母:表示dna,英文大写字母:表示rna,mc:表示5
‑
甲基胞苷,pho:表示基于磷酸基的5'末端的修饰,(l):表示锁核酸(lna),(me):表示基于2'
‑
o
‑
甲基的修饰。
[0095]
[实施例8]采用含错配碱基对的寡核苷酸片段的反应对由4个片段的寡核苷酸通过酶法连接来生成在碱基对中具有错配部分的双链修饰寡核苷酸的反应的进展进行了评价。目标产物的各链分别称为a链和b链。将目标产物和合成的底物片段的序列示于表6,将4个片段的组合示于图7。
[0096]
反应液的组成为1.78μg/ml t4 rna连接酶2(新英格兰生物实验室)、50mm tris
‑
hcl、2mm mgcl2、1mm二硫苏糖醇、400μm atp、ph7.5。分别按照最终浓度成为10μm的条件添加作为底物的4个片段的寡核苷酸片段,以40μl的液量进行了反应。使用热循环仪在25℃反应,4小时后,按照最终浓度成为10mm的条件加入edta而停止反应。作为阴性对照在未添加酶的条件下也进行了反应。按照实施例5中记载的条件通过hplc和lc
‑
tof/ms对反应液所含的连接产物的浓度进行了分析。
[0097]
采用hplc的分析中,通过酶的添加,与阴性对照相比,各底物的峰面积减少,可以新检出2个峰。进而,反应液的采用lc
‑
tof/ms的分析中,添加酶的条件下确认了a链和b链的生成;a链lc/ms m/z:计算值1361.77,实测值1361.75[m
‑
5h]5‑
b链lc/ms m/z:计算值1517.41,实测值1517.35[m
‑
5h]5‑
。
[0098]
由以上结果显示,通过t4 rna连接酶2,可以生成具有错配序列的双链修饰寡核苷酸。
[0099]
[表6]表6.产物和底物的序列pho:表示基于磷酸基的5'末端的修饰,英文大写字母:表示rna,(f):表示基于2'
‑
氟基的修饰,(me):表示基于2'
‑
o
‑
甲基的修饰,^:表示硫代磷酸键。
[0100]
[实施例9]采用5个片段和6个片段的寡核苷酸的反应对由5个片段和6个片段的寡核苷酸通过酶法连接来生成双链修饰寡核苷酸的反应的进展进行了评价。目标产物的各链分别称为a链和b链。将目标产物和合成的底物片段的序列示于表7,将4个片段的组合示于图8。
[0101]
反应液的组成为1.78μg/ml t4 rna连接酶2(新英格兰生物实验室)、50mm tris
‑
hcl、2mm mgcl2、1mm二硫苏糖醇、400μm atp、ph7.5。分别按照最终浓度成为10μm的条件添加作为底物的寡核苷酸片段,以30μl的液量进行了反应。使用热循环仪在37℃反应,16小时后,按照最终浓度成为10mm的条件加入edta而停止反应。作为阴性对照在未添加酶的条件下也进行了反应。按照实施例5中记载的条件通过hplc对反应液所含的连接产物的浓度进行了分析。
[0102]
采用hplc的分析中,如图9所示,通过酶的添加,与阴性对照相比,各底物的峰面积减少,可以新检出2个峰。这些峰的保留时间与产物的可信制品一致。
[0103]
由以上结果显示,通过t4 rna连接酶2,可以由5个片段和6个片段的底物寡核苷酸生成双链修饰寡核苷酸。
[0104]
[表7]表7.产物和底物的序列
pho:表示基于磷酸基的5'末端的修饰,英文大写字母:表示rna,(f):表示基于2'
‑
氟基的修饰,(me):表示基于2'
‑
o
‑
甲基的修饰。
[0105]
[实施例10]采用在5'末端添加有dmtr基的寡核苷酸的反应对由包括“在5'末端添加有二甲氧基三苯甲基(dmtr)的2个片段”的4个片段的寡核苷酸通过酶法连接来生成双链修饰寡核苷酸的反应的进展进行了评价。目标产物的各链分别称为a链和b链。将目标产物和合成的底物片段的序列示于表8,将4个片段的组合示于图10。
[0106]
反应液的组成为1.78μg/ml t4 rna连接酶2(新英格兰生物实验室)、50mm tris
‑
hcl、2mm mgcl2、1mm二硫苏糖醇、400μm atp、ph7.5。分别按照最终浓度成为10μm的条件添加作为底物的4个片段的寡核苷酸片段,以40μl的液量进行了反应。使用热循环仪在25℃反应,4小时后,按照最终浓度成为10mm的条件加入edta而停止反应。作为阴性对照在未添加酶的条件下也进行了反应。按照实施例5中记载的条件通过hplc和lc
‑
tof/ms对反应液所含的连接产物的浓度进行了分析。
[0107]
采用hplc的分析中,通过酶的添加,与阴性对照相比,各底物的峰面积减少,可以新检出2个峰。进而,反应液的采用lc
‑
tof/ms的分析中,添加酶的条件下确认了a链和b链的生成;a链lc/ms m/z:计算值1764.80,实测值1764.79[m
‑
4h]4‑
b链lc/ms m/z:计算值1738.76,实测值1738.75[m
‑
4h]4‑
。
[0108]
由以上结果显示,通过t4 rna连接酶2,可以由具有dmtr基的底物片段生成双链修饰寡核苷酸。
[0109]
[表8]表8.产物和底物的序列
pho:表示基于磷酸基的5'末端的修饰,dmtr:表示基于dmtr的5'末端的修饰,英文大写字母:表示rna,(me):表示基于2'
‑
o
‑
甲基的修饰,t:表示胸苷残基。
[0110]
[实施例11]采用载体添加型寡核苷酸片段的反应对由包括“在5'末端添加有n
‑
乙酰半乳糖胺(galnac)的1个片段”的4个片段的寡核苷酸通过酶法连接来生成双链修饰寡核苷酸的反应的进展进行了评价。目标产物的各链分别称为a链和b链。将目标产物和合成的底物片段的序列示于表9,将4个片段的组合示于图11。以galnac修饰的片段通过将具有羧基官能化peg5接头的三价β
‑
d
‑
galnac(trivalentβ
‑
d
‑
galnac with carboxyl
‑
functionalized peg5 linker,sussex公司制)介以氨基c6接头连接于寡核苷酸的5'末端而合成。
[0111]
反应液的组成为1.78μg/ml t4 rna连接酶2(新英格兰生物实验室)、50mm tris
‑
hcl、2mm mgcl2、1mm二硫苏糖醇、400μm atp、ph7.5。分别按照最终浓度成为10μm的条件添加作为底物的4个片段的寡核苷酸片段,以40μl的液量进行了反应。使用热循环仪在25℃反应,4小时后,按照最终浓度成为10mm的条件加入edta而停止反应。作为阴性对照在未添加酶的条件下也进行了反应。按照实施例5中记载的条件通过hplc和lc
‑
tof/ms对反应液所含的连接产物进行了分析。
[0112]
采用hplc的分析中,通过酶的添加,与阴性对照相比,各底物的峰面积减少,可以新检出2个峰。进而,反应液的采用lc
‑
tof/ms的分析中,添加酶的条件下检出a链和b链,确认了生成;a链lc/ms m/z:计算值1730.40,实测值1730.37[m
‑
5h]5‑
b链lc/ms m/z:计算值1330.38,实测值1330.36[m
‑
5h]5‑
。
[0113]
由以上结果显示,通过采用t4 rna连接酶2的由4个片段的反应,可以生成用n
‑
乙酰半乳糖胺修饰了末端的双链修饰寡核苷酸。
[0114]
[表9]表9.产物和底物的序列
pho:表示基于磷酸基的5'末端的修饰,galnac:表示基于n
‑
乙酰半乳糖胺的5'末端的修饰,英文大写字母:表示rna,(me):表示基于2'
‑
o
‑
甲基的修饰,t:表示胸苷残基。
[0115]
[实施例12]在连接部具有硫代磷酸二酯键的双链修饰寡核苷酸的生成反应对由将磷酸基替换为硫代磷酸基的4个片段的寡核苷酸通过酶法连接来生成双链修饰寡核苷酸的反应的进展进行了评价。目标产物的各链分别称为a链和b链。将目标产物和合成的底物片段的序列示于表10,将4个片段的组合示于图12。
[0116]
反应液的组成为1.78μg/ml t4 rna连接酶2(新英格兰生物实验室)、50mm tris
‑
hcl、2mm mgcl2、1mm二硫苏糖醇、400μm atp、ph7.5。分别按照最终浓度成为10μm的条件添加作为底物的4个片段的寡核苷酸片段,以40μl的液量进行了反应。使用热循环仪在25℃反应,4小时后,按照最终浓度成为10mm的条件加入edta而停止反应。作为阴性对照在未添加酶的条件下也进行了反应。按照实施例5中记载的条件通过hplc和lc
‑
tof/ms对反应液所含的连接产物进行了分析。
[0117]
采用hplc的分析中,通过酶的添加,与阴性对照相比,各底物的峰面积减少,可以新检出2个峰。进而,反应液的采用lc
‑
tof/ms的分析中,添加酶的条件下检出a链和b链,确认了生成;a链lc/ms m/z:计算值1769.15,实测值1769.13[m
‑
4h]4‑
b链lc/ms m/z:计算值1743.11,实测值1743.10[m
‑
4h]4‑
。
[0118]
由以上结果显示,通过采用t4 rna连接酶2的由4个片段的反应,可以生成在连接部具有硫代磷酸键的双链修饰寡核苷酸。
[0119]
[表10]表10.产物和底物的序列
ps:表示基于硫代磷酸基的5'末端的修饰,英文大写字母:表示rna,^:表示硫代磷酸键,(me):表示基于2'
‑
o
‑
甲基的修饰,t:表示胸苷残基。
[0120]
[实施例13]发夹型寡核苷酸的生成反应对由4个片段的寡核苷酸通过酶法连接来生成发夹型寡核苷酸的反应的进展进行了评价。将目标产物和合成的底物片段的序列示于表11,将4个片段的组合示于图13。作为接头,使用文献(hamasaki t,suzuki h,shirohzu h,et al.efficacy of a novel class of rna interference therapeutic agents.plos one.2012;7(8):e42655.)中记载的脯氨酸衍生物。
[0121]
反应液的组成为1.78μg/ml t4 rna连接酶2(新英格兰生物实验室)、50mm tris
‑
hcl、2mm mgcl2、1mm二硫苏糖醇、400μm atp、ph7.5。分别按照最终浓度成为10μm的条件添加作为底物的4个片段的寡核苷酸片段,以40μl的液量进行了反应。使用热循环仪在25℃反应,4小时后,按照最终浓度成为10mm的条件加入edta而停止反应。作为阴性对照在未添加酶的条件下也进行了反应。按照实施例5中记载的条件通过hplc和lc
‑
tof/ms对反应液所含的连接产物进行了分析。
[0122]
采用hplc的分析中,通过酶的添加,与阴性对照相比,各底物的峰面积减少,可以新检出1个峰。进而,反应液的采用lc
‑
tof/ms的分析中,添加酶的条件下检出目标产物,确认了生成;lc/ms m/z:计算值1891.61,实测值1891.60[m
‑
9h]9‑
。
[0123]
由以上结果显示,通过采用t4 rna连接酶2的由4个片段的反应,可以生成发夹型寡核苷酸。
[0124]
[表11]表11.产物和底物的序列
pho:表示基于磷酸基的5'末端的修饰,英文大写字母:表示rna,pro:表示脯氨酸衍生物。
[0125]
[实施例14]突出末端的碱基长度对反应性的影响按照产物相同、并形成长度为1~6个碱基的突出末端的条件设计底物的寡聚核酸,对由突出末端的碱基长度的差别所导致的反应性的差异进行了比较。目标产物的各链分别称为a链和b链。各组合中,构成b链的底物采用共通的序列,a链的切割位置采用不同的位置。将合成的目标产物可信制品和底物片段的序列示于表12,将4个片段的组合示于图14。
[0126]
反应液的组成为1.78μg/ml t4 rna连接酶2(新英格兰生物实验室)、50mm tris
‑
hcl、2mm mgcl2、1mm二硫苏糖醇、400μm atp、ph7.5。分别按照最终浓度成为10μm的条件添加作为底物的4个片段的寡核苷酸片段,以40μl的液量进行了反应。使用热循环仪在25℃反应,15分钟、30分钟、1小时、2小时和4小时后回收5μl,按照最终浓度成为10mm的条件加入edta而停止反应。作为阴性对照在未添加酶的条件下也进行了反应。按照实施例5中记载的条件通过hplc对反应液所含的连接产物和产物可信制品的浓度进行了分析,算出连接产物的浓度。
[0127]
通过hplc分析进行了确认,其结果是,在所有碱基长度的突出末端的情况下均观察到a链和b链的生成。长度为1个碱基的突出末端存在反应速度低的倾向。
[0128]
[表12]表12.产物和底物的序列
pho:表示基于磷酸基的5'末端的修饰,英文大写字母:表示rna,(me):表示基于2'
‑
o
‑
甲基的修饰。
[0129]
[实施例15]产物的碱基长度对反应性的影响对制造由长度为11~14个碱基的互补部分形成的较短的目标产物的情况下的反应性的差异进行了比较。目标产物的各链分别称为a链和b链。将目标产物和合成的底物片段的序列示于表13,将4个片段的组合示于图15。
[0130]
反应液的组成为1.78μg/ml t4 rna连接酶2(新英格兰生物实验室)、50mm tris
‑
hcl、2mm mgcl2、1mm二硫苏糖醇、400μm atp、ph7.5。分别按照最终浓度成为10μm的条件添加作为底物的4个片段的寡核苷酸片段,以40μl的液量进行了反应。使用热循环仪在25℃反应,4小时后,按照最终浓度成为10mm的条件加入edta而停止反应。作为阴性对照在未添加酶的条件下也进行了反应。按照实施例5中记载的条件通过hplc和lc
‑
tof/ms对反应液所含的连接产物进行了分析。
[0131]
采用hplc的分析中,通过酶的添加,与阴性对照相比,各底物的峰面积减少,可以在保留时间较晚的位置检出新的峰。进而,反应液的采用lc
‑
tof/ms的分析中,添加酶的条件下,如表14所示,所有碱基长度的产物的情况下均检出a链和b链的2价或3价的离子,确认了反应的进行。
[0132]
通过hplc算出各反应条件下的底物的峰面积值,通过以下的式子算出底物的残存率:
残存率(%)=(添加酶的条件下的底物的峰面积的合计)/(阴性对照的底物的峰面积的合计)
×
100。
[0133]
由长度为11个碱基的互补部分形成的产物与由长度为12个碱基以上的互补部分形成的产物相比,存在底物的残存率更高的倾向。
[0134]
[表13]表13.产物和底物的序列pho:表示基于磷酸基的5'末端的修饰,英文大写字母:表示rna,(me):表示基于2'
‑
o
‑
甲基的修饰。
[0135]
[表14]表14.基于质谱分析的各产物的确认
[0136]
[实施例16]高浓度底物时的反应在各ph下对存在更高浓度的底物的条件下的修饰寡核苷酸的生成反应速度进行了比较。反应的目标产物的各链分别称为a链和b链。将目标产物和合成的底物片段的序列示于表15,将4个片段的组合示于图16。
[0137]
反应液的组成为1.78μg/ml t4 rna连接酶2(新英格兰生物实验室)、2mm mgcl2、1mm二硫苏糖醇、400μm atp,作为缓冲液采用50mm tris
‑
hcl(ph7.0~9.0)。分别按照最终浓度成为10μm、300μm、500μm或1000μm的条件添加作为底物的寡核苷酸片段,以40μl的液量进行了反应。使用热循环仪在25℃反应,15分钟或1小时后取样,按照最终浓度成为10mm的条件加入edta而停止反应。按照实施例5中记载的条件通过hplc对反应液所含的连接产物进行了分析,由a链和b链的合计的浓度算出生成速度。在底物浓度300μm以上时均确认了反应进行,在这些浓度下于ph8.0和8.5时显示较高的反应速度。
[0138]
[表15]表15.产物和底物的序列pho:表示基于磷酸基的5'末端的修饰,英文大写字母:表示rna,(me):表示基于2'
‑
o
‑
甲基的修饰,t:表示胸苷残基。
[0139]
[实施例17]表面活性剂添加的效果对基于表面活性剂添加的修饰寡核苷酸的生成反应速度进行了评价。将目标产物和合成的底物片段的序列示于表15,将4个片段的组合示于图16。反应液的组成为1.78μg/ml t4rna连接酶2(新英格兰生物实验室)、2mm mgcl2、1mm二硫苏糖醇、400μm atp、50mm tris
‑
hcl(ph7.5),作为表面活性剂采用最终浓度0.1%的tritonx
‑
100。分别按照最终浓度成为20μm的条件添加作为底物的寡核苷酸片段,以40μl的液量进行了反应。评价中,对以下的3个条件进行了比较:将酶溶液用保存缓冲液(10mm tris
‑
hcl、50mm kcl、35mm硫酸铵、0.1mm二硫苏糖醇、0.1mm edta、50%甘油,ph7.5)稀释至17.8μg/ml后向反应液中添加1/10
量的条件(对照条件)、将酶溶液用保存缓冲液稀释至17.8μg/ml后向含最终浓度0.1%的tritonx
‑
100的反应液中添加1/10量的条件(试验条件1)、将酶溶液用含最终浓度0.1%的tritonx
‑
100的保存缓冲液稀释至17.8μg/ml后向含最终浓度0.09%的tritonx
‑
100的反应液中添加1/10量的条件(试验条件2,tritonx
‑
100最终浓度0.1%)。使用热循环仪在25℃反应,4小时后取样,按照最终浓度成为10mm的条件加入edta而停止反应。按照实施例5中记载的条件通过hplc对反应液所含的连接产物进行了分析,算出a链和b链的浓度。对于试验条件1和试验条件2而言,与对照条件相比,观察到更高浓度的a链和b链的产物。
[0140]
[实施例18]基于产物的碱基长度不同的杂质的淘汰性的比较对于底物和产物实施碱基长度不同的反应,对底物寡聚核酸片段和酶反应后的溶液所含的杂质进行了分析。反应的目标产物的各链分别称为a链和b链。将目标产物和合成的底物片段的序列示于表16,将4个片段的组合示于图17。
[0141]
采用修饰寡核苷酸的反应中,反应液的组成为8.9μg/ml t4 rna连接酶2(新英格兰生物实验室)、50mm tris
‑
hcl、2mm mgcl2、1mm二硫苏糖醇、400μm atp、ph7.5。采用dna的反应中,反应液的组成为22.0μg/ml t7 dna连接酶(新英格兰生物实验室)、50mm tris
‑
hcl、2mm mgcl2、1mm二硫苏糖醇、400μm atp、ph7.5。分别按照最终浓度成为50μm的条件添加作为底物的4个片段的寡核苷酸片段,以30μl的液量进行了反应。使用热循环仪在25℃反应,8小时后,按照最终浓度成为12.5mm的条件加入edta而停止反应。按照实施例5中记载的条件通过hplc和lc
‑
tof/ms对反应液进行了分析,确认了目标反应的进行。
[0142]
根据所得的质谱分析结果,基于在先文献(roussis et al.,journal of chromatogr a.2019;1584:106
‑
114.)的方法,算出杂质(n
±
1聚体)相对于目标结构的产物的含有率。此外,供于反应的底物寡核苷酸溶液也同样地通过lc
‑
tof/ms进行了分析,算出杂质(n
±
1聚体)相对于底物的含有率。
[0143]
根据上述中算出的值,对于各反应的a链和b链,分别通过以下的式子算出杂质的残存率(%):杂质的残存率(%)=(反应液中的n
±
1聚体相对于目标产物的比例)/(底物溶液中的n
±
1聚体相对于底物的比例)
×
100。
[0144]
结果示于表17。在生成长度为28个碱基的寡聚核酸的反应中,杂质(n
±
1聚体)的残存率为86%以上,相对而言,在生成长度为25个碱基以下的寡聚核酸的反应中,残存率为23~59%。
[0145]
[表16]表16.产物和底物的序列
pho:表示基于磷酸基的5'末端的修饰,英文小写字母:表示dna,英文大写字母:表示rna,(me):表示基于2'
‑
o
‑
甲基的修饰。
[0146]
[表17]表17.杂质(n
±
1聚体)的残存率(%)
[0147]
工业上的可利用性本发明对于可用于核酸药物等制品的修饰寡核苷酸(例如sirna、异源双链寡核苷酸等)的制造是有用的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1