由细菌连续生产重组GLP-1肽的方法与流程
由细菌连续生产重组glp
‑
1肽的方法
技术领域
1.本发明涉及一种由细菌,更具体地大肠杆菌(e.coli)连续生产和分泌重组胰高血糖素样肽
‑
1(glp
‑
1)的方法。
背景技术:
2.胰高血糖素样肽1(glp
‑
1)是一种由在回肠末端和结肠的l细胞中产生的31个氨基酸的强效肠促胰岛素激素。在l细胞中,glp
‑
1是由胰高血糖素原基因的组织特异性翻译后加工产生的。已知营养物质(包括葡萄糖、脂肪酸和膳食纤维)都可以上调编码glp
‑
1的基因的转录,并且它们可以刺激这种激素的释放。
3.初始产物glp
‑
1(1
‑
37)易于酰胺化和蛋白水解裂解,从而产生两种截短且等效的生物活性形式,glp
‑
1(7
‑
36)酰胺和glp
‑
1(7
‑
37)。
4.glp
‑
1是一种肠促胰岛素;因此表现出促胰岛素作用,即具有通过增加胰岛素的分泌以葡萄糖依赖性方式降低血糖水平的能力。除了促胰岛素作用外,glp
‑
1还与许多调节和保护作效应有关。glp
‑
1的作用在2型糖尿病患者中是已知的,并且因此大量的药物研究致力于开发基于glp
‑
1的治疗。glp
‑
1还被认为是一种用于管理相关的代谢紊乱(诸如肥胖)的可能的治疗剂。
5.因此,由于glp
‑
1生产的重要性,存在技术差距,其中需要一种使用重组细菌,更具体地大肠杆菌,以高产率生产重组glp
‑
1肽的方法。
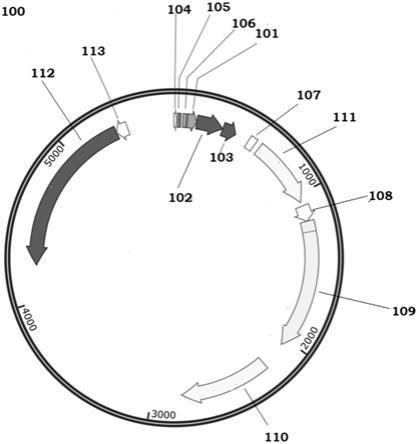
6.发明目的
7.本发明的主要目的是提供一种由细菌,更具体地大肠杆菌,连续生产和分泌重组glp
‑
1肽的方法,其中,所述重组glp
‑
1是利用新型细菌表达载体在细菌中产生的,并通过使用基于灌注的发酵系统在化学成分确定的培养基中培养所述细菌而分泌到细胞外。
8.本发明的另一个目的是提供一种利用新型细菌表达载体增加重组glp
‑
1的分泌的方法,该新型细菌表达载体包含由seq.id1代表的编码glp
‑
1肽的dna序列;和至少一个包含dna序列的分泌信号序列;以及至少一个用于纯化glp
‑
1肽的亲和标签序列。
9.本发明的又一个目的是提供一种生产重组glp
‑
1的方法,该重组glp
‑
1易于使用化学成分确定的培养基进行纯化。
10.本发明的又一个目的是提供一种用于增加细菌中重组glp
‑
1的生产和分泌的系统和方法,具有用于交替切向过滤流以从培养悬浮液中连续去除分泌的重组glp
‑
1的定制的分离系统。
技术实现要素:
11.本发明涉及一种使用细菌生产重组glp
‑
1的方法。更具体地,本发明涉及由大肠杆菌生产和分泌重组glp
‑
1。
12.在主要的实施方案中,本发明提供了一种在细菌,更具体地大肠杆菌中生产glp
‑
1的方法,包括以下步骤:用seq.id 6的细菌表达载体转化大肠杆菌,所述细菌表达载体携带
与至少一个分泌信号序列结合的编码由seq.id 1代表的glp
‑
1的dna序列;通过下述方式来制备重组大肠杆菌的起子培养物:使所述培养物在起子培养物生长培养基中于37℃在225rpm下生长12小时,直至所述起子培养物的od
600
达到5.0
‑
6.0;通过下述方式来制备基于灌注的发酵罐系统:将初始批次的培养基添加至所述发酵罐容器,包含浓度为10g/l的葡萄糖/右旋糖并且ph保持为6.9;将所述起子培养物添加至所述发酵罐容器中,并在第一小时内使用3n naoh以及在第一小时后使用4m液氨来将ph保持在6.9;当所述初始批次的培养基中残余的葡萄糖/右旋糖的浓度降低至约5g/l时,将乳糖操纵子诱导剂诸如乳糖或乳糖类似物添加至发酵罐容器,以诱导重组大肠杆菌产生和分泌重组glp
‑
1肽;以及在诱导30分钟至40分钟后启动基于灌注的发酵系统,以从含有作为渗透物的所述分泌的重组glp
‑
1肽的废培养基中分离作为渗余物的所述重组大肠杆菌,从所述渗透物收获重组glp
‑
1肽,以及用新鲜的灌注培养基和渗余物重组大肠杆菌重新进料所述发酵罐容器,从而用于连续生产和分泌重组glp
‑
1肽。
13.在又一个实施方案中,使用seq.id 6的所述重组表达载体使用基于灌注的发酵系统分泌范围为1g/l/hr至1.2g/l/hr的所述重组glp
‑
1肽。
14.在另一个实施方案中,本发明提供了起子培养物培养基、初始批次的培养基和灌注培养基,它们是具有如表2中所述的组成的化学成分确定的培养基。
15.在又一个实施方案中,本发明提供了一种基于灌注的发酵系统,其使得包含所述重组大肠杆菌的培养基能够以交替切向流在分离系统上循环,并且所述分离系统从培养基去除含有废培养基(含有重组glp
‑
1肽)的滤液,并将重组大肠杆菌保留在培养基中以用于连续生产。
16.在又一个实施方案中,本发明提供了一种新型细菌表达载体,所述表达载体包含:
17.1)编码glp
‑
1肽的dna序列seq.id 1;
18.2)至少一个分泌信号序列,其是以下的组合:a)至少一个编码选自由pelb、ompa、yebf和ompf组成的组的基因的信号序列的dna序列,和b)至少一个编码载体肽的dna序列,优选编码截短yebf(seq.id 4或seq.id 5)的dna序列(seq.id 2或seq.id 3);
19.3)至少一个基因表达盒,包含至少一个诱导型启动子、rbs、编码所述重组glp
‑
1肽的dna序列、编码亲和标签的dna序列和至少一个基因终止子;具有分泌信号序列,以及与重组glp
‑
1肽的dna序列可操作地连接的亲和标签的dna序列;
20.4)至少一个细菌ori基因序列,用于在宿主细菌细胞中复制所述载体;和
21.5)至少一个用于编码可选择标记物的dna序列,具有位于可选择标记物的dna序列侧翼的合适的启动子和基因终止子序列。
22.本发明还提供了一种编码重组glp
‑
1的dna序列seq.id 1。
23.本发明还提供了一种表达载体seq.id 6,用于在大肠杆菌中生产和分泌重组glp
‑
1肽。
24.本发明还涉及一种基于灌注的发酵罐系统,其中,该系统提供了进料罐;进料泵;液位传感器,电机;发酵罐容器;磁悬浮泵,分离模块,收获泵和收获罐,其中,所述分离模块中的中空纤维柱包括适用于从所述培养基去除分泌的重组蛋白的中空纤维膜的过滤模块,所述分离模块包括过滤模块,所述过滤模块包括中空纤维,例如,由聚砜、甲酯或纤维素酯制成的中空纤维,孔隙为0.4μm至0.1μm,例如孔隙为0.2μm。所述分离系统还包括过滤模块,
所述过滤模块包括膜,其中,所述膜的分子量截留孔径为500kda。
附图说明
25.对本发明的系统和方法的完整理解可通过参考以下附图获得:
26.图1是用于编码和分泌来自大肠杆菌的重组glp
‑
1肽的细菌表达载体的示意图;
27.图2阐明了基于灌注的发酵系统的示意图;
28.图3a是在分批发酵过程中随时间的用表达载体seq.id 6转化的重组大肠杆菌的生长动力学和重组glp
‑
1肽分泌的图示;
29.图3b是比较用表达载体seq.id 6细胞裂解物和培养基转化的重组大肠杆菌在0.25mm iptg诱导的不同时间点后检测的重组glp
‑
1肽的sds
‑
page的代表性图像;
30.图4是在分批发酵过程中随时间的用表达载体seq.id 6转化的重组大肠杆菌的生长动力学和葡萄糖消耗的图示;
31.图5是用表达载体seq.id 6转化的重组大肠杆菌和分批发酵工艺的培养基中的重组glp
‑
1肽;his纯化的重组glp
‑
1肽;和肠激酶消化的重组glp
‑
1肽的sds
‑
page的代表性图像;
32.图6a是基于灌注的发酵过程中随时间的用表达载体seq.id 6转化的重组大肠杆菌的生长动力学和葡萄糖消耗的图示;
33.图6b是10kda glp
‑
1肽分泌的sds
‑
page分析的代表性图像。在用0.25mm iptg诱导的0小时、2小时、4小时和6小时后收集和分析培养基样品;以及
34.图6c是基于灌注的发酵系统在10小时期间每小时的重组glp
‑
1肽的产率的图示。
具体实施方式
35.使用的缩写:
36.pelb指的是编码果胶裂解酶b的n端氨基酸残基的前导dna序列
37.ompa指的是编码外膜蛋白a的氨基酸残基的前导dna序列
38.ompf指的是编码外膜蛋白f的氨基酸残基的前导dna序列
39.yebf指的是编码蛋白质yebf的氨基酸残基的前导dna序列
40.ampr指的是编码氨苄青霉素抗性基因的dna序列
41.f1 ori
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
复制原点
42.iptg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
异丙基β
‑
d
‑1‑
硫代半乳糖吡喃糖苷
43.lac或lac1
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
编码lac阻遏物的dna序列
44.rbs
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
核糖体结合位点
45.现在将参考详细描述在下文中描述本发明,其中指出了本发明的一些实施方案,但不是全部实施方案。实际上,本发明可以以多种不同的形式体现,并且不应被解释为限于本文阐述的实施方案;相反,提供这些实施方案使得本公开将满足适用的法律要求。相同的数字始终指代相同的元件。本发明在本文中通过非限制性实施方案和示例性实验进行了全面描述。
46.本发明涉及由大肠杆菌生产和分泌的重组glp
‑
1肽。更具体地,本发明涉及由大肠杆菌生产和分泌的glp
‑
1,然后使用基于灌注的发酵系统将其分离。
47.在主要实施方案中,如图1所述,本发明提供了一种细菌表达载体100,具体用于大肠杆菌的细菌表达载体,用于生产和分泌重组glp
‑
1肽。表达载体包含编码glp
‑
1肽的dna序列103;和至少一个分泌信号序列,其是以下的组合:a)至少一个编码选自由pelb、ompa、yebf和ompf组成的组的基因的信号序列的dna序列101,和b)至少一个编码载体肽的dna序列102,优选编码截短yebf(seq.id 4或seq.id5)的dna序列(seq.id 2或seq.id 3)。表达载体还包含至少一个基因表达盒,该基因表达盒与编码glp
‑
1肽的dna序列103可操作地连接,包含至少一个诱导型启动子104、rbs 105、亲和标签的dna序列和至少一个基因终止子106。分泌信号序列101和102以及亲和标签的dna序列与重组glp
‑
1肽的dna序列103可操作地连接。此外,表达载体包含至少一个细菌ori基因序列110,用于在宿主细菌细胞中复制;和至少一个抗生素抗性基因109和至少一个额外的可选择标记物112,每个都由它们各自的基因启动子108和113控制。表达载体另外包含至少一个f1 ori序列111,用于在f1噬菌体系统中实现重组glp
‑
1肽的包装。
48.亲和标签序列用于实现重组glp
‑
1肽的纯化。
49.此外,编码重组glp
‑
1肽的dna序列通过肠激酶识别序列(ddddk)与分泌信号序列分离,从而能够在收获重组glp
‑
1肽后将重组glp
‑
1肽与分泌信号序列分离。
50.glp
‑
1肽包含由seq.id 1编码的人类glp
‑
1蛋白(ncbi参考编号aap35459)的7
‑
37个氨基酸片段;表1提供了细菌表达载体中使用的dna序列和肽序列。
51.表1提供了dna序列和肽序列
52.53.54.55.[0056][0057][0058]
seq.id 2编码33个氨基酸载体肽,由seq.id 4代表的截短yebf肽,并且seq.id 3编码由seq.5代表的肽。seq.id 3是通过突变seq.id 2合成的,其中,seq.id 2中40位处的tgc密码子突变为gcg密码子,以将seq.id 4的14位处的cys突变为seq.id 5的14位处的
ala。
[0059]
在另一个实施方案中,本发明提供了代表表达载体的dna序列的seq.id 6,其包含与分泌信号序列结合的编码重组glp
‑
1肽的seq.id1,所述分泌信号序列包含基因ompf的信号肽和编码seq.id 5的截短yebf肽的seq.id 3的dna序列载体肽的组合。
[0060]
在另一个实施方案中,如表2所述,本发明提供了一种化学成分确定的培养基,用于生长和培养用具有编码重组glp
‑
1肽的dna序列的细菌表达载体转化的细菌,其中,培养基不含任何复杂的不确定物质,复杂的不确定物质往往会降低分泌的重组蛋白在培养基中的溶解度,并减少最终纯化的重组蛋白量。培养基包含至少一种碳源,更具体地,葡萄糖/右旋糖;和甘油,作为稳定剂,其中葡萄糖/右旋糖与甘油的比为1:0.25至1:1,优选为1:0.5。培养基中甘油的存在是为了防止高剪切力和保护细菌免受伤害,并减少重组蛋白的变性。该培养基还包含至少一种氮源,其中该氮源是铵盐。此外,该培养基包含范围为5mm至25mm的柠檬酸。柠檬酸在所述化学成分确定的培养基中的作用是防止大肠杆菌感染噬菌体。噬菌体感染大肠杆菌是细菌培养中的常见问题,这会导致培养物中活细菌细胞的数量减少,这反过来会影响重组蛋白的产生,从而减少其产量。从机制上讲,噬菌体对柠檬酸非常敏感,并且在柠檬酸存在的情况下无法感染细菌。用于生产重组蛋白的普通lb肉汤缺乏柠檬酸,不能有效预防大肠杆菌中的噬菌体感染。该培养基还包含镁盐、钾盐、磷盐和钠盐;和选自不限于铁、钴、锰、铜、硼、钼和锌的组的微量元素的盐。此外,该培养基还含有甘氨酸,它在维持细菌细胞的膜电位和增加蛋白质分泌方面起着重要作用;和精氨酸,作为分子伴侣并增加重组蛋白在细胞内的折叠,从而减少包涵体或聚集体的形成,促进折叠重组蛋白在细胞外的分泌。甘氨酸增加分泌,而精氨酸有助于在分泌前折叠蛋白质。甘氨酸和精氨酸一起帮助分泌重组蛋白。此外,培养基包含至少一种螯合剂,包括但不限于乙二胺四乙酸(edta),和至少一种维生素,更具体地,硫胺素。
[0061]
表2:化学成分确定的起子培养物培养基、初始批次的培养基和灌注培养基的组成。
[0062]
培养基的主要组分浓度范围(mm)柠檬酸5至25mmkh2po450至150mm(nh4)2hpo410至50mmnacl1至10mm甘氨酸1至10mm甘油10至100mm精氨酸0.5至10mmcacl20.01至1mmmgso4.7h201至10mm右旋糖20至200mm卡那霉素20至200mm硫胺素0.001至1mm
ꢀꢀ
培养基中微量元素的盐克每升
柠檬酸fe(iii)1至5gcocl2
‑
6h2o0.1至2gmncl2
‑
4h2o0.5至5gcucl2
‑
2h2o0.01至1gh3bo30.1至1gna2moo4
‑
2h2o0.01至1g乙酸zn
‑
2h2o0.5至5gedta0.01至5g
[0063]
在另一个实施方案中,本发明提供了一种由大肠杆菌生产和分泌重组glp
‑
1的方法,使用基于灌注的发酵系统来连续生产和分离分泌的重组glp
‑
1肽。该方法包括以下步骤:
[0064]
a)用编码重组glp
‑
1肽的表达载体转化大肠杆菌以生产重组大肠杆菌;
[0065]
b)通过下述方式来制备重组大肠杆菌的起子培养物:使所述培养物在起子培养物生长培养基中于37℃在225rpm下生长12小时,直至所述起子培养物的od
600
达到5.0
‑
6.0;
[0066]
c)通过下述方式来制备基于灌注的发酵罐系统:将初始批次的培养基添加至所述发酵罐容器,包含浓度为10g/l的葡萄糖/右旋糖并且ph保持为6.9;
[0067]
d)将起子培养物添加至发酵罐容器,并在第一小时内使用3nnaoh以及在第一小时后使用4m液氨来将ph保持在6.9;
[0068]
e)当初始批次的培养基中残余的葡萄糖/右旋糖的浓度降低至约5g/l时,将乳糖操纵子诱导剂诸如乳糖或乳糖类似物添加至所述发酵罐容器,以诱导重组大肠杆菌产生和分泌重组glp
‑
1肽;以及
[0069]
f)在诱导30分钟至40分钟后启动基于灌注的发酵系统,以从含有作为渗透物的分泌的重组glp
‑
1肽的废培养基分离作为渗余物的重组大肠杆菌,从渗透物收获重组glp
‑
1肽,以及用新鲜的灌注培养基和渗余物重组大肠杆菌重新进料发酵罐容器,从而用于重组glp
‑
1肽的连续生产和分泌。
[0070]
灌注系统涉及在灌注悬浮培养物中生长重组大肠杆菌,其中包括细菌的培养基以交替切向流在分离系统上循环,并且分离系统从培养基去除含有废培养基(含有重组glp
‑
1肽)的滤液,并将细菌保留在培养基中以用于连续生产。
[0071]
图2阐明了基于灌注的发酵和分离系统的示意图,该系统包括进料罐(201);进料泵(202);液位传感器(203);电机(204);发酵罐容器(205);磁悬浮泵(206);分离模块(207);收获泵(208)和收获罐(209),其中,分离模块(207)中的中空纤维柱包括适用于从培养基去除分泌的重组glp
‑
1肽的中空纤维膜的过滤模块。
[0072]
进料罐(201)储存通过进料泵(202)泵送至发酵罐容器(205)的培养基。通过电机(204)搅拌装有包含大肠杆菌的起子培养物和培养基的培养悬浮液的发酵罐容器(205)。发酵罐容器(205)通过磁悬浮泵(206)连续或间歇地排出。培养基的液位通过液位传感器(203)保持。排出的液体还经过包括中空纤维膜的过滤模块。发酵罐容器(205)中的培养悬浮液以交替切向过滤流在分离系统上循环。分离模块(207)将作为渗余物的重组大肠杆菌与作为渗透物的包含重组glp
‑
1肽的废培养基分离。通过还包括中空纤维膜的过滤模块过滤的悬浮液适当地从废培养基中去除重组glp
‑
1。渗余物中过滤的大肠杆菌被重新引入到
发酵罐容器中。废培养基通过收获泵(208)泵送至收获罐(209)。
[0073]
在优选的发明的一个实施方案中,分离系统包括过滤模块,该过滤模块包括中空纤维,例如由聚砜、甲酯或纤维素酯制成的中空纤维,孔隙为0.4μm至0.1μm,例如0.2μm的孔隙,从而用于从废培养基中去除分泌的重组glp
‑
1肽。
[0074]
在又一个实施方案中,分离系统包括过滤模块,该过滤模块包括膜,其中该膜的分子量截留孔径为500kda。
[0075]
实施例1
[0076]
大肠杆菌培养和转化
[0077]
seq.id 6代表的表达载体的dna序列用于所有实验程序,其包含与分泌信号序列结合的编码重组glp
‑
1肽的seq.id 1,所述分泌信号序列包含基因ompf的信号肽和编码seq.id 5的截短yebf肽的seq.id 3的dna序列载体肽的组合。
[0078]
选择大肠杆菌bl21(de3)菌株作为表达系统,并且取100ng重组载体seq.id 6,通过化学转化法(即cacl2)将菌株进行转化。将化学感受态细胞(即b21(de3))从
‑
80℃冰箱取出后于4℃孵育并解冻。将细胞解冻至4℃后,加入载体并在相同的4℃孵育15分钟。此后,通过将细胞暴露于42℃约1分钟对细胞进行孵育热休克。进行热休克后,经转化的大肠杆菌细胞在4℃保持约15分钟。在那里通过添加luria肉汤(lb)培养基使细胞生长40分钟。稍后生长的细胞以适当的抗生素选择标准涂布在lb琼脂上。
[0079]
实施例2
[0080]
批量发酵和基于灌注的发酵
[0081]
a)起子培养物的制备
[0082]
制备足量的预培养物以使用表3中所述组成的高压灭菌起子培养物培养基进行补料分批发酵。通常,将300ml生长培养基放入2升烧瓶中,并用从转化板的单个菌落形成单元无菌接种,并在保持在37℃的旋转培养箱中以225rpm培养12小时。过滤器灭菌的培养基组分诸如硫胺素、微量元素,在准备起子培养物的同时进行重组。12小时孵育结束时od
600
达到约5.0。
[0083]
b)批量发酵过程
[0084]
具有表3所述的初始批次的培养基的组成的生长培养基的生物反应器在121℃高压灭菌,保持时间为45分钟,然后在具有scada软件的控制塔的帮助下将整个组装的生物反应器降至37℃。在生物反应器包装过程中,连接所有要求的用于进气单元和排气单元的给料管0.2微米疏水过滤器、溶解氧探针、ph探针、挡板、保持在1:1l/d比的叶轮片。
[0085]
发酵过程是通过保持所需的物理条件(例如ph为6.90,温度为37℃)开始的。根据生长曲线变量参数,例如通风,搅拌由控制单元自动控制。无菌起子培养物被转移至生物反应器。过滤器灭菌的培养基组分(诸如硫胺素、微量元素)的重组从注射口无菌地供给生物反应器。在发酵开始期间加入葡萄糖以达到10g/l的最终浓度。mgso4储备溶液以补充形式提供,以避免培养基沉淀。ph在3n naoh的帮助下维持一小时,然后使用4n氨直至发酵过程结束。细胞以约0.6/小时的最大生长速率生长。
[0086]
每小时从生物反应器无菌抽取样本,并使用设置在600nm处的分光光度计对照空白培养基测量细胞密度。使用数字血糖仪测量相同样本的残余葡萄糖。发酵3小时后,以指数形式进料。在od
600
达到约40后,用iptg(即约0.25mm)诱导培养物,确保残余葡萄糖为约
5g/l。
[0087]
诱导后ph仅用4n氨维持在6.90。在整个发酵过程中不使用酸。将包括甘氨酸、精氨酸、谷氨酸的补充剂添加至培养物,使每种氨基酸的最终浓度为2mm。每小时抽取样本并离心以分离细胞和培养基,然后使用page进行分析以检测细胞中重组蛋白表达的存在和培养基中的分泌物的量。6小时的诱导结束后,抽取并离心培养物以分离细胞和培养基。
[0088]
c)基于灌注的发酵方案
[0089]
使用bl21(de3)采用适当的质粒通过进行热休克并将它们铺在选择性抗生素lb琼脂板上,然后在37℃的培养箱中孵育12小时来制备转化细胞。通过取培养基组分并溶解在去离子水中,并使用5nnaoh将ph调至6.90来制备生长培养基。起子培养物培养基在高压灭菌器中于121℃保持45分钟来灭菌。所有其他耐热的培养基组分(即硫胺素、卡那霉素、微量元素)都经过过滤器灭菌。右旋糖和mgso4.7h2o分别高压灭菌。通过将来自lb琼脂板的菌落接种到摇瓶中来制备起子培养物。过滤器灭菌的培养基组分,即硫胺素、卡那霉素(50毫克/升)、微量元素1000x与1%右旋糖、mgso4.7h2o(5mm)、0.2%酵母提取物一起添加。在摇床培养箱中在37℃以225rpm孵育烧瓶过夜。
[0090]
生物反应器容器装有预校准的ph探针、消泡剂传感器以及重新填充oxylyte后安装在溶解氧(do)探针上的新膜、每个都装有0.2μ疏水性排气过滤器的分布管和排气管,挡板。将表3中描述的初始批次的培养基倒入发酵罐容器中,不包括对应于可重组培养基组分的体积。发酵罐容器在121℃、15psi、保持45分钟的时间进行高压灭菌,然后冷却至室温并连接至控制单元。发酵罐容器用每分钟0.1标准升(slpm)的空气吹扫过夜,从而用于do探针极化。do在添加起子培养物之前进行校准。在添加起子培养物之前完成培养基的重组。连接给料瓶,灌注管。所有参数都在控制单元中设置,即ph设置为6.90(0.1%死区),do在级联模式下设置为30%,酸/碱在自动模式下,消泡剂传感器使用0.1%sigma antifoam 204,温度设置为37℃。do在级联模式下用搅拌、每分钟气体流量、纯氧吹扫百分比进行控制。初始rpm设置为200。预培养物在无菌地转移到生物反应器中。第一小时的ph通过连接带有3n naoh的给料瓶来维持。其余批次的ph由4m液氨维持。mgso4.7h2o从发酵的第0小时起无菌重新配制三个剂量。每小时取样以通过紫外/可见分光光度计检查细胞密度并通过血糖仪检查残余葡萄糖。5小时后或具有残余葡萄糖为约5g/l的批次,被选为理想的时间点,以使用0.2mm iptg诱导培养物。将无菌500kda中空纤维连接至灌注设备并用无菌初始批次的培养基平衡,随后将管连接至生物反应器。诱导后灌注开始后30分钟,通过泵将培养物自动从容器抽出穿过中空纤维,将含有重组大肠杆菌细胞的来自中空纤维的渗余物送回生物反应器。通过将泵速设置为约16.6ml/分钟从中空纤维的渗透端收集收获物,并同时以相同流速将灌注培养基添加到发酵罐容器中。总发酵一直进行直至完成灌注培养基。进料灌注培养基完成后,通过抽取1/3的渗透物将培养物浓缩至分批体积的2/3,并终止分批。诱导后每小时抽取样本以检查重组glp
‑
1肽的表达和分泌。中空纤维用0.5n naoh灭菌并储存在0.1n naoh中。
[0091]
表3:培养基的组成
[0092][0093][0094]
实施例3
[0095]
重组细菌的生长和重组glp
‑
1肽的分泌的效率
[0096]
在不同时间测试使用分批发酵过程的培养基中的生长动力学、葡萄糖消耗以及重组蛋白的生产和分泌。
[0097]
图3a提供了一个线图,代表在指定时间点时与分泌信号序列和亲和标签结合的10kda的重组glp
‑
1肽的产生以及重组大肠杆菌的生长,这表明培养基中细菌的稳定生长和重组蛋白分泌的增加。然而,在分批方法下,在4小时分批发酵过程完成时产量低于2.5g/l。
[0098]
此外,在发酵过程中使用iptg诱导后的指定时间点收集5微升培养物上清液,并且还收集来自各个时间点的重组大肠杆菌细胞裂解物,然后通过还原性sds
‑
page进行分析并
进行比较。如图3b所示,在诱导后1小时内,细菌开始产生和分泌重组glp
‑
1肽。这随着时间的推移稳步增加。此外,细胞裂解物中几乎不存在任何重组glp
‑
1肽,表明重组细菌的有效分泌。这表明通过化学成分确定的分批培养基组成可实现重组glp
‑
1肽的分泌中载体seq.id 6的效率。
[0099]
还分析了发酵过程中的葡萄糖消耗。如图4所示,在将起子培养物接种到基于灌注的发酵过程中1小时后不久,葡萄糖消耗就以最佳速率开始。发明人标准化并确定了在细胞增殖阶段开始之前需要添加的足量的葡萄糖,以实现最大生长速率,从而很快获得足够的细胞密度。与传统的细胞增殖技术相比,每克葡萄糖的产量保持最佳,从而使该方法经济可靠。初始批次的培养基的葡萄糖/右旋糖浓度为10g/l,并当残余的葡萄糖/右旋糖浓度达到约5g/l时进行诱导。因此使用seq.id 6的载体以及化学成分确定的分批培养基对于生长和重组glp
‑
1肽的分泌是最佳的。
[0100]
实施例4
[0101]
重组glp
‑
1肽的肠激酶消化
[0102]
通过肠激酶识别序列(ddddk)将编码重组glp
‑
1肽的dna序列与分泌信号序列分离,以便在收获重组glp
‑
1肽后能够将重组glp
‑
1肽与分泌信号序列分离。glp
‑
1肽与his标签串联用于纯化过程。
[0103]
如图5所示,重组glp
‑
1肽分泌在培养基中,并且在使用his亲和层析纯化后,一旦经肠激酶消化,就会产生较小的条带,表明分泌信号序列的分离。
[0104]
实施例5
[0105]
通过基于灌注的发酵生产重组glp
‑
1肽
[0106]
基于灌注的发酵过程使用由如实施例2c所述的seq.id 6转化的重组大肠杆菌进行。在任何时间点,发酵罐都可以容纳1升用于发酵的培养基,其被过滤以用于回收重组细菌和含有分泌的重组glp
‑
1肽的废培养基。通过去除废培养基,以1l/小时的速度连续收获分泌的重组蛋白。一旦废培养基被去除,发酵罐就会重新进料等量的新鲜灌注培养基和渗留物大肠杆菌以进行连续发酵等。每小时收集少量样本用于定量和分析。在连续分批的灌注发酵中,总共10l的培养基发酵10小时。
[0107]
图6a阐明了在基于灌注的发酵系统中发酵的细菌细胞的生长曲线。5小时后或批次的残余葡萄糖为约5g/l后,开始使用iptg的诱导。诱导第1小时后,开始灌注以补充限制性营养物质,以将细胞增殖保持在最低速度。如图6a所示,大肠杆菌的od
600
保持为8至10。此外,大部分时间都用于重组蛋白的生产,而不是增加细菌数量。
[0108]
在灌注方法中用0.25mm iptg诱导0、2、4和6小时后收集和分析培养基样本,其中总共9升含有重组蛋白的培养基被收集用于sds
‑
page分析。如图6b所示,在用iptg诱导后2小时就可以看到10kda重组glp
‑
1肽的分泌,并且即使在6小时后分泌的重组glp
‑
1肽的量也几乎相同。这清楚地表明重组glp
‑
1肽的连续生产在很长一段时间内始终如一地出现在基于灌注的发酵方法中。
[0109]
如图6c所示,在第1小时内,重组glp
‑
1肽的产量达到1g/l,甚至在第10小时后,产率为约1g/l。这表明使用seq.id 6和化学成分确定的培养基利用基于灌注的发酵方法以1g/l/hr的速率稳定生产重组glp
‑
1肽。
[0110]
虽然在附图中已经描述和示出了某些示例性实施方案,但是应当理解,这些实施
方案仅是说明性的,而不是对广泛的发明的限制,并且本发明不限于所示的且所述的具体构造和布置,因为除了在以上段落中阐述的那些之外,各种其他变化、组合、省略、修改和替换也是可能的。本领域技术人员应理解,在不脱离本发明的范围和精神的情况下,可以配置刚刚描述的实施方案的各种改编和修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1