用于改善间充质干细胞的血管生成潜能的方法与流程
1.本发明涉及间充质干细胞(msc)用于通过msc的营养和免疫调节分泌性质来治疗冠状动脉疾病(cad)和外周动脉疾病(pad)的用途。本发明还涉及用于细胞工程的方法的开发,其中基底涂层引导msc的促血管生成分泌。
背景技术:
2.冠状动脉疾病(cad)和外周动脉疾病(pad)是最常见的心脏病类型,并且导致大多数心脏病发作。例如,在澳大利亚,cad是主要的致死原因,每27分钟造成一个澳大利亚人死亡。
3.现有的血管生成疗法(如向损伤部位直接递送细胞因子)经常产生不良副作用。此外,患有严重的血管不可重建(nonrevascularizable)cad的患者的唯一选择仍然是心脏移植,这受到缺乏合适供体的限制。
4.基于干细胞的疗法作为一种可能的替代治疗而出现,然而,局限性与将这些细胞并入到宿主体内的能力有关。已经探索了靶向基因疗法和基于细胞的疗法,以用于通过刺激增加的微血管密度(血管生成)和后续大血管重构(动脉生成)来治疗cad。
5.然而,由于高水平的细胞死亡和细胞对微环境应答的异质性,使用msc改善心血管损伤后功能的试验所取得的成效甚微。虽然msc在再生医学中展示出重要的前景,但其在组织培养聚苯乙烯上的长期培养(扩增)阻碍分泌活性,并且在临床试验中存在着相当大的可变性。
6.因此,需要改善msc存活率和msc均质性。
7.应当理解,在本文引用了任何现有技术出版物的情况下,此类引用并不应被视为承认该出版物在澳大利亚或任何其他国家形成本领域公知常识的一部分。
技术实现要素:
8.本公开涉及使用蛋白质缀合的水凝胶基质作为细胞培养基底,以使msc的msc分泌属性归一化为促血管生成(“引发(priming)”)。为此,本公开涉及改善的细胞培养基质,其改善msc用于治疗cad和pad的治疗效果。
9.本公开确认了使msc的促血管生成因子的分泌最大化的基质条件,如通过涉及内皮细胞管腺生成(tubulogenesis)的模型测定所确定的。令人惊奇地,在所公开的基质上培养的msc可在液氮下冷冻保存,并且在解冻后维持引发的促血管生成表型。
10.相对于使用缺氧或生长因子治疗的方法,单独地通过基底特性引导期望的细胞活性具有许多优点,包括制造简单和对细胞源的最小修饰。
11.根据本公开产生的msc具有促血管生成分泌蛋白质组,并且可用于治疗cad和pad。
12.第一方面提供了一种用于改善间充质干细胞(msc)的血管生成潜能的方法,该方法包括在刚度为约1kpa至100kpa且涂覆有基质蛋白的基底上培养msc,其中该msc与在相同条件下(除了不在刚度为约1kp至100kpa且未涂覆有基质蛋白的基底上培养之外)培养的
msc相比时,具有改善的血管生成潜能。
13.还公开了一种用于制备具有改善的血管生成潜能的间充质干细胞(msc)的方法,该方法包括在刚度为约1kpa至100kpa且涂覆有基质蛋白的基底上培养msc,其中该msc与在相同条件下(除了不在刚度为约1kp至100kpa且未涂覆有基质蛋白的基底上培养之外)培养的msc相比时,具有改善的血管生成潜能。
14.方法可为体外方法。
15.在一个实施方案中,刚度为约1kpa、10kpa或40kpa。
16.在一个实施方案中,基质蛋白为胶原蛋白、纤连蛋白或层粘连蛋白。
17.在一个实施方案中,基底具有约10kpa的刚度并且涂覆有纤连蛋白。
18.在一个实施方案中,基底具有约1kpa或10kpa的刚度并且涂覆有纤连蛋白和胶原蛋白。
19.在一个实施方案中,基底用基质蛋白以约25μg/ml涂覆。
20.在一个实施方案中,基底包含聚丙烯酰胺。
21.在一个实施方案中,msc根据wo2017/156580产生。
22.在一个实施方案中,该方法还包括在基底上培养msc之后冷冻保存msc。
23.在一个实施方案中,该方法还包括解冻冷冻保存的msc,其中改善的血管生成潜能在冷冻保存和解冻之后持续存在。
24.在一个实施方案中,改善的血管生成潜能使用管腺生成测定进行测量。
25.第二方面提供了一种间充质干细胞(msc),其具有通过第一方面的方法改善的血管生成潜能。
26.第三方面提供了一种组合物,其包含通过下述方法制备的间充质干细胞(msc),所述方法包括:在刚度为约1kpa至100kpa且涂覆有基质蛋白的基底上培养msc,其中该msc与在相同条件下(除了不在刚度为约1kp至100kpa且未涂覆有基质蛋白的基底上培养之外)培养的msc相比时,具有改善的血管生成潜能。
27.在一个实施方案中,第三方面的组合物是包含药学上可接受的载体、稀释剂和/或赋形剂的药物组合物。
28.第四方面提供了一种包含第二方面的msc或第三方面的组合物的容器。
29.第五方面提供了一种试剂盒,该试剂盒包含第二方面的msc或第三方面的组合物、或第四方面的容器。
30.第六方面提供了一种用于治疗冠状动脉疾病(cad)或外周动脉疾病(pad)的方法,该方法包括向患有cad或pad的受试者施用第二方面的msc。
31.另外或替代地,第六方面提供了第二方面的msc在制备药物中的用途,该药物用于在患有冠状动脉疾病(cad)或外周动脉疾病(pad)的受试者中治疗cad或pad。
32.另外或替代地,第六方面提供了第二方面的msc,以用于在患有冠状动脉疾病(cad)或外周动脉疾病(pad)的受试者中治疗cad或pad的方法。
附图说明
33.图1是研究干细胞促血管生成中基质生物和物理组成影响的实验设计的示意图。
34.图2是冷冻保存后测试引发的msc中促血管生成效果的持久性的实验设计的示意
图。
35.图3是管腺生成测定分析的示意图。主节段以黄色示出,其存在于由两个结点(称为主结点)界定的树状物的区段中,该两个结点非排他性地连接一个分支。主结点是连接至少三个主节段的结点。任选地,两个邻近的主结点可以融合成独特的主结点。主结点以红色示出。网格(mesh)是由节段或主节段包围的区域。网格以蓝色示出。
36.图4是示出了基质生物和物理组成影响msc形态的显微照片。在具有不同涂层的聚丙烯酰胺凝胶上培养的msc显示不同的细胞形状和肌动蛋白丝组构(红色),这取决于基底刚度(左边1kpa,中间10kpa,以及右边40kpa)和与各基底缀合的ecm蛋白(胶原蛋白,顶部;纤连蛋白,中间;层粘连蛋白,底部)。细胞核用dapi(即,4
‑6‑
二脒基
‑2‑
苯基吲哚)复染。
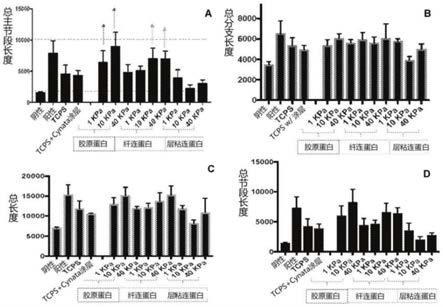
37.图5是描绘测量管形成的管腺生成测定的结果的柱形图,其中hmvec经不同刚度的水凝胶和基质蛋白组成培养的msc的条件培养基处理。a总主节段长度;b总分支长度;c总长度;d总节段长度。
38.图6(a)聚丙烯酰胺凝胶制造和缀合。(b)经不同刚度的水凝胶和配体组成培养的msc的条件培养基处理之后的平均人微血管内皮细胞(hmvec)管面积。(c)hmvec在阳性和阴性对照下的图像。(c)(顶部)分别在纤连蛋白0.5、10和40kpa条件的培养基下培养的hmvec,(底部)基底刚度改变msc细胞铺展特征并影响它们的分泌属性。*指示p<0.05。
39.图7是用来自涂覆有纤连蛋白和i型胶原蛋白的组合的标准组织培养板(tcps)(左边)、1kpa胶原蛋白(中间)和10kpa纤连蛋白(右边)的培养基培养的hmvec培养物的相差显微照片,以及量化该三种条件的柱形图。*p<0.05。
40.图8是描绘在冷冻保存之前(左边)和之后(右边)测量的hmvec中总主节段长度的管腺生成测定的结果的柱形图,该hmvec经通过不同刚度的水凝胶和基质蛋白组成培养的msc的条件培养基进行处理。引发的msc在冷冻保存之后保持其诱导管形成的能力。左边,*p<0.05。右边,p<0.05,单因素方差分析。
41.图9提供了在涂覆有两种基质蛋白的水凝胶上培养msc之后的管腺生成测定的示意图、管腺生成测定的定量,以及示出小管形成的各条件的相差显微照片。在msc培养之前,用12.5μg/ml纤连蛋白和12.5μg/ml胶原蛋白的组合涂覆水凝胶。两种基质蛋白的组合提高了冷冻保存后的msc的血管生成潜能。
具体实施方式
[0042]“冠状动脉疾病”或“cad”是指冠状动脉变窄,其减少流向心脏的血流量并因此减少氧供给。cad也可称为“冠心病”或“chd”。
[0043]“外周动脉疾病”或“pad”是指向四肢供应血液(因此供应氧气)的动脉变窄。
[0044]“动脉粥样硬化”涵盖cad和pad两者,因此本公开也与治疗动脉粥样硬化有关。
[0045]
如本文所用,“间充质干细胞”或“msc”是指可从广泛的组织,包括骨髓、脂肪组织(脂肪)、胎盘和脐带血分离的特定类型的干细胞。msc也称为“间充质基质细胞”。
[0046]
msc分泌生物活性分子(如细胞因子、趋化因子和生长因子),并且能够调节免疫系统。在不依赖于移植的情况下,msc已经显示促进再生和对免疫系统的效应。换句话说,msc本身并不一定并入到宿主中——而是,它们发挥其效应,然后在短时间段内被消除。然而,msc可以移植。
[0047]
治疗性msc可以是“自体的”或“同种异体的”。如本文所用,“自体的”意指用从例如患者自身骨髓或脂肪组织分离的细胞来治疗该患者,而“同种异体的”意指使用来自供体的细胞治疗其他人。同种异体msc可以经由诱导性多能干细胞或ipsc而来源于供体。替代地,同种异体msc可以来源于胚胎干细胞或esc。另外,同种异体msc也可来源于其他来源,包括例如供体骨髓、脂肪组织、脐带组织或血液、或磨牙细胞(如下颌第三磨牙的发育牙蕾)。
[0048]
同种异体msc未被证明在其他人中引起免疫反应,因此其不需要使供体与受体免疫匹配。这具有重要的商业优势。
[0049]
如本文所用,“多能干细胞”或“psc”是指能够自身无限增殖并分化成任何其他细胞类型的细胞。多能干细胞有两种主要类型:胚胎干细胞(esc)和诱导性多能干细胞(ipsc)。
[0050]
如本文所用,“胚胎干细胞”或“esc”是指从已经完成体外授精疗法并具有多余胚胎的患者所同意捐赠的五至七日龄胚胎中分离的细胞。esc的使用由于关于从人类胚胎提取细胞的伦理考量而在一定程度上受到阻碍。
[0051]
合适的人类psc包括h1和h9人类胚胎干细胞(hesc)。h1和h9 hesc可获自例如wicell,madison,wi 53719 usa。
[0052]
如本文所用,“诱导性多能干细胞”或“ipsc”是指来源于成体细胞的esc样细胞。ipsc具有与esc极为类似的特征,但避免了与esc相关的伦理考量,因为ipsc不来源于胚胎。相反,ipsc通常来源于已经被“重编程”回到多能状态的完全分化的成体细胞。
[0053]
合适的人ipsc包括但不限于来源于成纤维细胞的ipsc 19
‑9‑
7t、mirjt6i
‑
mnd1
‑
4和mirjt7i
‑
mnd2
‑
0以及来源于骨髓单核细胞的ipsc bm119
‑
9,其可获自例如wicell,madison,wi 53719 usa。其他合适的ipsc可获自cellular dynamics international of madison,wi,usa。
[0054]
根据本公开的一个实施方案,msc由具有间充质成血管细胞(mesenchymoangioblast,mca)潜能的
emh
lin
‑
kdr
+
aplnr
+
pdgfralpha
+
原中胚层细胞形成,并且可以根据wo2017/156580产生。wo2017/156580通过引用以其整体并入本文。
[0055]
根据wo2017/156580产生并任选地根据wo2018/090084测定的人msc可根据本公开进行血管生成引发。本领域技术人员已知的其他msc可根据本公开进行血管生成引发。
[0056]
基质蛋白可以包含细胞外基质(ecm)蛋白。基质蛋白可以包含:层粘连蛋白;胶原蛋白,例如i型胶原蛋白或iv型胶原蛋白;纤连蛋白;弹性蛋白;蛋白聚糖,例如硫酸乙酰肝素、硫酸软骨素或硫酸角质素。基质蛋白可为哺乳动物基质蛋白。基质蛋白可为人基质蛋白或非人类哺乳动物基质蛋白。本领域技术人员知道这些和其他基质蛋白。
[0057]
基底或水凝胶可以涂覆有两种或更多种基质蛋白。
[0058]
基底或水凝胶可以用以下量的基质蛋白涂覆:约1、2、2.5、3、4、5、6、7、7.5、8、9、10、11、12、12.5、13、14、15、16、17、17.5、18、19、20、21、22、22.5、23、24、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100μg/ml或其
±
10%。在一个实施方案中,胶原蛋白以12.5μg/ml涂覆在基底或水凝胶上。在一个实施方案中,纤连蛋白以12.5μg/ml涂覆在基底或水凝胶上。
[0059]
跨越约1kpa至100kpa刚度或其
±
10%的基底或水凝胶制剂可用于引发培养中的msc。例如,水凝胶制剂为约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19 20、21、
science and practice of pharmacy,第21版(2005),a.gennaro等人,lippincott williams&wilkins),并且包含如本文所公开的msc以及一种或多种药学上可接受的载体、稀释剂和/或赋形剂。
[0073]
还提供了一种制品和/或试剂盒,其包含容器,该容器包含本公开的msc或者药物组合物,该药物组合物包含本公开的msc。容器可以是瓶、小瓶或注射器,其包含本公开的msc或者药物组合物(任选为单位剂型),该药物组合物包含本公开的msc。例如,本公开的msc或者包含本公开的msc的药物组合物在一次性容器(任选地,注射器)中可以是可注射的。制品和/或试剂盒还可包含印刷说明书和/或标签等,其指示根据本文所公开的方法对受试者进行治疗。
[0074]
可产生“单位剂型”以利于施用和剂量均匀性,其是指适于作为用于待治疗受试者的单一剂量的物理离散单位,其含有治疗有效量的本公开的msc或者药物组合物,该药物组合物含有与所需药物赋形剂、载体和/或稀释剂联合的本公开的msc。在一个实施方案中,单位剂型是密封容器并且是无菌的。
[0075]
术语“治疗有效量”是指在受试者中有效地治疗cad或pad的本公开的msc或者药物组合物的量,该药物组合物包含本公开的msc。
[0076]
术语“治疗(treat、treating或treatment)”是指治疗性处理和预防或预防性措施两者,其中目的是在受试者中预防、减少或改善cad或pad,或者是在受试者中减缓(减轻)cad或pad的进展。需要治疗的受试者包括已经患有cad或pad的那些以及其中需要预防或改善cad或pad的那些。
[0077]
术语“预防(preventing、prevention、preventative)”或“预防性(prophylactic)”是指阻止cad或pad的发生,或者阻碍、防御或避免cad或pad的发生。需要预防的受试者可能倾向于发展cad或pad。
[0078]
术语“改善(ameliorate或amelioration)”是指cad或pad的减少、降低或消除。
[0079]
如本文所用,术语“受试者”可指哺乳动物。哺乳动物可为灵长类动物,特别是人类,或者可为家养动物、动物园动物或伴侣动物。虽然特别考虑到本文所公开的msc、组合物和方法适用于人类的医学治疗,但其也适用于兽医治疗,包括治疗家养动物(如马、牛和羊)、伴侣动物(如狗和猫)或动物园动物(如猫科动物、犬科动物、牛科动物和有蹄类动物)。
[0080]
除非在本说明书中另有定义,否则本文使用的技术和科学术语具有与本发明所属领域的技术人员和通过参考公开文本通常理解的含义相同的含义。
[0081]
在所附权利要求中以及在本发明的说明书中,除非上下文由于表达语言或必要的含意而另外要求,词语“包含(comprise)”或变型形式(如“包含(comprises或comprising)”)以包括性含义使用,即,指定所陈述特征的存在,但不排除在本发明的各种实施方案中存在或添加另外的特征。
[0082]
实验设计描绘于图1和图2中。实验结果描绘于图3至9中。
[0083]
附图显示基质生物和物理组成影响msc形态。msc在细胞形状和肌动蛋白丝组构方面表现出不同,这取决于凝胶刚度和与各基底缀合的蛋白质(图4)。细胞在所有条件下显示出圆形形态,并且在1kpa纤连蛋白组中显示出更显著的细胞聚集(图4,左中图)。在较高刚度凝胶上,msc铺展开。特别地,接种在10kpa纤连蛋白基底上的细胞能够彼此对齐(图4,中间一行的中间图)。在胶原蛋白涂覆的表面上培养的细胞在较高硬度的基底上也保持细胞
聚集。
[0084]
附图还显示,通过特定的基底刚度和基质蛋白的组合来刺激管形成。在水凝胶上培养2天之后,从各条件收集细胞培养基并且将其用于执行管腺生成测定。在8小时后评估管形成。结果显示,所有胶原蛋白和纤连蛋白涂覆的表面均能够比正常组织培养板(tcps)以及涂覆有纤连蛋白和i型胶原蛋白的组合的tcps更好地诱导管形成。此外,来自10kpa胶原蛋白的条件培养基显示出比阳性对照更高的管形成(图5)。当纤连蛋白和胶原蛋白均涂覆在不同刚度的凝胶上时,1kpa和10kpa显示出最好的管腺生成(图9)。
[0085]
实施例
[0086]
实施例1
[0087]
使用根据wo2017/156580产生并任选地根据wo2018/090084测定的人msc。
[0088]
对于水凝胶缀合,使用用于将氧化蛋白印刷到聚丙烯酰胺上的光刻技术来制造聚二甲基硅氧烷(pdms)印模。研究跨越1
‑
40kpa的水凝胶制剂;通过纳米压痕验证水凝胶机械特性。使基质蛋白层粘连蛋白、i型胶原蛋白和纤连蛋白氧化,并单独或组合地在基底上进行图案化。利用碘化作用来验证蛋白质表面密度。
[0089]
2天后收集msc的条件培养基。使用体外管腺生成测定来探测血管生成活性,其中将条件培养基添加到含有人微血管内皮细胞(hmvec)的生长因子耗竭的基质胶中。在8小时时收集管形成的图像并使用imagej(nih)进行定量。
[0090]
针对冷冻保存之前和之后的活化态的持久性,研究引发促血管生成状态的条件。
[0091]
实施例2
[0092]
使用市售细胞因子阵列,针对一组促血管生成细胞因子,对促进管腺生成的msc条件培养基进行分析。
[0093]
将msc包封在与基质金属蛋白酶(mmp)可降解肽交联的聚(乙二醇)二丙烯酸酯(pegda)水凝胶内。对在筛选中确认的促进血管生成分泌蛋白质组的蛋白质进行丙烯酸酯化,以便将其引入到材料内。通过pegda分子量调整机械特性并且通过纳米压痕对其进行评价。抗体阵列和hmvec的体外管腺生成用于评价包封msc的分泌。
[0094]
实施例3——使人psc分化为msc的方案
[0095]
表1.试剂
[0096]
[0097][0098]
表1中所列的试剂是本领域的技术人员已知的,并且具有被接受的组成,例如imdm和ham’s f12。glutamax包含l
‑
丙氨酰
‑
l
‑
谷氨酰胺二肽,通常以0.85%nacl中200mm的浓度供应。在二肽键被所培养的细胞裂解后,glutamax释放l
‑
谷氨酰胺。化学限定的脂质浓缩物包含2mg/l花生四烯酸、220mg/l胆固醇、70mg/l dl
‑
α
‑
生育酚乙酸酯、10mg/l亚油酸、10mg/l亚麻酸、10mg/l肉豆蔻酸、10mg/l油酸、10mg/l棕榈酸、10mg/l棕榈油酸、90g/l普朗尼克f
‑
68、10mg/l硬脂酸、2.2g/l tween和乙醇。h
‑
1152和y27632是高效的、细胞可渗透的选择性rock(rho相关的卷曲螺旋形成蛋白丝氨酸/苏氨酸激酶)抑制剂。
[0099]
表2.if6s培养基(10x浓度)
[0100][0101]
表3.if9s培养基(1x浓度;基于if6s)
[0102]
if9s量终浓度if6s5ml1x聚乙烯醇(pva;20mg/ml溶液)25ml10mg/ml全铁转铁蛋白(10.6mg/ml溶液)50μl10.6μg/ml胰岛素100μl20μg/ml胚胎移植级水至50mlna
[0103]
表4.分化培养基(1x浓度;基于if9s)
[0104]
分化培养基量终浓度if9s36ml1xfgf21.8μg50ng/mllicl(2m溶液)36μl2mmbmp4(100μg/ml溶液)18μl50ng/ml激活素a(10mg/ml溶液)5.4μl1.5ng/ml
[0105]
表5.间充质集落形成培养基(1x浓度)
[0106][0107][0108]
表6.间充质无血清扩增培养基(1x浓度)
[0109]
m
‑
sfem量终浓度人内皮
‑
sfm5l50%stemline ii hsfm5l50%glutamax100ml1x1
‑
硫代甘油87μl100μmfgf2100μg10ng/ml
[0110]
方案
[0111]
1.在玻连蛋白涂覆的(0.5μg/cm2)塑料器皿上在e8完全培养基(dmem/f12基础培养基+e8补充剂)+1μm h1152中解冻ipsc。在37℃、5%co2、20%o2(常氧)下孵育铺板的ipsc。
[0112]
2.在玻连蛋白涂覆的(0.5μg/cm2)塑料器皿上在e8完全培养基(不具有rock抑制剂)中使ipsc扩增三代,并且在37℃、5%co2、20%o2(常氧)下孵育,之后开始分化过程。
[0113]
3.收获ipsc并将其作为单细胞/小集落以5
×
103个细胞/cm2接种到iv型胶原蛋白涂覆的(0.5μg/cm2)塑料器皿上的e8完全培养基+10μm y27632中,并且在37℃、5%co2、20%o2(常氧)下孵育24小时。
[0114]
4.用分化培养基替换e8完全培养基+10μm y27632,并在37℃、5%co2、5%o2(低氧)下孵育48小时。
[0115]
5.从分化培养基贴壁培养物中收获集落形成细胞,作为单细胞悬液,将其转移到m
‑
cfm悬液培养物中,并在37℃、5%co2、20%o2(常氧)下孵育12天。
[0116]
6.收获集落(0代)并将其接种到纤连蛋白/i型胶原蛋白涂覆的(0.67μg/cm2纤连蛋白、1.2μg/cm2i型胶原蛋白)塑料器皿上的m
‑
sfem中,并在37℃、5%co2、20%o2(常氧)下孵育3天。
[0117]
7.收获集落并将其作为单细胞(1代)以1.3
×
104个细胞/cm2接种到纤连蛋白/1型胶原蛋白涂覆的塑料器皿上的m
‑
sfem中,并在37℃、5%co2、20%o2(常氧)下孵育3天。
[0118]
8.收获(2代)并将其作为单细胞以1.3
×
104个细胞/cm2接种到纤连蛋白/1型胶原蛋白涂覆的塑料器皿上的m
‑
sfem中,并在37℃、5%co2、20%o2(常氧)下孵育3天。
[0119]
9.收获(3代)并将其作为单细胞以1.3
×
104个细胞/cm2接种到纤连蛋白/1型胶原蛋白涂覆的塑料器皿上的m
‑
sfem中,并在37℃、5%co2、20%o2(常氧)下孵育3天。
[0120]
10.收获(4代)并将其作为单细胞以1.3
×
104个细胞/cm2接种到纤连蛋白/1型胶原蛋白涂覆的塑料器皿上的m
‑
sfem中,并在37℃、5%co2、20%o2(常氧)下孵育3天。
[0121]
11.收获(5代)并将其作为单细胞以1.3
×
104个细胞/cm2接种到纤连蛋白/1型胶原蛋白涂覆的塑料器皿上的m
‑
sfem中,并在37℃、5%co2、20%o2(常氧)下孵育3天。
[0122]
12.作为单细胞收获并冷冻最终产物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1