肽化合物的制造方法与流程
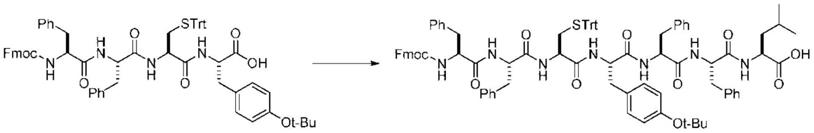
1.本发明涉及使用流动反应器(flow reactor)的肽的新型制造方法。
背景技术:
2.下述方法是已知的:用氯甲酸烷基酯将肽中的c末端羧基活化,并使其与经甲硅烷基化的氨基酸或肽反应,从而一步合成羧酸游离的肽(专利文献1、2)。需要说明的是,已知的是,就使用氯甲酸烷基酯将n末端经烷氧基羰基保护的氨基酸中的c末端羧基活化的方法而言,能够稳定地取出经活化的中间体(非专利文献1、2)。另一方面,已知的是,就使用氯甲酸烷基酯将例如肽这样在n末端具有酰胺结构的氨基酸中的c末端羧基活化的方法而言,无法稳定地取出经活化的中间体,且会形成吖内酯(oxazolon)(非专利文献1)。
3.另外,作为与间歇式不同的反应形式,有连续式,其中,已知下述方法:使用被称为流动反应器、微型反应器的小型反应装置,在使溶液流动的同时连续地进行化学合成。已知的是,与以往实施的间歇方式相比,流动反应器使用小的反应容器进行反应,因此具有能够实现精密的温度控制及反应时间控制、混合效率也良好这样的优点(非专利文献5)。作为合成肽的例子,已知使用三光气作为缩合剂来合成二肽并使肽链向n末端方向延伸的方法(非专利文献3、4)。另外,还已知使用o
‑
(苯并三唑
‑1‑
基)
‑
n,n,n’,n
’‑
四甲基脲六氟磷酸盐(hbtu)作为缩合剂而将肽彼此缩合的方法(专利文献3、4)。
4.现有技术文献
5.专利文献
6.专利文献1:日本专利第5535928号
7.专利文献2:美国专利第5714484号
8.专利文献3:日本特开2006
‑
169165号公报
9.专利文献4:国际公开第2007/059922号
10.非专利文献
11.非专利文献1:international journal of peptide and protein research,1988年,第31卷,第339
‑
344页
12.非专利文献2:canadian journal of chemistry,1987年,第67卷,619
‑
624
13.非专利文献3:angewandte chemie international edition,2014年,第53卷,851
‑
855
14.非专利文献4:nature communications,2016年,7,13429
15.非专利文献5:微型反应器的开发和应用(
マイクロリアクターの
開発
と
応用),2003年,第3
‑
9页
技术实现要素:
16.发明要解决的课题
17.本技术的发明人确认后发现,就专利文献1、2记载的间歇式而言,为了对羧基经活
化的肽与经甲硅烷基化的氨基酸或肽的反应中的发热进行控制,试剂的滴加耗费时间,并生成作为副产物的吖内酯而使收率降低,不适合在工业上实施。
18.另一方面,就非专利文献3、4记载的流动式而言,由于使用c末端被烷基保护的氨基酸,因此在使肽向c末端方向延伸的情况下,需要将c末端进行脱保护。另外,就羧基的活化而言,仅是氨基经保护的氨基酸,未对由具有酰胺键的肽末端(其容易生成吖内酯)的羧基活化带来的、向c末端侧的延伸进行研究。
19.另外,就专利文献3、4记载的流动式而言,得到的肽的c末端为难以脱保护的烷基酰胺,不适合于在c末端侧使肽链延伸的方法。此外,发现在实施利用hbtu将c末端羧基活化了的肽、与经甲硅烷基化的氨基酸或肽的反应时,发生由固体析出导致的流路堵塞。
20.此外,还发现在流动式中使用间歇式所用的三乙胺、二异丙基乙基胺作为利用氯甲酸烷基酯将羧基活化时使用的有机叔胺的情况下,反应未充分地进行。
21.本发明提供使用流动反应器使肽链从c末端侧延伸的、肽的新型制造方法。
22.用于解决课题的手段
23.本技术的发明人进行了深入研究,结果发现,通过使用酰卤化物和具有特定结构的有机叔胺在流动反应器中将肽的c末端羧基活化,在流动反应器中实施c末端羧基经活化的肽与经甲硅烷基化的氨基酸或肽的反应,能够解决上述课题,从而完成了本发明。即,本发明的特征如下。
24.[1]肽的制造方法,其包括下述工序(1),
[0025]
工序(1),使c末端羧基被活化的肽与经甲硅烷基化的氨基酸或肽在流动反应器中反应,其中,所述c末端羧基被活化的肽是使酰卤化物及式(ii)表示的叔胺与式(i)表示的n
‑
保护肽在流动反应器中反应而得到的,所述经甲硅烷基化的氨基酸或肽是使式(iii)表示的氨基酸或肽与甲硅烷基化剂反应而得到的,
[0026]
式(i):
[0027]
[化学式1]
[0028][0029]
[式中,aa1表示来自由2~20个氨基酸形成的肽的基团,p表示n末端保护基]
[0030]
式(ii):
[0031]
[化学式2]
[0032][0033]
[式中,
[0034]
r1、r2及r3中的1个或2个为甲基,其余为可具有取代基的脂肪族烃基,r1、r2及r3中的一个为甲基时,其余的2个可以一起形成c5‑6的亚烷基链,由此与它们所键合的氮原子一起形成6
‑
7元环,此时,该亚烷基链中的1个可以被替换为o或nr8(r8表示可具有取代基的脂肪族烃基)],
[0035]
式(iii):
[0036]
[化学式3]
[0037]
h
‑
aa2‑
oh
[0038]
(iii)
[0039]
[式中,aa2表示来自氨基酸或由2~20个残基形成的肽的基团]。
[0040]
[2]如[1]所述的肽的制造方法,其中,相对于式(i)表示的n
‑
保护肽,式(ii)表示的叔胺的使用量为0.05摩尔当量至1摩尔当量,进一步使用式(iv)表示的叔胺,
[0041]
式(iv)
[0042]
[化学式4]
[0043][0044]
[式中,
[0045]
r4、r5及r6各自独立地为可具有取代基的脂肪族烃基(其中,不包括甲基),r4、r5及r6中的2个可以形成c5‑6的亚烷基链,由此与它们所键合的氮原子一起形成6
‑
7元环,此时,该亚烷基链中的1个可以被替换为o或nr8(r8表示可具有取代基的脂肪族烃基)]。
[0046]
[3]如[2]所述的肽的制造方法,其中,相对于式(i)表示的n
‑
保护肽,式(iv)表示的叔胺与式(ii)表示的叔胺的总使用量为1.0至10摩尔当量。
[0047]
[4]如[1]至[3]中任一项所述的肽的制造方法,其中,酰卤化物为氯甲酸烷基酯、羧酰氯、磺酰氯或磷酰氯。
[0048]
[5]如[1]至[4]中任一项所述的肽的制造方法,其中,酰卤化物为氯甲酸c1‑6烷基酯。
[0049]
[6]如[1]至[5]中任一项所述的肽的制造方法,其中,酰卤化物为氯甲酸异丁酯。
[0050]
[7]如[1]至[6]中任一项所述的肽的制造方法,其中,式(ii)表示的叔胺为n,n
‑
二甲基丁基胺、n,n
‑
二甲基苄基胺、n
‑
甲基二乙基胺、n
‑
甲基哌啶或n
‑
甲基吗啉。
[0051]
[8]如[2]至[7]中任一项所述的肽的制造方法,其中,式(iv)表示的叔胺为n,n
‑
二异丙基乙基胺或三正丙基胺。
[0052]
[9]如[1]至[8]中任一项所述的肽的制造方法,其中,氨基酸或肽由α
‑
氨基酸构成。
[0053]
[10]如[1]至[9]中任一项所述的制造方法,其中,n
‑
保护肽的n末端的保护基为氨基甲酸酯系保护基。
[0054]
[11]如[1]至[10]中任一项所述的制造方法,其中,n
‑
保护肽的n末端的保护基为苄氧羰基、9
‑
芴基甲氧基羰基或叔丁氧羰基。
[0055]
[12]如[1]至[11]中任一项所述的制造方法,其中,甲硅烷基化剂为n,o
‑
双(三甲基甲硅烷基)乙酰胺。
[0056]
发明的效果
[0057]
通过本发明,能够提供基于流动反应器的肽的新型制造方法。
具体实施方式
[0058]
本说明书中的“n
‑”
是指正,“i
‑”
是指异,“s
‑”
及“sec
‑”
是指仲,“t
‑”
及“tert”是指叔,“c
‑”
是指环,“p
‑”
是指对,“me”是指甲基,“bu”是指丁基,“pr”是指丙基,“bn”是指苄基,“ph”是指苯基,“boc”是指叔丁氧羰基,“cbz”是指苄氧羰基,“fmoc”是指9
‑
芴基甲氧基羰基,“trt”是指三苯甲基,“ac”是指乙酰基。
[0059]“卤素”是指氟、氯、溴或碘。
[0060]“c1‑6烷基”是指碳原子数为1至6个的直链或支链状的烷基,作为具体例,可举出甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、正己基等。
[0061]“脂肪族烃基”是指直链、支链状或环状的、饱和或不饱和的脂肪族烃基,可举出烷基、环烷基、链烯基、炔基、芳烷基等,作为具体例,可举出c1‑
10
烷基、c3‑6环烷基、c2‑6链烯基、c2‑6炔基、c7‑
14
芳烷基等。
[0062]“c1‑
10
烷基”是指碳原子数为1至10个的直链或支链状的烷基,作为具体例,可举出甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、正己基、辛基、癸基等。
[0063]“c2‑6烷基”是指碳原子数为2至6个的直链或支链状的烷基,作为具体例,可举出乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、正己基等。
[0064]“c2‑6链烯基”是指碳原子数为2至6个的直链或支链状的链烯基,作为具体例,可举出乙烯基、1
‑
丙烯基、烯丙基、异丙烯基、丁烯基、异丁烯基等。
[0065]“c2‑6炔基”是指碳原子数为2至6个的直链或支链状的炔基,作为具体例,乙炔基、1
‑
丙炔基等可举出。
[0066]“c3‑6环烷基”是指碳原子数为3至6个的环烷基,作为具体例,可举出环丙基、环丁基、环戊基、环己基等。
[0067]“c7‑
14
芳烷基”是指碳原子数为7至14个的芳烷基,作为具体例,可举出苄基、1
‑
苯基乙基、2
‑
苯基乙基、1
‑
苯基丙基、萘基甲基、1
‑
萘基乙基、1
‑
萘基丙基等。
[0068]“三c1‑6烷基甲硅烷基”是指相同或不同的3个上述“c1‑6烷基”与甲硅烷基键合而成的基团,作为具体例,可举出三甲基甲硅烷基、三乙基甲硅烷基、三异丙基甲硅烷基、叔丁基二甲基甲硅烷基等。
[0069]“三c1‑6烷基甲硅烷基氧基”是指相同或不同的3个上述“c1‑6烷基”与甲硅烷基氧基键合而成的基团,作为具体例,可举出三甲基甲硅烷基氧基、三乙基甲硅烷基氧基、三异丙基甲硅烷基氧基、叔丁基二甲基甲硅烷基氧基等。
[0070]“二c1‑6烷基氨基”是指相同或不同的2个上述“c1‑6烷基”与氨基键合而成的基团,作为具体例,可举出二甲基氨基、二乙基氨基、二正丙基氨基、二异丙基氨基、二正丁基氨基、二异丁基氨基、二叔丁基氨基、二正戊基氨基、二正己基氨基、n
‑
乙基
‑
n
‑
甲基氨基、n
‑
甲基
‑
n
‑
正丙基氨基、n
‑
异丙基
‑
n
‑
甲基氨基、n
‑
正丁基
‑
n
‑
甲基氨基、n
‑
异丁基
‑
n
‑
甲基氨基、n
‑
叔丁基
‑
n
‑
甲基氨基、n
‑
甲基
‑
n
‑
正戊基氨基、n
‑
正己基
‑
n
‑
甲基氨基、n
‑
乙基
‑
n
‑
正丙基氨基、n
‑
乙基
‑
n
‑
异丙基氨基、n
‑
正丁基
‑
n
‑
乙基氨基、n
‑
乙基
‑
n
‑
异丁基氨基、n
‑
叔丁基
‑
n
‑
乙基氨基、n
‑
乙基
‑
n
‑
正戊基氨基、n
‑
乙基
‑
n
‑
正己基氨基等。
[0071]“5
‑
10元杂环基”是指构成环的原子数为5至10个、并且构成环的原子中含有1至4个独立地选自由氮原子、氧原子及硫原子组成的组中的杂原子的单环系或稠合多环系的杂
环基。该杂环基可以为饱和、部分不饱和、不饱和中的任意,作为具体例,可举出吡咯烷基、四氢呋喃基、四氢噻吩基、哌啶基、四氢吡喃基、四氢噻喃基、吡咯基、呋喃基、噻吩基、吡啶基、嘧啶基、哒嗪基、氮杂环庚烷基(azepanyl)、氧杂环庚烷基(oxepanyl)、硫杂环庚烷基(thiepanyl)、氮杂环庚烯基(azepinyl)、氧杂环庚烯基(oxepinyl)、硫杂环庚烯基(thiepinyl)、咪唑基、吡唑基、噁唑基、噻唑基、咪唑啉基、吡嗪基、吗啉基、噻嗪基、吲哚基、异吲哚基、苯并咪唑基、嘌呤基、喹啉基、异喹啉基、喹喔啉基、噌啉基、蝶啶基、色烯基、异色烯基等。
[0072]“c6‑
14
芳基”是指碳原子数为6至14个的芳香族烃基,作为其具体例,可举出苯基、1
‑
萘基、2
‑
萘基、1
‑
蒽基、2
‑
蒽基、9
‑
蒽基、联苯基等。
[0073]“c6‑
14
芳基氧基”是指碳原子数为6至14个的芳基氧基,作为具体例,可举出苯氧基、1
‑
萘氧基、2
‑
萘氧基、1
‑
蒽氧基、2
‑
蒽氧基、9
‑
蒽氧基、联苯基氧基等。
[0074]“c1‑6烷氧基”是指碳原子数为1至6个的直链或支链状的烷氧基,作为具体例,可举出甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、叔丁氧基、正戊氧基、正己氧基等。
[0075]“c3‑6环烷氧基”是指碳原子数为3至6个的环烷氧基,作为具体例,可举出环丙氧基、环丁氧基、环戊氧基、环己氧基等。
[0076]“c1‑6烷氧基羰基”是指碳原子数为1至6个的直链或支链状的烷氧基羰基,作为具体例,可举出甲氧基羰基、乙氧基羰基、正丙氧基羰基、异丙氧基羰基、正丁氧基羰基、异丁氧基羰基、叔丁氧羰基、正戊氧基羰基、正己氧基羰基等。
[0077]“可具有取代基”是指未取代、或者被任意数目的任意取代基取代。
[0078]
上述的“任意的取代基”只要为不对本发明作为对象的反应造成不良影响的取代基即可,种类没有特别限定。
[0079]
作为“可具有取代基的脂肪族烃基”中的“取代基”,例如,可举出c6‑
14
芳基、c6‑
14
芳基氧基、5
‑
10元杂环基、羟基、c1‑6烷氧基、c3‑6环烷氧基、乙酰氧基、苯甲酰氧基、氨基、n
‑
乙酰氨基、二c1‑6烷基氨基、卤原子、c1‑6烷氧基羰基、苯氧基羰基、n
‑
甲基氨基甲酰基、n
‑
苯基氨基甲酰基、三c1‑6烷基甲硅烷基、三c1‑6烷基甲硅烷基氧基、氰基、硝基、羧基等,优选为c6‑
14
芳基、c1‑6烷氧基、二c1‑6烷基氨基、三c1‑6烷基甲硅烷基、三c1‑6烷基甲硅烷基氧基,更优选为c6‑
14
芳基、c1‑6烷氧基、三c1‑6烷基甲硅烷基。
[0080]“n
‑
保护肽”是指n末端的氨基被保护、c末端的羧基未被保护的肽。
[0081]
作为本说明书中的、“r1、r2及r3中的一个为甲基时,其余的2个可以一起形成c5‑6的亚烷基链,由此与它们所键合的氮原子一起形成6
‑
7元环,此时,该亚烷基链中的1个可以被替换为o或nr8(r8表示可具有取代基的脂肪族烃基。)”的表述的具体例,可举出哌啶、氮杂环庚烷、吗啉、n
‑
甲基哌嗪等。
[0082]
本发明中使用的氨基酸为具有氨基和羧基这两种官能团的有机化合物,优选为α
‑
氨基酸、β
‑
氨基酸、γ
‑
氨基酸或δ
‑
氨基酸,更优选为α
‑
氨基酸或β
‑
氨基酸,进一步优选为α
‑
氨基酸。
[0083]
本发明中使用的氨基酸的氨基可以被取代,优选可以被可具有取代基的脂肪族烃基取代,更优选可以被c1‑6烷基或c7‑
14
芳烷基取代,进一步优选可以被甲基取代。
[0084]
构成本发明中使用的肽的氨基酸为上述的氨基酸。
[0085]
α
‑
氨基酸的立体结构没有特别限定,优选为l体。
[0086]
本说明书中使用的所有技术术语及科学术语具有与本发明所属的技术领域的人员通常所理解的相同的含义。与本说明书中记载的相同或同等的任意方法及材料均可以在本发明的实施或试验中使用,以下记载优选的方法及材料。出于描述和公开构建体和方法论的目的,本说明书提及的所有出版物和专利作为参照并入本说明书,所述构建体和方法例如在可与所描述的发明相关联地使用的出版物中描述。
[0087]
(本发明的肽的制造方法的具体说明)
[0088]
以下对本发明的肽的制造方法进行说明。
[0089]
本具体说明基于以下内容进行说明。
[0090]
(a)r1、r2及r3与上述为相同含义。
[0091]
(b)反应的具体条件只要可实现本发明的肽的制造即可,没有特别限制。各反应中的优选条件适当进行详细陈述。
[0092]
(c)各反应中记载的溶剂可以单独使用,也可以混合两种以上而使用。
[0093]
本发明为下述制造方法:使用具有特定结构的有机叔胺,使n
‑
保护肽的c末端的羧基在流动反应器中活化,使其与经甲硅烷基化的氨基酸或肽在流动反应器中反应,得到c末端经延伸的肽。
[0094]
使用具有特定结构的有机叔胺的n
‑
保护肽的c末端羧基的活化反应可以在酰氯化物的存在下实施。另外,使用具有特定结构的有机叔胺作为催化剂进行实施的情况下,可以在其他的碱共存的情况下实施。
[0095]
本说明书中,“具有特定结构的有机叔胺”是指上述式(ii)表示的胺化合物,优选:r1、r2及r3中的1个或2个为甲基、其余为可具有取代基的c1‑6烷基的胺;或者r1、r2及r3中的1个为甲基、其余的2个一起形成c5的亚烷基链由此与它们所键合的氮原子一起形成6元环(此时,该亚烷基链中的1个可以被替换为o)的胺,更优选为n,n
‑
二甲基丁基胺、n,n
‑
二甲基苄基胺、n
‑
甲基二乙基胺、n
‑
甲基哌啶或n
‑
甲基吗啉。
[0096]
本发明中使用的酰卤化物优选为氯甲酸烷基酯、羧酰氯、磺酰氯、磷酰氯,更优选为氯甲酸烷基酯、羧酰氯,进一步优选为氯甲酸c1‑6烷基酯,尤其优选为氯甲酸异丁酯。
[0097]
本发明中使用的“其他的碱”是指上述式(iv)表示的化合物,优选:r4、r5及r6独立地为可具有取代基的c2‑6烷基的胺;或者r4、r5及r6中的2个一起形成c5的亚烷基链、由此与它们所键合的氮原子一起形成6元环(此时,该亚烷基链中的1个可以被替换为o)的胺,更优选r4、r5及r6独立地为c2‑6烷基的胺,进一步优选为n,n
‑
二异丙基乙基胺或三正丙基胺。
[0098]
本发明中使用的“具有特定结构的有机叔胺”的使用量相对于式(i)表示的n
‑
保护肽而言,优选为0.01当量至50当量,更优选为0.1当量至20当量,进一步优选为0.2当量至5当量。
[0099]
本发明中使用的“具有特定结构的有机叔胺”的使用量相对于式(i)表示的n
‑
保护肽而言小于1当量时,与“其他的碱”的总使用量相对于式(i)表示的n
‑
保护肽而言,优选为0.9当量至50当量,更优选为0.95当量至20当量,进一步优选为1.0当量至5当量。
[0100]
本发明中使用的酸氯化物的使用量相对于式(i)表示的n
‑
保护肽而言,优选为0.9当量至50当量,更优选为0.95当量至20当量,进一步优选为1.0当量至5当量。
[0101]
本发明中使用的经甲硅烷基化的氨基酸或肽只要不妨碍反应即可,没有特别限
定,例如可利用专利文献1、2记载的方法,由氨基酸或肽与甲硅烷基化剂制备。
[0102]
本发明中使用的甲硅烷基化剂只要不妨碍反应即可,没有特别限定,例如为n,o
‑
双(三甲基甲硅烷基)乙酰胺、n,o
‑
双(三甲基甲硅烷基)三氟乙酰胺、六甲基二硅氮烷、n
‑
甲基
‑
n
‑
三甲基甲硅烷基乙酰胺(msa)、n
‑
甲基
‑
n
‑
三甲基甲硅烷基三氟乙酰胺、n
‑
(三甲基甲硅烷基)乙酰胺、n
‑
(三甲基甲硅烷基)二乙基胺、n
‑
(三甲基甲硅烷基)二甲基胺、1
‑
(三甲基甲硅烷基)咪唑、3
‑
(三甲基甲硅烷基)
‑2‑
噁唑烷酮、三甲基氰硅烷、氯三甲基硅烷、溴化三甲基硅烷、碘化三甲基硅烷、三氟甲磺酸三甲基甲硅烷基酯,优选为n,o
‑
双(三甲基甲硅烷基)乙酰胺。
[0103]
本发明中使用的溶剂只要不妨碍反应,则没有特别限定,作为其例子,可举出含卤素烃溶剂(例如,二氯甲烷、氯仿)、芳香族烃溶剂(例如,甲苯、二甲苯)、醚溶剂(例如,四氢呋喃、1,4
‑
二氧杂环己烷、环戊基甲基醚、甲基叔丁基醚)、酰胺溶剂(例如,n,n
‑
二甲基甲酰胺、n
‑
甲基吡咯烷酮)、腈溶剂(例如,乙腈)等。优选为腈溶剂、酰胺溶剂、或醚溶剂,更优选为乙腈、四氢呋喃、或n
‑
甲基吡咯烷酮。
[0104]
本发明中使用的溶剂的使用量相对于式(i)表示的n
‑
保护肽而言优选为100质量倍以下,更优选为1质量倍至50质量倍,进一步优选为5质量倍至20质量倍。
[0105]
本发明中使用的流动反应器是指将试剂连续地送入反应器、并将反应物连续地取出的装置,通常使用内径10μm至3cm左右的细长的流通路径。通常被称为微型反应器的装置为流动反应器的一种。
[0106]
本发明中,混合器及流通路径的形状、材质没有特别限定。例如作为混合器,可以使用t字管、株式会社techno applications制静态型混合器(商品名cometx
‑
01)、noritake制静态混合器(商品名c型、t型)等静态型混合器、株式会社ymc制螺旋型混合器(商品名spica)等螺旋型混合器等,优选株式会社techno applications制静态型混合器(商品名cometx
‑
01)。
[0107]
作为本发明中使用的混合器的材质,优选不锈钢、玻璃、聚四氟乙烯树脂。
[0108]
作为本发明中使用的流通路径没有特别限定,优选为截面积80μm2至7cm2、长度1cm至300m的管,更优选为截面积0.2mm2至80mm2、长度0.1m至10m的管。
[0109]
作为本发明中使用的流通路径的材质,优选玻璃、不锈钢、聚四氟乙烯树脂。
[0110]
本发明中使用的流速没有特别限定,例如为每分钟0.1ml至1l,优选为每分钟5ml至500ml。
[0111]
本发明中的反应温度没有特别限定,可以为
‑
40℃至使用的溶剂的沸点,优选可以在0~40℃的范围内进行。为了提高除热效率,可以将混合器部设定为比其之后的部分的温度低。
[0112]
本发明中得到的、“c末端经延伸的肽”为式(v)表示的化合物:
[0113]
[化学式5]
[0114]
p
‑
aa1‑
aa2‑
oh
[0115]
(v)
[0116]
[式中,各符号与上述为相同含义。]。
[0117]
各反应中,反应基质具有羟基、巯基、氨基、羧基或羰基时(尤其是在氨基酸或肽的侧链具有官能团时),可以利用肽化学等向这些基团中导入通常使用的保护基,反应后根据
需要将保护基除去,由此可以得到目标化合物。
[0118]
保护及脱保护可以通过下述方式实施:使用通常已知的保护基,进行保护
·
脱保护反应(例如,参见有机合成中的保护基第4版(protective groups in organic synthesis,fourth edition)、greene(t.w.greene)著、john wiley&sons inc.)(2006年)等)。
[0119]
实施例
[0120]
以下,示出参考合成例、合成例,更详细地说明本发明,但本发明不限于这些实施例。
[0121]
本说明书中,将氨基酸等以简称表示时,各表示基于由iupac
‑
iub commission on biochemical nomenclature定义的简称或本领域中的惯用简称。
[0122]
在没有特别记载的情况下,实施例的质子核磁共振(1h
‑
nmr)使用日本电子(jeol)公司制jnm
‑
ecp300、或日本电子(jeol)公司制jnm
‑
ecx300、或布鲁克(bruker)公司制ascend
tm
500,在氘代氯仿或氘代二甲基亚砜溶剂中进行测定,化学位移以将四甲基硅烷作为内部标准(0.0ppm)时的δ值(ppm)表示。
[0123]
nmr谱的记载中,“s”是指单峰,“d”是指双峰,“t”是指三重峰,“q”是指四重峰,“dd”是指双二重峰,“dt”是指双重三重峰,“m”是指多重峰,“br”是指宽峰,“j”是指耦合常数,“hz”是指赫兹,“cdcl
3”是指氘代氯仿。
[0124]
在没有特别记载的情况下,高效液相色谱/质谱使用waters公司制acquity uplc h
‑
class/qda、waters公司制acquity uplc h
‑
class/sqd2、或shimadzu公司制lc
‑
20ad/triple tof 5600中的任意进行测定。
[0125]
在高效液相色谱/质谱的记载中,esi+为电喷雾离子化法的正离子模式,m+h是指质子加成物,m+na是指钠加成物。
[0126]
在高效液相色谱/质谱的记载中,esi
‑
为电喷雾离子化法的负离子模式,m
‑
h是指去质子离子。
[0127]
在没有特别记载的情况下,利用硅胶柱色谱进行的纯化使用山善制hi
‑
flash柱、biotage制snap ultra silica cartridge、merck制silica gel 60或fuji silysia chemical制psq60b中的任意。
[0128]
需要说明的是,在没有特别说明的情况下,本实施例中使用的混合器为株式会社techno applications制静态型混合器(商品名cometx
‑
01)。
[0129]
参考合成例1:fmoc
‑
phe
‑
phe
‑
oh的合成
[0130]
[化学式6]
[0131][0132]
将苯基丙氨酸(12.8g,78.5mmol)与四氢呋喃(75.0g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(31.5g,157mmol)后,于40℃搅拌1小时,冷却至0℃(甲硅烷基化氨基酸溶液)。将fmoc
‑
phe
‑
oh(25.0g,64.5mmol)、n
‑
甲基吗啉(7.83g,78.5mmol)与四氢呋喃(125g)混合,冷却至0℃,一次性加入氯甲酸异丁酯(9.70g,71.0mmol),然后搅拌2分钟,加入甲硅烷基氨基酸溶液,搅拌1小时。向得到的反应液中加入水(50g),进行减压浓缩。用乙酸乙酯
(130g)将浓缩后的液体萃取2次,用水对得到的有机层清洗3次。将得到的有机层减压浓缩,加入乙腈(150g)并再次减压浓缩,加入乙腈(130g)并搅拌0.5小时,然后进行过滤,得到白色固体。向得到的固体中加入乙腈(150g),搅拌0.5小时后,通过过滤得到固体,然后进行减压干燥,以白色固体的形式得到fmoc
‑
phe
‑
phe
‑
oh(26.7g,收率78%,非对映异构体过量率99.7%de)。
[0133]
mass(esi+)m/z;535.34(m+h)+
[0134]
非对映异构体过量率通过使用高效液相色谱的分析<分析条件a>算出。
[0135]
<分析条件a>
[0136]
高效液相色谱:shimadzu制hplc lc
‑
20a
[0137]
色谱柱:agilent制poroshell 120ec
‑
c18(2.7μm,3.0
×
100mm)
[0138]
柱温箱温度:40℃
[0139]
洗脱液:乙腈:0.05vol%磷酸水溶液
[0140]
45:55(0
‑
15分钟)、45:55
‑
95:5(15
‑
18分钟)、95:5(18
‑
22分钟)(v/v)
[0141]
洗脱液速度:0.8ml/分钟
[0142]
检测波长:210nm
[0143]
合成例1:使用了n
‑
甲基吗啉的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的合成
[0144]
[化学式7]
[0145][0146]
将fmoc
‑
phe
‑
phe
‑
oh(2.00g,3.74mmol)、n
‑
甲基吗啉(0.45g,4.49mmol)与四氢呋喃(8.89g)及乙腈(7.86g)混合,进行均匀化而制作了溶液1。将氯甲酸异丁酯(0.56g,4.11mmol)溶解于乙腈(7.86g)中,制作了溶液2。将苯基丙氨酸(0.74g,4.49mmol)与乙腈(7.86g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(1.83g,8.98mmol)后,于50℃搅拌1小时而使其均匀化,然后冷却至室温,制作了溶液3。分别地,将溶液1以每分钟12.1ml、将溶液2以每分钟5.80ml进行送液,用混合器进行混合,使其在内径为1mm、长度为0.3m的聚四氟乙烯树脂制的管内通液,进一步向得到的混合溶液中将溶液3以每分钟7.14ml进行送液,用混合器进行混合,使其从内径为1mm、长度为1.0m的聚四氟乙烯树脂制的管内通过,将得到的溶液在预先加入有水(1.0ml)的容器中捕集1.5分钟。将得到的溶液加入至n
‑
甲基吡咯烷酮中并使其均匀化,得到的溶液的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的定量收率为97.6%,非对映异构体过量率为99.8%de。
[0147]
mass(esi+)m/z;682.5(m+h)+
[0148]
定量收率通过基于使用了高效液相色谱的分析<分析条件b>的定量分析法算出。
[0149]
<分析条件b>
[0150]
高效液相色谱:shimadzu制hplc lc
‑
20a
[0151]
色谱柱:agilent制poroshell 120ec
‑
c18(2.7μm,3.0
×
100mm)
[0152]
柱温箱温度:40℃
[0153]
洗脱液:乙腈:0.05vol%磷酸水溶液
[0154]
10:90(0分钟),10:90
‑
95:5(0
‑
11分钟),95:5(11
‑
15分钟)(v/v)
[0155]
洗脱液速度:0.7ml/分钟
[0156]
检测波长:210nm
[0157]
非对映异构体过量率通过使用了高效液相色谱的分析<分析条件c>算出。
[0158]
<分析条件c>
[0159]
高效液相色谱:shimadzu制hplc lc
‑
20a
[0160]
色谱柱:agilent制poroshell 120ec
‑
c18(2.7μm,3.0
×
100mm)
[0161]
柱温箱温度:40℃
[0162]
洗脱液:乙腈:0.05vol%磷酸水溶液
[0163]
50:50(0
‑
15分钟),50:50
‑
95:5(15
‑
18分钟),95:5(18
‑
22分钟)(v/v)
[0164]
洗脱液速度:0.7ml/分钟
[0165]
检测波长:210nm
[0166]
就定量分析而言,将由以下的步骤合成的fmoc
‑
phe
‑
phe
‑
phe
‑
oh作为标准物质,利用绝对标准曲线法进行定量分析。
[0167]
将反应中得到的n
‑
甲基吡咯烷酮溶液取出一部分,进行减压浓缩,用二氯甲烷(10.0g)稀释,用水(5.0g)清洗2次。将得到的有机层减压浓缩,加入乙腈(5.0g)并进行搅拌,通过过滤得到固体。接着,进行减压干燥,以白色固体的形式得到fmoc
‑
phe
‑
phe
‑
phe
‑
oh(0.41g)。
[0168]
示出标准物质的nmr。
[0169]1h nmr(300mhz,cdcl3):
[0170]
δ12.8(1h,s),8.35(1h,d,j=8.1hz),8.06(1h,d,j=7.5hz),7.87(2h,d,j=7.8hz),7.52
‑
7.62(2h,m),7.11
‑
7.42(20h,m),4.42
‑
7.62(2h,m),3.92
‑
4.22(4h,m),2.62
‑
3.10(6h,m),
[0171]
参考合成例2:使用了n
‑
乙基吗啉的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的合成
[0172]
[化学式8]
[0173][0174]
将fmoc
‑
phe
‑
phe
‑
oh(0.50g,0.94mmol)、n
‑
乙基吗啉(0.129g,1.13mmol)与n
‑
甲基吡咯烷酮(2.58g)及氯仿(3.73g)混合,进行均匀化而制作了溶液1。将氯甲酸异丁酯(0.153g,1.13mmol)溶解于氯仿(3.73g)中,制作了溶液2。将苯基丙氨酸(0.185g,1.13mmol)与n
‑
甲基吡咯烷酮(2.58g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(0.457g,2.26mmol)后,于50℃搅拌1小时而使其均匀化,然后冷却至室温,制作了溶液3。分别地,将溶液1以每分钟12.0ml、将溶液2以每分钟5.93ml进行送液,用混合器进行混合,使其在内径为1mm、长度为0.3m的聚四氟乙烯树脂制的管内通液,进一步向得到的混合溶液中将溶液3以每分钟7.02ml送液,用混合器进行混合,使其在内径为1mm、长度为1.0m的聚四氟乙烯树脂制的管内通液,将得到的溶液在预先加入有水(0.5ml)的容器中捕集18秒。将得到的溶液加入至n
‑
甲基吡咯烷酮中并使其均匀化,得到的溶液的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的定量收率为19.3%。
[0175]
合成例2:使用了n
‑
甲基哌啶的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的合成
[0176]
[化学式9]
[0177][0178]
将fmoc
‑
phe
‑
phe
‑
oh(0.50g,0.94mmol)、n
‑
甲基哌啶(0.112g,1.13mmol)与n
‑
甲基吡咯烷酮(2.58g)及氯仿(3.73g)混合,进行均匀化而制作了溶液1。将氯甲酸异丁酯(0.153g,1.13mmol)溶解于氯仿(3.73g)中,制作了溶液2。将苯基丙氨酸(0.185g,1.13mmol)与n
‑
甲基吡咯烷酮(2.58g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(0.457g,2.26mmol)后,于50℃搅拌1小时而使其均匀化,然后冷却至室温,制作了溶液3。分别地,将溶液1以每分钟12.0ml、将溶液2以每分钟5.93ml进行送液,用混合器进行混合,使其在内径为1mm、长度为0.3m的聚四氟乙烯树脂制的管内通液,进一步向得到的混合溶液中将溶液3以每分钟7.02ml送液,用混合器进行混合,使其在内径为1mm、长度为1.0m的聚四氟乙烯树脂制的管内通液,将得到的溶液在预先加入有水(0.5ml)的容器中捕集18秒。将得到的溶液加入至n
‑
甲基吡咯烷酮中并使其均匀化,得到的溶液的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的定量收率为93.0%,非对映异构体过量率为99.6%de。
[0179]
参考合成例3:使用了n
‑
乙基哌啶的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的合成
[0180]
[化学式10]
[0181][0182]
将fmoc
‑
phe
‑
phe
‑
oh(0.50g,0.94mmol)、n
‑
乙基哌啶(0.127g,1.13mmol)与n
‑
甲基吡咯烷酮(2.58g)及氯仿(3.73g)混合,进行均匀化而制作了溶液1。将氯甲酸异丁酯(0.153g,1.13mmol)溶解于氯仿(3.73g)中,制作了溶液2。将苯基丙氨酸(0.185g,1.13mmol)与n
‑
甲基吡咯烷酮(2.58g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(0.457g,2.26mmol)后,于50℃搅拌1小时而使其均匀化,然后冷却至室温,制作了溶液3。分别地,将溶液1以每分钟12.0ml、将溶液2以每分钟5.93ml进行送液,用混合器进行混合,使其在内径为1mm、长度为0.3m的聚四氟乙烯树脂制的管内通液,进一步向得到的混合溶液中将溶液3以每分钟7.02ml送液,用混合器进行混合,使其在内径为1mm、长度为1.0m的聚四氟乙烯树脂制的管内通液,将得到的溶液在预先加入有水(0.5ml)的容器中捕集18秒。将得到的溶液加入至n
‑
甲基吡咯烷酮中并使其均匀化,得到的溶液的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的定量收率为19.3%。
[0183]
合成例3:使用了n
‑
甲基二乙基胺的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的合成
[0184]
[化学式11]
[0185][0186]
将fmoc
‑
phe
‑
phe
‑
oh(0.50g,0.94mmol)、n
‑
甲基二乙基胺(0.098g,1.13mmol)与n
‑
甲基吡咯烷酮(2.58g)及氯仿(3.73g)混合,进行均匀化而制作了溶液1。将氯甲酸异丁酯
(0.153g,1.13mmol)溶解于氯仿(3.73g)中,制作了溶液2。将苯基丙氨酸(0.185g,1.13mmol)与n
‑
甲基吡咯烷酮(2.58g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(0.457g,2.26mmol)后,于50℃搅拌1小时而使其均匀化,然后冷却至室温,制作了溶液3。分别地,将溶液1以每分钟12.0ml、将溶液2以每分钟5.93ml进行送液,用混合器进行混合,使其在内径为1mm、长度为0.3m的聚四氟乙烯树脂制的管内通液,进一步向得到的混合溶液中将溶液3以每分钟7.02ml送液,用混合器进行混合,使其在内径为1mm、长度为1.0m的聚四氟乙烯树脂制的管内通液,将得到的溶液在预先加入有水(0.5ml)的容器中捕集18秒。将得到的溶液加入至n
‑
甲基吡咯烷酮中并使其均匀化,得到的溶液的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的定量收率为95.4%,非对映异构体过量率为99.7%de。
[0187]
参考合成例4:使用了三乙胺的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的合成
[0188]
[化学式12]
[0189][0190]
将fmoc
‑
phe
‑
phe
‑
oh(0.50g,0.94mmol)、三乙胺(0.114g,1.13mmol)与n
‑
甲基吡咯烷酮(2.58g)及氯仿(3.73g)混合,进行均匀化而制作了溶液1。将氯甲酸异丁酯(0.153g,1.13mmol)溶解于氯仿(3.73g)中,制作了溶液2。将苯基丙氨酸(0.185g,1.13mmol)与n
‑
甲基吡咯烷酮(2.58g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(0.457g,2.26mmol)后,于50℃搅拌1小时而使其均匀化,然后冷却至室温,制作了溶液3。分别地,将溶液1以每分钟12.0ml、将溶液2以每分钟5.93ml进行送液,用混合器进行混合,使其在内径为1mm、长度为0.3m的聚四氟乙烯树脂制的管内通液,进一步向得到的混合溶液中将溶液3以每分钟7.02ml送液,用混合器进行混合,使其在内径为1mm、长度为1.0m的聚四氟乙烯树脂制的管内通液,将得到的溶液在预先加入有水(0.5ml)的容器中捕集18秒。将得到的溶液加入至n
‑
甲基吡咯烷酮中并使其均匀化,得到的溶液的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的定量收率为33.2%。
[0191]
合成例4:使用了n,n
‑
二甲基丁基胺的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的合成
[0192]
[化学式13]
[0193][0194]
将fmoc
‑
phe
‑
phe
‑
oh(0.50g,0.94mmol)、n,n
‑
二甲基丁基胺(0.114g,1.13mmol)与n
‑
甲基吡咯烷酮(2.58g)及氯仿(3.73g)混合,进行均匀化而制作了溶液1。将氯甲酸异丁酯(0.153g,1.13mmol)溶解于氯仿(3.73g)中,制作了溶液2。将苯基丙氨酸(0.185g,1.13mmol)与n
‑
甲基吡咯烷酮(2.58g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(0.457g,2.26mmol)后,于50℃搅拌1小时而使其均匀化,然后冷却至室温,制作了溶液3。分别地,将溶液1以每分钟12.0ml、将溶液2以每分钟5.93ml进行送液,用混合器进行混合,使其在内径为1mm、长度为0.3m的聚四氟乙烯树脂制的管内通液,进一步向得到的混合溶液中将溶液3以每分钟7.02ml送液,用混合器进行混合,使其在内径为1mm、长度为1.0m的聚四氟乙烯树脂制的管内通液,将得到的溶液在预先加入有水(0.5ml)的容器中捕集18秒。将得到的溶液加入n
‑
甲基吡咯烷酮中并使其均匀化,得到的溶液的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的定量收率为
95.4%,非对映异构体过量率为99.8%de。
[0195]
合成例5:使用了n,n
‑
二甲基苄基胺的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的合成
[0196]
[化学式14]
[0197][0198]
将fmoc
‑
phe
‑
phe
‑
oh(0.50g,0.94mmol)、n,n
‑
二甲基苄基胺(0.152g,1.13mmol)与n
‑
甲基吡咯烷酮(2.58g)及氯仿(3.73g)混合,进行均匀化而制作了溶液1。将氯甲酸异丁酯(0.153g,1.13mmol)溶解于氯仿(3.73g)中,制作了溶液2。将苯基丙氨酸(0.185g,1.13mmol)与n
‑
甲基吡咯烷酮(2.58g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(0.457g,2.26mmol)后,于50℃搅拌1小时而使其均匀化,然后冷却至室温,制作了溶液3。分别地,将溶液1以每分钟12.0ml、将溶液2以每分钟5.93ml进行送液,用混合器进行混合,使其在内径为1mm、长度为0.3m的聚四氟乙烯树脂制的管内通液,进一步向得到的混合溶液中将溶液3以每分钟7.02ml送液,用混合器进行混合,使其在内径为1mm、长度为1.0m的聚四氟乙烯树脂制的管内通液,将得到的溶液在预先加入有水(0.5ml)的容器中捕集18秒。将得到的溶液加入至n
‑
甲基吡咯烷酮中而均匀化,得到的溶液的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的定量收率为92.2%,非对映异构体过量率为99.5%de。
[0199]
合成例6:使用了n,n
‑
二异丙基乙基胺及n
‑
甲基吗啉的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的合成
[0200]
[化学式15]
[0201][0202]
将fmoc
‑
phe
‑
phe
‑
oh(0.50g,0.94mmol)、n,n
‑
二异丙基乙基胺(0.121g,0.94mmol)及n
‑
甲基吗啉(0.019g,0.19mmol)与n
‑
甲基吡咯烷酮(2.58g)及氯仿(3.73g)混合,进行均匀化而制作了溶液1。将氯甲酸异丁酯(0.153g,1.13mmol)溶解于氯仿(3.73g)中,制作了溶液2。将苯基丙氨酸(0.185g,1.13mmol)与n
‑
甲基吡咯烷酮(2.58g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(0.457g,2.26mmol)后,于50℃搅拌1小时而使其均匀化,然后冷却至室温,制作了溶液3。分别地,将溶液1以每分钟12.0ml、将溶液2以每分钟5.93ml进行送液,用混合器进行混合,使其在内径为1mm、长度为0.3m的聚四氟乙烯树脂制的管内通液,进一步向得到的混合溶液中将溶液3以每分钟7.02ml送液,用混合器进行混合,使其在内径为1mm、长度为1.0m的聚四氟乙烯树脂制的管内通液,将得到的溶液在预先加入有水(0.5ml)的容器中捕集18秒。将得到的溶液加入n
‑
甲基吡咯烷酮中而均匀化,得到的溶液的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的定量收率为97.3%,非对映异构体过量率为99.8%de。
[0203]
参考合成例5:使用了n,n
‑
二异丙基乙基胺的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的合成
[0204]
[化学式16]
[0205][0206]
使fmoc
‑
phe
‑
phe
‑
oh(0.50g,0.94mmol)、n,n
‑
二异丙基乙基胺(0.145g,1.13mmol)与n
‑
甲基吡咯烷酮(2.58g)及氯仿(3.73g)混合,进行均匀化而制作了溶液1。使氯甲酸异丁酯(0.153g,1.13mmol)溶解于氯仿(3.73g)中,制作了溶液2。使苯基丙氨酸(0.185g,1.13mmol)与n
‑
甲基吡咯烷酮(2.58g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(0.457g,2.26mmol)后,于50℃搅拌1小时而使其均匀化,然后冷却至室温,制作了溶液3。分别地,将溶液1以每分钟12.0ml、将溶液2以每分钟5.93ml进行送液,用混合器进行混合,使其在内径为1mm、长度为0.3m的聚四氟乙烯树脂制的管内通液,进一步向得到的混合溶液中将溶液3以每分钟7.02ml送液,用混合器进行混合,使其在内径为1mm、长度为1.0m的聚四氟乙烯树脂制的管内通液,将得到的溶液在预先加入有水(0.5ml)的容器中捕集18秒。将得到的溶液加入n
‑
甲基吡咯烷酮中而均匀化,得到的溶液的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的定量收率为2.0%。
[0207]
参考合成例6:利用间歇式的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的合成1
[0208]
[化学式17]
[0209][0210]
将苯基丙氨酸(0.074g,0.44mmol)与乙腈(1.58g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(0.183g,0.88mmol)后,于50℃搅拌1小时,冷却至25℃(甲硅烷基化氨基酸溶液)。将fmoc
‑
phe
‑
phe
‑
oh(0.20g,0.37mmol)、n
‑
甲基吗啉(0.045g,0.44mmol)与四氢呋喃(0.89g)及乙腈(0.79g)混合,冷却至0℃,一次性加入氯甲酸异丁酯(0.061g,0.44mmol)后,搅拌30分钟,经2小时加入甲硅烷基氨基酸溶液,搅拌30分钟。向得到的反应液中加入水(1g)、n
‑
甲基吡咯烷酮并使其均匀化。得到的溶液的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的定量收率为42.0%,非对映异构体过量率为95.6%de。
[0211]
参考合成例7:利用间歇式的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的合成2
[0212]
[化学式18]
[0213][0214]
将苯基丙氨酸(0.074g,0.44mmol)与乙腈(1.58g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(0.183g,0.88mmol)后,于50℃搅拌1小时,冷却至25℃(甲硅烷基化氨基酸溶液)。将fmoc
‑
phe
‑
phe
‑
oh(0.20g,0.37mmol)、n
‑
甲基吗啉(0.045g,0.44mmol)与四氢呋喃(0.89g)及乙腈(0.79g)混合,于25℃一次性加入氯甲酸异丁酯(0.061g,0.44mmol)后,搅拌30分钟,经2小时加入甲硅烷基氨基酸溶液,搅拌30分钟。向得到的反应液中加入水(1g)、n
‑
甲基吡咯烷酮并使其均匀化,得到的溶液的fmoc
‑
phe
‑
phe
‑
phe
‑
oh的定量收率为21.7%,非对映异构体过量率为30.1%de。
[0215]
合成例7:fmoc
‑
phe
‑
phe
‑
cys(trt)
‑
oh的合成
[0216]
[化学式19]
[0217][0218]
将fmoc
‑
phe
‑
phe
‑
oh(2.00g,3.74mmol)、n
‑
甲基吗啉(0.454g,4.49mmol)与四氢呋喃(8.89g)及乙腈(7.86g)混合,进行均匀化而制作了溶液1。使氯甲酸异丁酯(0.562g,4.11mmol)溶解于乙腈(7.863g),制作了溶液2。使s
‑
三苯甲基半胱氨酸(1.632g,4.49mmol)与乙腈(17.3g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(1.827g,8.98mmol)后,于50℃搅拌1小时而使其均匀化,然后冷却至室温,制作了溶液3。分别地,将溶液1以每分钟9.4ml、将溶液2以每分钟4.5ml进行送液,用混合器进行混合,使其在内径为1mm、长度为0.3m的聚四氟乙烯树脂制的管内通液,进一步向得到的混合溶液中以每分钟11.1ml输送溶液3,用混合器进行混合,使其在内径为1mm、长度为1.0m的聚四氟乙烯树脂制的管内通液,将得到的溶液在预先加入有10%碳酸钾水溶液(10ml)的容器中捕集125秒。将得到的溶液分液,再次加入10%碳酸钾水溶液(15g)并进行分液,用10%氯化钠水溶液(10g)将有机层进行清洗。向得到的有机层中加入10%氯化钠水溶液(5g)、10%氯化铵水溶液(5g),进行2次分液。将得到的有机层浓缩,用硅胶柱色谱进行纯化,以白色固体的形式得到fmoc
‑
phe
‑
phe
‑
cys(trt)
‑
oh(2.74g,收率94%,非对映异构体过量率99.2%de)。
[0219]
mass(esi+)m/z;902.36(m+na)+
[0220]
非对映异构体过量率通过使用了高效液相色谱的分析<分析条件d>算出。
[0221]
<分析条件d>
[0222]
高效液相色谱:shimadzu制hplc lc
‑
20a
[0223]
色谱柱:agilent制poroshell 120ec
‑
c18(2.7μm、3.0
×
100mm)
[0224]
柱温箱温度:40℃
[0225]
洗脱液:乙腈:0.05vol%磷酸水溶液
[0226]
58:42(0
‑
27分钟),58:42
‑
95:5(27
‑
32分钟),95:5(32
‑
34分钟)(v/v)
[0227]
洗脱液速度:0.9ml/分钟
[0228]
检测波长:210nm
[0229]
合成例8:fmoc
‑
phe
‑
phe
‑
cys(trt)
‑
tyr(t
‑
bu)
‑
oh的合成
[0230]
[化学式20]
[0231][0232]
使fmoc
‑
phe
‑
phe
‑
cys(trt)
‑
oh(2.00g,2.27mmol)、n
‑
甲基吗啉(0.276g,2.72mmol)与四氢呋喃(8.89g)及乙腈(7.86g)混合,进行均匀化而制作了溶液1。使氯甲酸异丁酯(0.341g,2.50mmol)溶解于乙腈(7.863g)中,制作了溶液2。使o
‑
t
‑
bu
‑
酪氨酸(0.647g,2.72mmol)与乙腈(7.86g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(1.110g,5.45mmol)后,于50℃搅拌1小时而使其均匀化,然后冷却至室温,制作了溶液3。分别地,将
溶液1以每分钟12.4ml、将溶液2以每分钟5.8ml进行送液,用混合器进行混合,使其在内径为1mm、长度为0.3m的聚四氟乙烯树脂制的管内通液,进一步向得到的混合溶液中将溶液3以每分钟6.8ml送液,用混合器进行混合,使其在内径为1mm、长度为1.0m的聚四氟乙烯树脂制的管内通液,将得到的溶液在预先加入有10%碳酸钾水溶液(10ml)的容器中捕集90秒。将得到的溶液分液,再次加入10%碳酸钾水溶液(15g)并进行分液,用10%氯化钠水溶液(10g)清洗有机层。将得到的有机层浓缩,用硅胶柱色谱进行纯化,将捕集的溶液浓缩后,与己烷(40g)混合,将析出的固体过滤、干燥,以白色固体的形式得到fmoc
‑
phe
‑
phe
‑
cys(trt)
‑
tyr(t
‑
bu)
‑
oh(1.95g,收率92%,非对映异构体过量率99.6%de)。
[0233]
mass(esi+)m/z;1121.64(m+na)+
[0234]
非对映异构体过量率通过使用了高效液相色谱的分析<分析条件e>算出。
[0235]
<分析条件e>
[0236]
高效液相色谱:shimadzu制hplc lc
‑
20a
[0237]
色谱柱:agilent制poroshell 120ec
‑
c18(2.7μm、3.0
×
100mm)
[0238]
柱温箱温度:40℃
[0239]
洗脱液:乙腈:0.05vol%磷酸水溶液
[0240]
70:430(0
‑
27分钟),70:30
‑
95:5(27
‑
32分钟),95:5(32
‑
34分钟)(v/v)
[0241]
洗脱液速度:0.9ml/分钟
[0242]
检测波长:210nm
[0243]
参考合成例8:fmoc
‑
phe
‑
d
‑
phg
‑
oh的合成
[0244]
[化学式21]
[0245][0246]
将fmoc
‑
phe
‑
oh(2.00g,5.16mmol)、n
‑
甲基吗啉(0.627g,6.19mmol)与四氢呋喃(8.89g)及乙腈(7.86g)混合,进行均匀化而制作了溶液1。将氯甲酸异丁酯(0.776g,5.68mmol)溶解于乙腈(7.863g),制作了溶液2。将d
‑
苯基甘氨酸(0.936g,6.19mmol)与乙腈(7.86g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(3.255g,12.4mmol)后,于50℃搅拌1小时而使其均匀化,然后冷却至室温,制作了溶液3。分别地,将溶液1以每分钟11.5ml、将溶液2以每分钟5.6ml进行送液,用混合器进行混合,使其在内径为1mm、长度为0.3m的聚四氟乙烯树脂制的管内通液,进一步向得到的混合溶液中将溶液3以每分钟7.8ml送液,用混合器进行混合,使其在内径为1mm、长度为1.0m的聚四氟乙烯树脂制的管内通液,将得到的溶液在预先加入有水(2ml)的容器中捕集105秒。在得到的溶液中混合乙腈(80g),将析出的固体过滤、干燥,以白色固体的形式得到fmoc
‑
phe
‑
d
‑
phg
‑
oh(1.50g,收率62%)。
[0247]
mass(esi+)m/z;521.3(m+na)+
[0248]
合成例9:fmoc
‑
phe
‑
d
‑
phg
‑
phe
‑
oh的合成
[0249]
[化学式22]
[0250]
[0251]
将fmoc
‑
phe
‑
d
‑
phg
‑
oh(0.50g,0.96mmol)、n
‑
甲基吗啉(0.117g,1.15mmol)与n
‑
甲基吡咯烷酮(2.58g)及乙腈(1.97g)混合,进行均匀化而制作了溶液1。使氯甲酸异丁酯(0.144g,1.06mmol)溶解于乙腈(1.97g)中,制作了溶液2。将苯基丙氨酸(0.19g,1.06mmol)与乙腈(1.97g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(0.469g,2.30mmol)后,于50℃搅拌1小时而使其均匀化,然后冷却至室温,制作了溶液3。分别地,将溶液1以每分钟11.9ml、将溶液2以每分钟5.8ml进行送液,用混合器进行混合,使其在内径为1mm、长度为0.3m的聚四氟乙烯树脂制的管内通液,进一步向得到的混合溶液中将溶液3以每分钟7.2ml送液,用混合器进行混合,使其在内径为1mm、长度为1.0m的聚四氟乙烯树脂制的管内通液,将得到的溶液在预先加入有水(1ml)的容器中捕集20秒。将得到的溶液减压浓缩,与乙腈(25g)混合,将析出的固体过滤、干燥,以白色固体的形式得到fmoc
‑
phe
‑
d
‑
phg
‑
phe
‑
oh(0.45g,收率95%)。
[0252]
mass(esi+)m/z;668.4(m+na)+
[0253]
非对映异构体过量率通过使用了高效液相色谱的分析<分析条件c>算出。
[0254]
合成例10:cbz
‑
phe
‑
phe
‑
leu
‑
oh的合成
[0255]
[化学式23]
[0256][0257]
将cbz
‑
phe
‑
phe
‑
oh(2.00g,4.48mmol)、n
‑
甲基吗啉(0.591g,5.38mmol)与四氢呋喃(8.89g)及乙腈(7.86g)混合,进行均匀化而制作了溶液1。使氯甲酸异丁酯(0.641g,4.93mmol)溶解于乙腈(7.863g)中,制作了溶液2。使亮氨酸(0.705g,5.38mmol)与乙腈(7.86g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(2.187g,10.8mmol)后,于50℃搅拌1小时而使其均匀化,然后冷却至室温,制作了溶液3。分别地,将溶液1以每分钟12.0ml、将溶液2以每分钟5.8ml进行送液,用混合器进行混合,使其在内径为1mm、长度为0.3m的聚四氟乙烯树脂制的管内通液,进一步向得到的混合溶液中将溶液3以每分钟73ml送液,用混合器进行混合,使其在内径为1mm、长度为1.0m的聚四氟乙烯树脂制的管内通液,将得到的溶液在预先加入有5质量%盐酸(5g)的容器中捕集100秒。将得到的溶液减压浓缩,加入乙酸乙酯(30g)并分液,用10质量%氯化钠水溶液(5g)将有机层清洗2次。将得到的有机层浓缩,加入己烷(40g)并进行搅拌,将析出的固体过滤、干燥,以白色固体的形式得到cbz
‑
phe
‑
phe
‑
leu
‑
oh(2.17g,收率96%,非对映异构体过量率100%de)。
[0258]
mass(esi+)m/z;560.4(m+h)+
[0259]
非对映异构体过量率通过使用了高效液相色谱的分析<分析条件a>算出。
[0260]
参考合成例9:h
‑
phe
‑
phe
‑
leu
‑
oh的合成
[0261]
[化学式24]
[0262][0263]
将cbz
‑
phe
‑
phe
‑
leu
‑
oh(1.50g,2.68mmol)加入至四氢呋喃(10g)及甲醇(10g)中
使其溶解,加入10质量%钯碳(0.15g,n.e.chemcat制,pe型),于21℃进行氢置换,搅拌1小时。将得到的溶液过滤,向过滤物中加入n,n
‑
二甲基甲酰胺(150g)并搅拌后,进行过滤,得到滤液1。向得到的过滤物中再次加入n,n
‑
二甲基甲酰胺(150g)并搅拌后,进行过滤,得到滤液2。将滤液1与滤液2混合并减压浓缩,加入乙腈(20g)并进行搅拌,然后进行过滤,对得到的固体进行干燥,以灰色固体的形式得到h
‑
phe
‑
phe
‑
leu
‑
oh(1.03g,收率90%)。
[0264]
mass(esi+)m/z;426.4(m+h)+
[0265]
合成例11:fmoc
‑
phe
‑
phe
‑
cys(trt)
‑
tyr(t
‑
bu)
‑
phe
‑
phe
‑
leu
‑
oh的合成
[0266]
[化学式25]
[0267][0268]
将fmoc
‑
phe
‑
phe
‑
cys(trt)
‑
tyr(t
‑
bu)
‑
oh(0.55g,0.50mmol)、n
‑
甲基吗啉(0.066g,0.60mmol)与四氢呋喃(2.45g)及乙腈(2.16g)混合,进行均匀化而制作了溶液1。使氯甲酸异丁酯(0.075g,0.55mmol)溶解于乙腈(2.16g)中,制作了溶液2。将h
‑
phe
‑
phe
‑
leu
‑
oh(0.255g,0.60mmol)与乙腈(2.16g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(0.244g,1.20mmol)后,于室温搅拌而均匀化,制作了溶液3。分别地,将溶液1以每分钟12.3ml、将溶液2以每分钟5.8ml进行送液,用混合器进行混合,使其在内径为1mm、长度为0.3m的聚四氟乙烯树脂制的管内通液,进一步向得到的混合溶液中将溶液3以每分钟6.9ml送液,用混合器进行混合,使其在内径为1mm、长度为1.0m的聚四氟乙烯树脂制的管内通液,将得到的溶液在预先加入有水(1g)的容器中捕集20秒。在得到的溶液中混合水(4g)并搅拌,将析出的固体过滤、干燥,以白色固体的形式得到fmoc
‑
phe
‑
phe
‑
cys(trt)
‑
tyr(t
‑
bu)
‑
phe
‑
phe
‑
leu
‑
oh(0.43g,收率84%,非对映异构体过量率99.4%de)。
[0269]
mass(esi+)m/z;1507(m+h)+
[0270]
非对映异构体过量率通过使用了高效液相色谱的分析<分析条件f>算出。
[0271]
<分析条件f>
[0272]
高效液相色谱:shimadzu制hplc lc
‑
20a
[0273]
色谱柱:agilent制poroshell 120ec
‑
c18(2.7μm,3.0
×
100mm)
[0274]
柱温箱温度:40℃
[0275]
洗脱液:乙腈:0.05vol%磷酸水溶液
[0276]
80:20(0
‑
27分钟),80:20
‑
95:5(27
‑
32分钟),95:5(32
‑
34分钟)(v/v)
[0277]
洗脱液速度:0.9ml/分钟
[0278]
检测波长:210nm
[0279]
合成例12:fmoc
‑
phe
‑
phe
‑
megly
‑
oh的合成
[0280]
[化学式26]
[0281][0282]
使fmoc
‑
phe
‑
phe
‑
oh(2.00g,3.74mmol)、n
‑
甲基吗啉(0.454g,4.49mmol)与四氢呋
喃(8.89g)及乙腈(7.86g)混合,进行均匀化而制作了溶液1。使氯甲酸异丁酯(0.562g,4.11mmol)溶解于乙腈(7.863g)中,制作了溶液2。使肌氨酸(0.667g,7.48mmol)与乙腈(7.86g)混合,加入n,o
‑
双三甲基甲硅烷基乙酰胺(3.04g,15.0mmol)后,于50℃搅拌1小时而使其均匀化,然后冷却至室温,制作了溶液3。分别地,将溶液1以每分钟11.7ml、将溶液2以每分钟5.6ml进行送液,用混合器进行混合,使其在内径为1mm、长度为0.3m的聚四氟乙烯树脂制的管内通液,进一步向得到的混合溶液中将溶液3以每分钟7.7ml送液,用混合器进行混合,使其在内径为1mm、长度为1.0m的聚四氟乙烯树脂制的管内通液,将得到的溶液在预先加入有5质量%盐酸(10g)的容器中捕集107秒。将得到的溶液减压浓缩,加入乙酸乙酯(30g)并进行分液,用10质量%氯化钠水溶液(10g)将有机层清洗2次。将得到的有机层浓缩,用硅胶柱色谱进行纯化,以白色固体的形式得到fmoc
‑
phe
‑
phe
‑
megly
‑
oh(2.06g,收率96%,非对映异构体过量率99.7%de)。
[0283]
mass(esi+)m/z;606.4(m+h)+
[0284]
非对映异构体过量率通过使用了高效液相色谱的分析<分析条件a>算出。
[0285]
产业上的可利用性
[0286]
根据本发明,能够提供肽的高效率的制造方法。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1