使用iPS细胞生产成骨细胞构建体的方法
使用ips细胞生产成骨细胞构建体的方法
技术领域
1.[相关专利申请的交叉引用]
[0002]
本技术请求于2019年2月26日递交的日本专利申请no.2019
‑
033277的优先权的权益,其全部内容以引用的方式并入本文。本发明涉及一种使用ips细胞生产成骨细胞构建体的方法。
背景技术:
[0003]
存在对用于替代,例如因骨肿瘤切除、粉碎性骨折、与类风湿性关节炎固定相关的骨缺损、牙槽嵴吸收等导致骨丢失的缺陷部位的人工骨/骨替代材料的极高需求。
[0004]
目前临床上用作人工骨/骨替代材料的非吸收性材料(比如羟基磷灰石)和吸收性材料(比如β
‑
磷酸三钙)具有例如骨诱导活性低于自体骨和在手术干预中不能总是提供良好预后的问题。此外,通过将人工骨与诸如骨形态发生蛋白(bmp)的生长因子蛋白组合获得的混合人工骨/骨替代材料(需要进一步开发的下一代类型)缺乏对于骨组织再生重要的“细胞外基质”,并因此无法提供足够的骨再生效果。
[0005]
在这样的情况下,本发明的发明人成功地生产了一种骨再生剂,其包括一种以干细胞为原料的灭活细胞构建体,所述灭活细胞构建体至少含有矿物质和细胞外基质(专利文献1和2)。
[0006]
引用列表
[0007]
专利文献
[0008]
ptl 1:wo 2015/064705 a1
[0009]
ptl 2:wo 2018/181960 a1
[0010]
非专利文献
[0011]
npl 1:stem cell reports vol.2,751
‑
760,june 3,2014
技术实现要素:
[0012]
技术问题
[0013]
本发明的目的在于提供一种新的生产成骨细胞构建体的方法,其能够通过使用ips细胞作为原料提供具有高骨再生能力的成骨细胞构建体。
[0014]
解决问题的方案
[0015]
在上述情况下,本发明的发明人经过深入研究,结果惊奇地发现通过在生产成骨细胞构建体的方法中的如下各步中利用微空间培养而获得了具有极高骨再生能力的成骨细胞构建体:(1)胚状体形成诱导步骤和(2)诱导分化为中胚层细胞的步骤,所述方法使用未分化的ips细胞作为原料,并包括胚状体形成诱导步骤、诱导分化为中胚层的步骤,和诱导分化为成骨细胞的步骤。本发明的发明人基于该新发现进一步对培养条件等进行了细致研究,由此完成了本发明。
[0016]
因此,本发明提供了如以下项目所述的方法、成骨细胞构建体等。
[0017]
项目1、一种由ips细胞生产成骨细胞构建体的方法,包括如下步骤:
[0018]
(1)通过使未分化的ips细胞接受非贴壁培养来诱导形成胚状体;
[0019]
(2)通过使步骤(1)中获得的ips细胞的胚状体接受非贴壁培养来诱导ips细胞分化为中胚层细胞;和
[0020]
(3)通过使步骤(2)中获得的ips细胞的中胚层细胞接受非贴壁培养来诱导分化为成骨细胞,
[0021]
其中,步骤(1)和(2)均使用包括底面和垂直布置在底面上的环状侧壁的培养容器进行,该底面具有彼此独立布置的多个凹部。
[0022]
项目2、根据项目1所述的方法,其中,所述多个凹部中的至少一个具有200μm至900μm的圆当量直径和200μm至1000μm的深度。
[0023]
项目3、根据项目1或2所述的方法,其中,所述多个凹部中的每个均具有近圆形形状的开口。
[0024]
项目4、根据项目1至3中任一项所述的方法,其中,所述ips细胞为人类ips细胞或小鼠ips细胞。
[0025]
项目5、根据项目4所述的方法,其中,步骤(1)的培养时间为0.625天至3.5天。
[0026]
项目6、根据项目1至5中任一项所述的方法,其中,步骤(2)中的培养在选自wnt信号激活剂和刺猬信号抑制剂中的至少一种的存在下进行。
[0027]
项目7、根据项目6所述的方法,其中,所述wnt信号激活剂为选自chir99021、6
‑
溴靛玉红
‑3’‑
肟、肯帕罗酮(kenpaullone)、sb
‑
216763、skl2001、脱氧胆酸、way
‑
316606、nsc
‑
693868、蓖麻碱、7
‑
氧代
‑
β
‑
谷甾醇、im
‑
12、hly78和视黄酸中的至少一种。
[0028]
项目8、根据项目6或7所述的方法,其中,所述刺猬信号抑制剂为选自环巴胺、ay9944、gant58、gant61、蒜藜芦碱(jervine)、sant
‑
1、sant
‑
2、u18666a、藜芦胺、维莫德吉(vismodegib)、cur
‑
61414、robotnikinin、jk184和hpi
‑
4中的至少一种。
[0029]
项目9、根据项目1至8中任一项所述的方法,其中,步骤(3)的培养在选自缺氧模拟化合物、他汀类化合物和视黄酸中的至少一种的存在下进行。
[0030]
项目10、根据项目1至9中任一项所述的方法,在步骤(1)之前,所述方法进一步包括不使用饲养细胞而培养未分化的ips细胞的步骤。
[0031]
项目11、根据项目1至10中任一项所述的方法,其中,通过将具有1.5
×
105细胞/ml至3.5
×
105细胞/ml的细胞浓度的未分化的ips细胞的悬浮液置于培养容器中,并随后进行培养来实施步骤(1)。
[0032]
项目12、根据项目1至11中任一项所述的方法,
[0033]
其中,采用具有至少一个孔的培养容器来实施步骤(2),和
[0034]
其中,通过将对应于含有步骤(2)获得的中胚层细胞的1至10孔的培养液置于培养容器中,并随后进行培养来实施步骤(3)。
[0035]
项目13、根据项目1至12中任一项所述的方法,
[0036]
其中,步骤(1)的培养在rock抑制剂的存在下进行;和
[0037]
其中,步骤(2)和步骤(3)中的每个培养均在视黄酸的存在下进行。
[0038]
项目14、一种成骨细胞构建体,其源自人类ips细胞且具有1mm至4mm的feret's直径。
[0039]
项目15、根据项目14所述的成骨细胞构建体,其中,所述成骨细胞构建体通过项目1至13中任一项所述的方法获得。
[0040]
发明的有益效果
[0041]
根据本发明,可以提供一种新的生产成骨细胞构建体的方法,其能够通过将ips细胞用作原料来提供具有高骨再生能力的成骨细胞构建体。
附图说明
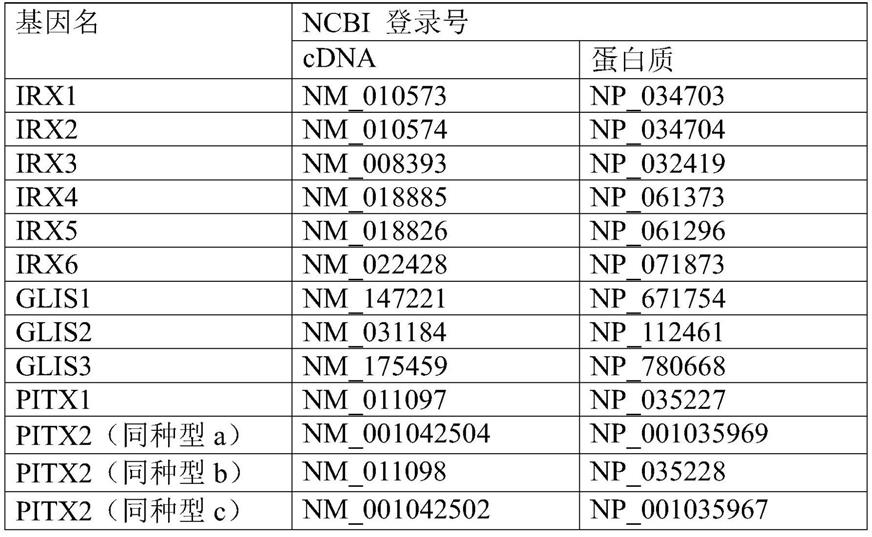
[0042]
图1:一种将小鼠ips诱导为成骨细胞构建体的方法。通过使用在每个孔的底面上具有多个凹部的微空间形低附着板elplasia(商标)(kuraray,日本),由小鼠ips细胞诱导胚状体来生成成骨细胞构建体。使用具有不同凹陷孔径直径的elplasia(商标)(400μm:elp400、500μm:elp500和900μm:elp900),并研究其差异对成骨细胞构建体的诱导的影响。
[0043]
图2:上图:在将小鼠ips细胞分别接种在elp400、elp500和elp900中并在es培养基中培养2天后的相差显微照片。下图:elp400、elp500和elp900中间部分各一个凹部的放大照片。
[0044]
图3:左图:采用elp400、elp500和elp900,在成骨细胞分化诱导期间(第0天至第35天)的ips细胞构建体的feret's直径(n=3,*p<0.01:anova与tukey's多重比价检验)。右图:在相同期间elp400、elp500和elp900中的典型ips细胞构建体的照片。
[0045]
图4:ips细胞构建体中细胞的存活和死亡。在用elp400、elp500和elp900的成骨细胞分化诱导开始(第0天)和14天后(第14天)使用活细胞/死细胞同时染色试剂盒(live/dead(商标)viability/cytotoxicity kit)进行研究。绿色表示活细胞,红色表示死细胞。
[0046]
图5:在用elp400、elp500和elp900的成骨细胞分化诱导10天后细胞构建体中成骨细胞特异性标记基因(runx2、osterix、胶原蛋白1a1、骨唾液蛋白、骨桥蛋白、骨钙素)的表达的实时rt
‑
pcr分析(n=3,*p<0.05:anova与tukey's多重比价检验)。
[0047]
图6:在用elp400、elp500和elp900的成骨细胞分化诱导35天后,细胞构建体切片的苏木精
‑
伊红(he)染色及von kossa和亚甲基蓝双染色的图像。
[0048]
图7:一种将人类ips诱导为成骨细胞构建体的方法。通过使用在其每个孔的底面上具有每个直径为500μm的多个凹部的微空间形低附着板elplasia(商标)(elp500),由人类ips细胞诱导了胚状体和中胚层,并生成了成骨细胞构建体。作为比较对照,设置了使用一般的低附着性培养皿来代替使用elplasia(商标)的情况。
[0049]
图8:使用低附着培养皿或elp500将人类ips细胞诱导为胚状体和中胚层细胞,然后进行成骨细胞分化诱导30天,随后计数培养瓶中细胞构建体的数量。当使用elp500时,来自人类ips细胞的成骨细胞构建体的生成效率增加了约9倍(n=5)。
[0050]
图9:使用elp500诱导成胚状体和中胚层细胞后,经受成骨细胞分化诱导30天至90天的人类ips细胞构建体的细胞构建体切片的von kossa和亚甲基蓝双染色的图像。
[0051]
图10:在用一般低附着培养皿(低附着培养皿)或elp500(elplasia(商标))诱导成胚状体和中胚层细胞后,经受成骨细胞分化诱导达30天的人类ips细胞构建体中,以及在胚状体培养前恰未分化的人类ips细胞中成骨细胞特异性标记基因(runx2、osterix、胶原蛋白1a1和骨钙素)的表达的实时rt
‑
pcr分析(n=3,*p<0.05:anova与tukey's多重比价检验)。
[0052]
图11示出了通过实时rt
‑
pcr方法,在用elp500诱导成胚状体和中胚层细胞后,经受成骨细胞分化诱导60天的人类ips细胞构建体中,以及在胚状体培养前恰未分化的人类ips细胞中未分化的标记基因(nanog)、中胚层(间充质干细胞)
‑
成骨细胞祖细胞标记基因(brachyury、runx2和osterix)和成骨细胞特异性基因(胶原蛋白1a1和骨钙素)的表达的分析结果(n=3)。
[0053]
图12:使用ftir的人类ips细胞衍生的成骨细胞构建体的成分分析。将在使用elp500诱导成胚状体和中胚层细胞后,经受成骨细胞分化诱导0天至60天的人类ips细胞构建体干燥并接受ftir分析。作为比较对照,使用了人冻干同种异体骨移植物(fdba)。箭头表示天然骨组织所具有的ftir光谱峰(ami、amii、po
43
‑
和co
32
‑
)。
[0054]
图13(a):在使用elp500诱导成胚状体和中胚层细胞后,经受成骨细胞分化诱导3天至30天的人类ips细胞构建体的feret's直径(n=25)。成骨细胞分化诱导30天后,发现了具有feret’s直径为约0.5μm至约3μm的各种尺寸的细胞构建体(插入的照片)。图13(b)示出了在成骨细胞分化诱导30天后根据feret's直径分组为0.5mm至小于1mm、1mm至小于2mm和2mm至3mm的尺寸的每个细胞构建体组的典型细胞构建体切片的he染色图像(左栏图)和von kossa和亚甲基蓝双染色图像(右栏图)。由于细胞构建体的尺寸增加,显示出更加明显的矿化。
[0055]
图14:在使用elp500诱导成胚状体和中胚层细胞后经受成骨细胞分化诱导达120天的人类ips细胞构建体的照片(a)及其冷干后的照片(b)。
[0056]
图15:在将(a)图14的人类ips细胞衍生的冻干成骨细胞构建体或(b)人冻干同种异体骨移植物(fdba)植入大鼠颅骨中产生的直径为5毫米的骨缺损部位4周后拍摄的he染色图像和显微
‑
ct成像图像。
[0057]
图16为本发明的典型实施方式中的微空间培养容器1的示意图。
[0058]
图17为图16中包含虚线a
‑
b的与微空间培养容器1垂直的面的剖视图。
[0059]
图18为图16中底面2的区域4的放大图。
[0060]
图19为图18所示的区域4的剖视图。
[0061]
图20为其中各个凹部6的形状为正六边形的实施方式中的区域4的放大图。
[0062]
图21为用于说明在微空间培养容器1的每个凹部收容一个细胞构建体的实施方式的示意图。
[0063]
图22为实施例中使用的跷跷板型生物反应器的轮廓图。
[0064]
图23为可用于振荡培养的培养瓶的示意图。
[0065]
图24为一种将人类ips细胞诱导为成骨细胞构建体的方法以及在使用的细胞数量研究中的条件设置的说明。
[0066]
图25示出了成骨细胞分化诱导第30天每个瓶中形成的细胞构建体的数量。接种的细胞数:在胚状体形成步骤中接种在24孔elplasia(商标)培养板的1个孔中的细胞数。孔:在成骨细胞分化诱导步骤开始时转移至1个瓶中的中胚层细胞培养的孔数。
[0067]
图26示出了成骨细胞分化诱导第30天的细胞构建体的feret's直径(n=10)。接种的细胞数:在胚状体形成步骤中接种在24孔elplasia(商标)培养板的1个孔中的细胞数。孔:在成骨细胞分化诱导步骤开始时转移至1个瓶中的中胚层细胞培养的孔数。
[0068]
图27示出了成骨细胞分化诱导第0天和第30天细胞构建体中成骨细胞特异性标记
细胞/瓶至1
×
108细胞/瓶,更优选地为1
×
106细胞/瓶至7
×
106细胞/瓶。
[0078]
微空间培养瓶
[0079]
本发明的特征在于,上述诱导分化为胚层细胞(germinal cell)的步骤(步骤(1))和上述诱导分化为中胚层细胞的步骤(步骤(2))均采用培养容器进行,所述培养容器包括一个或多个底面和一个或多个垂直布置在该底面上的环状侧壁,该底面具有彼此独立布置的多个凹部。在本发明中,有时将所述包括底面和垂直布置在该底面上的环状侧壁且该底面具有彼此独立布置的多个凹部的培养容器称为“微空间(microspace)培养容器”。类似地,有时将采用该微空间培养容器的培养称为“微空间(microspace)培养”。
[0080]
以下参照附图描述本发明的典型实施方式。首先,在图16中示出了本发明的典型实施方式中的微空间培养容器1。微空间培养容器1包括底面2和垂直布置在底面上的环状侧壁3。因此,也可以说微空间培养容器1包括分别由底面2和垂直布置在底面上的环状侧壁3形成的孔5。环状侧壁3不限于如图16所示的在开口和底面中的每一个处具有近圆形形状的那些,并且可以具有,例如多边形(三角形、四边形(例如,矩形,如正方形或矩形、平行四边形或梯形)、五边形、六边形等)。
[0081]
图17中示出了图16中包含虚线a
‑
b的与微空间培养容器1垂直的面的剖视图。在图17所示的优选实施方式中,形成壁面的材料和形成底面的材料可以彼此不同,在图17的情况下,底面由透明材料制成,壁面由不透明材料(如,黑色等)制成。此外,图18示出了图16中底面2的区域4的放大图。另外,图19示出了图18所示的区域4中包含虚线c
‑
d的且与微空间培养容器1形成的大致平面垂直的面的剖视图。如图18所示,图16的微空间培养容器1的底面2具有彼此独立布置的多个凹部6。在此,有时将在微空间培养容器(以及微空间培养容器的孔)的底面上形成的凹部称为微孔。在本发明中,每个凹部6的形状没有特别限制,只要该形状具有底面即可,其实例包括具有有近圆形(如图18中所示的圆形)的开口7或具有多边形(三角形、四边形,(例如,矩形,如正方形或矩形、平行四边形或梯形)、五边形、六边形等)。在本发明中,“开口7”意指通过在一个凹部6中连接侧壁9的最高点而形成的部分(在图19的情况下,开口与由微空间培养容器1主体形成的近似平面平行)。在本发明中,凹部6各自形成用于培养细胞的微空间。在本发明中,多个凹部6中的至少1个(优选地凹部6数目的80%以上,更优选地90%以上,特别是全部)具有优选地200μm至900μm、更优选地400μm至700μm、甚至更优选地450μm至550μm的等效圆直径“l”(circle
‑
equivalent diameter"l")。在本发明中,等效圆直径“l”意指由与微空间培养容器1和侧壁9形成的大致平面平行的面相交的点形成的平面图形的内切圆的直径(例如,在平面图形为正六边形的情况下的等效圆直径“l”如图20所示)。在本发明中,当“由与微空间培养容器1和侧壁9形成的大致平面平行的面相交的点形成的平面图形”随着凹部的深度改变时,等效圆直径“l”指其最大值。
[0082]
图19中示出了图18中包含虚线c
‑
d的与由微空间培养容器1形成的近似平面垂直的面的剖视图。在本发明中,在各个凹部6中,底面8可具有如图19所示的曲面的形状(如圆底),或可以是平面。此外,侧壁9可以如图19所示平行或可以是锥形的(如,在开口侧较宽而底面侧较窄的形式的锥形)。在本发明中,多个凹部6中的至少1个(优选地凹部6数目的80%以上,更优选地90%以上,特别是全部)具有优选地200μm至1000μm、更优选地300μm至800μm、甚至更优选地400μm至700μm的深度“d”。在本发明中,当形成凹部的开口7的表面与形成其底面8的表面彼此不平行时和/或当底面为曲面时,各凹部6的“深度”为凹部底面上距开
口最远位置到开口的距离。
[0083]
在本发明中,各凹部6形成的空间(由开口7、底面8和侧壁9限定的空间)的体积没有特别限制,但优选为每个凹部6为0.02mm3至0.55mm3,更优选地为0.04mm3至0.35mm3,再更优选地为0.07mm3到0.15mm3。优选多个凹部6中的至少1个(优选地凹部6数目的80%以上,更优选地90%以上,特别是全部)形成具有上述体积的空间。在本发明中,凹部优选具有这样的大小,该种大小使得每个凹部容纳一个或两个(优选一个)ips细胞构建体(如,图21)。
[0084]
用于形成微空间培养容器1的材料没有特别限制,该容器可以由如下制成:例如,树脂,如丙烯酸树脂、聚苯乙烯基树脂、丙烯酸/苯乙烯基树脂、聚碳酸酯基树脂、三聚氰胺树脂、聚乙醇酸、聚乳酸、聚酯基树脂、聚酰亚胺、聚乙烯醇基树脂、乙烯/乙烯醇基树脂、热塑性弹性体、氯乙烯基树脂、或硅树脂或它们的组合。
[0085]
为了在保持细胞或细胞构建体放置在凹部中的状态的同时进行培养,使用微空间培养容器1的培养通常通过静态培养进行。因此,为了防止细胞或细胞构建体附着在微空间培养容器1的底面2和/或侧壁3,特别是底面2上,优选其至少一部分是非细胞附着的。使壁面非细胞附着的方法没有特别限制,但其可想到的实例是涉及应用非细胞附着剂以在壁面的至少一部分上形成亲水相的方法。非细胞附着剂的实例包括各自含有亲水性聚合物(比如聚乙二醇)、具有甜菜碱结构的聚合物、含磷脂的聚合物或聚(甲基)丙烯酸羟乙酯聚合物的试剂。
[0086]
以上参照附图描述了本发明,其中示出了典型的实施方式,但是不发明不限于采用附图所示的培养容器。例如,微空间培养容器1不限于图16所示的矩形板,也可以是,例如,圆形板。
[0087]
(1)胚状体形成的诱导
[0088]
本发明的方法包括通过使未分化的ips细胞接受非贴壁培养来诱导形成胚状体的步骤。
[0089]
作为用作原料的ips细胞,可以使用通过将核重编程物质引入体细胞而产生的ips细胞。ips细胞的实例包括源自哺乳动物,比如人、小鼠、大鼠、猴、狗、猪、牛、猫、山羊、绵羊、兔、豚鼠和仓鼠的ips细胞。其中,优选源自人、小鼠、大鼠、猴、狗等的ips细胞,更优选源自人或小鼠的ips细胞。
[0090]
可用作原料用于产生ips细胞的体细胞可以是除生殖细胞外的任何细胞,其实例包括口腔黏膜细胞(如,牙龈成纤维细胞、颊黏膜成纤维细胞、牙龈上皮细胞和颊黏膜上皮细胞)、角化上皮细胞(如角化表皮细胞)、粘膜上皮细胞(如舌上皮细胞)、外分泌腺上皮细胞(如乳腺细胞)、激素
‑
分泌细胞(如肾上腺髓质细胞)、代谢和储存细胞(如肝细胞)、构成界面的管腔上皮细胞(如i型肺泡细胞)、闭合循环系统中管腔上皮细胞(如血管上皮细胞)、具有运动纤毛的细胞(如气道上皮细胞)、细胞外基质分泌细胞(如成纤维细胞)、收缩细胞(如平滑肌细胞)、造血和免疫细胞(如t淋巴细胞)、感觉细胞(如杆细胞)、自主神经元(如胆碱能神经元)、感觉器官外周神经元的支持细胞(如卫星细胞)、中枢神经系统中的神经细胞和神经胶质细胞(如星状胶质细胞)、色素细胞(如视网膜色素上皮细胞),以及它们的前体细胞(如组织前体细胞)。细胞的分化水平没有特别限制,在本发明中无论是未分化的祖细胞(包括体干细胞)还是最终分化的成熟细胞均可以类似地用作体细胞的来源。在本文中,未分化的祖细胞的实例包括组织干细胞(体干细胞),比如神经干细胞、造血干细胞、间充质
干细胞和牙髓干细胞。
[0091]
在本发明中,所述“核重编程物质”可包括能够由体细胞诱导ips细胞的任何物质(物质组),比如蛋白质因子或编码该蛋白质因子的核酸(包括引入至载体中的形式),或低分子量的化合物。当所述核重编程物质为蛋白质因子或编码该蛋白质因子的核酸时,其优选的实例包括如下组合(以下描述中仅给出了蛋白质因子的名称)
[0092]
[1]oct3/4、klf4和c
‑
myc
[0093]
[2]oct3/4、klf4、c
‑
myc和sox2(在此,sox2可被sox1、sox3、sox15、sox17或sox18替代。此外,klf4可被klf1、klf2或klf5替代。另外,c
‑
myc可被t58a(活性突变体)、n
‑
myc或l
‑
myc替代)
[0094]
[3]oct3/4、klf4、c
‑
myc、sox2、fbx15、nanog、eras、ecat15
‑
2、tcli和β
‑
连环蛋白(活性突变体s33y)
[0095]
[4]oct3/4、klf4、c
‑
myc、sox2、tert和sv40大t抗原(下文称为sv40lt)
[0096]
[5]oct3/4、klf4、c
‑
myc、sox2、tert和hpv16 e6
[0097]
[6]oct3/4、klf4、c
‑
myc、sox2、tert和hpv16 e7
[0098]
[7]oct3/4、klf4、c
‑
myc、sox2、tert、hpv6 e6和hpv16 e7
[0099]
[8]oct3/4、klf4、c
‑
myc、sox2、tert和bmil(对于以上所述的组合参见wo 2007/069666 a1(前提是在上述组合[2]中,用sox18代替sox2或用klf1或klf5代替klf4参见nature biotechnology,26,101
‑
106(2008))。“oct3/4、klf2(或klf5)、c
‑
myc和sox2”的组合还参见nat.cell biol.,11,197
‑
203(2009)。“oct3/4、klf4、c
‑
myc、sox2、htert和sv40lt”的组合还参见nature,451,141
‑
146(2008))
[0100]
[9]oct3/4、klf4和sox2(参见nature biotechnology,26,101
‑
106(2008))
[0101]
[10]oct3/4、sox2、nanog和lin28(参见science,318,1917
‑
1920(2007))
[0102]
[11]oct3/4、sox2、nanog、lin28、htert和sv40lt(参见stem cells,26,1998
‑
2005(2008))
[0103]
[12]oct3/4、klf4、c
‑
myc、sox2、nanog和lin28(参见cell research(2008)600
‑
603)
[0104]
[13]oct3/4、klf4、c
‑
myc、sox2和sv40lt(还参见stem cells,26,1998
‑
2005(2008))
[0105]
[14]oct3/4和klf4(参见nature 454:646
‑
650(2008),cell stem cell,2:525
‑
528(2008))
[0106]
[15]oct3/4和c
‑
myc(参见nature 454:646
‑
650(2008))
[0107]
[16]oct3/4和sox2(参见nature,451,141
‑
146(2008),wo 2008/118820a2)
[0108]
[17]oct3/4、sox2和nanog(参见wo 2008/118820 a2)
[0109]
[18]oct3/4、sox2和lin28(参见wo 2008/118820 a2)
[0110]
[19]oct3/4、sox2、c
‑
myc和esrrb(在本文中,essrrb可以被esrrg替代。参见nat.cell biol.,11,197
‑
203(2009))
[0111]
[20]oct3/4、sox2和esrrb(参见nat.cell biol.,11,197
‑
203(2009))
[0112]
[21]oct3/4、klf4和l
‑
myc
[0113]
[22]oct3/4和nanog
[0114]
[23]oct3/4
[0115]
[24]oct3/4、klf4、c
‑
myc、sox2、nanog、lin28和sv40lt(参见science,324:797
‑
801(2009))
[0116]
[25]oct3/4、klf4、sox2和glis家族成员(本文给出了,例如,glis1、glis2和glis3,并且适当地给出了glis家族锌指1(glis1)。参见wo2010/098419a1和wo 2011/102531 a2)
[0117]
[26]oct3/4、klf4、sox2和irx家族成员(本文给出了,例如,irx1、irx2、irx3、irx4、irx5和irx6,并且适当地给出了易洛魁族同源框蛋白6(irx6)。参见wo 2010/098419 a1)
[0118]
[27]oct3/4、klf4、sox2和ptx家族成员(本文给出了,例如,pitx1、pitx2和pitx3,并且适当地给出了成对样同源域转录因子2(pitx2)。已知pitx2有三种同种型(同种型a、b和c)且可以使用这些同种型中的任一一种,且同种型b是特别优选的。参见wo 2010/098419 a1)
[0119]
[28]oct3/4、klf4、sox2和具有富含脯氨酸的c
‑
末端1的dmrt
‑
样家族b(dmrtb1,参见wo 2010/098419 a1)
[0120]
在上述组合[1]
‑
[28]中,可以使用任何其他oct家族成员(比如oct1a或oct6)来代替oct3/4。此外,可以使用任何其他sox家族成员(比如sox7)来代替sox2(或sox1、sox3、sox15、sox17或sox18)。此外,可以使用任何其他lin家族成员(比如lin28b)来代替lin28。
[0121]
此外,与上述组合[1]至[28]中任一项均不完全相同但包含上述组合[1]至[28]中任一项中的所有组分且进一步包含任何其他物质的组合也可以包含在本发明的“核重编程物质”的范畴内。此外,在使上述组合[1]至[28]中的任一组合中的一些组分在经受核重编程的体细胞内以足以进行核重编程的水平内源性表达的条件下,仅上述成分以外的成分的组合也可以包含在本发明的“核重编程物质”的范畴内。
[0122]
在这些组合种,核重编程物质的优选实例为选自oct3/4、sox2、klf4、c
‑
myc、nanog、lin28和sv40lt中的至少一种,优选地至少两种或更多种,更优选地至少三种或更多种。
[0123]
上述核重编程物质的人cdna序列信息可参考wo 2007/069666 a1或wo 2010/098419a1中描述的ncbi登录号获取(在这些公开文本中以名称“ecat4”对nanog进行描述。关于lin28、lin28b、esrrb、esrrg和l
‑
myc的人cdna序列信息可参考下表1中所示的相应ncbi登录号获取)。本领域技术人员可以容易地分离其cdna。
[0124]
表1
[0125]
基因名ncbi登录号lin28nm_024674lin28bnm_001004317esrrbnm_004452esrrgnm_001438l
‑
mycnm_001033081
[0126]
另外,glis家族成员、irx家族成员、ptx家族成员和dmrtb1的人cdna序列信息可参考下表2所示的相应ncbi登录号获取。
[0127]
表2
[0128][0129][0130]
此外,与任何上述氨基酸序列具有90%以上,优选95%以上,更优选98%以上,特别优选99%以上的同一性的,并且作为klf4的替代因子具有与野生型蛋白质相当的核重编程能力的天然或人工突变蛋白以及编码该突变蛋白的核酸也可用作本发明的核重编程物质以代替klf4。
[0131]
当将蛋白质因子本身用作核重编程物质时,可以通过将获得的cdna插入至合适的表达载体中,将该表达载体导入宿主细胞,培养所述细胞并从所得培养物中收集重组蛋白因子来制备该蛋白质因子。同时,当将编码蛋白质因子的核酸用作核重编程物质时,通过将获得的cdna插入病毒载体、质粒载体、附加型载体等构建表达载体,并使其进行核重编程步骤。
[0132]
对于将核重编程物质引入体细胞,可以适当使用本发明所属技术领域中使用的方法,比如专利文献1(wo 2015/64705a1)的方法。
[0133]
此外,可以通过使用因子,比如c4orf51、hhla1、abhd12b或znf541作为分化抗性的指标,并选择其中不显著表达该因子的细胞系来获得ips细胞(参见wo 2013/014929 a1)。
[0134]
此外,可以通过例如,用饲养细胞进行培养来获得所使用的ips细胞,所述饲养细胞提供例如细胞的存活、增殖和未分化维持所需的可溶性因子并作为细胞粘附的支架,并且在胚体形成诱导前适当移除饲养细胞。在本发明的另一个实施方式中,从提高成骨细胞构建体的产生效率(可以获得更多数量的成骨细胞构建体)的角度而言,不使用饲养细胞的ips细胞培养优于上述涉及使用饲养细胞的方法。
[0135]
该步骤可以通过使用上述微空间培养容器使那些未分化的ips细胞在用于诱导胚状体形成的液体培养基中进行非贴壁培养来进行。
[0136]
对于培养基,可以适当地使用用于培养灵长类es/ips细胞的培养基。在本发明中,
fisher scientific生产的dmem/f12培养基;由thermo fisher scientific生产的neurobasal培养基;由thermo fisher scientific生产的rpmi 1640培养基;和由sigma
‑
aldrich corporation生产的stemline(商标)ii造血干细胞生长培养基。这些培养基可以单独使用或组合使用。
[0141]
从促进向中胚层的分化诱导的角度而言,本步骤中使用的培养基优选掺有wnt信号激活剂。wnt信号激活剂没有特别限制,但其实例包括chir99021、6
‑
溴靛玉红
‑3’‑
肟(bio)、肯帕罗酮、sb
‑
216763、skl2001、脱氧胆酸、way
‑
316606、nsc
‑
693868、蓖麻碱、7
‑
氧代
‑
β
‑
谷甾醇、im
‑
12、hly78和视黄酸(如全反式
‑
视黄酸(由fujifilm wako pure chemical corporation制造)。在这些wnt信号激活剂中,优选chir99021等。这些wnt信号激活剂可以单独使用或组合使用。在本发明的优选实施方式中,优选将视黄酸与视黄酸以外的wnt信号激活剂组合使用。当掺入视黄酸时,其掺入量没有特别限制,但就在本步骤中使用的培养基中的终浓度而言,其为,例如优选0.01μm至10μm,更优选0.1μm至5μm。
[0142]
当掺入wnt信号激活剂时,其掺入量没有特别限制,但就在本步骤中使用的培养基中的终浓度而言,其为,例如优选1μm至100μm,更优选10μm至50μm。
[0143]
从促进向中胚层的分化诱导的角度而言,优选在本步骤中使用的培养基中掺有刺猬信号抑制剂。刺猬信号抑制剂没有特别限制,其实例包括环巴胺、ay9944、gant58、gant61、蒜藜芦碱(jervine)、sant
‑
1、sant
‑
2、u18666a、藜芦胺、维莫德吉(vismodegib)、cur
‑
61414、robotnikinin、jk184和hpi
‑
4。在这些刺猬信号抑制剂中,优选环巴胺等。这些刺猬信号抑制剂可以单独使用或者组合使用。
[0144]
当掺入刺猬信号抑制剂时,其掺入量没有特别限制,但就在本步骤中使用的培养基中的终浓度而言,其为,例如优选1μm至100μm,更优选1μm至10μm。
[0145]
在本发明中,优选同时使用wnt信号激活剂和刺猬信号抑制剂。
[0146]
如上在“解决问题的方案”中所述,通过在为了解决该发现所涉及的问题中的以下新发现的基础上进一步改进完成了本发明:根据专利文献1中记载的方法,通过涉及在es培养基中培养2天,进一步添加视黄酸培养2天,并在成骨细胞分化诱导培养基中培养的方法获得的细胞构建体具有中空的袋状形状。因此,在诱导胚状体形成的步骤之后使用仅掺有视黄酸作为能够诱导分化成中胚层的成分的培养基进行培养步骤的方法被排除在本发明的方法之外。
[0147]
此外,培养基可任选地在其中掺有可用于细胞培养的添加剂。此类添加剂的具体实例包括胎牛血清、氨基酸(如,l
‑
谷氨酰胺)、抗生素(如,青霉素、链霉素、两性霉素b)。
[0148]
此外,培养基可以补充有,例如,商购可获得的用于细胞培养的补充剂(用作用于细胞培养的添加剂)。此类补充剂的实例包括:由thermo fisher scientific生产的n
‑
2补充剂;由thermo fisher scientific生产的b
‑
27补充剂;由thermo fisher scientific生产的胰岛素、转铁蛋白、硒溶液;由r&d systems生产的wnt 3a;由r&d systems生产的激活素a;和由peprotech生产的bmp4。这些补充剂可以单独使用或组合使用。当在(1)上述诱导胚状体形成的步骤和(3)以下所述的诱导向成骨细胞分化的步骤之间实施诱导向中胚层细胞分化的步骤时,可以,特别是在采用人类ips细胞作为原料的情况下,获得固体细胞构建体。
[0149]
本发明的方法是一种生产成骨细胞的细胞构建体的方法。因此,该中胚层细胞分
化诱导步骤也通过非贴壁培养进行。在本发明中,步骤(2)的培养使用微空间培养容器,并因此为了保持细胞或细胞构建体处于在微空间培养容器的孔中的状态,通常通过静态培养实施该步骤。
[0150]
在本发明的典型实施方式中,通过将包含在步骤(1)中获得的胚状体的上述培养基放置并保持在培养容器的凹部中来进行本步骤。本步骤的培养时间,例如,优选为0.125天至10天,更优选为1天至8天,甚至更优选地为3天至6天。此外,本步骤的培养时间,例如,优选为约3小时至约240小时,更优选为约24小时至约192小时,甚至更优选为约72小时至约144小时。本步骤中的培养温度没有特别限制,例如优选地为30℃至42℃,更优选地为35℃至39℃。本步骤中的培养优选在3%至10%co2的气氛下进行。
[0151]
(3)向成骨细胞分化的诱导
[0152]
本发明的方法包括通过使步骤(2)中获得的ips细胞的中胚层细胞进行非贴壁培养以诱导分化为成骨细胞。
[0153]
作为本步骤中使用的培养基,可以适当使用适合于向成骨细胞分化的诱导的培养基。此类培养基的实例包括:dmem培养基(如由nacalai tesque生产的无丙酮酸钠的dmem培养基);和αmem培养基(如由由nacalai tesque生产的αmem培养基)。这些培养基可以单独使用或组合使用。
[0154]
本步骤中,培养基中可以掺有成骨细胞分化诱导促进剂等。成骨细胞分化诱导促进剂的实例包括抗坏血酸、β
‑
甘油磷酸酯、地塞米松、bmp
‑
2、氢化可的松半琥珀酸酯和视黄酸(如全反式
‑
视黄酸)。抗坏血酸可以是抗坏血酸
‑2‑
磷酸或其盐。此外,作为分化诱导剂,氢化可的松琥珀酸酯可以代替地塞米松或与地塞米松共同使用。这些成骨细胞分化诱导促进剂可以单独使用或组合使用。
[0155]
当掺入抗坏血酸时,其掺入量没有特别限制,但就在本步骤中使用的培养基中的终浓度而言,其为,例如优选50μm至300μm,更优选150μm至200μm。当掺入β
‑
甘油磷酸酯时,其掺入量没有特别限制,但就在本步骤中使用的培养基中的终浓度而言,其为,例如优选1mm至100mm,更优选5mm至15mm。当掺入地塞米松时,其掺入量没有特别限制,但就在本步骤中使用的培养基中的终浓度而言,其为,例如优选0.001μm至10μm,更优选0.01μm至1.0μm。当掺入视黄酸时,其掺入量没有特别限制,但就在本步骤中使用的培养基中的终浓度而言,其为,例如优选0.01μm至10μm,更优选0.1μm至5μm。
[0156]
从成骨细胞矿化的角度而言,优选地本步骤中的培养基还掺有缺氧模拟化合物。缺氧模拟化合物的实例包括去铁胺(dfx)和氯化钴(cocl2)。这些缺氧模拟化合物可以单独使用或组合使用。
[0157]
从成骨细胞矿化的角度而言,优选地本步骤中的培养基还掺有他汀类化合物。他汀类化合物的实例包括阿托伐他汀、氟伐他汀、辛伐他汀、洛伐他汀、匹伐他汀、普伐他汀和瑞舒伐他汀。这些他汀类化合物可以单独使用或组合使用。
[0158]
此外,培养基可任选地在其中掺有可用于细胞培养的添加剂。此类添加剂的具体实例包括胎牛血清、氨基酸(如,l
‑
谷氨酰胺)、抗生素(如,青霉素、链霉素、两性霉素b)。
[0159]
本发明的方法是一种生产成骨细胞的细胞构建体的方法。因此,该中胚层细胞分化诱导步骤也通过非贴壁培养进行。非贴壁培养的具体模式包含以上所述的那些。在本步骤(向成骨细胞分化的诱导)中,从通过机械刺激促进分化的角度而言,优选振荡培养等。
[0160]
在本发明的典型实施方式中,通过将步骤(2)中获得的ips细胞的中胚层细胞的悬浮液放置在培养容器(例如25cm2低附着瓶(greiner bio
‑
one,生长面积))的上述培养基中,并随后培养来进行本步骤。在本发明中,在步骤(3)的培养开始时,培养基中ips细胞的中胚层细胞的数量没有限制,但从提高成骨细胞构建体的产生效率的角度而言,例如,优选地每10ml培养基中添加在对应于用于步骤(2)的培养的培养容器的1至10个孔的培养液体中包含的中胚层细胞,更优选地添加对应于培养容器的1至5个孔的中胚层细胞。例如,更优选地添加对应于培养容器的2至4个孔的中胚层细胞。上述优选的中胚层细胞的数量通常显示为在采用实验实施例3中使用的24
‑
孔微空间形低附着板[elplasia(商标)(corning,目录号4441:具有直径为500μm和深度为400μm的微孔尺寸,和具有554至580个凹陷/孔]大小的板的情况下的值。此外,优选地添加对应于用于步骤(2)的培养的培养容器的580至5800个凹部的培养液体中包含的中胚层细胞,更优选地添加对应于580至2900个凹部的中胚层细胞,和进一步优选地添加对应于1160至2320个凹部的中胚层细胞。出于相同的目的,通过将对应于2ml至20ml,优选2ml至10ml,更优选4ml至8ml的采用步骤(2)的24
‑
孔培养容器获得中胚层细胞悬浮液的中胚层细胞悬浮液转移至25cm2低附着瓶中,并将培养基更换为10ml上述成骨细胞分化诱导培养基来适当的进行步骤(3)。本步骤的培养时间,例如优选地为约1天至约90天,更优选地为7天至60天,甚至更优选地为21天至50天。此外,本步骤的培养时间,例如优选地为约24小时至约2160小时,更优选地为约168小时至约1440小时,甚至更优选地为约504小时至约1200小时。本步骤的培养温度没有特别限制,例如,优选地为30℃至42℃,更优选地为35℃至39℃。本步骤中的培养优选在3%至10%co2的气氛下进行。
[0161]
根据本发明,由于上述结构特征,可以获得具有高度矿化的成骨细胞构建体。此外,如上所述,根据本发明,可以获得具有高骨再生能力的成骨细胞构建体。因此,例如,当将本发明中获得的成骨细胞构建体用作原料,对其适当地进行灭活处理,然后植入到骨缺损部位时,可以形成新骨以填充此类缺损部位(空隙),因此本发明极其有用。因此,本发明还提供了诸如促进ips细胞衍生的成骨细胞(或细胞构建体)矿化的方法、增强ips细胞衍生的成骨细胞(或细胞构建体)的骨诱导能力的方法和向培养中的ips细胞施加用于诱导自组装成骨的刺激(细胞周围的空间环境)的方法。这些方法中的每种方法中的培养容器、材料和各种条件均与上述那些类似。
[0162]
成骨细胞构建体
[0163]
当采用人类ips细胞作为原料实施本发明的方法时,可以获得直径为0.5mm至5mm的成骨细胞构建体。此前未报道过该种衍生自人类ips细胞并具有此类直径的成骨细胞构建体,并因此其是一种新型的成骨细胞构建体。此外,如上所述,具有此类直径的成骨细胞构建体具有高骨再生能力,并因此是极其有用的。成骨细胞构建体的直径在优选地0.5mm至5mm的范围内,更优选地1mm至4mm的范围内,甚至更优选地1mm至3mm的范围内。
[0164]
生产骨再生剂的方法
[0165]
本发明还提供一种生产骨再生剂的方法,所述方法包括如下步骤:通过上述方法由ips细胞生产成骨细胞构建体;并使所述成骨细胞构建体接受灭活处理。
[0166]
作为在成骨细胞构建体的生产步骤中使用的原料的ips细胞、成骨细胞构建体的生产步骤中所需的处理等如上所述。
[0167]
本发明的方法包括使通过上述步骤获得的成骨细胞构建体接受灭活处理的步骤。
[0168]
用于灭活的方法没有特别限制,但其实例包括冷冻干燥、热处理、高压处理、酸或碱溶液处理、高压蒸汽灭菌、辐射灭菌、气体灭菌和电磁波处理。冷冻干燥的条件没有特别限制,可以使用已知的方法。此外,例如,可以在冷冻干燥之前进行初步冷冻。初步冷冻的温度没有特别限制,但优选地为,例如约
‑
20℃至约
‑
12℃。冷冻干燥的温度没有特别限制,但优选地为,例如约
‑
100℃至约
‑
5℃。另外,冷冻干燥的压力没有特别限制,例如优选地为600pa以下,更优选地为50pa以下。作为具体的冷冻干燥条件,这里提供,例如,一种方法,其涉及在
‑
10℃的固定温度下,将压力从5pa逐渐降低到20pa,降压开始的同时开始冷冻干燥。根据本发明,可以获得具有高度矿化和高骨再生能力的骨再生剂。在一个实施方式中,本发明还提供通过上述生产方法获得的骨再生剂。
[0169]
现在,通过实施例和比较例的方式更具体地描述本发明。然而,本发明不限于此。
[0170]
实施例
[0171]
实验1:用于将ips细胞诱导为成骨细胞构建体的最佳微空间尺寸的筛选
[0172]
《方法》
[0173]
1.1.小鼠ips细胞的培养
[0174]
对于该实验,使用了从小鼠牙龈成纤维细胞建立的ips细胞系[plos one,5(9):e12743,2010]。通过使用es培养基[包含15%胎牛血清(gibco/life technologies,grand island,ny,usa)、2mm l
‑
谷氨酰胺(wako pure chemical,osaka)、1
×
10
‑4m非必需氨基酸(life technologies,grand island,ny,usa)、1
×
10
‑4m 2
‑
巯基乙醇(life technologies,grand island,ny,usa)、50u青霉素和50μg/ml链霉素(wako pure chemical)的dulbecco's改良eagle's培养基(dmem:包含4.5g/l葡萄糖且无丙酮酸钠;nacalai tesque,kyoto)]将这些小鼠ips细胞作为ips细胞构建体在snlp76.7
‑
4饲养细胞(经丝裂霉素c处理)上维持和培养。
[0175]
1.2.使用微空间形低附着板生成小鼠ips细胞的成骨细胞构建体
[0176]
通过用含有1mm edta的0.25%胰蛋白酶(wako pure chemical)处理,将上述培养的小鼠ips细胞构建体解离成单个细胞,并将其用es培养基调整的细胞悬液(3.9
×
106个细胞/ml)用于本实验。在本实验中从小鼠ips细胞生成成骨细胞构建体的方法示于图1。
[0177]
作为培养容器,使用了微空间形低附着板elplasia(商标)(kuraray,日本),其在6孔板的每个孔的底面上具有不同的凹陷尺寸的微空间(图1):
[0178]
elp400;cat.#rb 400 560na6:具有400μm的直径和560μm的深度,elp500;cat.#rb 500 700na6:具有500μm的直径和700μm的深度,或elp900;cat.#rb 900 700na6:具有900μm的直径和700μm的深度。每孔接种上述细胞悬液2ml,培养2天以诱导胚状体形成(图2)。
[0179]
培养2天后,将孔中的培养基更换为含有1μm全反式视黄酸(ra;wako pure chemical)的es培养基,然后进一步培养3天。
[0180]
之后,将培养基更换为成骨细胞分化诱导培养基[含有15%fbs(gibco/life technologies)、0.1μm地塞米松(sigma
‑
aldrich,st.louis,mo,usa)、10mmβ
‑
甘油磷酸酯(sigma
‑
aldrich)和50μg/ml抗坏血酸
‑2‑
磷酸(sigma
‑
aldrich)、1%抗生素
‑
抗真菌剂(100单位/ml青霉素、100μg/ml链霉素和250ng/ml两性霉素b(gibco/life technologies)的α
‑
mem培养基(nacalai tesque)],并进行培养达35天。每2天更换一半培养基。将在成骨细胞分化诱导培养基中开始培养的时间点定义为“成骨细胞分化诱导的第0天”。
[0181]
《结果》
[0182]
1.3.微空间直径对成骨细胞构建体的大小的影响
[0183]
使用image j图像分析软件计算自将ips细胞悬浮液加入到每个微空间尺寸的孔中(成骨细胞分化诱导的第0天)培养5天后的细胞构建体的大小(feret's直径)。结果,在相应微空间中培养的elp400组、elp500组和elp900组的样品的平均feret's直径分别为约187.6、约242.5和约328.8μm,elp500组和elp900组的大小显著大于elp400组的大小。在转移到成骨细胞分化诱导培养基后的35天中,elp400组和elp500组的细胞构建体的大小逐渐增加。同时,elp900组的细胞构建体的大小增加直至诱导的第28天,但在直至第35天的时间段内降低(图3:左)。
[0184]
在相差显微镜下观察成骨细胞分化诱导中的各组的细胞构建体,结果显示,在诱导的第21天到第28天期间,观察到elp400组和elp900组的细胞构建体塌陷,其轮廓逐渐变得不那么平滑。同时,elp500组的细胞构建体以细胞构建体存在直到诱导35天后才塌陷(图3:右)。
[0185]
使用活细胞/死细胞同时染色试剂盒(live/dead(商标)viability/cytotoxicity kit,molecular probes/thermo fisher scientific,eugene,or,usa)研究每组细胞构建体中细胞的存活和死亡。结果显示,在成骨细胞分化诱导14天后的elp400组和elp900组中,发现大量表示死亡细胞的红色细胞。特别是elp900组的细胞构建体的中心部分呈红色,即发现细胞构建体内部的细胞大部分死亡的图像。同时,从诱导开始到诱导14天后,elp500组的细胞构建体由代表活细胞的绿色细胞形成,且几乎没有发现红色的死细胞(图4)。
[0186]
1.4.微空间直径对细胞构建体的成骨细胞分化的影响
[0187]
通过sybr green实时rt
‑
pcr分析法(thunderbird(商标)sybr(商标)qpcr mix,toyobo)成骨细胞分化诱导10天后各组细胞构建体中成骨细胞特异性标记基因(runx2、osterix、胶原蛋白1a1、骨唾液蛋白、骨桥蛋白和骨钙素)的表达。sybr green实时rt
‑
pcr法中使用的引物的碱基序列如下所示。将18s rrna用作内部对照。
[0188]
runx2正向引物:5
’‑
cgggctacctgccatcac
‑3’
[0189]
runx2反向引物:5
’‑
ggccagaggcagaagtcaga
‑3’
[0190]
osterix正向引物:5
’‑
ctcgtctgactgcctgcctag
‑3’
[0191]
osterix反向引物:5
’‑
gcgtggatgcctgccttgta
‑3’
[0192]
胶原蛋白1a1正向引物:5
’‑
tgtcccaacccccaaagac
‑3’
[0193]
胶原蛋白1a1反向引物:5
’‑
ccctcgactcctacatcttctga
‑3’
[0194]
骨钙素正向引物:5
’‑
ccgggagcagtgtgagctta
‑3’
[0195]
骨钙素反向引物:5
’‑
ccgggagcagtgtgagctta
‑3’
[0196]
骨桥蛋白正向引物:5
’‑
tctccttgcgccacagaatg
‑3’
[0197]
骨桥蛋白反向引物:5
’‑
tccttagactcaccgctctt
‑3’
[0198]
骨唾液蛋白正向引物:5
’‑
cggaggagacaacggagaag
‑3’
[0199]
骨唾液蛋白反向引物:5
’‑
gtaagtgtcgccacgaggct
‑3’
[0200]
18s rrna正向引物:5
’‑
gtaacccgttgaaccccatt
‑3’
[0201]
18s rrna反向引物:5
’‑
ccatccaatcggtagtagcg
‑3’
[0202]
结果,所有这些基因在elp500组中的表达均显著高于那些在elp400组合elp900组
中的表达(图5)。
[0203]
此外,在成骨细胞分化诱导35天后将各组细胞构建体切片,进行he染色或von kossa和亚甲基蓝双染色以进行组织学观察。
[0204]
对于he染色的结果,观察到以下图像:elp400组和elp900组中的大部分细胞失去了它们的细胞核并死亡,并且细胞构建体塌陷。同时,从图像中观察到:在elp500组的细胞构建体中,发现形成了层状细胞结构,成骨细胞在外层形成了骨样组织。对于von kossa和亚甲基蓝双染色的结果,在elp400组和elp900组中,整个细胞构建体上均可见被染成黑色的矿化,但显示了呈脆性且塌陷的图像,未见细胞成分,提示矿化可能伴有细胞死亡发生的可能性。同时,在elp500组,在细胞结构的内层发现了丰富的细胞外基质并伴有矿化,外层也发现了伴有部分矿化的骨样组织的形成(图6)。
[0205]
1.5.实验1的结论
[0206]
上述结果反映出使用具有各直径为500μm的凹陷的微空间形低附着板elplasia(商标)(elp500)可以有效地从小鼠ips细胞产生三维成骨细胞构建体。此外,当使用具有各直径为400μm或900μm的凹陷的elp400或elp900时,结果表明难以从小鼠ips细胞产生含有活细胞的成骨细胞构建体。
[0207]
实验2:凹陷的微空间(elp500)对人类ips细胞的成骨细胞构建体诱导的影响<<方法>>
[0208]
2.1.人类ips细胞的培养
[0209]
在实验中,使用了人皮肤成纤维细胞衍生的ips细胞系(409b2:riken brc cell bank)。将snlp76.7
‑
4细胞(由the sanger institute的allan bradley博士提供,uk)用作饲养细胞。
[0210]
将snlp76.7
‑
4饲养细胞接种于10cm细胞培养板(涂有0.1%明胶),使用含有7%胎牛血清(fbs:japan bio serum,lot#jbs
‑
011501)、2mm l
‑
谷氨酰胺(thermo fisher scientific)、50u青霉素和50μg/ml链霉素(thermo fisher scientific)的dmem培养基培养(无丙酮酸钠:nacalai tesque)。每2天更换一次培养基。在ips细胞培养前,将snlp76.7
‑
4饲养细胞用12μg/ml丝裂霉素c(nacalai tesque)处理2.5小时,然后以
[0211]
1.5
×
106个细胞/培养皿的浓度接种在10cm细胞培养板(涂有0.1%明胶)中。
[0212]
将ips细胞接种在snlp76.7
‑
4饲养细胞上,并使用含有4ng/ml人碱性fgf(reprocell)的灵长类es培养基(es培养基:reprocell)进行培养。每天更换培养基。
[0213]
在本实验中从人类ips细胞生成成骨细胞构建体的方法示于图7。
[0214]
2.2.胚状体的形成
[0215]
将ips细胞用磷酸盐缓冲液(pbs)洗涤并在37℃下用1ml的ctk溶液(0.25%胰蛋白酶、0.1mg/ml胶原酶iv、10mm cacl2、20%ksr)处理1分钟。之后,通过抽吸移除ctk溶液,并加入1ml的pbs。移除pbs,并尽可能仅通过抽吸移除从培养板剥落的饲养细胞。之后,使用4ml的es培养基收集残留在培养板中的附着ips细胞。将2ml的细胞悬浮液(悬浮液中ips细胞的数量:6.25
×
105细胞/ml)转移至微空间形低附着板elplasia(商标)(elp500:kuraray,cat.#rb 500 700na24)的1个孔中,并培养1天以诱导胚状体的形成,其中所述微空间形低附着板elplasia在24孔板的各孔的底面上具有直径为500μm的凹部(每孔554至580个凹部)(每孔放置的ips细胞数:12.5
×
105个细胞)。作为对照,设置了其中胚状体培养
和中胚层诱导均采用低附着培养皿(nunc未经处理的多孔皿,thermo fisher scientific)而非采用elp500进行的组。
[0216]
2.3.向中胚层分化的诱导
[0217]
胚状体形成1天后,将es培养基更换为2ml的中胚层分化诱导培养基[含有2%b
‑
27补充剂(thermo fisher scientific)、1%n
‑
2补充剂(thermo fisher scientific)、30μm chir99021(wako pure chemical industries)和5μm环巴胺(enzo life science)的dmem/f12(thermo fisher scientific)与neurobasal培养基(thermo fisher scientific)的1:1混合培养基],并进行培养5天。每2天更换一次培养基。
[0218]
2.4.向成骨细胞分化的诱导
[0219]
在中胚层分化诱导后,将对应于8个孔的细胞构建体(对应于16ml培养液)自elplasia(商标)中移除,并重新悬浮在10ml成骨细胞分化诱导培养基[含有15%fbs(thermo fisher scientific)、0.1μm地塞米松(sigma aldrich)、10mmβ
‑
甘油磷酸酯(sigma
‑
aldrich)和50μg/ml抗坏血酸
‑2‑
磷酸(sigma aldrich)、100单位/ml青霉素、100μg/ml链霉素和250ng/ml两性霉素b(thermo fisher scientific)的dmem培养基(无丙酮酸钠:nacalai tesque,kyoto)]中。采用低附着瓶(greiner bio
‑
one,生长面积25cm2)在在跷跷板型生物反应器(10
°
倾角,周期:0.33hz,台子宽度:32cm,振幅:5.5cm)(bc
‑
700:bio craft)上振荡的同时使该细胞悬浮液进行低附着培养达30天。培养基每7天更换一次。
[0220]
2.5.向成骨细胞分化的诱导的评估
[0221]
成骨细胞分化诱导30天后,通过sybr green实时rt
‑
pcr法(thunderbird(商标)sybr(商标)qpcr mix,toyobo)分析成骨细胞分化特异性基因(osterix、胶原蛋白1a1、runx2和骨钙素)的表达。
[0222]
此外,通过sybr green实时rt
‑
pcr法(thunderbird(商标)sybr(商标)qpcr mix,toyobo)分析直至成骨细胞分化诱导60天后未分化的标记基因(nanog)、成骨细胞祖细胞标记基因(brachyury和runx2)以及成骨细胞标记基因(osterix、胶原蛋白1a1、runx2和骨钙素)的表达。sybr green实时rt
‑
pcr法中使用的引物的碱基序列如下所示。将gapdh用作内部对照。
[0223]
runx2正向引物:5
’‑
cagaccagcagcactccata
‑3’
[0224]
runx2反向引物:5
’‑
cagcgtcaacaccatcattc
‑3’
[0225]
osterix正向引物:5
’‑
aagctgatctggtggtgcat
‑3’
[0226]
osterix反向引物:5
’‑
gactccacaaagggcatgat
‑3’
[0227]
胶原蛋白1a1正向引物:5
’‑
gtgctaaaggtgccaatggt
‑3’
[0228]
胶原蛋白1a1反向引物:5
’‑
ctcctcgctttccttcctct
‑3’
[0229]
骨钙素正向引物:5
’‑
cactcctcgccctattggc
‑3’
[0230]
骨钙素反向引物:5
’‑
ccctcctgcttggacacaaag
‑3’
[0231]
nanog正向引物:5
’‑
aactggccgaagaatagcaa
‑3’
[0232]
nanog反向引物:5
’‑
tgcaccaggtctgagtgttc
‑3’
[0233]
brachyury正向引物:5
’‑
cagtcagtaccccagcctgt
‑3’
[0234]
brachyury反向引物:5
’‑
actggctgtccacgatgtct
‑3’
[0235]
gapdh正向引物:5
’‑
gaaggtgaaggtcggagtca
‑3’
[0236]
gapdh反向引物:5
’‑
gaagatggtgatgggatttc
‑3’
[0237]
此外,使所得样品进行he染色或von kossa和亚甲基蓝双重染色以进行组织化学观察。
[0238]
使用傅立叶变换红外(ft
‑
ir)光谱分析来分析ips细胞构建体的成分。收集所有ips细胞构建体,用10%中性缓冲福尔马林溶液固定,用蒸馏水洗涤,然后用乙醇(30%、70%、90%、100%)逐渐脱水。再次将乙醇更换为新鲜乙醇(100%),然后将其全部置于37℃的干燥机静置12小时。使用溴化钾(kbr)板法对干燥的细胞样品进行ft
‑
ir分析。将ft
‑
ir测量装置ft/ir
‑
6300st(jasco corporation)用于分析,并分析以2cm
‑1的分辨率、在650cm
‑1至4000cm
‑1的范围内扫描1000次获得的红外吸收光谱图。
[0239]
2.6.ips细胞衍生的骨替代材料的产生
[0240]
用pbs洗涤成骨细胞分化诱导120天后的成骨细胞构建体,然后将其浸入10ml pbs中在4℃下过夜。第二天,将成骨细胞构建体取出,并转移至6cm细胞培养皿中,并在冰箱中在
‑
80℃下初步冷冻过夜。之后,将培养皿置于冷冻干燥机(vd
‑
250r;taitec)中,进行冷冻干燥过夜以灭活细胞。由此,获得ips细胞衍生的骨替代材料。将其中放入了骨替代材料的培养皿盖上盖子,用密封件密封,并储存在防潮的储存器(玻璃干燥器)中。
[0241]
2.7.向大鼠颅骨缺损模型中的移植
[0242]
将10周龄的sd大鼠(slc:sd;japan slc,inc.)置于全身麻醉下。之后,剥去头皮形成骨膜瓣,形成穿过颅骨矢状缝的直径为5mm的缺损。使用动物手术用引擎和环钻杆(implatex,tokyo)在流动水下进行颅骨缺损的形成。将冻干的ips细胞构建体植入颅骨缺损处,覆盖骨膜,缝合头皮。之后,在无特定病原体且自由饮水和接触的条件下饲养大鼠。
[0243]
《结果》
[0244]
2.8成骨细胞构建体的生成效率
[0245]
通过上述2.2至2.4所述的方法,计算从10cm细胞培养板中的80%汇合的ips细胞获得的成骨细胞诱导分化第30天的成骨细胞构建体的数量。使用低附着培养皿得到的结果为5.7
±
0.77,使用elp500得到的结果为46.2
±
8.8,表明通过使用elp500产生胚状体,生成效率显著增加(图8)。
[0246]
2.9.采用elp500生成的三维成骨细胞构建体的评估
[0247]
在使用elp500诱导胚状体和中胚层细胞后,从经成骨细胞分化诱导30天的人类ips细胞构建体中制备切片标本,并进行von kossa和亚甲蓝双染色。组织学观察的结果表明,在成骨细胞分化诱导30天后,在细胞结构内部发现了部分矿化图像(图9,上部图)。此外,当成骨细胞分化诱导进行60天和90天时,细胞构建体内部的矿化部位增加(图9,中部和下部图)。同时,在于采用低附着培养皿诱导为胚状体和中胚层后经受30天的成骨细胞分化诱导的人类ips细胞构建体中未观察到矿化,而在60天的成骨细胞分化诱导后最终发现了部分矿化图像。因此,结果表明使用elp500可以缩短人类ips细胞构建体实现矿钙化的时间。
[0248]
此外,发现在成骨细胞分化诱导第30天使用elp500生成的细胞构建体中的成骨细胞特异性标记基因runx2、sp7、胶原蛋白1a1和骨钙素的表达显著高于使用低附着培养皿的那些(图10)。
[0249]
通过实时rt
‑
pcr法分析了诱导人类ips细胞向胚状体、中胚层和成骨细胞分化(图
7)过程中未分化的标记基因(nanog)、指示中胚层的标记基因(间充质干细胞)至成骨细胞祖细胞(brachyury、runx2和osterix)和成骨细胞特异性基因(胶原蛋白1a1和骨钙素)的表达(图11)。结果表明,在胚状体培养前在ips细胞中高表达的nanog的表达通过中胚层诱导显著降低,并在诱导的第5天时几乎消失。发现brachyury、runx2和osterix基因的表达在中胚层诱导后到成骨细胞分化诱导的初始阶段期间出现表达高峰,然后osterix、胶原蛋白1a1和骨钙素基因的表达随时间增加直至分化诱导后60天。将使用elp500诱导成胚状体和中胚层细胞后经受成骨细胞分化诱导达0天至60天的人类ips细胞构建体干燥,然后使用ftir分析进行成分分析。结果发现,经过30天以上的成骨细胞分化诱导的人类ips细胞构建体样品具有与天然骨组织(人冻干同种异体骨移植物)相似的ftir光谱峰(图12)。
[0250]
测量使用elp500诱导成胚状体和中胚层细胞后经受成骨细胞分化诱导达3天至30天的人类ips细胞构建体的feret's直径,结果显示,在经过30天的成骨细胞分化诱导的细胞构建体群组,发现了尺寸不同的细胞构建体,它们的feret's直径在0.66mm至2.68mm的范围内(图13a)。那些经30天成骨细胞分化诱导的细胞构建体群组按照feret's直径分为0.5mm至小于1mm、1mm至小于2mm以及2mm至3mm的大小,并由这些细胞构建体群组生成切片并通过使用von kossa染色进行矿化程度的评估。结果表明,2mm至3mm的细胞构建体显示出最显著的矿化(图13b),表明随着细胞构建体的大小增加,形成了更成熟的成骨细胞构建体。
[0251]
2.10.采用elp500生成的成骨细胞构建体的骨再生能力的评估
[0252]
通过2.6中所述的方法,对采用elp500在成骨细胞分化诱导第120天生成的细胞构建体进行冷冻干燥处理(图14)。
[0253]
将冻干成骨细胞构建体或用作比较对照的人冻干同种异体骨移植物(fdba)植入大鼠颅骨中产生的直径为5mm的骨缺损部位。在ips细胞衍生的冻干成骨细胞构建体植入4周后,通过组织切片的he染色观察组织图像。结果表明,新骨的形成填充了该处骨缺损,并且在植入的成骨细胞结构周围发现了伴有黏合线的骨重建图像。此外,显微ct分析的结果显示,观察到骨缺损部位完全被与其周围的现有骨连续的新骨填充的图像(图15a)。
[0254]
同时,在fdba植入4周后的he染色图像中,fdba被未成熟的纤维组织包围,未发现成熟的新骨形成。另外,在显微ct分析中,在缺损部位几乎没有发现新骨形成,缺损基本上以原样存在(图15b)。
[0255]
2.11.结论
[0256]
由此,揭示了在由人类ips细胞生成三维成骨细胞构建体中,在向胚状体和中胚层细胞诱导的过程中,与使用常规低附着培养皿的情况相比,凹陷的微空间的使用,特别是具有特定凹陷尺寸的elp500的使用不仅在时间和数量方面提高了生成效率,而且还能够诱导更成熟的成骨细胞构建体。此外,在通过该过程生成的细胞构建体中,在成骨细胞分化诱导第30天,feret’s直径大小为2mm至3mm的细胞构建体在矿化方面特别先进,表明成骨细胞构建体更加成熟。另外,与现有的骨替代材料(fdba)相比,冻干的人类ips细胞衍生的成骨细胞构建体显示出优异的骨再生能力,表明其可用作促进骨缺损部位修复的骨替代材料。
[0257]
实验3:在无饲养细胞环境中的ips细胞培养对成骨细胞构建体形成的影响
[0258]
《方法》
[0259]
3.1.人类ips细胞
[0260]
在该实验中,使用了人皮肤成纤维细胞衍生的ips细胞系(409b2:riken brc cell bank)。
[0261]
3.2.在饲养细胞上的人类ips细胞的培养(采用饲养细胞组)
[0262]
通过与实验2相同的培养方法,将snlp76.7
‑
4饲养细胞用作饲养细胞,将人类ips细胞接种在这些用经丝裂霉素c处理后的细胞上,并用含有4ng/ml人类碱性fgf(reprocell)灵长类es培养基(es培养基:reprocell)培养。每天更换培养基。
[0263]
3.3.在无饲养细胞的环境下的人类ips细胞培养
[0264]
将在饲养细胞上维持并培养的人类ips细胞集落收集在通过向stemfit(商标)ak02n培养基(es培养基:ajinomoto co.,inc.)补充10μm y
‑
27632(wako pure chemical)获得的培养液体中,并以8.0
×
104细胞/培养皿的浓度接种在涂覆有层粘连蛋白;imatrix
‑
511silk(nippi)的10cm细胞培养板上。第二天,将培养基更换为es培养基,以维持并培养细胞。由此进行无饲养细胞培养。每两天更换一次培养基。
[0265]
3.4.采用微空间形低附着板产生人类ips细胞的成骨细胞构建体
[0266]
图24显示了在该实验中,从人类ips细胞产生成骨细胞构建体的方法。
[0267]
3.4.1.胚状体形成的诱导
[0268]
作为培养容器,使用24
‑
孔微空间形低附着板elplasia(商标)(corning,cat#4441:具有直径为500μm和深度为400μm的微孔尺寸,和具有554至580个凹陷/孔)。
[0269]
根据实验2的方法,采用es培养基(reprocell),将在饲养细胞上培养的人类ips细胞制备成细胞悬浮液(悬浮液中ips细胞的数量:6.25
×
105细胞/ml),并将2ml的该悬浮液添加至每孔中,从而elplasia(商标)板的每个孔中接种的细胞的数量为12.5
×
105个细胞(采用饲养细胞的组:条件0)。
[0270]
通过采用trypleselect(thermo fisher scientific)处理将在无饲养细胞环境下培养的人类ips细胞集落解离成单个细胞,并用es培养基(stemfit培养基)将其细胞悬浮液调整为以下三个条件。
[0271]
条件1
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
6.25
×
105细胞/ml
[0272]
条件2
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
3.125
×
105细胞/ml
[0273]
条件3
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1.563
×
105细胞/ml
[0274]
将在饲养细胞上培养的细胞悬液(条件0)和在无饲养细胞环境下调整的条件1至3的细胞悬液以2ml的量加入上述培养板的每孔中,每孔细胞数设置如下。
[0275][0276]
通过使用条件0的es培养基(reprocell)和条件1至3的各自的es培养基(stemfit培养基)培养1天来诱导胚状体的形成。
[0277]
3.4.2.向中胚层细胞分化的诱导
[0278]
胚状体培养1天后,对于每个条件,以与实验2相同的方式,将培养基更换为中胚层分化诱导培养基[含有2%b
‑
27补充剂(thermo fisher scientific)、1%n
‑
2补充剂(thermo fisher scientific)、30μm chir99021(wako pure chemical industries)和5μm
环巴胺(enzo life science)的dmem/f12(thermo fisher scientific)与neurobasal培养基(thermo fisher scientific)的1:1混合培养基],然后培养5天。每两天更换一半的培养基。
[0279]
3.4.3.向成骨细胞分化的诱导
[0280]
中胚层分化诱导5天后,将如下条件a至d中所示孔数中包含的细胞构建体自每种条件下的elplasia(商标)板中取出并转移至低附着瓶(greiner bio
‑
one,生长面积:25cm2)中。
[0281][0282]
对于在饲养细胞上培养的组(条件0),将对应于8个elplasia(商标)板的孔的细胞转移至1个瓶中(条件0+条件a)。
[0283]
将每个瓶中的培养基更换为10ml成骨细胞分化诱导培养基[含有15%fbs(gibco/life technologies)、0.1μm地塞米松(sigma
‑
aldrich,st.louis,mo,usa)、10mmβ
‑
甘油磷酸酯(sigma
‑
aldrich)和50μg/ml抗坏血酸
‑2‑
磷酸(sigma
‑
aldrich)、1%抗生素
‑
抗真菌剂(100单位/ml青霉素、100μg/ml链霉素和250ng/ml两性霉素b的α
‑
mem培养基(nacalai tesque)],并在跷跷板型生物反应器(10
°
倾角,周期:0.33hz,台子宽度:32cm,振幅:5.5cm)(bc
‑
700:bio craft)上采用振荡进行培养达30天。
[0284]
每3天更换一半培养基。将在成骨细胞分化诱导培养基中开始培养的时间点定义为“成骨细胞分化诱导的第0天”。
[0285]
3.5.向成骨细胞分化的诱导的评估
[0286]
在成骨细胞分化诱导30天后,计算每个条件组的细胞构建体的数量,并使用imagej图像分析软件((商标)nih)计算它们的大小(feret’s直径)。
[0287]
此外,通过sybr green实时rt
‑
pcr法(thunderbird(商标)sybr(商标)qpcr mix,toyobo)分析了成骨细胞分化诱导30天后各组细胞构建体中成骨细胞特异性标记基因(runx2和骨钙素)的表达。gapdh用作内部对照。所用引物与实验2中的那些相同。
[0288]
成骨细胞分化诱导30天后,取各组细胞构建体切片,he染色,或von kossa和亚甲蓝双染色以进行组织化学观察。
[0289]
3.6.诱导培养基中视黄酸的补充对成骨细胞构建体形成的影响
[0290]
在无饲养细胞环境中使用人类ips细胞的实验系统中,在上述3.4.1中诱导胚状体形成时使用的es培养基(stemfit培养基)中补充了10μm y
‑
27632。此外,在上述3.4.2的中胚层分化诱导培养基和3.4.3的成骨细胞分化诱导培养基中补充了1μm视黄酸(wako pure chemical),在条件2和条件b下诱导形成了成骨细胞构建体,在向成骨细胞分化诱导30天后,通过通过he染色和von kossa和亚甲蓝的双染色评价细胞构建体的矿化和成熟度。
[0291]
《结果》
[0292]
3.7.ips细胞的无饲养细胞培养和接种细胞的数量对成骨细胞构建体形成数量的影响
[0293]
成骨细胞分化诱导30天后,在饲养细胞培养组(条件0+条件a)中,每个瓶形成的细
胞构建体的数量为56。另一方面,在无饲养细胞培养中,每个瓶形成的细胞构建体的数量如下:当接种细胞数量为12.5
×
105细胞/孔(条件1)时,8孔/1瓶组(条件1+条件a)中为100个构建体,和4孔/1瓶组(条件1+条件b)中为93个构建体;当接种细胞数量为6.25
×
105细胞/孔(条件2)时,8孔/1瓶组(条件2+条件a)中为139个构建体,和4孔/1瓶组(条件2+条件b)中为103个构建体;和当接种细胞数量为3.125
×
105细胞/孔(条件3)时,8孔/1瓶组(条件3+条件a)中为103个构建体,4孔/1瓶组(条件3+条件b)中为112个构建体,和2孔/1瓶组(条件3+条件c)中为126个构建体。由此,在这些条件下的无饲养细胞培养组中,虽然在胚状体形成步骤和成骨细胞分化诱导步骤中使用的细胞数与饲养细胞培养组(条件0+条件a)中的数量相同或更小,但是形成的成骨细胞构建体的数量显著增加(图25)。
[0294]
3.8.ips细胞的无饲养细胞培养和接种细胞的数量对成骨细胞构建体的尺寸的影响
[0295]
成骨细胞分化诱导30天后,饲养细胞培养组中细胞构建体的feret’s直径往往大于无饲养细胞培养组中的feret’s直径。同时,在无饲养细胞培养组中,接种细胞数量为6.25
×
105细胞/孔(条件2)的组以及接种细胞数量为3.125
×
105细胞/孔(条件3)的组具有更小的尺寸变化,并由此比饲养细胞培养组更加均一(图26)。
[0296]
3.9.ips细胞的无饲养细胞培养和接种细胞的数量对细胞构建体的成骨细胞分化的影响
[0297]
成骨细胞分化诱导30天后,与饲养细胞培养组(条件0+条件a)的细胞构建体相比,无饲养细胞培养组的细胞构建体中成骨细胞特异性标记基因(runx2和骨钙素)的表达更高。特别地,在胚状体形成步骤中,在的接种细胞(无饲养细胞环境下培养的ips细胞)的数量为6.25
×
105细胞/孔(条件2)和3.125
×
105细胞/孔(条件3)的组中,发现在所有条件a至d下,在成骨细胞分化诱导步骤中这些基因的表达显著增加(图27)。
[0298]
3.10.ips细胞的无饲养细胞培养和接种细胞的数量对成骨细胞构建体的矿化的影响
[0299]
成骨细胞分化诱导30天后,与饲养细胞培养组(条件0+条件a)的细胞构建体相比,具有接种细胞数量为6.25
×
105细胞/孔(条件2)的无饲养细胞培养,即8孔/1瓶组(条件2+条件a)和4孔/1瓶组(条件2+条件b),具有接种细胞数量为3.125
×
105细胞/孔(条件3)的无饲养细胞培养,即8孔/1瓶组(条件3+条件a)、4孔/1瓶组(条件3+条件b)和2孔/1瓶组(条件3+条件c)的细胞构建体内部具有明显更大的矿化范围,并且作为成骨细胞构建体显示出更成熟的图像(图28)。
[0300]
3.11.诱导培养基中补充视黄酸对ips细胞成骨细胞构建体形成的影响
[0301]
在无饲养细胞环境下使用ips细胞生成成骨细胞构建体中,当胚状体培养中的es培养基补充有10μm y
‑
27632,中胚层分化诱导培养基和成骨细胞分化诱导培养基补充有1μm视黄酸时,在成骨细胞诱导30天后,在细胞构建体的内层和外层发现明显矿化,并且获得比未补充的情况下更成熟和均匀的骨样组织(图29)。
[0302]
3.12.结论
[0303]
通过在人类ips细胞增殖阶段使用无饲养细胞培养代替饲养细胞培养,可以从少量细胞有效地产生成骨细胞。特别地,在胚状体形成过程中,每孔接种6.25
×
105个在无饲养细胞环境中培养的人类ips细胞,并进一步地通过将含有对应于8或4个孔的中胚层细胞
的培养液转移至1个瓶中进行成骨细胞分化诱导步骤,并且在胚状体形成过程中,每孔接种3.125
×
105个在无饲养细胞环境中培养的人类ips细胞,并进一步地通过将含有对应于8、4或2个孔的中胚层细胞的培养液转移至1个瓶中进行成骨细胞分化诱导步骤,不仅可以获得大量的成骨细胞构建体,而且还可以获得更成熟的成骨细胞构建体。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1