用于治疗癌症的多克隆抗体和抗PD1或抗PDL1抗体的联合的制作方法
用于治疗癌症的多克隆抗体和抗pd1或抗pdl1抗体的联合
技术领域
1.本发明涉及免疫学领域,并且更特别地涉及多克隆抗体与单克隆抗pd1和/或抗pdl1抗体的联合,以及它们在人类医学中的用途。
2.特别地,本发明涉及多克隆非人哺乳动物抗体与单克隆抗pd1和/或抗pdl1抗体的联合在治疗癌症中的用途。
背景技术:
3.癌症是世界第二大死因,并且2018年估计有960万人死于癌症。在全球范围内,全世界约有六分之一的死亡由癌症引起。在该领域,无法获得积极治疗或不充分的积极治疗很常见。因此,公认需要开发新的和改进的治疗癌症的疗法。
4.免疫疗法代表治疗大量癌症的真正希望,特别是治疗目前无法通过常规疗法有效治愈的癌症。这种治疗主要在于施用针对肿瘤细胞或针对抗癌症免疫应答检查点的激活剂或抑制剂的单克隆抗体。
5.针对肿瘤(被动免疫疗法)的抗体可以通过两种互补方式发挥作用:
6.‑
通过细胞毒性补体依赖性(cdc)或杀伤细胞依赖性(adcc)或吞噬细胞依赖性(adcp)。
7.‑
通过诱导适应性免疫应答。确实已经证明,靶标的调理素作用和补体分子(c3a、c5a)的局部产生(参见strainic et al.,immunity,2008mar;28(3):425
‑
35)激活t淋巴细胞共刺激并增加其存活。因此,作为第一步,被动施用抗肿瘤抗体可以从补体中释放因子,并且在第二步,缓解t细胞应答。
8.但是,40%
‑
85%的患者对基于使用单克隆抗体的治疗耐药。逃逸机制包括免疫选择机制,即肿瘤细胞失去通过免疫系统识别的抗原的能力和免疫颠覆机制(诱导特异性耐药性)。在基于使用单克隆抗体的治疗中(其对独特表位具有特异性),免疫原性较低的肿瘤变体的出现可能特别有害。
9.因此,基于使用靶向肿瘤细胞上不同表位的多克隆抗体的治疗可能允许将逃逸机制最小化。
10.但是,尽管具有潜在的功效,但特别由于患者的高毒性风险,多克隆抗体很少用于治疗肿瘤。这种毒性主要基于以下事实:许多细胞表面抗原在生物体中的许多不同细胞类型上表达,这可导致与非癌细胞的主要交叉反应性。毒性还与neu5gc和α
‑
1,3
‑
半乳糖碳水化合物在动物免疫球蛋白上的表达有关,其在人中引发与过敏、血清病和免疫复合物的形成相关的有效抗neu5gc和抗α
‑
1,3
‑
半乳糖免疫应答。此外,这些交叉反应性还与另一个问题(即它“稀释”了生物体中的有效抗体的)有关,即大量施用的多克隆抗体群结合在与实际癌症靶标不同的位点中。靶向肿瘤中有效抗体的这种损失需要在患者体内施用更大量的多克隆抗体,这当然会导致相关毒性作用的加重。
11.因此,本领域仍然需要提供用于治疗癌症并且具有减少的副作用或没有副作用的有效且改进的疗法。
12.许多肿瘤对基于使用单克隆抗体的治疗的耐药性也可能来自“冷肿瘤”的存在(bonaventura et al.,2019;front.immunol.;10;168),即,由于各种原因,包含较少浸润性免疫细胞,特别是浸润性t细胞,因此不会引起免疫系统的强烈应答的肿瘤,使它们很难用免疫疗法治疗。事实上,在这种肿瘤中,对治疗性抗体(如治疗肿瘤)中常用的靶向免疫检查点的治疗性单克隆抗体的应答率仍然相对较低并且因此无效。
13.因此,本领域仍然需要提供允许治疗冷肿瘤的有效治疗。
14.本领域还需要提供将冷肿瘤转变为“热肿瘤”,即包含足够水平或甚至高水平的如上所解释的浸润性t细胞的肿瘤的手段。
15.本领域特别需要提供通过改进(即增加这些肿瘤被免疫细胞,和特别是t细胞和骨髓细胞,更特别是t细胞浸润的能力)来降低“冷”肿瘤对靶向免疫检查点的单克隆抗体的耐药性的手段。
16.发明概述
17.根据其第一方面,本发明涉及:
18.‑
针对癌细胞的非人哺乳动物多克隆抗体;与
19.‑
至少一种选自下组的单克隆抗体的联合:抗pdl和抗pdll单克隆抗体,其用于预防和/或治疗哺乳动物患者的癌症。
20.根据本发明的联合的非人哺乳动物多克隆抗体针对对应于或甚至属于哺乳动物患者中待预防或待治疗的癌症的癌细胞。
21.本发明人首次表明,针对癌症,特别是针对肝癌的多克隆抗体与单克隆抗pdl1抗体的联合体内施用提供了针对靶向肿瘤的出乎意料的高效率。特别地,本发明人观察到这些活性物质对肿瘤治疗的协同作用。
22.此外,治疗几周后,存活的动物通过组织病理学评估或毒性没有可见疾病的证据(未检测到自身免疫,即无痛苦、无体重减轻、无动物变色、无脱毛或腹泻)。
23.因此,发明人设法确定了一种新的、有效的、改进的和无毒的治疗癌症的疗法。
24.在一个具体实施方案中,根据本发明的联合的多克隆抗体不含:
25.‑
第一抗原决定簇,其选自(i)n
‑
乙二醇神经氨酸(neu5gc)和(ii)α
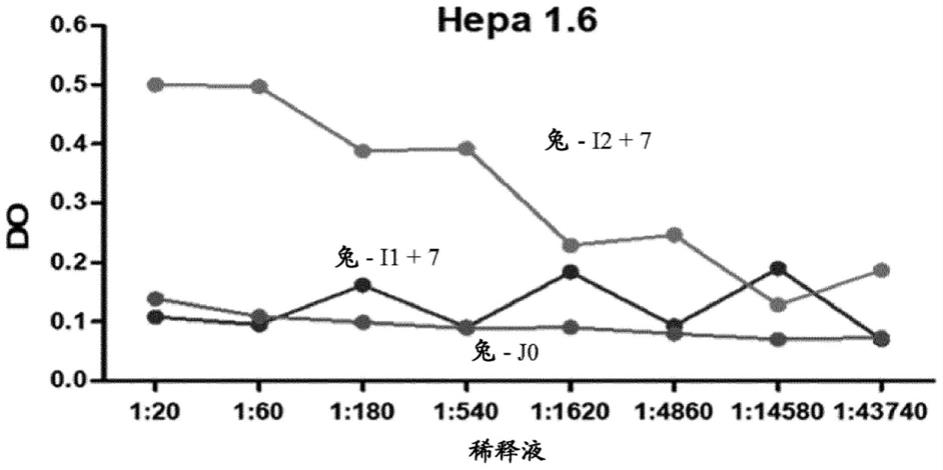
‑
1,3
‑
半乳糖;和
26.‑
第二抗原决定簇,其不同于第一抗原决定簇并且选自下组:(i)n
‑
乙二醇神经氨酸(neu5gc)和(ii)α
‑
1,3
‑
半乳糖。
27.更特别地,多克隆抗体可以不含两个抗原决定簇(i)n
‑
乙二醇神经氨酸(neu5gc)和(ii)α
‑
1,3
‑
半乳糖。
28.在具体实施方案中,多克隆抗体是免疫球蛋白g(igg)。
29.在进一步的实施方案中,根据本发明的联合的单克隆抗体是抗pdl1抗体。
30.在另一个实施方案中,非人哺乳动物选自下组:啮齿动物,例如小鼠、大鼠、豚鼠和仓鼠;兔类动物,例如兔子;雪貂;猫科动物,例如猫;犬科动物,例如狗;山羊;绵羊;牛科动物,例如奶牛;猪(swine),例如小猪(pig)和阉猪(hog);骆驼科动物;马和灵长类动物。
31.特别地,所述非人哺乳动物可以选自下组:啮齿动物,例如小鼠、大鼠、豚鼠和仓鼠以及兔类动物,例如兔子。
32.更特别地,所述非人哺乳动物可选自下组:兔类动物、山羊、绵羊、小猪、马和牛科
动物。
33.在具体实施方案中,哺乳动物患者选自下组:啮齿动物,例如小鼠、大鼠、豚鼠和仓鼠;兔类动物,例如兔子;雪貂;猫科动物,例如猫;犬科动物,例如狗;山羊;绵羊;牛科动物,例如奶牛;猪,例如小猪和阉猪;骆驼科动物;马;灵长类动物和人。
34.特别地,所述哺乳动物患者可以选自下组:啮齿动物,例如小鼠、大鼠、豚鼠和仓鼠。
35.特别地,所述哺乳动物患者可以是人。
36.在具体实施方案中,所述哺乳动物患者可以选自下组:啮齿动物,例如小鼠、大鼠、豚鼠和仓鼠;和人。
37.在另一个实施方案中,癌细胞选自下组:膀胱癌、乳腺癌、结肠直肠癌、肾癌、肺癌、淋巴瘤、白血病、骨髓瘤、黑色素瘤、口腔或口咽癌、胰腺癌、前列腺癌、甲状腺癌、子宫癌、腺样囊性癌、肾上腺肿瘤、淀粉样变性、肛门癌、阑尾癌、胆管癌、骨癌、脑癌、中枢神经系统肿瘤、宫颈癌、食道癌、眼癌、眼睑癌、胃肠癌、hiv/aids相关癌症、泪腺癌、喉癌或下咽癌、白血病、肝癌、脑膜瘤、鼻咽癌、卵巢癌、输卵管癌、腹膜癌、甲状旁腺癌、阴茎癌、唾液腺癌、肉瘤、非黑色素瘤皮肤癌、小肠癌、胃癌、睾丸癌、胸腺瘤和胸腺癌、阴道癌和外阴癌。
38.特别地,癌细胞来自肝癌。
39.在具体实施方案中,以相同组合物或单独组合物,优选单独组合物向哺乳动物患者施用非人哺乳动物多克隆抗体和至少一种单克隆抗pd1或抗pdl1抗体。
40.在另一个实施方案中,根据本发明的联合进一步包含至少一种与以下不同的额外的抗癌药物:
41.‑
所述非人哺乳动物多克隆抗体;和
42.‑
单克隆抗pd1或抗pdl1抗体。
43.特别地,至少一种额外的抗癌药物可以是不同于单克隆抗pd1或抗pdl1抗体的单克隆抗体。
44.特别地,至少一种额外的抗癌药物可以是选自下组的单克隆抗体:抗cd137、抗ctla4、抗tim
‑
3、抗b7
‑
h3、抗cd134、抗cd154、抗
‑
lag
‑
3、抗cd227、抗btna3、抗cd39、抗cd73、抗cd115、抗sirpα、抗sirpγ、抗cd28、抗ncr、抗nkp46、抗nkp30、抗nkp44、抗nkg2d和抗dnam
‑
1单克隆抗体。
45.本发明的另一个目的涉及以下的联合:
46.‑
针对癌细胞的非人哺乳动物多克隆抗体;与
47.‑
至少一种选自下组的单克隆抗体:抗pd1和抗pdl1单克隆抗体。
附图说明
48.图1:表示说明通过elisa测定的抗血清滴度的图。血清来源于用hepa 1.6细胞系(肝细胞癌)的鼠肿瘤细胞免疫的兔,并连续稀释并与纯化的hepa 1.6细胞反应。
49.在第一次皮下注射(rabbit
–
i1+7)后7天和第二次皮下注射(rabbit
–
i2+7)后7天,在预先免疫的兔(rabbit
–
j0)中收集血清。
50.纵坐标:光密度(do 450nm)
51.横坐标:收集的血清的系列稀释液。从左到右:1:20;1:60;1:180;1:540;1:1620;
1:4860;1:14580;1:43740。
52.图2:表示在8周龄c57/bl6j免疫活性小鼠中从门动脉中注射2.5.106个hepa 1.6细胞的第一天到随后的30天期间测量的临床评分。在注射hepa 1.6细胞后4天(d4)施用不同的处理。
53.临床评分1对应于动物出现刚毛和轻微肿胀的腹部。临床评分2对应于动物出现腹部肿胀和面部水肿。临床评分3对应于动物出现腹部肿胀和眼球突出。临床评分4分对应于动物出现腹部高度肿胀(直径>9厘米)、虚脱、驼背、孤立(导致个体处死)。
54.形成四个不同的治疗组。
55.第一组(组1;n=7;对照),接受:对照同种型(3g8:无关单克隆抗体(mab)
‑
同种型igg1)(8mg/kg,每周2次,28天)+兔的免疫前多克隆抗体(20mg/kg,每周2次,28天)。
56.第二组(组2;n=8;对比),接受:对照同种型(3g8:无关单克隆抗体(mab)
‑
同种型igg1;8mg/kg,每周2次,28天)+从免疫兔血清中分离的多克隆抗hepa 1.6细胞抗体(20mg/kg,每周2次,28天)。
57.第三组(组3;n=8),接受:单克隆抗pdl
‑
1抗体(8mg/kg,每周2次,28天)+从免疫兔血清中分离的多克隆抗hepa 1.6细胞抗体(20mg/kg,每周2次,28天)。
58.第四组(组4;n=7;对比),接受:单克隆抗pdl
‑
1抗体(8mg/kg每周2次,28天)+兔的免疫前多克隆抗体(20mg/kg,每周2次,28天)。
59.图中显示了获得的平均临床值。
60.纵坐标:临床评分
61.横坐标:天。
62.图3:表示8周龄c57/bl6j免疫活性小鼠从其处理第一天起的存活百分比,所述处理在门动脉中注射2.5.106个hepa 1.6细胞后4天以及随后的50天期间发生。
63.所表示的组1、组2、组3和组4与图2中定义的组相同。
64.纵坐标:存活百分比
65.横坐标:天。
66.图4:代表通过将cd3+t细胞(第一线)或ly6g+骨髓细胞(第二线)显示到肿瘤活检中获得的免疫组织学结果,所述肿瘤通过将b16f10黑色素瘤细胞皮下植入balb/c小鼠获得。涉及两组:
67.‑
组1(对照pab;n=7),接受:兔的免疫前多克隆抗体(20mg/kg,每周2次,28天)。
68.‑
组2(抗b16 pab;n=8),接受:从用小鼠b16f10黑色素瘤细胞免疫的兔获得的抗肿瘤多克隆抗体的igg部分,从第4天(d4)至第30天(d30)每两周输注一次(12.5mg/kg,每周两次)。
69.发明详述
70.1.定义
71.为了更完整地理解本发明,列出以下若干定义。这种定义意欲涵盖语法上的等同。
72.术语“抗体”以其最广的含义在本文使用。“抗体”是指至少包含以下的任何多肽:(i)fc区和(ii)衍生自免疫球蛋白可变区的结合多肽结构域。因此,抗体包括但不限于:全长免疫球蛋白、抗体、抗体缀合物以及分别各自的片段。术语“抗体”和“免疫球蛋白”在本文可交替使用。
73.术语“抗体”涵盖上述多肽,其可包含或不含选自下组的抗原决定簇:(i)n
‑
乙二醇神经氨酸(neu5gc)和/或(ii)α
‑
1,3
‑
半乳糖,特别是可以包含或不含两种抗原决定簇(i)n
‑
乙二醇神经氨酸(neu5gc)和(ii)α
‑
1,3
‑
半乳糖。
74.如本文所用,“多克隆抗体”是指识别给定抗原和/或细胞的不同表位的抗体混合物。多克隆抗体涵盖包含于或衍生自哺乳动物生物体,特别是非人哺乳动物生物体的体液,尤其是血清或血浆的那些。
75.在人免疫球蛋白的情况下,轻链分为κ和λ轻链。重连分为μ、δ、γ、α或ε,并将抗体的同种型分别定义为igm、igd、igg、iga和ige。
76.如本文所用,“igg”是指属于基本上由公认的免疫球蛋白γ基因编码的抗体类的多肽。在人中,igg包含亚类或同种型igg1、igg2、igg3和igg4。在小鼠中,igg包含igg1、igg2a、igg2b、igg3。全长igg由两对相同的两条免疫球蛋白链组成,每对具有一条轻链和一条重链,每条轻链包含免疫球蛋白结构域vl和cl,且每条重链包含免疫球蛋白结构域vh、cγ1(也称为ch1)、cγ2(也称为ch2)和cγ3(也称为ch3)。
77.根据本发明的“生理学上可接受的介质”是指对所治疗的哺乳动物患者是生理学上可接受的,同时保留与其一起施用的化合物的治疗特性的载体或赋形剂。一种示例性的药学上可接受的介质是生理盐水。在本发明的情况下,其他生理学上可接受的介质是本领域技术人员已知的。
78.如本文所用,“抗体依赖性细胞介导的毒性”(或adcc)是指细胞介导的免疫机制,其中免疫系统的效应子细胞积极裂解已经被特异性抗体结合的靶细胞。adcc大多数由nk细胞介导,但也由其他免疫细胞(例如嗜中性粒细胞和嗜酸性粒细胞)介导。典型地,adcc由nk细胞的活化导致。nk细胞的活化涉及其fc受体与结合至靶细胞表面上存在的抗原的igg的fc区的结合。这种相互作用诱导通过nk细胞释放细胞因子和细胞毒性颗粒。为评估抗体诱导adcc的能力,可以进行如de romeuf等.br j haematol.2008mar;140(6):635
‑
43所述的试验。
79.如本文所用,对非人哺乳动物多克隆抗体适用的“抗原决定簇”(或表位)是指抗原分子的结构成分,其包括抗原蛋白和抗原碳水化合物,负责其与由相同或相关抗原引发的抗体分子的特异性相互作用。广义上,在本文对非人哺乳动物多克隆抗体适用的“抗原决定簇”还用于统称包含多个容易被由相同或相关抗原引起的抗体分子识别的表位的抗原分子。说明性地,抗原分子n
‑
乙二醇神经氨酸(neu5gc)在本文可以称为“抗原决定簇”,尽管所述抗原分子可包含超过一个由neu5gc或含有neu5gc的分子所引起的抗体所识别的表位。
80.在血液中,“血清”是衍生自血浆的成分,其中除去了细胞(白血细胞和红血细胞)和凝血因子。血清包括不用于血液凝集(凝结)的所有蛋白和所有电解质、抗体、抗原、激素和任何最终也是外源性的物质(例如药物和微生物)。
81.术语“恶性细胞”、“癌细胞”和“肿瘤细胞”在本文中可互换使用。如本文所用,“肿瘤细胞”是指在体内自主过度增殖的细胞。肿瘤细胞的实例包括(1)肉瘤,如骨肉瘤和软组织肉瘤,(2)癌,如乳腺癌、肺癌、膀胱癌、甲状腺癌、前列腺癌、结肠癌、结直肠癌、胰腺癌、胃癌、肝癌、子宫癌、宫颈癌和卵巢癌,(3)淋巴瘤,如霍奇金淋巴瘤和非
‑
霍奇金淋巴瘤,(4)神经母细胞瘤,(5)黑色素瘤,(6)骨髓瘤,(7)维尔姆斯瘤,(8)白血病,如急性髓细胞白血病(aml)、慢性髓细胞白血病(cml)、急性淋巴细胞白血病(all)和慢性淋巴细胞白血病(cll),
(9)胶质瘤和(10)视网膜母细胞瘤。
82.如本文所用,术语“癌症”是指细胞不受控制的异常生长,并且在其范围内包括由细胞不受控制和异常生长引起的所有众所周知的疾病。常见癌症的非限制性实例包括膀胱癌、乳腺癌、卵巢癌和胃癌、宫颈癌、结肠癌、子宫内膜癌、头颈癌、肺癌、黑色素瘤、多发性骨髓瘤、白血病(例如髓细胞、淋巴细胞、髓细胞和淋巴细胞白血病)、非霍奇金淋巴瘤、前列腺癌、直肠癌、恶性黑色素瘤,特别是胰腺癌。
83.特别地,本发明癌细胞可以是选自下组的癌症中包括的细胞:膀胱癌、乳腺癌、结肠直肠癌、肾癌、肺癌、淋巴瘤、黑色素瘤、口腔或口咽癌、胰腺癌、前列腺癌、甲状腺癌、子宫癌、腺样囊性癌、肾上腺肿瘤、淀粉样变性、肛门癌、阑尾癌、胆管癌、骨癌、脑癌、中枢神经系统肿瘤、宫颈癌、食道癌、眼癌、眼睑癌、胃肠癌、hiv/aids相关癌症、泪腺癌、喉癌或下咽癌、白血病、肝癌、脑膜瘤、鼻咽癌、卵巢癌、输卵管癌、腹膜癌、甲状旁腺癌、阴茎癌、唾液腺癌、肉瘤、非黑色素瘤皮肤癌、小肠癌、胃癌、睾丸癌、胸腺瘤和胸腺癌、阴道癌和外阴癌。
84.在一个具体实施方案中,本发明的癌症或肿瘤是冷肿瘤。“冷肿瘤”是常用于指定“非炎症”肿瘤的术语,即以缺乏t细胞浸润为特征的肿瘤。它们是众所周知的具有挑战性的肿瘤,因为没有建立或维持适应性免疫响应。它们与作为浸润的t细胞数量足以触发对它们的适应性响应的肿瘤的“热肿瘤”或“炎症肿瘤”相反。
85.特别地,冷肿瘤选自下组:膀胱癌、乳腺癌、结肠直肠癌、肾癌、肺癌、淋巴瘤、黑色素瘤、口腔或口咽癌、胰腺癌、前列腺癌、甲状腺癌、子宫癌、腺样囊性癌、肾上腺肿瘤、淀粉样变性、肛门癌、阑尾癌、胆管癌、骨癌、脑癌、中枢神经系统肿瘤、宫颈癌、食道癌、眼癌、眼睑癌、胃肠癌、hiv/aids相关癌症、泪腺癌、喉癌或下咽癌、白血病、肝癌、脑膜瘤、鼻咽癌、卵巢癌、输卵管癌、腹膜癌、甲状旁腺癌、阴茎癌、唾液腺癌、肉瘤、非黑色素瘤皮肤癌、小肠癌、胃癌、睾丸癌、胸腺瘤和胸腺癌、阴道癌和外阴癌。
86.2.根据本发明的联合
87.考虑到响应上述目的,特别是为了提供一种新的抗癌治疗,其提高的效率与所治疗的生物体中的任何可观察到的毒性无关,本发明人构思了以下的联合:
88.‑
针对癌细胞的非人哺乳动物多克隆抗体;与
89.‑
至少一种选自下组的单克隆抗体:抗pdl和抗pdll单克隆抗体。
90.根据本发明的抗pd1单克隆抗体可以例如选自下组:纳武单抗、派姆单抗和西米普利单抗。
91.根据本发明的抗pdl1单克隆抗体可以例如选自下组:阿特珠单抗、阿维单抗和度伐利尤单抗。
92.在优选实施方案中,根据本发明的联合的单克隆抗体是抗pdl1抗体。
93.根据本发明的联合进一步包括针对癌细胞的非人哺乳动物多克隆抗体。
94.多克隆抗体针对相同的癌细胞,即它们都针对相同癌细胞表面存在的不同或相同抗原的不同表位。
95.可以使用包括以下步骤的方法获得根据本发明的多克隆抗体:
96.a)用目标癌细胞免疫接种非人哺乳动物;和
97.b)收集在步骤a)的所述非人哺乳动物的体液中含有的抗体。
98.使非人哺乳动物针对目标癌细胞免疫的步骤在于将所述细胞注入非人哺乳动物
appl.immunol.,1978,vol.57:477
‑
480;aggarwal s.等,nat biotechnol.2008;26:1227
–
1233;arnold jn等,annu rev immunol.2007;25:21
–
50;durocher y等,curr opin biotechnol.2009;20:700
–
707;higgins e等,glycoconj.j.2009)。
116.本领域还已知,酶α
‑
1,3
‑
半乳糖基转移酶(α1,3gt或ggta1)合成α
‑
1,3
‑
半乳糖(α1,3gal)表位(galα1、3galβ1、4glcnac
‑
r),其是引起猪至人的异种移植中超急性排斥反应的主要异种抗原。
117.根据这些实施方案,可以使用包括以下步骤的方法获得根据本发明的多克隆抗体:
118.a)提供缺少选自下组的第一基因的遗传改变的非人哺乳动物:(i)编码功能性胞苷
‑
5'
‑
单磷酸n
‑
乙酰神经氨酸水解酶(cmah)的基因;和(ii)编码功能性α
‑
1,3
‑
半乳糖基转移酶的基因;
119.b)使所述遗传改变的非人哺乳动物针对人细胞进行免疫;和
120.c)收集在步骤b)的所述遗传改变的非人哺乳动物的体液中含有的抗体。
121.优选地,所述遗传改变的非人哺乳动物是cmah和/或ggta1敲除非人转基因哺乳动物(或cmah和/或ggta1 ko非人哺乳动物),其包括cmah和ggta1双敲除非人转基因哺乳动物。
122.如本文所用,“敲除非人转基因哺乳动物”是指其中一个或多个目标基因的等位基因已经例如通过同源重组或其他插入或缺失改变的非人转基因哺乳动物。
123.在一些实施方案中,该基因被破坏。“破坏基因”是指一部分基因编码被改变,从而影响该段基因编码的转录和/或翻译,例如通过敲除技术或为通过期望蛋白插入额外的基因或插入调控已有序列转录的调控序列而使得那段编码不可读。
124.在一些实施方案中,非人转基因哺乳动物的所有细胞包括破坏基因。
125.在某些实施方案中,敲除非人转基因哺乳动物是其中一个或多个目标基因的等位基因已经失去功能的非人转基因哺乳动物。
126.在一些实施方案中,目标基因的两个等位基因失去功能。这种实施方案包括通常称为“基因敲除”、“基因敲入”和使得天然目标基因失去功能的对该基因的一个或多个天然等位基因进行的任何其他修饰。这种非人转基因哺乳动物可用作生产根据本发明的多克隆抗体的来源。
127.用于获得缺少选自下组的基因的遗传改变的非人哺乳动物的方法是本领域技术人员的公知常识:(i)编码功能性胞苷
‑
5'
‑
单磷酸n
‑
乙酰神经氨酸水解酶的基因;和/或(ii)编码功能性α
‑
(1,3)
‑
半乳糖基转移酶的基因。
128.用于获得cmah敲除非人转基因哺乳动物的方法尤其描述于wo2006/133356中,其更特别地公开了生产用于人类使用的不含5
‑
乙二醇神经氨酸(neu5gc)的动物产品,包括以下步骤:制备缺少功能性胞苷
‑
5'
‑
单磷酸n
‑
乙酰神经氨酸水解酶(cmah)基因的遗传改变的非人哺乳动物;和从所述遗传改变的非人哺乳动物提取至少一种动物产品。
129.用于获得gal敲除非人转基因哺乳动物的方法是本领域技术人员的公知常识(cooper dk等,genetically engineered pigs,lancet 1993,342:682;lai l等,science 2002,295:1089;sachs dh等,current opinion in organ transplantation,2009,14:148
–
153)。
130.用于获得gal敲除非人转基因哺乳动物的方法特别描述于us7,547,816中。
131.如本领域已知的,通过施用包含目标癌细胞的免疫原性组合物来免疫接种非人哺乳动物,可以容易地获得针对哺乳动物细胞,特别是癌症哺乳动物细胞的抗体。
132.用于鉴定或表征根据本发明的不含选自下组的第一抗原决定簇的多克隆抗体的这些特定形式的方法是本领域技术人员的公知常识:(i)n
‑
乙二醇神经氨酸(neu5gc)和(ii)α
‑
1,3
‑
半乳糖。
133.本领域技术人员可以用于鉴定或表征根据本发明的多克隆抗体的方法包括其中使用抗neu5gc抗体和/或抗gal抗体作为检测分子的酶联免疫吸附测定(elisa)。
134.作为用于评估neu5gc抗原决定簇缺失的抗neu5gc抗体,可以提及由公司sialix,inc.销售的gc
‑
free basic kit。
135.作为用于说明α
‑
1,3
‑
半乳糖抗原决定簇缺失的抗gal抗体,可以考虑jianq
‑
qiang wang等(j.am.chem.soc.,1999,121:8181)中公开的实验方案或由公司sigma
‑
aldrich销售的名称为wh0051083m1sigma的那些。
136.特别地,根据本发明的联合可进一步包含至少一种与以下不同的额外的抗癌药物:
137.‑
所述非人哺乳动物多克隆抗体;和
138.‑
单克隆抗pd1或抗pdl1抗体。
139.特别地,至少一种额外的抗癌药物可以是不同于单克隆抗pd1或抗pdl1抗体的单克隆抗体。
140.特别地,至少一种额外的抗癌药物可以是选自下组的单克隆抗体:抗cd137、抗ctla4、抗tim
‑
3、抗b7
‑
h3、抗cd134、抗cd154、抗
‑
lag
‑
3、抗cd227、抗btna3、抗cd39、抗cd73、抗cd115、抗sirpα、抗sirpγ、抗cd28、抗ncr、抗nkp46、抗nkp30、抗nkp44、抗nkg2d和抗dnam
‑
1。
141.3.根据本发明的医疗用途
142.如上所述,根据其第一方面,本发明涉及:
143.‑
针对癌细胞的非人哺乳动物多克隆抗体;与
144.‑
至少一种选自下组的单克隆抗体的联合:抗pdl和抗pdll单克隆抗体,其用于预防和/或治疗哺乳动物患者的癌症。
145.这些多克隆和单克隆抗体在本说明书中都有描述。
146.如前所述,根据本发明的联合的非人哺乳动物多克隆抗体针对对应于或甚至属于哺乳动物患者中待预防或待治疗的癌症的癌细胞。
147.为了治疗有需要的患者,例如上文提到的,可以施用治疗有效剂量的根据本发明的联合。
148.本文中的“治疗有效剂量”是指产生施用效果的剂量。确切的剂量将取决于治疗的目的,并且本领域技术人员可以使用已知技术确定。
149.剂量范围可为0.001
‑
100mg的根据本发明的多克隆抗体/kg体重(mg/kg)或更大,例如0.1、1.0、10或50mg/kg体重。特别地,根据本发明的多克隆抗体的剂量范围可以是0.1
‑
100mg/kg,或更特别地1
‑
10mg/kg。
150.剂量也可以是0.001
‑
100mg的根据本发明的抗pd1和/或抗pdl1单克隆抗体/kg体
重(mg/kg)或更大,例如0.1、1.0、10或50mg/kg体重。特别地,根据本发明的抗pd1和/或抗pdl1单克隆抗体的剂量范围可以是0.1
‑
100mg/kg,或更特别地1
‑
10mg/kg。
151.由于更好的耐药性,可以根据宿主反应以及注射频率来调整施用的剂量和频率。
152.仅出于说明的目的,根据本发明的联合施用频率可以是连续5
‑
15天的每日施用。
153.如本领域已知的,针对蛋白质降解、全身递送与局部递送以及年龄、体重、一般健康状况、性别、饮食、施用时间、药物相互作用和病症的严重程度的调整可能是必要的,并且可以通过本领域技术人员的常规实验容易地确定。
154.本发明的联合施用可以多种方式进行,包括但不限于口服、皮下、静脉内、肠胃外、鼻内、腹腔内、眼内、直肠、阴道、透皮、局部(例如凝胶)、腹膜内、肌肉内、肺内或鞘内。
155.在具体实施方案中,根据本发明的联合是适合于通过静脉内或肠胃外途径施用的形式。
156.如上所述,本发明涉及:
157.‑
针对癌细胞的非人哺乳动物多克隆抗体;与
158.‑
至少一种选自下组的单克隆抗体的联合:抗pdl和抗pdll单克隆抗体,其用于预防和/或治疗哺乳动物患者的癌症。
159.针对癌细胞的非人哺乳动物多克隆抗体和至少一种选自抗pd1和抗pdl1单克隆抗体的单克隆抗体可以组合在一个相同的组合物中,或者可以以单独组合物的形式使用,所述单独组合物可以同时或顺次施用。
160.在一个具体实施方案中,针对癌细胞的非人哺乳动物多克隆抗体和至少一种选自下组的单克隆抗体以单独的组合物施用:抗pd1和抗pdl1单克隆抗体。
161.当针对癌细胞的非人哺乳动物多克隆抗体和至少一种选自下组的单克隆抗体以单独的组合物施用时:抗pd1和抗pdl1单克隆抗体,所述组合物可以通过相同途径或通过不同途径同时或单独向哺乳动物患者施用。
162.通过同时,应理解组合物可以在同一时刻或最多同一天或几天施用。
163.通过单独,应理解组合物可以相差至少几天,例如相差至少两天施用。
164.在一些实施方案中,根据本发明的多克隆抗体的组合物和抗pd1和/或抗pdl1单克隆抗体的组合物是液体形式。
165.在一些实施方案中,根据本发明的多克隆抗体的组合物和抗pd1和/或抗pdl1单克隆抗体的组合物是固体形式,包括冻干形式。
166.这些组合物可以根据标准方法配制,如在remington:the science and practice of pharmacy(lippincott williams&wilkins;第20版,2005)中描述的那些。
167.上述组合物包含生理学/药学上可接受的介质/赋形剂。术语“生理学上可接受的”和“药学上可接受的”在本文中可互换使用。
168.可以使用的药学上可接受的赋形剂或介质特别描述于handbook of pharmaceuticals excipients,american pharmaceutical association(pharmaceutical press;第6修订版,2009)中。
169.本发明的联合可以与其他疗法或治疗剂一起施用,包括例如小分子、其他生物制品、放疗、手术等,其不同于上述的额外的抗癌药物并且也不同于:
170.‑
所述非人哺乳动物多克隆抗体;和
171.‑
单克隆抗pd1或抗pdl1抗体。
172.根据具体实施方案,根据本发明的联合可进一步包含作为其他治疗剂的至少一种免疫抑制药物,例如糖皮质激素、细胞抑制剂(硫唑嘌呤、甲氨蝶呤)、作用于免疫亲和素的抗体或药物(环孢菌素、他克莫司、雷帕霉素)。
173.这些其他治疗剂可以与针对癌细胞的非人哺乳动物多克隆抗体或至少一种选自抗pdl和抗pdll单克隆抗体的单克隆抗体相同的组合物,或以单独的组合物向哺乳动物患者施用。
174.特别地,这些其他治疗剂以与针对癌细胞的非人哺乳动物多克隆抗体或至少一种选自下组的单克隆抗体分开的组合物施用:抗pdl和抗pdll单克隆抗体。
175.在具体实施方案中,本发明涉及:
176.‑
针对癌细胞的非人哺乳动物多克隆抗体;与
177.‑
至少一种选自下组的单克隆抗体的联合:抗pdl和抗pdll单克隆抗体,在制备用于预防和/或治疗哺乳动物患者的癌症的药物中的用途。
178.在另一个实施方案中,本发明涉及预防和/或治疗哺乳动物患者的癌症的方法,包括向所述哺乳动物患者施用:
179.‑
针对癌细胞的非人哺乳动物多克隆抗体;与
180.‑
至少一种选自下组的单克隆抗体的联合:抗pdl和抗pdll单克隆抗体。
181.本发明还涉及:
182.‑
针对癌细胞的非人哺乳动物多克隆抗体;与
183.‑
至少一种选自下组的单克隆抗体的联合:抗pdl和抗pdll单克隆抗体,其用作药物。
184.通过以下实施例进一步说明本发明。
具体实施方式
185.实施例1:通过用癌细胞系免疫兔获得的多克隆抗体的elisa对照
186.用来自鼠肿瘤细胞系hepa 1.6(肝细胞癌)的细胞免疫兔以获得相应的抗肿瘤多克隆抗体。
187.所述肿瘤细胞皮下注射两次,间隔两周。
188.在第一次皮下注射(rabbit
–
i1+7)后7天和第二次皮下注射(rabbit
–
i2+7)后7天,实际上在预先免疫的兔(rabbit
–
j0)中收集血清以测试抗体识别用于免疫兔的肿瘤细胞的能力。
189.更特别地,基于用于免疫兔的hepa 1.6细胞,使用细胞elisa测试测量经免疫兔的抗体反应。收集的血清以1:20;1:60;1:180;1:540;1:1620;1:4860;1:14580;1:43740系列稀释入0.05%pbs
‑
牛血清白蛋白中,并在室温下孵育2小时。将elisa板离心和洗涤后(注意不要吸出细胞),添加过氧化物酶标记的山羊抗兔抗体(稀释度1/1000),并且孵育1小时和再次洗涤。然后,添加50微升tmb,在黑暗中孵育15分钟。添加10微升hcl后,在450nm处读取光密度。
190.结果示于图1中。
191.注释:
192.可以看出,在第二次注射后,收集到的血清中获得的多克隆抗体有效识别目标靶向肿瘤细胞。
193.实施例2:在同源和原位小鼠模型中体内使用收集的多克隆抗体
194.hepa1.6肝细胞癌小鼠模型已在gauttier et al.,int j cancer.2014dec 15;135(12):2857
‑
67中使用和描述。
195.该模型在免疫活性c57/bl6j小鼠中是同源和原位的。
196.将重悬于pbs中的2.5.106个hepa1.6细胞注入8周龄雄性小鼠的门静脉中,如果不处理,这导致肝性高血压并导致动物在12
‑
15天内死亡。
197.4天后(d4)施用不同的治疗:
198.‑
第一组(组1;n=7;对照),接受:对照同种型(3g8:无关单克隆抗体(mab)
‑
同种型igg1)(8mg/kg,每周2次,28天)+兔的免疫前多克隆抗体(20mg/kg,每周2次,28天)。
199.‑
第二组(组2;n=8;对比),接受:对照同种型(3g8:无关单克隆抗体(mab)
‑
同种型igg1;8mg/kg,每周2次,28天)+从免疫兔血清中分离的多克隆抗hepa 1.6细胞抗体(20mg/kg,每周2次,28天)。
200.‑
第三组(组3;n=8),接受:单克隆抗pdl
‑
1抗体(8mg/kg,每周2次,28天)+从免疫兔血清中分离的多克隆抗hepa 1.6细胞抗体(20mg/kg,每周2次,28天)。
201.‑
第四组(组4;n=7;对比),接受:单克隆抗pdl
‑
1抗体(8mg/kg每周2次,28天)+兔的免疫前多克隆抗体(20mg/kg,每周2次,28天)。
202.所用的多克隆抗体对应于根据实施例1获得的igg抗体,其使用本领域技术人员熟知的方法(包括蛋白a上的亲和柱)从兔血清中纯化。
203.在这些处理之后,在肿瘤细胞注射后的30天内观察不同组的临床评分。
204.获得的结果如图2所示。
205.从0
‑
4的临床评分如下所示:
206.‑
临床评分1对应于动物出现刚毛和轻微肿胀的腹部;
207.‑
临床评分2对应于动物出现腹部肿胀和面部水肿;
208.‑
临床评分3对应于动物出现腹部肿胀和眼球突出;
209.‑
临床评分4分对应于动物出现腹部高度肿胀(直径>9厘米)、虚脱、驼背、孤立(导致个体处死)。
210.注释:
211.如所预期,在未处理的对照组1中,所有小鼠在注射细胞后的第15天死亡(如图3所示)。
212.观察到的结果对于组2和组4是相似的,对应于施用如上所述获得的纯化多克隆抗体或单克隆抗pdl1抗体。这两种单独的处理导致25天后临床评分降低至约3。
213.相反,在用本发明的组合的多克隆抗体和抗pdl1单克隆抗体处理的组3动物观察到协同作用,因为它们将0
‑
1的临床评分保持直到第30天(实验结束)。
214.令人惊讶的是,在此实验后的几天内对组3小鼠的仔细观察没有观察到任何毒性,特别是任何自身免疫体征(即无痛苦、无体重减轻、无动物变色、无脱毛或腹泻)。
215.实施例3:本发明的多克隆抗体允许将冷肿瘤转化为热肿瘤
216.用小鼠b16f10黑色素瘤细胞免疫兔以获得相应的抗肿瘤多克隆抗体。
217.众所周知,b16f10黑色素瘤细胞系是“冷”肿瘤的很好的实例,因为例如对抗pdl1抗体具有耐药性,其中此类抗体对肿瘤消退的影响非常有限(chen et al.,cancer immunol res.2014;3(2):149
‑
60;ueha et al.,2015;3(6):631
‑
40)。
218.从第4天(d4)到第30天(d30)每两周(12.5mg/kg,每周两次)将这些来自兔的针对b16f10细胞产生的多克隆抗体的igg部分输注到皮下植入b16f10黑色素瘤细胞(d0)的balb/c小鼠中(组2
–
n=8)。
219.同样皮下植入b16f10黑色素瘤细胞的动物对照组(组1
–
n=7)仅接受兔的免疫前多克隆抗体(20mg/kg,每周2次,28天)。
220.在注射细胞后30天(针对组2)或用于组1的所述注射后18天(因为来自该组的所有个体均已死亡),抽取肿瘤活检并通过免疫组织学分析。
221.显示cd3+t细胞和ly6g+骨髓细胞,如图4所示。
222.在接受针对所述肿瘤的本发明多克隆抗体的动物的肿瘤中观察到显著更高的t细胞和骨髓细胞浸润。
223.因此,可以看出,本发明的多克隆抗体诱导cd3+t细胞和骨髓免疫细胞浸润到肿瘤床中。
224.因此,它将已知的“冷”肿瘤转化为“热”肿瘤,从而使抗pd1/抗pdl1有效地发挥它们在防止肿瘤细胞使现在可以进入肿瘤的t细胞失活的作用,从而使免疫系统能够全力对抗肿瘤。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1