杀虫基因和使用方法与流程
1.本发明涉及分子生物学领域,特别是编码可用于防治害虫,特别是植物害虫的杀虫蛋白的新基因。这些蛋白以及编码它们的核酸序列可用于制备杀虫组合物以及用于生产转基因害虫抗性植物。
背景技术:
2.在世界范围内,作物受到多种威胁,例如害虫、植物病害、杂草。由于害虫和病害造成的损失极大地威胁着全球粮食供应,因此有必要开发解决方案以避免培育物部分或完全破坏。主要解决方案是化学品、生物防治或gmo。
3.目前的gmo策略使用表达毒素的基因来产生转基因作物。毒素是毒力决定因子,其在微生物致病性中发挥重要作用。这些毒素通常衍生自苏云金芽孢杆菌(bacillus thuringiensis),其为一种革兰氏阳性孢子形成土壤细菌。它们称为cry(结晶蛋白)或vip(植物杀虫蛋白)。表达杀虫蛋白毒素的转基因作物用于对抗昆虫对作物的损害。
4.农民广泛采用芽孢杆菌毒素来防治田间昆虫,导致世界许多地方的一些目标害虫对苏云金芽孢杆菌(bt)毒素产生抗性。解决该问题的一种方法是在转基因植物中堆叠具有不同作用模式的杀虫基因。为了找到具有新作用模式的新毒素,该策略在于发现来自除苏云金芽孢杆菌以外的其他来源的新毒素。这些新毒素可用作衍生自苏云金芽孢杆菌的毒素的替代物,用于部署于昆虫和害虫抗性转基因植物。因此,需要新的毒素蛋白。
技术实现要素:
5.本发明涉及一种分离的核酸序列,其编码选自由以下组成的组的蛋白质:
6.a)与seq id no:1(gdi005)具有至少70%同一性的第1组蛋白质,和
7.b)与seq id no:2(gdi006)具有至少65%同一性的第2组蛋白质。
8.因此,根据本发明,如seq id no:1所示的gdi0005蛋白和与seq id no:1具有至少70%同一性的蛋白形成第1组蛋白质。类似地,如seq id no:2所示的gdi0006蛋白和与seq id no:2具有至少65%同一性的蛋白形成第2组蛋白质。
9.如seq id no:3、5、28、29、30、31、32、33或34所示的分离的核酸序列编码优选的第1组蛋白质。如seq id no:4、6、35、36、37、38、39、40或41所示的分离的核酸序列编码优选的第2组蛋白质。
10.由上述核酸序列编码的分离的多肽也是本发明的目的。如seq id no:1、11、12、13、14、15、16或17所示的多肽是优选的第1组蛋白质。如seq id no:2、18、19、20、21、22、23或24所示的多肽是优选的第2组蛋白质。
11.本发明的一个目的是昆虫害虫(包括西方玉米根虫(diabrotica virgifera virgifera)幼虫)的二元毒素。当包含选自与seq id no:1(gdi0005a)具有至少70%同一性的第1组蛋白质和选自与seq id no:2(gdi0006a)具有至少65%同一性的第2组蛋白质的蛋白质时,本发明的二元毒素是有效的。本发明的一个目的还是本发明的二元毒素的蛋白质
组分,其选自如上所述的第1组或第2组蛋白质。
12.本发明的另一个目的是包含至少一种上述核酸序列的载体。这种载体因此包含编码本发明的二元毒素的第1组或第2组的蛋白质之一的至少一种核酸序列,或包含各自编码本发明的二元毒素的蛋白质之一的核酸两者,即编码第1组蛋白质和第2组蛋白质两者。
13.优选的载体包含两种核酸序列,其中:
[0014]-第一种如seq id no:1所示,或编码与seq id no:1具有至少70%同一性的蛋白质,或如seq id no:3、5、28、29、30、31、32、33或34所示,以及
[0015]-第二种如seq id no:2所示,或编码与seq id no:2具有至少65%同一性的蛋白质,或如seq id no:4、6、35、36、37、38、39、40或41所示。
[0016]
更优选地,该载体包含两种核酸序列,其中第一种如seq id no:3、5、28、29、30、31、32、33或34所示,第二种如seq id no:4、6、35、36、37、38、39、40或41所示。
[0017]
优选地,包含在本发明的载体中的核酸序列与启动子可操作地连接。
[0018]
另一方面,本发明涉及一种包含上述本发明载体的宿主细胞。特别地,该宿主细胞包含
[0019]
至少一种核酸序列,其编码本发明的第1组或第2组的二元毒素的蛋白质中的一种,或包含各自编码本发明的第1组和第2组的二元毒素的蛋白质中的一种的核酸序列两者。
[0020]
优选地,该宿主细胞是可以包含一种或两种如上所述的核酸序列的植物细胞。
[0021]
仍然,本发明的另一个目的是一种包含至少一种如上所述的核酸序列的转基因植物。特别地,所述转基因植物表达本发明的二元毒素的第1组或第2组蛋白质中的至少一种,或本发明的二元毒素的两种蛋白质。因此,这种转基因植物是害虫耐受性植物。
[0022]
有利地,本发明的转基因植物为玉米植物。此外,来自转基因植物,优选玉米植物的转基因种子构成本发明的另一个目的。
[0023]
本发明的另一个目的是一种生产害虫耐受性转基因植物的方法,其中所述方法包含用如上所述的本发明的载体转化植物细胞,选择包含本发明的核酸序列的转化的植物细胞,以及从所述转化的植物细胞再生表达至少一种如上所述的本发明的多肽的害虫耐受性转基因植物。
[0024]
在另一方面,本发明涉及一种用于防治田间害虫群体的方法,其包含在所述田间种植如上所述的转基因植物或其种子。
[0025]
本发明还涉及一种用于鉴定具有改善的害虫耐受性的植物的方法,其包含如下的步骤:在植物群体中鉴定表达本发明的二元毒素的第1组或第2组蛋白质中的至少一种或本发明的二元毒素的两种蛋白质的植物,尤其是包含如上所定义的载体或包含其的宿主细胞的那些。
[0026]
在另一方面,本发明还涉及一种用于在生物样品中检测如上所定义的本发明的核酸序列或多肽的存在或缺乏的方法,其包含以下步骤:获得生物样品,从该生物样品中提取dna或rna或蛋白质;以及检测如上所定义的本发明的核酸序列或多肽的存在或缺乏。
[0027]
本发明的生物样品可以定义为细胞裂解物。细胞可以是属于古细菌(archaea)或细菌的原核生物、真核生物诸如真菌或植物细胞。根据需要,可以使用澄清的裂解物或粗裂解物。
[0028]
用于在这种方法中进行上述检测步骤的工具(means)也是本发明的一个目的,其中所述工具选自由以下组成的组:
[0029]-至少两种用于扩增本发明的核酸序列的引物,
[0030]-至少一种与本发明的核酸序列杂交的标志物,以及
[0031]-至少一种识别本发明的多肽的抗体。
[0032]
本发明的一个目的是如上定义的本发明的分离的核酸序列用于筛选具有杀虫活性的同源物序列的用途。
[0033]
本发明的另一个目的是一种针对昆虫害虫的杀虫组合物,其包含有效量的如本文所述的第1组或第2组的至少一种蛋白质,或包含来自如本文所述的第1组和第2组两者的蛋白质。
[0034]
本发明的一个目的是一种生产所述杀虫组合物的方法,其包含培养细胞,该细胞包含编码第1组或第2组蛋白质,或优选地编码第1组和第2组蛋白质两者的至少一种核酸序列,以及回收第1组或第2组的至少一种蛋白质,或第1组和第2组蛋白质两者。该细胞可以是野生型细胞或宿主细胞。宿主细胞可以是原核生物、真核生物诸如真菌或植物细胞。
[0035]
本发明的另一个目的是一种处理植物免于害虫侵染或处理受害虫侵染的植物的方法,其包含向该植物或其部分施用本发明的二元毒素的第1组或第2组中的至少一种蛋白质,或来自本发明的二元毒素的第1组和第2组的每种的蛋白质两者。
附图说明
[0036]
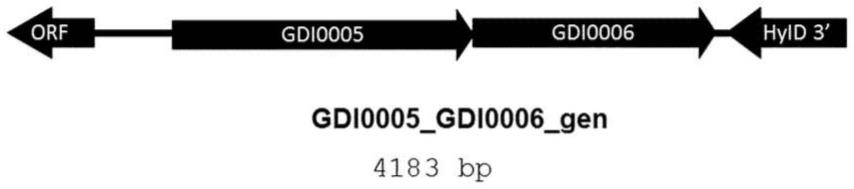
图1:包括gdi0005和gdi0006基因和相应序列的推定操纵子。
[0037]
图2:gdi0005和7个同源物序列之间的同一性百分比。
[0038]
图3:gdi0006和7个同源物序列之间的同一性百分比。
[0039]
图4:用于植物转化的gdi0005盒。
[0040]
图5:用于植物转化的gdi0006盒。
[0041]
图6:在96孔板(每次处理n=48孔,2018)的人工饮食中,在包含gdi0005和/或gdi0006的细菌裂解物处理中或阴性对照(缓冲液中的空菌株)中,在处理后3天和5天,新生西方玉米根虫幼虫的发育迟缓率(stunting)(a)和死亡率(b)。
[0042]
图7:在96孔板(每次处理n=48孔,2018)的人工饮食中,在gdi0005a同源物+gdi0006a同源物细菌裂解物处理中或在阴性对照(缓冲液中的空菌株)中,新生西方玉米根虫幼虫在处理后5天的死亡率(a)和在处理后3天的发育迟缓率(亚致死效应)(b)。
[0043]
图8:在包含gdi0005和gdi0006蛋白的细菌裂解物处理中或在阴性对照(缓冲液中的空裂解物,tris缓冲液和utc)或阳性对照(cry34/35裂解物),无稀释后,处理后5天,易感wcrw幼虫(a)、cry3bb1抗性wcrw幼虫(b)和cry34/35抗性wcrw幼虫(c)的幼虫重量(mg)。
[0044]
图9:蛋白质印迹显示转化烟草叶的总蛋白提取物。用gdi0005a(seq id no:1)或其同源物gdi0175a(seq id no:11)、gdi0177a(seq id no:12)、gdi0179a(seq id no:13)、gdi0181a(seq id no:14)、gdi0183a(seq id no:15)、gdi0185a(seq id no:16)、gdi0187a(seq id no:17)中的一种转化烟草植物。
[0045]
图10:蛋白质印迹显示转化烟草叶的总蛋白提取物。用gdi0006a(seq id no:2)或其同源物gdi0176a(seq id no:18)、gdi0178a(seq id no:19)、gdi0180a(seq id no:20)、
gdi0182a(seq id no:21)、gdi0184a(seq id no:22)、gdi0186a(seq id no:23)中的一种转化烟草植物。
[0046]
图11:在96孔板的人工饮食中,用包含gdi0005a(seq id no:1)和gdi0006a(seq id no:2)或gdi0005a(seq id no:1)和gdi0176a(seq id no:18)或gdi0005a(seq id no:1)和gdi0178a(seq id no:19)或gdi0005a(seq id no:1)和gdi0184a(seq id no:22)或gdi0005a(seq id no:1)和gdi0186a(seq id no:23)或gdi0005a(seq id no:1)和gdi0188a(seq id no:24)的细菌裂解物或阴性对照(缓冲液中的空菌株)或阳性对照(cry34/cry35)处理后3天,新生西方玉米根虫幼虫的发育迟缓率。
具体实施方式
[0047]
蛋白质
[0048]
根据本发明,本发明的蛋白质或多肽或毒素是杀虫的。杀虫是指该蛋白质/多肽/毒素能够诱导昆虫害虫的发育迟缓(亚致死效应)和/或杀死(致死效应)。
[0049]
第1组蛋白质和第2组蛋白质具有杀虫活性。
[0050]
启动子
[0051]
根据本发明,启动子可以选自能够驱动基因在细菌、真菌、酵母或植物细胞中表达的启动子。
[0052]
启动子可以是天然启动子或异源启动子。异源启动子为不是位于下游的基因的天然启动子的启动子。
[0053]
在一个优选的实施方案中,能够驱动基因在细菌细胞中表达的启动子能够驱动在大肠杆菌(e.coli)中表达。在另一个优选的实施方案中,这种启动子能够驱动基因在酵母细胞中的表达,例如在解脂耶氏酵母(yarrowia lipolytica)中的表达。
[0054]
在另一个优选的实施方案中,能够驱动与其可操作连接的基因在植物细胞中表达的“在植物中具有功能性”的启动子能够驱动基因在玉米细胞中表达。
[0055]
为了得到表达,编码如上定义的要过表达的蛋白质,优选如seq id no:1或seq id no:2所示的蛋白质的序列可以在组成型、组织特异性、发育调控、诱导型或减数分裂启动子的控制下存在。此类启动子通常是本领域熟知的。可以使用其它合适的启动子。这可以是组织特异性启动子,诸如叶特异性启动子、种子特异性启动子、betl特异性启动子等。在文献中描述了许多组织特异性启动子,并且可以使用它们中的任何一种,例如us 20130024998中公开的启动子。
[0056]
其它有用的启动子是在种子发育期间受调控的启动子,诸如小麦的hmwg启动子(高分子量麦谷蛋白)(anderson&greene,1989;robert et al.,1989),玉米的蜡质(waxy)、玉米醇溶蛋白或bronze启动子,或us 20150007360、us 20120011621、us 20100306876、us 20090307795或us 20070028327中公开的启动子。
[0057]
尽管一些启动子在不同物种中可具有相同的调控模式,但在植物中通常优选在单子叶植物中使用单子叶启动子,而在双子叶植物中使用双子叶启动子。
[0058]
在一个优选的实施方案中,启动子是pcsvmv+osactin+内含子,如seq id no:7所示。
[0059]
同源物序列的定义
[0060]
本发明的同源物序列可以从公共或私人保藏物中分离得到,也可以基于本发明中呈现的肽序列的全部或部分,或者使用其编码核苷酸序列的全部或部分,通过各种常规方法制备,诸如随机诱变、定点诱变、基因合成或基因改组。此类同源物包含例如蛋白质的氨基酸序列中一个或多个残基的缺失、插入或取代,或其组合。本发明还涉及本文公开的序列gdi0005a和gdi0006a的任何同源物,条件是这些同源物单独(gdi0005型或gdi0006型)或以二元形式(gdi0005型与gdi0006型)保留杀虫活性。
[0061]
根据本发明,gdi0005a同源物是与seq id no:1具有至少70%序列同一性,优选至少73%序列同一性,优选至少75%序列同一性,优选至少80%序列同一性,优选至少85%序列同一性,优选至少90%序列同一性,优选至少90%序列同一性,优选至少95%序列同一性,优选至少98%序列同一性,优选至少99%序列同一性,优选至少99.2%序列同一性,优选至少99.5%序列同一性,优选至少99.8%序列同一性,优选至少99.9%序列同一性的蛋白质。
[0062]
在一个优选的实施方案中,gdi0005a同源物选自序列seq id no:11至seq id no:17。
[0063]
根据本发明,gdi0006a同源物是与seq id no:2具有至少65%序列同一性,优选至少68%序列同一性,优选至少70%序列同一性,优选至少75%序列同一性,优选至少80%序列同一性,优选至少85%序列同一性,优选至少90%序列同一性,优选至少95%序列同一性,优选至少98%序列同一性,优选至少99%序列同一性,优选至少99.2%序列同一性,优选至少99.5%序列同一性,优选至少99.8%序列同一性,优选至少99.9%序列同一性的蛋白质。
[0064]
在一个优选的实施方案中,gdi0006a同源物选自序列seq id no:18至seq id no:24。
[0065]
同源物序列表现出序列的50%或更多的序列对查询覆盖(gdi0005a或gdi0006a)长度和此比对区域中的同一性》30%。该同一性百分比优选通过使用blastp算法获得。
[0066]“序列同一性百分比”可通过在比较窗上比较两个最佳比对的序列来确定,其中与参考序列(其不包含添加或缺失)相比,比较窗中的多核苷酸或多肽序列的部分可包含添加或缺失(即,缺口)以用于两个序列的最佳比对。通过确定在两个序列中出现相同的核酸碱基或氨基酸残基的位置的数目以得到匹配的位置的数目,将匹配的位置的数目除以比较窗中的位置的总数并将结果乘以100以得到序列同一性的百分比来计算百分比。优选地,如本发明上下文中定义的序列同一性百分比是通过在其全长上比较的序列的全局比对确定的。
[0067]
通过应用blastp程序(altschul et al.(1997),nucleic acids res.25:3389-3402;altschul et al.(2005)febs j.272:5101-5109)至seq id no:1或seq id no:2,使用默认算法参数,可以鉴定同源物蛋白。
[0068]
二元毒素
[0069]
杀虫二元毒素由两种组分构成,一种来自第1组蛋白质,另一种来自第2组蛋白质,并且当将这两种组分组合施用至昆虫害虫时诱导杀灭或发育迟缓。当单独施用时,毒素蛋白中的一些可以具有致死或亚致死特性。然而,当两种组分蛋白一起施用时,杀虫二元毒素蛋白的毒性要大得多。
[0070]
gdi0005a蛋白及其同源物,例如seq id no:11所示的gdi0175a、seq id no:12所
示的gdi0177a、seq id no:13所示的gdi0179a、seq id no:14所示的gdi0181a、seq id no:15所示的gdi0183a、seq id no:16所示的gdi0185a和seq id no:17所示的gdi0187a属于第1组蛋白质。
[0071]
gdi0006蛋白及其同源物,例如seq id no:18所示的gdi0176a、seq id no:19所示的gdi0178a、seq id no:20所示的gdi0180a、seq id no:21所示的gdi0182a、seq id no:22所示的gdi0184a、seq id no:23所示的gdi0186a和seq id no:24所示的gdi0188a属于第2组蛋白质。
[0072]
在本发明的一个实施方案中,杀虫二元毒素可以用选自第1组的任何蛋白质与选自第2组的任何蛋白质组合形成,以最大化对昆虫幼虫的致死或亚致死效应。
[0073]
在具体的实施方案中,gdi0005a和gdi0006a形成第一二元毒素,gdi0175a和gdi0176a形成第二二元毒素,gdi0177a和gdi0178a形成第三二元毒素,gdi0179a和gdi0180a形成第四二元毒素,gdi0181a和gdi0182a形成第五二元毒素,gdi0183a和gdi0184a形成第六二元毒素,gdi0185a和gdi0186a形成第七二元毒素,gdi0187a和gdi0188a形成第八二元毒素。
[0074]
在二元毒素的其它具体实施方案中,gdi0005a可以与任何gdi0006a同源物组合,诸如与seq id no:18所示的gdi0176a,seq id no:19所示的gdi0178a,seq id no:20所示的gdi0180a,seq id no:21所示的gdi0182a,seq id no:22所示的gdi0184a,seq id no:23所示的gdi0186a或seq id no:24所示的gdi0188a组合。类似地,gdi0006a可与任何gdi0005a同源物组合,诸如与seq id no:11所示的gdi0175a,seq id no:12所示的gdi0177a,seq id no:13所示的gdi0179a,seq id no:14所示的gdi0181a,seq id no:15所示的gdi0183a,seq id no:16所示的gdi0185a或seq id no:17所示的gdi0187a组合。
[0075]
盒与载体
[0076]
在一个实施方案中,编码蛋白gdi0005a或其同源物中的一种和gdi0006a或其同源物中的一种的核酸序列在盒中的单个启动子的控制下。将克隆在单个载体中的单个盒插入宿主细胞,诸如选自微藻、植物、细菌、古细菌、酵母或真菌的细胞,如下文举例说明的。转化这些细胞类型所需的载体是本领域熟知的。转化的细胞能够表达gdi0005a(或其同源物中的一种)和gdi0006a(或其同源物)的融合体。
[0077]
在一个具体的实施方案中,两种蛋白可以表达为一种蛋白,在二元毒素的两种组分之间具有蛋白接头。
[0078]
该接头可为长度为4-21个氨基酸残基的序列。该接头可为天然序列或设计的序列。接头可包含蛋白水解切割位点以分离两种融合蛋白。接头可以是长且柔性的,以保持两种蛋白融合并允许两种蛋白的正确折叠。接头示例于chen x,zaro jl,shen wc.fusion protein linkers:property,design and functionality.adv drug deliv rev.2012;65(10):1357-69。
[0079]
在第二个实施方案中,这两种蛋白由克隆在同一载体中的两个不同的盒编码。用所述载体转化宿主细胞。该宿主细胞能够表达这两种蛋白。
[0080]
在第三个实施方案中,这两种蛋白由克隆在两个单独的载体中的两个不同的盒编码。
[0081]
在特定实施方案中,用这两种载体转化宿主细胞。该宿主细胞能够表达这两种蛋
白。
[0082]
根据本发明,载体还可以携带选择标志物。术语“选择标志物”意图指一种如下的基因,其表达赋予含有该基因的宿主细胞以使得可以选择如此转化的所述宿主细胞(阳性选择)的特征。例如,其为赋予抗生素抗性或热稳定性抗生素抗性的基因,或编码能够互补营养缺陷型(天然的,诸如克服必需氨基酸的缺乏,或工程化的,诸如ura3缺陷型突变体,其中ura3是尿嘧啶生物合成所必需)的酶的基因。选择标志物基因包括赋予抗生素抗性的基因,诸如卡那霉素(nptii基因)、潮霉素(aph iv)、壮观霉素(aada)和庆大霉素(aac3和aacc4),或赋予除草剂抗性的基因,诸如草铵膦(glufosinate)(bar或pat)、麦草畏(dicamba)(dmo)和草甘膦(glyphosate)(aroa或epsps)。也可以使用允许直接视觉鉴定转化体的选择标志物,例如,表达有色或荧光蛋白诸如荧萤光素酶或绿色荧光蛋白(gfp)的基因,或表达β-葡糖醛酸糖苷酶或uida基因(gus)的基因,对于这些基因的各种显色底物是已知的。它们可具有宿主特异性。选择标志物是本领域熟知的。
[0083]
在另一个实施方案中,用至少一种编码二元毒素的第一蛋白的载体转化宿主细胞,并用至少一种编码二元毒素的第二蛋白的另一种载体转化另一种宿主细胞。当宿主细胞是植物细胞时,然后将由其衍生的两种生长的植物杂交。在后代中选择表达这两种蛋白的植物。当宿主细胞是微生物细胞时,单独培养表达二元毒素的蛋白质中的一种的每种宿主细胞,以表达二元毒素的蛋白质组分中的一种。在另一个实施方案中,当宿主细胞是微生物细胞时,二元毒素的两种蛋白在同一宿主细胞中表达。
[0084]
在一个优选的实施方案中,这种载体包含启动子pcsvmv+osactin+内含子,如seq id no:7所示。
[0085]
本领域技术人员可以通过熟知的常规手段将至少一个拷贝的上述核酸或至少一个拷贝的载体引入宿主细胞。例如,可以采用氯化钙处理、电穿孔、使用基因枪、病毒介导的转化、通过显微注射的转化、土壤杆菌(agrobacterium)介导的植物转化(ishida et al.,nat.biotechnol.,14:745-750,1996)。
[0086]
根据一个实施方案,本领域技术人员可以通过常规方法将几个拷贝的上述核酸或载体引入宿主细胞。
[0087]
转化步骤之后可以是选择步骤和再生步骤。专用于每种物种的选择和再生方法是本领域技术人员熟知的。
[0088]
信号肽/靶向
[0089]
根据本发明,通过将信号肽核酸序列与编码gdi0005和gdi0006的核酸序列融合,可以将二元毒素的两种组分靶向于特定的细胞区室中。
[0090]
信号肽可以将本发明的蛋白靶向不同的细胞器,例如细胞核、液泡、er、线粒体、叶绿体。在革兰氏阴性菌中,它们将本发明的蛋白质靶向周质。在革兰氏阳性菌中,它们将本发明的蛋白质靶向分泌到细胞外(培养基中)。
[0091]
本发明的信号肽可以为叶绿体靶向信号,诸如玉米rubisco活化酶(rca)(seq id no:42),玉米酮醇酸还原异构酶kari2(seq id no:43),玉米乙酰乳酸合酶1(ahas)(seq id no:44),us 8426204 b2中描述的莱茵衣藻(c.reinhardtii)5-烯醇丙酮基莽草酸-3-磷酸合酶(epsps),sallaud et al.(2009)中描述的番茄z,z-法呢基焦磷酸合酶,番茄檀香烯和香柠檬烯(bergamotene)合酶(sallaud et al.(2009)),稻rubisco ssu(jang et al.
(2002)),拟南芥rubisco ssu(wong et al.1992)。
[0092]
其它叶绿体靶向信号已在文献(例如von heijne et al.(1991))中确定,并且可用于靶向本发明的蛋白质。
[0093]
本发明的信号肽可以为线粒体靶向信号,诸如huang et al.(2009)中描述的osppr_02g02020和os01g49190,或质外体分泌信号,诸如大麦α-淀粉酶信号序列(rogers 1985)和烟草发病相关蛋白,pr1a(pen et al.1992)。
[0094]
本发明的信号肽可以在具有er保留信号(诸如c末端kdel基序)的情况下将蛋白质靶向到内质网(er)中,在具有大麦aleuraine信号肽(holwerda et al.(1992))或烟草壳多糖酶a信号肽(neuhaus et al.(1994))的情况下将蛋白质靶向到液泡中。
[0095]
本发明的其它信号肽为过氧化物酶体靶向性c末端pts1信号、skl、srl和变体(hayashi et al.(1996),kragler et al.(1998))以及核靶向信号(nls)诸如猿猴病毒sv40(kalderon at al.(1984))。raikhel n.(1992)还描述了植物nls序列。
[0096]
利用例如torrent et al.(2009)描述的玉米γ玉米醇溶蛋白信号肽,可以将本发明的蛋白质靶向到蛋白质体中,以改善细胞中的蛋白积累。
[0097]
此外,玉米细胞基因组学数据库(http://maize.jcvi.org/cellgenomics/index.php)中描述了定位于不同植物区室并因此具有靶向信号的玉米蛋白质。植物区室包括:细胞壁,叶绿体,造粉体,高尔基体,线粒体,细胞核,过氧化物酶体,质膜,胞间连丝,蛋白质体,糙面内质网,光滑内质网,液泡膜,液泡,囊泡,核周间隙。
[0098]
在第一个实施方案中,本发明的第1组和第2组蛋白质均靶向于相同的细胞区室中。
[0099]
在第二个实施方案中,本发明的第1组和第2组蛋白质靶向于不同的细胞区室中。
[0100]
宿主细胞
[0101]
宿主细胞可以是属于古细菌或细菌的原核生物、真核生物诸如真菌或植物细胞。
[0102]
根据本发明,如上所述的宿主细胞可为微生物细胞,诸如木霉属(trichoderma),曲霉属(aspergillus),脉孢菌属(neurospora),腐质霉属(humicola),青霉属(penicillium),镰刀菌属(fusarium),热单孢菌属(thermomonospora),芽孢杆菌属(bacillus),假单胞菌属(pseudomonas),埃希氏菌属(escherichia),梭菌属(clostridium),纤维单胞菌属(cellulomonas),链霉菌属(streptomyces),耶氏酵母属(yarrowia),毕赤酵母属(pichia)或酵母属(saccharomyces)。
[0103]
例如,根据一个实施方案,如上所述的微生物宿主细胞可选自里氏木霉(trichoderma reesei),绿色木霉(trichoderma viridae),康宁木霉(trichoderma koningii),黑曲霉(aspergillus niger),构巢曲霉(aspergillus nidulans),文氏曲霉(aspergillus wentii),米曲霉(aspergillus oryzae),海要曲霉(aspergillus phoenicis),粗糙脉孢菌(neurospora crassa),灰腐质霉(humicola grisae),嗜松青霉(penicillium pinophilum),草酸青霉菌(penicillium oxalicum),大肠杆菌(escherichia coli),丙酮丁醇梭菌(clostridium acetobutylicum),解糖梭菌(clostridium saccharolyticum),clostridium bejerinckii,丁酸梭菌(clostridium butylicum),毕赤酵母(pichia pastoris),荧光假单胞菌(pseudomonas fluorescens)和解脂耶氏酵母(yarrowia lipolytica)。
[0104]
根据本发明,如上所述的宿主细胞可为诸如属于蓝细菌物种的微藻细胞。
[0105]
例如,根据一个实施方案,如上所述的微藻宿主细胞可为聚球藻属种(synechococcus sp.)或集胞藻属种(synechocystis sp.)。
[0106]
根据本发明,如上所述的宿主细胞是选自双子叶植物和单子叶植物的植物细胞。
[0107]
例如,根据一个实施方案,如上所述的植物宿主细胞选自双子叶植物诸如烟草、棉、大豆、向日葵、油菜籽和单子叶植物诸如小麦、玉米、稻、大麦、高粱,并且优选玉米。
[0108]
本发明涉及包含如上所述的本发明的载体的宿主细胞。特别是,宿主细胞包含至少一种编码本发明的第1组或第2组蛋白质的二元毒素的蛋白质之一的核酸序列,或包含各自编码本发明的二元毒素的第1组和第2组蛋白质之一的核酸序列两者。
[0109]
优选地,宿主细胞为可以包含一种或两种如上所述的核酸序列的植物细胞。
[0110]
转基因植物
[0111]
转基因植物可选自双子叶植物和单子叶植物。
[0112]
根据一个实施方案,转基因植物选自双子叶植物诸如烟草、棉、大豆、向日葵、油菜籽和单子叶植物诸如小麦、玉米、稻、大麦、高粱,并且优选玉米。
[0113]
防治害虫群体/耐受性
[0114]
根据本发明,防治害虫群体意味着限制害虫的发育、停止其发育或杀死害虫。这包括诱导害虫(成虫或幼虫)的生理或行为变化,诸如生长发育迟缓,死亡率增加,繁殖能力降低,摄食行为或运动的减少或停止,或变态阶段发育的减少或停止。
[0115]
害虫生存力的降低诱导植物对害虫侵染的耐受性增强。
[0116]
在一个优选的实施方案中,本发明实现了昆虫耐受性,更优选鞘翅目耐受性,更优选对西方玉米根虫(wcrw)diabrotica virgifera virgifera的耐受性。
[0117]
在一个实施方案中,本发明涉及一种用于防治田间害虫群体的方法,其包含在所述田间种植本发明的转基因植物或来自其的转基因种子。
[0118]
在一个优选的实施方案中,本发明涉及一种防治田间昆虫群体,更优选鞘翅目昆虫群体,更优选西方玉米根虫(wcrw)diabrotica virgifera virgifera群体的方法。
[0119]
制备方法
[0120]
根据本发明,二元毒素的蛋白质组分可以在宿主细胞中一起产生,或者分别在单独的宿主细胞中产生,该单独的宿主细胞可以是相同种类或不同的,然后以期望的剂量组合在单一组合物中,以提供其有效量,用于应用于植物或其环境以及应用于害虫。
[0121]
本发明的二元毒素的蛋白质可通过培养宿主细胞单独产生或组合产生以用于组合物中。将目的基因克隆入表达载体,然后插入宿主细胞中。转化的宿主细胞在需要时在诱导下在表达条件下培养。
[0122]
或者,本发明的二元毒素的每种蛋白质组分可以通过培养野生型微生物(细菌、古细菌、真菌和原核和真核微藻)来产生。野生型微生物的生长条件得到修饰并且适合于改善生长或二元毒素的生成,或者都利用这些微生物在选择压力下的适应性进化能力。
[0123]
在一个实施方案中,包含表达本发明的二元毒素的第1组或第2组蛋白质中的至少一种,或来自本发明的二元毒素的第1组或第2组中的每一个的蛋白质两者的野生型金黄杆菌属的组合物是本发明的一个目的。这种组合物可以特别用于通过将该组合物施用于植物或其部分来处理植物以防昆虫害虫侵染或处理受害虫侵染的植物。
[0124]
野生型金黄杆菌属是可以在自然界中发现的金黄杆菌属细菌菌株。这种天然存在的菌株未经修饰、转化或突变。
[0125]
例如在下面列出可根据本发明使用的这种金黄杆菌菌株。
[0126]
chryseobacterium arthrosphaerae cc-vm-7(jeong et al.,2016.genome announc 4(5):e01168-16.doi:10.1128/genomea.01168-16),一种从球马陆(pill millipede)arthrosphaera magna attems的粪便分离的菌株(kampfer et al.2010international journal of systematic and evolutionary microbiology,60,1765
–
1769)。该菌株表达seq id no:1和seq id no:2。
[0127]
chryseobacterium carnipullorum菌株25581是一种革兰氏阴性、棒状、非孢子形成的、非运动性细菌,其从南非布隆方丹的家禽加工厂的生鸡中分离得到(charimba et al.2013)。该菌株可通过莱布尼茨研究所dsmz-德国微生物和细胞培养物保藏中心(leibniz institute dsmz-german collection of microorganisms and cell cultures)获得。该菌株表达gdi0175a(seq id no:11)和gdi0176a(seq id no:18)。
[0128]
chryseobacterium shigense菌株dsm17126(也称为bamy 1001和gum-kaji)是一种革兰氏阴性、严格需氧、棒状、非运动性细菌,其从日本的乳酸饮料中分离(shimomura et al.2005)。该菌株可通过莱布尼茨研究所dsmz-德国微生物和细胞培养物保藏中心获得。该菌株表达gdi0177a(seq id no:12)和gdi0178a(seq id no:19)。
[0129]
chryseobacterium kwangjuense菌株kj1r5(也称为kacc 13029(t)和jcm 15904(t))是一种革兰氏阴性棒状细菌,其从韩国光州的辣椒植物番椒(capsicum annuum)的根部分离得到(sang et al.2013)。该菌株可通过jcm riken获得。该菌株表达gdi0183a(seq id no:15)和gdi0184a(seq id no:22)。
[0130]
金黄杆菌ov705表达gdi0185a(seq id no:16)和gdi0186a(seq id no:23)。
[0131]
产吲哚金黄杆菌(chryseobacterium indologenes)表达gdi0187a(seq id no:17)和gdi0188a(seq id no:24)。
[0132]
无论蛋白质是由野生型微生物或重组微生物产生的,蛋白质都可以在之前有或没有细胞破碎的情况下从细胞沉淀中回收,或者可以从细胞沉淀、培养物上清液或整个培养物中提取、纯化和浓缩它们。
[0133]
组合物
[0134]
本发明的杀虫组合物含有一种或多种活性剂(包括本发明的二元毒素的第1组和第2组蛋白质中的一种或两种)与一种或多种其它组分(诸如例如载体,佐剂,表面活性剂,乳化剂,包封剂,释放剂,渗透剂,可检测剂以及本领域已知赋予活性剂或组合物本身以下特性中的一种或多种的其它组分:诸如活性剂的稳定性、乳化、悬浮或增溶,活性剂在环境中的持久性或植物渗透性,活性剂进入植物的渗透性,害虫的吸收)的组合。
[0135]
本发明的二元毒素的蛋白质的市售制剂可用于生产稳定且易于使用的农业和园艺产品。市售制剂包括可湿性粉剂、悬浮浓缩物、水分散颗粒、油可溶混悬浮剂、胶囊悬浮剂和颗粒剂。
[0136]
本发明的组合物还可含有其他活性剂,诸如除草剂、杀真菌剂、杀细菌剂、杀线虫剂、杀软体动物剂或其他杀虫剂。该组合物还可含有其他有利于植物生长的活性剂,诸如肥料、营养物、植物生长促进根瘤菌(pgpr)或微量营养物供体。
[0137]
用法
[0138]
根据本发明,可以通过将二元毒素或制备二元毒素的两种蛋白质组分中的任一种施用于昆虫害虫来处理植物免于昆虫害虫的侵染或处理受害虫侵染的植物。因此,该处理可以是预防性的,即在昆虫害虫侵染之前,或者是治愈性的,即一旦害虫侵染存在。可以通过培养表达有效量的本发明的二元毒素的一种或两种蛋白质组分的转基因植物来施用毒素或蛋白质。或者,可通过将包含有效量的本发明二元毒素的一种或两种蛋白质组分的组合物应用于害虫的环境来处理植物。所述组合物可应用于任何植物部分,直接应用至其叶子,或应用于其根部,或应用于两者,或应用于种子,通常应用于植物的叶子上,或通过常规方法诸如喷雾施用于作物上。其它应用方法包括但不限于,撒粉,喷洒,充气,土壤浸泡,土壤注射,种子包衣,幼苗包衣,叶面喷雾,喷雾,熏蒸,雾化以及本领域技术人员熟知的任何其它应用方法。此外,可以将包含有效量的本发明的二元毒素的至少一种蛋白质组分的组合物应用于表达其他蛋白质组分的转基因植物。对于包含本发明的二元毒素的单一组分的组合物,这种组合物可以单独应用,或者应用这些组合物中的两种,每种组合物具有二元毒素的一种蛋白质组分;它们可以同时或顺序施用。
[0139]“有效量”是足以在幼虫阶段或成年阶段逆转、减缓、阻碍、延迟或停止昆虫害虫的生长,或导致幼虫或成年昆虫害虫死亡的量。可以在一种或多种治疗应用中或经由如本文所公开的一种或多种方法施用有效量。
[0140]
如本领域技术人员将理解的,有效量将随具体制剂的性质而广泛地变化,特别是其是在使用前稀释的浓缩物还是直接使用的浓缩物。制剂可含有约1重量%至约100重量%的本发明的二元毒素。干制剂可具有约1-95重量%的二元毒素,而液体制剂通常可具有液相中约1-60%重量的固体。表达本发明的二元毒素的全细胞组合物通常可具有约102至约104个细胞/mg。这些组合物可以每公顷约50mg(液体或干)至1kg或更多使用。
[0141]
根据本发明,可以通过种植表达二元毒素的两种蛋白中的至少一种的转基因植物来控制害虫群体,然后可以将二元毒素的另一种蛋白以如上所述的处理的形式应用于植物。害虫群体还可通过种植经修饰以表达二元毒素的两种蛋白的植物来防治。
[0142]
本发明的组合物可配制成含有引诱剂和本发明的二元毒素或表达它们或本文所述的其蛋白质组分之一的全细胞的诱饵颗粒。可将诱饵颗粒应用于土壤。本发明的组合物还可以在作物周期的后期阶段作为种子包衣或根处理或全植物处理应用。对于植物和土壤处理,表达如本文所述的本发明二元毒素或其组分蛋白质之一的细胞可通过与各种惰性材料(诸如无机矿物(层状硅酸盐(phyllosilicate)、碳酸盐、硫酸盐、磷酸盐等)或植物材料(玉米芯粉、稻壳、胡桃壳等))混合而用作可湿性粉剂、颗粒剂或粉剂。制剂可包括涂抹剂-粘着剂佐剂、稳定剂、其它杀虫添加剂或表面活性剂。液体制剂可为泡沫、凝胶、悬浮液、可乳化浓缩物等形式的水性或非水性制剂。成分可包括流变剂、表面活性剂、乳化剂、分散剂或聚合物。
[0143]
在本文公开的方法和组合物的另一个实施方案中,表达本发明的二元毒素的宿主细胞培养物可在液氮中快速冷冻,然后在最终冷冻温度下储存。该培养物也可以更渐进的方式冷冻,或本领域已知的用于冷冻宿主细胞培养物的任何其它方法冷冻。
[0144]
实施例
[0145]
实施例1:基因组测序和dna分析
no:18至seq id no:24表示。序列之间的同一性百分比在图3中呈现。所有蛋白质均见于金黄杆菌的各物种的基因组,c.carnipullorum(gdi0176a;seq id no:18),c.shigense(gdi0178a;seq id no:19),c.kwangjuense(gdi0184a;seq id no:22),ov705(gdi0186a;seq id no:23),产吲哚金黄杆菌(gdi0188a;seq id no:24)。它们均在gdi0005和gdi0006等推定的操纵子中构造。
[0155]
chryseobacterium carnipullorum菌株25581是一种革兰氏阴性、棒状、非孢子形成的、非运动性细菌,其从南非布隆方丹的家禽加工厂的生鸡中分离得到(charimba et al.2013)。该菌株可通过莱布尼茨研究所dsmz-德国微生物和细胞培养物保藏中心获得。
[0156]
chryseobacterium shigense菌株dsm17126(也称为bamy 1001和gum-kaji)是一种革兰氏阴性、严格需氧、棒状、非运动性细菌,其从日本的乳酸饮料中分离(shimomura et al.2005)。该菌株可通过莱布尼茨研究所dsmz-德国微生物和细胞培养物保藏中心获得。
[0157]
chryseobacterium kwangjuense菌株kj1r5(也称为kacc 13029(t)和jcm 15904(t))是一种革兰氏阴性棒状细菌,其从韩国光州的辣椒植物番椒(capsicum annuum)的根部分离得到(sang et al.2013)。该菌株可通过jcm riken获得。
[0158]
实施例3:gdi0005a和gdi0006a在大肠杆菌中的克隆和表达
[0159]
为了在大肠杆菌中表达gdi0005a和gdi0006a,将缺少编码n末端met和c端密码子终止的序列的dna基因编码序列优化用于在大肠杆菌中表达(seq id no:26和seq id no:27)。将这些序列克隆到electra克隆载体pd441-hmbp(atum(ex dna2.0))中,从而将n末端his+mbp tag编码序列与每个基因融合。将克隆转化到大肠杆菌菌株bl21(de3)中,并在50ml体积的自诱导培养基(switch培养基/delphi genetics/ge-aime-04)中生长。将培养物离心并重悬于12ml具有6μl溶菌酶(50mg/ml)和6μl dnasei(2mg/ml)的化学细胞裂解缓冲液(nzy bacterial cell lysis buffer/nzytech/mb17801)中。
[0160]
以类似的方式,在大肠杆菌中表达seq id no:11至seq id no:17的gdi0005a同源蛋白(针对大肠杆菌优化的核酸序列,seq id no:28至seq id no:34)和seq id no:18至seq id no:24的gdi0006a同源蛋白(针对大肠杆菌优化的核酸序列,seq id no:35至seq id no:41),并制备用于昆虫幼虫活性测定的细菌裂解物。
[0161]
实施例4:使用gdi0005a和gdi0006a细菌裂解物进行易感鞘翅目生物测定
[0162]
用裂解物进行杀虫活性生物测定以评估杀虫蛋白对鞘翅目昆虫,西方玉米根虫diabrotica virgifera virgifera leconte的作用。根据pleau et al.(2002)和moar et al.(2017plos one),使用96孔板对根虫特异性人工饲料(frontier scientific ltd f9800b饲料加上冻干玉米根,按照pleau et al.2002ent.exp.et appl.)进行幼虫喂养试验。将20μl不同大肠杆菌克隆的澄清液体裂解物应用于每孔190μl固体人工饲料的0.8cm2表面上。裂解物含有gdi0006a蛋白或gdi0005a蛋白,或两者的50:50混合物(均为his&mbp tags)。类似体积的澄清的空裂解物及其nzy-tech tris缓冲液用作阴性对照。将1只西方玉米根虫新生幼虫置于每个孔中喂养5天。如果幼虫死亡率和发育迟缓率在统计学上高于阴性对照,则认为结果是阳性的。
[0163]
如在本实施例和以下实施例中使用的空裂解物是在相同条件下并由相同细菌菌株(其含有与含有杀虫蛋白的裂解物相同的表达载体,唯一的例外是该表达载体不含有编码毒素的基因)产生的细菌裂解物。
[0164]
三天后,与每种单一的gdi0005a和gdi0006a毒素和对照的活性相比,含有组合的gdi0006a和gdi0005a蛋白的裂解物在幼虫中表现出强烈的发育迟缓(图6a)。五天后,发现了类似的发育迟缓作用,并且在根虫幼虫中由组合的gdi0006a和gdi0005a蛋白引起显著死亡率(图6b)。
[0165]
三天后,含有组合的gdi0006a同源物和gdi0005a同源物蛋白的裂解物在幼虫中表现出强烈的发育迟缓(图7b)。五天后,结果显示由组合的gdi0006a同源物和gdi0005a同源物蛋白引起的根虫幼虫的显著死亡率(图7a)。
[0166]
实施例5:使用gdi0005a和gdi0006a细菌裂解物对抗性和易感鞘翅目进行生物测定以确定模式作用
[0167]
杀虫活性:
[0168]
用如huynh mp,et al.(plos one 12(11):e0187997)所述生产的饮食,称为wcrmo-1饮食,利用人工饮食生物测定法测定gdi005(his_mbp_gdi0005a)和gdi006(his_mbp_gdi0006a)细菌裂解物对wcrw(西方玉米根虫,diabrotica virgifera virgifera leconte)的杀虫活性。针对3种wcrw新生幼虫株,wcrw易感、wcrw cry3bb1抗性和wcrw cry34/35抗性,进行了四种测定(每种株系一个)。wcrw cry34/35抗性群体呈现对cry34/35毒素的不完全抗性,如ludwick et al.(2017)和gassmann et al.(2018)所报道的。这种不完全抗性对于新发现的田间进化抗性是典型的。
[0169]
每个测定法由一系列3个96孔测定板(costar 3370,corning inc.,kennebunk me)组成,其中每个板在每个测试中含有重复的样品。与utc、空裂解物、tris缓冲液和阳性对照相比,分别针对易感、cry3bb1抗性和cry34/35抗性wcrw,测定评估了未稀释(1x)时gdi005和gdi006等比例的二元混合物的wcrw活性,所述阳性对照是天然细菌裂解物cry34/35的1:1混合物。
[0170]
数据评价:
[0171]
每个测试有3个重复,每个重复包含每种毒素、阴性对照和阳性对照以及utc的1列,每个测试每个处理总共24个数据点。包括测试毒素(gdi005/gdi006)、空裂解物、tris缓冲液和pos的每个处理孔通过在约200μl的wcrmo-1饮食中添加20μl的测试物质来处理。utc没有覆盖测试物质,因为它仅仅是饮食。在覆盖测试物质后,将托盘在层流通风橱下干燥约30分钟。接下来,使用细尖水彩刷将一只新生wcrw幼虫侵染到96孔测定板的每个处理孔中。幼虫侵染后,将各个板用密封膜(excel scientific,inc.,thermalseal rtstm,tss-rtq-100)覆盖,并置于25℃黑暗的生长室中5天。在第5天,取出各个板,并评估每个孔中的幼虫的死亡率(活的或死的)。在死亡率评估后,使用以mg为单位的分析天平,将幼虫称重作为每种处理的每个列每重复96孔测定板的合并组。评估了死亡率和幼虫重量后,对数据进行分析。数据示于图8a-8b-8c。如果与utc相比,当暴露于毒素5天时,结果显示重量减少至少50%,则认为毒素是有效的。以空裂解物、tris缓冲液和pos作为阳性对照和阴性对照,以评估每个测试的质量和可靠性。此外,pos用于测量毒素与已在商业上使用的已知毒素类别相比的有效性。
[0172]
结果:
[0173]
试验显示二元毒素对cry34/35和cry3b1抗性株的毒性。cry34/35和cry3bb1抗性集落的结果显示,本发明的二元毒素呈现与cry34/35和cry3bb1毒素中的一种不同的模式
作用。
[0174]
实施例6:lc50
[0175]
gdi005和gdi006的纯化蛋白用于测定二元混合物的lc50值。lc50方法的第一步是通过范围探索体外生物测定(range finding in vitro bioassay)确定在3次重复的测定中杀死约50%和100%的昆虫的二元混合物的浓度。这些测定将标准蛋白质覆盖在饮食测定之上,其中将20μl测试物质移液到约200μl的wcrmo-1饮食上。在覆盖测试物质后,将托盘在层流通风橱下干燥约30分钟。接下来,使用细尖水彩刷将一个新生wcrw幼虫侵染到96孔测定板的每个处理孔中。幼虫侵染后,将各个板用密封膜(excel scientific,inc.,thermalseal rtstm,tss-rtq-100)覆盖,并置于25℃黑暗的生长室中5天。在第5天,取出各个板,并评估每个孔中的幼虫的死亡率(活的或死的)。在死亡率评估后,使用以mg为单位的分析天平,将幼虫称重作为每种处理的每个列每重复96孔测定板的合并组。评估死亡率和幼虫重量后,对数据进行分析。每个浓度最初产生至少24个数据点,如果需要,添加更多的数据点。在易感的wcrw上进行初始范围探索生物测定,以确定纯化蛋白质二元混合物的基线死亡率。
[0176]
范围探索测定完成后,在来自范围探索测定的全强度浓度和50%浓度开始制备几种浓度的二元纯化蛋白质混合物,并使用低熔融琼脂掺入wcrmo-1饮食中。首先评估易感wcrw幼虫以测定lc50。由于饮食掺入的复杂性质,使用了48孔板。每个孔用7-10只新生幼虫侵染,并在5天后评估死亡率。此外,通过重复和通过浓缩在合并的基础上评估幼虫重量。在易感wcrw群体上建立lc50后,评估cry3bb1和cry34/35抗性群体并测定lc50。
[0177]
实施例7:烟草瞬时测定
[0178]
将编码gdi0005a的合成玉米密码子优化序列加n末端组氨酸tag(seq id no:5)克隆在与存在于植物二元载体中的稻肌动蛋白5'utr(seq id no:7)连接的强组成型csvmv启动子(verdaguer et al.(1996))和高粱hsp多聚腺苷酸化序列(seq id no:8)之间。gdi0005基因盒(seq id no:9)在图4中呈现。类似地,将编码gdi0006a加上n末端组氨酸tag的合成玉米密码子优化序列(seq id no:6)克隆到另一种植物载体中。gdi0006基因盒(seq id no:10)在图5中呈现。另外,将上述gdi0005a和gdi0006a植物表达盒一起克隆到同一植物二元载体中。
[0179]
根据komari et al.(1996),将得到的二元质粒转移到土壤杆菌菌株lba4404(psb1)中,提供菌株t11467(含有gdi0005)和t11466(含有gdi0006)和t11522(含有gdi0005a和gdi0006a)。使用标准烟草(本氏烟草(nicotiana benthamiana))土壤杆菌渗入(agroinfiltration)方案(基本上如https://bio-protocol.org/bio101/e95中所述),用单一菌株或单一基因株两者的共渗入瞬时转化叶扇区(leaf sector)。以类似的方式,将gdi0005a同源物和gdi0006a同源物瞬时转化到烟草中。
[0180]
从转化的烟草叶中提取总蛋白,并分别使用对seq id no:1具有特异性并能够识别gdi0005同源物的多克隆抗体或对seq id no:2具有特异性并能够识别gdi0006同源物的多克隆抗体,通过蛋白质印迹检测目的蛋白的表达。
[0181]
图9的蛋白质印迹显示蛋白质gdi0005a(seq id no:1)及其同源物gdi0175a(seq id no:11)、gdi0177a(seq id no:12)、gdi0179a(seq id no:13)、gdi0181a(seq id no:14)、gdi0183a(seq id no:15)、gdi0185a(seq id no:16)、gdi0187a(seq id no:17)在转
化烟草植物中表达。被特异性抗体识别的蛋白以53kda的预期大小累积。
[0182]
图10的蛋白质印迹显示蛋白质gdi0006a(seq id no:2)及其同源物gdi0176a(seq id no:18)、gdi0178a(seq id no:19)、gdi0180a(seq id no:20)、gdi0182a(seq id no:21)、gdi0184a(seq id no:22)、gdi0186a(seq id no:23)在转化烟草植物中表达。被特异性抗体识别的蛋白以53kda的预期大小累积,并通过纯化的gdi0006的大小确认。
[0183]
基本上如实施例4所述,将粗蛋白提取物也用于昆虫幼虫毒素活性测定。在处理后3天和5天评估幼虫的死亡率和发育迟缓率。
[0184]
实施例8:玉米植株转化
[0185]
基本上如ishida et al.(1996)所述,将实施例7中描述的植物二元构建体菌株t11467、t11466和t11522转化到玉米自交系a188中。还将菌株t11467和t11466共转化到玉米自交系a188中。每个构建体产生最少10个个体,单拷贝转化体或具有完整t-dna的共转化体。对t0叶材料进行qrt-pcr和蛋白质印迹分析。基本上如实施例4所述,将粗蛋白提取物用于昆虫幼虫毒素活性测定。
[0186]
在处理后3天和5天评估幼虫的死亡率和发育迟缓率。
[0187]
以类似的方式,在玉米中转化gdi0005同源物和gdi0006同源物。基本上如实施例4所述,将粗蛋白提取物也用于昆虫幼虫毒素活性测定。在处理后3天和5天评估幼虫的死亡率和发育迟缓率。
[0188]
实施例9:gdi0005a和gdi0006a在荧光假单胞菌(pseudomonas fluorescens)中的克隆和表达
[0189]
为了在荧光假单胞菌中表达gdi0005a和gdi0006a,将缺少编码n末端met和c末端密码子终止的序列的dna基因编码序列优化用于在荧光假单胞菌中表达(分别为seq id no:46和seq id no:47)。将这些序列克隆到pcom10克隆载体中,从而将n末端his tag编码序列与每个基因融合。将克隆转化到荧光假单胞菌中并在50ml体积的lb培养基中生长。加入二环丙基酮诱导蛋白表达。将培养物离心并重悬于1ml重悬浮缓冲液(tris 20mm ph8,nacl 150mm,dtt 1mm)中。用二氧化硅和玻璃珠机械裂解细胞。
[0190]
以类似的方式,将编码seq id no:11至seq id no:17的gdi0005a同源蛋白的核酸序列和编码seq id no:18至seq id no:24的gdi0006a同源蛋白的核酸序列进行优化以在假单胞菌中表达,并在荧光假单胞菌中表达。
[0191]
制备细菌裂解物用于昆虫幼虫活性测定。
[0192]
实施例10:从野生型菌株生产gdi0005a和gdi0006a蛋白
[0193]
为了从野生型菌株产生gdi0005a和gdi0006a蛋白或gdi0005a和gdi0006a同源蛋白,在每种菌株的最佳温度下,使实施例2的金黄杆菌属物种在200ml体积的丰富矿物质培养基中生长,进行或不进行通过与幼虫或昆虫的直接接触的诱导。在对数生长期和稳定生长期收获培养物并离心。用二氧化硅和玻璃珠机械裂解细胞并重悬于10ml新鲜培养基中。
[0194]
用培养物上清液(毒素分泌物)和裂解物进行杀虫活性生物测定,以评估杀虫蛋白对鞘翅目物种幼虫的影响。
[0195]
实施例11:用gdi0005a和gdi0006a或gdi0006同源物细菌裂解物进行易感鞘翅目生物测定
[0196]
将如实施例3所述获得的转化大肠杆菌制备成裂解物,并如实施例4所述进行测
molecular weight glutenin gene in transgenic tobacco.,the plant cell,1:569:578
[0224]
rogers,j.c.(1985)two barley alpha-amylase gene families are regulated differently in aleurone cells.j.biol.chem.260,3731
–
3738.
[0225]
sallaud c,rontein d,onillon s,jab
è
s f,duff
éꢀ
p,giacalone c,thoraval s,escoffier c,herbette g,leonhardt n,causse m,tissier a.(2009)a novel pathway for sesquiterpene biosynthesis from z,z-farnesyl pyrophosphate in the wild tomato solanum habrochaites.plant cell.21:301-17.
[0226]
sang,kim,myung,ryu,kim kim(2013)chryseobacterium kwangjuense sp.nov.,isolated from pepper(capsicum annuum l.)root,international journal of systematic and evolutionary microbiology 63:2835-2840
[0227]
shimomura,k;kaji,s;hiraishi,a(september 2005)."chryseobacterium shigense sp.nov.,a yellow-pigmented,aerobic bacterium isolated from a lactic acid beverage".international journal of systematic and evolutionary microbiology.55(pt 5):1903
–
6.doi:10.1099/ijs.0.63690-0.pmid 16166686.
[0228]
torrent m,llompart b,lasserre-ramassamy s,llop-tous i,bastida m,marzabal p,westerholm-parvinen a,saloheimo m,heifetz pb,ludevid md.(2009)eukaryotic protein production in designed storage organelles.bmc biol.7:5 doi:10.1186/1741-7007-7-5.
[0229]
verdaguer b,de kochko a,beachy rn,fauquet c.(1996).isolation and expression in transgenic tobacco and rice plants,of the cassava vein mosaic virus(cvmv)promoter.plant mol biol.31:1129-39
[0230]
von heijne g,hirai t,r-b,steppuhn j,bruce b,keegstra k,herrmann r(1991)chlpep—a database of chloroplast transit peptides.plant molecular biology reporter 9:104
–
126
[0231]
wong ey,hironaka cm,fischhoff da.(1992)arabidopsis thaliana small subunit leader and transit peptide enhance the expression of bacillus thuringiensis proteins in transgenic plants.plant mol biol.20:81-93.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1