用于无核遗传毒性化学治疗的改用型抗生素和包含其的用于抗癌的药物组合物
1.本发明涉及用于在对核基因损伤最小的情况下进行癌症治疗的经修饰的抗生素化合物和包含所述化合物的抗癌药物组合物。
背景技术:
2.世界各地的许多研究组致力于开发不同的药物递送系统,以在降低副作用的情况下提高现有抗癌药物的治疗作用,并且作为结果,成功开发了将现有的高毒性抗癌药物有效地递送至癌组织并使抗癌药物仅在癌症微环境中被激活的药物递送系统,实现了显著提高的癌症治疗安全性。
3.然而,尽管取得了这些技术性进步,但对具有获得性药物抗性的复发性和转移性癌症的治疗和抑制仍然是对于常规抗癌治疗仍然是挑战。90%的癌症死亡是由复发性癌症而不是原发性癌症导致的。患有过癌症的人即使在存活5年之后,在其一生中仍然具有非常高的癌症复发的可能性。特别地,儿科癌症患者的癌症复发的风险提高更多。最近已经报道了癌症复发自相矛盾地是由于使用抗癌药物引起的。
4.一般的化学治疗在癌细胞中抑制核dna的复制并导致核dna损伤,从而杀伤癌细胞。在这个过程中,突变发生,并将导致癌症复发。发现向2期胶质瘤患者施用替莫唑胺进行抗癌治疗导致更恶性(4期)的胶质瘤作为复发性癌症,并且在复发性癌症中检测到由抗癌药物替莫唑胺诱导的dna突变。
5.线粒体是具有其自己的不同于动物中细胞核的环状dna并以与原核细胞相同的方式分裂和融合的胞内细胞器。由于这些原因,线粒体的起源由内共生学说来解释,在内共生学说中,细菌在进化期间侵入宿主细胞并成为动物细胞中的线粒体。证据是线粒体如细菌一样具有其自己的环状dna,并且在结构和遗传上类似于细菌。大量研究揭示了,由于线粒体像细菌一样使用酶进行生物合成,因此主要靶向细菌的一些抗生素抑制线粒体功能,导致线粒体毒性,这是它们副作用的原因。已经尝试了通过反向使用抗生素的毒性来杀伤癌细胞。然而,抗生素在低浓度下对人细胞不表现出显著毒性,并且在高浓度下抑制癌细胞和正常细胞二者的分裂(但即使其对正常细胞更具选择性毒性),使得其基本不可能用作抗癌药物。即,研究结果仅限于抗生素对动物细胞的毒性。一些研究还揭示了,用高浓度抗生素处理癌症干细胞抑制了癌症生长。然而,抗生素对占总癌症体积99%的大量癌细胞没有作用,并且其抑制癌症干细胞的分裂和生长而不是杀伤癌症干细胞。即,这些研究仅表明抗生素的可能的治疗作用。
6.具有高线粒体质量和高线粒体膜电位的癌症干细胞可通过使用线粒体膜电位以递送药物并使药物在线粒体中积累的药物递送系统最有效地消除。特别地,不同于通过核dna损伤杀伤癌细胞的常规化学治疗,在癌细胞中选择性地靶向线粒体以进行有效的癌症治疗将在不导致遗传修饰的情况下预防癌症复发。
技术实现要素:
7.技术挑战
8.本发明旨在提供这样的经修饰的抗生素抗癌药物,其在不损伤正常细胞和正常干细胞的情况下选择性地杀伤癌细胞和癌症干细胞,并且在预定时间过去之后失去其靶向基团从而成为可从身体中安全地释放而没有次级毒性的简单的抗生素药物,因此可用于新癌症治疗策略以抑制癌症复发和转移并使可能的副作用的可能性最小化。
9.技术方案
10.本发明的一个方面提供了用于在对核基因损伤最小的情况下进行癌症治疗的经修饰的抗生素化合物,其由式1表示:
11.[式1]
[0012][0013]
下面将描述由式1表示的抗生素的结构和取代基。
[0014]
本发明的经修饰的抗生素抗癌化合物在癌细胞中使对核基因的损伤最小化并在癌细胞中选择性地靶向线粒体,并因此其在癌细胞中抑制线粒体电子传递链(etc)和线粒体dna合成。
[0015]
本发明的另一个方面提供了用于在对核基因损伤最小的情况下预防和治疗癌症疾病的药物组合物,其包括由式1表示的经修饰的抗生素化合物或其盐作为活性成分。
[0016]
有益效果
[0017]
本发明的经修饰的抗生素抗癌药物在癌细胞中选择性地靶向线粒体以表现出其治疗作用。因此,不同于用于通过核dna损伤来杀伤癌细胞的常规化学治疗,本发明的经修饰的抗生素抗癌药物可在不导致遗传修饰的情况下预防癌症复发。另外,本发明的化合物可用于提供线粒体靶向治疗以用于有效治疗由于获得性药物抗性而难以通过一般抗癌治疗来治疗的恶性肿瘤。
附图说明
[0018]
图1示出了在用本发明化合物(酯mt
‑
cfx)和商业抗生素(环丙沙星)处理之后转移性乳腺癌细胞(mda
‑
mb
‑
231)的生存力。
[0019]
图2示出了在用酯mt
‑
cfx和酰胺mt
‑
cfx处理之后转移性乳腺癌细胞(mda
‑
mb
‑
231)的生存力,所述酰胺mt
‑
cfx通过用酰胺基替代酯mt
‑
cfx的结合位点来获得,以得到更好的体内相容性。
[0020]
图3示出了在用本发明化合物(酯mt
‑
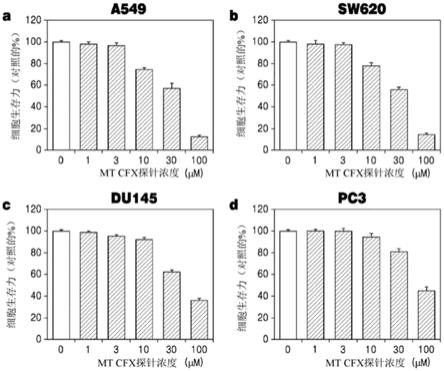
cfx)处理之后,多种癌细胞类型(包括a549(肺癌细胞)、sw620(结肠癌细胞)、du145(前列腺癌细胞)和pc3(前列腺癌细胞))的生存力。
[0021]
图4示出了由用荧光标记(amplex
‑
red和cm
‑
h2dcfda)标记的本发明化合物(酯mt
‑
cfx)进行的在细胞中的活性氧物质(reactive oxidativespecies,ros)的产生。
[0022]
图5示出了在用本发明化合物(酯mt
‑
cfx)处理之后线粒体dna合成的抑制和膜电
位的降低。
[0023]
图6示出了在用本发明化合物(酯mt
‑
cfx)处理之后产生的活性氧物质对dna、蛋白质和脂质的损伤程度。
[0024]
图7示出了在用本发明化合物(酯mt
‑
cfx)处理之后随时间推移的线粒体膜电位差的降低(jc
‑
1测定)和凋亡的发生(膜联蛋白v测定)。
[0025]
图8比较了本发明抗癌化合物(酯mt
‑
cfx)和商业抗癌药物(多柔比星(doxo))对核dna和线粒体dna的损伤程度。
[0026]
图9示出了在用本发明化合物(酯mt
‑
cfx)和商业抗癌药物(多柔比星(doxo))处理之后dna修复蛋白的表达水平(其中polγ是参与线粒体基因修复的蛋白质,并且ercc1和ddb2是参与核基因修复的蛋白质)。
[0027]
图10比较了酯mt
‑
cfx和对核dna造成损伤的常规抗癌药物对线粒体基因组dna的损伤程度,这通过taq1测定来确定。
[0028]
图11示出了在用本发明化合物(酯mt
‑
cfx)和常规商业抗癌药物(多柔比星、替莫唑胺、喜树碱、顺铂、苯丁酸氮芥和5
‑
fu)处理之后对核dna损伤病变和线粒体dna损伤病变的实时pcr的结果。
[0029]
图12示出了化合物(酯mt
‑
cfx)对肿瘤细胞的抑制作用,这使用乳腺癌移植模型,通过在注射化合物之后确定随时间推移的肿瘤靶向作用(体内成像)以及测量肿瘤体积和重量的时间依赖性变化来进行。
[0030]
用于实施本发明的最佳方式
[0031]
现在将更详细地描述本发明。
[0032]
本发明涉及用于抗癌治疗新概念的经修饰的抗生素药物,其可抑制由强遗传毒性导致的复发和转移,这是当前抗癌治疗的主要问题。
[0033]
本发明的经修饰的抗生素抗癌药物化合物由式1表示:
[0034]
[式1]
[0035][0036]
其中d是选自以下的高度稳定的氟喹诺酮抗生素的骨架:氟甲喹(flumequine)、奥索利酸(oxolinic acid)、罗索沙星(rosoxacin)、西诺沙星(cinoxacin)、萘啶酸(nalidixic acid)、吡咯米酸(piromidic acid)、吡哌酸(pipemidic acid)、环丙沙星(ciprofloxacin)、氟洛沙星(fleroxacin)、洛美沙星(lomefloxacin)、那氟沙星(nadifloxacin)、诺氟沙星(norfloxacin)、氧氟沙星(ofloxacin)、培氟沙星(pefloxacin)、芦氟沙星(rufloxacin)、依诺沙星(enoxacin)、巴洛沙星(balofloxacin)、格帕沙星(grepafloxacin)、左氧氟沙星(levofloxacin)、帕珠沙星(pazufloxacin)、司帕沙星(sparfloxacin)、替马沙星(temafloxacin)、托氟沙星(tosufloxacin)、克林沙星(clinafloxacin)、加替沙星(gatifloxacin)、莫西沙星(moxifloxacin)、西他沙星
(sitafloxacin)、普卢利沙星(prulifloxacin)、贝西沙星(besifloxacin)、吉米沙星(gemifloxacin)、曲伐沙星(trovafloxacin)、德拉沙星(delafloxacin)、达氟沙星(danofloxacin)、二氟沙星(difloxacin)、恩诺沙星(enrofloxacin)、依巴沙星(ibafloxacin)、马波沙星(marbofloxacin)、奥比沙星(orbifloxacin)和沙氟沙星(sarafloxacin)。
[0037]
x与氟喹诺酮抗生素的骨架的末端羟基连接,并且选自o、s和nr(其中r选自氢、c1‑
c
30
烷基、c6‑
c
30
芳基和c2‑
c
30
杂芳基),优选o或nr。
[0038]
l为与靶向基团的连接基团,并且选自c1‑
c
30
烷基、c2‑
c
30
烯基和聚亚烷基二醇基团。
[0039]
q是选自n、p、as和sb的第15族元素;r1至r3彼此相同或不同,并且各自独立地选自c1‑
c
30
烷基、c2‑
c
30
烯基、c6‑
c
30
芳基和c2‑
c
30
杂芳基。
[0040]
并且a
‑
是选自以下的阴离子:卤素、羟基、羧酸根、硫酸根、氨基磺酸根、磺酸根、磷酸根、膦酸根、硼酸根和(聚)乙烯氧基阴离子。
[0041]
本发明的经修饰的抗生素抗癌药物化合物使用高度稳定的抗生素的骨架作为基本结构,并且被设计为选择性地靶向线粒体,实现了增强的抗癌治疗效力。另外,本发明的经修饰的抗生素抗癌药物化合物在线粒体靶向基团在体内被水解之后成为安全的抗生素药物,导致最小的副作用。当x为酰胺基(nr)时,确保了由式1表示的化合物更好的在体内的稳定性。
[0042]
根据本发明的一个示例性实施方案,式1化合物选自但不限于:
[0043]
[酯mt
‑
cfx]
[0044][0045]
其中n为1至30的整数并且a
‑
如式1中所限定;和
[0046]
[酰胺mt
‑
cfx]
[0047][0048]
其中n和a
‑
如上所限定。式1化合物具有作为氟喹诺酮抗生素的环丙沙星的骨架。在随后的实施例部分中,n为6并且a
‑
为氯阴离子。酰胺mt
‑
cfx是通过用酰胺基替代酯mt
‑
cfx的结合位点而获得的化合物,以得到更好的体内稳定性。
[0049]
本发明还涉及用于预防和治疗癌症疾病的药物组合物,其包含由式1表示的经修
饰的抗生素抗癌化合物或其盐作为活性成分。
[0050]
本发明的药物组合物可用于预防和治疗广泛多种的癌症疾病,例如原发性癌症及其转移性癌症。癌症疾病的一些实例包括但不限于乳腺癌、肺癌、结肠癌、前列腺癌,及其转移性癌症。
[0051]
本发明的药物组合物可在施用之前与用于预防或治疗癌症疾病的其他已知药物复合,或者还可包含选自以下的一种或更多种另外的添加剂:载体、稀释剂、辅料和稳定剂。
[0052]
根据本发明的组合物的剂型可取决于所期望的施用方式而变化。这样的剂型的一些实例包括但不限于固体、半固体和液体制剂,例如片剂、丸剂、散剂、胶囊剂、凝胶剂、软膏剂、乳剂和混悬剂。本发明的组合物可以以适合于单次施用精确剂量的单位剂型施用。本发明的组合物可经口或肠胃外施用。对于肠胃外施用,本发明的组合物可静脉内、皮下或肌内施用。
[0053]
取决于所期望的制剂,组合物还可包含一种或更多种可药用的载体、稀释剂、辅料和稳定剂,它们被定义为通常用于配制用于人施用的药物组合物的基于水的载剂。
[0054]
术语“载体”意指促进化合物并入到细胞或组织中的物质。合适的载体的一些实例包括但不限于基于碳水化合物的化合物(例如乳糖、直链淀粉、右旋糖、蔗糖、山梨糖醇、甘露糖醇、淀粉和纤维素)、阿拉伯胶、磷酸钙、藻酸盐、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、糖浆剂、盐溶液、醇类、阿拉伯胶、植物油(例如玉米油、棉籽油、大豆油、橄榄油和椰子油)、聚乙二醇、甲基纤维素、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁和矿物油,它们通常用于配制药物组合物。术语“稀释剂”被定义为在水中稀释的物质,其可溶解目的化合物并使化合物的生物活性形式稳定化。合适的稀释剂的一些实例包括蒸馏水、生理盐水、林格溶液、右旋糖溶液和hank溶液。稳定剂可选自蛋白质、碳水化合物、缓冲剂,及其混合物。本发明的组合物还可任选地包含一种或更多种添加剂。这样的任选的添加剂的一些实例包括但不限于润滑剂、润湿剂、甜味剂、矫味剂、乳化剂、助悬剂和防腐剂。
[0055]
这样的另外的添加剂例如载体、稀释剂、辅料和稳定剂可以以有效获得在活性成分的溶解度、生物活性和其它特征等方面可药用的制剂的量使用。
具体实施方式
[0056]
将参考以下实施例更具体地解释本发明。本领域技术人员将理解,这些实施例仅是举例说明性的并且本发明的范围不限于此。
[0057]
合成例1:酯mt
‑
cfx的合成
[0058]
根据方案1合成酯mt
‑
cfx:
[0059]
[方案一]
[0060][0061]
方案1中所示的化合物1和2根据本领域已知的方法合成。
[0062]
(1)化合物3的合成
[0063]
将化合物1(1g,1.975mmol)和化合物2(852mg,1.975mmol)溶解在作为溶剂的二甲基甲酰胺中,并随后向其中缓慢添加碳酸钾(819mg,5.925mmol)。将混合物在50℃下搅拌12小时。将反应混合物在减压下蒸发以去除溶剂。将残余物通过柱色谱进行纯化并溶解在甲醇和蒸馏水(1/9)的50ml混合溶液中。向溶液添加nabf4,随后搅拌1小时。将反应混合物用二氯甲烷和蒸馏水萃取并将其溶解在甲醇中。在添加1
×
8氯化物之后,将所得混合物搅拌6小时。将反应混合物过滤并蒸发以去除溶剂。
[0064]
(2)酯mt
‑
cfx的合成
[0065]
将化合物3溶解在1,4
‑
二氧六环和二氯甲烷(4/1)的18ml混合溶液中,并随后在0℃下向其中逐滴添加6ml在二氧六环中的4n hcl。将混合物在室温下搅拌12小时。通过在减
压下蒸发将溶剂去除,得到酯mt
‑
cfx。
[0066]1h nmr(cdcl3,500mhz):δ8.50(s,1h),7.87
‑
7.70(m,15h),7.66(d,j=13.1hz,1h),7.36(d,j=7.1hz,1h),4.29
‑
4.23(m,2h),3.69
‑
3.60(m,2h),3.59
‑
3.53(m,1h),3.50
‑
3.42(m,4h),3.30
‑
3.20(m,4h),1.78
‑
1.65(m,6h),1.61
‑
1.53(m,2h),1.39(d,j=5.9hz,2h),1.14
‑
1.07(m,2h)ppm.
[0067]
合成例2:酰胺mt
‑
cfx的合成
[0068]
根据方案2合成酰胺mt
‑
cfx:
[0069]
[方案二]
[0070]
cacl2、1.22mm mgso4、5.5mm葡萄糖,ph7.35)中制备50μmred试剂和0.1u/ml hrp的反应混合物。向每个板孔添加100μl反应混合物,随后在37℃下孵育10分钟。使用微板读取仪在530至560nm激发波长和590nm发射波长下测量荧光亮度。将mda
‑
mb
‑
231细胞系接种到共焦皿中。将细胞用10μm酯mt
‑
cfx处理48小时,随后与10μm cm
‑
h2dcfda染料孵育30分钟。cm
‑
h2dcfda染料是细胞中活性氧物质的已知标志物。细胞中产生的活性氧物质的荧光通过共焦激光扫描显微术在492至495nm激发波长和517至527nm发射波长下成像。
[0086]1‑
4.dna氧化测量
[0087]
使用市售8
‑
ohdg elisa试剂盒通过酶联免疫测定来分析氧化应激引起的胞内dna氧化。在将mda
‑
mb
‑
231细胞用10μm酯mt
‑
cfx和10μm cfx处理48小时之后,将样品与一抗在37℃下以及与二抗在37℃下孵育1小时。使经孵育的样品在室温下静置15分钟以显色。使用多板读取仪在450nm下测量所得溶液的吸光度值。
[0088]1‑
5.蛋白质羰基化测量
[0089]
已知蛋白质羰基是氧化应激的重要生理标志物,并且活性氧物质(ros)易于损伤胞内蛋白质。通过elisa确定蛋白质羰基化。在将mda
‑
mb
‑
231细胞用10μm酯mt
‑
cfx和10μm cfx处理48小时之后,用10μl10%(w/v)sds使来自每个样品的10μl 1μg/μl的蛋白质裂解物变性并用在tpa中制备的20μl 20mm的2,4
‑
二硝基苯肼(dnph)溶液使其衍生化。在于室温下孵育10分钟且每2分钟进行涡旋之后,用20μl的2m tris
‑
cl中和反应产物。将dnp衍生化样品的3μl等分试样用0.25ml吸附缓冲液(20mm nahco3、150mm nacl、0.25%sds,ph 8.5)稀释,并将100μl经稀释样品加载到96孔板上。将板用铝箔覆盖并在4℃下孵育过夜。在孵育之后,将样品孔用pbst(0.5%吐温20)冲洗5次,并且与200μl封闭缓冲液(吸附缓冲液中1%bsa)在37℃下孵育1小时。然后将样品孔与包含山羊抗dnp抗体的100μl封闭缓冲液在室温下孵育1小时。在孵育之后,将样品孔用pbst冲洗5次,并且与hrp缀合的兔抗山羊igg抗体在室温下孵育1小时。在用pbst洗涤5次之后,将标准孔与100μl tmb底物在室温下孵育2至3分钟以显色。用100μl的0.5m h2so4终止反应,并且在450nm和690nm下测量吸光度。在减去690nm下的背景吸光度之后,使用氧化的bsa标准品的标准曲线来确定每个样品中的羰基含量。
[0090]1‑
6.脂质过氧化测量
[0091]
脂质过氧化是细胞损伤机制的标志之一并且可通过测量丙二醛(malondialdehyde,mda)(脂质过氧化的产物)来确定。在将mda
‑
mb
‑
231细胞用10μm酯mt
‑
cfx和10μm cfx处理48小时之后,将1mg/ml的每个样品置于磷酸缓冲液中并且在恒温浴中于37℃下孵育6小时。将0.5ml 0.75%硫代巴比妥酸添加至10μl用10%tca淬灭的丁基化羟基甲苯(butylated hydroxytoluene,bht)的混合溶液中。将混合物在95℃下加热20分钟,冷却并且以780
×
g离心10分钟。使用多板读取仪在532nm下测量所得溶液的吸光度。
[0092]1‑
7.facs测量
[0093]
通过流式细胞术来分析膜联蛋白v阳性凋亡细胞。为此,将mda
‑
mb
‑
231细胞用10μm酯mt
‑
cfx处理不同的时间段(0、6、12和24小时)并且培养指定的时间段。收获细胞,将其用冰冷的pbs洗涤两次,置于bd facs管(106/ml)中,并且用包含10%fbs的pbs中的10μg/ml膜联蛋白v在室温下培养30分钟。随后,将细胞用冰冷的pbs洗涤,并且使用facscalibur流式细胞仪(bd,usa)在fl
‑
1通道中测量膜联蛋白v荧光。
[0094]1‑
8.线粒体膜电位测量
[0095]
测量线粒体膜电位差。为此,将mda
‑
mb
‑
231细胞用10μm酯mt
‑
cfx处理不同的时间段(0、6、12和24小时)并且培养指定的时间段。收获细胞,将其用冰冷的pbs洗涤一次,并且与2m 5,5’,6,6
’‑
四氯
‑
1,1’,3,3
’‑
四乙基
‑
苯并咪唑基碳菁氯化物(jc
‑
1)在37℃下培养20分钟。将经jc
‑
1染色的细胞以1,300g离心3分钟,并用冰冷的pbs洗涤两次。在不同波长段中测量jc
‑
1单体(绿色通道)和聚集体(红色通道)的线粒体膜电位。
[0096]1‑
9.实时pcr分析
[0097]
使用trizol溶液从每个样品中提取rna。将从分离的rna合成的cdna或使用基因组dna分离试剂盒提取的胞内基因组dna用于实时聚合酶链反应(pcr)。将实时pcr数据通过甘油醛
‑3‑
磷酸脱氢酶(gapdh)的表达进行归一化。将相对表达水平表示为相对于对照的倍数变化。结果(平均值
±
se)以一式三份获得,并且p值<0.05被认为是统计学上显著的。
[0098]1‑
10.动物准备
[0099]
使用了称重为18至20g的五周龄免疫缺陷型雄性balb/c
‑
nu
‑
nu小鼠(orient bio,korea)。将动物在基于12小时光/暗循环维持30至40%湿度和22
±
1℃温度的设施中育种并饲养。所有动物实验均由韩国大学动物研究伦理委员会批准。根据伦理委员会批准的方案处理动物。
[0100]1‑
11.体内小鼠异体移植模型
[0101]
将mda
‑
mb
‑
231细胞(5
×
106个细胞)皮下注射到称重为18至20g的6周龄免疫缺陷型balb/c
‑
nu
‑
nu小鼠中以建立荷瘤小鼠模型。将环丙沙星和酯mt
‑
cfx每周3次地静脉内注射到所建立的荷瘤小鼠模型中。每周测量肿瘤长轴和短轴的长度。在每种化合物的第一次注射之后12周,处死小鼠并收集肿瘤样品用于进一步分析。结果示出为每组中4只小鼠的肿瘤的平均值
±
se。每个星号(*)表示与相应对照的显著性差异。
[0102]1‑
12.体内荧光成像
[0103]
评价了酯mt
‑
cfx的肿瘤靶向能力和酯mt
‑
cfx在每个器官中的分布。使用ivis lumina series iii preclinical成像系统(perkinelmer co.,usa),在通过尾静脉将2μmol/kg酯mt
‑
cfx注射到荷瘤小鼠中之后1小时至48小时获得体内光谱荧光图像。在560nm的激发波长下测量用于获得体内图像的滤光片。使用多激发光谱分析功能对荧光图像去卷积。
[0104]1‑
13.统计学分析
[0105]
从以一式三份进行的三个独立实验中计算每组的平均值和标准误差(se)。使用sas软件(版本9.0,cary)通过单因素方差分析(anova)评价组间的统计学上显著性差异。当anova显示出显著性差异时,使用student’s t检验进行组平均值的比较。p值<0.05被认为是统计学上显著的。
[0106]
实验结果
[0107]
(1)市售的抗生素环丙沙星对mda
‑
mb
‑
231转移性乳腺癌细胞几乎没有或没有凋亡作用。相比之下,具有靶向基团的本发明化合物酯mt
‑
cfx显示出对mda
‑
mb
‑
231细胞的强凋亡作用,其中ic
50
为约15μm(图1)。
[0108]
图1示出了mda
‑
mb
‑
231肿瘤细胞系(韩国细胞系库)的生存力。mda
‑
mb
‑
231是三阴性乳腺癌细胞系。目前,没有可有效地治疗三阴性乳腺癌的抗癌药物。将细胞在补充有10%
fbs的dmem中在37℃和5%co2下培养。通过ldh测定来确定细胞毒性。将细胞在皿中培养约24小时使得其保持稳定地黏附至皿底部,随后用抗生素环丙沙星和本发明的酯mt
‑
cfx处理48小时。作为重复实验的结果,估计环丙沙星的ic
50
为1.65m并且酯mt
‑
cfx的ic
50
为20至30μm,表明酯mt
‑
cfx针对癌细胞的凋亡活性比环丙沙星的凋亡活性高约55,000倍。总之,本发明的抗癌药物对三阴性乳腺癌具有优异的抗癌作用。
[0109]
(2)为了更好的体内稳定性,通过使酯mt
‑
cfx的结合位点(酯基)转化为酰胺基来合成酰胺mt
‑
cfx。酰胺mt
‑
cfx对癌细胞的凋亡作用经证实类似于酯mt
‑
cfx的凋亡作用(图2)。
[0110]
对于本发明的酰胺mt
‑
cfx,重复了与针对酯mt
‑
cfx(图1)所述的相同的实验程序。结果示于图2中。本发明的酰胺mt
‑
cfx也显示出对癌细胞的增强的凋亡作用。
[0111]
(3)本发明的化合物酯mt
‑
cfx和酰胺mt
‑
cfx显示出对多种癌细胞类型的凋亡作用,所述癌细胞类型包括a549(肺癌细胞)、sw620(结肠癌细胞)、du145(前列腺癌细胞)和pc3(前列腺癌细胞)以及mda
‑
mb
‑
231转移性乳腺癌细胞,表明了其广泛的适用性(图3)。
[0112]
为了证明本发明抗癌药物对多种癌细胞类型的适用性,对a549、du145、sw620和pc3肿瘤细胞系(韩国细胞系库)重复了与针对mda
‑
mb
‑
231转移性乳腺癌细胞(图1)所述的相同实验程序。结果示于图3中。发现本发明抗癌药物对多种癌细胞类型是有效的。特别地,本发明抗癌药物对a549和sw620的ic
50
值分别为23.77μm和27.05μm。
[0113]
(4)本发明的经修饰的抗生素mt
‑
cfx的抗癌作用可通过以下两种机制来解释:(i)化合物mt
‑
cfx在线粒体中积累以抑制电子传递链(etc),因此其产生了活性氧物质(图4),以及(ii)抑制线粒体dna合成(图5)。
[0114]
图6示出了在本发明化合物酯mt
‑
cfx处理之后产生的活性氧物质对dna、蛋白质和脂质的损伤程度。图7示出了在用本发明化合物酯mt
‑
cfx处理之后随时间推移的线粒体膜电位差的降低(jc
‑
1测定)和凋亡的发生。
[0115]
(5)图8通过比较本发明抗癌化合物酯mt
‑
cfx和商业抗癌药物(多柔比星(doxo))对核dna和线粒体dna的损伤程度,示出了本发明抗癌化合物酯mt
‑
cfx对核基因的无毒性。作为结果,多柔比星显示出对核基因的强毒性,而本发明的抗癌化合物酯mt
‑
cfx显示出对核基因的无毒性和对线粒体基因的选择性毒性。
[0116]
图9示出了在用本发明化合物酯mt
‑
cfx和商业抗癌药物(多柔比星(doxo))处理之后dna修复蛋白的表达水平(其中polγ是参与线粒体基因修复的蛋白质并且erccl和ddb2是参与核基因修复的蛋白质)。图10揭示了不同于商业抗癌药物,本发明的酯mt
‑
cfx靶向线粒体,这通过taq1测定来确定。
[0117]
在用本发明的酯mt
‑
cfx和多种抗癌药物处理之后,通过pcr来分析dna损伤病变。结果示于图11中。商业抗癌药物在核基因中导致许多突变而酯mt
‑
cfx诱导线粒体突变。
[0118]
(6)通过体内实验确定了本发明荧光抗癌化合物酯mt
‑
cfx仅在癌组织中选择性地积累。与用对照进行的处理相比,用本发明抗癌化合物酯mt
‑
cfx进行的处理使得癌症体积显著降低,表明本发明抗癌化合物酯mt
‑
cfx对癌症具有优异的治疗作用(图12)。
[0119]
工业实用性
[0120]
本发明的经修饰的抗生素抗癌药物在癌细胞中选择性地靶向线粒体以表现出其治疗作用。因此,不同于通过核dna损伤来杀伤癌细胞的常规化学治疗,经修饰的抗生素抗
癌药物可在不导致遗传修饰的情况下预防癌症复发。另外,本发明的经修饰的抗生素抗癌药物可有效地治疗由于获得性药物抗性而难以通过一般抗癌治疗来治疗的恶性肿瘤。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1