用于电穿孔的装置、方法和系统与流程
用于电穿孔的装置、方法和系统
1.相关申请的交叉引用
2.本技术要求2019年5月16日提交的美国临时专利申请序列号62/848,944的申请日的权益;所述专利申请特此以引用方式整体并入。
背景技术:
3.在医学和生物医学研究中,通常需要将生物活性分子插入选择活细胞中。这些分子可以是用来治疗特定疾病的药物,但一个重要的应用是插入核酸分子诸如dna和rna,这通常称为转染或转化。所插入的核酸分子可用作疫苗,可实现特定蛋白质的细胞产生,或者可用于重编程人类免疫系统细胞以攻击肿瘤或致病细胞。在此类应用中,至关重要的是将足够的dna或rna或核酸蛋白复合物插入细胞中而不会造成可能杀死细胞的损伤。对过程的控制很重要,并且不同类型的细胞的过程参数通常不同。对于细胞转化过程而言,可靠地、可重复地并以足够的速度操作以在尽可能短的时间内转化所需数量的细胞也是重要的。
4.称为电穿孔或电通透的方法几十年来用作在细胞膜中以电的方式打开孔以允许分子进入细胞中的方法。在此方法中,通过向插入包含悬浮在液体溶液中的细胞的液体容器中的电极施加高压电脉冲来产生电场,所述液体溶液包含要插入细胞中的分子。所施加的高压脉冲在细胞膜中产生允许分子进入细胞中的暂时性孔。然而,开孔也允许细胞内含物逸出并且允许不期望的分子扩散到细胞中,对细胞的健康产生负面影响。脉冲电压、脉冲数目和脉冲持续时间属于根据经验变化以优化分子插入和细胞存活的效率的参数。然而,当前装置的局限性在于细胞和分子暴露于大范围的电场,从而通常在电穿孔期间致使生物活性分子不能高效地转移和/或许多细胞受损或死亡。当前装置还缺乏对过程参数的控制;因此,过程无法对各种细胞类型和生物活性分子进行控制和优化。此外,当前装置具有有限的吞吐量。这些缺点限制了此方法的广泛应用。
5.已通过使具有活细胞和生物活性分子的溶液流动通过具有电极的容器来对吞吐量作出一些改善。例如,choi等人的公开(2010)提出一种用于将嵌合抗原受体引入人t细胞以重定向其特异性的高吞吐量微电穿孔装置。此外,美国专利号4,752,586;5,612,207;6,074,605;以及6,090,617(每个专利以引用方式并入)涉及利用用于处理大量细胞的流的电穿孔。这些装置引入流来填充和清空电穿孔室,但分子转化的效率以及细胞的潜在裂解仍然是个问题。
6.美国专利申请公开2014/0066836(以引用方式并入)公开一种电穿孔装置,其包括可移动电极以在电极与细胞之间实现更具体的空间配置。然而,细胞驻留在装置中或体内的本体溶液中。因此,暴露于精确场强度的细胞的数量是有限的。
7.当前的电穿孔方法还存在另外的实际限制。例如,需要高电压,并且经常需要脉冲输送电压以允许细胞在电压暴露之间恢复。另外,当前装置允许仅在单一、均质流体环境中对细胞进行穿孔。此外,当前装置排除在细胞运动和电穿孔过程发生时光学地或以电的方式对其进行监测的能力。
8.目前,现有技术缺乏用于通过以允许控制影响电穿孔效率的各种参数的方式进行
电穿孔来将生物活性分子引入流动的活细胞中的系统、方法和装置。
技术实现要素:
9.根据本公开的一个方面,提供一种能够将生物活性分子插入活细胞中的装置,所述装置包括:平面流体通道,所述平面流体通道包括被构造来允许包括活细胞和生物活性分子的流体流通过所述通道的至少一个流体输入端和一个流体输出端;以及电极,所述电极位于所述流体通道的相对侧上,可向所述电极施加电势以形成跨所述流体通道引导的时变电场,其中不同电极可维持在不同电势处以在所述通道内提供空间变化的电场。在一个实施方案中,第一电极与第二电极之间的距离使得细胞能够以单层形式穿过电极之间的空间,因此当流体流中的活细胞和流体流中的其他活细胞穿过平面通道时,所述活细胞维持在与所述其他活细胞类似的位置中,其方式为防止一个活细胞遮蔽另一个活细胞而使其受不到所施加电场的作用,其中活细胞所暴露于的所述电场的强度足以在活细胞的膜内形成生物活性分子可通过其穿越细胞膜的孔,但不会裂解活细胞。此外,可在贯穿通道的时间和位置上控制电场,以为装置吞吐量、细胞活力和转染效率创建最有利的条件。所公开的装置可并入用于制造用于治疗性用途的细胞的多个系统中,并且可被用于研究开发新的基于细胞的治疗性方法。
10.根据本公开的另一个方面,提供一种能够将生物活性分子插入活细胞中的装置,所述装置包括:流体平面通道,所述流体平面通道包括流体通道,所述流体通道包括被构造来独立地控制通过通道的包括活细胞、生物活性分子和化学溶液的流体束流中的组成和流体流速的至少两个流体输入端和一个流体输出端;以及电极,所述电极位于所述流体通道的相对侧上,可向所述电极施加电势以形成跨所述流体通道引导的时变电场和空间变化的电场,其中所述流体通道的尺寸和两个或更多个层流鞘流体束流足以迫使细胞主要以单层形式穿过电极之间的空间,因此当流体流中的活细胞和流体流中的其他活细胞穿过第一电极和第二电极之间的电场时,所述活细胞维持在与所述其他活细胞类似的位置中,其方式为防止一个活细胞遮蔽另一个活细胞而使其受不到所施加电场的作用,其中活细胞所暴露于的所述电场的强度足以在活细胞的膜内形成生物活性分子可通过其穿越细胞膜的孔,但不会裂解活细胞。
11.根据本公开的另一个方面,提供用于流体通道装置的设计和用于通过诸如注塑成型和结合的高效方法来制造平面流体通道装置的方法。还提出用于联接圆柱形管或管道以将流体从泵和流体控制系统传送到多通道装置中的设计。
12.根据本公开的另一个方面,提供在细胞电穿孔系统的上游整合用于细胞分选或细胞分离的装置的平面微流体装置和系统的设计。在此实施方案中,可选择期望电镀的特定细胞类型,从而提高过程的效率或从过程去除不期望的细胞。
13.根据本公开的另一个方面,提供用于利用平面多流装置来修饰细胞以用于医疗应用的系统和方法。在一个实施方案中,通过流体流和电参数的受控变化来修饰来自人或动物血液的细胞,以高效地确定生物分子的特定组合的最优条件以实现细胞修饰的效率和细胞活力。在一个实施方案中,通过优化条件来修饰来自患者血液的t细胞以快速地用于治疗性给药。
14.在一些实施方案中,本发明涉及利用周期性时间相关电压特性电激活基于流的电
穿孔系统中的电极,以提高细胞电穿孔的有效性并减轻电极上的表面电荷和反应的问题。本发明的这一方面明显不同于使批量细胞暴露于一个或几个电压脉冲的标准实践。在一些实施方案中,以连续方式利用规定的电压波形,使得在通道中流动液体中移动的细胞将在不同时间处经历不同电压。
15.在一些方面,电穿孔装置包括:第一侧支撑件,所述第一侧支撑件具有设置在所述第一侧支撑件的内表面区域处的至少一个第一侧电极;第二侧支撑件,所述第二侧支撑件具有设置在所述第二侧支撑件的内表面区域处的至少一个第二侧电极,其中所述至少一个第二侧电极是所述至少一个第一侧电极的配对电极;以及流体通道,所述流体通道的至少一部分位于所述第一侧支撑件与所述第二侧支撑件之间,并且所述流体通道具有至少一个流体输入端和至少一个流体输出端,其中所述流体通道允许流体在至少一个流体束流中朝向所述至少一个流体输出端连续地流动,其中所述至少一个第一侧电极和所述至少一个第二侧电极定位在所述电穿孔装置中,以允许在所述流体通道的位于所述第一侧支撑件与所述第二侧支撑件之间的至少一个部段(part)(例如,至少两个部段、至少三个部段、至少四个部段、至少五个部段、至少六个部段)中作为时间和位置的预定函数调节电场。
16.在一些实施方案中,第一侧支撑件上的任何电极与第二侧支撑件上的所述任何电极的配对电极中的任何一个之间的最短距离为至多1毫米(例如,至多50毫米、100毫米、150毫米、200毫米、250毫米、300毫米、350毫米、400毫米、450毫米、500毫米、550毫米、600毫米、650毫米、700毫米、750毫米、800毫米、850毫米、900毫米、950毫米或1000微米)。在其他实施方案中,此距离可进一步增大(例如,增大到2毫米或更大),伴随有电压的增大(例如,对于10毫米的距离,增大到500v)以在流体通道内实现类似的电场。
17.在一些实施方案中,所述电穿孔装置还包括:至少一个电压供应器,其中所述至少一个第一侧电极和所述至少一个第一侧电极的所述配对电极独立于所述电穿孔装置的任何其他电极连接到所述电压供应器,并且其中所述电压供应器允许在所述流体通道的所述至少一个部段(例如,至少两个部段、至少三个部段、至少四个部段、至少五个部段、至少六个部段)中作为时间的函数调节电场。在一些实施方案中,所述电穿孔装置具有多个第一侧电极,所述多个第一侧电极包括所述至少一个第一侧电极,并且包括多个第二侧电极,所述多个第二侧电极包括所述至少一个第二侧电极,其中至少两组配对电极彼此独立地操作。在某些实施方案中,至少三组配对电极彼此独立地操作。在一些实施方案中,所述电穿孔装置还包括:一个或多个另外的电压供应器,其中每个电压供应器连接到所述电穿孔装置中的一组不同的配对电极。在某些实施方案中,所述电压供应器允许作为时间和所述流体通道内的位置的函数形成电场,所述电场最大化与细胞转染效率正相关并且与细胞死亡率负相关的结果函数。在某些实施方案中,所述电压供应器允许作为时间和所述流体通道内的位置的函数形成电场,所述电场最大化与电极耐久性正相关的结果函数。在某些实施方案中,所述电压供应器允许独立地控制以下各项中的任何两者或更多者:(a)在所述流体通道中的流体中的细胞中打开孔;(b)将分子驱动到所述流体通道中的流体中的细胞中;(c)测量所述流体通道中的流体的电性质;(d)将分子集中在所述流体通道的一个部段处;(e)将所述流体通道中的流体中的细胞移动到所述流体通道的一个部段;以及(f)使所述流体通道中的流体中的细胞旋转。
18.在一些实施方案中,所述电压供应器提供具有周期性波形的电压。在某些实施方
案中,所述周期性波形是时间的正弦函数,其中所述正弦函数具有从零开始至多50伏特的绝对振幅、至少10hz且至多100khz的频率以及至少0且至多2π的相位。在一些实施方案中,所述周期性波形具有第一频率和不同于所述第一频率的第二频率。在一些实施方案中,所述周期性波形是傅立叶级数。在一些实施方案中,所述周期性波形是具有至少0.1v且至多100v的电压振幅和至少100hz且至多1thz的频率的方形波形。在一些实施方案中,所述方形波形是双极的。在一些实施方案中,所述方形波形还包括至多
±
10v的直流分量。
19.在某些实施方案中,所述第一侧支撑件的所述内表面和所述第二侧支撑件的所述内表面是基本上平面的。在一些实施方案中,所述流体通道的所述部分具有面向第一侧的第一表面和面向第二侧的第二表面,并且其中所述第一表面和所述第二表面两者是基本上平面的。在一些实施方案中,所述作为时间和位置的预定函数调节所述电场动态地控制所述电场而无需离散电脉冲。在一些实施方案中,所述流体通道包括至少两个流体输入端。在一些实施方案中,所述流体通道允许来自所述至少两个流体输入端的流体层流。
20.在一些实施方案中,所述流体通道的位于所述第一侧支撑件与所述第二侧支撑件之间的所述部分的平均宽度是所述流体通道的位于所述第一侧支撑件与所述第二侧支撑件之间的所述部分的平均高度的至少10倍且至多1000倍(例如,20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、150倍、200倍、250倍、300倍、350倍、400倍、450倍、500倍、550倍、600倍、650倍、700倍、750倍、800倍、850倍、900倍、950倍),所述平均宽度如沿着基本上平行于所述第一侧支撑件和所述第二侧支撑件并且垂直于所述至少一个流体束流的流动的方向所测量,所述平均高度如沿着基本上垂直于所述第一侧支撑件和所述第二侧支撑件并且平行于所述至少一个流体束流的流动的方向所测量。
21.在一些方面,电穿孔装置包括:第一侧支撑件,所述第一侧支撑件具有设置在所述第一侧支撑件的内表面区域处的至少一个第一侧电极;第二侧支撑件,所述第二侧支撑件具有设置在所述第二侧支撑件的内表面区域处的至少一个第二侧电极,其中所述至少一个第二侧电极是所述至少一个第一侧电极的配对电极;以及流体通道,所述流体通道的至少一部分位于所述第一侧支撑件与所述第二侧支撑件之间,并且所述流体通道具有至少两个流体输入端和至少一个流体输出端,其中所述流体通道允许流体在至少两个流体束流中朝向所述至少一个流体输出端连续地流动,其中所述流体通道允许作为时间、位置或时间和位置两者的预定函数调节所述至少两个流体束流中的流速、化学组成或流速和化学组成两者。
22.在此类电穿孔装置的一些实施方案中,第一侧支撑件上的任何电极与第二侧支撑件上的所述任何电极的配对电极中的任何一个之间的最短距离为至多1毫米(例如,至多50毫米、100毫米、150毫米、200毫米、250毫米、300毫米、350毫米、400毫米、450毫米、500毫米、550毫米、600毫米、650毫米、700毫米、750毫米、800毫米、850毫米、900毫米、950毫米或1000微米)。在其他实施方案中,此距离可进一步增大(例如,增大到2毫米或更大),伴随有电压的增大(例如,对于10毫米的距离,增大到500v)以在流体通道内实现类似的电场。
23.在一些实施方案中,所述电穿孔装置还包括:至少一个流体供应器,其中所述流体供应器允许独立于所述流体通道内的任何其他流体束流作为时间、位置或时间和位置两者的预定函数调节所述至少两个束流之一中的流速和化学组成。在一些实施方案中,所述电穿孔装置还包括:一个或多个另外的流体供应器,其中每个流体供应器连接到所述流体通
道中的不同流体输入端。在某些实施方案中,所述流体供应器允许作为时间和所述流体通道内的位置的函数调节单独流体束流中的流速和化学组成,以最大化流体束流中的细胞处于其最佳培养基中的时间。在某些实施方案中,所述流体供应器允许作为时间和所述流体通道内的位置的函数调节单独流体束流中的流速和化学组成,以最小化流体束流中的细胞处于电穿孔介质中的时间。在某些实施方案中,所述流体通道具有至少三个流体输入端,允许流体在至少三个流体束流中朝向所述至少一个流体输出端连续地流动。在某些实施方案中,所述第一侧支撑件的所述内表面和所述第二侧支撑件的所述内表面是基本上平面的。在一些实施方案中,所述流体通道的所述部分具有面向所述第一侧的第一表面和面向所述第二侧的第二表面,并且其中所述第一表面和所述第二表面两者是基本上平面的。在某些实施方案中,所述作为时间、位置或时间和位置两者的预定函数调节所述至少两个流体束流中的流速、化学组成或流速和化学组成两者动态地控制电穿孔过程。
24.在此类电穿孔装置的一些实施方案中,所述流体通道的位于所述第一侧支撑件与所述第二侧支撑件之间的所述部分的平均宽度是所述流体通道的位于所述第一侧支撑件与所述第二侧支撑件之间的所述部分的平均高度的至少10倍且至多1000倍(例如,20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、150倍、200倍、250倍、300倍、350倍、400倍、450倍、500倍、550倍、600倍、650倍、700倍、750倍、800倍、850倍、900倍、950倍),所述平均宽度如沿着基本上平行于所述第一侧支撑件和所述第二侧支撑件并且垂直于所述至少一个流体束流的流动的方向所测量,所述平均高度如沿着基本上垂直于所述第一侧支撑件和所述第二侧支撑件并且平行于所述至少两个流体束流中的至少一个的流动的方向所测量。
25.在某些方面,系统包括:电穿孔装置和联接到所述电穿孔装置的流体递送设备。在各种实施方案中,所述电穿孔装置具有在上文和别处描述的特征件。
26.在所述系统的一些实施方案中,所述流体递送设备包括流速控制模块。在一些实施方案中,所述流体递送设备包括温度控制模块。在一些实施方案中,所述系统还包括:流体接口,所述流体接口将所述流体递送设备联接到所述电穿孔装置。在所述系统的某些实施方案中,所述电穿孔装置还包括:至少一个电压控制模块。在一些实施方案中,所述系统还包括:电子或光学监测模块,所述电子或光学监测模块联接到所述电穿孔装置。在某些实施方案中,所述系统还包括:细胞处理模块,所述细胞处理模块联接到所述电穿孔装置。在一些实施方案中,所述细胞处理模块位于所述电穿孔装置的上游。在一些实施方案中,所述细胞处理模块允许细胞分选、选择、标记、分析或其组合。在某些实施方案中,所述细胞处理模块包括荧光激活的细胞分选部件。在一些实施方案中,所述细胞处理模块包括允许磁珠分离的磁场源。在某些实施方案中,所述系统还包括:单采袋,所述单采袋位于所述细胞处理模块的上游。在一些实施方案中,所述系统还包括:细胞收集贮存器,所述细胞收集贮存器位于所述电穿孔装置的下游。
27.在一些方面,形成电穿孔装置的方法包括:模制材料以形成至少两个支撑块,至少一个支撑块具有至少一个输入开口,并且至少一个支撑块具有至少一个输出开口;将至少一个电极附接到所述两个支撑块中的每个支撑块以获得两个支撑件;以及将所述至少两个支撑件层压在一起以形成电穿孔装置,其中所述电穿孔装置在所述两个支撑件之间具有通道。
28.在形成电穿孔装置的此类方法的一些实施方案中,所述模制包括注塑成型。在形
成电穿孔装置的方法的一些实施方案中,附接包括热结合。在形成电穿孔装置的方法的某些实施方案中,所述材料是光学透明的。
29.在某些方面,将分子电穿孔到细胞中的方法包括:使流体以一定流速流动通过电穿孔装置中的流体通道,其中所述流体包括至少一个细胞和至少一个分子,并且其中所述流体通道具有至多10毫米(例如,至多50毫米、100毫米、150毫米、200毫米、250毫米、300毫米、350毫米、400毫米、450毫米、500毫米、550毫米、600毫米、650毫米、700毫米、750毫米、800毫米、850毫米、900毫米、950毫米、1000毫米、1500毫米、2000毫米、2500毫米、3000毫米、3500毫米、4000毫米、4500毫米、5000毫米、5500毫米、6000毫米、6500毫米、7000毫米、7500毫米、8000毫米、8500毫米、9000毫米9500毫米)的至少一个尺寸;以及向所述流体施加电场,所述电场在所述流体通道的至少一个部段(例如,至少两个部段、至少三个部段、至少四个部段、至少五个部段、至少六个部段)中作为时间和位置的预定函数变化。
30.在此类方法的一些实施方案中,所述流体包括至少两个束流,并且其中所述至少一个细胞在所述至少两个束流中的一个中并且所述至少一个分子在所述至少两个束流中的另一个束流中。在一些实施方案中,所述至少两个束流具有不同化学组成。在某些实施方案中,所述至少一个细胞是多个人t细胞。在一些实施方案中,所述至少一个分子是多个核酸、蛋白质或小分子。在一些实施方案中,所述方法还包括:监测转染效率或细胞死亡率。在一些此类实施方案中,所述方法还包括:基于所述转染效率或所述细胞死亡率来调整所述电场、所述流速、所述至少一个细胞的浓度、所述至少一个分子的浓度或所述流体的化学组成。在这些方法的一些实施方案中,所述流体通道的第二尺寸是所述至少一个尺寸的至少10倍且至多1000倍(例如,20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、150倍、200倍、250倍、300倍、350倍、400倍、450倍、500倍、550倍、600倍、650倍、700倍、750倍、800倍、850倍、900倍、950倍)。
31.在阅读以下具体实施方式和权利要求时,本公开的这些和其他方面将变得显而易见。
附图说明
32.图1示出根据本公开的实施方案的流体通道装置(即,电穿孔装置)的一部分的示意性剖视图。
33.图2示出包括流体通道系统、多个流体输入端、输出端和一对电极的流体通道装置(即,电穿孔装置)的示意性剖视图。
34.图3示出由三个层构造的电穿孔装置的实施方案。
35.图4示出用于控制流体流和电压以及用于光学地和以电的方式监测受控电穿孔的系统的示意图。
36.图5示出电穿孔装置的实施方案的示意性剖视图。
37.图6示出振幅为10v且频率为10khz的示例性正弦电压波形。
38.图7示出具有用于透化细胞的高频分量和用于电泳地驱动带电荷分子的低频分量的示例性周期性电压波形。
39.图8示出由层压模制零件制成的多通道装置的示意图。
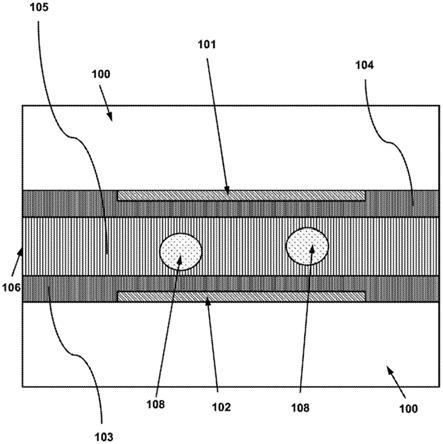
40.图9示出流体接口的实施方案的透视图。
41.图10示出流体接口的实施方案的透视图。
42.图11示出与平面流体电穿孔装置(其例如可以是微流体芯片等)整合成一体的细胞处理功能的示意图。流体流式装置示意图以平面格式示出用于磁性细胞选择和电穿孔的单独区域。
43.图12示出独立微流体装置和平面电穿孔装置(例如,电穿孔芯片)的系统。在此图以及本公开的其余部分中,除非在特定上下文中另外描述,否则单词“芯片”与单词“装置”互换使用以有利于讨论各个方面。
44.图13示出并入电穿孔系统的自动化细胞制造平台。
45.图14示出具有动态过程控制以获得最佳细胞修饰参数的多流装置。
46.图15示出独立地控制和改变三个流体束流的化学组成以用于组合处理的示意图。
具体实施方式
47.本公开涉及一种用于通过电穿孔将生物活性分子引入活细胞中的系统、方法和装置。本公开允许在电穿孔期间监测和控制细胞位置、运动并暴露于装置内电极对之间的电场,使得每个细胞暴露于类似的电条件和化学条件。在一个实施方案中,电穿孔装置包含流体通道,两个电极侧接在所述通道的相对侧上,可向所述电极施加电势以在电极对之间产生跨通道的电场。在一些实施方案中,流体通道的尺寸与流体流的特性组合提供足够的控制,以将流体流内的单个活细胞维持在相对于所述活细胞正穿过的电极对附近的类似位置处。当活细胞流动通过电极之间的通道时,从细胞到每个电极的距离保持为几乎恒定并且其方式为防止一个活细胞遮蔽另一个活细胞而使其不受到所施加电场的作用。通常,细胞流在相对电极对之间的通道尺寸上为一层厚,使得细胞在经过电极对之间时独立地暴露于在通道中形成的相同电流。在一些实施方案中,通道对在通道长度和未侧接电极的相对通道壁的其他两个维度上的距离没有限制。细胞以设定通量流动通过通道,并且这些特征使得用户能够向细胞施加精确电场。电场的强度足够强以在活细胞的膜内形成生物分子可通过其穿越细胞膜的孔,但又足够弱以便不会裂解细胞。
48.装置包括一个或多个流体输入端和至少一个流体输出端。当装置包括单一流体输入端时,产生单一层流流体束流。单一流体束流包含活细胞,与生物活性分子组合以用于通过电穿孔将生物活性分子引入活细胞中。电极之间的合适间距是细胞直径的约2倍到5倍、或是典型细胞直径的大约两倍,从而迫使细胞以单层形式穿过电极之间的空间。单一流体流中的活细胞在电穿孔期间在它们穿过电极对之间的电场时维持在与其他活细胞类似的位置中,因此每个细胞暴露于类似的电条件和化学条件。电极对的电极之间的合适距离包括约50微米至约100微米的范围,或小于约100微米(例如,20微米、25微米、30微米、35微米、40微米、45微米、50微米、55微米、60微米、65微米、70微米、75微米、80微米、85微米、90微米、95微米)。
49.当装置包括至少两个流体输入端时,产生多个层流鞘流体束流。每个流体输入端可接受单独的流体束流。例如,一个束流包含活细胞,而另一个则包含生物活性分子。因此,活细胞和生物活性分子通过单独的流体输入端流入通道中。束流被层流鞘流分离。流体通道的尺寸被构造来容纳层流分离的束流,使得包含在流体流中的活细胞在它们穿过电极对之间的电场时维持在与其他活细胞类似的位置中。在具有多个鞘流的系统中,鞘流以由流
速控制的恒定间距将细胞与电极和通道壁分离。多个鞘流装置允许细胞相对侧上流体的化学组成不同,从而允许将带电荷分子(诸如dna和rna)高效地电驱动到细胞中。通过通道的液体流可在时间上保持不变,这简化了过程并确保所有细胞在电穿孔期间在它们穿过流动通道时经历相同的条件组合。成对电极之间的包含活细胞的鞘流的边界之间的合适距离包括约50微米至约100微米;小于约100微米(例如,20微米、25微米、30微米、35微米、40微米、45微米、50微米、55微米、60微米、65微米、70微米、75微米、80微米、85微米、90微米、95微米);是细胞直径约2倍至5倍;或是典型细胞直径大约两倍,从而迫使细胞以单层形式穿过电极之间的空间。装置可包含一个或多个流体输出端。在此实施方案中,电极对之间的距离可大于上述距离,因为鞘束流中的活细胞在它们借助于相邻鞘流穿过电极对之间的电场时维持在与其他活细胞类似的位置中。电极对的电极之间的合适距离包括约50微米至约500微米。本公开的实施方案的另一个优点是用户可在沿着通道长度的不同位置处操纵环境的化学性质和电性质。此外,本公开的实施方案允许用户监测细胞和/或溶液的各种性质,以实时修改和优化流动和电压参数。
50.通道
51.图1示出装置的实施方案的示意性剖视图。流动通道106位于两个支撑块100之间。正电极101位于上部支撑块100的内流动通道表面上,与位于下部支撑块100的内流动通道表面上的负电极102相对。包含被电穿孔的细胞108和核酸或其他生物分子110的缓冲液的液体束流106在下部支撑块100与上部支撑块100之间流动。
52.通过将电极之间的间隙尺寸限制为是细胞直径的约2倍至5倍或小于细胞直径的大约两倍,不存在足够的物理空间供流动束流中的多于一个细胞位于电极之间的通道间隙中。这种受控间隙间距以及在层流状态(例如,无湍流)下操作允许单一给定细胞受控地定位在这一平面中的电极之间。虽然流动通道在电极附近较窄,但可在正交维度上使通道与所需要的一样宽以实现细胞通过通道的期望流速。类似地,在一些实施方案中,通道的长度没有限制。对电极之间距离的控制允许每个细胞被隔离或相对于电极保持在类似位置中。因此,每个细胞基本上经受类似的电和化学环境中,而同时高总细胞吞吐量是可能的。在装置的一个实施方案中,通道可被制造成使得支撑块100之间以及因此电极101与102之间的距离可调整成容纳不同类型和大小的活细胞。电极101和102安装在其上的支撑块100可由任何非导电或电绝缘材料诸如玻璃、塑料或光学透明材料制成。
53.图2示出装置的实施方案的示意性剖视图。流动通道107位于具有图案化电极的支撑块100之间;正电极101位于与负电极102相对。包含要电穿孔的核酸或其他生物分子的高电导率缓冲液的下部液体束流103相邻于负电极102流动。高电导率缓冲液的上部液体束流104相邻于正电极101流动。包含要电穿孔的细胞108的低电导率缓冲液的中间液体束流105在下部液体束流103与上部液体束流104之间流动。上部液体束流104、中间液体束流105和下部液体束流102通过层流分离。
54.在图2中,来自输入端103、104和105的流体流动通过通道107并经由输出端108流离开装置。间隔件106用于改变流的方向。
55.流动通道可制成各种几何结构并且可具有恒定或可变宽度。
56.图5示出装置的实施方案的示意性剖视图。流动通道207位于具有图案化成对电极的支撑块200之间;两个正电极101位于与两个负电极102相对。两个电极之间的距离被选择
成略大于流入流体输入端205中的活细胞的直径。虽然流动通道在电极附近较窄,但可在正交维度上使通道与所需要的一样宽以实现细胞通过通道的期望流速。类似地,在此实施方案中通道的长度没有限制。考虑到由流体输入端203、204和205建立的层流,对成对电极之间距离的控制允许每个细胞相对于成对电极被隔离或保持在类似位置中。因此,每个细胞基本上经受类似的电和化学环境中,而同时高总细胞吞吐量是可能的。来自输入端203、204和205的流体流动通过通道207并经由出口流208离开装置。间隔件206用于改变流的方向。
57.流体输入和束流
58.流体可以0.1cm/s的速率流动通过通道,其中流速的相关范围在0.001cm/s与10cm/s之间。流动通过通道的流体的体积与流动通道的横截面积相关。例如,对于2cm宽和100微米高的通道,体积流速将在约0.2微升/秒至2微升/秒的范围内。
59.装置允许使用通过通道装置中的狭缝的多个流体输入以提供具有不同溶液组成层的流。可控制两个或更多个流体束流进入通道中的流速以产生鞘流。在装置的一个实施方案中,通道107(图2)通过液体鞘递送包含要电穿孔的活细胞的低电导率缓冲液。与通道105位于装置同一侧上的任选通道104递送高电导率缓冲液。位于装置相对侧上的另一个通道103也递送高电导率缓冲液。在图2中,此缓冲液包含要插入活细胞中的生物活性分子。各种细胞或分子束流经由这些输入端进入通道,并且这些束流可具有相同或不同的流速。如果需要,则具有不同流速的束流采用层流通过通道。因此,束流平行地流动通过通道并在很大程度上保持分离,从而仅通过扩散缓慢地混合。以此方式,活细胞束流中的单个细胞可通过相邻流体束流的层流在电极对之间被隔离。
60.使用多个流体输入可防止各种类型的结垢或污染。例如,要插入细胞中的分子或核酸可存在于与细胞分开的溶液中。这可能是有用的,因为某些分子,如rna可由于细胞表面或细胞培养基上的酶而在活细胞附近不稳定。另外,已知电极的退化可导致释放对细胞有毒的污染物。单独的流体层确保细胞保持不含来自电极的污染物。另外,细胞本身与支撑块的表面和电极两者保持不接触,从而防止可能的污染。
61.在一些实施方案中,使用单独的流体束流允许将不同组分维持在对它们最优的培养基中达更长时间。例如,一个流体束流可包含要电穿孔的细胞,并且代替将细胞保存在对于电穿孔效率最佳的介质中,在电穿孔之前将细胞保存在对于它们(例如,对于它们的存活)最优的培养基中,并且然后在实际电穿孔时间窗口期间与电穿孔介质混合。在电穿孔完成之后,可将细胞切换回对于它们最优的培养基中。这允许最小化细胞处于对其健康不利的培养基中的时间。因此,本文所公开的实施方案允许例如作为时间和/或流体通道内的位置的函数动态地控制细胞的化学环境和要被单独地电穿孔到细胞中的试剂。
62.替代地,装置的实施方案可包含单一流体输入端,细胞和生物活性分子的均质溶液通过所述单个流体输入端进入通道。束流由包含要插入活细胞中的生物活性分子的导电缓冲溶液组成。在一些实施方案中,生物活性分子选自核酸、药物分子和其他生物活性分子的类别中。与具有多个输入端的装置相比,这可能是有利的,因为对于细胞和生物活性分子而言存在彼此接触的更大的机会并且可提高转化效率。
63.在一个实施方案中,输入端104、105将流体束流引入通道,使得束流在流入电极之间之前以一定角度转向。在图2中,此角度示出为90
°
,但所述角度可以是包括0
°
的任何角度。在这种情况下,间隔件106有助于引导来自入口104、105的流。
64.类似地,在本公开的一个实施方案中,流拐弯,之后通过输出端108离开装置。在图2中,此角度为90
°
,但此角度可以是包括0
°
的任何角度。在这种情况下,间隔件106有助于将流引导到出口。
65.流体束流经由管材、配件、互连件、歧管或精细的流体路径连接件与装置接口连接。这些零件中的一个或多个可以是流体接口的一部分。流体接口用于将管材或导管重定格式为装置的接收狭缝端口(例如,图2中的103、104或105)。流体接口可具有表面积变化以及用于将流体递送到装置的变化的几何结构。流体接口可具有增强混合或维持层流特性的特征。这包括可有助于湍流、扩散速率改变或在流动路径中的驻留时间的几何改变。流体路径可具有定制为避免捕集气体(气泡)或接种以避免由于气体从溶液中出来而形成气泡的几何结构。
66.流体路径部件可被加工、模制(例如,注塑成型)、铸造、挤压等。流体接口可制造为通道装置的一部分(一件式)或经由永久性或非永久性结合与装置结合(整合)。替代地,流体接口可例如经由注塑成型作为装置的一部分制造为一个整合部件,其中装置和流体接口两者在成型过程期间形成。流体接口与装置之间的密封可以是气密的、基于压缩的、基于o形环的、基于垫圈的、基于粘附的、熔融的、鲁尔锁定(快速连接)的、基于平底压缩的、基于锥形套圈的、基于截头圆锥压缩的、摩擦配合、倒钩连接等。
67.流体转移管线可以是软的、半硬的或硬的,其中部件之间的防漏密封件由本领域技术人员已知的连接件制成。
68.管材和流体导管可经由挤压或成型来制造。
69.对于一些歧管设计,系统的各部分可不包含管材,并且流体将经由歧管结构按路线引导。
70.在一个实施方案中,与装置的流体接口是经由利用压缩材料(诸如o形环或垫圈)与刨床装置的防漏密封件。
71.装置可接口连接到流体递送系统。流体递送设备或泵被构造来从器皿移位流体以在流体路径内建立流体流。流体器皿可包含纯流体或溶液。流体可包含细胞、小分子或大分子,从而包括用于转染过程的化学实体。流体移位设备可提供流体的正移位和/或负移位。这允许流体被推动或拉动通过装置和流体路径部件。
72.递送泵包括机构可包括蠕动泵、注射器、齿轮泵、隔膜泵、气压(正或负)、离心机、活塞、止回阀或机械移位件、流体静力或重力驱动流。
73.优选地,流体间接地由泵移位,而液体不会直接接触设备的移动零件中的任何一个,所述泵例如像作用在流体填充管上的蠕动泵。替代地,可使用正压力移位机构,其中压头压力将液体从加压器皿移位;或负移位,其中使用真空来将液体拉动到电穿孔装置中;真空经由压力调节器或蠕动泵实现。负移位的使用允许在装置的入口侧上实现有限的系统部件。
74.当使用负移位将液体拉动通过装置时,可使用中间器皿来捕获离开装置的细胞和流体,以避免与泵的负移位装备(例如注射器、蠕动泵管、流量传感器等)接触。
75.相反,当流体通过直接接触设备的移动零件中的任何一个(例如像注射器泵的柱塞)而被移位时,流体可直接由设备移位。替代地,注射器泵可将液体拉动通过装置,并且目标流体不会行进至到达注射器筒的点。注射器可以是可重复使用的或一次性的。注射器可
整合在流体路径中或者在使用时连接。
76.流体控制可以是开环的或者可具有闭环反馈控制。
77.迄今为止建立的泵送系统在控制流速准确度和精度方面具有若干弱点,并且在控制稳定的非脉冲流方面可能具有性能限制。对电穿孔装置的流体脉冲的控制最优选地控制在小于30秒、更优选地小于10秒并且最优选地快于1秒的时间范围内。对于后者提到的给定时间段,脉冲控制优于20%。
78.对于电穿孔装置,优选实施方案包括蠕动泵机构和/或基于气压泵的机构。两种类型可操作来拉动或推动液体。
79.传统的蠕动泵由于经由辊(或线性压缩机构)对泵管的机械接触的固定速率而遭受高脉冲递送,所述辊通过压缩所述管从而导致管id改变来连续地变更横截面积。脉冲由管id的横截面改变造成。另外,蠕动泵遭受因随着时间和使用管材顺应性改变和管磨损特性改变造成的准确性问题。对于没有直接测量流体流速或利用天平或体积测量来测量输出量,这种磨损就无法得到补偿或调整。利用天平测量液体流速是不切实际的,因为然后必须添加需要适当环境(例如,温度、湿度、振动和空间)的另外的仪器。另外,流体路径然后变得依赖于对天平的相对较大占用面积/空间要求的可达性。
80.压力泵递送相对非搏动流,但由于流体路径尺寸公差、粘度和温度改变(流体和周围环境温度)以及当器皿为空和被填充时的液体高度改变而遭受准确性问题。利用天平测量液体流速是不切实际的,因为然后必须添加需要适当环境(例如,温度、湿度、振动和空间)的另外的仪器。另外,流体路径然后变得依赖于对天平的相对较大占用面积/空间要求的可达性。
81.为了克服这些限制,可实现流量传感器以向液体移位机构提供闭环反馈。在此提出添加流体流速传感器(与系统部件一致)以近实时地测量流速并能够反馈到流体移位机构。例如,具有蠕动泵的流速传感器或作用于流体器皿上的气压控制系统。流速传感器可连续地或间歇地控制流体位移。在开环操作的情况下,传感器还可用于测量流速作为检查。
82.最优选地,在一些实施方案中,传感器并不接触流体并且不与装置、管材或导管连通。
83.传感器在它与一个或多个一次性流体部件结合使用的情况下可以是可重复使用的。或者传感器可以是一次性的。
84.最优选地,可使用的两种类型的传感器,包括但不限于:(1)与流体路径连通(非接触)的基于超声波的传感器,所述传感器与液体正行进通过的部件连通;和(2)与流体路径连通(非接触)的热式流量传感器,所述传感器与液体正行进通过的部件连通。
85.传感器可在它们与要改变的流体路径部件暂时地接口连接的情况下重复使用,或者传感器可以是路径的一部分并且本质上可以是一次性的。在一些实施方案中,一次性传感器整合在流体路径中。
86.进入装置的液体的接口连接可经由一个或多个部件(诸如管或导管)和/或流体接口发生。流体部件可包括允许分布或变更流体的流动剖面和路径的一个或多个特征。此部件可以是润湿路径,其中横截面积和形状可与离开横截面积或形状的流体部件的横截面积和形状不同。流体路径改变可以是组件的一部分或者可模制为电穿孔装置的一部分。
87.这可包括可将来自管导管的液体流重新分布或重定格式为与装置入口兼容的格
式的一或多个几何形状。流体路径的这种架构取决于进入的流体源管材、配件或流体接口以及装置流体入口形状。
88.流体接口部件可由一个或多个流体路径组成并且不限于入口或出口特征件的位置或数量。
89.图9和图10中提供了流体接口的两个实施方案的示意图。流体接口可用于允许各种格式和类型的流体部件对微流体装置入口进行流体密封。装置入口可为圆形形状或者可具有非圆柱状几何结构或形状。流体接口部件可例如允许一个或多个进入的流体管线或导管连接到流体接口入口,在所述流体接口入口处,流体然后可穿越所改变的横截面或几何形状,之后流体以与装置流体入口几何结构匹配的横截面或形状离开流体接口。流体装置入口几何结构将对应于流体接口部件输出端几何结构。例如,流体接口可用于允许传统管然后将流体供应到装置上的裂缝。图中的描绘仅是示例性的,因为接口连接流体可以许多方式(例如,不同类型的导管/管的不同几何形状)实现。
90.可在电穿孔后操纵细胞。在一些实施方案中,在电穿孔之后,将细胞从pa转移到无菌的多孔培养皿或t型烧瓶并使其在37℃下恢复30-40分钟。将细胞悬浮在标准细胞培养基中并进行培养以供立即使用或冷冻保存。
91.在一些实施方案中,电穿孔装置接口连接到接收站,所述接收站用于形成一个或多个连接,从而提供形成防漏流体连接的手段。这种接口站还可用于形成电连接。
92.接收站可(1)包括形成一个或多个流体防漏连接的能力;(2)包括形成一个或多个电连接的能力;(3)包含实现光学器件的区域或用于允许外部光学器件进入装置的路径;(4)具有本质上是一次性并且与灭菌手段兼容的所有润湿部件;(5)具有经由各种流体区域内联阀或更优选地经由非接触式机构(诸如夹管阀)隔离的流体,或者泵可包括隔离流的方式,例如当利用蠕动机构时(例如,轮可定位成夹住管或关闭泵管);(6)具有经由倒钩或压缩配件连结的导管、管材和流体部件;并且/或者(7)涵盖使用焊接和零件熔化来制造流体组件。
93.细胞和生物活性材料可经由若干种方法呈现给装置。它们可经由机器人流体处置平台或注射系统注射,或者经由生物相容性容器连接。生物工艺容器包括聚合物袋、t型烧瓶、锥形管、培养基瓶、孔板等。这些器皿可一次性使用或者在执行适当灭菌后可重复使用。与流体递送路径的连接可通过压缩密封、螺纹连接、夹紧压缩、鲁尔锁机构、o形环密封、摩擦密封、垫圈密封、夹钳或类似连接来实现。在气动移位的情况下,容器本身可被加压或被包含在加压器皿内部。
94.在一个实施方案中,细胞可通过与泵送或流体操纵系统接口连接的定制盒呈现给装置。
95.流体输出
96.示例性流体出口108示出于图2中。在电穿孔之后,所有流体束流的混合物可经由此出口离开装置。可将溶液转移到无菌聚合物袋、t型烧瓶、锥形管、培养基瓶、孔板等并使其在37℃下恢复。然后可将细胞重悬在标准组织培养基中并铺板以立即用于细胞测定、冷冻保存以供将来使用或根据需要使用。
97.具有电场时间和空间控制的电极
98.跨流体装置的厚度定位的电极之间的间隔较小,因此仅需要几伏的所施加电压来
执行电穿孔。这与需要标准电穿孔通常所需的多至几千伏的电压形成对比。例如,文献中已知需要小于1kv/cm的跨膜电场来对细胞膜进行穿孔(weaver和chizmadzhev,1996)。然而,根据本发明装置,对于电极对之间的100微米的距离,这需要大约5v电势差以对普通哺乳动物细胞进行穿孔。跨哺乳动物活细胞的合适电压差包括以下范围:0.1v至10v。例如,对于电极之间的100微米的距离,此范围对应于10v/cm到1000v/cm的电场。
99.流动通道可具有一个或若干个电独立的电极对。例如,所述流动通道可具有四组电极对101。通过使用夹子或导电粘合剂将这些电极连接到可变电压电源、函数发生器、经由数据获取卡或放大器的计算机或具有分压器的电池来与这些电极形成连接。电流表可用于监测在任何一对电极之间流动的电流,以便监测和控制过程。
100.电极可被构造来施加垂直于流动方向或沿着流动方向的恒定的、脉动的或连续时变电压。如果期望脉动电压,则约0.01毫秒至约100毫秒的脉冲持续时间是合适的。多个电极对可被图案化以产生空间和时间变化的电场。可在光刻工艺中使用光掩模或在溅射或沉积工艺中通过荫罩掩模来图案化电极。图案化允许制造具有变化几何形状的电极。与流体流动特性组合的形状变化对细胞经受电场的时间提供控制。
101.本发明提供在流动通道表面上的不同位置处图案化电极的能力,所述电极可单独地连接到各种电源,其中电源可具有不同电压和电流特性。由一种或多种电绝缘材料组成的所公开的平面流体系统能够图案化各种电极结构。
102.在各种实施方案中,可进行以下项中的任何一项或多项:(1)可利用时间相关电压特性激活一个电极或一组电极以在细胞中打开孔;(2)可激活另一个电极或另一组电极以将带电荷分子驱动到细胞中;(3)可使用另一个电极或另一组电极来测量含细胞流体的电性质;(4)可使用另一个电极或另一组电极来将核酸或其他分子浓缩在具有变化电导率的流体层之间的界面处;(5)可激活另一个电极或另一组电极以通过在流体中产生的流主动地或被动地将细胞移动到流动通道中的指定位置以用于细胞分选或其他目的;以及(6)可激活另一个电极或另一组电极以使细胞旋转以便增加电穿孔暴露的表面积。
103.重要的是,所公开实施方案中的一些允许将任意时变电压施加到不同电极。电压信号可通过计算机生成期望时变波形来形成,所述期望时变波形通过数模转换并放大到期望电压范围而转换为所施加电压。
104.简单波形将是指定频率的正弦电压,如图6所示。波形的振幅需要足以透化细胞。在一些实施方案中,这在流体装置内哺乳动物细胞的典型10微米大小上需要大约1v的电压降。这意味着电压波形的振幅可为约5v,范围为从0.1v延伸至100v,这取决于流体装置(例如,芯片)的深度和流体层的离子组成。脉冲的频率取决于电路的阻抗特性,具体地取决于已知由于水溶液中存在自由移动的离子而在电极表面处形成的所谓双层的电容方面以及流体或具有变化电导率的流体层的电阻。电容双层的阻抗相反地取决于频率。因此,频率应优选为大约10khz,使得流体层的阻抗占主导地位,从而导致大部分电压改变发生在流体层内,而不是发生在电极-电解质界面处。取决于流体装置尺寸和流体层的离子组成,频率可能在100hz至1mhz的范围内。电路的阻抗可以复杂的方式取决于流体层的离子电导率。流体的电阻与离子浓度成反比,而双电层电容与升高到某次幂的离子浓度成正比。电解质-电极界面处的电路通常由于双层与频率相关阻抗并联而近似为电容器,所述频率相关阻抗由于跨电极转移的电荷而与电阻串联(称为randles等效电路模型)。控制电压的时间变化的能
力意指可根据用于对细胞电穿孔的最优配置来调节给双电层充电的电流和由于跨电极转移的电荷而产生的电流。除恒定的dc电压偏移之外,电压波形还可由正弦波的总和组成,从而产生净电流。
105.根据一些实施方案,另一种周期性波形具有短持续时间电压以打开孔,之后是较长持续时间的较低电压以将带电荷分子移动到细胞附近,如图7所示。带电荷分子的移动可能是由于电泳力、或由于因电极所引起的净流体运动而造成的电泳、或由于带电荷分子或细胞上的介电泳力。
106.波形的连续重复本质对连续流系统是有用的。对于波形的各部分,所施加电压可从正变化为负,或者保持为零或另一个恒定电压。
107.除恒定电压偏移之外,还可通过将任意数量的正弦波形加在一起来产生任意形状的波形,每个正弦波形具有其自己的频率和振幅。
108.净时间平均电压可选取为正的、负的或零,从而提供控制电荷流的净方向的能力。这将对控制电极上的表面电化学和在选取方向上引导带电荷分子是有用的。
109.波形还可被选取成打开细胞或细胞核中的孔并留出时间以供中性分子在另一个孔打开电压施加之前扩散到细胞中。
110.在一些实施方案中,配对电极组跨流体通道表面的空间布置允许产生作为时间和流体通道内的位置的函数变化的电场,而无需用户产生离散电脉冲(例如,经由向每组配对电极提供波形的多个电压供应器,所述波形对于任何组可以是正弦波形并且在不同组之间可以不同)。
111.可通过多种方法来图案化电极,所述多种方法包括喷墨印刷、丝网印刷、平版印刷图案化、通过荫罩掩模的气相沉积以及用于在包括塑料的各种基板上图案化导电材料的其他方法。
112.制造装置
113.装置的一些实施方案由聚合物基板或塑料的三层堆叠构成,如图3所示。所有三层用小束斑、高分辨率co2激光进行激光切割。电极固定在其上的层自1mm厚的丙烯酸块切割而成,从而产生通道的相对表面。中间层106限定电极对101、102之间的距离。在图3所示的实施方案中,层的三个尺寸相同。尽管最实际的是,层在束流流动的平面中的尺寸相同,但这些尺寸可彼此不同。制造这些层的一种方式是使用激光器来将丙烯酸件切割成25x75mm的显微镜格式,分别添加流体入口狭缝或端口103、104、105以支撑块100并添加对准孔109以有利于组装。金-钯(au/pd)混合物的薄膜电极(50nm)通过物理气相沉积沉积在每个丙烯酸件的内部表面上。经由激光切割工艺将每侧上具有医用粘合剂的100微米厚的中间层106聚合物膜切割成形并使其接收对应的对准孔。在激光切割之后,将三个件放置在包含对应于每层中的对准孔的对准销的夹具上。然后在压力机中压缩结合夹层组件。这种激光切割和压缩组装的两步过程适合于大规模生产,并允许产生成本有效的消耗品。所述过程可用于每年制造数以万计的装置。这与通常需要昂贵资本装备和大量化学处理步骤的许多其他类型的标准非电穿孔微流体装置形成对比。
114.装置层的对准可通过光学定位或物理手段(诸如基准垫、对准销或结构)来进行。装置层可具有用于与夹具对准件或系统一起使用的接收特征件。替代地,对准特征件可驻留在装置层中,因此不需要夹具或外围对准系统。这些对准特征件可包括卡扣在一起的销
状结构或特征件。
115.流动池也可通过注塑成型工艺生产,其中使用一台具有多腔模具的注塑成型压力机,数量可扩展到每年数百万的一次性装置。
116.本公开实现了容易地适合于注塑成型的用于制造装置的架构。在此装置中,所有层都可经由注塑成型来形成。流体通道可在全深度处形成在一个层中,或替代地,通道可跨越两个或更多个层,在这种情况下全深度在组装时实现。注射端口可经由核心销来产生。替代地,可在成型后添加流体入口作为二次操作或结构。层可由平面表面或边缘模制。从模腔适当且高效地释放零件在本领域中是已知的。
117.模制层可通过机械连接、粘合、结合、焊接(包括超声波和激光)、熔融、熔化等组装在一起。此外,层之间可存在用于连接和密封的另一种材料,诸如但不限于垫圈、o形环、垫片等。替代地,可通过压紧或结合特征件来实现密封。
118.图8描绘可由四个模制塑料部件形成的三通道平面层流装置。此图中并未示出所有视图,但通道和流体递送都并入所述结构中。圆形进入端口可利用各种配件连接到诸如自动化细胞制造平台中的常规管材。低成本制造方法是期望的,因为与含细胞的培养基接触的流动池和材料通常应在一次使用后被丢弃以防止交叉污染。存在许多方式进行注塑成型,包括使用一种模具或多于一种包覆成型技术。多个层也可在成型后使用但不限于诸如超声、激光、热压缩、粘合等技术进行结合。
119.在另一个实施方案中,流体通道可驻留在一个层中,并且相对的密封结构是非注塑成型零件,诸如包含必要流体入口的膜、带或平面材料。
120.在另一个实施方案中,装置可通过三维印刷或增材制造工艺来产生。其他制造技术包括压缩成型、铸造和压花。
121.在另一个实施方案中,装置经由光刻和湿蚀刻或干蚀刻由玻璃制成。替代地,装置可经由计算机数字控制(cnc)或超声加工进行物理加工。
122.在其他实施方案中,装置可由各种材料制成,例如像其中至少一个层是玻璃,其中至少一个层是塑料,其中层之一是光学透明的,或者其中通道材料是电绝缘的。
123.制造电极
124.在流动通道表面上形成图案化电极可利用多种容易获得的技术来完成。一种方法是使用溅射工艺来沉积金属导电层,诸如金、铂、铝、钯、其他金属或多种金属的合金。金-钯是可用于构成电极的金属合金的实例。电极可由光学透明材料制成以允许观察活细胞在装置的流体通道中的运动。为了生成透明导电层,经常使用氧化铟锡(ito)膜。在金属沉积之后,可通过掩模和蚀刻来图案化这些导电层以去除不想要形成期望图案化电极形状的材料。可使用常见光刻曝光工艺来由光致抗蚀剂形成适当掩模。
125.用于形成电极的另一种方法是沉积由金属或其他导电层制成的导电膜诸如ito。借助于通过预先定位的掩模(有时称为荫罩掩模)沉积导电薄膜,膜定位在要涂覆的表面附近,使得导电层仅到达已在掩模中形成先前打开区域的表面。此外,可使用称为“剥离”的相关技术,其中可使用图案化光致抗蚀剂层来定型沉积导电材料的图案。
126.导电油墨层的沉积可通过刷涂或喷涂进行,之后进行加热以形成图案化导电膜。
127.这些薄膜图案化工艺为本领域技术人员所熟知。在这种情况下,膜的厚度期望在5nm至5微米的范围内,优选范围为10nm至100nm。
128.在装置的一个实施方案中,可通过将线材嵌入形成在支撑块(例如,图1中的100)中的沟槽中而不是将电极附连到支撑块来形成电极。在此实施方案中,沟槽被加工在支撑块(例如塑料支撑块)中,并且电极是金属。优选地,电极是金或镀金金属。然后将线材胶粘在沟槽中。
129.系统的一个实施方案包括电穿孔装置、包括泵的流体递送系统、温度控件以及细胞的光学和电子监测器以获得关于细胞修饰过程的实时反馈。可通过以下方式来获得反馈:监测在两个电极之间经过的电流以提供关于活细胞修饰的信息,对活细胞进行成像以提供关于活细胞修饰的信息或监测活细胞的荧光以提供关于活细胞修饰的信息。
130.一个实施方案包括一种用于将生物活性分子插入活细胞中的系统,所述系统包括:电穿孔装置,所述电穿孔装置能够执行细胞修饰过程,所述细胞修改过程包括:通过使包括活细胞和生物活性分子的流体流动通过两个电极之间的通道来将生物活性分子插入流体流中所含有的活细胞中,每个电极设置在通道的相对侧上;使细胞以单层形式通过两个电极之间的空间,因此当流体流中的活细胞和流体流中的其他活细胞经过两个电极之间时,所述活细胞维持在与所述其他其他活细胞类似的位置中;以及当活细胞经过两个电极之间时跨两个电极施加电压,其方式为防止一个活细胞遮蔽另一个活细胞而使其受不到所施加电场的作用,其中活细胞所暴露于的电场的强度足以在活细胞的膜内形成生物活性分子可通过其穿越细胞膜的孔,但不会裂解活细胞;流体递送系统,所述流体递送系统包括流体源和流体泵,与电穿孔装置流体连通;电流源,所述电流源与电极对电连通;温度控件,所述温度控件与流体流热连通;以及活细胞的光学和电子监测器,所述活细胞的光学和电子监测器能够获得关于细胞修饰过程的实时反馈。
131.电穿孔装置优于现有技术的一个优点是能够对细胞进行光学和电子监测以获得关于细胞修饰过程的实时反馈。图4例示装置的一个实施方案:具有观察显微镜605的微流体电穿孔系统。因此,可根据需要调整流体流量控制器601或电压控制器606以优化过程效率和细胞活力。在此实施方案中,显微镜被定位成使得其观察包含生物活性材料的贮存器602。例如,此生物活性材料可以是核酸。来自输入端细胞贮存器600的流体流动通过微流体电穿孔装置604的通道并跨显微镜605的视场,并进入细胞收集贮存器603中,因此使得用户能够根据需要进行调整以提高转化效率。
132.对与流体接触的溶液或材料的温度控制可在系统中的任何一种或多种情况(包括加热和冷却)下实现。此温度控制可包括静态控制或温度循环。
133.装置可接口连接到流体递送系统。与流量控制器601一起操作的流体递送设备或泵被构造来移位、优选地间接移位来自输入端细胞贮存器600的流体,以在流体路径内建立流体流。流体移位设备可提供流体的正移位和/或负移位。递送泵包括基于蠕动、气动(压力移位)、液压、活塞、真空、离心力、来自注射器的手动或机械压力等的机构。优选地,流体间接地由泵移位,而流体不会直接接触设备的移动零件中的任何一个,所述泵例如像作用在流体填充管上的蠕动泵。替代地,可使用气动移位机构,其中压头压力将液体从加压器皿移位。相反,当流体通过直接接触设备的移动零件中的任何一个(例如像注射器泵的柱塞)而被移位时,流体可直接由设备移位。
134.泵可包括用于监测流速的流量传感器,或者流量传感器可向泵控制系统提供闭环反馈。闭环反馈可确保准确度并减少脉冲。泵使包含在柔性管材中的流体移位,以产生流体
束流。系统可与内联流量传感器一起操作,所述内联流量传感器被构造来在流体经过传感器时直接测量流体流速。在一些实施方案中,系统包括与流体移位设备和内联流量传感器连通的反馈控制。内联流量传感器测量流量并与反馈控制机构连通。合适类型的流量传感器机构包括热脉冲、超声波、声波、机械等。内联传感器可以是基于机械的、基于电的、基于运动的或基于微机电系统(mems)的。传感器机构可以是热的、超声的或声学的、电磁的或差压的。适于根据本公开使用的传感器的一个实例是热型流量传感器,其中所述传感器通常具有基板,所述基板包括加热元件和一个或两个接近的热接收元件。当使用两个感测元件时,它们优选地相对于要测量的流体(液体或气体)流的方向定位在加热元件的上游侧和下游侧。当流体沿着基板流动时,它由位于上游侧的加热元件加热,并且然后热量非对称地被转移到加热元件任一侧上的热接收元件。因为非对称的程度取决于流体流的速率并且所述非对称可以电的方式被感测到,所以可使用这种流量传感器来确定流体流的速率和累积量。此机构允许在任一方向上对流量进行测量。在一个优选实施方案中,温度传感器和加热元件与流体输送管的外部热接触,并且由于流体束流仅接触管的内表面,因此流体介质避免与传感器和加热元件直接接触。此格式类型允许执行高准确度和高灵敏度的流量测量。
135.流体细胞处理与电穿孔装置的整合
136.流体细胞处理与电穿孔装置(例如,芯片)的整合允许将更大功能构建到系统中。例如,多通道流式装置可并入利用磁珠分选方法来选择要通过电穿孔处理的细胞的能力。作为一个实例,图11示出流体流式装置示意图,其以平面格式描绘用于磁性细胞选择和电穿孔的单独区域。
137.流式装置的光学透明性使得能够光学监测过程。材料可包括但不限于玻璃、石英、聚合物、基板透明基板上的金属膜。
138.可使用与给定细胞类型的特定抗体偶联的磁珠来实现对多种t细胞和b细胞的选择。存在若干个超顺磁珠的商业制造商,包括dynal和seradyn,这些超顺磁珠具有通常在2微米与5微米之间的多种不同大小。这些珠可用于从例如cd8+、cd3+、cd4+和cd19+细胞的流进行正选择或耗尽。磁场内部磁性粒子上的力(f)取决于粒子的体积(v)、粒子与周围流体之间的磁化率差异(δχ)以及磁场的绝对强度和梯度(b):通过在流体装置内建立大磁场和大磁场梯度,结合了与适当抗体偶联的磁珠的细胞可相对于流保持静止。在这种情况下,磁力必须强于珠上的来自流的拖曳力,并且能够克服珠的随机扩散运动。
139.为了在流体装置内建立足够的磁场,可将特征为在极点表面处具有多至500mt磁通密度的小型钕铁硼(ndfeb)磁体放置在平面表面附近。这些磁体的可商购版本允许操纵微通道内部的磁性粒子或细胞,即使当磁体放置在距通道若干毫米距离处时也是如此。将磁体从表面附近移除将释放细胞。可购买直径大小在0.01cm至10cm范围内和包括圆柱体、立方体、环等不同几何形状的这些磁体。另外,商业电磁体可用于建立必要的场和梯度,但因相对较高电流产生的焦耳加热使这些电磁体在小体积应用中更成问题。还可通过沉积导电金属(如金或铂)在平面表面上制造电极。另外,可在存在外部磁场的情况下通过在流体层内沉积和图案化磁性金属(通常是镍或铁)来增强流体内的磁场。将磁体从表面附近移除将释放细胞。替代地,装置和或磁源可以是可移动的。
140.测量细胞在上游和下游的性质以测量电穿孔的有效性。这需要流动以及持续地监
测含细胞液体的电性质(例如电阻)的能力。还可监测电穿孔脉冲期间电阻的改变,其中时间相关i-v关系将提供有关电穿孔过程有效性的信息。这与可能存在的并不监测连续流动过程期间的影响的其他系统不同。
141.电穿孔后细胞操纵:在电穿孔之后,可将细胞移动到装置中的另外的区域以供二次处理或转移。可将细胞从装置流体出口(或流体接口部件)转移到无菌的多孔培养皿或器皿并暴露于第二组条件。例如,在37℃下暴露30-40分钟。将细胞悬浮在细胞培养基中并进行培养以供立即使用或冷冻保存。
142.系统可使用磁珠或微流体柱亲和分离来丰富选择的细胞类型以进行电穿孔和转染。输入端是从患者收集的白血细胞,并且输出端是用于扩增的常规细胞培养袋。
143.示例性过程和部件示出于图12中。
144.另外,所述过程的零件或部分可连接到过程的其他处理装备或阶段。例如,在图13中,电穿孔装置和部件可用更传统的细胞处理硬件来实现。
145.需要用于选择最佳受体分子的改进方法,利用所述最佳受体分子来修饰免疫系统细胞以开发用于个体化和精确靶向免疫疗法的治疗。使用基于流的电穿孔系统,可及时改变提供到输入端的材料,使得可产生细胞和插入分子的许多不同组合以用于产生疾病(诸如癌症)的候选细胞治疗的库的目的。通过从此库进行选择,医生可选择最佳类型的修饰细胞来治疗特定人的疾病。此外,基于多输入流的电穿孔系统可用于产生或制造具有如针对个体患者规定的不同化学修饰的专门设计的细胞组合。以此方式,所公开的方法可有利于对许多不同类型的癌症和疾病的高度个体化的基于免疫疗法的治疗。
146.图14中示出的是用于在电穿孔装置中快速受控地处理细胞的通用系统的配置。在电穿孔过程期间控制和改变多个流体输入的能力带来许多优点。通过在电穿孔期间作为时间的函数改变各种流体束流的组成,并将所得材料收集到不同收集器皿中,如图14所示,可收集和评估一系列电穿孔条件以确定例如用于转染特定细胞类型的最佳条件,或者改变束流中的分子以评估一系列生物分子以便确定哪些生物分子可对治疗性用途有价值。这种组合过程可大大地减少测试新化合物和开发基于细胞的疗法所需的时间。图15表明流体束流的化学性质或含量可独立地变化和控制以可控地改变电穿孔条件。化学组合可包括但不限于缓冲液、盐、酸、碱、碳水化合物、肽、蛋白质、脂质和小药物分子。
147.此能力的另一个优点是使得能够处置小体积流体或小量细胞和试剂样品以供研究。这在细胞可为稀有或者生物分子可为稀有或珍贵的研究中特别有价值。此类体积包括皮升、纳升、微升和毫升体积。
148.独立地控制流体束流的组成包括可能的微流体整合功能以用于预处理和后处理。图11示出沿着流动通道的不同位置处的流体输入。这使得能够在电穿孔之前、期间和/或之后产生例如不同的化学条件。这可在如图11所示的相同装置(例如,芯片)上或在如图14所示的单独但连接的芯片上进行。此能力的一个重要实例包括在电穿孔之前处理或选择细胞。
149.另一个重要的应用是在电穿孔之前、期间或之后维持用于细胞的不同化学条件。这是有价值的,例如,因为就长期而言,有效电穿孔和分子转移到细胞的条件对于细胞可能是不健康或不期望的。因此,在电穿孔后改变流体的化学组成使得能够在电穿孔之后立即改变用于细胞的流体条件。例如,这可通过在变化的含化学品溶液(诸如在其中细胞可有效
地维持更长时间的包含营养物的培养基)中流动来完成。这种营养培养基可被简单地引入电穿孔区域的下游,以稀释在电穿孔期间使用的流体并建立细胞可更长时间地保持活力或功能的条件。
150.在此类整合系统中,存在用于通过在电穿孔过程之前或之后高效地处理材料或维持不同化学条件来增强电穿孔样品的价值的许多其他能力。
151.图15中示出的是例示用于改变流动束流中的输入材料以产生细胞和试剂的选择和变化组合,以便被组合来产生修饰细胞的两种可能性的图。
152.实施例
153.将参考以下具体实施例进一步说明本公开。这些实施例以说明方式给出,并且并不意在限制本公开或随附的权利要求。
154.实施例1:利用dna质粒来对哺乳动物细胞进行电穿孔
155.此实施例描述使用流式电穿孔装置来利用dna质粒对哺乳动物细胞进行电穿孔的实施方案。使用所描述的流通式电穿孔装置利用表达绿色荧光蛋白的质粒来对中国仓鼠卵巢(cho-k1)细胞(atcc)进行电穿孔。可基于对碘化丙啶的摄取确定细胞活力。可使用相对于细胞总数表达绿色荧光蛋白的细胞数的荧光观察来确定电穿孔效率。
156.在37℃和5%co2的培养箱中培养细胞。可在合成培养基中培养细胞,所述合成培养基诸如补充有10%胎牛血清(sigma)和100mg/ml链霉素(sigma)的dulbecco改良eagle最小必需培养基(dmem,sigma,st.louis,mo)。当细胞悬液密度达到一定值,例如2
×
106个细胞/ml时,用另外的培养基稀释细胞悬液。在引入装置中之前,将10ml悬液样品以300g离心5min。丢弃上清液,并将细胞重新悬浮在低电导率缓冲液(如下所述)中。用于电穿孔的细胞悬液密度优选为1x108个细胞/ml,范围在1x107个细胞/ml与1x109个细胞/ml之间。
157.低电导率缓冲液由0.8mm na2hpo4、0.2mm kh2po4、0.1mm mgso4·
7h2o和250mm蔗糖在ph为7.4下组成。这种缓冲液是通过将0.1136g的na2hpo4、0.0272g的kh2po4、0.02465g的mgso4·
7h2o和85.575g的蔗糖溶解在1升水中并随后调整ph来制成的。蔗糖用于平衡缓冲液的渗透压与细胞的渗透压。缓冲液用0.2微米膜过滤并被储存在4℃下。如所描述的缓冲液中盐的浓度导致溶液的电导率为大约0.014s/m。这种缓冲液的电导率的优选范围在1
×
10-3
与2.5s/m之间。
158.pacgfp-c1质粒(4.7kb,clontech,mountain view,ca)编码来自墨绿多管水母(aequorea coerulescens)的绿色荧光蛋白(gfp),并且包含用于在哺乳动物细胞中复制的sv40起点。gfp蛋白在475nm处被激发,并且在505nm处发射。根据制造商的说明书,质粒在大肠杆菌中进行扩增并使用qiafilter plasmid mega kit(qiagen,valencia,ca)进行纯化。将质粒dna溶解在tris-edta缓冲液中并储存在-20℃下直到使用为止。通过260nm处的紫外(uv)吸光度确定质粒dna浓度。在电穿孔实验之前,质粒用乙醇沉淀并以大约40ug/ml的浓度重新悬浮在电导率为大约1.5s/m的磷酸盐缓冲盐水(pbs、137mm nacl、2.7mm kcl、10mm na2hpo4、1.8mm kh2po4)缓冲液中。这种缓冲液的电导率的范围在1
×
10-2
与10s/m之间。质粒浓度的范围在0.01ug/ml与100ug/ml之间。
159.用于细胞流入口105(图2)的低电导率缓冲液与用于上部鞘入口104流层和下部鞘入口103流层(图2)的较高电导率缓冲液(pbs)组合使用导致对于给定施加电压,跨细胞流层的电场显著更大。对于典型的实验,调整每个流的压力,使得细胞流层的深度为大约50微
米并且上部鞘流层和下部鞘流层的深度各自为大约25微米。低电导率缓冲液和高电导率缓冲液的电导率分别为0.014s/m和1.5s/m。鞘层的电阻(对于如图2所示在两个支撑块表面100之间施加的电压)为总电阻的大约99%。这意指如果在两个支撑块上的电极之间施加5v,则与电极相邻的束流中的电场为大约9v/cm,而夹置在这两个束流之间的束流为991v/cm。
160.已知,某个细胞的内部与外部之间大约1v的差值将导致形成可允许核酸分子通过的孔。在强度为e的外部电场中,在细胞表面上某一点处跨细胞膜的电势差u由u=fer cosθ给出,其中r是细胞半径,θ是电场与细胞表面的法线之间的角度,并且f是通常为大约3/2的几何因子。这意味着为了在细胞的极点处形成孔,对于半径为8微米的细胞,电场应为约1kv/cm。
161.利用这种电穿孔装置,鉴于所描述的电场强度和流层深度,在顶板与底板之间施加5v电势差导致细胞流层内的电场为约1kv/cm。所施加电压的优选范围在1v与100v之间。如果图案化电极的大小为2.5cm
×
0.5cm,则对于5v所施加电压,生成约0.17a的电流并且耗散0.87j/s的功率。假设通过边界没有热量被消散,这种功率的量将使尺寸为5cm乘以2.5cm乘以0.01cm的装置中纯水的温度增大1.7度c/s。所施加电压的源可来自具有固定电压的电池或与电阻分压器结合使用以使得电压能够在所选择范围内变化的电池。商业电压供应器也可容易地获得以提供在1v至100v范围内的选择电压。替代性电极大小实例包括尺寸为2.5cm乘以0.05cm的电极,然后对于5v所施加电势,生成约0.017a的电流并且耗散0.087j/s的功率。这种功率的量将使尺寸为5cm乘以2.5cm乘以0.01cm的装置中纯水的温度增大0.17度c/s。在典型的实验中,密度为1.0x107/ml的细胞以大约1.5ml/min的体积速率流动通过装置(例如,芯片),所述体积速率的优选范围在0.01ml/min与100ml/min之间。1.5ml/min的标称流速导致平均线性流速为1.0cm/s。在此速度下,细胞经受来自宽度和长度为2.5cm乘以0.5cm的电极的电场持续0.5s。假设hele-shaw流,跨装置(例如,芯片)的输入端和输出端的压力差为约40atm。重要的是需注意,假设质粒处于下部鞘流中并且顶部电极保持在与底部电极相比更高电压处,在细胞经受电场的大约0.5s期间,朝向细胞流层电泳地驱动质粒dna。假设dna迁移率为4x10-4
cm2/vs,dna分子移动通过25微米距离(包含质粒的鞘流层的典型深度)的一半所花费的平均时间为0.34s。到达细胞流层的dna分子在约10ms内被驱动跨过所述细胞流层。
162.另一个重要的时间尺度是降落细胞流层厚度二分之一距离的细胞沉降时间。再次假设细胞半径为8微米,细胞与周围流体之间的密度差为0.07g/cm3,并且细胞的流体动力摩擦系数为6πηr,其中η是缓冲液粘度(大约0.001pa,但对于添加剂化学品(诸如蔗糖)可能更高),下降25微米距离的时间为大约0.4s。并且典型的盐离子(诸如na或k)扩散25微米距离的时间为0.6s。这表明当图案化电极的宽度和长度为约2.5cm乘以0.5cm时,流层在细胞跨电极区域所花费的时间内保持层流(并保持其相应的电导率)。
163.在对给定体积的细胞进行电穿孔后,通过相衬和静态荧光成像并且有时通过流式细胞术来确定电穿孔效率和细胞活力。在于流式装置(例如,芯片)中利用gfp表达质粒来对细胞进行电穿孔之后,收集细胞并将其转移到具有适当细胞培养基(诸如dmem)的96或24孔板。将细胞在37℃下在具有5%co2的培养箱中培养1小时、6小时、12小时、24小时或48小时。将细胞以300g离心5min,并且丢弃吸液。将细胞用pbs洗涤,并且重复此过程。此后,将细胞
用浓度为大约1微克/ml的碘化丙啶(invitrogen)染色。将细胞在黑暗中孵育15min,并且然后在荧光滤光器下通过相衬进行光学检查。使用标准gfp滤光器套件来确定细胞的已利用质粒电穿孔的部分。使用在488nm处激发并且在大约620nm处发射的滤光器套件来确定已被碘化丙啶透化的死细胞。可在不同位置处获取若干个图像以改进对电穿孔效率和细胞活力的统计。还可通过流式细胞术检查细胞以确定如由绿色荧光信号鉴定的已被电穿孔的部分和如由碘化丙啶的摄取量和红色荧光信号鉴定的死亡的部分。
164.因此,所描述的装置可以可靠地用于在短时间内以高效率和低细胞死亡对大量哺乳动物细胞或细菌细胞进行电穿孔。可用质粒dna转染细胞,所述质粒dna可转录成对疾病有治疗作用的蛋白质。可用mrna转染细胞,所述mrna同样被转录成用于改善细胞健康所必需或者可收获用于其他医学用途(诸如生产抗体)的蛋白质。还可用纯化cas9蛋白或另一种dna引导的核酸酶和合成的引导rna分子(称为核糖核蛋白)转染细胞,以高效地编辑有害的基因组位点。
165.实施例2:对不同类型的细胞和分子进行电穿孔
166.实施例1中概述的方法可用于电穿孔对多种不同哺乳动物细胞类型进行电穿孔,所述多种不同哺乳动物细胞类型包括:cho、hela、t细胞、cd8+、cd4+、cd3+、pbmc、huh-7、renca、nih 3t3、原代成纤维细胞、hmsc、k562、vero、hek 293、a549、b16、bhk-21、c2c12、c6、caco-2、cap-t、cos-1、cos-7、cv-1、dld-1、h1299、hep g2、hos、jurkat、l5278y、lncap、mcf7、mda-mb-231、mdck、间充质干细胞、min-6、neuro2a、nih3t3l1、nso、panc-1、pc12、pc-3、rbl、rle、sf21、sf9、sh-sy5y、sk-mes-1、sk-n-sh、sl3、sw403、thp-1、u20s和u937。
167.实施例1中概述的方法可用于将多种不同类型的分子电穿孔到任何哺乳动物细胞,所述多种不同类型的分子包括:dna、rna、mrna、sirna、mirna、其他核酸、蛋白质、肽、酶、代谢物、膜不可渗透药物、冷冻保护剂、外源细胞器、分子探针、纳米颗粒、脂质、碳水化合物、小分子和蛋白质与核酸的复合物(如cas9-sgrna)。虽然实施例1中概述的方法依赖于电场将带电荷核酸分子递送到经电穿孔的细胞,但所述方法也足以进行中性分子的电穿孔,其中扩散运动对于递送是足够的。
168.实施例3:使用电压波形进行电穿孔
169.实施例1中概述的方法可用于利用多种不同施加的电压波形来对细胞进行电穿孔。当施加频率为10khz并且峰至峰电压差为大约10v的方形波形时,可对细胞进行电穿孔。峰至峰电压差的优选范围在0.1v与100v之间。频率的优选范围在100hz与1thz之间。方形波可以是双极的,使得时间平均电流为零。方波还可具有优选地小于正负10v的另外的dc分量。所施加波形可以是正弦的、锯齿形、矩形、三角形,或者可以是时间上具有不同频率和振幅的任何数量的正弦形状的总和。
170.实施例1中概述的方法可用于通过向不同电极对施加不同电压波形来提高细胞电穿孔的效率。第一电极对可用于施加频率为10khz并且峰至峰电压差为大约10v的方形波形,以透化在流体通道中经过的细胞的膜。第二对电极或第三对电极或更多对电极可用于施加优先将带电荷分子(如核酸)朝向所透化细胞引导的dc或振荡电压。第二对电极或第三对电极或更多对电极可用于对溶液中的细胞或分子施加电力,这在溶液中细胞与流体、分子与流体之间或细胞与带荷电分子或中性分子之间产生相对速度。由第二对电极或更多对电极施加的电压振幅或偏移的优选范围在1mv与100v之间。第二对电极或更多对电极可用
于施加沿着装置中的流动方向或垂直于流动方向的电力。用于施予电力的电极对可位于装置的相同表面或相对表面上,其中每个表面与流体接触。第二电极对可用于在膜被穿孔之后透化细胞内的结构。第二对电极或更多对电极可用于施加电场,所述电场导致位于变化电导率的流体层之间的界面处的核酸或其他分子的浓度增大。第二对电极或更多对电极可用于施加致使细胞旋转,因此更大表面积暴露于溶液中的核酸或其他分子的电场。
171.尽管本文已经详细描绘和描述了各种实施方案,但对于相关领域的技术人员来说将显而易见的是,在不脱离本公开的精神的情况下可作出各种修改、添加、替换等,并且因此这些修改、添加、替换等应认为落在如随后的权利要求中所限定的本公开范围内。
172.以引用方式并入
173.本文提及的所有美国专利和美国和pct专利申请公开特此以引用方式整体并入,就如同每个单个专利和专利申请公开具体地和单个地被指示为以引用方式并入一样。在发生冲突的情况下,将以本技术(包括本文中的任何定义)为准。
174.等效物
175.本领域技术人员将认识到或者能够仅仅使用常规实验来探究本文所描述的本发明的具体实施方案的许多等效物。此类等效物意图由以下权利要求涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1