多巴胺-Β-羟化酶抑制剂的制作方法
多巴胺-β-羟化酶抑制剂
技术领域
1.本发明涉及:(a)可用作多巴胺-β-羟化酶抑制剂的化合物及其药学上可接受的盐或溶剂化物;(b)包含此类化合物、盐或溶剂化物的药物组合物;(c)此类化合物、盐或溶剂化物在治疗中的用途;和(d)使用此类化合物、盐或溶剂化物来治疗的治疗方法。
背景技术:
2.多巴胺-β-羟化酶(dβh),也称为多巴胺β-单加氧酶,在外周和中枢神经系统(cns)中均表达。dβh催化多巴胺(da)的特定羟基化以产生正肾上腺素(norepinephrine),也称为去甲肾上腺素(noradrenaline;na)。因此,dβh抑制剂可抑制na的生物合成,限制其浓度并且增加da水平。
3.近年来,在开发dβh抑制剂方面中的关注集中于以下假设:这种酶的抑制可在罹患心血管病症诸如高血压或慢性心脏衰竭的患者中提供显著的临床改善。使用dβh抑制剂的基本原理是基于其抑制na的生物合成的能力,所述生物合成经由da的酶法羟基化来实现。经由抑制dβh来减少na的生物合成可直接减弱交感神经功能,所述功能的激活是充血性心脏衰竭的主要临床表现(parmley,w.w.,clin.cardiol.,18:440-445,1995)。充血性心脏衰竭患者的血浆去甲肾上腺素浓度升高(levine,t.b.等人,am.j.cardiol.,49:1659-1666,1982)、中枢交感神经传出增加(leimbach,w.n.等人,circulation,73:913-919,1986)以及心肾去甲肾上腺素溢流增强(hasking,g.j.等人,circulation,73:615-621,1966)。心肌长期和过量暴露于去甲肾上腺素可导致心脏β
1-肾上腺素受体下调、左心室重塑、心律失常和坏死,所有此类情形都会降低心脏的功能完整性。血浆去甲肾上腺素浓度高的充血性心脏衰竭患者的长期预后也最不利(cohn,j.n.等人,n.engl.j.med.,311:819-823,1984)。较为显著的是,观察到没有明显心脏衰竭的无症状患者中的血浆去甲肾上腺素浓度已经升高,并且可预测随后的死亡率和发病率(benedict,c.r.等人,circulation,94:690-697,1996)。因此,激活的交感神经驱动不仅是充血性心脏衰竭的临床标志,而且可能导致疾病的进行性恶化。
4.如果dβh抑制剂穿越血脑屏障(bbb),则其也可能显示出cns活性。
5.迄今为止,在文献中已经报导了几种dβh抑制剂。发现早期第一代和第二代实例,诸如二硫仑(disulfiram)(goldstein,m.等人,life sci.,3:763,1964)和二乙基二硫代氨基甲酸盐(lippmann,w.等人,biochem.pharmacol.,18:2507,1969)或镰刀菌酸(fusaric acid)(hidaka,h.nature,231,1971)和芳族或烷基硫脲(johnson,g.a.等人,j.pharmacol.exp.ther.,171:80,1970)的效力较低,表现出对于dβh的较差选择性并引起毒副作用。然而,发现第三代dβh抑制剂,诸如内匹司他(nepicastat)(rs-25560-197,ic
50 9nm)(stanley,w.c.,等人,br.j.pharmacol.,121:1803-1809,1997)的效力大得多,其已被开发至早期临床试验。尽管其最初是针对外周适应症(高血压和充血性心脏衰竭)而开发的,但是有一项重要发现,发现内匹司他可穿越bbb,从而能够产生中枢以及外周作用。
6.内匹司他及其类似物公开于wo95/29165。此外,wo 2004/033447和wo 2008/
136695公开了效力高且脑部进入显著减少的dβh抑制剂,产生了有效和外周选择性的dβh抑制剂。然而,这些化合物也难以合成,其合成路线中需要许多步骤,使其制造昂贵。具体地说,wo 2008/136695中公开的有效化合物是略溶的,并且展示出在与高脂餐一起施用时暴露水平提高。beliaev,a.等人在current enzyme inhibition,5,27-43,2009中综述了dβh的基质、底物和抑制剂。
7.wo2018/056854和wo2018/056855公开了可用于治疗通过抑制cns内的dβh来改善的疾患的dβh抑制剂。与本发明的式i化合物相比,wo2018/056854和wo2018/056855的化合物在稠合咪唑环的3号位具有不同的取代基。
8.wo2019/112457(在本技术的优先权日期之后公布)公开了可用于治疗通过抑制cns外部的dβh来改善的疾患的dβh抑制剂。其中公开的具体化合物包括(r)-1-(3-(吡咯烷-1-基)丙基)-6-(2,3,5,6-四氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮盐酸盐(实施例219)、(r)-1-(3-(吡咯烷-1-基)丙基)-6-(2,3,5,6-四氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮(实施例471)和(r)-1-(3-(吡咯烷-1-基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮氢氟酸盐(实施例478)。
[0009]
因此,对于可用于治疗某些心血管病症的有效、无毒和外周选择性的dβh抑制剂的临床需求仍然未得到满足。与迄今为止在现有技术中描述的所有dβh抑制剂化合物相比,以下dβh抑制剂将提供显著改善,其效力与内匹司他类似或甚至更大,但没有cns作用(即不能有效穿越bbb),但在外周表现出较长的停留时间以便提供较长持续时间的dβh抑制。另外,此类化合物优选是口服可生物利用的、高度可溶并且合成更容易且更廉价。
技术实现要素:
[0010]
本发明提供一种式i化合物或其药学上可接受的盐或溶剂化物:
[0011][0012]
其中:
[0013]
r1是氢;
[0014]
r2是氢;并且
[0015]
r3是氢、甲基、6元杂环基或ch2x,其中x是5元或6元杂环基;或
[0016]
r2是甲基;并且
[0017]
r3是甲基、5元或6元杂环基或ch2x,其中x是5元或6元杂环基;或
[0018]
r2和r3与其所连接的n原子一起组合以形成任选地被一个氟基取代基取代的5元或6元n-杂环基;
[0019]
r4是氢;并且
[0020]
r5是氢;或
[0021]
r4和r5与其所连接的碳原子一起组合以形成环丙基环;并且
[0022]
a是
[0023][0024]
其中:
[0025]
x1是氢或卤基;
[0026]
x1’
是氢或卤基;
[0027]
x2是氢或卤基;
[0028]
x2’
是氢或卤基;并且
[0029]
x3是氢;
[0030]
限制条件是化合物(r)-1-(3-(吡咯烷-1-基)丙基)-6-(2,3,5,6-四氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮盐酸盐、(r)-1-(3-(吡咯烷-1-基)丙基)-6-(2,3,5,6-四氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮和(r)-1-(3-(吡咯烷-1-基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮氢氟酸盐被排除在外。
[0031]
本发明还涉及一种如上文所定义的式i化合物或其药学上可接受的盐或溶剂化物,其用于疗法。
[0032]
本发明还涉及一种如上文所定义的式i化合物或其药学上可接受的盐或溶剂化物,其用于治疗通过抑制cns外部的dβh来改善的疾患。
[0033]
本发明涉及一种如上文所定义的式i化合物或其药学上可接受的盐或溶剂化物,其在制造用于治疗通过抑制cns外部的dβh来改善的疾患的药剂中。
[0034]
本发明还涉及一种用于治疗或预防通过抑制cns外部的dβh来改善的疾患的方法,其包括向有需要的患者施用治疗有效量的如上文所定义的式i化合物或其药学上可接受的盐或溶剂化物。
[0035]
本发明还涉及一种药物组合物,其包含(i)治疗有效量的如上文所定义的式i化合物或其药学上可接受的盐或溶剂化物;和(ii)药学上可接受的赋形剂。
[0036]
某些式i化合物可以互变异构体形式存在。在存在互变异构体的情况下,每种互变异构形式及其混合物都被认为包括在本发明中。在本说明书中对式i化合物的一种特定互变异构体的任何提及应理解为涵盖每种互变异构形式以及其任何比率的任何混合物。此情况同样适用于本文所述的式i的化合物的更具体实施方案的互变异构体,诸如但不限于下文所述的式ia、ib、ic、id、ie和if化合物的互变异构体,以及在下文的实验部分中描述的特定实例的互变异构体。
附图说明
[0037]
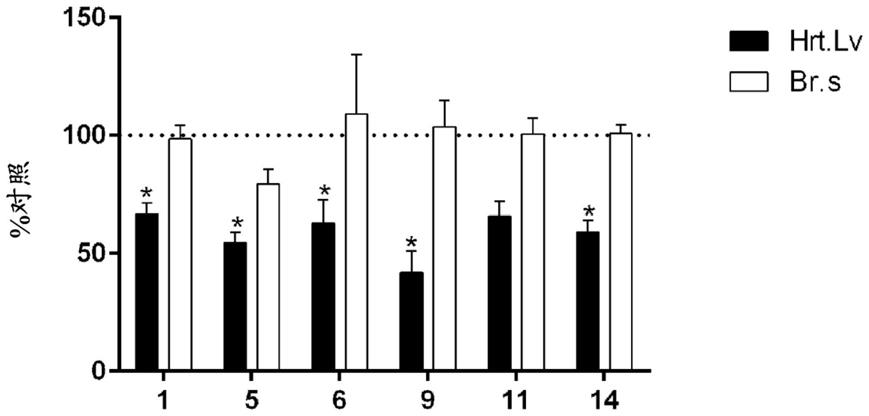
图1显示出在口服施用10mg/kg化合物1、5、6、9、11和14之后给药后15h的脑干(br.s)和左心室(hrt.lv)中去甲肾上腺素(na)的水平。资料以对照的%来表示。每个柱条表示每组4至5只大鼠的平均值
±
sem。
具体实施方式
[0038]
a.定义
[0039]“c
1-c6烷基”意指具有1至6个碳原子的单价未取代的饱和直链或支链烃基。“c
1-c2烷基”、“c
1-c3烷基”、“c
1-c4烷基”和“c
1-c5烷基”具有相似含义。
[0040]“部分或完全氘化的c
1-c6烷基”意指一些或全部氢原子被氘替换的c
1-c6烷基。
[0041]“c
3-c6环烷基”意指具有3至6个碳原子的单价未取代的饱和环烃基。
[0042]“5元或6元杂环基”意指在环中具有总共5个原子的饱和单环基团,其中那些原子中的1个或2个各自独立地选自n、o和s;或在环中具有总共6个原子的饱和单环基团,其中那些原子中的1个或2个各自独立地选自n、o和s。5元杂环基包括吡咯烷基、四氢呋喃基、四氢噻吩基(也称为四氢苯硫基)、咪唑烷基、吡唑烷基、二氧戊环基、二硫戊环基、噁唑烷基、异噁唑烷基、噻唑烷基和异噻唑烷基。6元杂环基包括哌啶基、四氢吡喃基、四氢噻喃基、哌嗪基、二噁烷基、二噻吩基、吗啉基和硫吗啉基。
[0043]“5元或6元n-杂环基”意指在环中具有总共5个原子的饱和单环基团,其中那些原子中的1个是n并且那些原子中的另一个任选地选自n、o和s;或在环中具有总共6个原子的饱和单环基团,其中那些原子中的1个是n并且那些原子中的另一个任选地独立地选自n、o和s。5元n-杂环基包括吡咯烷基、咪唑烷基、吡唑烷基、噁唑烷基、异噁唑烷基、噻唑烷基和异噻唑烷基。6元n-杂环基包括哌啶基、哌嗪基、吗啉基和硫吗啉基。
[0044]“卤基”意指氟(其可表示为-f)、氯(其可表示为-cl)、溴(其可表示为-br)或碘(其可表示为-i)基。
[0045]“药学上可接受的盐”意指诸如关于盐形成的标准教科书中所描述的盐的盐,参见例如:p.stahl等人,handbook of pharmaceutical salts:properties,selection and use(vcha/wiley-vch,2002)或s.m.berge等人,“pharmaceutical salts”(1977)journal of pharmaceutical sciences,66,1-19。
[0046]“药学上可接受的溶剂化物”意指包含本发明的化合物和一种或多种药学上可接受的溶剂分子例如水或乙醇的分子复合物。当所述溶剂是水时,可采用术语“水合物”。药学上可接受的溶剂化物包括水合物和其他溶剂化物,其中结晶的溶剂可被同位素取代,例如d2o、d
6-丙酮、d
6-dmso。
[0047]“药学上可接受的赋形剂”意指除本发明的化合物或其他已知药理活性组分以外的任何成分。赋形剂的选择在很大程度上取决于诸如特定施用方式、赋形剂对溶解度和稳定性的作用以及剂型的性质的因素。
[0048]“疗法”、“治疗(treatment)”和“治疗(treating)”包括对疾患、疾病或病症的预防性和治愈性治疗。其还包括减缓、中断、控制或停止疾患、疾病或病症的进展。其还包括预防、治愈、减缓、中断、控制或停止疾患、疾病或病症的症状。
[0049]
根据公开内容的研究和所附权利要求,本领域技术人员在实践所要求保护的发明
时可理解和实现所公开的实施方案的其他变化形式。在权利要求中,“包括”一词不排除其他要素或步骤,并且不定冠词“一个(种)(a/an)”不排除复数个(种)。在彼此不同的附属权利要求中叙述的某些措施的事实并不表示不能有利地使用这些措施的组合。
[0050]
b.化合物
[0051]
本发明提供一种如上文所定义的式i化合物或其药学上可接受的盐或溶剂化物:
[0052][0053]
限制条件是化合物(r)-1-(3-(吡咯烷-1-基)丙基)-6-(2,3,5,6-四氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮盐酸盐、(r)-1-(3-(吡咯烷-1-基)丙基)-6-(2,3,5,6-四氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮和(r)-1-(3-(吡咯烷-1-基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮氢氟酸盐被排除在外。
[0054]
b0.核心结构
[0055]
在式i的一些实施方案中,r4和r5与其所连接的碳原子一起组合以形成式ia的结构:
[0056][0057]
在一些实施方案中,式i化合物的超过50%、优选超过90%、更优选超过95%和甚至更优选超过99%的取代基r5和a具有式ib的立体化学构型
[0058][0059]
在式ib一些优选实施方案中,r4和r5与其所连接的碳原子一起组合以形成环丙基环以使得超过50%、优选超过90%、更优选超过95%和甚至更优选超过99%的取代基a具有式ic的立体化学构型
[0060][0061]
在一些实施方案中,式i化合物的超过50%、优选超过90%、更优选超过95%和甚至更优选超过99%的取代基r5和a具有式id的立体化学构型
[0062][0063]
式i的优选实施方案包括式ie化合物
[0064][0065]
式i的其他优选实施方案包括式if化合物
[0066][0067]
其中y是氢或氟基。
[0068]
b1.取代基r1[0069]
r1是氢。
[0070]
b2.取代基r2和r3[0071]
r2是氢;并且
[0072]
r3是氢、甲基、6元杂环基或ch2x,其中x是5元或6元杂环基;或
[0073]
r2是甲基;并且
[0074]
r3是甲基、5元或6元杂环基或ch2x,其中x是5元或6元杂环基;或
[0075]
r2和r3与其所连接的n原子一起组合以形成任选地被一个氟基取代基取代的5元或6元n-杂环基。
[0076]
在一些实施方案中,r2是氢并且r3是氢、甲基、6元杂环基或ch2x,其中x是6元杂环基。
[0077]
在一些实施方案中,r2是甲基并且r3是甲基、5元或6元杂环或ch2x,其中x是6元杂环基。
[0078]
在一些实施方案中,r2和r3与其所连接的n原子一起组合以形成任选地被一个氟基取代基取代的5元或6元n-杂环基。
[0079]
在一些优选实施方案中,r2是氢并且r3是氢、甲基、四氢吡喃基或ch2x,其中x是四
氢吡喃基。
[0080]
在一些优选实施方案中,r2是甲基并且r3是甲基、四氢呋喃基、四氢吡喃基或ch2x,其中x是四氢吡喃基。
[0081]
在一些优选实施方案中,r2和r3与其所连接的n原子一起组合以形成吡咯烷基、3-氟吡咯烷基、哌啶基或吗啉基。
[0082]
b3.取代基r4(未与r5结合时)
[0083]
r4是氢。
[0084]
b4.取代基r5(未与r4结合时)
[0085]
r5是氢。
[0086]
b5.取代基a
[0087]
a是
[0088][0089]
其中:
[0090]
x1是氢或卤基;
[0091]
x1’
是氢或卤基;
[0092]
x2是氢或卤基;
[0093]
x2’
是氢或卤基;并且
[0094]
x3是氢。
[0095]
优选地,a是
[0096][0097]
其中:
[0098]
x1是氢、氟基或氯基;
[0099]
x1’
是氢、氟基或氯基;
[0100]
x2是氢、氟基、氯基或溴基;
[0101]
x2’
是氢、氟基、氯基或溴基;并且
[0102]
x3是氢。
[0103]
更优选地,a是
[0104][0105]
其中:
[0106]
x1是氢或氟基;
[0107]
x1'是氟基;
[0108]
x2是氟基或氯基;
[0109]
x2’
是氢;并且
[0110]
x3是氢。
[0111]
在一个优选实施方案中,不是所有x1、x1'、x2、x2'和x3都是氢。优选地,a选自由以下组成的组
[0112][0113]
更优选地,a选自由以下组成的组
[0114][0115]
甚至更优选地,a选自由以下组成的组
[0116][0117]
最优选地,a选自由以下组成的组
[0118][0119]
b6.式i化合物的具体实施方案
[0120]
取代基r1、r2、r3、r4、r5、a、x、x1、x1’
、x2、x2’
和x3的各种实施方案都在上文b1至b5中讨论。这些“取代基”实施方案可与上文b0中讨论的任何“核心结构“实施方案组合,以形成式i化合物的进一步实施方案。通过将上文讨论的“取代基”实施方案和“核心结构”实施方案组合而形成的式i化合物的所有实施方案均处于申请人发明的范围内,并且下文提供了式i化合物的一些优选进一步实施方案。
[0121]
在式i的一些实施方案中,式ie的结构是高度优选的
[0122][0123]
其中:
[0124]
r2是氢;并且
[0125]
r3是氢、甲基、6元杂环基或ch2x,其中x是5元或6元杂环基;或
[0126]
r2是甲基;并且
[0127]
r3是甲基、5元或6元杂环基或ch2x,其中x是5元或6元杂环基;或
[0128]
r2和r3与其所连接的n原子一起组合以形成任选地被一个氟基取代基取代的5元或6元n-杂环基。
[0129]
优选地,其中:
[0130]
r2是氢;并且
[0131]
r3是氢、甲基、四氢吡喃基或ch2x,其中x是四氢呋喃基或四氢吡喃基(tetraydropyranyl);或
[0132]
r2是甲基;并且
[0133]
r3是甲基、四氢呋喃基、四氢吡喃基或ch2x,其中x是四氢呋喃基或四氢吡喃基;或
[0134]
r2和r3与其所连接的n原子一起组合以形成3-氟吡咯烷基或吗啉基。
[0135]
在式i的一些实施方案中,式if的结构是高度优选的
[0136][0137]
其中:
[0138]
r2是氢;并且
[0139]
r3是6元杂环基;或
[0140]
r2和r3与其所连接的n原子一起组合以形成5元或6元n-杂环基;并且
[0141]
y是氢或氟基。
[0142]
优选地,其中:
[0143]
r2是氢;并且
[0144]
r3是四氢吡喃基;或
[0145]
r2和r3与其所连接的n原子一起组合以形成吡咯烷基或吗啉基。
[0146]
式i化合物的特别优选实施方案在下面实施例1至22中描述。当这些实施例描述药学上可接受的盐或溶剂化物形式的式i化合物的制备时,应当理解,本发明还涉及对应游离酸或游离碱形式的所述化合物。类似地,当这些实施例描述游离酸或游离碱形式的式i化合物的制备时,应当理解,本发明还涉及药学上可接受的盐或溶剂化物形式的所述化合物。
[0147]
实施例1至22的非盐、非溶剂化形式在下文列出。本发明还涉及这些单独化合物各自的药学上可接受的盐或溶剂化物。如果任何这些化合物以互变异构体形式存在,则每种互变异构形式及其混合物都被认为包括在本发明中。
[0148]
实施例1:(r)-1-(3-n-吗啉代丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0149]
实施例2:(r)-1-(3-氨基丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0150]
实施例3:(r)-1-(3-((((四氢-2h-吡喃-4-基)甲基)氨基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0151]
实施例4:(r)-1-(3-氨基丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0152]
实施例5:(r)-1-(3-(((四氢-2h-吡喃-4-基)氨基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0153]
实施例6:(r)-1-(3-n-吗啉代丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0154]
实施例7:(r)-1-(3-((r)-3-氟吡咯烷-1-基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0155]
实施例8:(r)-1-(3-(二甲基氨基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0156]
实施例9:(r)-1-(3-((((s))-四氢-2h-吡喃-3-基)氨基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0157]
实施例10:(r)-1-(3-(二甲基氨基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0158]
实施例11:(r)-1-(3-((r)-3-氟吡咯烷-1-基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0159]
实施例12:(r)-1-(3-(甲基(四氢-2h-吡喃-4-基)氨基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0160]
实施例13:(6r)-1-(3-(甲基(四氢呋喃-3-基)氨基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0161]
实施例14:(r)-1-(3-(甲基(四氢-2h-吡喃-4-基)氨基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0162]
实施例15:(5as,6ar)-5a-(3-氯-2,6-二氟苯基)-1-(3-n-吗啉代丙基)-5,5a,6,6a-四氢环丙[3,4]吡咯并[1,2-c]咪唑-3(2h)-硫酮
[0163]
实施例16:(5as,6ar)-5a-(5-氯-2-氟苯基)-1-(3-n-吗啉代丙基)-5,5a,6,6a-四氢环丙[3,4]吡咯并[1,2-c]咪唑-3(2h)-硫酮
[0164]
实施例17:(5as,6ar)-5a-(5-氯-2-氟苯基)-1-(3-((四氢-2h-吡喃-4-基)氨基)丙基)-5,5a,6,6a-四氢环丙[3,4]吡咯并[1,2-c]咪唑-3(2h)-硫酮
[0165]
实施例18:(5as,6ar)-5a-(3-氯-2,6-二氟苯基)-1-(3-((四氢-2h-吡喃-4-基)氨基)丙基)-5,5a,6,6a-四氢环丙[3,4]吡咯并[1,2-c]咪唑-3(2h)-硫酮
[0166]
实施例19:(5as,6ar)-5a-(3-氯-2,6-二氟苯基)-1-(3-(吡咯烷-1-基)丙基)-5,5a,6,6a-四氢环丙[3,4]吡咯并[1,2-c]咪唑-3(2h)-硫酮
[0167]
实施例20:(5as,6ar)-5a-(5-氯-2-氟苯基)-1-(3-(吡咯烷-1-基)丙基)-5,5a,6,6a-四氢环丙[3,4]吡咯并[1,2-c]咪唑-3(2h)-硫酮
[0168]
实施例21:(5as,6ar)-5a-(5-氯-2-氟苯基)-1-(3-((((s))-四氢-2h-吡喃-3-基)氨基)丙基)-5,5a,6,6a-四氢环丙[3,4]吡咯并[1,2-c]咪唑-3(2h)-硫酮
[0169]
实施例22:(5as,6ar)-5a-(3-氯-2,6-二氟苯基)-1-(3-((((s))-四氢-2h-吡喃-3-基)氨基)丙基)-5,5a,6,6a-四氢环丙[3,4]吡咯并[1,2-c]咪唑-3(2h)-硫酮
[0170]
c.组合物
[0171]
意图用于药物用途的本发明化合物可单独、或与一种或多种本发明的其他化合物组合、或与一种或多种其他药物(或作为其任何组合)组合施用。通常,其将作为与一种或多种药学上可接受的赋形剂结合的制剂来施用。因此,本发明还涉及一种药物组合物,其包含(i)治疗有效量的如上文所定义的式i化合物或其药学上可接受的盐或溶剂化物;和(ii)药学上可接受的赋形剂。
[0172]
适于递送本发明化合物的药物组合物及其制备方法对于本领域技术人员而言将
是显而易见的。此类组合物及其制备方法可在例如“remington’s pharmaceutical sciences”,第19版(mack publishing company,1995)中找到。
[0173]
d.使用方法
[0174]
本发明还涉及如上文所定义的式i化合物或其药学上可接受的盐或溶剂化物,其用于疗法,尤其用于治疗通过抑制cns外部的dβh来改善的疾患。
[0175]
本发明还涉及如上文所定义的式i化合物或其药学上可接受的盐或溶剂化物在制造治疗通过抑制cns外部的dβh来改善的疾患的药剂中的用途。
[0176]
本发明还涉及一种用于治疗通过抑制cns外部的多巴胺-β-羟化酶来改善的疾患的方法,其包括向有需要的患者施用治疗有效量的如权利要求1定义的式i化合物或其药学上可接受的盐或溶剂化物。
[0177]
通过抑制cns外部的dβh来改善的疾患可包括但不限于:心血管病症,诸如心绞痛、高血压、慢性或充血性心脏衰竭、肺高压(pulmonary hypertension;ph)和肺动脉高压(pulmonary arterial hypertension;pah)。
[0178]
有关ph的定义、分类以及病理学和病理生物学特征的细节,请参考“guidelines for the diagnosis and treatment of pulmonary hypertension”(european heart journal(2009)30,2493-2537)。
[0179]
通常,肺高压是特征在于肺血管阻力进行性增加导致右心室衰竭和过早死亡的一组疾病。其可由静止时等于或大于25mmhg的平均肺动脉压力来定义。
[0180]
根据疾病的原因,who已在临床上将ph分成5组,并且取决于导致所述疾病的
‘
组’,症状可有所不同。但是,
‘
常见’症状如下:
[0181]
·
呼吸困难或呼吸短促(主要症状)
[0182]
·
疲劳
[0183]
·
晕眩
[0184]
·
脚踝或腿部肿胀(水肿)
[0185]
·
嘴唇和皮肤发蓝(发绀)
[0186]
·
胸痛
[0187]
·
疾脉和心悸
[0188]
mclaughlin等人对肺高压(ph)进行了临床分类并在“accf/aha 2009expert consensus document on pulmonary hypertension”,j am coll cardiol 53,1573
–
1619,2009中报告。ph分类如下:
[0189]
1.肺动脉高压(pah)
[0190]
1.1.特发性(ipah)
[0191]
1.2.家族性(fpah)
[0192]
1.3.与以下相关(apah):
[0193]
1.3.1.结缔组织病症
[0194]
1.3.2.先天性体-肺分流
[0195]
1.3.3.门脉高压
[0196]
1.3.4.hiv感染
[0197]
1.3.5.药物和毒素
[0198]
1.3.6.其他(甲状腺病症、糖原贮积病、高雪氏病(gaucher’s disease)、遗传性出血性毛细血管扩张、血红素病、慢性骨髓增生性病症、脾切除术)
[0199]
1.4.与显著的静脉或毛细血管受累相关
[0200]
1.4.1.肺静脉闭塞性疾病(pvod)
[0201]
1.4.2.肺毛细血管血管瘤病(pch)
[0202]
1.5.新生儿持续性肺高压
[0203]
2.肺高压伴左心疾病
[0204]
2.1.左侧心房或心室性心脏病
[0205]
2.2.左侧瓣膜性心脏病
[0206]
3.与肺部疾病和/或低氧血症相关的肺高压
[0207]
3.1.慢性阻塞性肺病
[0208]
3.2.间质性肺病
[0209]
3.3.睡眠呼吸障碍
[0210]
3.4.肺泡换气不足病症
[0211]
3.5.长期高海拔暴露
[0212]
3.6.发育异常
[0213]
4.由慢性血栓形成性(thrombotic)和/或栓塞性疾病(cteph)引起的肺高压
[0214]
4.1.近端肺动脉的血栓性(thromboembolic)阻塞
[0215]
4.2.远端肺动脉的血栓性阻塞
[0216]
4.3.非血栓形成性肺栓塞(肿瘤、寄生虫、异物)
[0217]
5.其他
[0218]
结节病、组织细胞增生症x、淋巴管瘤病、肺血管压迫(腺病、肿瘤、纤维性纵膈腔炎)
[0219]
who还提供了以下功能评估分类:
[0220]
功能 症状概况
[0221]
分类
[0222]
i患者患有肺高压但没有导致身体活动受限。普通身体活动不会引起呼吸困难或疲劳、胸痛或近乎晕厥(near syncope)
[0223]
ii患者患有肺高压,导致身体活动轻微受限。所述患者在静止时感到舒适。普通身体活动会引起过度呼吸困难或疲劳、胸痛或近乎晕厥
[0224]
iii患者患有肺高压,导致身体活动明显受限。所述患者在静止时感到舒适。少于普通活动会引起过度呼吸困难或疲劳、胸痛或近乎晕厥
[0225]
iv患者患有肺高压并且不能进行任何身体活动,但没有症状。这些患者表现出右心衰竭的病征。甚至在静止时会出现呼吸困难和/或疲劳。任何身体活动都会增加不适感。
[0226]
e.一般合成方法
[0227]
下面的方案说明了用于合成本发明化合物的方法。用于制备这些化合物的起始材料和试剂可从商业供应商处获得,或者可通过本领域技术人员清楚的方法来制备。
[0228]
式ie化合物的起始材料(以下称为中间体1)总体上可通过方案1中概述的方法合成为富集对映体或外消旋体:
[0229]
方案1
[0230][0231]
式if化合物的起始材料(以下称为中间体2和3)总体上可通过方案2中概述的方法合成为富集对映体或外消旋体:
[0232]
方案2
[0233][0234]
具有r2和r3的不同身份的式ie或if的化合物总体上可通过方案3中概述的方法合成为富集对映体或外消旋体:
[0235]
方案3
[0236][0237]
f.实施例
[0238]
所有化合物和中间体均通过nmr表征。在bruker avance iii 600mhz光谱仪上记录光谱,其中溶剂用作内标。在150mhz处记录
13
c光谱,并且在600mhz处记录1h光谱。数据按以下顺序报告:近似化学位移(ppm),质子数,多重性(br,宽峰;d,双重峰;m,多重峰;s,单峰;t,三重峰)和耦合常数(hz)。
[0239]
以下方案中的室温意指在20℃至25℃范围内的温度。
[0240]
中间体1:(r)-3-(3-硫酮基-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-1-基)丙酸
[0241]
步骤1:2-硝基-1-(2,3,6-三氟苯基)乙-1-醇
[0242][0243]
在5℃下于30min内向甲醇(60ml)、水(30ml)和2.5m氢氧化钠(28.7ml,71.8mmol)的溶液中逐滴加入2,3,6-三氟苯甲醛(10g,62.5mmol)和硝基甲烷(3.87ml,71.8mmol)在甲醇(10ml)中的溶液,同时以外部冷却使内部温度保持在5℃与10℃之间。然后在冷条件下再搅拌反应0.5h,然后在0-10℃下,在搅拌的情况下一次性加入cc.hcl(10.41ml,125mmol)在水(30ml)中的溶液。将混合物用二氯甲烷(约200ml)萃取,有机相用盐水洗涤,经mgso4干燥,过滤并蒸发至干以得到标题产物(产率:13.05g,94%)。
[0244]
步骤2:(e)-1,2,4-三氟-3-(2-硝基乙烯基)苯
[0245][0246]
在环境温度下,向2-硝基-1-(2,3,6-三氟苯基)乙醇(13.04g,59.0mmol)和n,n-二甲基吡啶-4-胺(0.720g,5.90mmol)在二氯甲烷(120ml)中的溶液中加入乙酸酐(6.68ml,70.8mmol),并将混合物搅拌16h。随后,将其分别用水和碳酸氢钠洗涤。经mgso4干燥后,通过短氧化硅垫过滤并蒸发至干以得到呈浅黄色粉末的(e)-1,2,4-三氟-3-(2-硝基乙烯基)苯(产率:11.55g,96%)。
[0247]
步骤3:(r)-2-(2-硝基-1-(2,3,6-三氟苯基)乙基)丙二酸二乙酯
[0248][0249]
在室温下,在搅拌的情况下,向(e)-1,2,4-三氟-3-(2-硝基乙烯基)苯(5.7g,28.1mmol)在无水四氢呋喃(40ml)中的搅拌溶液中加入4-((1s)-羟基((1s,4s,5r)-5-乙烯基奎宁环-2-基)甲基)喹啉-6-醇(0.218g,0.702mmol),随后加入丙二酸二乙酯(5.56ml,36.5mmol)。将混合物在惰性气氛下冷却至-5至-10℃,并在冷条件下搅拌16h。随后,将混合物在真空下蒸发至干,并将残余物吸收在二氯甲烷中,分别用1m hcl(约15ml)和盐水洗涤。经mgso4干燥后,将混合物过滤并蒸发以得到呈微黄色油状物的标题化合物。(产率:11.37g,95%)。
[0250]
步骤4:(4r)-2-氧代-4-(2,3,6-三氟苯基)吡咯烷-3-羧酸乙酯
[0251][0252]
向(r)-2-(2-硝基-1-(2,3,6-三氟苯基)乙基)丙二酸二乙酯(11.36g,26.6mmol)在甲醇(150ml)中的混悬液中加入氯化镍(ii)六水合物(6.32g,26.6mmol),然后在冰冷却的情况下分批加入硼氢化钠(8.04g,213mmol)。将混合物在室温下搅拌5h,然后用1.5n hcl溶液淬灭至ph=3。将混合物在环境温度下搅拌16h,然后用二氯甲烷(150+75ml)萃取,有机相经mgso4干燥并蒸发至干。使获得的粗产物从石油醚中结晶以得到米色粉末。(产率:6.93g,91%)。
[0253]
步骤5:(4r)-4-(2,3,6-三氟苯基)-2-氧代吡咯烷-3-羧酸
[0254][0255]
向(4r)-4-(2,3,6-三氟苯基)-2-氧代吡咯烷-3-羧酸乙酯(6.92g,24.09mmol)在乙醇(100ml)中的搅拌溶液中加入1m氢氧化钠(28.9ml,28.9mmol)。将所得混悬液在室温下
搅拌2h,然后在真空下去除有机物,并且将残余物溶解于水(约100ml)中,然后通过加入cc hcl(5.94ml,72.3mmol)进行酸化。将混合物在冷条件下老化,然后通过过滤收集所得晶体,用水洗涤并在真空下干燥以得到标题产物。产率:5.61g,90%。
[0256]
步骤6:(r)-4-(2,3,6-三氟苯基)吡咯烷-2-酮
[0257][0258]
将(4r)-4-(2,3,6-三氟苯基)-2-氧代吡咯烷-3-羧酸(5.6g,21.61mmol)在甲苯(200ml)中的溶液回流搅拌3h,随后将混合物蒸发至约50ml,然后用石油醚(约30ml)稀释。收集所得晶体,用石油醚洗涤并真空干燥以得到米色粉末。产率:4.33g,93%。
[0259]
步骤7:(r)-4-(2,3,6-三氟苯基)-2-氧代吡咯烷-1-羧酸叔丁酯
[0260][0261]
在室温下,向(r)-4-(2,3,6-三氟苯基)吡咯烷-2-酮(4.32g,20.08mmol)在无水二氯甲烷(16ml)中的搅拌溶液中加入二碳酸二叔丁酯(6.57g,30.1mmol),然后加入n,n-二甲基吡啶-4-胺(2.453g,20.08mmol)。然后将混合物在室温下搅拌24h,然后用二氯甲烷(100ml)稀释。将混合物用柠檬酸洗涤,经mgso4干燥,过滤,然后蒸发至干。色谱法(石油醚-乙酸乙酯)得到油状物,使其从石油醚中结晶。分离出呈白色粉末的产物。产率:5.35g,85%。
[0262]
步骤8:(4r)-4-(2,3,6-三氟苯基)-2-羟基吡咯烷-1-羧酸叔丁酯
[0263][0264]
在0-5℃、氮气下,向(r)-4-(2,3,6-三氟苯基)-2-氧代吡咯烷-1-羧酸叔丁酯(5.34g,16.94mmol)在无水乙醚(51ml)中的搅拌溶液中逐滴加入含65%red-al(双(2-甲氧基乙氧基)铝(iii)氢化钠(3.30ml,11.01mmol)的甲苯,并且在冷条件下搅拌混合物0.5h。随后,将混合物用碳酸氢钠溶液淬灭并搅拌30min,分离有机相,并用乙醚萃取水相。合并的有机相经mgso4干燥,过滤,然后蒸发至干以得到呈微黄色油状物的产物。(产率:6.08g,96%)。
[0265]
步骤9:(4r)-2-甲氧基-4-(2,3,6-三氟苯基)吡咯烷-1-羧酸叔丁酯
[0266][0267]
在20-25℃下,向(4r)-2-羟基-4-(2,3,6-三氟苯基)吡咯烷-1-羧酸叔丁酯(6g,
16.07mmol)在甲醇(160ml)中的搅拌溶液中加入对甲苯磺酸一水合物(0.306g,1.607mmol),并且搅拌溶液24h。然后,通过加入1m naoh(1.607ml,1.607mmol)来中和所述溶液,然后汽提至干。将残余物吸收在乙酸乙酯-石油醚(1:1)的混合物中,经mgso4干燥,通过二氧化硅过滤,然后蒸发至干以得到呈微黄色油状物的(4r)-2-甲氧基-4-(2,3,6-三氟苯基)吡咯烷-1-羧酸叔丁酯(5.7g,96%产率)。
[0268]
步骤10:(4r)-2-氰基-4-(2,3,6-三氟苯基)吡咯烷-1-羧酸叔丁酯
[0269][0270]
向(4r)-2-甲氧基-4-(2,3,6-三氟苯基)吡咯烷-1-羧酸叔丁酯(5.69g,15.46mmol)在无水二氯甲烷(110ml)中的搅拌溶液中加入三甲基氰基硅烷(4.14ml,30.9mmol),随后在-70℃下加入三氟化硼乙醚(4.31ml,34.0mmol)。将混合物在冷条件下搅拌4h,随后用碳酸氢钠溶液淬灭,然后在搅拌的情况下升温至室温。有机相经mgso4干燥,过滤并在真空下蒸发至干以得到呈米色固体的标题化合物。(产率:5.78g,97%)。
[0271]
步骤11:(4r)-2-氨基甲酰基-4-(2,3,6-三氟苯基)吡咯烷-1-羧酸叔丁酯
[0272][0273]
向(4r)-2-氰基-4-(2,3,6-三氟苯基)吡咯烷-1-羧酸叔丁酯(5.77g,15.03mmol)在丙酮(75ml)和水(25ml)的混合物中的搅拌溶液中加入过氧化氢脲复合物(7.07g,75mmol),随后加入碳酸钾(0.415g,3.01mmol),并将所述溶液在20-25℃下搅拌16h。然后在旋转蒸发仪上部分去除丙酮,直到分离出油。随后,将混合物用水和石油醚稀释,在搅拌的情况下老化1h(发生结晶)。收集获得的固体,用水、石油醚洗涤,然后干燥以得到呈白色粉末的(4r)-2-氨基甲酰基-4-(2,3,6-三氟苯基)吡咯烷-1-羧酸叔丁酯(4.43g,86%产率)。
[0274]
步骤12:(4r)-1-(叔丁氧羰基)-4-(2,3,6-三氟苯基)吡咯烷-2-羧酸
[0275][0276]
将(4r)-2-氨基甲酰基-4-(2,3,6-三氟苯基)吡咯烷-1-羧酸叔丁酯(4.42g,12.84mmol)在2m hcl(96ml,193mmol)中的搅拌混悬液在回流下搅拌16h。随后,将混合物浓缩并将残余物溶于水中。然后通过加入1m naoh(25.7ml,25.7mmol)中和混合物,并将溶液浓缩至约50ml。加入甲醇(70ml),随后加入二碳酸二叔丁酯(3.08g,14.12mmol),并将混合物搅拌45min。然后在真空下去除甲醇,将残余物用水(50ml)稀释,并用石油醚洗涤。通过加入2n hcl,将水相酸化至ph=2,然后用二氯甲烷萃取。干燥有机相,汽提至干以得到呈白色
粉末的(4r)-1-(叔丁氧羰基)-4-(2,3,6-三氟苯基)吡咯烷-2-羧酸(3.85g,87%产率)。
[0277]
步骤13:(4r)-2-(2-重氮乙酰基)-4-(2,3,6-三氟苯基)吡咯烷-1-羧酸叔丁酯
[0278][0279]
在0-5℃下,向(4r)-1-(叔丁氧羰基)-4-(2,3,6-三氟苯基)吡咯烷-2-羧酸(9.22g,26.7mmol)和n-乙基-n-异丙基丙-2-胺(8.16ml,46.7mmol)在无水四氢呋喃(100ml)中的溶液中加入氯甲酸乙酯(3.85ml,40.1mmol)。将混合物在冷条件下搅拌4h,然后用乙腈(50ml)稀释,随后加入在乙醚中的2m(重氮甲基)三甲基硅烷(26.7ml 53.4mmol)。在0-5℃下再继续搅拌3h,并在n2下,在搅拌的情况下,使混合物自然升温过夜。随后,真空去除溶剂,并将残余物通过柱色谱法在石油醚-乙酸乙酯的混合物中纯化以得到呈黄色油状物的(4r)-2-(2-重氮乙酰基)-4-(2,3,6-三氟苯基)吡咯烷-1-羧酸叔丁酯。产率:6.92g,42%。
[0280]
步骤14:(4r)-2-(2-溴乙酰基)-4-(2,3,6-三氟苯基)吡咯烷-1-羧酸叔丁酯
[0281][0282]
在0-5℃下,在搅拌的情况下,向(4r)-2-(2-重氮乙酰基)-4-(2,3,6-三氟苯基)吡咯烷-1-羧酸叔丁酯(6.91g,18.71mmol)在乙醚(55ml)中的溶液中加入48%hbr(2.22ml,19.64mmol)。5min后,将混合物用乙酸乙酯(83ml)稀释,然后用碳酸氢钠溶液洗涤。将有机相干燥(mgso4),过滤,蒸发至干以得到呈浅黄色油状物的(4r)-2-(2-溴乙酰基)-4-(2,3,6-三氟苯基)吡咯烷-1-羧酸叔丁酯。产率:6.4g,60%。
[0283]
步骤15:2-(2-((4r)-1-(叔丁氧羰基)-4-(2,3,6-三氟苯基)吡咯烷-2-基)-2-氧代乙基)丙二酸二乙酯
[0284][0285]
在冰冷却的情况下,向丙二酸二乙酯(3.47ml,22.74mmol)在n,n-二甲基甲酰胺(28ml)中的溶液中加入氢化钠(在矿物油中60%)(0.727g,18.9mmol),并将溶液搅拌30min。随后,在冰冷却的情况下,将在无水四氢呋喃(14ml)中的(4r)-2-(2-溴乙酰基)-4-(2,3,6-三氟苯基)吡咯烷-1-羧酸叔丁酯(6.4g,15.16mmol)加入至上述反应混合物中,并将混合物在冷条件下搅拌30min。然后将反应用乙酸乙酯-石油醚(2:1)的混合物稀释,用nahso4溶液洗涤,经mgso 4
干燥,过滤并蒸发至干。在乙酸乙酯-石油醚的混合物中进行的色谱法得到呈浅黄色油状物的标题产物。产率:5.44g,60%。
[0286]
步骤16:2-(2-氧代-2-((4r)-4-(2,3,6-三氟苯基)吡咯烷-2-基)乙基)丙二酸二
乙酯盐酸盐
[0287][0288]
将2-(2-((4r)-1-(叔丁氧羰基)-4-(2,3,6-三氟苯基)吡咯烷-2-基)-2-氧代乙基)丙二酸二乙酯(5.43g,10.83mmol)溶解于在二噁烷中的4mhcl(40.6ml,162mmol)中,并将溶液搅拌2h。随后,将混合物用乙醚(约200ml)稀释。收集所得晶体,用乙醚洗涤并真空干燥以得到呈白色固体的2-(2-氧代-2-((4r)-4-(2,3,6-三氟苯基)吡咯烷-2-基)乙基)丙二酸二乙酯盐酸盐。产率:3.61g,64%。
[0289]
步骤17:(r)-2-((6-(2,3,6-三氟苯基)-3-硫酮基-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-1-基)甲基)丙二酸二乙酯
[0290][0291]
将2-(2-氧代-2-((4r)-4-(2,3,6-三氟苯基)吡咯烷-2-基)乙基)丙二酸二乙酯盐酸盐(3.6g,8.22mmol)、异硫氰酸钾(1.039g,10.69mmol)和cc.hcl(0.405ml,4.93mmol)在无水乙醇(86ml)的混合物在回流下搅拌30min。然后将混悬液冷却至室温,蒸发至干,并将残余物在二氯甲烷与水之间分配。干燥(mgso4)有机相,过滤并蒸发至干以得到呈黄色泡沫的标题产物。产率:3.31g,82%产率。
[0292]
步骤18:(r)-2-((6-(2,3,6-三氟苯基)-3-硫酮基-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-1-基)甲基)丙二酸
[0293][0294]
向(r)-2-((6-(2,3,6-三氟苯基)-3-硫酮基-3,5,6,7-四氢-2h-吡咯并[1,2-c]咪唑-1-基)甲基)丙二酸二乙酯(3.3g,7.46mmol)在甲醇(80ml)中的溶液中加入1m氢氧化钠溶液(44.8ml,44.8mmol),并将混合物在室温下搅拌5h。随后,真空去除甲醇,将残余物用水稀释,然后通过在冰冷却的情况下加入2m hcl溶液酸化至ph=1。通过过滤来收集所得沉淀物,用水洗涤并真空干燥以得到呈黄色固体的(r)-2-((6-(2,3,-三氟苯基)-3-硫酮基-3,5,6,7-四氢-2h-吡咯并[1,2-c]咪唑-1-基)甲基)丙二酸。产率:2.88g,85%。
[0295]
步骤19:(r)-3-(6-(2,3,6-三氟苯基)-3-硫酮基-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-1-基)丙酸
[0296][0297]
在搅拌的情况下,向(r)-2-((6-(2,3,6-三氟苯基)-3-硫酮基-3,5,6,7-四氢-2h-吡咯并[1,2-c]咪唑-1-基)甲基)丙二酸(2.88g,7.45mmol)在甲酸(8.58ml,224.0mmol)中的溶液中逐滴加入三乙胺(12.47ml,89.0mmol)(放热反应),然后将所得溶液在115℃下搅拌1h。随后,将混合物用1m hcl(80ml)处理,然后老化30min。收集所得固体,用水洗涤并在50℃下真空干燥以得到呈深米色固体的(r)-3-(6-(2,3,6-三氟苯基)-3-硫酮基-3,5,6,7-四氢-2h-吡咯并[1,2-c]咪唑-1-基)丙酸。产率:2.13g,75%。
[0298]
中间体2:3-((5as,6ar)-5a-(5-氯-2-氟苯基)-3-硫酮基-2,3,5,5a,6,6a-六氢环丙[3,4]吡咯并[1,2-c]咪唑-1-基)丙酸
[0299]
步骤1:((1r,2s)-2-(氨基甲基)-2-(5-氯-2-氟苯基)环丙基)甲醇
[0300][0301]
在室温、氮气下向2-(5-氯-2-氟苯基)乙腈(10.0g,59.0mmol)在无水四氢呋喃(100ml)中的搅拌溶液中加入(r)-2-(氯甲基)环氧乙烷(5.53ml,70.8mmol)。然后将反应冷却至15℃,并在15℃下,在2h内,逐滴加入在四氢呋喃(51.6ml,103.0mmol)中的2m双(三甲基硅基)氨基钠。随后,使因此获得的红色混合物升温至室温并搅拌2h。用无水四氢呋喃(100ml)稀释反应,冷却至0℃,然后加入硼氢化钠(8.92g,236.0mmol),随后逐滴加入三氟化硼乙醚(29.9ml,236.0mmol)。使混合物升温至室温并搅拌过夜。将所得淡黄色混悬液冷却至0℃,并小心地用2m hcl(177ml,354mmol)淬灭。然后蒸发掉四氢呋喃,并且将水相用乙醚洗涤。通过加入3m氢氧化钠将水相的ph设定为ph=10,然后用二氯甲烷萃取。有机相经mgso4干燥,过滤并且在真空下蒸发至干以留下黄色油状物。(产率:12.95g,81%)。
[0302]
步骤2:((((1s,2r)-1-(5-氯-2-氟苯基)-2-(羟甲基)环丙基)甲基)氨基甲酸叔丁酯
[0303][0304]
向((1r,2s)-2-(氨基甲基)-2-(5-氯-2-氟苯基)环丙基)甲醇(12.95g,56.4mmol)在乙醇(205ml)中的冰冷溶液中加入二碳酸二叔丁酯(12.31g,56.4mmol)。将溶液在室温下搅拌3h,然后在真空下蒸发掉溶剂。所得黄色油状物通过色谱法(石油醚-乙酸乙酯)纯化。分离出呈无色泡沫的产物。(产率:13.65g,62%)。
[0305]
步骤3:(1s,5r)-1-(5-氯-2-氟苯基)-4-羟基-3-氮杂双环[3.1.0]己烷-3-羧酸叔丁酯
[0306][0307]
在-78℃下,向草酰二氯(3.99ml,45.50mmol)在无水二氯甲烷(94ml)中的搅拌溶液中逐滴加入二甲基亚砜(6.46ml,91.0mmol)在无水二氯甲烷(19ml)中的溶液。将反应混合物在冷条件下搅拌15min,然后逐滴加入((((1s,2r)-1-(5-氯-2-氟苯基)-2-(羟甲基)环丙基)甲基)氨基甲酸叔丁酯(13.65g,41.4mmol)在无水二氯甲烷(38ml)中的溶液。将混合物在-78℃下搅拌1h,然后加入三乙胺(28.8ml,207.0mmol)。使反应逐渐升温至室温,并在室温下搅拌2h。随后,将混合物用水洗涤三次,经mgso4干燥,过滤并蒸发至干以得到黄色油状物。(产率:14.0g,83%)。
[0308]
步骤4:(1s,5r)-1-(5-氯-2-氟苯基)-4-氰基-3-氮杂双环[3.1.0]己烷-3-羧酸叔丁酯
[0309][0310]
在室温、氮气下,向(1s,5r)-1-(5-氯-2-氟苯基)-4-羟基-3-氮杂双环[3.1.0]己烷-3-羧酸叔丁酯(13.6g,41.5mmol)在无水二氯甲烷(210ml)中的搅拌溶液中加入三甲基氰基硅烷(14.85ml,111.0mmol)。然后将溶液冷却至-78℃,并逐滴加入三氟化硼乙醚(15.42ml,111.0mmol)。将反应混合物在冷条件下搅拌4h,然后加入饱和碳酸氢钠溶液并且使其升温至室温。分离有机相,并且将水相用二氯甲烷萃取。将合并有机相经mgso4干燥,过滤并且蒸发至干以留下黄色油状物。(产率:13.1g,80%)。
[0311]
步骤5:(1r,5s)-3-(叔丁氧羰基)-5-(5-氯-2-氟苯基)-3-氮杂双环[3.1.0]己烷-2-羧酸
[0312][0313]
在室温下,向(1s,5r)-4-氰基-1-(5-氯-2-氟苯基)-3-氮杂双环[3.1.0]己烷-3-羧酸叔丁酯(13.1g,38.9mmol)在乙醇(135ml)中的搅拌溶液中加入3m氢氧化钠溶液(64.8ml,194.0mmol)。将所述溶液在80℃下加热5h,然后冷却至室温。随后蒸发掉乙醇,并且将水相用2m hcl溶液酸化,然后用二氯甲烷-异丙醇(7:3)的混合物萃取。有机相经mgso4干燥,过滤并且蒸发至干以留下黄色固体。(产率:11.56g,71%)。
[0314]
步骤6:(1s,5r)-1-(5-氯-2-氟苯基)-4-(2-重氮乙酰基)-3-氮杂双环[3.1.0]己烷-3-羧酸叔丁酯
[0315][0316]
在0-5℃下,向(1r,5s)-3-(叔丁氧羰基)-5-(5-氯-2-氟苯基)-3-氮杂双环[3.1.0]己烷-2-羧酸(11g,30.9mmol)和n-乙基-n-异丙基丙-2-胺(dipea)(9.45ml,54.1mmol)在无水四氢呋喃(114ml)中的溶液中加入氯甲酸乙酯(4.45ml,46.40mmol)。将混合物在冷条件下搅拌4h,然后用乙腈(57ml)稀释,随后加入在乙醚中的2m(重氮甲基)三甲基硅烷(30.9ml 61.80mmol)。在0-5℃下再继续搅拌3h,并在n2下,在搅拌的情况下,使混合物自然升温过夜。随后,在真空下去除溶剂并且残余物通过柱色谱法在石油醚
–
乙酸乙酯的混合物中纯化以得到呈浅黄色油状物的(1s,5r)-1-(5-氯-2-氟苯基)-4-(2-重氮乙酰基)-3-氮杂双环[3.1.0]己烷-3-羧酸叔丁酯。产率:8.38g,60%。
[0317]
步骤7:(1s,5r)-4-(2-溴乙酰基)-1-(5-氯-2-氟苯基)-3-氮杂双环[3.1.0]己烷-3-羧酸叔丁酯
[0318][0319]
在0-5℃下,在搅拌的情况下,向1-(5-氯-2-氟苯基)-4-(2-重氮乙酰基)-3-氮杂双环[3.1.0]己烷-3-羧酸酯(8.30g,21.85mmol)在乙醚(64ml)中的溶液中加入48%hbr(2.60ml,22.95mmol)。5min后,将混合物用乙酸乙酯(97ml)稀释,然后用碳酸氢钠溶液洗涤。将有机相干燥(mgso4),过滤,蒸发至干以得到呈浅黄色油状物的(1s,5r)-4-(2-溴乙酰基)-1-(5-氯-2-氟苯基)-3-氮杂双环[3.1.0]己烷-3-羧酸叔丁酯。产率:9.25g,83%。
[0320]
步骤8:2-(2-((1r,5s)-3-(叔丁氧羰基)-5-(5-氯-2-氟苯基)-3-氮杂双环[3.1.0]己-2-基)-2-氧代乙基)丙二酸二乙酯
[0321][0322]
在冰冷却的情况下,向丙二酸二乙酯(4.89ml,32.10mmol)在n,n-二甲基甲酰胺(40ml)中的溶液中加入氢化钠(在矿物油中60%)(1.026g,25.70mmol)并且将溶液搅拌30min。随后,在冰冷却的情况下,将在无水四氢呋喃(20.0ml)中的(1s,5r)-4-(2-溴乙酰基)-1-(5-氯-2-氟苯基)-3-氮杂双环[3.1.0]己烷-3-羧酸叔丁酯(9.25g,21.38mmol)加入至上述反应混合物中,并将混合物在冷条件下搅拌30min。然后将反应用乙酸乙酯
–
石油醚(2:1)的混合物稀释,用nahso4溶液洗涤,经mgso4干燥,过滤并蒸发至干。在乙酸乙酯-石油
醚的混合物中进行的色谱法得到呈黄色油状物的标题产物。产率:9.37g,72%。
[0323]
步骤9:2-(2-((1r,5s)-5-(5-氯-2-氟苯基)-3-氮杂双环[3.1.0]己-2-基)-2-氧代乙基)丙二酸二乙酯盐酸盐
[0324][0325]
将2-(2-((1r,5s)-3-(叔丁氧羰基)-5-(5-氯-2-氟苯基)-3-氮杂双环[3.1.0]己-2-基)-2-氧代乙基)丙二酸二乙酯(9.3g,18.17mmol)溶解于在二噁烷中的4m hcl(68.1ml,272mmol)中并且将溶液搅拌2h。随后,将混合物用乙醚(约180ml)稀释。收集所得晶体,用乙醚洗涤,并在50℃下真空干燥以得到呈黄色固体的2-(2-((1r,5s)-5-(5-氯-2-氟苯基)-3-氮杂双环[3.1.0]己-2-基)-2-氧代乙基)丙二酸二乙酯盐酸盐。产率:8.3g,98%。
[0326]
步骤10:2-(((5as,6ar)-5a-(5-氯-2-氟苯基)-3-硫酮基-2,3,5,5a,6,6a-六氢环丙[3,4]吡咯并[1,2-c]咪唑-1-基)甲基)丙二酸二乙酯
[0327][0328]
将2-(2-((1r,5s)-5-(5-氯-2-氟苯基)-3-氮杂双环[3.1.0]己-2-基)-2-氧代乙基)丙二酸二乙酯盐酸盐(8.11g,18.07mmol)、异硫氰酸钾(2.283g,23.49mmol)和cc.hcl(0.89ml,10.84mmol)在无水乙醇(187ml)中的混合物在回流下搅拌30min。然后将混悬液冷却至室温,用水稀释,搅拌30min,然后蒸发掉乙醇。将水相用二氯甲烷萃取。将有机相干燥(mgso4),过滤并蒸发至干以得到呈黄色泡沫的标题产物。产率:8.2g,75%。
[0329]
步骤11:2-(((5as,6ar)-5a-(5-氯-2-氟苯基)-3-硫酮基-2,3,5,5a,6,6a-六氢环丙[3,4]吡咯并[1,2-c]咪唑-1-基)甲基)丙二酸
[0330][0331]
向2-(((5as,6ar)-5a-(5-氯-2-氟苯基)-3-硫酮基-2,3,5,5a,6,6a-六氢环丙[3,4]吡咯并[1,2-c]咪唑-1-基)甲基)丙二酸二乙酯(8.1g,17.88mmol)在甲醇(190ml)中的溶液中加入1m氢氧化钠溶液(107ml,107mmol),并将混合物在室温下搅拌过夜。随后,真空去除甲醇,将残余物用水稀释,然后通过在冰冷却的情况下加入2m hcl溶液酸化至ph=1。然后将混合物用二氯甲烷-异丙醇(7:3)的混合物萃取,有机相经mgso4干燥,过滤以得到呈黄
色泡沫的2-(((5as,6ar)-5a-(5-氯-2-氟苯基)-3-硫酮基-2,3,5,5a,6,6a-六氢环丙[3,4]吡咯并[1,2-c]咪唑-1-基)甲基)丙二酸。产率:6.2g,87%。
[0332]
步骤12:3-((5as,6ar)-5a-(5-氯-2-氟苯基)-3-硫酮基-2,3,5,5a,6,6a-六氢环丙[3,4]吡咯并[1,2-c]咪唑-1-基)丙酸
[0333][0334]
在搅拌的情况下,向2-(((5as,6ar)-5a-(5-氯-2-氟苯基)-3-硫酮基-2,3,5,5a,6,6a-六氢环丙[3,4]吡咯并[1,2-c]咪唑-1-基)甲基)丙二酸(6.2g,15.62mmol)于甲酸(17.98ml,469mmol)中的溶液逐滴加入三乙胺(26.1ml,187mmol)(放热反应),然后将所得溶液在115℃下搅拌1h。随后,将混合物冷却至0℃,并加入1n hcl(234ml,234mmol),然后老化90min。通过倾析分离得到的固体块,然后将其溶解在二氯甲烷-异丙醇(7:3)的混合物中,经mgso4干燥,过滤并蒸发至干。粗产物通过柱色谱法(二氯甲烷-甲醇)纯化,随后从乙酸异丙酯中结晶以得到呈白色固体的3-((5as,6ar)-5a-(5-氯-2-氟苯基)-3-硫酮基-2,3,5,5a,6,6a-六氢环丙[3,4]吡咯并[1,2-c]咪唑-1-基)丙酸。产率:2.62g,45%。
[0335]
中间体3:3-((5as,6ar)-5a-(3-氯-2,6-二氟苯基)-3-硫酮基-2,3,5,5a,6,6a-六氢环丙[3,4]吡咯并[1,2-c]咪唑-1-基)丙酸
[0336][0337]
由2-(3-氯-2,6-二氟苯基)乙腈以类似于中间体2的方式制备并分离出呈灰白色粉末的化合物。
[0338]
方法a:
[0339][0340]
向中间体1(400mg,1.168mmol)在无水二氯甲烷(12ml)中的搅拌混悬液中分批加入1,1
′‑
羰基二咪唑(227mg,1.402mmol)。将反应混合物在室温下搅拌30min。将获得的溶液
用r2r3nh(2.337mmol)处理,并在室温下搅拌2h。随后,将混合物用碳酸氢钠溶液洗涤,有机相经mgso4干燥,过滤,然后蒸发至干。产物通过色谱法纯化。
[0341]
方法b:
[0342][0343]
向中间体1(400mg,1.168mmol)在无水二氯甲烷(12ml)中的搅拌混悬液中分批加入1,1
′‑
羰基二咪唑(227mg,1.402mmol)。将反应混合物在室温下搅拌30min。所获得的溶液用r2r3nh.hcl(2.337mmol)处理,随后加入n-乙基二异丙胺(0.408ml,2.337mmol)并且在室温下搅拌2h。随后,将混合物用碳酸氢钠溶液洗涤,有机相经mgso4干燥,过滤,然后蒸发至干。产物通过色谱法纯化。
[0344]
方法c:
[0345][0346]
向中间体1(400mg,1.168mmol)在无水二氯甲烷(12ml)中的搅拌混悬液中加入r2r3nh.hcl(2.337mmol),然后加入n-乙基二异丙胺(0.245ml,1.402mmol)和1-丙烷磷酸环酐(0.871ml,1.402mmol)。将反应混合物在室温下搅拌2h。随后,将混合物用碳酸氢钠溶液洗涤,有机相经mgso4干燥,过滤,然后蒸发至干。产物通过色谱法纯化。
[0347]
将酰胺还原为胺的一般方案:
[0348][0349]
向起始酰胺(1.00mmol)在无水四氢呋喃(4.2ml)中的搅拌混悬液中加入硼氢化钠(189mg,5.01mmol),然后将反应冷却至0℃。随后,逐滴加入三氟化硼乙醚(0.635ml,5.01)在无水四氢呋喃(1.9ml)中的溶液,并将所述反应在室温下搅拌2h。随后,将反应再次冷却
至0℃,并用1m hcl(约1.4ml)淬灭,随后加入2m hcl(约1.2ml,至ph=1)。然后将混合物升温至室温,并加热回流30min。随后,将混合物冷却至室温,用水稀释,然后蒸发掉四氢呋喃。将水相通过加入1m naoh溶液来碱化,然后用二氯甲烷萃取。有机相经mgso4干燥,过滤并蒸发至干以得到所期望的胺。
[0350]
基于与10当量的于乙醚中的2m hcl反应,将胺在乙酸乙酯中转化为hcl盐。
[0351]
实施例1:(r)-1-(3-n-吗啉代丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮盐酸盐
[0352][0353]
通过方法a由中间体1和吗啉制备并分离出呈浅米色固体的化合物。
[0354]1h nmr(dmso
d6
):11.85(1h,br s),11.10(1h,br s),7.48(1h,m),7.19(1h,m),4.45(1h,quin,j=8.7hz),4.15(1h,dd,j=11.4,9.2hz),3.93(2h,br dd,j=12.4,2.7hz),3.80(2h,br t,j=12.2hz),3.74(1h,dd,j=11.6,8.2hz),3.38(2h,m),3.32(1h,d,j=8.9,15.5hz),3.03(4h,m),2.94(1h,dd,j=15.6,8.4hz),2.45(2h,br t,j=7.5hz),1.97(2h,m)。
[0355]
13
c nmr(dmso
d6
):156.9,156.9,155.3,155.3,149.1,149.1,149,149,147.6,147.6,147.5,147.5,147.4,147.4,147.3,145.9,145.9,145.9,145.8,128,118.8,118.7,118.7,118.6,118.1,116.6,116.5,116.4,116.4,112,112,112,112,111.9,111.8,111.8,111.8,63.1,55.1,50.9,48.3,35.7,29,21.5,21.3。
[0356]
实施例2:(r)-1-(3-氨基丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0357]
[0358]
通过方法a由中间体1和氨制备并分离出呈白色固体的化合物。
[0359]1h nmr(dmso
d6
):7.47(1h,m),7.18(1h,m),4.45(1h,quin,j=8.6hz),4.14(1h,dd,j=11.4,9.1hz),3.72(1h,dd,j=11.6,7.9hz),3.27(1h,dd,j=15.6,9.2hz),2.90(1h,dd,j=8.2,15.7hz),2.56(2h,t,j=7.0hz),2.39(2h,t,j=7.4hz),1.62(2h,quin,j=7.2hz)。
[0360]
13
c nmr(dmso
d6
):156.9,156.9,156.9,156.9,155.3,155.3,155.3,155.3,155,149.1,149,149,148.9,147.5,147.5,147.4,147.4,147.3,147.3,146,145.9,145.9,145.8,127.5,119.5,119.1,119,119,118.9,116.5,116.4,116.4,116.3,112,111.8,48.4,40.0,35.6,30.3,29.1,21.3。
[0361]
实施例3:(r)-1-(3-(((四氢-2h-吡喃-4-基)甲基)氨基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0362][0363]
通过方法a由中间体1和(四氢-2h-吡喃-4-基)甲胺制备并分离出呈灰白色固体的化合物。
[0364]1h nmr(dmso
d6
):11.32(1h,br),7.47(1h,m),7.18(1h,m),4.44(1h,quin,j=8.5hz),4.14(1h,dd,j=11.5,9.2hz),3.80(2h,br dd,j=11.1,4.2hz),3.73(1h,dd,j=11.7,7.8hz),3.27(1h,dd,j=9.5,15.5hz),3.24(2h,m),2.87(1h,dd,j=15.6,8.1hz),2.5(2h,m),2.39(4h,m),1.66(2h,quin,j=7.2hz),1.58(3h,m),1.12(2h,m)。
[0365]
13
c nmr(dmso
d6
):156.9,156.9,156.9,156.9,155.3,155.3,155.3,155.3,155,149.1,149,149,148.9,147.5,147.5,147.4,147.4,147.3,147.3,146,145.9,145.9,145.8,127.6,119.5,119.1,119,119,118.9,116.5,116.4,116.4,116.3,112,111.8,66.9,55.2,48.4,48.3,35.7,34.6,31,29.1,27.5,21.7。
[0366]
实施例4:(r)-1-(3-氨基丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮盐酸盐
[0367][0368]
通过方法a由中间体1和氨制备并分离出呈黄色固体的化合物。
[0369]1h nmr(dmso
d6
):11.85(1h,s),7.95(2h,br s),7.48(1h,m),7.19(1h,m),4.46(1h,quin,j=8.6hz),4.15(1h,dd,j=11.4,9.2hz),3.73(1h,dd,j=11.6,7.9hz),3.30(1h,dd,j=15.6,9.2hz),2.90(1h,dd,j=15.6,8.2hz),2.73(2h,m),2.45(2h,t.j=7.1hz),1.81(2h,quin,j=7.5hz)。
[0370]
13
c nmr(dmso
d6
):156.9,156.9,155.3,155.3,149.1,149,149,148.9,147.5,147.5,147.5,147.4,147.4,147.3,147.3,146,145.9,145.9,145.8,127.9,118.9,118.9,118.8,118.7,118.4,116.5,116.5,116.4,116.3,112,112,112,112,111.9,111.8,111.8,111.8,48.4,38,35.6,29.1,25.8,21。
[0371]
实施例5:(r)-1-(3-((四氢-2h-吡喃-4-基)氨基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0372][0373]
通过方法a由中间体1和四氢-2h-吡喃-4-胺制备并分离出呈白色固体的化合物。
[0374]1h nmr(dmso
d6
):11.80(1h,br s),7.47(1h,m),7.18(1h,t,j=9.6hz),4.45(1h,quin,j=8.5hz),4.14(1h,dd,j=11.5,9.2hz),3.80(2h,ddt,j=11.1,7.4,3.5,3.5hz),3.73(1h,dd,j=11.6,7.8hz),3.28(1h,dd,j=15.6,9.4hz),3.25(2h,m),2.87(1h,dd,j=15.6,7.9hz),2.59(1h,m),2.53(2h,m),2.40(2h,br t,j=7.4hz),1.72(2h,m),1.65(2h,quin,j=7.2hz),1.21(2h,m)。
[0375]
13
c nmr(dmso
d6
):156.9,156.9,156.9,156.9,155.3,155.3,155.3,155.3,155,
149.1,149,149,148.9,147.5,147.5,147.4,147.4,147.3,147.3,146,145.9,145.9,145.8,127.6,119.5,119.1,119,119,118.9,116.5,116.4,116.4,116.3,112,111.8,65.8,53.4,48.4,44.6,35.6,32.8,29.1,27.9,21.8。
[0376]
实施例6:(r)-1-(3-n-吗啉代丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0377][0378]
通过方法a由中间体1和吗啉制备并分离出呈米色固体的化合物。
[0379]1h nmr(dmso
d6
):11.78(1h,s),7.47(1h,m),7.18(1h,m),4.44(1h,quin,j=8.5hz),4.14(1h,dd,j=11.4,9.2hz),3.73(1h,dd,j=11.6,7.9hz),3.54(4h,m),3.28(1h,br dd,j=15.6,9.2hz),2.88(1h,br dd,j=15.4,8.1hz),2.36(2h,br t,j=7.4hz),2.30(4h,br s),2.23(2h,br t,j=7.0hz),1.67(2h,quin,j=7.3hz)。
[0380]
13
c nmr(dmso
d6
):156.9,156.9,156.9,156.9,155.3,155.3,155.3,155.3,155,149.1,149,149,148.9,147.5,147.5,147.4,147.4,147.3,147.3,146,145.9,145.9,145.8,127.6,119.4,119.1,119,119,118.9,116.5,116.4,116.4,116.3,112,111.8,66.1,57,53.1,48.3,35.7,29.0,24.3,21.7。
[0381]
实施例7:(r)-1-(3-((r)-3-氟吡咯烷-1-基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮盐酸盐
[0382][0383]
通过方法b由中间体1和(r)-3-氟吡咯烷盐酸盐制备并分离出呈浅棕色粉末的化
合物。
[0384]1h nmr(dmso
d6
):11.96,11.45,10.98(2h,m),7.49(1h,m),7.19(1h,m),5.44(1h,d,j=53hz),4.48(1h,quin,j=8.6hz),4.19(1h,br t,j=10.2hz),3.90-3.73(2h,m),3.67(1h,m),3.44-3.30(2h,m),3.22-3.05(3h,m),2.95(1h,dd,j=8.2,15.7hz),2.48(2h,m),2.35-2.0(2h,m),1.96(2h,m)。
[0385]
13
c nmr(dmso
d6
):156.9,156.9,155.3,155.3,149.1,149,149,149,147.7,147.6,147.5,147.4,147.4,147.3,146,145.9,145.9,145.8,118.7,118.6,118.6,118.5,116.6,116.5,116.5,116.4,112,112,112,112,111.9,111.9,111.8,111.8,92.6,92.5,92.4,91.4,91.3,91.2,58.6,54.4,53.8,51.5,48.5,35.8,31.6,30.6,29,23.8,21.4。
[0386]
实施例8:(r)-1-(3-(二甲基氨基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0387][0388]
通过方法b由中间体1和二甲胺盐酸盐制备并分离出呈灰白色固体的化合物。
[0389]1h nmr(dmso
d6
):11.78(1h,br s),7.48(1h,m),7.18(1h,m),4.45(1h,quin,j=8.6hz),4.14(1h,dd,j=11.6,9.1hz),3.73(1h,dd,j=11.7,7.9hz),3.30(1h,dd,j=9.3,15.7hz),2.89(1h,dd,j=15.6,8.2hz),2.36(2h,t,j=7.6hz),2.30(2h,br m),2.21(6h,br s),1.68(2h,m)。
[0390]
13
c nmr(dmso
d6
):156.9,156.9,156.9,156.9,155.3,155.3,155.3,155.3,155,149.1,149,149,148.9,147.5,147.5,147.4,147.4,147.3,147.3,146,145.9,145.9,145.8,127.8,119.3,119.1,119,119,118.9,116.5,116.4,116.4,116.3,112,111.8,57.7,48.4,44.6,35.7,29.0,25.1,21.6。
[0391]
实施例9:(r)-1-(3-(((s)-四氢-2h-吡喃-3-基)氨基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0392][0393]
通过方法b由中间体1和(s)-四氢-2h-吡喃-3-胺盐酸盐制备并分离出呈灰白色固体的化合物。
[0394]1h nmr(dmso
d6
):11.79(1h,m),7.47(1h,m),7.17(1h,m),4.44(1h,quin,j=8.5hz),4.14(1h,dd,j=11.6,9.1hz),3.75(1h,m),3.72(1h,dd,j=11.6,7.9hz),3.66(1h,dt,j=11.1,3.9hz),3.27(1h,br dd,j=15.5,9.3hz),3.22(1h,td,j=10.8,2.6hz),2.96(1h,br t,j=9.9hz),2.88(1h,dd,j=15.6,8.1hz),2.53(1h,m),2.47(2h,m),2.38(2h,t,j=7.3hz),1.88(1h,m),1.67-1.53(3h,m),1.44(1h,m),1.21(1h,m)。
[0395]
13
c nmr(dmso
d6
):156.9,156.9,156.9,156.9,155.3,155.3,155.3,155.3,155,149.1,149,149,148.9,147.5,147.5,147.4,147.4,147.3,147.3,146,145.9,145.9,145.8,127.6,119.5,119.1,119,119,118.9,116.5,116.4,116.4,116.3,112,111.8,71.1,67.3,53.1,48.4,45.2,35.7,29.2,29.1,27.9,24.2,21.7。
[0396]
实施例10:(r)-1-(3-(二甲基氨基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮盐酸盐
[0397][0398]
通过方法b由中间体1和二甲胺盐酸盐制备并分离出呈黄色固体的化合物。
[0399]1h nmr(dmso
d6
):11.84(1h,br s),10.24(1h,br s),7.48(1h,m),7.21(1h,m),4.45(1h,quin,j=8.7hz),4.15(1h,dd,j=11.2,9.3hz),3.74(1h,br dd,j=11.4,8.2hz),3.31(1h,br dd,j=15.6,9.2hz),3.00(2h,m),2.93(1h,br dd,j=15.6,8.4hz),2.72(6h,m),2.43(2h,t,j=7.5hz),1.91(2h,m)。
[0400]
13
c nmr(dmso
d6
):156.9,156.9,155.3,155.3,149.1,149.1,149,149,147.5,147.5,147.4,147.4,147.3,146,145.9,145.9,145.9,128.1,118.9,118.7,118.1,116.6,116.5,116.4,116.4,112,111.8,55.7,48.4,42,42,35.7,29,22.5,21.2。
[0401]
实施例11:(r)-1-(3-((r)-3-氟吡咯烷-1-基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0402][0403]
通过方法b由中间体1和(r)-3-氟吡咯烷盐酸盐制备并分离出呈黄色粉末的化合物。
[0404]1h nmr(dmso
d6
):11.76(1h,s),7.47(1h,m),7.17(1h,m),5.17(1h,m),4.44(1h,t,j=8.6hz),4.14(1h,dd,j=11.6,9.1hz),3.73(1h,dd,j=11.6,7.9hz),3.27(1h,br dd,j=15.6,9.2hz),2.88(1h,dd,j=15.6,8.1hz),2.75(2h,m),2.54(1h,m),2.37(4h,m),2.20(1h,m),2.09(1h,m),1.83(1h,m),1.67(2h,quin,j=7.3hz)。
[0405]
13
c nmr(dmso
d6
):156.9,156.9,156.9,156.9,155.3,155.3,155.3,155.3,155,149.1,149,149,148.9,147.5,147.5,147.4,147.4,147.3,147.3,146,145.9,145.9,145.8,127.7,119.5,119.1,119,119,118.9,116.5,116.4,116.4,116.3,112,111.8,93.9,92.8,60.3,60.1,54.2,51.7,48.4,35.7,32.3,32.2,29.0,26.6.21.8。
[0406]
实施例12:(r)-1-(3-(甲基(四氢-2h-吡喃-4-基)氨基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮
[0407]
[0408]
通过方法c由中间体1和n-甲基四氢-2h-吡喃-4-胺制备并分离出呈浅米色固体的化合物。
[0409]1h nmr(dmso
d6
):11.79(1h,s),7.47(1h,m),7.18(1h,m),4.44(1h,quin,j=8.5hz),4.14(1h,dd,j=11.4,9.1hz),3.86(2h,br d,j=9.5hz),3.73(1h,dd,j=11.6,7.9hz),3.28(1h,dd,j=15.3,9.2hz),3.24(2h,m),2.88(1h,br dd,j=15.6,8.1hz),2.50(1h,br),2.35(2h,br),2.35(2h,t,j=7.2hz),2.16(3h,br s),1.67(2h,br s),1.59(2h,br s),1.41(2h,br s)。
[0410]
13
c nmr(dmso
d6
):156.9,156.9,156.9,155.3,155.3,155.3,155.1,149.1,149,149,148.9,147.6,147.5,147.5,147.4,147.4,147.3,147.3,145.9,145.9,145.9,145.8,127.6,119.5,119.1,119,119,118.9,116.5,116.4,116.4,116.3,112,112,112,111.9,111.8,111.8,111.8,111.8,66.5,59.4,51.9,48.4,36.8,35.6,29.1,28.6,25.4,21.7。
[0411]
实施例13:(6r)-1-(3-(甲基(四氢呋喃-3-基)氨基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮盐酸盐
[0412][0413]
通过方法c由中间体1和n-甲基四氢呋喃-3-胺盐酸盐制备并分离出呈浅黄色固体的化合物。
[0414]1h nmr(dmso
d6
):11.84(1h,m),10.92(1h,m),7.48(1h,m),7.20(1h,m),4.46(1h,quin,j=8.6hz),4.15(1h,dd,j=11.4,9.3hz),4.05(1h,m),4.0(1h,m),3.93(1h,m),3.74(2h,m),3.60(1h,m),3.31(1h,dd,j=15.8,9.6hz),3.13-2.86(3h,m),2.67(3h,m),2.43(2h,m),2.29-2.10(2h,m),1.97(2h,m)。
[0415]
13
c nmr(dmso
d6
):157,156.9,156.9,156.9,155.4,155.3,149.1,149.1,149,149,149,147.6,147.5,147.5,147.4,147.4,147.3,146,145.9,145.9,145.9,128,118.9,118.8,118.8,118.8,118.7,118.2,116.6,116.5,116.4,116.4,112,112,112,112,111.9,111.9,111.8,111.8,67.8,67.1,66.9,66.9,64.4,64.1,59.8,53.1,53.1,52.9,52.9,48.4,37,37,36.6,36.6,35.7,29.1,27.2,27.2,26.1,26,22.2,22.2,22.1,21.3,21.3。
[0416]
实施例14:(r)-1-(3-(甲基(四氢-2h-吡喃-4-基)氨基)丙基)-6-(2,3,6-三氟苯基)-2,5,6,7-四氢-3h-吡咯并[1,2-c]咪唑-3-硫酮盐酸盐
[0417][0418]
通过方法c由中间体1和n-甲基四氢-2h-吡喃-4-胺制备并分离出呈浅黄色固体的化合物。
[0419]1h nmr(dmso
d6
):11.85(1h,br s),10.60(1h,br s),7.48(1h,m),7.19(1h,m),4.46(1h,quin,j=8.6hz),4.16(1h,dd,j=11.5,9.2hz),3.95(2h,m),3.74(1h,br dd,j=11.4,8.1hz),3.41(1h,m),3.31(3h,m),3.10(1h,m),2.94(2h,m),2.67(3h,d,j=5hz),2.44(2h,m),1.98(3h,m),1.90(1h,m),1.69(2h,m)。
[0420]
13
c nmr(dmso
d6
):156.9,156.9,156.9,155.3,155.3,155.3,155.3,149.1,149,149,149,148.9,148.9,147.6,147.5,147.5,147.4,147.4,147.4,147.3,147.3,146,145.9,145.9,145.8,128.1,119,118.9,118.9,118.9,118.9,118.8,118.8,118.7,118.2,118.2,118.2,116.5,116.5,116.4,116.4,112,112,112,112,111.9,111.8,111.8,111.8,65.5,65.4,60.2,51.1,48.4,35.8,35.7,35.6,29.1,27.1,26.1,26.1,22.1,22.1,21.3。
[0421]
实施例15:(5as,6ar)-5a-(3-氯-2,6-二氟苯基)-1-(3-n-吗啉代丙基)-5,5a,6,6a-四氢环丙[3,4]吡咯并[1,2-c]咪唑-3(2h)-硫酮盐酸盐
[0422][0423]
通过方法a由中间体3和吗啉制备并分离出呈灰白色固体的化合物。
[0424]1h nmr(dmso
d6
):11.80(1h,s),10.82(1h,br s),7.65(1h,td,j=8.7,5.6hz),7.22(1h,t,j=9.0hz),4.02(1h,d,j=12.4hz),3.95(2h,m),3.78(2h,br t,j=11.4hz),
3.74(1h,d,j=12.2hz),3.41(2h,m),3.07(4h,m),2.83(1h,dd,j=8.3,4.5hz),2.55(2h,m),2.01(2h,m),1.67(1h,dd,j=8.3,5.5hz),1.32(1h,t,j=5.0hz)。
[0425]
13
c nmr(dmso
d6
):161.2,161.2,159.6,159.6,157.8,157.8,156.2,156.1,156.1,130.3,130.3,118.1,117.2,117.1,116.9,115.8,115.8,115.7,115.6,113,112.8,63.2,55.2,51.3,51,51,26.4,21.8,21.7,21.3,21。
[0426]
实施例16:(5as,6ar)-5a-(5-氯-2-氟苯基)-1-(3-n-吗啉代丙基)-5,5a,6,6a-四氢环丙[3,4]吡咯并[1,2-c]咪唑-3(2h)-硫酮
[0427][0428]
通过方法c由中间体2和吗啉制备并分离出呈白色固体的化合物。
[0429]1h nmr(dmso
d6
):11.71(1h,s),7.48(1h,dd,j=6.5,2.7hz),7.42(1h,ddd,j=8.8,4.3,2.7hz),7.29(1h,dd,j=10.0,8.9hz),4.06(1h,d,j=11.8hz),3.77(1h,d,j=12.2hz),3.57(4h,br t,j=4.5hz),2.89(1h,dd,j=8.3,4.3hz),2.43(2h,m),2.34(4h,m),2.27(2h,t,j=7.0hz),1.73(2h,m),1.64(1h,dd,j=8.3,5.4hz),1.13(1h,t,j=4.8hz)。
[0430]
13
c nmr(dmso
d6
):161.3,159.7,155.7,130.2,130.1,130,129.3,129.2,129,128.9,128.3,128.2,119.2,117.5,117.4,66.2,57.1,53.3,51.4,32.3,24.5,22.3,21.8,20.4。
[0431]
实施例17:(5as,6ar)-5a-(5-氯-2-氟苯基)-1-(3-((四氢-2h-吡喃-4-基)氨基)丙基)-5,5a,6,6a-四氢环丙[3,4]吡咯并[1,2-c]咪唑-3(2h)-硫酮
[0432][0433]
通过方法a由中间体2和四氢-2h-吡喃-4-胺制备并分离出呈灰白色固体的化合物。
[0434]1h nmr(dmso
d6
):11.74(1h,m),7.48(1h,dd,j=6.5,2.7hz),7.43(1h,ddd,j=8.7,4.4,2.7hz),7.30(1h,dd,j=10.0,8.7hz),4.06(1h,d,j=12.0hz),3.83(2h,m),3.78(1h,d,j=12.2hz),3.27(2h,tt,j=11.6,2.4hz),2.87(1h,dd,j=8.3,4.3hz),2.69(1h,br s),2.61(2h,m),2.47(2h,td,j=7.4,2.9hz),1.77(2h,d,j=13.4hz),1.72(2h,m),1.65(1h,dd,j=8.4,5.3hz),1.27(2h,m),1.13(1h,t,j=4.8hz)。
[0435]
13
c nmr(dmso
d6
):161.3,159.7,155.7,130.2,130.1,130.1,129.3,129.3,129,128.9,128.3,119.1,117.6,117.4,65.8,53.4,51.4,44.5,32.5,32.3,27.7,22.3,21.8,20.5。
[0436]
实施例18:(5as,6ar)-5a-(3-氯-2,6-二氟苯基)-1-(3-((四氢-2h-吡喃-4-基)氨基)丙基)-5,5a,6,6a-四氢环丙[3,4]吡咯并[1,2-c]咪唑-3(2h)-硫酮
[0437][0438]
通过方法c由中间体3和四氢-2h-吡喃-4-胺制备并分离出呈灰白色固体的化合物。
[0439]1h nmr(dmso
d6
):11.77(1h,m),7.64(1h,td,j=8.7,5.6hz),7.21(1h,m),4.01
(1h,d,j=12.2hz),3.83(2h,m),3.72(1h,d,j=12.2hz),3.27(2h,m),2.73(2h,m),2.63(2h,m),2.48(2h,m),1.76(2h,br d,j=12.2hz),1.73(2h,m),1.67(1h,br dd,j=8.3,5.5hz),1.35-1.20(3h,m)。
[0440]
13
c nmr(dmso
d6
):161.3,161.2,159.6,159.6,157.8,157.8,156.2,156.1,155.8,130.3,130.2,130,119.3,117.3,117.1,117,115.7,115.6,113,112.8,65.8,53.4,51.3,44.3,32.2,27.5,26.4,21.8,21.7,21.1。
[0441]
实施例19:(5as,6ar)-5a-(3-氯-2,6-二氟苯基)-1-(3-(吡咯烷-1-基)丙基)-5,5a,6,6a-四氢环丙[3,4]吡咯并[1,2-c]咪唑-3(2h)-硫酮
[0442][0443]
通过方法c由中间体3和吡咯烷制备并分离出呈灰白色固体的化合物。
[0444]1h nmr(dmso
d6
):11.78(1h,br s),7.64(1h,td,j=8.7,5.8hz),7.21(1h,t,j=8.6hz),4.01(1h,d,j=12.2hz),3.73(1h,d,j=12.3hz),3.04-2.58(6h,m br),2.75(1h,m),2.50(2h,m),1.93-1.71(6h,m),1.67(1h,br dd,j=8.1,5.4hz),1.28(1h,br t,j=5.0hz)。
[0445]
13
c nmr(dmso
d6
):161.3,161.2,159.6,159.6,157.8,157.8,156.2,156.1,155.9,130.3,130.2,130.1,118.9,117.2,117.1,117,115.7,115.7,115.6,115.6,112.9,112.8,53.9,53.3,51.3,26.4,25.8,22.9,21.7,21.6,21。
[0446]
实施例20:(5as,6ar)-5a-(5-氯-2-氟苯基)-1-(3-(吡咯烷-1-基)丙基)-5,5a,6,6a-四氢环丙[3,4]吡咯并[1,2-c]咪唑-3(2h)-硫酮
[0447]
[0448]
通过方法c由中间体2和吡咯烷制备并分离出呈浅米色固体的化合物。
[0449]1h nmr(dmso
d6
):11.74(1h,br s),7.48(1h,dd,j=6.5,2.7hz),7.43(1h,ddd,j=8.7,4.3,2.8hz),7.30(1h,t,j=9.4hz),4.06(1h,br d,j=12.0hz),3.78(1h,d,j=12.0hz),2.90(1h,br dd,j=8.1,4.3hz),2.98-2.19(8h,m),1.95-1.55(6h,m),1.64(1h,br dd,j=8.2,5.3hz),1.14(1h,br t,j=4.7hz)。
[0450]
13
c nmr(dmso
d6
):161.3,159.7,155.8,130.3,130.1,130,129.3,129.2,129,128.9,128.3,118.9,117.6,117.4,54.2,53.4,51.4,32.3,26.2,22.9,22.3,21.8,20.4。
[0451]
实施例21:(5as,6ar)-5a-(5-氯-2-氟苯基)-1-(3-(((s)-四氢-2h-吡喃-3-基)氨基)丙基)-5,5a,6,6a-四氢环丙[3,4]吡咯并[1,2-c]咪唑-3(2h)-硫酮
[0452][0453]
通过方法c由中间体2和(s)-四氢-2h-吡喃-3-胺制备并分离出呈浅米色固体的化合物。
[0454]1h nmr(dmso
d6
):11.71(1h,m),7.48(1h,dd,j=6.5,2.7hz),7.43(1h,ddd,j=8.7,4.4,2.7hz),7.30(1h,dd,j=10.0,8.9hz),4.05(1h,m),3.80(1h,m),3.77(1h,d,j=12.0hz),3.67(1h,dt,j=3.5,11hz),3.24(1h,br s),3.01(1h,m),2.88(1h,m),2.56(2h,m),2.50(1h,m),2.44(2h,td,j=7.4,3.5hz),1.90(1h,m),1.69(2h,br s),1.64(1h,dd,j=8.4,5.3hz),1.59(1h,m),1.47(1h,m),1.23(1h,dt,j=7.2,3.5hz),1.13(1h,m)。
[0455]
13
c nmr(dmso
d6
):161.3,159.7,155.7,130.1,130,130,129.3,129.2,129,128.9,128.3,119.3,117.5,117.4,71.6,67.3,53.3,51.3,45.4,32.3,29.7,28.4,24.4,22.3,21.8,20.5。
[0456]
实施例22:(5as,6ar)-5a-(3-氯-2,6-二氟苯基)-1-(3-(((s)-四氢-2h-吡喃-3-基)氨基)丙基)-5,5a,6,6a-四氢环丙[3,4]吡咯并[1,2-c]咪唑-3(2h)-硫酮
[0457][0458]
通过方法c由中间体3和(s)-四氢-2h-吡喃-3-胺制备并分离出呈浅黄色固体的化合物。
[0459]1h nmr(dmso
d6
):11.74(1h,m),7.63(1h,td,j=8.7,5.7hz),7.20(1h,t,j=9.0hz),4.01(1h,d,j=12.2hz),3.78(1h,dt,j=10.7,1.9hz),3.72(1h,d,j=12.2hz),3.67(1h,dt,j=7.4,3.4hz),3.22(1h,td,j=10.9,2.5hz),2.97(1h,br t,j=9.8hz),2.72(1h,dd,j=8.2,4.4hz),2.54(2h,m),2.48(1h,m),2.45(2h,m),1.90(1h,m),1.66(3h,m),1.58(1h,m),1.44(1h,m),1.31-1.15(2h,m)。
[0460]
13
c nmr(dmso
d6
):161.3,161.2,159.6,159.6,157.8,157.8,156.2,156.1,155.7,130.3,130.2,129.9,119.6,117.3,117.1,117,115.7,115.7,115.6,115.6,112.9,112.8,71.7,67.3,53.4,51.2,45.3,29.7,28.5,26.3,24.4,21.8,21.7,21.1
[0461]
g.多巴胺-β-羟化酶抑制测定
[0462]
可以使用以下测定评估人血浆中化合物抑制dβh活性的能力。本发明的优选化合物(包括大多数上述具体实施例)在此细胞测定中在0.1μm下表现出≤50%的以“对照的%”来表示的活性。本发明的更优选化合物在此细胞测定中在0.1μm下表现出≤20%的以“对照的%”来表示的活性。本发明的特别优选化合物在此测定中表现出≤20nm的ic
50
。
[0463]
人血浆中的多巴胺β羟化酶活性通过nagatsu和udenfriend(nagatsu,t.和udenfriend,s.“photometric assay of dopamine-β-hydroxylase activity in human blood.”clin.chem.18(9)980-983,1972)的方法、加以轻微修改来测量。过氧化氢酶、n-乙基马来酰亚胺、酪胺、富马酸二钠、巴吉林(pargyline)、乙酸钠、抗坏血酸、硫酸铜和章鱼胺(octopamine)获自sigma chemical co.,st.louis,mo.63178。人血浆样品获自健康供体(instituto portugu
ê
s do sanguesanguecentro sangueporto,portugal)。从收集之日起,将血浆储存在-80℃下直至使用。首先在二甲基亚砜中以10mm的浓度制备测试化合物,并且在二甲基亚砜中稀释至所需浓度。将测试化合物在超纯水中进一步稀释至浓度为待测最终浓度的20倍。测试化合物的最终浓度为10和100nm。预混合用于构成孵育缓冲液的各种试剂,并且其由以下组分组成:乙酸钠缓冲液(1m,ph 5.0,18ml)、富马酸钠(0.2m,4.5ml)、抗坏血酸(0.2m,4.5ml,新鲜制备)、巴吉林(20mm,新鲜制备,4.5ml)、n-乙基马来酰亚胺(0.2m,4.5ml)、过氧化氢酶(10 000u/ml,9ml)、硫酸铜(20μ
m,4.5ml)和4.5超纯水。标准孵育混合物(总体积950μl)含有:50μl化合物或媒介物(二甲基亚砜2%);700μl孵育缓冲液;125μl血浆(或用于空白反应或标准曲线的盐水);75μl盐水。将反应混合物置于水浴中,在37℃下振荡,并预孵育10分钟。加入酪胺(0.5m),并且继续孵育45分钟。将反应内容物暴露于空气。在预孵育期结束时加入高氯酸2m的酶制剂样品(含125μl血浆)用作空白。使用每种测试化合物的空白。对于章鱼胺标准曲线,将2m高氯酸替换为在2m高氯酸中制备的递增浓度(0.5、1、2.5、5、7.5、10、15、20μg/ml最终浓度)的章鱼胺。通过加入200μl 2m摩尔高氯酸停止孵育,并将混合物以9000g离心5min。将上清液(800μl)转移至色谱柱(spe短柱isolute scx-3,100mg)中,并以150g离心2min。通过以150g离心2min,用0.5ml超纯水将色谱柱再洗涤两次。通过以150g离心2min,用0.3ml的4m氢氧化铵将吸附的章鱼胺洗脱两次。然后通过加入200μl高碘酸钠(2%)并孵育6min,将洗脱液中的章鱼胺转化为对羟基苯甲醛。通过加入200μl焦亚硫酸氢钠(10%)来减少过量高碘酸盐。通过使用具有软件pro software 5.3的spectramax plus 384(molecular devices)分光光度计在96孔板中于330mm处测量吸光度。吸光度与在0.5至20μg/ml之间的章鱼胺浓度呈线性关系。多巴胺β羟化酶活性以nmol所形成章鱼胺/ml血浆/小时来测定并且化合物的作用表示为%对照。结果在下表中报告为在测试的抑制剂浓度下以对照的%来表示的活性。
[0464]
基于6种不同化合物浓度(100nm至0.3nm)的结果的曲线拟合,计算出所选化合物的ic
50
值。ic
50
数据以nm浓度报告。
[0465]
h.儿茶酚胺测定
[0466]
如先前所述(bonifacio,m.j.;sousa,f.;neves,m.;palma,n.;igreja,b.;pires,n.m.;wright,l.c.;soares-da-silva,p.“characterization of the interaction of the novel anthyhypertensiveetamicastat with human dopamine-beta-hydroxylase:comparison withnepicastat.”eur.j.pharmacol.751,50-58,2015.),加以轻微修改,对脑干和左心室中的儿茶酚胺进行定量。在40%的kleptose中以2.5mg/ml的浓度制备测试化合物以便在10mg/kg的剂量下施用。向wistar大鼠和组织(脑干或左心室)施用化合物和媒介物(kleptose 40%),在施用后的指定时间点,收集在高氯酸(0.2m)中。将组织在4℃下储存过夜,然后通过0.22μm孔径过滤器(costar spin-x from corning inc.,usa)通过离心(1500g,4min,4℃)过滤溶液。通过使用spheri-5rp-185mm色谱柱(perkin-elmer)在带有电化学检测的hplc系统上直接注入50μl样品体积来定量滤液中的儿茶酚胺。流动相由含0.1m柠檬酸、0.1m乙酸钠、0.15mm edta、1mm二丁胺、1mm辛基硫酸盐和用高氯酸来调整至ph 3.5的5%甲醇的溶液组成。
[0467]
i.生物数据
[0468]
表1.
[0469]
下表示出了所述化合物在人血浆中的dβh抑制作用和ic
50
值:
[0470]
实施例dβh(0.1μm)adβh(0.01μm)aic
50
(nm)b112.964.612.7266.698.4nd315.557.39.5454.282.7nd
55.442.512.7610.463.611.673.042.58.3852.8113.4nd912.248.119.11045.886.2nd117.740.67.21218.971.220.91329.369.922.21419.073.233.1151.013.62.7163.336.27.7173.941.89.9181.020.14.0191.017.03.0209.153.49.8218.545.3nd223.523.54.0
[0471]a对照的%;bic
50
值以95%的置信区间来表示
[0472]
图1示出了在口服施用10mg/kg化合物1、5、6、9、11和14之后给药后15h的脑干(br.s)和左心室(hrt.lv)中去甲肾上腺素(na)的水平。数据以对照的%来表示。每个柱条表示每组4至5只大鼠的平均值
±
sem。
[0473]
从图1中可以看出,这些化合物具有外周选择性,即其降低了hrt.lv中的na水平(与对应的对照值显著不同)(*p《0.05)),同时br.s中的na水平保持不变(与对应的对照值无显著不同)(*p》0.05))。将kruskal-wallis检验然后dunn多重比较检验用于统计分析。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1