新的季铵化合物的制作方法
新的季铵化合物
1.相关申请的引用:本技术要求于2019年6月19日提交的欧洲申请号19305787.4的优先权,出于所有目的将该申请的全部内容通过引用并入本文。
2.本发明涉及新的季铵化合物、特别是衍生自由脂肪酸或其衍生物获得的内酮的新的季铵化合物和该新化合物作为表面活性剂的用途。
3.具有表面活性剂特性并且可以用于相应应用的脂肪季铵化合物已经描述于文献中,并且是从各种供应商以多种不同类型可商购获得的。
4.wo 97/08284披露了包含由以下通式表示的格尔伯特(guerbet)醇甜菜碱酯的组合物
5.其中r1至r3独立地选自c1至c4烷基基团或c
2-c4烯基基团,a是从1至4,并且r4和r5独立地选自c
12
至c
22
烷基或烯基基团,r4和r5的链长总和优选地是至少30。由于化合物衍生自格尔伯特醇,因此基团r4和r5中碳原子的数目总是相差2。
6.ep 721 936涉及以下通式的液体季铵化合物
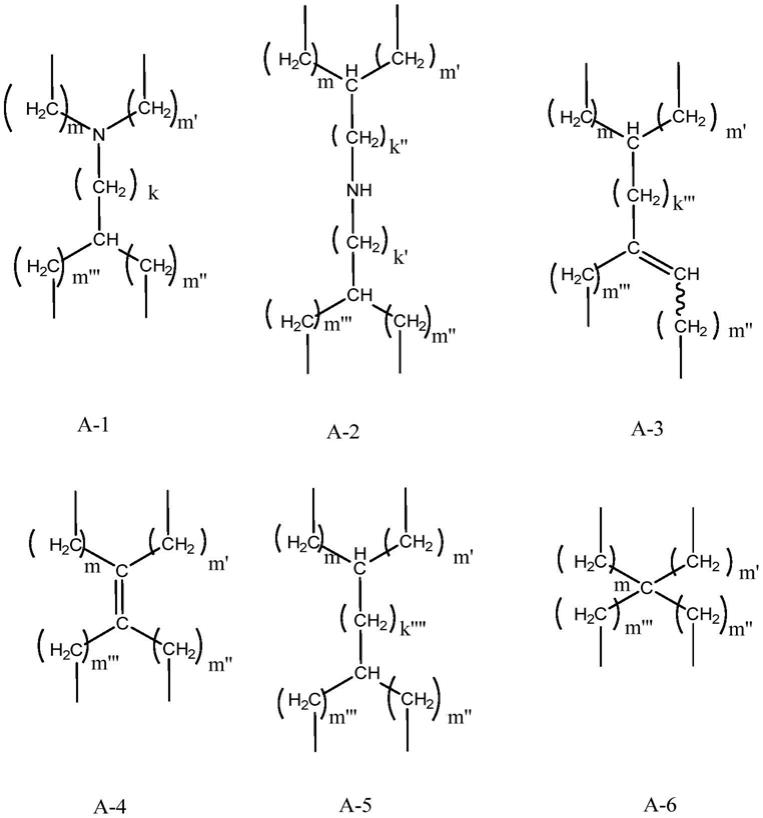
7.其中r
1-2
是直链或支链的c
36-c
44
烷基或烯基基团,r2至r4是c
1-c5烷基或羟烷基基团,y是直链或支链的c
2-c4亚烷基基团,m是0至20的数并且n是1至6的整数。如在wo 97/08284中,ep 721 936的优选化合物衍生自格尔伯特醇并且由以下式表示
8.de 3402146涉及季铵化合物。如在wo 97/08284和ep 721 936中,化合物包含两个长链取代基,它们是格尔伯特酸的酯。
9.虽然脂肪季铵化合物被广泛用作表面活性剂,但是仍然需要该类型的化合物,其具有一方面表面活性剂特性和另一方面生物降解性的良好组合。由于消费者期望具有更加环境友好的产品,生物降解性在最近已经变得越来越重要。生物降解性的改善不应负面影响表面活性剂特性。
10.因此,本发明的目的是提供具有良好的表面活性剂特性和良好的生物降解性的新的季铵化合物。
11.该目的用式(i)的化合物实现。本发明的优选实施例也在后文详述。
12.根据本发明的新颖的离子化合物具有通式(i)
13.其中a是选自由a-1至a-6组成的组的四价连接基,q1至q4可以彼此相同或不同,选自由氢、r和x组成的组,其中r,在每次出现时可以相同或不同,是c
5-c
27
脂肪族基团、优选地c6至c
24
脂肪族基团,m、m’、m”和m
”’
,在每次出现时可以相同或不同,是0、1、2或3,k、k’、k”、k
”’
和k
””
,可以相同或不同,是0、1、2或3,和x,在每次出现时可以相同或不同,由式ii表示
其中z1、z2和z3,可以相同或不同,是o、s或nh,y是二价的c
1-c6脂肪族基团,r’、r”和r
”’
,可以相同或不同,是氢或c1至c4烷基基团,n和n’是0或1,其中n+n’的总和是1或2,其中q1至q4中的至少一个由x表示,并且基团q1至q4中的至少两个由r表示,基团r在每次出现时可以相同或不同,和其中,如果离子化合物是使得:(i)a由a-6表示,其中m、m’、m”和m
”’
等于0,(ii)q1至q4中的一个且仅一个由取代基x表示并且取代基x中的n等于0,以及(iii)q1至q4中的两个且仅两个由取代基r表示,则该两个取代基r的碳原子的数目的差值是0、1、3或大于3。
14.m、m’、m”、m
”’
,在每次出现时可以相同或不同,优选地是0、1、或2,甚至更优选地是0或1。
15.k、k’、k
”’
和k
””
,可以相同或不同,优选地是0、1或2,甚至更优选地是0或1。
16.根据本发明的新颖化合物是季铵衍生物并且包含四价连接基a和在每次出现时可以彼此相同或不同的四个取代基q1至q4。q1至q4中的至少两个是基团r,即包含从5至27个、优选地从6至24个碳原子的脂肪族基团。
17.脂肪族基团r可以不含任何双键和任何三键。替代性地,脂肪族基团r可以包含至少一个-c=c-双键和/或至少一个-c≡c-三键。
18.脂肪族基团r有利地选自烷基基团、烯基基团、烷二烯基基团、烷三烯基基团和炔基基团。
19.脂肪族基团r可以是直链或支链的。
20.优选地,脂肪族基团r独立地选自烷基和烯基基团。
21.更优选地,脂肪族基团r独立地选自烷基和烯基基团,通常选自c
6-c
24
烷基和c
6-c
24
烯基基团,非常经常选自c
6-c
21
烷基和c
6-c
21
烯基基团,并且经常选自(i)c
6-c
19
烷基和c
6-c
19
烯基基团或选自(ii)c
6-c
17
烷基和c
6-c
17
烯基基团。更优选地,r表示烷基基团,通常表示c
6-c
24
烷基基团,非常经常表示c
6-c
21
烷基基团,经常表示c
6-c
19
烷基基团或c
6-c
17
烷基基团。已经发现在某些情况下具有10至20、优选地具有11至17或具有10至17个碳原子的脂肪族基团、特别是烷基基团是有利的。
22.非环脂肪族基团、更优选地直链脂肪族基团、仍更优选地直链烷基基团可以作为取代基r的优选实例提及。
23.r的碳原子的数目可以是偶数或奇数,并且每个基团r可以具有相同的碳原子数目,或者不同基团r的碳原子数目可以不同。
24.如果a由a-6表示,其中m、m’、m”和m
”’
等于0,(ii)q1至q4中的一个且仅一个由取代
基x表示并且取代基x中的n等于0,以及(iii)q1至q4中的两个且仅两个由取代基r表示,则该两个取代基r的碳原子的数目的差值是0、1、3或大于3。
25.在本发明的离子化合物中,取代基q1至q4中的至少一个由以上式(ii)表示的基团x表示。
26.在基团x中,优选地取代基z1、z2和z3中的至少一个、更优选地至少两个并且最优选地所有三个是氧。其中所有三个取代基z1、z2和z3是氧的化合物是酯(n+n’是1)或碳酸酯(n+n’是2)衍生物。
27.n和n’可以是0或1并且n和n’的总和是至少1、优选地1或2。
28.r’、r”和r
”’
,可以相同或不同,优选地是氢或c1至c4烷基基团、优选地甲基或乙基、更优选地甲基。优选地r’、r”和r
”’
中的至少一个、更优选地至少两个、更优选所有三个是c1至c4烷基基团、优选地甲基或乙基、最优选地甲基。
29.y优选地是非环二价脂肪族基团、更优选地直链二价脂肪族基团、仍更优选地直链烷二基(亚烷基)基团并且优选地具有1至6个、甚至更优选地1至4个碳原子。在其中n’是1的化合物中,脂肪族基团y优选地具有至少两个碳原子、特别是2至6个碳原子。
30.根据另一优选实施例,本发明的化合物包含一个或两个基团x和两个且仅两个基团r。
31.在本发明的第一组优选化合物中,a由a-6表示,m、m’、m”和m
”’
是0,z1至z3是o,并且化合物包含两个基团r和一个基团x。在该实施例的优选子组中,n是0并且n’是1或n是1。
32.在第二组优选化合物中,a由a-3或a-4表示,m、m’、m”、m
”’
和k
”’
是0并且取代基q1至q4中的两个由基团x表示,其中两个x附接至连接基a的相同碳原子并且两个基团r附接至连接基a的相同或不同碳原子。
33.在第三组优选化合物中,a由a-1表示,m和m’是1,m”和m
”’
是0,k是0并且两个取代基q1至q4由基团x表示,其中两个基团x附接至直接附接至连接基a的氮原子的-(ch2)
m-和-(ch2)m’‑
基团。
34.在第四组优选化合物中,a由a-2表示,k’是0,k”是1,m是1,m’、m”和m
”’
是0,并且取代基q1至q4中的两个由附接至连接基a的两个相邻碳原子的基团x表示;换言之,一个第一基团x附接至连接基a的一个第一碳原子并且另一个基团x附接至连接基a的另一个碳,连接基a的所述第一碳原子和连接基a的所述另一个碳原子彼此相邻。
35.在第五组优选化合物中,a由a-5表示,m、m’、m”、m
”’
和k
””
是0,取代基q1至q4中的两个是x,其中连接基a的每个次甲基基团携带一个基团x和一个基团r,其中x和r在每次出现时可以相同或不同。在该实施例的优选子组中,n是1,n’是0,z2是o并且y是ch2。在该实施例的非常优选子组中,n是1,n’是0,z1和z2是o并且y是ch2。
36.以下式(iv)至(ix)的化合物表示根据本发明的特别优选的化合物的组
37.其中s和s’,可以相同或不同,是0、1、2或3,
[0038][0039]
式(iv)至(ix)中的r、r’、r”、r
”’
和y具有如前文对式(i)所定义的含义。
[0040]
式(x)和(xi)的化合物,其中式(viii)和(ix)的化合物分别表示子集,也是非常优选的:
[0041]
式(x)和(xi)中的r、r’、r”、r
”’
和y具有如前文对式(i)所定义的含义。
[0042]
本发明的另一实施例涉及式(iii)的电中性化合物
[0043]
其中a、q1至q4如前文所定义和描述,w是带有w个负电荷的阴离子或阴离子基团,并且r是由基团x表示的取代基q1至q4的数目。合适的阴离子或阴离子基团w是例如卤离子诸如氯离子、氟离子、溴离子或碘离子、甲基硫酸根(methyl sulfate)或甲基硫酸根(methosulfate)阴离子(ch
3-oso
3-)、硫酸根阴离子、硫酸氢根阴离子(hso
4-)或有机羧酸根阴离子诸如乙酸根、丙酸根、苯甲酸根、酒石酸根、柠檬酸根、乳酸根、马来酸根或琥珀酸根。
[0044]
根据本发明的化合物可以通过多种不同的方法获得。用于制造本发明的化合物的优选方法包括式r-c(=o)-r的内酮的反应,该内酮可以优选地通过脂肪酸、脂肪酸衍生物或其混合物的脱羧酮化获得。在us 2018/0093936中披露了按照该路线制造内酮的合适方法,进一步的细节参见该专利。
[0045]
现在描述使用如以上所指示的可获得的内酮作为起始材料合成本发明的各种化合物。后文所描述的方法变体示出了具体化合物的合成,并且技术人员将基于其专业知识并考虑相应合成的具体目标产物来修改反应物和反应条件以制造根据本发明的其他化合物。
[0046]
其中a是a-6的化合物的合成,其示例性地示出了其中j是j1的式(iv)的化合物。
[0047]
在第一示例性方法中,内酮r-c(=o)-r首先与氢反应(氢化反应)以提供仲醇。然后通过羰基化反应使该醇与一氧化碳反应。然后使为羧酸的羰基化产物经受与季铵盐(例如氯化胆碱)的酯化反应,由此分离出水并获得所期望的式(iv)的化合物。替代性地,羧酸可以首先与氨基醇(例如二甲基氨基乙醇)通过酯化反应(同时释放水)缩合,并且所获得的氨基酯可以用烷基化剂季铵化。
[0048]
前述步骤顺序的反应方案如下:
[0049]
其中l’是单价离去基团,诸如例如卤素阴离子(特别是氯阴离子)或甲基硫酸根基团。
[0050]
以上反应方案中的第一步骤包括将内酮还原成仲醇。该步骤之后是由一氧化碳(羰基基团)的插入组成的第二转化以产生羧酸。在合适的催化剂的存在下分别用活性氢和一氧化碳进行的该通用反应序列的氢化和羰基化反应是技术人员已知的并且已经在文献中描述。技术人员将基于其专业知识考虑期望的目标化合物来选择合适的催化剂和反应条件,这样在此不需要给出进一步的细节。
[0051]
式(iv)的化合物的替代性路线包括氢氰化步骤并且由以下序列组成:向酮中添加hcn以提供羟基腈中间体。然后将该羟基腈在一个步骤中脱水和氢化以提供腈中间体。然后将该腈水合以提供羧酸中间体。该羧酸可以按照如以上所描述的相同方式转化成所期望的季化合物。前述步骤顺序的反应方案如下:其中l’如前文所定义。
[0052]
如对于前述反应序列,该序列的单个反应步骤已经在文献中描述并且是技术人员已知的。技术人员将基于其专业知识考虑期望的目标化合物来选择合适的催化剂和反应条件,这样在此不需要给出进一步的细节。
[0053]
其中a是a-6并且j是j3的化合物的合成
[0054]
该类型的化合物可以通过包括将内酮氢化成仲醇、随后进行涉及碳酸二甲酯和由此获得的仲醇的碳酸酯交换反应的步骤的序列获得。然后与二甲基氨基乙醇进行第二碳酸酯交换反应、随后季铵化,得到所期望的产物。
[0055]
在第一步骤中,将内酮氢化成仲醇可以在优选地配备有搅拌装置(诸如例如rushton涡轮机)而不添加任何溶剂的高压釜中进行。将内酮和合适的催化剂(例如钯或钌金属/碳)引入反应器中,其后将反应器密封。然后优选地用氢气吹扫反应器。然后将温度升高至高于酮的熔点(温度通常在从80℃至120℃的范围内)并搅拌混合物。然后将温度升高至大约120℃至180℃(优选地大约150℃)并且将混合物在维持超大气压氢气压力(10至80巴)的此种升高的温度下搅拌直至反应完成。
在反应结束时,允许混合物冷却至略高于醇的熔点的温度,释放压力并且可以过滤催化剂以获得仲醇:
[0056]
在随后的步骤中,将仲醇碳酸化以获得碳酸酯衍生物。该步骤可以例如在过量的碳酸二烷基酯alk
1-o-c(=o)-o-alk2中进行,其中alk1和alk2可以相同或不同,是具有1至8个碳原子的烷基基团、优选地具有1至4个碳原子的烷基基团,其可以作为溶剂,用甲醇钠(naome)作为催化剂(通常以基于仲醇的量从3至10mol%的量使用)。优选的碳酸二烷基酯是碳酸二甲酯(dmc),其中alk1和alk2都是甲基。代替以上所描述的碳酸二烷基酯,碳酸化可以用带有一个或多个芳香族基团的碳酸酯(在后文中,“芳香族碳酸酯”)实现;此种碳酸酯通常符合式hyd
1-o-c(=o)-o-hyd2,其中hyd1和hyd2彼此独立地表示c
1-c
18
烃基,其前提是hyd1和hyd2中的至少一个(可能两者)是芳香族基团;hyd1和hyd2可以值得注意地选自具有1至8个碳原子的烷基基团、苯基和被至少一个具有1至4个碳原子的烷基基团取代的苯基基团,其前提仍是hyd1和hyd2中的至少一个是任选地取代的苯基基团。特别感兴趣的符合式hyd
1-o-c(=o)-o-hyd2的碳酸酯是碳酸二苯酯。
[0057]
反应可以通过在催化剂存在下,在优选地50℃与250℃之间的温度下加热仲醇在碳酸二烷基酯或芳香族烃基中的混合物来进行。在反应期间作为副产物产生的脂肪族或芳香族醇可以在反应期间蒸馏出。
[0058]
在反应结束时,可以蒸发碳酸二烷基酯或碳酸芳香族二烃基酯,并且可以将残余物原样用于与二烷基氨基乙醇的第二反式碳酸化反应中。
[0059]
该反应步骤示出于以下的反应方案中:
[0060]
在示例性方法的下一步骤中,根据以下反应使如以上所描述的获得的仲醇衍生的碳酸酯与式ho-ch
2-ch
2-nr’r”的二烷基氨基乙醇(例如优选地二甲基氨基乙醇,dmae)反应:
[0061]
该第二反式碳酸化可以在合适的溶剂(例如甲苯)中使用例如naome作为催化剂(例如来自先前步骤)进行。通常将起始的不对称碳酸烷基酯或碳酸芳香族烃基仲烷基酯、二烷基氨基乙醇和催化剂在甲苯中的混合物加热至大约120℃。在反应期间,应去除形成的脂肪族或芳香族醇(例如通过蒸馏)。在反应结束时,通常用水洗涤有机相以去除催化剂和未反应的二烷基氨基乙醇并将溶剂蒸发。将残余物再溶解于合适的溶剂(例如乙醇)中以沉
淀出可能形成的脂肪碳酸二烷基酯。过滤之后,将溶剂蒸发之后获得产物。
[0062]
在最终步骤中,使以上所描述的步骤中获得的产物经受用例如通式r
”’‑
l”的烷基化剂的烷基化,其中l”是单价阴离子或阴离子基团(诸如例如甲基硫酸根)、优选地二烷基硫酸根、甚至更优选地二甲基硫酸根(dms),以获得根据本发明的所期望的季铵衍生物:
[0063]
在室温下在搅拌下以避免由于反应放热引起的显著温度升高的速率,向在合适的溶剂(例如甲醇)中的1当量的二烷基硫酸盐(例如dms)中逐渐添加碳酸酯-胺在相同溶剂中的浓溶液。添加结束之后,允许混合物在室温下搅拌(例如一小时)并在真空下去除挥发物(溶剂)以提供通常呈白色蜡的最终产物。
[0064]
技术人员将基于其专业知识并考虑所期望的最终产物来选择用于前文所描述的方法步骤的适当的反应条件和反应物,这样在此不需要给出细节。
[0065]
其中a是a-3或a-4的化合物的合成,其示例性地示出了式(v)或(vi)的化合物:
[0066]
在第一步骤中,在催化剂的存在下在有机溶剂中在范围从110℃至250℃、优选地从125℃至175℃、甚至更优选地约140℃的温度下,使内酮经受与丙二酸二烷基酯(例如丙二酸二甲酯)的缩合反应。用于此反应的合适且优选的溶剂是二甲苯,并且优选的催化剂是叔丁醇钾,其量通常在基于内酮的摩尔量从2至10mol%、优选地从3至8mol%的范围内。
[0067]
将内酮(例如如us 2018/093936中所描述的获得的)、丙二酸二烷基酯(例如丙二酸二甲酯)和催化剂溶解在溶剂(例如二甲苯)中并在升高的温度(例如大约140℃)下反应通常从1至72小时的时间段。作为副产物产生的水可以通过共沸蒸馏去除。在反应结束时,然后通常将反应介质冷却至室温并用水洗涤有机相以去除催化剂。
[0068]
然后将挥发物蒸馏出,并通过将所得油再溶解在合适的溶剂(例如乙醇)中纯化粗产物,允许更重的副产物诸如酮缩醛反应/丁烯醛化加合物以及剩余的起始酮沉淀。过滤之后,可以将滤液蒸发(去除溶剂)以提供所期望的加合物。
[0069]
该第一步骤的反应方案如下给出:其中alk3和alk4可以相同或不同,表示具有1至6个碳原子的烷基基团。
[0070]
然后可以使在第一步骤中获得的产物经受与二烷基氨基乙醇(例如二甲基氨基乙醇)的酯交换。用于该反应步骤的合适的催化剂是二丁基氧化锡(通常以相对于在第一步骤中获得的丙二酸酯加合物2至10、优选地3至8mol%的量),并且对于第一步骤,合适的溶剂是二甲苯。反应温度再次优选地在从110℃至170℃并且甚至更优选地大约140℃的范围内。
[0071]
使在第一步骤中获得的丙二酸酯加合物溶解在溶剂(例如二甲苯)中,将过量的二
烷基乙醇胺(基于化学计量从100%至500%过量)添加至溶液中,随后添加催化剂。然后允许混合物在优选地从110℃至170℃范围内、优选地大约140℃的温度下搅拌,并将形成的醇从反应介质蒸馏出。反应完成之后,用水洗涤有机相以便去除过量的二烷基氨基乙醇,并将二甲苯蒸馏出以提供粗酯胺。
[0072]
该第二步骤可以由以下反应方案表示:
[0073]
在第三步骤中,可以将在第二步骤中获得的酯胺用通式r
”’‑
l”的烷基化剂烷基化,其中l”是单价阴离子或阴离子基团(诸如例如甲基硫酸根)、优选地二烷基硫酸根、甚至更优选地二甲基硫酸根(dms),以获得本发明的目标季铵化合物。
[0074]
在搅拌下(通常在室温下)以避免由于反应放热引起的显著温度升高的速率,向在合适的溶剂中的合适量的烷基化剂中逐渐添加酯胺在相同溶剂中的浓溶液。
[0075]
添加结束之后,允许混合物在室温(典型地15℃-30℃)下搅拌,并在真空下去除挥发物(主要是溶剂和痕量的烷基化剂(例如dms))以提供呈白色蜡的最终产物。
[0076]
步骤3的反应方案可以描绘如下(用甲醇作为溶剂):
[0077]
右侧所示出的楔形键是反应产物是衍生自第一步骤的反应方案中的结构的三种异构体的混合物的事实的表现。
[0078]
技术人员将基于其专业知识适当地修改前述示例性方法以获得式(v)和(vi)的其他化合物。其将选择用于与内酮反应的合适的反应物,并且对于其他反应物/内酮组合根据需要改变反应条件。
[0079]
技术人员将基于其专业知识并考虑所期望的目标化合物来采用反应条件。在文献中已经描述了这样的反应步骤,这样在此不需要给出进一步的细节。
[0080]
其中a是如由式(vii)表示的a-1的化合物的合成
[0081]
在该示例性方法的第一步骤中,根据以下反应方案例如用氢气和氨使内酮经受还原胺化:
[0082]
还原胺化可以在高压釜中使用过量的氨进行。反应器装载有内酮、作为溶剂的乙醇(或另一合适的溶剂)和合适的催化剂(例如以相对于酮底物例如大约2wt%的浓度的pt/
c)。用高压氮气吹扫反应器气氛数次。然后将氨添加进反应器中并且然后添加氢气,并将温度升高至例如120℃,同时维持反应器中的高压(例如4mpa)。在这些条件下搅拌反应介质直至反应完成。
[0083]
随后,使由此获得的反应产物根据以下通用方案经受烷基化,对于作为烷基化剂的氯乙酸烷基酯如下所示:其中alk5是具有1至6个碳原子的烷基基团。
[0084]
反应可以优选地使用氯乙酸烷基酯(特别优选的氯乙酸甲酯)作为烷基化剂在合适的溶剂中进行,或者直接使用氯乙酸烷基酯作为溶剂(意指与仲烷基胺相比过量的反应物)进行。在反应期间应使用合适的碱(例如碳酸钠)以中和所形成的hcl,并且可以任选地采用催化剂(例如碘化钾,ki)以加速反应。然后允许混合物在范围从50℃至250℃的温度下搅拌直至反应完成。在反应结束时,将盐过滤出并且可以用水洗涤有机相。然后可以在真空下去除挥发物,并且然后将粗产物用于下一步骤。
[0085]
然后可以使由此获得的粗产物任选地在如前文所描述的适合的催化剂的存在下,根据以下反应方案经受与二烷基氨基乙醇(例如二甲基氨基乙醇(dmae))的酯交换反应:
[0086]
可以如前文在用于合成其中a是a-3或a-4的化合物的示例性方法中所描述的选择反应条件。
[0087]
在最终步骤中,将由此获得的胺化合物烷基化以获得根据本发明的所期望的化合物,如以下反应方案中对于烷基化剂r
”’‑
l”所示出的:
[0088]
可以采用与前文对于式(v)和(vi)的化合物的甲基化阶段所描述的相同的条件。
[0089]
其中a由如由式(ix)和(xi)所示例的a-5表示的化合物的合成
[0090]
相应的化合物可以优选地通过两种方法获得。第一种方法从皮里亚(piria)酮化
开始,随后氢化、脱水、环氧化(以获得环氧化物)、水合(以获得二醇)和酯化(以获得某种二酯)。这是皮里亚技术上的多步骤方法。其具有不含盐并且依赖于可以容易进行的化学转化的优点。
[0091]
作为反应的以上顺序的替代性方案,可能的是,通过直接将环氧化物转化成二酯来绕过水合步骤(即二醇的形成),前提是使用合适的酯化剂,如稍后将详述的。
[0092]
酯化步骤之后可以是胺缩合步骤(作为最终步骤)以将二酯转化成符合式(ix)或(xi)的化合物。
[0093]
最终,从二醇开始,还可能的是,在一个反应步骤中获得符合式(ix)或(xi)的化合物,即在一个步骤中实现所述酯化和胺缩合,前提是使用另一合适的酯化,如稍后将详述的。
[0094]
用于合成其中a由如由式(ix)和(xi)所示例的a-5表示的化合物的第一方法
[0095]
皮里亚酮化
[0096]
第一步骤中的基本反应是:
[0097]
该反应已经在美国专利10035746、wo 2018/087179和wo 2018/033607中充分描述,进一步的细节参见该专利。
[0098]
氢化
[0099]
然后使内酮经受氢化,其可以在技术人员已知的用于氢化反应的标准条件下进行:
[0100]
氢化反应通过使内酮与氢气在高压釜反应器中在范围从15℃至300℃的温度下和在范围从1巴至100巴的氢气压力下接触来进行。反应可以在任选的溶剂的存在下进行,但是此种溶剂的使用不是强制性的,并且反应也可以在没有任何添加的溶剂的情况下进行。作为合适溶剂的实例,可以提及:甲醇、乙醇、异丙醇、丁醇、thf、甲基-thf、烃、水或其混合物。应采用基于过渡金属的合适催化剂用于该反应。作为合适催化剂的实例,可以提及非均相过渡金属基催化剂,诸如例如负载型分散的过渡金属基催化剂或过渡金属的均相有机金属络合物。合适的过渡金属的实例是:ni、cu、co、fe、pd、rh、ru、pt、ir。作为合适催化剂的实例,可以提及pd/c、ru/c、pd/al2o3、pt/c、pt/al2o3、雷尼镍、雷尼钴等。在反应结束时,可以在适当的后处理之后回收所期望的醇。技术人员了解代表性技术,因此在此不需要给出进一步的细节。该方法步骤的细节可以例如在本文参考的美国专利10035746中找到。
[0101]
技术人员将基于其专业经验并考虑有待合成的具体目标化合物来选择合适的反应条件。因此,在此不需要给出进一步的细节。
[0102]
脱水
[0103]
在下一步骤中,使由此获得的醇经受脱水以获得内烯烃。该反应还可以在技术人
员已知的用于相应脱水反应的标准条件下进行(例如美国专利10035746,实例4),这样在此不需要给出进一步的细节:
[0104]
脱水反应通过在反应区域中在合适的催化剂的存在下在范围100℃与400℃之间的温度下加热仲醇来进行。反应可以在任选的溶剂的存在下进行,但是此种溶剂的使用不是强制性的,并且反应也可以在没有任何添加的溶剂的情况下进行。作为溶剂的实例,可以提及:烃、甲苯、二甲苯或它们的混合物。该反应必须采用催化剂。催化剂的合适实例是酸性(路易斯或布朗斯特(bronsted))催化剂非均相固体酸催化剂或均相催化剂。作为非均相催化剂的实例,可以提及氧化铝(al2o3)、二氧化硅(sio2)、铝硅酸盐(al2o
3-sio2)诸如沸石、负载在二氧化硅或氧化铝上的磷酸、酸性树脂诸如等。也可以采用均相催化剂并且可以提及以下合适的酸:h2so4、hcl、三氟甲磺酸、对甲苯磺酸、alcl3、fecl3等。反应期间产生的水可以在反应的过程中从反应介质中蒸馏出来。在反应结束时,可以在适当的后处理之后回收所期望的烯烃。技术人员了解代表性技术并且例如在美国专利10035746中描述了这些代表性技术这样在此不需要给出进一步的细节。
[0105]
环氧化
[0106]
该内烯烃其后可以根据以下方案被氧化成相应的环氧化物,其中双键被环氧基团取代(其中反应物仅是用于相应官能团的化合物的相应基团的示例):
[0107]
其中r**可以是氢或可以被杂原子或含杂原子的基团取代和/或间隔的烃基团,或者r**可以是通式r***-c(=o)-的酰基基团,其中r***可以具有与r**相同的含义。
[0108]
环氧化反应有利地通过使内烯烃与适当的氧化剂在反应区域中在通常范围从15℃至250℃的温度下接触来进行。
[0109]
作为合适的氧化剂,可以提及过氧化物化合物,诸如可以采用的呈水溶液的形式的过氧化氢(h2o2)、有机过氧化物诸如通式r****-co3h的过酸(例如间氯过氧苯甲酸、过乙酸等)、通式r****
’‑
o2h的烃基(例如烷基)氢过氧化物(例如环己基氢过氧化物、氢过氧化枯烯、叔丁基氢过氧化物),其中过酸中的r****或烃基(例如烷基)氢过氧化物中的r****’是可以被杂原子或含杂原子的基团取代和/或间隔的烃基团(例如烷基基团)。
[0110]
反应可以在任选的溶剂的存在下进行,但是此种溶剂的使用不是强制性的,并且反应也可以在没有任何添加的溶剂的情况下进行。作为合适溶剂的实例,可以提及:chcl3、ch2cl2、叔丁醇或它们的混合物。
[0111]
当h2o2用作氧化剂时,在反应期间有机羧酸的存在可以是有益的,因为它将通过与h2o2反应原位产生过酸化合物。作为合适的羧酸的实例,可以提及:甲酸、乙酸、丙酸、丁酸、苯甲酸等。
[0112]
催化剂也可以用于促进反应。合适的催化剂是路易斯酸或布朗斯特酸,并且可以
提及例如:高氯酸(hclo4),三氟甲磺酸,非均相钛硅沸石(tio
2-sio2),非均相酸性树脂诸如树脂,锰、钛、钒、铼、钨的均相有机金属络合物,多金属氧酸盐等。
[0113]
在反应结束时,可以在适当的后处理之后回收所期望的环氧化物,并且技术人员了解代表性技术,这样不需要在此给出进一步的细节。
[0114]
在式的环氧化物之中,已经发现其中在每次出现时可以相同或不同的r通常表示c
5-c
27
脂肪族基团,其中r具有至少10个碳原子的那些、尤其是其中r具有从10至20个碳原子的那些对于制备可用作表面活性剂的式(ix)和(xi)的化合物是特别有利的,显示出出色的特性平衡。然而,此类环氧化物,其可以由式(xii)表示
[0115][0116]
其中rf,在每次出现时可以相同或不同,表示c
10-c
27
脂肪族基团,在文献中很少披露,并且在本技术人了解到的范围内,这两种很少的披露内容与本发明的技术领域即表面活性剂的合成完全无关。
[0117]
在us 3,974,224(拜耳公司(bayer)的)中,教导了通过使以下通式的环氧乙烷化合物
[0118]
与过氧化氢在硼化合物的存在下反应可用于制备醛化合物。在以上式中,r1和r2彼此独立地(着重强调)在如第1栏l.52-61中所述的化学部分的广泛清单中选择;一些可能的部分是烷基部分,但在这种情况下,c
2-c6烷基优选于其他更高级烷基。在具体提出的环氧乙烷化合物的大量清单中,仅有3种环氧乙烷,即2,3-双十一烷基环氧乙烷、2,3-双十二烷基环氧乙烷和2-十六烷基-3-十八烷基环氧乙烷符合式(xii)。us’224完全没有提及如何合成任何所列的环氧乙烷,包括符合式(xii)的3种环氧乙烷。除了us’224中的以上3种环氧乙烷的披露内容与本发明无关并且看起来是偶然的事实之外,它正是不能实现的,因为us’223没有提供关于如何制造这些环氧乙烷的任何指示。
[0119]
mori和argade在european journal of organic chemistry[欧洲有机化学杂志],1994,第7卷,第695-700页中描述了通过使(2s,3r)-4-乙酰氧基-2,3-环氧-1-丁醇的碳链延伸合成(9z,25s,26r,43z)-25,26-环氧-9,43-五十一碳基二烯及其对映体,由蟑螂灰色蜚蠊(nauphoeta cinerea)的若虫产生的若虫识别信息素的组分。在该论文中,披露了符合通式(xii)的四个c
51
环氧化物;它们中的所有均有资格作为2-二十四碳烯基-3-二十五碳烯基环氧乙烷或25,26-环氧-五十一碳基二烯。符合式(xii)的环氧乙烷的该另一披露内容同样与本发明无关,并且看上去如此也是偶然的。
[0120]
因此,本发明的另一目的是提供可用于制造具有良好表面活性剂特性和良好生物降解性的季铵化合物的新的环氧化合物。
[0121]
该另一目的用后文在项目a.1下所描述的环氧化合物(“本发明a”)实现:
[0122]-项目a.1:一种式(xii)的环氧化合物
其中rf,在每次出现时可以相同或不同,表示c
10-c
27
脂肪族基团,其中2-二十四碳烯基-3-二十五碳烯基环氧乙烷除外。
[0123]
本发明a的优选的和/或具体的实施例在后文中设定:
[0124]-项目a.2:如项目a.1中所描述的环氧化合物,其中2,3-双十一烷基环氧乙烷、2,3-双十二烷基环氧乙烷和2-十六烷基-3-十八烷基环氧乙烷进一步除外;
[0125]-项目a.3:如项目a.1或a.2中所描述的环氧化合物,其中每个rf包含至少12个碳原子并且至少一个rf包含至少13个碳原子;
[0126]-项目a.4:如项目a.3中所描述的环氧化合物,其中rf(即每个rf)包含至少14个碳原子;
[0127]-项目a.5:如项目a.1、a.2、a.3或a.4中所描述的环氧化合物,其中rf(即每个rf)包含至多24个碳原子;
[0128]-项目a.6:如项目a.5中所描述的环氧化合物,其中rf包含至多20个碳原子;
[0129]-项目a.7:如项目a.6中所描述的环氧化合物,其中rf包含至多17个碳原子;
[0130]-项目a.8:如项目a.1或a.2中所描述的环氧化合物,其中rf包含从10至20个碳原子;
[0131]-项目a.9:如项目a.1或a.2中所描述的环氧化合物,其中rf包含从11至17个碳原子;
[0132]-项目a.10:如项目a.1至a.9中任一项目所描述的环氧化合物,其中两个rf基团的碳原子的总数目是至少30;
[0133]-项目a.11:如项目a.1至a.10中任一项目所描述的环氧化合物,其中rf(即每个rf)不含任何双键和任何三键;
[0134]-项目a.12:如项目a.1至a.10中任一项目所描述的环氧化合物,其中rf选自烷基和烯基基团;
[0135]-项目a.13:如项目a.12中所描述的环氧化合物,其中rf是烷基基团;
[0136]-项目a.14:如项目a.1至a.13中任一项目所描述的环氧化合物,其中rf是直链的;
[0137]-项目a.15:如项目a.1或a.2中所描述的环氧化合物,其中rf是具有从14至17个碳原子的直链烷基基团;
[0138]-项目a.16:如项目a.1至a.15中任一项目所描述的环氧化合物,其中一个且仅一个rf具有奇数个碳原子并且一个且仅一个rf具有偶数个碳原子;
[0139]
当两个rf均源自具有偶数个碳原子的羧酸时,这可能发生,并且从经济的观点来看这可能是有利的,因为天然来源的脂肪羧酸-其典型地具有此偶数个碳原子-是广泛可用的;
[0140]
当两个rf均源自具有奇数个碳原子的羧酸时,这也可能发生;
[0141]
另一方面,当一个且仅一个rf源自具有偶数个碳原子的羧酸并且一个且仅一个rf源自具有奇数个碳原子的羧酸时,获得如项目a.1至a.15中任一项目所描述的环氧化合物,其中或者两个rf均具有偶数个碳原子或者两个rf均具有奇数个碳原子;实际上,由于尽管不同链长的羧酸通常具有相近的反应性,但通常获得其中两个rf均具有偶数个碳原子的第一
环氧化物和其中两个rf均具有奇数个碳原子的第二环氧化物的混合物;
[0142]-项目a.17:如项目a.1至a.15中任一项目所描述的环氧化合物,其中一个且仅一个rf具有奇数个碳原子no同时另一个rf具有偶数个碳原子ne,其中ne等于n
o-1;当环氧化物由一个且仅一个具有偶数个碳原子的羧酸获得时,这可能发生,并且出于与上述相同的原因,从经济的观点来看,这也可能是有利的;
[0143]-项目a.18:如项目a.1至a.15中任一项目所描述的环氧化合物,其中两个rf基团的碳原子的数目由对(n1,n2)表示,n1是第一rf基团的碳原子的数目并且n2是第二rf基团的碳原子的数目,所述对(n1,n2)选自以下对:(10,11)、(12,13)、(14,15)、(16,17)、(10,13)、(10,15)、(10,17)、(11,12)、(11,14)、(11,16)、(12,15)、(12,17)、(13,14)、(13,16)、(14,17)和(15,16)。
[0144]-项目a.19:如项目a.18中所描述的环氧化合物,其中表示两个rf基团的碳原子的数目的对(n1,n2)选自以下对:(14,15)、(16,17)、(14,17)和(15,16);
[0145]
为了获得根据项目a.19的环氧化物,它可以值得注意地从以下羧酸或羧酸的混合物开始:单独的棕榈酸、单独的硬脂酸、单独的油酸、呈与硬脂酸或与油酸或与硬脂酸和油酸的掺合物的棕榈酸、以及呈与油酸的掺合物的硬脂酸;
[0146]-项目a.20:如项目a.1至a.19中任一项目所描述的环氧化物,其是式(xiia)的顺式-环氧化物
[0147]
与式(xiib)的反式-环氧化物的混合物
[0148]
此种混合物可以值得注意地由顺式-烯烃和反式-烯烃的混合物的环氧化产生;
[0149]-项目a.21:如项目a.1至a.19中任一项目所描述的环氧化物,其是式(xiia)的顺式-环氧化物
[0150]-项目a.22:如项目a.1至a.19中任一项目所描述的环氧化物,其是式(xiib)的反式-环氧化物
[0151]
项目a.21的顺式-环氧化物和项目a.22的反式-环氧化物可以值得注意地通过经由任何常规分离手段将它们从项目a.20的顺式-环氧化物和反式-环氧化物的混合物中分离而获得;
[0152]-项目a.23:一种用于获得如项目a.1至a.22中任一项目所描述的环氧化物的方法,其包括使以下式的烯烃
其中rf,在每次出现时可以相同或不同,如本文之前所描述,与式r**ooh的氧化剂反应,其中r**是氢或可以被杂原子或含杂原子的基团取代和/或间隔的烃基团,或者r**是通式r***-c(=o)-的酰基基团,其中r***具有与r**相同的含义,以便形成环氧化物和式r**oh的化合物;
[0153]-项目a.24:如项目a.23中所描述的方法,其中氧化剂是通式r****-co3h的过酸,其中r****是可以被杂原子或含杂原子的基团取代和/或间隔的烃基团,诸如过乙酸;
[0154]-项目a.25:如项目a.23中所描述的方法,其中氧化剂是过氧化氢;
[0155]-项目a.26:如项目a.25中所描述的方法,其中使烯烃与过氧化氢在有机羧酸诸如乙酸的存在下反应;
[0156]-项目a.27:如项目a.23至a.26中任一项目所描述的方法,其包括:-使以下式的第一羧酸经受与以下式的另一羧酸的皮里亚酮化反应其中rf,在每种羧酸中可以相同或不同,如本文之前所描述,其中第一羧酸和另一羧酸因此可以彼此相同或不同(当第一羧酸的式中的rf与另一羧酸的式中的r
f-ch
2-相同时,它们彼此相同),以便获得以下式的内酮其中rf,在每次出现时可以相同或不同,如本文之前所描述;-用氢气使内酮氢化,以便获得以下式的甲醇和-使甲醇脱水,以便获得以下式的烯烃
[0157]-项目a.28:如项目a.1至a.22中任一项目所描述的环氧化物用于制造表面活性剂的用途;
[0158]-项目a.29:如项目a.1至a.22中任一项目所描述的环氧化物的用途或如项目a.28
中所描述的用途,其用于制造式(xi)的化合物
[0159]
其中,在式(xi)中,在每次出现时可以相同或不同的r等于rf,rf具有如前文所描述的含义,并且r’、r”、r
”’
和y具有如前文对于式(i)所描述的含义;
[0160]-项目a.30:如项目a.1至a.22中任一项目所描述的环氧化物用于制造不同于前文所描述的式(xi)的化合物的化合物的用途,例如用于制造聚合物(可能是低聚物)诸如聚醚、或者用于制造环状碳酸酯。
[0161]
环氧化物可以直接用于下一步骤而无需进一步纯化。该下一步骤可以是水合步骤(以便形成二醇,随后是酯化步骤)或直接酯化步骤。
[0162]
环氧化物水合(二醇形成)
[0163]
其后可以根据以下方案使环氧化物水合成相应的二醇:
[0164]
开环反应可以通过使环氧化物与水接触来进行,通常在合适的催化剂的存在下并且通常在范围从15℃至150℃的温度下。作为催化剂的实例,可以提及布朗斯特酸或路易斯酸催化剂,诸如:h2so4、hcl、高氯酸(hclo4)、三氟甲磺酸、对甲苯磺酸、非均相酸性树脂诸如树脂等。
[0165]
反应可以在任选的溶剂的存在下进行以促进试剂接触,并且可以提及:me-thf、thf、dmso、叔丁醇、甲醇、乙醇、异丙醇、乙腈、或它们的混合物。反应也可以在无任何添加的溶剂的情况下进行。
[0166]
在反应结束时,可以在适当的后处理之后回收所期望的二醇,并且技术人员了解代表性技术,这样不需要在此给出进一步的细节。
[0167]
在式的二醇之中,同样地已经发现其中在每次出现时可以相同或不同的r通常表示c
5-c
27
脂肪族基团,其中r具有至少10个碳原子的那些、尤其是其中r具有从10至20个碳原子的那些对于制备可用作表面活性剂的式(ix)和(xi)的化合物是特别有利的,显示出出色的特性平衡。然而,此类二醇,其可以由式(xiii)表示
[0168][0169]
其中rf,在每次出现时可以相同或不同,表示c
10-c
27
脂肪族基团,在文献中很少披露,并且此很少的披露内容与本发明的技术领域即表面活性剂的合成完全无关。
[0170]
pubchem的网站披露了几种符合式(xiii)的链烷二醇。除了一些其后将被引用和评论的链烷二醇,pubchem的链烷二醇看起来是纯的理论结构,它们的特性通过预测模型来估计。作为此类链烷二醇,可以列举以下链烷二醇:二十二烷-11,12-二醇、二十三烷-11,12-二醇、二十四烷-12,13-二醇、二十五烷-12,13-二醇、二十六烷-12,13-二醇、二十七烷-11,12-二醇、二十八烷-12,13-二醇、二十八烷-14,15-二醇、二十九烷-14,15-二醇、三十烷-15,16-二醇、三十一烷-15,16-二醇、三十二烷-14,15-二醇、三十二烷-15,16-二醇、三十二烷-16,17-二醇、三十四烷-16,17-二醇、三十四烷-17,18-二醇、三十五烷-17,18-二醇、三十六烷-15,16-二醇、三十七烷-12,13-二醇、三十八烷-18,19-二醇、三十八烷-19,20-二醇、三十九烷-19,20-二醇、四十烷-18,19-二醇、四十烷-19,20-二醇、四十二烷-20,21-二醇和四十四烷-22,23-二醇(“pubchem”清单)。除了形成“pubchem”清单的一部分的二醇的披露内容显然与本发明无关并且看起来是偶然的事实之外,它正是不能实现的,因为pubchem没有提供关于如何制造这些二醇的任何指示。
[0171]
tornabene等人在lipids[脂质],第6卷,第3期,第190-195页(1971)中进行了藤黄八叠球菌(sarcina lutea)和黄色八叠球菌(sarcina flava)的支链单不饱和烃的表征。在该表征的框架内,将烯烃转化成三甲基甲硅烷基醚(tmse)衍生物;通过用四氧化锇使烯烃氧化形成二醇中间体获得此类tmse衍生物。这些表征努力导致一些c
23-c
30
支链烯烃的识别:支链11-二十三碳烯、支链11-二十四碳烯、支链12-二十四碳烯、支链12-二十五碳烯、支链12-二十六碳烯、支链13-二十六碳烯、支链12-二十七碳烯、支链13-二十七碳烯、支链13-二十八碳烯、支链14-二十八碳烯、支链14-二十九碳烯和支链15-三十碳烯。虽然这不应解释为来自申请人的承认,但可能可以推测,当形成可用于表征的tmse衍生物时,获得了对应于先前所引用的烯烃的二醇中间体。此外,两个gc峰(在表1中命名为峰“a”和“b”)暂时(着重强调)归因于直链13-二十七碳烯和直链14-二十九碳烯。tornabene的披露内容与本发明无关,并且如果认为其与本发明的新颖性的评估有关,则将是偶然的。
[0172]
subramanian等人在tetrahedron[四面体],第42卷,第14期,第3967-3972页(1986)中描述了用于合成13-二十七碳烯的多步骤方法。用作该合成的中间体的二十七烷-13,14-二醇通过以下获得:首先用氢化铝锂使二甲基-13,14-二羟基二十七烷-1,27-二酸酯的异亚丙基的衍生物还原以得到1,13,14,27-四羟基二十七烷,然后使以上四醇的丙酮化合物甲苯磺酰化,用zn-nai还原并用酸水解。符合式(xiii)的二醇的该披露内容与本发明无关,并且看上去如此是偶然的。
[0173]
kr20060060776(eung ju oh的)描述了可用于有机电子应用的聚[3,4-烷氧基噻吩]和聚[3,4-亚乙二氧基噻吩]的合成。二十二烷-11,12-二醇参与此类聚合物的合成。符合式(xiii)的二醇的该另一披露内容显然与本发明无关,并且看上去如此也是偶然的。
[0174]
因此,本发明的另一目的是提供可用于制造具有良好表面活性剂特性和良好生物降解性的季铵化合物的新的二醇。
[0175]
该另一目的用后文在项目b.1下所描述的二醇(“本发明b”)实现:
[0176]-项目b.1:式(xiii)的二醇其中rf,在每次出现时可以相同或不同,表示c
10-c
27
脂肪族基团,其中二十二烷-11,12-二醇和二十七烷-13,14-二醇除外。
[0177]
本发明b的优选的和/或具体的实施例在后文中设定:
[0178]-项目b.2:如项目b.1中所描述的二醇,其中支链二十三烷-11,12-二醇、支链二十四烷-11,12-二醇、支链二十四烷-12,13-二醇、支链二十五烷-12,13-二醇、支链二十六烷-12,13-二醇、支链二十六烷-13,14-二醇、支链二十七烷-12,13-二醇、支链二十七烷-13,14-二醇、支链二十八烷-13,14-二醇、支链二十八烷-14,15-二醇、支链二十九烷-14,15-二醇和支链三十烷-15,16-二醇进一步除外。
[0179]-项目b.3:如项目b.2中所描述的二醇,其中直链二十七烷-13,14-二醇和直链二十九烷-14,15-二醇进一步除外。
[0180]-项目b.4:如项目b.1或b.2或b.3中所描述的二醇,其中如以上详述的“pubchem”清单的链烷二醇进一步除外;
[0181]-项目b.5:如项目b.1至b.4中任一项目所描述的二醇,其中rf(即每个rf)不含任何双键和任何三键;
[0182]-项目b.6:如项目b.1至b.4中任一项目所描述的二醇,其中rf是烷基基团;
[0183]-项目b.7:如项目b.1至b.6中任一项目所描述的二醇,其中rf是直链的;
[0184]-项目b.8:如项目b.1至b.7中任一项目所描述的二醇,其中每个rf包含至少12个碳原子并且至少一个rf包含至少13个碳原子;
[0185]-项目b.9:如项目b.8中所描述的二醇,其中rf(即每个rf)包含至少14个碳原子;
[0186]-项目b.10:如项目b.1至b.9中任一项目所描述的二醇,其中rf包含至多24个碳原子;
[0187]-项目b.11:如项目b.10中所描述的二醇,其中rf包含至多20个碳原子;
[0188]-项目b.12:如项目b.11中所描述的二醇,其中rf包含至多17个碳原子;
[0189]-项目b.13:如项目b.1至b.7中任一项目所描述的二醇,其中rf包含从10至20个碳原子;
[0190]-项目b.14:如项目b.13中所描述的二醇,其中rf包含从11至17个碳原子;
[0191]-项目b.15:如项目b.1至b.14中任一项目所描述的二醇,其中两个rf基团的碳原子的总数目是至少30;
[0192]-项目b.16:如项目b.1至b.7中任一项目所描述的二醇,其中rf是具有从14至17个碳原子的直链烷基基团;
[0193]-项目b.17:如项目b.1至b.16中任一项目所描述的二醇,其中一个且仅一个rf具有奇数个碳原子并且一个且仅一个rf具有偶数个碳原子,可能是c
33
二醇、c
41
二醇、c
45
二醇、c
47
二醇、c
49
二醇、c
51
二醇、c
53
二醇或c
55
二醇;
[0194]-项目b.18:如项目b.1至b.16中任一项目所描述的二醇,两个rf均具有奇数个碳
原子或两个rf均具有偶数个碳原子,可能是c
44
二醇、c
46
二醇、c
48
二醇、c
50
二醇、c
52
二醇、c
54
二醇或c
56
二醇;
[0195]-项目b.19:如项目b.1至b.16中任一项目所描述的二醇,其中一个且仅一个rf具有奇数个碳原子no同时另一个rf具有偶数个碳原子ne,其中ne等于n
o-1;
[0196]-项目b.20:如项目b.1至b.19中除b.18的任一项目所描述的二醇,其中两个基团rf的碳原子的数目由对(n1,n2)表示,n1是第一rf基团的碳原子的数目并且n2是第二rf基团的碳原子的数目,所述对(n1,n2)选自以下对:(10,11)、(12,13)、(14,15)、(16,17)、(10,13)、(10,15)、(10,17)、(11,12)、(11,14)、(11,16)、(12,15)、(12,17)、(13,14)、(13,16)、(14,17)和(15,16)。
[0197]-项目b.21:如项目b.20中所描述的二醇,其中表示两个基团rf的碳原子的数目的对(n1,n2)选自以下对:(14,15)、(16,17)、(14,17)和(15,16);
[0198]-项目b.22:至少一千克的包含如项目b.1至b.21中任一项目所描述的二醇的包;
[0199]-项目b.23:一种二醇混合物,其包含以分别具有n3和(n
3-1)个碳原子的rf基团为特征的第一二醇、以分别具有n4和(n
4-1)个碳原子的rf基团为特征的第二二醇、以分别具有n3和(n
4-1)个碳原子的rf基团为特征的第三二醇和以分别具有n4和(n
3-1)个碳原子的rf基团为特征的第四二醇,其中n3≤n4+2,并且其中第一二醇、第二二醇、第三二醇和第四二醇如项目b.1至b.17中任一项目或项目b.21中所描述;
[0200]-项目b.24:一种用于获得如项目b.1至b.21中任一项目所描述的二醇的方法,其包括使以下式的环氧化合物
[0201]
其中rf,在每次出现时可以相同或不同,如本文之前在本发明b的框架内所描述的,与水反应;
[0202]-项目b.25:如项目b.24中所描述的方法,其中反应在布朗斯特或路易斯催化剂的存在下进行;
[0203]-项目b.26:项目b.24或b.25中所描述的方法,其包括使以下式的烯烃其中rf,在每次出现时可以相同或不同,如本文之前在本发明b的框架内所描述的;与式r**ooh的氧化剂反应,其中r**是氢或可以被杂原子或含杂原子的基团取代和/或间隔的烃基团,或者r**是通式r***-c(=o)-的酰基基团,其中r***具有与r**相同的含义,以便形成式r**oh的化合物和有待与水反应的式(xii)的环氧化合物;
[0204]-项目b.27:如项目b.26中所描述的方法,其中氧化剂是通式r****-co3h的过酸,其中r****是可以被杂原子或含杂原子的基团取代和/或间隔的烃基团,诸如过乙酸;
[0205]-项目b.28:如项目b.26中所描述的方法,其中氧化剂是过氧化氢;
[0206]-项目b.29:如项目b.28中所描述的方法,其中使烯烃与过氧化氢在有机羧酸诸如乙酸的存在下反应
[0207]-项目b.30:如项目b.26至b.29中任一项目所描述的方法,其包括:-使以下式的第一羧酸经受与以下式的另一羧酸的皮里亚酮化反应其中rf,在每种羧酸中可以相同或不同,如本文之前所描述,其中第一羧酸和另一羧酸因此可以彼此相同或不同(当第一羧酸的式中的rf与另一羧酸的式中的r
f-ch
2-相同时,它们彼此相同),以便获得以下式的内酮其中rf,在每次出现时可以相同或不同,如本文之前所描述;-用氢气使内酮氢化,以便获得以下式的甲醇和-使甲醇脱水,以便获得以下式的烯烃
[0208]-项目b.31:如项目b.1至b.21中任一项目所描述的二醇或如项目b.23中所描述的二醇混合物用于制造表面活性剂的用途;
[0209]-项目b.32:如项目b.1至b.21中任一项目所描述的二醇用于制造式(xi)的化合物的用途
其中,在式(xi)中,在每次出现时可以相同或不同的r等于rf,rf具有如前文所描述的含义,并且r’、r”、r
”’
和y具有如前文对于式(i)所描述的含义;
[0210]-项目b.33:如项目b.1至b.21中任一项目所描述的二醇用于制造不同于前文所描述的式(xi)的化合物的化合物的用途,例如用于制造聚合物(可能是低聚物)诸如聚醚或聚酯。
[0211]
酯化(由二醇开始)
[0212]
二醇可以根据以下反应方案酯化:其中其中r,在每次出现时可以相同或不同,是c
5-c
27
脂肪族基团、优选地c6至c
24
脂肪族基团,l是离去基团,y是二价的c
1-c6脂肪族基团,r*****是氢或c
1-c6烷基基团,t是等于1或者等于或大于2的整数,u
u+
是阳离子,和u是确定阳离子的正电荷的整数。
[0213]
首先通过使二醇与酯化剂接触进行酯化,酯化剂是以下通式的羧酸或羧酸的酯:[l-y-co2r*****]
(t-1)-[u
u+
]
(t-1)/u
[0214]
其中y是含有1个与6个之间碳原子的二价烃基、更精确地二价c
1-c6脂肪族基团,并且其中l是离去基团。
[0215]
y优选地是非环二价脂肪族基团、更优选地直链二价脂肪族基团、仍更优选地直链烷二基(亚烷基)基团。y优选地具有从1至6个、更优选地从1至4个碳原子、仍更优选地1或2个碳原子。最优选的y是-ch
2-。
[0216]
当t等于1时,不存在阳离子。换句话说,酯化通过使二醇与以下式的羧酸或羧酸的酯接触进行:l-y-co2r*****。
[0217]
在离去基团l已经在羧酸或酯反应物中携带负电荷的情况下(这是当(t-1)等于或大于1或者当t等于或大于2时的情况),标记为u
u+
(其中u优选地是1、2或3,甚至更优选地1)的阳离子必须存在于反应物中以确保电中性(在这种情况下,阳离子具有u
+
电荷)。该阳离子可以例如选自h
+
、碱金属阳离子、碱土金属阳离子(例如na
+
、k
+
、ca
2+
)、al
3+
和铵,仅提及几个实例。
[0218]
离去基团l的性质没有特别限制,条件是下一反应步骤(即胺缩合,如稍后将详述的)可以发生。离去基团l有利地是亲核基团。它可以值得注意地选自-卤素,-式r
a-o-so
2-o-的(烃基氧基磺酰基)氧基基团,其中ra表示可以任选卤代的c
1-c
20
烃基基团,-式r
a-so
2-o-的(烃基磺酰基)氧基基团,其中ra表示可以任选卤代的c
1-c
20
烃基基团(诸如在cf
3-so
2-o-中),和-式-o-so
2-o-的氧基磺酰基氧基基团(其是已经在末端氧原子上携带一个负电荷的离去基团l)。
[0219]
烃基基团ra,无论存在于本文之前式中何处,可以值得注意地是脂肪族基团或芳香族基团诸如苯基或对甲苯基。脂肪族基团ra通常是c
1-c6烷基基团,其可以是直链或支化的;它通常是直链c
1-c4烷基,诸如甲基、乙基或正丙基。
[0220]
离去基团l优选地选自:-卤素,诸如氟、氯、溴或碘,-式r
a-o-so
2-o-的(烃基氧基磺酰基)氧基基团,其中ra表示c
1-c
20
烃基基团,诸如ch
3-o-so
2-o-,和-式-o-so
2-o-的氧基磺酰基氧基基团。
[0221]
其中t等于1的化合物的实例是化合物ch
3-o-so
3-ch
2-coor*****,在r*****是h时,得到化合物ch
3-o-so
3-ch
2-cooh,其可以定名为2-((甲氧基磺酰基)氧基)乙酸。
[0222]
作为其中t等于1并且因此不存在阳离子的化合物的另外的实例,可以提及:氯乙酸、溴乙酸和2-氯丙酸。
[0223]
t等于2的实例是羧甲基硫酸钠,其中[l-y-coor*****]
(t-1)-[u
u+
]
(t-1)/u
是[na
+
][o-so
2-o-ch
2-coor*****]-其中r*****是h,u是na,并且因此[u
u+
]
t/u
[l
t-]是na2so4。酯化可以优选地在范围从50℃至250℃的温度下在任选的溶剂的存在下进行。然而,此种溶剂的存在不是强制性的,并且反应也可以在无任何添加的溶剂的情况下进行。作为合适溶剂的实例,可以提及:甲苯、二甲苯、烃、dmso、me-thf、thf或其混合物。
[0224]
在反应期间作为副产物形成的水可以在反应的过程中通过蒸馏从反应介质中去除。
[0225]
在反应期间也可以采用催化剂,并且合适的催化剂是布朗斯特酸或路易斯酸催化剂。作为催化剂的优选实例,可以提及:h2so4、对甲苯磺酸、三氟甲烷磺酸、hcl、或非均相酸性树脂诸如树脂、alcl3等。在反应结束时,可以在适当的后处理之后回收所期望的二酯,并且技术人员了解代表性的技术,这样不需要在此给出进一步的细节。
[0226]
如稍后将看到的,式(xiv)的二酯
可以容易地转化成如先前所表示的式(xi)的化合物,其展现出出色的表面活性剂特性。
[0227]
据申请人所知,式(xiv)的二酯是新的。关于mol-instincts的网络发布(https://www.molinstincts.com/structure/coixenolide-cstr-ct1013031379.html)提出了薏苡仁酯(coixenolide)的结构式,其是可从薏苡(job’s tears)中提取的生物碱药物组分,其值得注意地能够抑制癌细胞生长。从纯粹的结构观点来看,关于式(xiv)的二酯,所提出的薏苡仁酯的式可能是最接近的技术。然而,薏苡仁酯不含有任何离去基团,使得将其转化成将展现出出色的表面活性剂特性的化合物相当困难或甚至不可能,类似于式(xi)的化合物的那些。此外,薏苡仁酯难以获得且成本高,这将使得从工业和经济的观点来看对其改性或甚至尝试对其改性以获得可能与式(xi)的化合物的那些类似的表面活性剂特性是无意义的。
[0228]
因此,本发明的另一目的是提供可用于制造具有良好表面活性剂特性和良好生物降解性的季铵化合物的新的二酯化合物。
[0229]
该另一目的用后文在项目c.1下所描述的二酯化合物(“本发明c”)实现:
[0230]-项目c.1:一种式(xiv)的二酯化合物其中-r,在每次出现时可以相同或不同,表示c
5-c
27
脂肪族基团;-y是二价的c
1-c6脂肪族基团;-l是离去基团;和-t是等于1或者等于或大于2的整数。应理解,在式(xiv)中,y和l
(t-1)-在每次出现时可以相同或不同,如对于r的情况。
[0231]
本发明c的优选的和/或具体的实施例在后文中设定:
[0232]-项目c.2:如项目c.1中所描述的二酯化合物,其中y(即每个y)是非环二价脂肪族
基团;
[0233]-项目c.3:如项目c.2中所描述的二酯化合物,其中y是直链二价脂肪族基团;
[0234]-项目c.4:如项目c.3中所描述的二酯化合物,其中y是直链烷二基基团;
[0235]-项目c.5:如项目c.1至c.4中任一项目所描述的二酯化合物,其中y具有从1至6个碳原子;
[0236]-项目c.6:如项目c.5中所描述的二酯化合物,其中y具有从1至4个碳原子;
[0237]-项目c.7:如项目c.6中所描述的二酯化合物,其中y具有1或2个碳原子;
[0238]-项目c.8:如项目c.7中所描述的二酯化合物,其中y是ch2;
[0239]-项目c.9:如项目c.1至c.8中任一项目所描述的二酯化合物,其中离去基团l是亲核基团;
[0240]-项目c.10:如项目c.1至c.9中任一项目所描述的二酯化合物,其中离去基团l选自卤素、式r
a-o-so
2-o-的(烃基氧基磺酰基)氧基团、式r
a-so
2-o-的(烃基磺酰基)氧基团和式-o-so
2-o-的氧基磺酰基氧基团,其中ra,无论存在于本文之前式中何处,表示可以任选地卤代的c
1-c
20
烃基基团;
[0241]-项目c.11:如项目c.10中所描述的二酯化合物,其中离去基团l选自卤素和式r
a-o-so
2-o-的(烃基氧基磺酰基)氧基团,其中ra表示c
1-c
20
烃基基团;
[0242]-项目c.12:如项目c.11中所描述的二酯化合物,其中离去基团l是选自氟、氯、溴和碘的卤素;
[0243]-项目c.13:如项目c.12中所描述的二酯化合物,其中离去基团l是氯;
[0244]-项目c.14:如项目c.10或c.11中所描述的二酯化合物,其中烃基基团ra是脂肪族基团;
[0245]-项目c.15:如项目c.14所描述的二酯化合物,其中烃基基团ra是c
1-c6烷基基团,其可以是直链的或支化的;
[0246]-项目c.16:如项目c.15中所描述的二酯化合物,其中烃基基团ra是直链c
1-c4烷基基团、优选地甲基;
[0247]-项目c.17:如项目c.1至c.16中任一项目所描述的二酯化合物,其中r(即每个r)是c6至c
24
脂肪族基团;
[0248]-项目c.18:如项目c.17中所描述的二酯化合物,其中r包含从10至20个碳原子;
[0249]-项目c.19:如项目c.18中所描述的二酯化合物,其中r包含从11至17个碳原子;
[0250]-项目c.20:如项目c.1至c.19中任一项目所描述的二酯化合物,其中两个r基团的碳原子的总数目是至少30;
[0251]-项目c.21:如项目c.1至c.20中任一项目所描述的二酯化合物,其中r不含任何双键和任何三键;
[0252]-项目c.22:如项目c.21中所描述的二酯化合物,其中r是烷基基团;
[0253]-项目c.23:如项目c.1至c.22中任一项目所描述的二酯化合物,其中r是直链的;
[0254]-项目c.24:如项目c.1至c.16中任一项目所描述的二酯化合物,其中r是具有从14至17个碳原子的直链烷基基团;
[0255]-项目c.25:如项目c.1至c.24中任一项目所描述的二酯化合物,其中一个且仅一个r具有奇数个碳原子并且一个且仅一个r具有偶数个碳原子;
[0256]-项目c.26:如项目c.1至c.24中任一项目所描述的二酯化合物,其中两个r均具有偶数个碳原子或两个r均具有奇数个碳原子;
[0257]-项目c.27:如项目c.1至c.24中任一项目所描述的二酯化合物,其中一个且仅一个r具有奇数个碳原子no同时另一个r具有偶数个碳原子ne,其中ne等于n
o-1;
[0258]-项目c.28:如项目c.1至c.27中任一项目所描述的二酯化合物,其中两个r基团的碳原子的数目由对(n1,n2)表示,n1是第一r基团的碳原子的数目并且n2是第二r基团的碳原子的数目,所述对(n1,n2)选自以下对:(10,11)、(12,13)、(14,15)、(16,17)、(10,13)、(10,15)、(10,17)、(11,12)、(11,14)、(11,16)、(12,15)、(12,17)、(13,14)、(13,16)、(14,17)和(15,16)。
[0259]-项目c.29:一种用于获得如项目c.1至c.28中任一项目所描述的二酯化合物的方法,其包括使以下式的二醇与以下通式的羧酸或羧酸的酯接触:[l-y-co2r*****]
(t-1)-[u
u+
]
(t-1)/u
其中-r、y、l和t如本文之前在本发明c的框架内所描述;-r*****是氢或c
1-c6烷基基团,-u
u+
是阳离子,和-u是确定阳离子的正电荷的整数(例如对于h
+
、nh
4+
或碱金属阳离子是1或者对于碱土金属阳离子是2);
[0260]-项目c.30:如项目c.29中所描述的用于合成二酯的方法,其包括使以下式的环氧化合物其中r如本文之前所描述,与水反应,以便获得以下式的二醇
[0261]-项目c.31:项目c.30中所描述的方法,其包括使以下式的烯烃其中r如本文之前所描述,与式r**ooh的氧化剂反应,其中r**是氢或可以被杂原子或含杂原子的基团取代和/或间隔的烃基团,或者r**是通式r***-c(=o)-的酰基基团,其中r***具有与r**相同的含义,以便形成式r**oh的化合物和有待与水反应的式的环氧化合物;
[0262]-项目c.32:如项目c.31中所描述的方法,其包括:-使以下式的第一羧酸经受与以下式的另一羧酸的皮里亚酮化反应其中r,在每种羧酸中可以相同或不同,如本文之前所描述,其中第一羧酸和另一羧酸因此可以彼此相同或不同,以便获得以下式的内酮其中r,在每次出现时可以相同或不同,如本文之前所描述;-用氢气使内酮氢化,以便获得以下式的甲醇和-使甲醇脱水,以便获得有待与氧化剂反应的以下式的烯烃
[0263]-项目c.33:如项目c.1至c.28中任一项目所描述的二酯化合物用于制造表面活性剂的用途;
[0264]-项目c.34:如项目c.1至c.28中任一项目所描述的二酯化合物的用途或如项目c.33中所描述的用途,其用于制造式(xi)的化合物其中r和y如前文在本发明c的框架内所描述,并且r’、r”和r
”’
具有如前文对于式
(i)所描述的含义;
[0265]-项目c.35:如项目c.1至c.28中任一项目所描述的二酯化合物用于制造不同于如前文所描述的式(xi)的化合物的化合物的用途,例如用于制造不同于如项目c.34中所描述的式(xi)的化合物(其中两个-n
+
r’r”r
”’
均被-so
3-基团替代)的化合物;这可以通过使二酯与亚硫酸盐或亚硫酸氢盐诸如亚硫酸钠或亚硫酸氢钠反应来实现。
[0266]
直接酯化(从环氧化物开始,包括环氧化物开环)
[0267]
申请人出人意料地发现,当且仅当羧酸用作酯化剂[l-y-co2r*****]
(t-1)-[u
u+
]
(t-1)/u
时,换言之当酯化剂[l-y-co2r*****]
(t-1)-[u
u+
]
(t-1)/u
具有式[l-y-co2h]
(t-1)-[u
u+
]
(t-1)/u
时,其中l、y、t、u
u+
和u如本文之前结合二醇的酯化所描述,环氧化物可以直接酯化成二酯。
[0268]
然后根据以下反应方案进行环氧化物开环和酯化:其中r,在每次出现时可以相同或不同,是c
5-c
27
脂肪族基团、优选地c6至c
24
脂肪族基团,l是离去基团,y是二价的c
1-c6脂肪族基团,t是等于1或者等于或大于2的整数,u
u+
是阳离子,和u是确定阳离子的正电荷的整数。
[0269]
环氧化物开环和酯化通过使环氧化物与以下通式的羧酸反应进行:[l-y-co2h]
(t-1)-[u
u+
]
(t-1)/u
其中l是离去基团,y是二价c
1-c6脂肪族基团,t是等于1或者等于或大于2的整数,u
u+
是阳离子,并且u是确定阳离子的正电荷的整数。
[0270]
在本文之前提供的关于l、y、t、u
u+
和u与二醇的酯化有关的所有细节也是有效的,并且可以在本文与环氧化物的直接酯化有关地应用,使得此类细节不需要重复。
[0271]
特别地,当t等于1时,不存在阳离子。换句话说,酯化通过使环氧化物与以下式的羧酸接触进行:l-y-co2h。
[0272]
据申请人所知,带有2个长脂肪族链的环氧化物诸如式的环氧化物的直接酯化是新的,其中每个r,在每次出现时可以相同或不同,是c
5-c
27
脂肪族基团。
[0273]
在ber.bunsenges.phys.chem.,100,1335-1340(1996),第8期中,可以找到溴甲基环氧乙烷与二氯乙酸的反应的热动力学研究。“对应于”以上式的r的溴甲基环氧乙烷的部分分别是h和ch2br,并且“对应于”酯化剂的式中的y的二氯乙酸的部分是-chcl-。此类“r-等效物”和“y-等效物”部分都不是脂肪族基团。
[0274]
garcia等人在journal of industrial microbiology[工业微生物学杂志],28,173-179(2002),173-179中实现了在来自米黑毛霉(mucor miehei)的固定化脂肪酶的存在下用2-氯丁酸使1,2-环氧-5-己烯酶酯化以获得2-氯酯。“对应于”以上式的r的1,2-环氧-5-己烯的部分是h和-(ch2)
2-ch=ch2。garcia没有考虑环氧化物的酶酯化,其“r-等效物”部分将均是脂肪族的。更不必说,garcia没有考虑环氧化物的直接环氧化,其“r-等效物”部分在没有酶作为催化剂的情况下均是脂肪族的。
[0275]
更一般地,所有涉及具有一个且仅一个脂肪族或卤代脂肪族基团的环氧化物的酯化的这些
背景技术:
引文都没有描述或提示式的环氧化物(其中每个rg,在每次出现时可以相同或不同,将是脂肪族或卤代脂肪族基团)与通式[l-y-co2h]
(t-1)-[u
u+
]
(t-1)/u
的羧酸(其中l、y、t、u
u+
和u如本文之前所描述)的酯化。
[0276]
因此,本发明的另一目的是提供一种用于酯化此种任选地卤代的式的二脂肪族环氧化物的新的、有效的且成本有效的方法。特别地,本发明的另一目的是一种用于从式的长链二脂肪族环氧化物获得二酯的新的、有效的且成本有效的方法,所述二酯可用于制造具有良好表面活性剂特性和良好生物降解性的季铵化合物。
[0277]
该另一目的用后文在项目d.1下所描述的方法(“本发明d”)实现:
[0278]-项目d.1:一种用于获得具有通式(xv)的二酯的方法所述方法包括使式(xvi)的环氧化物与通式(xvii)的羧酸反应[l-y-co2h]
(t-1)-[u
u+
]
(t-1)/u
(xvii)
其中,无论用于以上式中何处:-rg,在每次出现时可以相同或不同,是脂肪族基团或卤代脂肪族基团;-y是二价的c
1-c6脂肪族基团;-l是离去基团;-t是等于1或者等于或大于2的整数;-u
u+
是阳离子,和-u是确定阳离子的正电荷的整数(例如对于h
+
、nh
4+
或碱金属阳离子是1或者对于碱土金属阳离子是2)。应理解,同样地rg、y和l
(t-1)-在每次出现时可以相同或不同。
[0279]
本发明d的优选的和/或具体的实施例在后文中设定:
[0280]-项目d.2:如项目d.1中所描述的方法,其中反应通过一摩尔的环氧化物消除一摩尔的水进行,如可以由以下表示:
[0281]-项目d.3:如项目d.1或d.2中所描述的方法,其中反应在反应介质中进行,在反应的过程中通过蒸馏从反应介质中去除水;
[0282]-项目d.4:如项目d.1、d.2或d.3所描述的方法,其中反应在不存在酶的情况下进行;
[0283]-项目d.5:如项目d.1至d.4中任一项目所描述的方法,其中反应在惰性气氛诸如氮气或稀有气体气氛下进行;
[0284]-项目d.6:如项目d.5中所描述的方法,其中惰性气氛是氩气气氛;
[0285]-项目d.7:如项目d.1至d.6中任一项目所描述的方法,其中在反应的整个过程中与环氧化物接触的式(xvii)的羧酸的摩尔总数超过环氧化物的摩尔数;
[0286]-项目d.8:如项目d.7中所描述的方法,其中在反应的整个过程中与环氧化物接触的式(xvii)的羧酸的摩尔总数比环氧化物的摩尔数高至少两倍;
[0287]-项目d.9:如项目d.8中所描述的方法,其中在反应的整个过程中与环氧化物接触的式(xvii)的羧酸的摩尔总数比环氧化物的摩尔数高至少四倍;
[0288]-项目d.10:如项目d.1至d.9中任一项目所描述的方法,其中在反应的整个过程中与环氧化物接触的式(xvii)的羧酸的摩尔总数比环氧化物的摩尔数高至多十倍;
[0289]-项目d.11:如项目d.10中所描述的方法,其中在反应的整个过程中与环氧化物接触的式(xvii)的羧酸的摩尔总数比环氧化物的摩尔数高至多八倍;
[0290]-项目d.12:如项目d.1至d.11中任一项目所描述的方法,其中反应在其中环氧化
物呈熔融状态的反应器中进行;
[0291]-项目d.13:如项目d.1至d.12中任一项目所描述的方法,其中反应在其中式(xvii)的羧酸呈熔融状态的反应器中进行;
[0292]-项目d.14:如项目d.1至d.13中任一项目所描述的方法,其中将环氧化物逐步添加进含有全部量的式(xvii)的羧酸的反应器中;
[0293]-项目d.15:如项目d.14中所描述的方法,其中将环氧化物连续添加进含有全部量的式(xvii)的羧酸的反应器中;申请人已经观察到,使环氧化物逐步地、优选地连续地与全部量的羧酸接触使得能够限制环氧化物的自缩合;
[0294]-项目d.16:如项目d.1至d.15中任一项目所描述的方法,其包括:-第一步骤s1,其中使环氧化物与式(xvii)的羧酸在低于100℃的温度t1下反应足以将大于f1=80mol.%的环氧化物转化成式(xviii)的单羟基-单酯的时间t1:-第二步骤s2,其中在至少100℃的温度t2下,使单羟基-单酯和未在步骤s1中转化成单羟基-单酯的环氧化物与式(xvii)的羧酸反应足以形成式(xv)的二酯的时间t2,其摩尔量大于与羧酸反应的环氧化物的总量的f2=50mol.%;本技术人已经出人意料地发现,首先使环氧化物与羧酸在低于100℃的温度t1下反应足以将大于f1=80mol.%的环氧化物转化成单羟基-单酯的时间t1(步骤s1),之后升高温度以将单羟基-单酯转化成二酯(步骤s2)使得能够限制酮和脱水副产物的形成;
[0295]-项目d.17:如项目d.16中所描述的方法,其中在步骤s1期间,将全部量的环氧化物逐步添加进含有全部量的式(xvii)的羧酸的反应器中;
[0296]-项目d.18:如项目d.17中所描述的方法,其中在步骤s1期间,将全部量的环氧化物连续添加进含有全部量的式(xvii)的羧酸的反应器中;
[0297]-项目d.19:如项目d.16至d.18中任一项目所描述的方法,其中t1是至多80℃;
[0298]-项目d.20:如项目d.19中所描述的方法,其中t1是至多70℃;
[0299]-项目d.21:如项目d.16至d.20中任一项目所描述的方法,其中t1是至少25℃;
[0300]-项目d.22:如项目d.21中所描述的方法,其中t1是至少40℃、优选地至少55℃、更优选地至少60℃;
[0301]-项目d.23:如项目d.16至d.22中任一项目所描述的方法,其中f1=90mol.%;
[0302]-项目d.24:如项目d.23中所描述的方法,其中f1=95mol.%;
[0303]-项目d.25:如项目d.24中所描述的方法,其中f1=98mol.%;
[0304]-项目d.26:如项目d.16至d.25中任一项目所描述的方法,其中t1范围从10min至10h;
[0305]-项目d.27:如项目d.26中所描述的方法,其中t1是至少30min、可能地至少45min;
[0306]-项目d.28:如项目d.26或d.27中所描述的方法,其中t1是至多4h、优选地从30min至3h;
[0307]-项目d.29:如项目d.16至d.28中任一项目所描述的方法,其中t2是至少120℃;
[0308]-项目d.30:如项目d.29中所描述的方法,其中t2是至少130℃;
[0309]-项目d.31:如项目d.16至d.30中任一项目所描述的方法,其中t2是至多250℃,
[0310]-项目d.32:如项目d.31中所描述的方法,其中t2是至多200℃、优选地至多170℃、更优选地至多150℃;
[0311]-项目d.33:如项目d.16至d.32中任一项目所描述的方法,其中式(xv)的二酯以大于f2=65mol.%的摩尔量形成;
[0312]-项目d.34:如项目d.33中所描述的方法,其中f2=70mol.%;
[0313]-项目d.35:如项目d.34中所描述的方法,其中f2=75mol.%;优选地,式(xv)的二酯以至少80mol.%的摩尔f2形成;
[0314]-项目d.36:如项目d.16至d.35中任一项目所描述的方法,其中t2范围从1h至30h;
[0315]-项目d.37:如项目d.36中所描述的方法,其中t2≥3h;
[0316]-项目d.38:如项目d.37中所描述的方法,其中t2≥4h;
[0317]-项目d.39:如项目d.36、d.37或d.38中所描述的方法,其中t2是至多10h;
[0318]-项目d.40:如项目d.39中所描述的方法,其中t2≤7h;
[0319]-项目d.41:如项目d.16至d40中任一项目所描述的方法,其中步骤s2在至多90kpa、优选地从50kpa至90kpa、更优选地从70kpa至90kpa例如约80kpa的压力p2下进行;-项目d.42:如项目d.16至d40中任一项目所描述的方法,其中步骤s2在从95kpa至99kpa、优选地从96kpa至98kpa例如约97.5kpa的压力p2下进行;申请人已经观察到,在低真空下进行步骤s2使得更容易去除作为酯化的副产物所形成的水;
[0320]-项目d.43:如项目d.41或d.42所描述的方法,其包括在步骤s2完成后,将压力p2逐步降低至低于100kpa、优选地至多50kpa、更优选地至多20kpa例如约10kpa的压力p3;申请人已经观察到,这使得能够蒸馏过量的羧酸并且提高从单羟基-单酯到二酯的转化率;
[0321]-项目d.44::如项目d.1至d.43中任一项目所描述的方法,其中反应在布朗斯特酸或路易斯酸催化剂的存在下进行;
[0322]-项目d.45:如项目d.1至d.43中任一项目所描述的方法,其中反应在选自h2so4、对甲苯磺酸、三氟甲磺酸、hcl、alcl3和非均相酸性催化剂诸如树脂的催化剂的存在下进行;
[0323]-项目d.46:如项目d.1至d.43中任一项目所描述的方法,其中反应在不存在任何催化剂的情况下进行;
[0324]-项目d.47:如项目d.1至d.46中任一项目所描述的方法,其中反应在不存在溶剂的情况下进行;
[0325]-项目d.48:如项目d.1至d.46中任一项目所描述的方法,其中反应在溶剂诸如甲苯、二甲苯、烃、dmso、me-thf或thf的存在下进行;
[0326]-项目d.49:如项目d.1至d.48中任一项目所描述的方法,其中rg(即每个rg)是脂肪族基团;
[0327]-项目d.50:如项目d.1至d.49中任一项目所描述的方法,其中rg包含至少2个、可能地至少3个或至少4个碳原子;
[0328]-项目d.51:如项目d.1至d.50中任一项目所描述的方法,其中rg包含至多4个碳原子;
[0329]-项目d.52:如项目d.1至d.50中任一项目所描述的方法,其中rg包含至少5个碳原子;
[0330]-项目d.53:如项目d.1至d.48中任一项目所描述的方法,其中rg(即每个rg),在每次出现时可以相同或不同,表示c
5-c
27
脂肪族基团,即rg具有与如先前所描述的r相同的定义,并且通过本方法获得的二酯是如先前在与本发明c有关的项目c.1中所描述的二酯;-项目d.54:如项目d.53中所描述的方法,其中所获得的二酯是如项目c.2至c.28中任一项目所描述的二酯;-项目d.55:如项目d.53或d.54中所描述的方法,其包括使式的烯烃与式r**ooh的氧化剂反应,其中r**如项目c.31中所描述的;
[0331]-项目d.56:如项目d.55中所描述的方法,其包括通过施用如项目c.32中所描述的反应方案获得式的烯烃;-项目d.57:如项目d.1至d.56中任一项目所描述的方法,其中u
u+
选自h
+
、nh
4+
、碱金属阳离子、碱土金属阳离子和al
+3
;
[0332]-项目d.58:式(xviii)的单羟基-单酯化合物:其中-rg,在每次出现时可以相同或不同,是脂肪族基团或卤代脂肪族基团,-y是二价的c
1-c6脂肪族基团,-l是离去基团,和-t是等于1或者等于或大于2的整数;
[0333]-项目d.59:如项目d.58中所描述的单羟基-单酯化合物,其中rg(即每个rg),在每次出现时可以相同或不同,表示c
5-c
27
脂肪族基团,即rg具有与如先前所描述的r相同的定义;
[0334]-项目d.60:如项目d.59中所描述的单羟基-单酯化合物,其中r、y、l和t符合如在与本发明c的二酯相关的项目c.2至c.28中任一项目所描述的一个或多个特征;
[0335]-项目d.61:如项目d.58、d.59或d.60中所描述的单羟基-单酯化合物用于制造二
酯化合物的用途;
[0336]-项目d.62:如项目d.61中所描述的用途,其中单羟基-单酯化合物是如项目d.59或d.60中所描述的,并且二酯化合物是如项目c.1至c.28中任一项目所描述的。
[0337]
由二酯开始的胺缩合
[0338]
式(xiv)的二酯化合物可以通过以下反应方案转化成式(xi)的离子化合物(或其电中性同系物):其中-r、y、l、t、u
u+
和u是如本文之前所描述的,和-r’、r”和r
”’
是c1至c4烷基基团、优选地甲基或乙基、最优选地甲基。
[0339]
胺缩合反应通过使如以上所描述的获得的中间体二酯与通式nr’r”r
”’
的胺接触进行,其中r’、r”和r
”’
是c1至c4烷基基团、优选地甲基或乙基、最优选地甲基。
[0340]
反应可以在范围从15℃至250℃的温度下在合适溶剂的存在下进行。作为合适溶剂的实例,可以提及:thf、me-thf、甲醇、乙醇、异丙醇、dmso、甲苯、二甲苯或它们的混合物。替代性地,反应也可以在不存在任何添加的溶剂下进行。
[0341]
在该反应期间,存在取代二酯中的l
(t-1)-的胺的亲核攻击,l
(t-1)-起到离去基团的作用。然后l
t-变成最终季铵化合物的抗衡阴离子。在离去基团已经在二酯反应物中携带负电荷的情况下(这是当(t-1)等于或大于1或者当t等于或大于2时的情况),还存在作为反应的副产物的盐的形成(具有如以上等式方案中所示出的通用化学式[u
u+
]
t/u
[l
t-])。
[0342]
由二醇开始的酯化和胺缩合/直接季铵化
[0343]
由式的二醇开始,其中r如本文之前所描述,申请人已经发现在一个反应步骤中能够获得符合式(ix)或(xi)的化合物,即在一个步骤中实现所述酯化和胺缩合,前提是使用另一合适的酯化剂。该合适的酯化剂通常可以定义为式(xixa)的氨基酸或其酯的活化形式r’r”r
”’
+
n-y-c(=o)-o-ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(xixa)或者式(xixb)的它们的氢卤化物加合物的活化形式r’r”r
”’
+
n-y-c(=o)-oh x-ꢀꢀꢀꢀꢀꢀꢀꢀ
(xixb)其中-r’、r”和r
”’
,可以相同或不同,是氢或c1至c4烷基基团,-y是二价的c
1-c6脂肪族基团,和-x表示卤素原子,诸如氯或溴。
[0344]
式(xixa)的氨基酸或其酯或者式(xixb)的它们的氢卤化物加合物的活化形式有利地选自:-式(xx)的酰基卤化物r’r”r
”’
+
n-y-c(=o)-x x-ꢀꢀꢀꢀꢀꢀꢀ
(xx)其中r’、r”、r
”’
、y和x如先前关于式(xixa)和(xixb)所描述;特别地,它可以是式r’r”r
”’
+
n-y-c(=o)-cl cl-的酰氯。
[0345]
式(xixa)的氨基酸或其酯或者式(xixb)的它们的氢卤化物加合物的其他合适的活化形式包括式(xxi)的酰基叠氮化物r’r”r
”’
+
n-y-c(=o)-n=n
+
=n-ꢀꢀꢀꢀꢀꢀꢀ
(xxi)和酰基咪唑或酰基咪唑鎓。
[0346]
若干出版物描述了多元醇(其中羟基基团是伯(着重强调)羟基基团)与氨基酸或其酯的直接酯化。
[0347]
例如,stakleff在acta biomaterialia[生物材料学报],9,5132-5142(2013)中教导了在对甲苯磺酸的存在下己二醇与苯丙氨酸或亮氨酸的反应。
[0348]
lele等人在synthetic communications[合成通讯],29:10,1727-1739(1999)中实现了聚(乙二醇)和氨基酸盐酸化物在二环己基碳二亚胺的存在下的介导偶联。
[0349]
等人在carbohydrate polymers[碳水化合物聚合物],41,277-283(2000)中,在作为溶剂的二噁烷和作为亲核试剂和催化剂的吡啶的存在下由淀粉和甜菜碱酰氯制备甜菜碱淀粉酯:早已通过使甘氨酸甜菜碱与亚硫酰氯在二氯甲烷中反应来制备甜菜碱酰氯。
[0350]
另一方面,这些现有技术都不解决直接季铵化带有两个或更多个仲羟基基团的多元醇的可能性,其反应性与带有伯羟基基团的多元醇的反应性显著不同,如现在可以在本发明的框架内实现的。
[0351]
因此,本发明的另一目的是提供一种用于直接季铵化式的二醇的新的、有效的且简单的方法,其中rh,在每次出现时可以相同或不同,表示脂肪族基团。特别地,本发明的另一目的是提供一种用于直接季铵化式(具有如本文之前所描述的r)的二醇的新的、有效的且简单的方法,由此获得具有良好表面活性剂特性和良好生物降解性的季铵化合物。
[0352]
该另一目的用后文在项目e.1下所描述的方法(“本发明e”)实现:
[0353]-项目e.1:一种用于获得具有以下通式的季铵化合物的方法具有以下通式的季铵化合物的方法所述方法包括使以下式的二醇与氨基酸或其衍生物或者它们的氢卤化物加合物的活化形式反应,其中-氨基酸或其衍生物具有式(xixa)r’r”r
”’
+
n-y-c(=o)-o-ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(xixa),并且它们的氢卤化物加合物具有式(xixb)r’r”r
”’
+
n-y-c(=o)-oh x-ꢀꢀꢀꢀꢀꢀꢀꢀ
(xixb),-rh,在每次出现时可以相同或不同,是脂肪族基团-r’、r”和r
”’
是氢或c1至c4烷基基团,-y是二价的c
1-c6脂肪族基团,和-x表示卤素原子,诸如氯或溴。应理解,在式(xxii)中,正如rh、y、r’、r”和r
”’
在每次出现时可以相同或不同的情况。本发明e的优选的和/或具体的实施例在后文中设定:
[0354]-项目e.2:如项目e.1中所描述的方法,其中氨基酸或其衍生物或者它们的氢卤化物加合物的活化形式是式(xx)的酰基卤化物r’r”r
”’
+
n-y-c(=o)-x x-ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(xx)其中r’、r”、r
”’
、y和x如之前关于式(xxii)所描述;
[0355]-项目e.3:如项目e.2中所描述的方法,其包括通过使式(xixa)的氨基酸或其衍生物和/或式(xixb)的其氢卤化物加合物与选自亚硫酰基卤化物、草酰基卤化物、三卤化磷、五卤化磷或氧卤化磷的试剂反应、优选地通过使式(xixa)的氨基酸或其衍生物和/或式
(xixb)的其氢卤化物加合物与选自亚硫酰氯(socl2)、草酰氯[(cocl)2]、三氯化磷(pcl3)、五氯化磷(pcl5)和三氯氧磷(pocl3)的试剂反应、更优选地通过使式(xixa)的氨基酸或其衍生物和/或式(xixb)的氢卤化物加合物与亚硫酰氯反应获得式(xx)的酰基卤化物;
[0356]-项目e.4:如项目e.1中所描述的方法,其中氨基酸或其衍生物或者它们的氢卤化物加合物的活化形式是式(xxi)的酰基叠氮化物r’r”r
”’
+
n-y-c(=o)-n=n
+
=n-ꢀꢀꢀꢀꢀ
(xxi)其中r’、r”、r
”’
、y和x如之前关于式(xxii)所描述;
[0357]-项目e.5:如项目e.1至e.4中任一项目所描述的方法,其中x是氯化物;
[0358]-项目e.6:如项目e.1至e.5中任一项目所描述的方法,其中rg包含至少2个、可能地至少3个或至少4个碳原子;
[0359]-项目e.7:如项目e.1至e.6中任一项目所描述的方法,其中rg包含至多4个碳原子;
[0360]-项目e.8:如项目e.1至e.6中任一项目所描述的方法,其中rg包含至少5个碳原子;
[0361]-项目e.9:如项目e.8中所描述的方法,其中rg(即每个rg),在每次出现时可以相同或不同,表示c
5-c
27
脂肪族基团,即rg具有与如先前例如关于本发明c所描述的r相同的定义,并且通过本方法获得的季铵化合物具有式(xi);
[0362]-项目e.10:如项目e.9中所描述的方法,其中r如项目c.2至c.28中任一项目所描述;
[0363]-项目e.11:如项目e.1至e.10中任一项目所描述的方法,其中y选择-ch
2-、-ch(ch3)-、-ch[ch(ch3)2]-、-ch[ch
2-ch(ch3)2]-和-ch[ch(ch3)-ch
2-ch3]-;
[0364]-项目e.12:如项目e.11中所描述的方法,其中y是-ch
2-;
[0365]-项目e.13:如项目e.1至e.12中任一项目所描述的方法,其中r’、r”和r
”’
中的至少一个是c1至c4烷基基团;
[0366]-项目e.14:如项目e.13中所描述的方法,其中r’是c1至c4烷基基团,r”是c1至c4烷基基团并且r
”’
是c1至c4烷基基团;
[0367]-项目e.15:如项目e.14中所描述的方法,其中r’、r”和r
”’
是甲基;
[0368]-项目e.16:如项目e.1至e.15中任一项目所描述的方法,其中式(xixa)的氨基酸或其衍生物是三甲基甘氨酸并且式(xixb)的氢卤化物加合物是甜菜碱盐酸化物。用于合成其中a由如由式(ix)和(xi)所示例的a-5表示的化合物的第二方法
[0369]
偶姻缩合
[0370]
用于合成根据本发明的化合物(其中a由a-5表示并且在以下方案中对于式(ix)和(xi)的化合物示出)的替代性方法根据以下方案经由偶姻缩合进行:
其中r******是具有从1至6个碳原子的烷基基团。
[0371]
偶姻缩合通常通过使酯(典型地脂肪酸甲酯)与作为还原剂的钠金属反应来进行。反应在高沸点芳香族溶剂诸如甲苯或二甲苯中进行,其中可以将金属在高于其熔点的温度(在钠的情况下约98℃)下分散。反应可以在范围从100℃至200℃的温度下进行。在还原结束时,可以用水小心地淬灭反应介质,并且可以分离含有所期望的偶姻产物的有机相。最终产物可以在适当的后处理之后获得,并且技术人员了解代表性技术,这样不需要在此给出进一步的细节。
[0372]
该类型的反应已经描述于文献中,例如在hansley,j.am.chem.soc[美国化学会会志]1935,57,2303-2305或van heyningen,j.am.chem.soc.[美国化学会会志]1952,74,4861-4864中或者在rongacli等人,eur.j.lipd sci.technol.[欧洲脂质科学与技术杂志]2008,110,846-852中,对其因此进行了进一步的细节参考。
[0373]
酮-醇氢化
[0374]
该反应可以使用前文对于分别用于制造式(ix)和(xi)的化合物(其中a由a-5表示)的第一方法变体所描述的条件进行。
[0375]
随后的反应步骤也如前文对于分别用于制造式(ix)和(xi)的化合物(其中a由a-5表示)的第一方法变体所描述的。
[0376]
用于制造其中a由a-2表示的化合物、更具体地用于制造式(viii)的化合物的合适方法描述于后文的实验部分中。
[0377]
之前所描述的示例性方法是合适方法的实例,即可能存在合成根据本发明的化合物的其他合适方法。因此,就根据本发明的制造化合物的方法而言,前文所描述的方法并不受。
[0378]
如果在前文所描述的示例性方法中用作反应物的内酮由具有偶数个碳原子的天然脂肪酸获得,则式iv、v、vii、viii和x的化合物中两个基团r的碳原子的数目优选地是以下对中的任一种:
[0379]
(5,5)、(7,7)、(9,9)、(11,11)、(13,13)、(15,15)、(17,17)(7,9)、(7,11)、(7,13)、(7,15)、(7,17)(9,11)、(9,13)、(9,15)、(9,17)(11,13)、(11,15)、(11,17)(13,15)、(13,17)
(15,17)。
[0380]
特别地,如果在前文所描述的示例性方法中用作反应物的内酮由具有范围从12至18的偶数个碳原子的一种或多种羧酸获得,则式iv、v、vii、viii和x的化合物中两个基团r的碳原子的数目是以下对中的一种或多种:
[0381]
(11,11)、(13,13)、(15,15)、(17,17)(11,13)、(11,15)、(11,17)(13,15)、(13,17)(15,17)。
[0382]
如果内酮衍生自包含奇数个碳原子的脂肪酸,则其他对是可能的并将获得的。
[0383]
如果在前文所描述的示例性方法中用作反应物的内酮衍生自具有偶数个碳原子的天然脂肪酸,则对于式vi、ix和xi的化合物,两个基团r的碳原子的数目优选地是以下对中的任一种:
[0384]
(4,5)、(6,7)、(8,9)、(10,11)、(12,13)、(14,15)、(16,17)(4,7)、(4,9)、(4,11)、(4,13)、(4,15)、(4,17)(5,6)、(5,8)、(5,10)、(5,12)、(5,14)、(5,16)(6,9)、(6,11)、(6,13)、(6,15)、(6,17)(7,8)、(7,10)、(7,12)、(7,14)、(7,16)(8,11)、(8,13)、(8,15)、(8,17)(9,10)、(9,12)、(9,14)、(9,16)(10,13)、(10,15)、(10,17)(11,12)、(11,14)、(11,16)(12,15)、(12,17)(13,14)、(13,16)(14,17)(15,16)。
[0385]
特别地,如果在前文所描述的示例性方法中用作反应物的内酮由具有范围从12至18的偶数个碳原子的一种或多种羧酸获得,则式vi、ix和xi的化合物中两个基团r的碳原子的数目是以下对中的一种或多种:
[0386]
(10,11)、(12,13)、(14,15)、(16,17)(10,13)、(10,15)、(10,17)(11,12)、(11,14)、(11,16)(12,15)、(12,17)(13,14)、(13,16)(14,17)(15,16)
[0387]
如果内酮由包含奇数个碳原子的脂肪酸获得,则其他对是可能的并将获得的。
[0388]
其中a由a-5表示的化合物并且特别是式(xi)的化合物、尤其是式(ix)的化合物,一方面具有表面活性剂特性的特别令人感兴趣的且有利的特性特征,并且另一方面具有生物降解性特性。随着生物降解性越来越成为表面活性剂产品的重要方面,其中a由a-5表示
的化合物并且特别是在该组中式(xi)的化合物、尤其是式(ix)的化合物构成本发明的优选实施例。
[0389]
本发明的化合物可以用作表面活性剂。表面活性剂是降低两种液体、液体与气体或液体与固体之间的表面张力(或界面张力)的化合物。表面活性剂可以充当洗涤剂、润湿剂、乳化剂、发泡剂、以及分散剂。
[0390]
表面活性剂通常是两亲性的有机化合物,意指它们含有疏水基团(其尾)和亲水基团(其头)二者。因此,表面活性剂含有水不溶性(或油溶性)组分和水溶性组分二者。表面活性剂将扩散在水中并且在空气与水之间的界面处或在油与水之间的界面(在其中水与油混合的情况下)处吸附。水不溶性疏水基团可以延伸出本体水相到空气或油相中,同时水溶性头基留在水相中。
[0391]
阳离子表面活性剂在带负电的表面上的吸附对于此类表面活性剂是重要的特性。此特性通常与在水性介质中产生带负电的纤维素纳米晶体(cnc,其经常用作参考材料)悬浮液的聚集所需的表面活性剂的最小浓度相关。尺寸的连续变化可以被监测,并且随后进行动态光散射(dls)。
[0392]
按照e.k.oikonomou等人,j.phys.chem.b[物理化学杂志b],2017,121(10),2299-307中所描述的方案,可以通过监测在水溶液中在固定的[表面活性剂]+[cnc]=0.01wt%下诱导纤维素纳米晶体聚集所需的比率x=[表面活性剂]/[cnc]或质量分数m=[表面活性剂]/([表面活性剂+[cnc])来研究季铵化合物的吸附特性。
[0393]
本发明的化合物的生物降解性可以根据现有技术中所描述的和技术人员已知的程序确定。关于一种这样的方法oecd标准301的细节在后文的实验部分中给出。
[0394]
如果通过援引并入本文的任何专利、专利申请和公开物的披露内容与本技术的说明相冲突到了可能导致术语不清楚的程度,则本说明应优先。
[0395]
工作实例
[0396]
实例1-由12-二十三烷醇开始合成式iv的季铵化合物,其中j是j3,即其中基团x中的n和n’各自是1
[0397]
根据us-a 2018/093936(参见该文献中的实例3),通过催化氢化由c
23
12-二十三烷酮获得c
23 12-二十三烷醇。
[0398]
所有反应在小心干燥的容器中和在惰性氩气气氛下进行。
[0399]
按原样使用新鲜的市售无水chcl3(戊烯稳定的)、无水甲苯和无水乙腈。将氯化胆碱(其是吸湿的)用无水thf洗涤数次,并在使用之前真空干燥。
[0400]
向配备有冷凝器、温度探针、加热器和磁力搅拌器的500ml圆底烧瓶中添加38.37g的12-二十三烷醇(112.7mmol),随后添加150ml的甲苯。然后允许混合物在室温下搅拌,并且然后添加0.1g的固体koh(1.7mmol,1.6mol%),随后添加18.26g的羰基二咪唑(112.7mmol,1当量)和另外20ml的甲苯。
[0401]
然后允许在70℃下搅拌混合物;在该温度下,混合物变得透明。通过1h-nmr跟踪反应进程,并且在70℃下三小时之后,达到99%的醇转化率。
[0402]
然后通过在50℃、9毫巴下蒸馏去除所有挥发物以提供59.4g的残余物,将其不经纯化用于下一阶段。
[0403]
然后将残余物溶解在40ml chcl3和40ml的乙腈的混合物中,并在室温下添加
15.74g的氯化胆碱(112.7mmol,1当量)。然后允许混合物在50℃下搅拌过夜。
[0404]
在反应的过程中,反应介质变成均相和绿色。通过1h-nmr跟踪反应进程,并且在该阶段获得89%的转化率。然后在真空下去除溶剂以提供约79.1g的粗品。
[0405]
粗残余物通过在硅胶上柱层析(330g的二氧化硅)纯化,以便使用乙酸乙酯/甲醇(acoet/meoh)洗脱液(从100%acoet至50:50acoet:meoh进行)去除杂质和咪唑副产物(规格《0.5wt%的咪唑)。
[0406]
收集五种级分:弃去对应于中间体咪唑碳酸酯的第一级分以及对应于咪唑的第二级分,并收集三种剩余的级分并再纯化。
[0407]
对于在硅胶上的第二次柱层析,使用200g的二氧化硅和相同的洗脱液体系。收集两种级分:第一种是产物和咪唑的混合物,并且第二种是纯产物。
[0408]
最终,将第一级分使用30g的硅胶和相同的洗脱液体系再次纯化以提供额外量的产物。
[0409]
收集所有干净的级分,得到39.8g的呈白色蜡的产物,对应于70%分离收率。
[0410]1h nmr(cdcl3,400mhz)δ(ppm):4.65(五重峰,1h),4.61-4.51(m,2h),4.22-4.02(m,2h),3.52(s,9h),1.61-1.44(m,4h),1.32-1.12(m,36h),0.84(t,j=8.0hz,6h)。
[0411]
13
c nmr(cdcl3,101mhz)δ(ppm):154.21,80.88,64.92,61.24,54.59,33.96,32.10,29.83,29.82,29.80,29.70,29.68,29.54,25.36,22.88,14.31(末端ch3)。
[0412]
实例2-由16-三十一烷醇开始合成式iv的季铵化合物,其中j是j3,即其中基团x中的n和n’各自是1
[0413]
根据us-a us2018/093936(参见该文献中的实例3),通过催化氢化由c
31 16-三十一烷酮获得c
31 16-三十一烷醇。
[0414]
所有反应在小心干燥的容器中和在惰性氩气气氛下进行。
[0415]
按原样使用新鲜的市售无水chcl3(戊烯稳定的)、无水甲苯和无水乙腈。将氯化胆碱(其是吸湿的)用无水thf洗涤数次,并在使用之前真空干燥。
[0416]
向配备有冷凝器、温度探针、加热器和磁力搅拌器的500ml圆底烧瓶中添加45.2g的16-三十一烷醇(99.9mmol),随后添加150ml的甲苯。然后允许混合物在室温下搅拌,并且然后添加0.1g的固体koh(1.7mmol,1.7mol%),随后添加17.0g的羰基二咪唑(105mmol,1.05当量)和另外50ml的甲苯。
[0417]
然后允许在60℃下搅拌混合物;在该温度下,混合物变得透明。通过1h-nmr跟踪反应进程,并且在60℃下一小时之后,达到》99%的醇转化率。
[0418]
然后通过真空去除所有挥发物以提供白色残余物,将其不经纯化用于下一阶段。
[0419]
然后将残余物溶解在80ml chcl3和80ml的乙腈的混合物中,并在室温下添加13.95g的氯化胆碱(99.9mmol,1当量)。然后允许混合物在55℃下搅拌过夜。
[0420]
通过1h-nmr跟踪反应进程,并且在该阶段仅获得30%的弱转化率。该弱转化率可以通过koh分解(例如通过与chcl3反应)来解释。
[0421]
然后添加0.3g的koh(5.1mmol)并将混合物在回流下再搅拌3小时。根据nmr,转化率水平达到78%。
[0422]
再次添加另外0.2g的koh,随后在回流下搅拌十二小时。
[0423]
在该阶段,转化率水平是83%,并且混合物的颜色是棕色。
[0424]
然后在真空下去除溶剂以提供约84g的粗品。
[0425]
粗残余物通过在硅胶上柱层析(330g的二氧化硅的2根柱)纯化,以便使用acoet/meoh洗脱液(从100%acoet至50:50acoet:meoh进行)去除杂质和咪唑副产物(规格《0.5wt%的咪唑)。
[0426]
收集四种级分:第一级分对应于中间体咪唑碳酸酯,并且第二级分对应于咪唑。第三级分含有咪唑和所期望的产物的混合物,并且最后级分对应于所期望的产物。
[0427]
收集每根柱的第四级分并使其在硅胶上经受第二次柱层析。330g的二氧化硅与相同的洗脱液体系一起使用以提供具有良好纯度的所期望的产物。
[0428]
获得了36.6g的呈白色蜡的产物,对应于60%分离收率。
[0429]1h nmr(cdcl3,400mhz)δ(ppm):4.66(五重峰,1h),4.62-4.52(m,2h),4.24-4.04(m,2h),3.53(s,9h),1.62-1.46(m,4h),1.34-1.14(m,52h),0.85(t,j=6.8hz,6h)。
[0430]
13
c nmr(cdcl3,101mhz)δ(ppm):154.20,80.87,64.91,61.23,54.58,33.96,32.11,29.90,29.85,29.82,29.72,29.69,29.55,25.36,22.88,14.31(末端ch3)。
[0431]
实例3-由c
31-16-三十一烷酮开始合成其中a由a-2或a-3表示的季铵化合物的混合物(式(v)和(vi)的化合物的混合物)
[0432]
诺文葛耳(knoevenagel)缩合以提供二酯中间体:
[0433]
所有反应在小心干燥的容器中和在惰性氩气气氛下进行。
[0434]
按原样使用新鲜的市售无水chcl3、无水thf和无水吡啶。
[0435]
在配备有机械搅拌器(具有四个倾斜犁片的螺旋桨)、冷凝器、加料漏斗和温度探针的1l双夹套反应器中添加36.5ml的ticl4(63.00g,0.332摩尔),随后添加146.3ml的chcl3。
[0436]
将混合物在-10℃下搅拌并通过加料漏斗以避免反应介质的温度升高超过+5℃的速率缓慢添加无水thf(358ml)。在thf添加期间,出现黄色沉淀物。然后将15.3ml的丙二酸二甲酯(17.69g,0.134摩尔)添加进反应混合物中,然后允许其在室温下搅拌1小时以便允许发生丙二酸酯络合。
[0437]
然后允许混合物冷却至0℃并将71.80ml的无水吡啶(70.50g,0.891摩尔)在23ml的thf中的溶液缓慢添加进反应器中。在添加期间,混合物的颜色变成红色。然后允许混合物在室温下搅拌20分钟以允许发生去质子化。
[0438]
最终,将50.00g的c
31
酮(0.111摩尔)添加进反应混合物中,允许其在室温下搅拌一夜并在35℃下再搅拌一天。然后将250ml的水小心地添加进反应器中,随后添加250ml的乙醚。分离有机相并用250ml的水洗涤4次,并用200ml的饱和nacl水溶液洗涤一次以便去除吡啶鎓盐。合并水相并用250ml的乙醚再萃取3次。将最终有机相经mgso4干燥、过滤并在真空下蒸发以提供70.08g的粗橙色油。在该阶段,粗品含有残余量的起始酮以及对应于2当量的酮的缩合(醛醇缩合+丁烯醛化)的主要杂质。
[0439]
通过将油溶于乙醇中(副产物和起始酮不溶于乙醇)、随后经硅藻土过滤,可以容易地纯化产物。
[0440]
将滤液蒸发、再溶于chcl3中、再次过滤并蒸发以提供52.57g的油,具有95%的纯度(rmn)。
[0441]
总纯化收率是79%。
[0442]1h nmr(cdcl3,400mhz)δ(ppm):3.68(s,6h),2.32-2.19(m,4h),1.45-1.39(m,4h),1.30-1.10(m,48h),0.81(t,j=6.4hz,6h)。
[0443]
13
c nmr(cdcl3,101mhz)δ(ppm):166.30,164.47,123.65,52.15,34.61,32.15,30.16,29.92,29.91,29.87,29.76,29.60,28.65,22.92,14.34(末端ch3)。
[0444]
与二甲基氨基乙醇酯交换以提供二胺混合物中间体:
[0445]
所有反应在小心干燥的容器中和在惰性氩气气氛下进行。
[0446]
按原样使用新鲜的市售无水甲苯和二甲基氨基乙醇。
[0447]
在配备有机械搅拌器(具有四个倾斜犁片的螺旋桨)、具有蒸馏装置的冷凝器和温度探针的2l双夹套反应器中添加42.7g的内酮/丙二酸二甲酯加合物(75.6mmol),随后添加50ml的甲苯。将混合物在室温下搅拌并将30.4ml的二甲氨基乙醇(26.9g,302.2mmol,4当量)添加至反应体系中,随后添加50ml的甲苯。然后将0.9g的催化剂二丁基氧化锡(3.8mmol,5mol%)添加至反应混合物中,随后添加200ml的甲苯。
[0448]
然后允许混合物在120℃下搅拌并通过nmr分析跟踪反应进程。为了进行适当的分析,将反应介质的等分试样取样并在乙醚中稀释、用水淬灭、倾析,并将有机相在真空下蒸发以在cdcl
3 nmr溶剂中分析。在120℃下搅拌4天之后,nmr分析示出转化率水平是约83%,具有91%选择性。另外,副产物甲醇也存在于蒸馏烧瓶中。然后允许反应混合物在室温下冷却并用500ml的水淬灭。将介质倾析,并将水相用500ml的乙醚萃取三次。收集有机相并用500ml的水洗涤三次并用500ml的饱和nacl水溶液洗涤一次以便去除过量的二甲基氨基乙醇。然后将有机相经mgso4干燥、过滤并蒸发以给出47.9g的粗深色油。在该阶段,粗品含有残余量的起始丙二酸酯。
[0449]
然后将产物通过在硅胶上的快速柱层析纯化,用由chcl3/acoet混合物组成的第一洗脱液通过从100%chcl3至100%acoet的梯度进行。
[0450]
为了从柱中去除所有产物,也用异丙醇+net3混合物(10%体积net3)冲洗柱,允许获得另外的纯产物。
[0451]
收集干净的级分,在溶剂蒸发之后得到27.8g的纯产物,对应于54%分离收率。
[0452]
nmr分析示出产物呈具有以下比率的两种位置异构体的混合物的形式:54mol%的异构化产物(顺式和反式非对映异构体)和46mol%的亚甲基化产物。
[0453]1h nmr(cdcl3,400mhz)δ(ppm):5.45-5.13(m,1h:异构体2顺式+反式),4.42(s,1h,异构体2顺式或反式),4.24-4.06(m,4h,异构体1+2),3.99(s,1h,异构体2顺式或反式),
2.58-2.40(m,4h,异构体1+2),2.32-2.24(m,4h,异构体1),2.20(s,12h,异构体1),2.19(s,12h,异构体2),2.09-1.89(m,4h,异构体2顺式+反式),1.45-0.99(m,51h,异构体1+2),0.81(t,j=6.8hz,6h)。
[0454]
13
c nmr(cdcl3,101mhz)δ(ppm):168.60,168.41,165.49,164.05,132.07,131.57,131.12,130.77,123.73,63.35,62.76,58.08,57.49,57.45,53.45,45.73,34.45,30.07,30.03,29.72,29.68,29.58,29.53,29.45,29.38,28.46,28.43,28.27,28.09,22.70,14.13(末端ch3)。
[0455]
甲基化以提供化合物(v)和(vi)的混合物:
[0456]
所有反应在小心干燥的容器中和在惰性氩气气氛下进行。
[0457]
按原样使用新鲜的市售无水thf和硫酸二甲酯。
[0458]
在配备有机械搅拌器、冷凝器、加料漏斗和温度探针的1l双夹套反应器中添加100ml的干燥thf和6.9ml的硫酸二甲酯(9.14g,72mmol,2当量)。在加料漏斗中预先制备24.6g的酯胺(36mmol,1当量)在154ml的thf中的溶液并在室温下在搅拌下将其逐步添加进反应器中以便限制温度升高。然后将混合物在室温下在氩气下搅拌,并通过nmr分析监测反应进程。2小时之后,使混合物达到40℃并添加0.2ml的硫酸二甲酯(2mmol,0.06当量)以允许搅拌并实现完全转化。
[0459]
在40℃下搅拌一小时之后完成反应,并在真空下去除所有挥发物(thf和剩余的dms)以便提供33.15g的呈米黄色蜡的95mol%纯度产物,具有94%收率。nmr分析示出存在具有异构化衍生物(顺式和反式非对映异构体)与缀合的非异构化亚甲基化衍生物之间55:45比率的2种位置异构体。
[0460]1h nmr(meod,400mhz)δ(ppm):5.60-5.25(m,1h:异构体2顺式+反式),4.80(s,1h,异构体2顺式或反式),4.75-4.50(m,4h,异构体1+2),4.38(s,1h,异构体2顺式或反式),3.84-3.72(m,4h,异构体1+2),3.69(s,6h,异构体1+2),3.22(s,18h,异构体2),3.21(s,18h,异构体1),2.50-2.35(m,4h,异构体1),2.22-2.02(m,4h,异构体2顺式+反式),1.60-1.09(m,35h,异构体1+2),0.90(t,j=6.8hz,6h)。
[0461]
13
c nmr(meod,101mhz)δ(ppm):169.22,169.01,168.96,165.52,134.16,133.22,132.94,131.74,65.90,65.81,60.23,60.18,59.73,55.27,54.66,54.62,35.66,35.54,33.24,33.23,31.76,31.01,30.94,30.91,30.87,30.85,30.77,30.74,30.71,30.66,30.65,30.63,30.60,29.73,29.62,29.45,29.27,23.89,14.61(末端ch3)。
[0462]
实例4-由c
23-12-二十三烷酮开始合成其中a由a-2或a-3表示的季铵化合物的混合物(式(v)和(vi)的化合物的混合物)
[0463]
诺文葛耳(knoevenagel)缩合以提供二酯中间体:
[0464]
所有反应在小心干燥的容器中和在惰性氩气气氛下进行。
[0465]
按原样使用新鲜的市售无水chcl3、无水thf和无水吡啶。
[0466]
在配备有机械搅拌器(具有四个倾斜犁片的螺旋桨)、冷凝器、加料漏斗和温度探针的1l双夹套反应器中添加48.6ml的ticl4(84.02g,0.443摩尔),随后添加146ml的chcl3。将混合物在-10℃下搅拌并通过加料漏斗以避免反应介质的温度升高超过+5℃的速率缓慢添加无水thf(358ml)。在thf添加期间,出现黄色沉淀物。然后将20.4ml的丙二酸二甲酯(23.41g,0.177摩尔)添加进反应混合物中,然后允许其在室温下搅拌1小时以便允许发生
丙二酸酯络合。
[0467]
然后允许混合物冷却至0℃并将95.5ml的无水吡啶(93.44g,1.181摩尔)在23ml的thf中的溶液缓慢添加至反应器中。在添加期间,混合物的颜色变成红色。然后允许混合物在室温下搅拌20分钟以允许发生去质子化。
[0468]
最终,将50.00g的c
23
酮(0.148摩尔)添加至反应混合物中,允许其在室温下搅拌一夜并在35℃下再搅拌一天。然后将250ml的水小心地添加进反应器中,随后添加250ml的乙醚。分离有机相并用250ml的水洗涤四次,并用200ml的饱和nacl水溶液洗涤一次以便去除吡啶鎓盐。收集水相并用250ml的乙醚再萃取三次。将最终有机相经mgso4干燥、过滤并在真空下蒸发以提供69.5g的粗橙色油。在该阶段,粗品含有残余量的起始酮以及对应于2当量的酮的缩合(醛醇缩合+丁烯醛化)的主要杂质。
[0469]
通过将油溶于甲醇中(副产物和起始酮不溶于甲醇)、随后经硅藻土过滤,可以容易地纯化产物。
[0470]
将滤液蒸发以提供54g的油,具有95%的纯度(rmn)。
[0471]
总纯化收率是77%。
[0472]1h nmr(cdcl3,400mhz)δ(ppm):3.72(s,6h),2.33-2.29(m,4h),1.48-1.40(m,4h),1.34-1.17(m,32h),0.85(t,j=6.4hz,6h)。
[0473]
13
c nmr(cdcl3,101mhz)δ(ppm):166.28,164.44,123.63,52.14,34.6,32.12,30.13,29.84,29.73,29.58,29.55,28.64,22.90,14.32(末端ch3)。
[0474]
与二甲基氨基乙醇酯交换以提供二胺混合物中间体:
[0475]
所有反应在小心干燥的容器中和在惰性氩气气氛下进行。
[0476]
按原样使用新鲜的市售无水甲苯和二甲基氨基乙醇。
[0477]
在配备有机械搅拌器(具有四个倾斜犁片的螺旋桨)、具有蒸馏装置的冷凝器和温度探针的1l双夹套反应器中添加51.1g的内酮/丙二酸二甲酯加合物(110mmol,1当量)在300ml的甲苯中的溶液。将混合物在室温下搅拌并将45.5ml的二甲氨基乙醇(40.5g,450mmol,4当量)添加至反应介质中,随后添加1.37g的催化剂二丁基氧化锡(5.5mmol,5mol%)。
[0478]
然后允许混合物在120℃下搅拌并通过nmr分析跟踪反应进程。为了进行适当的分析,将反应介质的等分试样取样并在乙醚中稀释、用水淬灭、倾析,并将有机相在真空下蒸发以在cdcl
3 nmr溶剂中分析。在120℃下搅拌2天之后,允许混合物在室温下冷却并在真空下浓缩。然后将200ml的水添加至残余物中,随后添加200ml的乙醚。倾析有机相并用300ml的水洗涤三次并用300ml的nacl的饱和水溶液洗涤一次以便去除过量的二甲基氨基乙醇。收集水相并用700ml的乙醚再萃取。收集有机相,并且然后经mgso4干燥、过滤并蒸发。将所获得的残余物再溶解于甲醇中并过滤沉淀的固体。将滤液蒸发以提供59.04g的粗黄色油。在该阶段,粗产物含有残余量的起始丙二酸酯和一些副产物。
[0479]
然后将产物通过在硅胶上的快速柱层析纯化,用由chcl3/异丙醇混合物组成的洗脱液通过从100%chcl3至100%异丙醇的梯度进行。
[0480]
收集干净的级分,在溶剂蒸发之后得到22.9g的纯产物,对应于35%分离收率。
[0481]
nmr分析示出产物呈具有以下比率的2种位置异构体混合物的形式:60mol%的异构化产物(顺式和反式非对映异构体)和40mol%的亚甲基化产物。
[0482]1h nmr(cdcl3,400mhz)δ(ppm):5.45-5.15(m,1h:异构体2顺式+反式),4.42(s,1h,异构体2顺式或反式),4.24-4.08(m,4h,异构体1+2),3.99(s,1h,异构体2顺式或反式),2.65-2.40(m,4h,异构体1+2),2.32-2.24(m,4h,异构体1),2.20(s,12h,异构体1),2.19(s,12h,异构体2),2.10-1.90(m,4h,异构体2顺式+反式),1.50-0.95(m,35h,异构体1+2),0.81(t,j=6.4hz,6h)。
[0483]
13
c nmr(cdcl3,101mhz)δ(ppm):168.81,168.62,165.71,164.24,132.27,131.78,131.33,130.97,123.95,63.57,62.98,58.29,57.69,57.65,53.71,45.94,34.66,34.28,32.13,31.02,30.23,29.90,29.87,29.78,29.65,29.57,29.55,28.67,28.64,28.47,28.29,22.90,14.33(末端ch3)。
[0484]
甲基化以提供化合物v和vi的混合物:
[0485]
所有反应在小心干燥的容器中和在惰性氩气气氛下进行。
[0486]
按原样使用新鲜的市售无水thf和硫酸二甲酯。
[0487]
在配备有机械搅拌器(具有四个倾斜犁片的螺旋桨)、冷凝器、加料漏斗和温度探针的200ml双夹套反应器中添加100ml的干燥thf和7.59ml的硫酸二甲酯(10.1g,80mmol,2当量)。在加料漏斗中预先制备22.94g的酯胺(40mmol,1当量)在154ml的thf中的溶液并在室温下在搅拌下将其逐步添加进反应器中以便限制温度升高。然后将混合物在室温下在氩气下搅拌,并通过nmr分析监测反应进程。在室温下搅拌一小时之后完成反应,并在真空下去除所有挥发物(thf和剩余的dms)以便提供32.6g的呈米黄色蜡的产物,具有99%收率。
[0488]
nmr分析示出存在具有异构化衍生物(顺式和反式非对映异构体)与缀合的非异构化亚甲基化衍生物之间60:40比率的两种位置异构体。
[0489]1h nmr(meod,400mhz)δ(ppm):5.60-5.25(m,1h:异构体2顺式+反式),4.80(s,1h,异构体2顺式或反式),4.75-4.50(m,4h,异构体1+2),4.38(s,1h,异构体2顺式或反式),3.84-3.72(m,4h,异构体1+2),3.69(s,6h,异构体1+2),3.22(s,18h,异构体2),3.21(s,18h,异构体1),2.50-2.35(m,4h,异构体1),2.22-2.02(m,4h,异构体2顺式+反式),1.60-1.09(m,35h,异构体1+2),0.90(t,j=6.8hz,6h)。
[0490]
13
c nmr(meod,101mhz)δ(ppm):169.22,169.01,168.96,165.52,134.16,133.22,132.94,131.74,65.90,65.81,60.23,60.18,59.73,55.27,54.66,54.62,35.66,35.54,33.24,33.23,31.76,31.01,30.94,30.91,30.87,30.85,30.77,30.74,30.71,30.66,30.65,30.63,30.60,29.73,29.62,29.45,29.27,23.89,14.61(末端ch3)。
[0491]
实例5-由c
23 12-二十三烷酮开始合成其中a由a-1表示的化合物、具体地式vii的化合物
[0492]
还原胺化以提供伯胺
[0493]
所有反应在惰性氩气气氛下进行。
[0494]
在配备有磁力搅拌器、冷凝器、温度探针和加热器的5l三颈圆底烧瓶中,制备二十三烷-12-酮(100g,0.295mol,1当量)在700ml的甲醇中的溶液。
[0495]
然后将nh4oac(227.386g,2.95mol,10当量)、随后nacnbh3(74.15g,1.18mol,4当量)以小份添加至混合物中。将反应介质在室温下搅拌1小时。最终,将混合物在回流下加热
16小时。然后将反应介质冷却至室温并在真空下浓缩。
[0496]
最终,将500ml的饱和nahco3水溶液和500ml的甲基叔丁基醚(mtbe)添加至残余物中并将混合物在室温下搅拌一小时。添加浓naoh水溶液以将ph调节至约9。用mtbe萃取产物并将有机相用水和盐水洗涤数次。将有机相用k2co3干燥、过滤并在真空下浓缩以提供100.4g的粗黄色油。
[0497]
然后将粗品通过经硅胶的快速柱层析纯化,使用二氯甲烷(dcm):甲醇混合物作为洗脱液,以从dcm:meoh=100:1至dcm:meoh=10:1+1%et3n的梯度进行。溶剂蒸发之后,获得93.5g(0.275mol)的纯的浅黄色油。
[0498]
收率:93%
[0499]
伯胺的烷基化以提供氨基-二酯中间体
[0500]
反应在惰性氩气气氛下进行。
[0501]
在配备有冷凝器、温度探针、磁力搅拌器和加热器的1l圆底烧瓶中添加:62.0g(0.18mol,1当量)的c
23
脂肪伯胺。700ml的甲基-thf。63.7g的2-氯乙酸甲酯(0.59mol,3.3当量)。
[0502]
81.5g的k2co3(0.59mol,3.3当量)。97.94g的ki(0.59mol,3.3当量)。
[0503]
然后允许混合物在回流下(78℃-80℃)搅拌一夜。
[0504]
在反应结束时,将混合物过滤并在真空下浓缩以给出98.0g的仍含有2-氯乙酸甲酯的粗物料。
[0505]
然后通过经硅胶的使用石油醚:乙酸乙酯混合物(50:1)作为洗脱液的快速柱层析纯化产物,以在溶剂蒸发之后提供52g的纯物料(0.108mol)。
[0506]
收率:60%
[0507]
酯水解以提供亚氨基二乙酸中间体。
[0508]
在配备有磁力搅拌器的2l圆底烧瓶中添加:27.3g的naoh(0.683mol,6.0当量)300ml的水300ml的甲醇300ml的thf
[0509]
然后允许所获得的溶液在0℃下搅拌并缓慢添加55g的氨基-二酯(0.113mol,1当量)。
[0510]
然后将反应介质在室温下搅拌过夜。
[0511]
在反应结束时,通过添加浓hcl溶液将ph从11调节至1,并将产物用3l的二氯甲烷萃取两次。
[0512]
收集有机相并用盐水洗涤数次、经mgso4干燥、过滤并在真空下蒸发溶剂以提供55g的产物,其按原样用于下一步骤。
[0513]
定量的收率
[0514]
用二甲基氨基乙醇酯化以提供二酯中间体
[0515]
反应在惰性氩气气氛下进行。
[0516]
在配备有磁力搅拌器的2l圆底烧瓶中添加:53.3g(0.117mol,1当量)的亚氨基二乙酸中间体2l的二氯甲烷104.2g的二甲基氨基乙醇(1.17摩尔,10当量)142g的三甲胺(1.40摩尔,12当量)189.7g的hobt(1.40摩尔,12当量)
[0517]
允许混合物冷却至0℃并将220g的edci(1.15摩尔,10当量)添加进反应容器中。
[0518]
允许混合物在室温下搅拌二十小时,允许反应完成。
[0519]
然后将反应混合物用水洗涤并将有机相经mgso4干燥、过滤并在真空下蒸发以提供118g的呈深黄色油的粗产物。
[0520]
然后将粗物料通过经硅胶的快速柱层析纯化,首先使用石油醚:ch2cl2混合物(9:1)作为洗脱液并且然后使用ch2cl2:异丙醇(50:1)+1.5%net3混合物。
[0521]
获得两种级分:第一级分含有31.0g的产物并且第二级分含有35g的物料。
[0522]
然后将第二级分纯化第二次以提供29.2g的深黄色油。
[0523]
总共获得60.2g(101摩尔的)的呈黄色油的纯产物。
[0524]
收率:86%
[0525]
季铵化以获得式(vii)的化合物
[0526]
所有反应在小心干燥的容器中和在惰性氩气气氛下进行。
[0527]
按原样使用新鲜的市售无水thf和硫酸二甲酯。
[0528]
在配备有机械搅拌器(具有四个倾斜犁片的螺旋桨)、冷凝器、加料漏斗和温度探针的200ml双夹套反应器中添加100ml的干燥thf和8.0ml的硫酸二甲酯(10.6g,84mmol,2当量)。在加料漏斗中制备25.2g的酯胺(42mmol,1当量)在154ml的thf中的溶液并在室温下在搅拌下将其逐步添加至反应器中以便限制温度升高。然后将混合物在室温下在氩气下搅拌,并通过nmr分析监测反应进程。在室温下搅拌一小时之后完成反应,并在真空下去除所有挥发物(thf和剩余的dms)以便以定量的收率提供35.7g的呈米黄色蜡的产物。
[0529]1h nmr(meod,400mhz)δ(ppm):4.59-4.50(m,4h),3.78-3.71(m,4h),3.68(s,6h),3.59-3.51(brs,4h),3.25(s,18h),2.68-2.54(m,1h),1.60-1.00(m,40h),0.90(t,j=6.4hz,6h)。
[0530]
13
c nmr(meod,101mhz)δ(ppm):173.02,66.13,65.49,59.35,55.26,54.69,54.34,33.23,32.82,31.04,30.95,30.93,30.91,30.63,28.27,23.89,14.61(末端ch3)。
[0531]
实例6-由c
31 16-三十一烷酮开始合成其中a由a-1表示的化合物、具体地式vii的化合物
[0532]
还原胺化以提供伯胺。
[0533]
按照与以上实例5中对于c
23
衍生物所描述的相同的方案。
[0534]
伯胺的烷基化以提供氨基-二酯中间体。
[0535]
反应在惰性氩气气氛下进行。
[0536]
在配备有冷凝器、温度探针、磁力搅拌器和加热器的500ml圆底烧瓶中添加:18.0g(40毫摩尔,1当量)的c
31
脂肪伯胺。500ml的甲基-thf。12.48g的2-氯乙酸甲酯(132毫摩尔,3.3当量)。18.24g的k2co3(132毫摩尔,3.3当量)。21.92g的ki(132mol,3.3当量)。
[0537]
然后允许混合物在回流下(78℃-80℃)搅拌一夜。
[0538]
在反应结束时,将混合物经硅藻土的塞过滤。用thf洗涤固体并在真空下浓缩滤液以提供仍含有2-氯乙酸甲酯的粗物料。
[0539]
然后通过经硅胶的使用石油醚:乙酸乙酯混合物(100:1)作为洗脱液的快速柱层析纯化产物,以在溶剂蒸发之后提供22.4g的纯物料(37.6摩尔)。
[0540]
收率:94%
[0541]
酯水解以提供亚氨基-二乙酸中间体。
[0542]
在配备有磁力搅拌器的1l圆底烧瓶中添加:11.3g的naoh(0.282mol,6.0当量)100ml的水100ml的甲醇100ml的thf
[0543]
然后允许所获得的溶液在0℃下搅拌并缓慢添加28g的氨基-二酯(0.047mol,1当量)。
[0544]
然后将反应介质在室温下搅拌过夜。
[0545]
在反应结束时,通过添加1m hcl水溶液将ph从11调节至2,并将产物用二氯甲烷萃取。
[0546]
收集有机相并用盐水洗涤数次,并最终浓缩。将残余物再溶解于thf中并将有机溶液经mgso4干燥、过滤,并在真空下蒸发溶剂以提供26g的产物(45.8毫摩尔),将其按原样用于下一步骤。
[0547]
收率:97%。
[0548]
用二甲基氨基乙醇酯化以提供二酯中间体。
[0549]
按照与实例5中对于c
23
衍生物所描述的相同的方案。
[0550]
季铵化以获得式vii的化合物
[0551]
按照与实例5中对于c
23
衍生物所描述的相同的方案。
[0552]1h nmr(meod,400mhz)δ(ppm):4.52-4.36(m,4h),3.71-3.61(m,4h),3.58(s,6h),3.46-3.39(brs,4h),3.15(s,18h),2.58-2.39(m,1h),1.60-1.00(m,56h),0.80(t,j=
6.8hz,6h)。
[0553]
13
c nmr(meod,101mhz)δ(ppm):173.09,66.09,65.23,59.31,55.25,54.69,54.29,33.25,32.82,31.03,30.99,30.96,30.91,30.87,30.66,28.24,28.13,23.91,14.68(末端ch3)。
[0554]
实例7-由16-三十一烷酮开始合成式(viii)的化合物
[0555]
还原胺化以提供氨基二醇中间体
[0556]
反应在惰性氩气气氛下进行。
[0557]
在配备有机械搅拌器(具有四个倾斜犁的螺旋桨)、冷凝器和温度探针的1l双夹套反应器中添加:50g的16-三十一烷酮(111毫摩尔,1当量)281ml的chcl317.73ml的3-氨基-1,2-丙二醇(20.8g,222毫摩尔,2当量)
[0558]
然后将混合物在室温下搅拌并且将54.71ml的ti(oet)4(59.52g,222毫摩尔,2当量)添加进反应器中。然后将混合物在65℃下搅拌过夜,并且观察到在反应的过程期间混合物变得均匀。
[0559]
在反应结束时,将温度冷却至40℃并将56ml的无水甲醇添加进反应器中,随后小心且缓慢地添加8.74g的nabh4(222毫摩尔,2当量)。注意避免在nabh4添加期间起泡。
[0560]
然后将反应介质在40℃下搅拌三小时。
[0561]
然后将混合物冷却至室温并添加100ml的水,随后添加100ml的乙醚。在水添加期间,发生tio2的沉淀。
[0562]
将悬浮液过滤,将固体用乙醚洗涤数次并分离两相滤液。将有机相再次经硅藻土过滤并用水和盐水洗涤。然后将有机相经mgso4干燥、过滤并蒸发以提供呈黄色糊的粗物料(48.9g)。
[0563]
然后将粗品通过经硅胶的快速柱层析纯化,使用chcl3:异丙醇混合物作为洗脱液,以从100:0至50:50的梯度进行。
[0564]
溶剂蒸发之后,获得28.75g的纯产物(54.70毫摩尔)。
[0565]
收率:49%
[0566]1h nmr(meod,400mhz)δ(ppm):3.78-3.64(m,1h),3.62-3.42(m,2h),2.78(dd,j=11.6hz,j=3.6hz,1h),2.62-2.40(m,2h),1.70-1.11(m,56h),0.90(t,j=6.4hz,6h)。
[0567]
13
c nmr(meod,101mhz)δ(ppm):71.78,66.46,59.03,51.08,34.67,33.26,31.08,31.04,30.97,30.95,30.92,30.83,30.80,30.66,26.87,26.85,23.91,14.62(末端ch3)。
[0568]
用甘氨酸甜菜碱酯化以提供式viii的季铵化合物
[0569]
所有反应在小心干燥的容器中和在惰性氩气气氛下进行。
[0570]
按原样使用市售的无水thf、无水甲苯和用戊烯稳定的无水chcl3。
[0571]
在使用前,通过用无水thf洗涤数次、随后在真空下干燥来干燥甘氨酸甜菜碱盐酸化物。
[0572]
在配备有冷凝器、连接至naoh阱的蒸馏装置、温度探针、磁力搅拌器和加热器的250ml四颈圆底烧瓶中添加:7.13g的甜菜碱盐酸化物(46.4mmol)
[0573]
然后将10ml的socl2(16.38g,136.9mmol)小心地引入反应器容器中,并在搅拌下将所得悬浮液逐步加热至70℃。观察到当温度达到68℃时,释放气体(so2和hcl)并且混合物均匀地变成黄色。
[0574]
然后允许混合物在70℃下搅拌两小时,并将热的无水甲苯(25ml,80℃)添加进容器中。将混合物搅拌并在0℃下倾析以使甜菜碱酰氯沉淀。然后通过套管去除甲苯的上层相,重复甲苯洗涤的操作四次以便去除所有过量的socl2。
[0575]
nmr分析示出甘氨酸甜菜碱盐酸化物的完全转化,但也形成了nme3·
hcl加合物(固体中nme3·
hcl含量:19.3mol%)。
[0576]
然后将20ml的chcl3添加至固体甜菜碱酰氯中。
[0577]
然后制备脂肪二醇(9.85g,18.7mmol)在30ml的chcl3中的溶液,并在-3℃以避免反应介质的温度超过5℃的速率滴加至甜菜碱酰氯/chcl3悬浮液中。在添加结束时,允许混合物在室温下升温,并且然后在50℃下搅拌过夜。
[0578]
然后在30℃下在真空下去除所有挥发物以提供16g的米黄色蜡。
[0579]
nmr分析示出所得产物的纯度是约73wt%(剩余副产物是:质子化的起始醇、nme3·
hcl、甜菜碱盐酸化物和单酯)。
[0580]
收率:75%(14毫摩尔)
[0581]1h nmr(cdcl
3-meod,400mhz)δ(ppm):5.55-5.63(m,1h),4.93(d,j=16.8hz,1h),4.92(d,j=16.8hz,1h),4.81(d,j=16.8hz,1h),4.70(d,j=16.8hz,1h),4.49(dd,j=12hz,j=3.6hz,1h),4.39(dd,j=12hz,j=6.4hz,1h),3.36(s,9h),3.33(s,9h),3.32-3.28(m,2h),1.80-1.45(m,4h),1.45-1.10(m,52h),0.84(t,j=6.8hz,6h)。
[0582]
13
c nmr(meod,101mhz)δ(ppm):166.06,71.18,65.29,64.59,64.28,61.35,54.99,54.87,45.99,45.55,33.24,30.96,30.93,30.91,30.80,30.64,30.61,30.60,26.34,26.21,23.89,14.61(末端ch3)。
[0583]
实例8-由c
31 16-三十一烷酮开始合成其中a由a-5表示并且对应于式(ix)的季铵化合物
[0584]
根据美国专利10035746、实例4中所描述的方案由棕榈酸获得c
31
内烯烃。
[0585]
内烯烃环氧化成脂肪环氧化物
[0586]
反应在惰性氩气气氛下进行。
[0587]
在配备有机械搅拌器(具有四个倾斜犁片的螺旋桨)、冷凝器、加料漏斗和温度探针的1l双夹套反应器中添加61.9g的c
31
烯烃(0.142mol),随后添加16.3ml(17.1g,0.285mol)的乙酸和13.6g(22wt%)的ir 120h树脂。将混合物加热至65℃以熔融脂肪烯烃。开始搅拌,并且然后使用加料漏斗以避免显著温度升高的速率缓慢添加21.8ml(24.2g,0.214mol)的h2o2的水溶液(浓度30%)至混合物中。这需要约一小时。然后将温度升高至75℃并允许反应混合物搅拌过夜(15min之后,nmr分析示出转化率水平已经是
约60%,具有99%选择性)。然后缓慢添加另外10.2ml(11.3g,0.1mol)的h2o2的水溶液(30%),并在第二次添加h2o2后4小时之后,nmr分析示出转化率水平是约88%(98%选择性)。最终进行另外添加8.14ml的乙酸(8.55g,0.142mol)、随后添加11.6ml的30%h2o2(12.91g,0.114mol),以便提高转化率水平。
[0588]
允许混合物在75℃下搅拌第二夜。
[0589]
最终,nmr分析示出93%的转化率水平(95%选择性)。
[0590]
允许混合物冷却至室温并且然后添加300ml的氯仿。将混合物转移至分液漏斗中并用300ml的水洗涤有机相三次,并且然后用100ml的氯仿萃取水相两次。固体催化剂留在水相中并且在与水相的第一分离期间被去除。收集有机相、经mgso4干燥、过滤并蒸发以给出65.3g的白色固体,具有91%w/w的纯度(环氧化物+二元醇)。
[0591]
考虑到纯度,收率是92%。
[0592]1h nmr(cdcl3,400mhz)δ(ppm):2.91-2.85(m,2h,非对映异构体1),2.65-2.6(m,2h,非对映异构体2),1.53-1.00(m,54h),0.86(t,j=6.8hz,6h)。
[0593]
13
c nmr(cdcl3,101mhz)δ(ppm):58.97,57.28,32.18,31.96,29.72,29.6,29.4,27.86,26.95,26.63,26.09,22.72,14.15(末端ch3)。
[0594]
水解脂肪环氧化物以提供脂肪二醇
[0595]
反应在惰性氩气气氛下进行。
[0596]
在配备有机械搅拌器(具有四个倾斜犁片的螺旋桨)、冷凝器和温度探针的1l双夹套反应器中添加82.9g的c
31
环氧化物(纯度:94.5wt%,0.174mol),随后添加480ml的甲基-thf。
[0597]
允许混合物在室温下搅拌并且然后添加73ml的h2so4的3m水溶液。然后将反应介质在80℃下搅拌90分钟。nmr分析示出反应完成。允许两相混合物冷却至室温并分离有机相。然后在真空下去除溶剂并将残余物悬浮于200ml的乙醚中。过滤悬浮液并将所得固体用50ml的乙醚洗涤3次。最终将白色固体用50ml的甲醇洗涤2次并在真空下干燥以去除痕量的溶剂。
[0598]
最后,获得75.53g的呈白色粉末的产物,具有95.7%w/w的纯度,对应于89%的收率。
[0599]1h nmr(cdcl3,400mhz)δ(ppm):3.61-3.55(m,2h,非对映异构体1),3.43-3.25(m,2h,非对映异构体2),1.88(brd,j=2.4hz,oh,非对映异构体2),1.72(brd,j=3.2hz,oh,非对映异构体1),1.53-1.10(m,54h),0.86(t,j=6.8hz,6h)。
[0600]
13
c nmr(cdcl3,101mhz)δ(ppm):74.71,74.57,33.66,31.96,31.23,29.71,29.39,26.04,25.68,22.72,14.15(末端ch3)
[0601]
用三甲基甘氨酸酯化脂肪二醇以提供式ix的化合物
[0602]
所有反应在小心干燥的容器中和在惰性氩气气氛下进行。
[0603]
按原样使用新鲜的市售无水chcl3(戊烯稳定的)和无水甲苯。
[0604]
在使用前,将甜菜碱盐酸化物(19.66g,128.4毫摩尔)用20ml的无水thf洗涤十次,
随后在真空下干燥以去除痕量的溶剂。
[0605]
在配备有磁力搅拌器、加热器、冷凝器、温度探针和连接至naoh的两个阱的弯曲的蒸馏柱的100ml四颈圆底烧瓶中快速添加:19.66g的干燥的甜菜碱盐酸化物(128.4毫摩尔)和28ml的socl2(45.86g,0.386mol)。
[0606]
搅拌不均匀的混合物并且然后将温度缓慢升至70℃。观察到当温度达到68℃时,释放气体(so2和hcl)并且混合物变成均匀的黄色。
[0607]
然后允许混合物在70℃下搅拌两小时,并将热的无水甲苯(25ml,80℃)添加进容器中。搅拌混合物并且然后在0℃下倾析(白色-黄色沉淀物形成),并通过套管去除甲苯的上层相。重复甲苯洗涤的操作七次以去除所有过量的socl2。nmr分析示出甘氨酸甜菜碱盐酸化物的完全转化,但也形成了nme3·
hcl加合物(固体中nme3·
hcl含量:12.3mol%)。
[0608]
然后将20ml的干燥chcl3添加至固体甜菜碱酰氯中。
[0609]
在55℃下制备26.19g(56mmol)的脂肪二醇在90ml的无水chcl3中的溶液,并在室温下在搅拌下滴加至反应容器中(观察到放热性和hcl的排放)。然后允许混合物在55℃下搅拌过夜。在反应的过程中,混合物均匀地变成橙色。nmr分析示出转化率水平是约100%。
[0610]
然后允许混合物冷却至室温并在真空下蒸发溶剂。
[0611]
在0℃下将残余物溶解于甲醇中并将所形成的沉淀物过滤出。然后将所获得的滤液蒸发以给出39.7g的粗产物。
[0612]
然后将该产物沉积在烧结式过滤器上并用环己烷洗涤以去除一些残留的有机杂质。将所得洗涤的固体在真空下干燥以提供22g的粗物料。用ch2cl2/环己烷50:50的混合物进行最终纯化;在50℃下将固体再次溶解在该溶剂混合物中并允许其冷却至室温。将所形成的沉淀物过滤出并在蒸发滤液之后获得19g的具有以下组成的米黄色蜡:95wt%的甘氨酸甜菜碱二酯1.5wt%的甜菜碱甲酯2wt%的三甲胺盐酸化物1.5wt%的甘氨酸甜菜碱盐酸化物。
[0613]
纯化收率是44%。
[0614]1h nmr(meod-d4,400mhz)δ(ppm):5.3-5.2(m,2h),4.68(d,j=16.8hz,2h),4.50(d,j=16.8hz,2h),4.53(s,1h),4.48(s,1h),3.37(s,18h),1.75-1.55(m,4h),1.39-1.10(m,50h),0.9(t,j=6.8hz,6h)。
[0615]
13
c nmr(meod-d4,101mhz)δ(ppm):164.58,75.76,62.43,53.10,31.68,30.05,29.41,29.38,29.33,29.28,29.15,29.09,28.96,24.71,22.34,13.05(末端ch3)。
[0616]
实例9-对纳米纤维素晶体的吸附特性的评价
[0617]
阳离子表面活性剂在带负电的表面上的吸附对于各种应用是重要的特性。该特性与在水性介质中的悬浮液中产生带负电的纤维素纳米晶体(cnc)的聚集所需的阳离子表面活性剂的最小浓度有关。可以通过动态光散射(dls)监测聚集体尺寸的比较。
[0618]
按照文献(e.k.oikonomou等人,j.phys.chem.b[物理化学杂志b],2017,121(10),第2299-2307页)中所描述的方案,通过监测在水溶液中在固定的[表面活性剂]+[cnc]=0.01wt%下诱导纤维素纳米晶体聚集所需的比率x=[表面活性剂]/[cnc]或质量分数m=
[表面活性剂]/([表面活性剂+[cnc])来研究季铵的吸附特性。
[0619]
cnc聚集的范围对应于引发cnc的聚集的比率x(或m)的范围,即通过dls测量的聚集体尺寸高于cnc的纯水溶液或在0.01wt%处的表面活性剂的水溶液的范围。
[0620]
cnc的聚集的x和m的范围总结在表1中。聚集x或m的范围越低,在带负电的表面上的吸附特性越好
[0621]
表1
[0622]
tep用作对比。tep是表示基准的市售表面活性剂。
[0623]
数据示出,与市售表面活性剂tep相比,根据本发明的化合物的表面活性剂特性是优异的。
[0624]
就纤维素纳米晶体的吸附而言,实例2和5至8的化合物的特性与实例1、3和4的化合物的特性类似,其值在表1中给出。
[0625]
实例10-生物降解性的确定根据301f oecd方案已经测量了测试物质的生物降解性。
[0626]
在闭合烧瓶(oxitop
tm
呼吸测量烧瓶)中在恒温(20
±
2℃)下,将作为有机碳的标称唯一来源的、测定体积的接种的矿物培养基(其含有已知浓度的测试物质以便达到约50至100mg thod/l(理论需氧量))搅拌至多28天。在该测试中使用oxitop
tm
呼吸测量瓶以便获得测试样品的生物降解性:密封培养bod烧瓶在20
±
2c的温度下使用28天。
[0627]
释放的二氧化碳被瓶的顶部空间中存在的氢氧化钠或氢氧化钾颗粒吸收。生物降解过程(测试物质的生物氧化)期间被微生物种群吸收的氧的量(=以mg/l表示的氧消耗)降低了顶部空间的压力(通过压力开关测量的δp),并以mg消耗的o2/升进行数学转换。接种物对应于在矿物培养基(zw培养基)中洗涤以便降低doc(溶解氧碳)含量的城市活性污泥。含有参照物质乙酸钠的对照溶液以及毒性对照(测试物质+参照物质)用于确认目的。在一个瓶中(对应于100mg thod/l的129mg/l的标称浓度)已经测试了参照物质乙酸钠以便检查接种物的生存能力。毒性对照对应于参照物质和测试物质的混合物;它将检查测试物质是否对接种物有毒(如果是,则必须以更低的测试物质浓度重新进行测试,如果关于方法的灵敏度可行的话)。
[0628]
由于本发明的物质对于它们中的大多数不是非常可溶于水的(如果一些可溶于水,则它们的水解之后含有烷基链的代谢物在水中通常具有非常低的溶解度),我们使用称为“乳液方案”的具体方案。该方案使我们能够提高我们有接种物的水相中水溶性差的物质
的生物利用度。
[0629]
乳液方案包括通过在乳液中制备的储备溶液将测试物质添加在瓶中。
[0630]
乳液是溶解在不可生物降解的表面活性剂(1g/l的pe 105)中的测试物质的储备溶液的50/50v/v混合物,并且然后与矿物硅油ar 20(西格玛)混合。
[0631]
测试物质在不可生物降解的表面活性剂溶液中的第一次溶解通常需要磁力搅拌器搅拌,随后超声处理。
[0632]
一旦溶解完成,我们将水溶液与矿物硅油以50/50体积/体积比混合。通过磁力搅拌器搅拌维持该乳液并取样用于添加在相应的瓶中,以便达到所需的测试物质浓度。
[0633]
在测试期间平行运行两个乳液对照以便从含有通过乳液储备溶液添加的测试物质的乳液瓶中去除它们的值。
[0634]
生物降解性测试的结果总结于表2中以下项的化合物28天之后的生物降解性实例20%(oecd 301f)实例317%(oecd 301d)实例715%(oecd 301f)实例892%(oecd 301f)
[0635]
结果示出实例8的化合物在工作实例中使用的化合物之中具有最佳的生物降解性,即根据本发明的化合物(其中a由a-5表示并且具体地式ix的化合物)的生物降解性高于其他化合物。获得该有益效果而不会不利地影响化合物的表面活性剂特性。
[0636]
实例11-由16-三十一烷酮开始合成季二铵化合物
[0637]
16-三十一烷酮购自tci,但可以按照us 2018/0093936中所描述的皮里亚酮化方案由棕榈酸获得。
[0638]
16-三十一烷酮氢化成16-三十一烷醇
[0639]
在配备有机械搅拌器(rushton涡轮机)的100ml高压釜中添加:-4.36g的ru/c(4.87%ru)催化剂(相对于酮5wt%的干燥催化剂,含有54.9%h2o的催化剂)-39.3g(87.2mmol)的熔融的c
31
酮。
[0640]
反应在20巴氢气压力下进行。进行4次氮气吹扫,随后在20巴下进行氢气的3次吹扫。然后将反应混合物的温度设定在100℃以熔化酮底物。使温度在100℃下保持10min并以200rpm缓慢开始搅拌。当确认适当的搅拌时,将搅拌速率增加至1200rpm并将温度设定在150℃。
[0641]
在150℃下6h反应时间之后,停止加热并允许混合物在搅拌的同时在90℃下冷却。然后停止搅拌。将混合物冷却至室温并将高压釜小心地减压。
[0642]
粗品在cdcl3中的nmr分析示出酮转化率水平》99%并且脂肪醇的摩尔纯度为99%。将含有产物和催化剂的致密固体研磨成粉末并且然后引入1l烧瓶中。添加500ml的氯仿并且然后将烧瓶在60℃下加热以完全溶解醇。将悬浮液在60℃下经硅藻土过滤。在60℃下用热氯仿冲洗固体滤饼数次。将滤液蒸发以给出35.6g(78.7mmol)的所期望的c
31
脂肪醇的重量纯度约99%的白色粉末,对应于90%分离收率。
[0643]
16-三十一烷醇脱水成内烯烃
[0644]
反应在惰性氩气气氛下进行。在配备有加热垫、机械搅拌器(通过用inox ss316l 3d打印制造的a320-型搅拌移动装置)、连接至50ml双颈馏出物收集烧瓶的冷凝器和温度探针的200ml石英反应器中添加:-56.1g的c
31
脂肪醇(124mmol,1当量)-5.61g(10wt%)的al2o
3-η。
[0645]
然后将反应介质的温度升高至150℃以使醇熔融并开始搅拌(约500rpm)。最终,将温度设定在300℃并允许混合物在氩气下以1000rpm搅拌。由于使用硼硅酸盐玻璃管的nmr分析监测反应进程。
[0646]
在300℃下反应2小时之后,在cdcl3中的nmr分析示出脂肪醇的完全转化和作为副产物已经形成的1.5mol%酮的存在。
[0647]
然后停止搅拌和加热。将温度降低至80℃并将熔融的粗品转移至烧杯中。用氯仿(al2o3是不可溶的)冲洗反应器容器和搅拌移动装置。将悬浮液过滤并在真空下蒸发溶剂以提供52.24g(120.2mmol)的透明油,其在室温下变成白色固体(99wt%纯度),对应于97%分离收率(nmr)。
[0648]1h nmr(cdcl3,400mhz)δ(ppm):5.38-5.29(m,2h),2.03-1.93(m,4h),1.35-1.19(m,48h),0.86(t,j=6.8hz,6h)。
[0649]
13
c nmr(cdcl3,101mhz)δ(ppm):130.6,130.13,32.84,32.16,30.01,29.93,29.8,29.6,29.55,29.4,22.93,14.35(末端ch3)。
[0650]
内烯烃环氧化成环氧乙烷
[0651]
反应在惰性氩气气氛下进行。在配备有机械搅拌器(具有四个倾斜犁片的螺旋桨)、冷凝器和温度探针的双夹套的1l反应器中添加92.4g的c
31
烯烃(0.212mol),随后添加18.2ml(19.1g,0.319mol)的乙酸和27.7g(30wt%)的ir 120h树脂。
[0652]
将混合物加热至75℃以便熔融脂肪烯烃。然后开始搅拌,并使用加料漏斗将32.6ml(36.1g,0.319mol)的30%h2o2水溶液缓慢添加进混合物中,同时监测反应物质温度以避免温度升高。添加需要约一小时。
[0653]
在h2o2添加结束之后,将温度升高至85℃并且由于nmr分析而跟踪反应进程。在4小时反应时间之后,烯烃转化率水平是》99%,对所期望的环氧化物的选择性约99%(在反应期间还形成了痕量的有价值的二醇)。
[0654]
然后停止加热并在温度是约50℃时向反应容器中添加300ml的氯仿。将混合物转移至分液漏斗。将有机相用300ml的水洗涤3次。然后,将水相用100ml的氯仿萃取两次。在与水相的相分离期间去除树脂。将有机相经mgso4干燥、过滤并蒸发以给出95.3g的白色固体,具有98%w/w的纯度(环氧化物+二醇)。考虑到纯度,收率是97%。
[0655]1h nmr(cdcl3,400mhz)δ(ppm):2.91-2.85(m,1.5h),2.65-2.6(m,0.5h),1.53-1.36(m,4h),1.35-1.19(m,48h),0.86(t,j=6.8hz,6h)。
[0656]
13
c nmr(cdcl3,101mhz)δ(ppm):58.97,57.28,32.18,31.96,29.72,29.6,29.4,27.86,26.95,26.63,26.09,22.72,14.15(末端ch3)。
[0657]
与氯乙酸缩合(用h2so4作为任选的催化剂)
[0658]
反应在惰性氩气气氛下在配备有磁力搅拌器、加热器、冷凝器、温度探针和绝热加料漏斗的500ml三颈圆底烧瓶中进行。在圆底烧瓶本身中添加128.7g的氯乙酸(1.35摩尔,8
当量)。在维持在65℃的隔热加料漏斗中添加77.8g的熔融的脂肪环氧化物(98wt%纯度,0.169摩尔,1当量)。
[0659]
中间体羟基-酯形成的第一步骤在65℃下通过将脂肪环氧化物缓慢添加进氯乙酸中进行,以便限制酮和环氧化物自缩合副产物的形成。因此在65℃下在搅拌下经30分钟将脂肪环氧化物滴加进含有氯乙酸的反应器中。
[0660]
在添加结束时,允许混合物在65℃下再搅拌20min。nmr分析示出起始环氧化物的转化率水平》99%。
[0661]
然后,为了形成最终的双酯,将0.19ml的95%h2so4(3.37mmol,2mol%)添加进反应器中并将冷凝器用弯曲的蒸馏柱代替。
[0662]
允许混合物在140℃下在轻真空(800毫巴)下搅拌3h30,以便去除在酯化反应期间作为副产物形成的水。
[0663]
在140℃下3h30之后,nmr分析示出83mol%的选择性(单酯+双酯)和以下近似粗混合物组成:80mol%的双酯、3mol%的单酯、2mol%的酯化的二聚体和4mol%的酮。
[0664]
然后将混合物在室温(约23℃)下冷却并添加300ml的甲苯。将溶液转移进分液漏斗中,并将有机相用500ml的naoh水溶液(0.3m)洗涤3次以去除过量的氯乙酸。将有机相经mgso4干燥、过滤并且然后蒸发以给出102.7g的粗产物。
[0665]
通过将油溶于乙醇中(起始酮不溶于乙醇)、随后经硅藻土过滤,可以容易地纯化产物。将滤液蒸发以提供94g的黑色油,具有89wt%的双酯纯度,对应于80%的分离收率(rmn)。
[0666]1h nmr(cdcl3,400mhz)δ(ppm):5.11-5.02(m,2h),4.04(s,异构体1,2h),4.03(s,异构体2,2h),1.66-1.49(m,4h),1.43-1.19(m,50h),0.86(t,j=6.8hz,6h)。
[0667]
13
c nmr(cdcl3,101mhz)δ(ppm):167.14,167,76.22,75.83,40.92,40.82,31.96,30.6,29.72,29.69,29.63,29.54,29.39,29.33,29.28,28.85,25.47,24.96,22.72,14.15(末端ch3)。
[0668]
与氯乙酸缩合(用三氟甲磺酸作为任选的催化剂)
[0669]
反应在惰性氩气气氛下在配备有磁力搅拌器、加热器、冷凝器、温度探针和绝热加料漏斗的500ml三颈圆底烧瓶中进行。在圆底烧瓶本身中添加85.63g的氯乙酸(0.897mol,5当量)。在隔热加料漏斗中添加83.3g的熔融的脂肪环氧化物(97wt%纯度,0.179mol,1当量)。
[0670]
单酯形成的第一步骤在65℃下在无三氟甲磺酸的情况下进行以限制酮和脱水副产物的形成。因此在65℃下在搅拌下经2h将脂肪环氧化物滴加进含有氯乙酸的反应器中以限制脂肪环氧化物的自缩合。在添加结束时,使混合物在65℃下在搅拌下再放置一小时。nmr分析示出起始环氧化物的转化率水平》99%。
[0671]
为了形成双酯,然后将3.2μl的99%三氟甲磺酸(0.036mmol,0.02mol%)添加进反应混合物中。将冷凝器用弯曲的蒸馏柱替换,并允许混合物在140℃下在轻真空(975毫巴)下搅拌5h00,以便去除作为酯化反应的副产物形成的水。
[0672]
5h00之后,nmr分析示出88mol%的选择性(单酯+双酯)以及82mol%的双酯、6mol%的单酯,5mol%的酯化的二聚体和3mol%的酮的组成。
[0673]
然后将真空增加至800毫巴并逐步增加至10毫巴以便蒸馏氯乙酸、三氟甲磺酸催
化剂并完成单酯向双酯的转化。
[0674]
一旦所有氯乙酸已经蒸馏出(通过nmr分析验证),允许混合物在室温下冷却并恢复大气压。将粗油转移进烧瓶中用于纯化。通过将油溶于乙醇中(起始酮不溶于乙醇)、随后经硅藻土过滤,可以容易地纯化产物。将滤液蒸发以提供107.3g的黑色油,具有93wt%的双酯纯度,对应于89%的分离收率。
[0675]1h nmr(cdcl3,400mhz)δ(ppm):5.11-5.02(m,2h),4.04(s,异构体1,2h),4.03(s,异构体2,2h),1.66-1.49(m,4h),1.43-1.19(m,50h),0.86(t,j=6.8hz,6h)。
[0676]
13
c nmr(cdcl3,101mhz)δ(ppm):167.14,167,76.22,75.83,40.92,40.82,31.96,30.6,29.72,29.69,29.63,29.54,29.39,29.33,29.28,28.85,25.47,24.96,22.72,14.15(末端ch3)
[0677]
用nme3的季铵化反应
[0678]
反应在惰性氩气气氛下进行。在配备有机械搅拌器、冷凝器和温度探针的1l双夹套反应器中添加:-107.3g(93wt%纯度,0.16mol,1当量)的氯乙酸双酯c
31-687ml(1.28mol,8当量)的三甲胺(nme3)在thf(约2mol/l)中的溶液,其在前一天预先在活化的分子筛上干燥。
[0679]
将反应混合物在40℃下加热并以1000rpm开始搅拌。6h之后,在d
4-meoh中的nmr分析示出起始双酯的转化率水平》99%,其中甘氨酸甜菜碱双酯的摩尔组成为约86mol%。使反应器排干,用ch2cl2冲洗,并在真空下蒸发挥发物。
[0680]
将棕色固体变成粉末、沉积在烧结式过滤器上并用200ml的乙酸乙酯洗涤5次。在真空下干燥固体。
[0681]
然后,将产物转移进配备有机械搅拌器、冷凝器、加热器和温度探针的1l反应器中。将产物溶解在800ml的氯仿中并添加150g的活性炭颗粒。将混合物在40℃下搅拌2小时以便使产物变白。
[0682]
2h之后,将悬浮液经硅藻土过滤并将溶剂蒸发以提供109g的棕色蜡,其具有约95wt%的式(ix)的季二铵化合物、2wt%的季单铵、0.1wt%的c
31
酮和4wt%的醚副产物的重量组成。甘氨酸甜菜碱双酯的纯化收率是约87%。
[0683]
实例12-由c
16-c
18
(30:70)脂肪酸馏分开始合成季二铵化合物
[0684]
皮里亚酮化成c
31-c
35
内酮馏分
[0685]
反应在惰性氩气气氛下在配备有机械搅拌(由用inox ss316l 3d-打印制造的a320-型搅拌移动装置)、隔热加料漏斗、蒸馏装置、加热垫和温度探针的200ml石英反应器中进行。
[0686]
在反应器中引入:-12.5g的mascid
tm
酸1865(来自春金集团(musim mas group)),其由33.7wt%的棕榈酸和65.3wt%的硬脂酸(0.045摩尔的脂肪酸)组成,和-0.935g的mgo(0.023摩尔)。
[0687]
在隔热加料漏斗中添加37.5g的相同的熔融脂肪酸混合物(0.135摩尔)。
[0688]
然后将反应介质的温度升高至250℃。一旦温度达到150℃,开始搅拌(1200rpm)。在250℃下2h00反应时间之后,ftir分析示出起始脂肪酸完全转化成中间体羧酸镁络合物。
[0689]
然后将反应物料的温度进一步升高至330℃,并允许混合物在该温度下搅拌1h30,以便允许中间体羧酸镁络合物分解成所期望的酮。
[0690]
然后,在30分钟内通过加料漏斗将12.5g的熔融的脂肪酸混合物逐步添加进反应器中,并在330℃下将混合物再搅拌1h00。ftir分析示出脂肪酸和镁络合物完全转化成所期望的酮。
[0691]
然后实现另外两个循环:在30分钟内添加12.5g的脂肪酸、随后在330℃下再搅拌1h00。
[0692]
在最后的循环之后,允许混合物在330℃下再搅拌1h00以确保中间体镁络合物完全转化成所期望的酮,这通过ftir分析证实。
[0693]
然后允许反应混合物的温度在室温下冷却并将粗品溶解在热chcl3中。将悬浮液在二氧化硅(70g)的塞上过滤,并将产物进一步用另外量的chcl3洗脱。
[0694]
溶剂蒸发之后,获得41.83g(0.086摩尔)的呈白色蜡的产物,对应于96%的分离收率。
[0695]1h nmr(cdcl3,400mhz)δ(ppm):2.45-2.25(t,j=7.6hz,4h),1.62-1.46(m,4h),1.45-1.05(m,54h),0.86(t,j=6.8hz,6h)。
[0696]
13
c nmr(cdcl3,101mhz)δ(ppm):212.00,43.05,32.16,29.93,29.91,29.88,29.84,29.72,29.65,29.59,29.51,24.13,22.92,14.34(末端ch3)。
[0697]
酮混合物氢化成c
31-c
35
内脂肪醇混合物
[0698]
按照与实例11中在“16-三十一烷酮氢化成16-三十一烷醇”部分下描述的方案相同的方案以优异的收率获得所期望的脂肪醇混合物。
[0699]c31-c
35
脂肪醇脱水成内烯烃
[0700]
所有反应在惰性氩气气氛下进行。
[0701]
在配备有加热垫、机械搅拌器(通过用inox ss316l 3d打印制造的a320-型搅拌移动装置)、被连接至50ml双颈馏出物收集烧瓶的冷凝器包绕和温度探针的200ml石英反应器中添加:-41.3g的c
31-35
脂肪醇(85mmol,1当量),和-4.13g(40mmol,10wt%)的al2o
3-η。
[0702]
将反应介质的温度升高至150℃以使醇熔融并开始搅拌(约500rpm)。然后,将温度设定在300℃并允许混合物在氩气下以1000rpm搅拌。由于使用硼硅酸盐玻璃管的nmr分析监测反应进程。
[0703]
在300℃下反应2小时之后,在cdcl3中的nmr分析示出脂肪醇的完全转化和作为副产物已经形成的1.5mol%的酮的存在。
[0704]
然后停止搅拌和加热并将温度降低至80℃。将熔融的粗品转移至烧杯。用氯仿(al2o3是不可溶的)冲洗反应器容器和搅拌移动装置。
[0705]
将混合物过滤,并将溶剂在真空下蒸发以提供39g的清澈黄色油,其在室温下固化以给出呈蜡的形式的白色固体(98wt%纯度),对应于97%收率(nmr)。
[0706]1h nmr(cdcl3,400mhz)δ(ppm):5.38-5.29(m,2h),2.03-1.93(m,4h),1.35-1.19(m,55h(平均h数目)),0.86(t,j=6.8hz,6h)。
[0707]
13
c nmr(cdcl3,101mhz)δ(ppm):130.6,130.13,32.84,32.16,30.01,29.93,29.8,
29.6,29.55,29.4,22.93,14.35(末端ch3)。
[0708]
环氧化内烯烃以提供c
31-35
环氧乙烷
[0709]
反应在惰性氩气气氛下进行。
[0710]
在配备有机械搅拌器(具有四个倾斜犁的螺旋桨)和折流板、冷凝器和温度探针的300ml双夹套反应器中添加:-38.2g的c
31-35
烯烃(98wt%纯度,80mmol)-6.9ml(7.2g,120mmol)的乙酸,和-11.3g(30wt%)的ir 120h树脂。
[0711]
将混合物加热至75℃以熔融脂肪烯烃。然后开始搅拌,并使用加料漏斗将12.3ml(13.7g,120mmol)的h2o
2 30%缓慢添加进混合物中,同时监测反应介质的温度以防止反应物质的温度升高(放热性)。这需要约20min。在添加期间,由于反应介质的非均相性质,增加搅拌以改善转移。
[0712]
在添加结束时,将反应介质的温度升高至85℃,并且在该温度下搅拌6h10之后,nmr分析示出转化率水平是约99%,具有98%选择性。
[0713]
然后停止加热并在反应物料的温度是约50℃时添加150ml的氯仿。将混合物转移至分液漏斗并将有机相用150ml的水洗涤3次。在相分离期间去除留在水相中的树脂催化剂。将水相用50ml的氯仿萃取两次。将有机相经mgso4干燥、过滤并蒸发以提供39.2g的白色固体,具有98wt%的纯度(环氧化物+二元醇副产物)。考虑到纯度,收率是99%。
[0714]1h nmr(cdcl3,400mhz)δ(ppm):2.91-2.85(m,1.5h),2.65-2.6(m,0.5h),1.53-1.36(m,4h),1.35-1.19(m,55h(平均h数目)),0.86(t,j=6.8hz,6h)。
[0715]
13
c nmr(cdcl3,101mhz)δ(ppm):58.97,57.28,32.18,31.96,29.72,29.6,29.4,27.86,26.95,26.63,26.09,22.72,14.15(末端ch3)。
[0716]
与氯乙酸缩合以提供氯乙酸双酯c
31-35
(用h2so4作为任选的溶剂)
[0717]
反应在惰性氩气气氛下在配备有磁力搅拌器、加热器、冷凝器、温度探针和隔热加料漏斗的250ml三颈圆底烧瓶中进行。在圆底烧瓶本身中添加59.2g的氯乙酸(0.62mol,8当量)。在维持在60℃的隔热滴液漏斗中添加38.3g的熔融的c
31-35
环氧化物(纯度:98wt%,77.6mmol,1当量)。
[0718]
羟基-酯形成的第一步骤在70℃下在无硫酸的情况下进行以限制酮和脱水副产物的形成,并且通过将脂肪环氧化物逐步添加进氯乙酸中以便限制环氧化物自缩合。允许反应混合物在70℃下搅拌以便熔融氯乙酸。
[0719]
然后在搅拌下经1h00将熔融的环氧化物滴加进反应混合物中,以便限制环氧化物的自缩合。
[0720]
在添加结束时,允许混合物在70℃下再搅拌20min。在该阶段,nmr分析示出环氧化物几乎完全转化成中间体单酯。
[0721]
为了单酯转化成双酯,将87μl的95%h2so4(1.6mmol,2mol%)添加进反应混合物中。冷凝器被弯曲的蒸馏柱替换,并允许混合物在140℃下搅拌6h30,同时施加800毫巴真空以促进水去除。6h30反应时间之后,nmr分析示出粗介质的估计组成:-79mol%的双酯-6mol%的单酯-1mol%的酯化的二聚体副产物,和-5mol%的酮副产物。
[0722]
将混合物在室温下冷却并向粗品中添加150ml的甲苯。将有机溶液转移进分液漏斗中并用250ml的naoh水溶液(0.15m)洗涤7次以去除过量的氯乙酸。使用100ml的甲苯将水相萃取2次。
[0723]
收集有机相并用150ml的hcl水溶液(0.1n)洗涤,并且然后用150ml的饱和nacl溶液洗涤。将有机相经mgso4干燥、过滤并且然后蒸发以给出48g的粗产物。
[0724]
通过将油溶于异丙醇中(起始酮不溶于异丙醇)、随后经硅藻土过滤,可以容易地纯化产物。将滤液蒸发以给出45.7g的黑色油,具有91wt%的双酯的估计纯度,对应于81%的收率(rmn)。
[0725]1h nmr(cdcl3,400mhz)δ(ppm):5.11-5.02(m,2h),4.04(s,异构体1,2h),4.03(s,异构体2,2h),1.66-1.49(m,4h),1.43-1.19(m,55h(平均h数目)),0.86(t,j=6.8hz,6h)。
[0726]
13
c nmr(cdcl3,101mhz)δ(ppm):167.14,167,76.22,75.83,40.92,40.82,31.96,30.6,29.72,29.69,29.63,29.54,29.39,29.33,29.28,28.85,25.47,24.96,22.72,14.15(末端ch3)。
[0727]
用nme3季铵化
[0728]
反应在5巴氮气压力下进行。在配备有机械搅拌器(rushton涡轮机)的750ml高压釜中添加:-45.7g(91wt%纯度,63mmol,1当量)的氯乙酸双酯c
31-35
,和-169ml(316mmol,5当量)的三甲胺在thf中的溶液(约2mol/l),其已经预先在前一天活化的分子筛上干燥。
[0729]
进行三次氮气吹扫。将反应混合物在40℃下加热并以1000rpm开始搅拌。
[0730]
在4h15反应时间之后,在meod/cdcl3中的nmr分析示出对于具有大约81mol%的所期望的甘氨酸甜菜碱双酯的起始氯乙酸双酯的大约99%的转化率水平。
[0731]
允许混合物在室温下冷却,将反应器减压并且然后排出溶液。用ch2cl2冲洗反应器并将溶剂蒸发以提供43g的粗产物。
[0732]
然后将固体沉积在烧结式过滤器上并用乙酸乙酯洗涤数次以去除一些有机杂质。将固体在真空下干燥并转移进配备有磁力搅拌器、加热器、冷凝器和温度探针的500ml三颈圆底烧瓶中。
[0733]
将产物溶解在250ml的氯仿中并添加25g的活性炭。然后将反应混合物在回流下加热2小时以便使产物变白。
[0734]
在室温下冷却之后,将悬浮液经硅藻土过滤然后蒸发以给出33g的具有以下近似组成的米黄色蜡:92wt%的式(ix)的季二铵化合物、5wt%的季单铵化合物和3wt%的醚副产物。
[0735]1h nmr(meod-d4,400mhz)δ(ppm):4.78(s,1h),4.74(s,1h),4.53(s,1h),4.49(s,1h),3.38(s,18h),1.77-1.6(m,4h),1.51-1.25(m,55h(平均h数目)),0.9(t,j=6.8hz,6h)。
[0736]
13
c nmr(meod-d4,101mhz)δ(ppm):166.39,166.12,79.62,78.17,77.28,64.25,63.98,54.8,54.65,33.21,31.61,30.95,30.83,30.69,30.64,30.5,30.44,29.81,26.7,
26.21,23.9,14.58(末端ch3)。
[0737]
实例13-由c
16-c
18
(60:40)脂肪酸馏分开始合成季二铵化合物
[0738]
皮里亚酮化成c
31-c
35
内酮馏分
[0739]
反应在惰性氩气气氛下在配备有加热垫、机械搅拌(由用inox ss316l3d-打印制造的a320-型搅拌移动装置)、隔热加料漏斗、蒸馏装置和温度探针的200ml石英反应器中进行。
[0740]
在反应器本身中引入:-15g的具有以下组成的mascid
tm
酸1801(来自春金基团(musim mas group)):60.9wt%的棕榈酸和38.2wt%的硬脂酸(0.056摩尔的脂肪酸),和-1.15g的mgo(0.028摩尔)。
[0741]
在隔热加料漏斗中添加45g的相同的熔融脂肪酸混合物(0.167摩尔)。
[0742]
然后将反应混合物的温度升至250℃,并且一旦温度已经达到150℃,就开始搅拌(1200rpm)。在250℃下1h15反应时间之后,ftir分析示出起始脂肪酸完全转化成中间体羧酸镁络合物。
[0743]
然后将反应物料的温度进一步升高至330℃,并允许混合物在该温度下搅拌1h30,以便允许镁络合物分解成所期望的酮。
[0744]
然后,在15分钟内通过加料漏斗将15g的熔融的脂肪酸混合物逐步添加至反应器中,并在330℃下将混合物再搅拌一小时。ftir分析示证实脂肪酸和镁络合物完全转化成所期望的酮。
[0745]
然后实现另外两个循环:在15分钟内添加15g的脂肪酸、随后在330℃下搅拌一小时。在最后的添加循环之后,允许混合物在330℃下再搅拌一小时以便确保中间体羧酸镁络合物完全转化成所期望的酮,这通过根据以下方案的ftir和nmr分析证实:将样品溶于氯仿中并用2n hcl水溶液洗涤三次,并将溶剂蒸发。对残余物的nmr和ir分析没有示出任何可能已经由络合物水解形成的起始脂肪酸的存在。
[0746]
允许反应混合物的温度在60℃下冷却并将粗品溶解在350ml的热chcl3(60℃)中。将悬浮液在二氧化硅(100g)的塞上过滤,并将产物进一步用另外量的chcl3洗脱。溶剂蒸发之后,获得50.5g的粗产物。
[0747]
将产物在烧结式过滤器上用200ml的异丙醇洗涤3次以便去除痕量的副产物。将固体干燥以提供呈白色粉末的所期望的酮,具有100mol%的纯度,对应于90%的收率。
[0748]1h nmr(cdcl3,400mhz)δ(ppm):2.35(t,j=7.6hz,4h),1.62-1.46(m,4h),1.34-1.16(m,54.8h(平均数目)),0.86(t,j=6.8hz,6h)。
[0749]
13
c nmr(cdcl3,101mhz)δ(ppm):212.00,43.06,32.16,29.92,29.89,29.85,29.72,29.66,29.6,29.52,24.16,22.93,14.35(末端ch3)。
[0750]
酮混合物氢化成c
31-c
35
内脂肪醇混合物
[0751]
按照与实例11中在“16-三十一烷酮氢化成16-三十一烷醇”部分下描述的方案相同的方案以优异的收率获得所期望的脂肪醇混合物。
[0752]c31-c
35
脂肪醇脱水成内烯烃
[0753]
反应在惰性氩气气氛下进行。在配备有加热垫、机械搅拌器(通过用inox ss316l 3d打印制造的a320-型搅拌移动装置)、被连接至50ml双颈馏出物收集烧瓶的冷凝器包绕和
温度探针的200ml石英反应器中添加:-43.6g的c
31-35
脂肪醇(92mmol,1当量)-4.4g(43mmol,10wt%)的al2o
3-η。
[0754]
首先将反应介质在150℃下加热以便使脂肪醇混合物熔融并开始搅拌(约500rpm)。然后,将温度升高至300℃并允许混合物在氩气气氛下以1000rpm搅拌。由于nmr分析监测反应进程。在300℃下2小时反应时间之后,在cdcl3中的nmr分析示出脂肪醇的完全转化以及作为副产物已经形成的0.3mol%的酮的存在。
[0755]
然后停止搅拌和加热以允许粗介质冷却。一旦温度已经降低至约80℃,将熔融的粗品转移至烧杯。用氯仿(al2o3是不可溶的)冲洗反应器容器和搅拌移动装置。
[0756]
将悬浮液过滤以去除催化剂,并将溶剂在真空下蒸发以提供40.1g的清澈黄色油,其在室温下固化以给出呈蜡的形式的白色致密固体(》99wt%纯度)和95%收率(nmr)。
[0757]1h nmr(cdcl3,400mhz)δ(ppm):5.42-5.29(m,2h),2.04-1.9(m,4h),1.35-1.19(m,52.8h(平均数目)),0.86(t,j=6.8hz,6h)。
[0758]
13
c nmr(cdcl3,101mhz)δ(ppm):130.59,130.13,32.84,32.16,30.02,29.93,29.77,29.6,29.55,29.4,27.44,22.93,14.35(末端ch3)。
[0759]
环氧化内烯烃以提供c
31-35
环氧乙烷
[0760]
反应在惰性氩气气氛下进行。在配备有机械搅拌器(具有四个倾斜犁的螺旋桨)和折流板、冷凝器、加料漏斗和温度探针的300ml双夹套反应器中添加:-39g的c
31-35
烯烃(》99wt%纯度,86mmol)-7.3ml(7.7g,128mmol)的乙酸,和-11.7g(30wt%)的ir 120h树脂。
[0761]
将混合物加热至75℃以便熔融脂肪烯烃。然后开始搅拌,并使用加料漏斗将13.1ml(14.6g,128毫摩尔)的h2o
2 30%缓慢添加进混合物中,同时监测反应介质的温度以便防止反应物质的温度升高(轻微放热性)。这需要约20min。在添加期间,由于反应介质的非均相性质,增加搅拌速率以改善传质。在添加结束时,将反应介质的温度增加至85℃。搅拌4h30之后,nmr分析示出烯烃转化率水平是约97%。
[0762]
为了完成反应,向反应介质中再添加4.4ml(4.8g,43mmol)的h2o230%。在85℃下7小时的总反应时间之后,nmr分析示出烯烃的完全转化率水平。
[0763]
然后停止搅拌以便允许液相在85℃下在反应器中分离。固体树脂已经沉淀在反应器的底部。通过经底部阀排出去除水相。然后将100ml的水添加进反应器中并允许混合物搅拌15分钟。再次分离各相并去除水相。
[0764]
最终,将熔融的有机相排入烧杯(具有催化剂)中,并将反应器用100ml的氯仿冲洗2次以便回收剩余产物。将有机相经mgso4干燥、过滤并蒸发以提供40.1g的白色致密固体,具有99wt%的纯度(环氧化物+二元醇副产物)。考虑到纯度,收率是98%。
[0765]1h nmr(cdcl3,400mhz)δ(ppm):2.91-2.85(m,1.5h),2.65-2.6(m,0.5h),1.53-1.36(m,4h),1.35-1.19(m,52.8h(平均数目)),0.86(t,j=6.8hz,6h)。
[0766]
13
c nmr(cdcl3,101mhz)δ(ppm):58.97,57.29,32.18,31.96,29.73,29.6,29.49,29.4,27.86,26.63,26.09,22.72,14.15(末端ch3)。
[0767]
与氯乙酸进行无催化剂缩合以提供氯乙酸双酯c
31-35
[0768]
反应在惰性氩气气氛下在配备有磁力搅拌器、加热器、冷凝器、温度探针和隔热加料漏斗的500ml三颈圆底烧瓶反应器中进行。在底烧瓶反应器本身中添加39.19g的氯乙酸(410.5mmol,5当量)。在维持在65℃的隔热加料漏斗中添加38.6g的熔融的脂肪环氧化物(纯度:99wt%,82.1mmol,1当量)。
[0769]
羟基-酯形成的第一步骤在65℃下进行以限制酮和脱水副产物的形成。因此在65℃下在搅拌下经1h30将脂肪环氧化物滴加进含有氯乙酸的反应器中以便限制两个脂肪环氧化物分子的自缩合。一旦脂肪环氧化物的添加完成,允许混合物在65℃下搅拌30min。nmr分析示出起始环氧化物的转化率水平》98%。
[0770]
为了形成最终的双酯,将冷凝器用弯曲的蒸馏柱替换,并允许混合物在140℃下在轻真空(975毫巴)下搅拌5h30,以便帮助去除作为酯化反应的副产物形成的水。在140℃下5h之后,nmr分析示出92mol%的选择性(单酯+双酯)和以下近似粗混合物组成:90mol%的双酯、2mol%的单酯、1mol%的酯化的二聚体和2mol%的酮。
[0771]
然后将压力降低至800毫巴并逐步降低直至10毫巴以便蒸馏过量的氯乙酸并完成单酯向双酯的转化。一旦全部量的氯乙酸已经蒸馏出(通过nmr分析验证),允许混合物冷却至室温并恢复大气压。然后将粗油转移进烧瓶中用于纯化。
[0772]
通过将油溶于300ml的异丙醇中(起始酮不溶于异丙醇)、随后经硅藻土过滤,可以容易地纯化产物。将滤液蒸发以提供49.1g的黑色油,具有93wt%的双酯纯度,对应于86%的分离收率(rmn)。
[0773]1h nmr(cdcl3,400mhz)δ(ppm):5.11-5.02(m,2h),4.04(s,异构体1,2h),4.03(s,异构体2,2h),1.66-1.49(m,4h),1.43-1.19(m,52.8h(平均数目)),0.86(t,j=6.8hz,6h)。
[0774]
13
c nmr(cdcl3,101mhz)δ(ppm):167.14,167,76.22,75.83,40.92,40.82,31.96,30.6,29.73,29.64,29.54,29.39,29.28,28.85,25.47,24.96,22.72,14.15(末端ch3)。
[0775]
用nme3季铵化
[0776]
反应在惰性氩气气氛下进行。在配备有机械搅拌器、冷凝器和温度探针的1l双夹套反应器中添加:-48.1g(69mmol,1当量)的氯乙酸双酯c
31-35
(纯度:93wt%)-334ml(625mmol,9当量)的三甲胺在thf中的溶液(约2mol/l)。
[0777]
然后在40℃下搅拌(1000rpm)反应混合物。3h之后,允许混合物在室温下冷却并搅拌过夜。第二天,nmr分析(d
4-meod)示出起始双酯向所期望产物甘氨酸甜菜碱双酯的完全转化,具有大约92mol%(nmr)的选择性。使反应器排干,用thf冲洗并在真空下去除挥发物。
[0778]
将产物变成粉末、沉积在烧结式过滤器上并用100ml的乙酸乙酯洗涤5次以便去除有机杂质。在真空下干燥固体以提供53g的具有以下近似重量组成的棕色蜡:94wt%的nq19季双铵、2wt%的季单铵、0.1wt%的n(me)3.hcl和3.5wt%的醚副产物。甘氨酸甜菜碱双酯的纯化收率是94%。
[0779]1h nmr(meod-d4,400mhz)δ(ppm):5.3-5.13(m,2h),4.79(s,1h),4.75(s,1h),4.53(s,1h),4.49(s,1h),3.38(s,18h),1.78-1.63(m,4h),1.49-1.2(m,52.8h(平均数目)),0.9(t,j=6.8hz,6h)。
[0780]
13
c nmr(meod-d4,101mhz)δ(ppm):166.39,166.12,79.62,78.17,77.28,64.25,
63.98,54.8,54.65,33.21,31.61,30.95,30.83,30.69,30.64,30.5,30.44,29.81,26.7,26.21,23.9,14.58(末端ch3)。
[0781]
总之,本发明的化合物示出表面活性剂特性与合理至良好的生物降解性结合的良好组合-在许多情况下市售表面活性剂无法实现的组合。
[0782]
由于本发明的化合物也容易从易于由脂肪酸或脂肪酸衍生物获得的内酮开始获得,因此本发明的化合物也提供优于现有技术化合物的经济益处。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1