用于产生产胰岛素β细胞的组合物和方法与流程
用于产生产胰岛素
β
细胞的组合物和方法
技术领域
1.本发明涉及用于从多能干细胞产生产胰岛素β细胞的组合物和方法。本发明的组合物和方法涉及当细胞在肺组织衍生的脱细胞支架上培养时的逐步分化和任选的增殖。
背景技术:
2.诱导多能干细胞(ipsc)和胚胎干细胞(esc)具有自我更新和能够分化成许多类型的细胞的独特性质。已提出使用此类细胞产生产胰岛素β细胞,用于移植到糖尿病(1型糖尿病)患者。
3.在rezania等,2014,nat biotechnol,32(11):1121-33的初步工作的基础上,已开发出各种不同的体外分化方案,可以将人类esc/ipsc成功分化成在表型和功能上类似于成熟β细胞的单激素产胰岛素细胞(例如pagliuca等,2014,cell.,159:428-39;和russ等,2015,embo j.,34:1759-72)。这些方案的一个重要特点是产生共表达pdx1和nkx6.1的胰腺祖细胞,由此可以提高产胰岛素细胞的产量。尽管产生的产胰岛素细胞在植入到啮齿动物模型中后逆转糖尿病并且在体外葡萄糖刺激的胰岛素分泌(gsis)测定法中表现出葡萄糖响应性,但灌注测定法表明这些细胞的胰岛素分泌动力学和线粒体呼吸在功能上不成熟。由于在分化过程后残留的任何未分化细胞的致瘤风险以及移植后针对所述细胞的可能的自体/同种异体免疫反应,这种不成熟引起与所述细胞的治疗用途的安全性有关的问题。
4.在天然环境中,β细胞位于被称为朗格罕氏岛的聚集体中,所述聚集体由内分泌细胞和细胞外基质(ecm)分子组成,并被发现嵌入在胰腺组织中。在这种三维环境中,β细胞经历细胞-基质和细胞-细胞相互作用。以前的研究显示了细胞外基质(ecm)在胰腺细胞增殖和发育中发挥关键作用的证据。已显示细胞-基质相互作用改善β细胞增殖、胰岛素分泌和胰岛发育(wang等,2017,stem cells dev.,26(6):394-404;weber等,2008,tissue eng part a,14:1959
–
1968;hammar等,2004,diabetes,53:2034
–
2041)。
5.3d细胞培养物是一种人工创造的环境,在所述环境中允许细胞在所有三个维度上生长或与它们的周围环境相互作用。细胞通常被包埋在材料中,在所述材料中它们可以在所有三个维度上迁移并经历细胞-基质相互作用和细胞-细胞接触。3d细胞培养平台代表了一种改进的体外细胞培养和分化方法,可以更好地捕获天然组织环境。几项研究使用了各种不同的人工支架例如pes、plla/pva和pcl/pva支架,从ipsc获得人类产胰岛素细胞(enderami等,2018,artif cells nanomed biotechnol.,2:1
–
8;abazari等,2018,gene,5:50
–
57;mansour等,artif cells nanomed biotechnol.,2:1
–
7)。然而,此类支架具有诸如不可生物降解、吸引渗透到支架结构中的细胞的潜力低和/或由于疏水性而导致细胞附着不良的限制。此类支架缺少天然组织微环境的结构和特性。
6.sionov等,2015,tissue eng part a,21(21-22):2691-702报道了内分泌微胰腺(emp)的制备,所述emp由接种有完整的或酶解离的人类胰岛的脱细胞的胰腺衍生或肺衍生的微支架构成。
7.us 7,297,540公开了微器官(mo)作为成体干细胞的(连续)来源的用途,所述mo是
保留了原始组织的基本细胞-细胞、细胞-基质和细胞-间质体系结构的组织外植体;还公开了微器官的天然多信号微环境诱导干细胞分化的用途;以及mo脱细胞基质的天然三维结构作为支架用于接种成体或胚胎来源的干细胞的用途。
8.us 10,093,896公开了一种物质组合物,其包含接种有分化的细胞、特别是胰岛或胰岛细胞的失活、脱细胞的组织衍生的支架,其中所述细胞可以在所述支架上在培养中保持细胞特异性功能或结构。还公开了产生所述组合物的方法及其用途。
9.对于提高在体外从多能干细胞产生的β细胞的质量、功能和成熟度,存在着需求。
技术实现要素:
10.本发明提供了用于产生从人类多能干细胞分化的高质量人类β细胞的组合物、方法和试剂盒。本发明的组合物、方法和试剂盒利用了逐步分化,其中在将分化细胞在也被称为脱细胞微器官基质(mom)的肺组织衍生的脱细胞支架上培养时顺序施加多种分化因子。所有分化步骤可以伴有也可以不伴有细胞增殖。
11.本发明的发明人利用了通常在2d细胞培养中进行的逐步分化过程,在所述过程中顺序施加多种分化因子。本发明人发现,通过在将分化细胞在肺组织衍生的三维支架(3d)上培养时进行所述过程,可以获得具有改进的功能和成熟度的β细胞。
12.本发明首次公开了通过在非同源组织支架、即从胰腺之外的组织衍生的组织支架、特别是肺组织衍生的支架上进行细胞分化来产生β细胞。以前的报道显示,从天然组织衍生的支架影响在其上培养的细胞的分化,并将其导向所述支架所源自的组织。令人吃惊的是,本发明的发明人发现通过在肺组织衍生的支架上分化可以获得β细胞,其特征在于与使用相同的分化程序在2维细胞培养中产生的细胞相比胰岛素生产提高。因此,所述支架的肺来源不仅对分化过程没有负面影响,相反它产生性能改进的β细胞。
13.有利的是,所述肺组织衍生的3d支架提供了衬有基膜的巨大表面积,类似于胰腺中β细胞的天然微环境。发现肺组织衍生的支架甚至比胰腺衍生的支架更加有利。胰腺衍生的支架主要包含源自于胰腺的外分泌部分而不是含有朗格罕氏岛的内分泌部分的基质,因为所述内分泌部分仅占胰腺的约1-2%。胰腺的内分泌部分的特征在于被基膜包围的高密度血管系统。因此,肺组织衍生的支架更好地模拟了胰岛组织的天然微环境。
14.正如本文中所公开的,通过在肺组织衍生的支架上分化而产生的β细胞是完全成熟的(例如,它们表达在成体β细胞中表达并且在发育中的β细胞和其他胰腺细胞中不存在的mafa转录因子),并且对葡萄糖刺激做出响应,以与通过在2d细胞培养中分化而产生的细胞相比更高的水平分泌胰岛素。重要的是,如本文中公开所获得的β细胞以受调节的双相方式对葡萄糖刺激做出响应分泌胰岛素,正如通过研究对葡萄糖做出响应的胰岛素分泌随时间的变化情况的动态葡萄糖响应性胰岛素分泌测定法所证实的。这与通过在2d细胞培养中分化而产生的细胞形成对比,正如在下文中举例说明的。所述对葡萄糖做出响应的受调节的胰岛素分泌表明所述得到的细胞在功能上是成熟的。此外,如本文中所公开的在肺组织衍生的支架上分化与在2d培养中分化相比产生更多表达胰岛素的细胞。因此,本文公开的分化方法提供了产量更高的完全分化的β细胞以及增加和改善的胰岛素分泌。
15.根据某些实施方式,所述肺组织衍生的支架来自于非人类来源(例如猪),并且所述分化细胞是人类的。令人吃惊的是,正如在下文中示例的,非人类的肺组织衍生的支架对
胰腺谱系的人类细胞分化成β细胞没有负面影响。
16.根据一个方面,本发明提供了一种产生产胰岛素β细胞群体的方法,所述方法包括:
17.(a)将胰腺谱系的祖细胞接种在失活的、脱细胞的、肺组织衍生的三维支架上;和
18.(b)通过逐步分化使所述胰腺谱系的祖细胞分化成β细胞,所述逐步分化包括顺序施加多种分化因子,其中所述逐步分化在所述肺组织衍生的三维支架上进行,使得在整个分化过程中所述细胞保留在所述支架上,由此产生产胰岛素β细胞群体。
19.在某些实施方式中,所述方法还包括在步骤(a)之前将多能干细胞在2d细胞培养中分化成所述胰腺谱系的祖细胞。
20.在某些实施方式中,所述胰腺谱系的祖细胞选自定形内胚层细胞,原肠细胞、后前肠细胞、胰腺内胚层细胞、胰腺祖细胞1(pp1)、内分泌胰腺祖细胞(pp2)和内分泌前体细胞(也被称为胰腺内分泌祖细胞)。每种可能性代表本发明的独立实施方式。
21.在某些实施方式中,所述胰腺谱系的祖细胞选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺内胚层细胞和内分泌前体细胞。每种可能性代表本发明的独立实施方式。
22.在另外的实施方式中,所述胰腺谱系的祖细胞选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺祖细胞1(pp1)、内分泌胰腺祖细胞(pp2)和内分泌前体细胞(也被称为胰腺内分泌祖细胞)。每种可能性代表本发明的独立实施方式。
23.在某些特定实施方式中,所述胰腺谱系的祖细胞是胰腺内胚层细胞。在某些实施方式中,所述胰腺谱系的祖细胞是胰腺内胚层细胞,并且所述顺序施加多种分化因子包括:
24.(i)将所述接种有胰腺内胚层细胞的支架在包含一种或多种内分泌前体细胞分化因子的培养基中培养,以在所述支架上获得内分泌前体细胞;和
25.(ii)将所述带有内分泌前体细胞的支架在包含一种或多种β细胞分化因子的培养基中培养,以在所述支架上获得β细胞。
26.在某些实施方式中,所述胰腺谱系的祖细胞是胰腺内胚层细胞,并且所述方法还包括在步骤(a)之前将多能干细胞在2d细胞培养中分化成胰腺内胚层细胞。
27.在某些实施方式中,所述方法还包括将选自内皮细胞和间充质干细胞(msc)的至少一种类型的支持细胞接种在所述支架上,并在将所述支持细胞与分化细胞在所述支架上共培养时执行所述分化过程。
28.在某些特定实施方式中,所述方法还包括将内皮细胞和间充质干细胞(msc)两者接种在所述支架上,并在将所述内皮细胞和msc与分化细胞在所述支架上共培养时执行所述分化过程。
29.根据另一方面,本发明提供了一种用于产生产胰岛素β细胞的组合物,所述组合物包含:
30.(i)失活的、脱细胞的、肺组织衍生的三维支架;和
31.(ii)接种在所述支架上的胰腺谱系的祖细胞。
32.在某些实施方式中,所述胰腺谱系的祖细胞选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺内胚层细胞、胰腺祖细胞1(pp1)、内分泌胰腺祖细胞(pp2)和内分泌前体细胞(也被称为胰腺内分泌祖细胞)。每种可能性代表本发明的独立实施方式。
33.在某些实施方式中,所述胰腺谱系的祖细胞选自定形内胚层细胞、原肠细胞、后前
肠细胞、胰腺内胚层细胞和内分泌前体细胞。每种可能性代表本发明的独立实施方式。
34.在另外的实施方式中,所述胰腺谱系的祖细胞选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺祖细胞1(pp1)、内分泌胰腺祖细胞(pp2)和内分泌前体细胞(也被称为胰腺内分泌祖细胞)。每种可能性代表本发明的独立实施方式。
35.在某些特定实施方式中,所述胰腺谱系的祖细胞是胰腺内胚层细胞。
36.在某些实施方式中,所述组合物还包含接种在所述支架上的选自内皮细胞和间充质干细胞(msc)的至少一种类型的支持细胞。
37.在某些特定实施方式中,所述组合物还包含接种在所述支架上的内皮细胞和msc两者。
38.根据另一方面,本发明提供了一种产生产胰岛素β细胞的方法,所述方法包括:
39.(a)提供根据本发明所述的接种有胰腺谱系的祖细胞的失活的、脱细胞的、肺组织衍生的三维支架;和
40.(b)通过逐步分化使所述胰腺谱系的祖细胞分化成β细胞,其中所述逐步分化在所述肺组织衍生的三维支架上进行,使得在整个分化过程中所述分化细胞保留在所述支架上。
41.在某些实施方式中,在步骤(a)中所述支架进一步接种有选自内皮细胞和间充质干细胞(msc)的至少一种类型的支持细胞,并且其中所述逐步分化在所述支持细胞存在下在所述支架上进行。
42.在某些特定实施方式中,在步骤(a)中所述支架进一步接种有内皮细胞和间充质干细胞(msc)两者,并且其中所述逐步分化在所述内皮细胞和msc存在下在所述支架上进行。
43.根据另一方面,本发明提供了一种用于产生产胰岛素β细胞的试剂盒,所述试剂盒包含:
44.(i)失活的、脱细胞的、肺组织衍生的三维支架;
45.(ii)用于进行胰腺谱系的祖细胞向β细胞的逐步分化的多种分化因子;和
46.(iii)说明手册,其具体说明了在所述支架上进行逐步分化,使得在整个分化过程中细胞保留在所述支架上的技术指导。
47.在某些实施方式中,所述支架预先接种有选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺内胚层细胞、胰腺祖细胞1(pp1)、内分泌胰腺祖细胞(pp2)和内分泌前体细胞(也被称为胰腺内分泌祖细胞)的胰腺谱系的祖细胞。每种可能性代表本发明的独立实施方式。
48.在某些实施方式中,所述支架预先接种有选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺内胚层细胞和内分泌前体细胞的胰腺谱系的祖细胞。每种可能性代表本发明的独立实施方式。
49.在某些实施方式中,所述支架预先接种有选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺祖细胞1(pp1)、内分泌胰腺祖细胞(pp2)和内分泌前体细胞(也被称为胰腺内分泌祖细胞)的胰腺谱系的祖细胞。每种可能性代表本发明的独立实施方式。
50.在某些实施方式中,所述说明手册还具体说明了在所述逐步分化之前将所述胰腺谱系的祖细胞接种在所述支架上的技术指导。在某些实施方式中,所述胰腺谱系的祖细胞选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺内胚层细胞、胰腺祖细胞1(pp1)、内分泌
胰腺祖细胞(pp2)和内分泌前体细胞。每种可能性代表本发明的独立实施方式。
51.在某些实施方式中,所述说明手册还具体说明了接种胰腺谱系的祖细胞的技术指导,所述胰腺谱系的祖细胞选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺内胚层细胞和内分泌前体细胞。每种可能性代表本发明的独立实施方式。
52.在其他实施方式中,所述说明手册还具体说明了在所述逐步分化之前将胰腺谱系的祖细胞接种在所述支架上的技术指导,所述胰腺谱系的祖细胞选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺祖细胞1(pp1)、内分泌胰腺祖细胞(pp2)和内分泌前体细胞(也被称为胰腺内分泌祖细胞)。每种可能性代表本发明的独立实施方式。
53.在某些实施方式中,所述试剂盒还包含多种分化因子,用于在所述支架上接种之前,进行多能干细胞在2d细胞培养中向所述胰腺谱系的祖细胞的逐步分化。在某些实施方式中,所述说明手册还具体说明了用于进行多能干细胞在接种到所述支架上之前在2d细胞培养中向所述胰腺谱系的祖细胞的逐步分化的技术指导。
54.在某些实施方式中,所述试剂盒还包含接种在所述支架上的选自内皮细胞和间充质干细胞(msc)的至少一种类型的支持细胞。
55.在某些特定实施方式中,所述试剂盒还包含接种在所述支架上的内皮细胞和msc两者。
56.在某些实施方式中,所述试剂盒还包含一种或多种细胞培养基。
57.根据另一方面,本发明提供了一种生产人造微器官的方法,所述方法包括:
58.(a)将胰腺谱系的祖细胞接种在失活的、脱细胞的、肺组织衍生的三维支架上;和
59.(b)通过逐步分化使所述胰腺谱系的祖细胞分化成产胰岛素β细胞,在所述逐步分化中顺序施加多种分化因子,其中所述逐步分化在所述肺组织衍生的三维支架上进行,使得在整个分化过程中所述细胞保留在所述支架上,
60.由此获得人造微器官,其包含在所述肺组织衍生的三维支架上培养且当在所述支架上培养时维持葡萄糖响应性胰岛素分泌的产胰岛素β细胞。
61.在某些实施方式中,所述胰腺谱系的祖细胞选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺内胚层细胞、胰腺祖细胞1(pp1)、内分泌胰腺祖细胞(pp2)和内分泌前体细胞(也被称为胰腺内分泌祖细胞)。每种可能性代表本发明的独立实施方式。
62.在某些实施方式中,所述胰腺谱系的祖细胞选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺内胚层细胞和内分泌前体细胞。每种可能性代表本发明的独立实施方式。
63.在另外的实施方式中,所述胰腺谱系的祖细胞选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺祖细胞1(pp1)、内分泌胰腺祖细胞(pp2)和内分泌前体细胞(也被称为胰腺内分泌祖细胞)。每种可能性代表本发明的独立实施方式。
64.在某些实施方式中,所述方法还包括将选自内皮细胞和间充质干细胞(msc)的至少一种类型的支持细胞接种在所述支架上,并在将所述支持细胞与分化细胞在所述支架上共培养时执行所述分化过程。
65.在某些特定实施方式中,所述方法还包括将内皮细胞和间充质干细胞(msc)两者接种在所述支架上,并在将所述内皮细胞和msc与分化细胞在所述支架上共培养时执行所述分化过程。
66.根据另一方面,本发明提供了一种通过本发明的方法生产的人造微器官,其包含
肺组织衍生的三维支架和在其上培养的产胰岛素β细胞。
67.根据另一方面,本发明提供了一种在需要的受试者中治疗糖尿病的方法,所述方法包括在所述受试者中植入治疗有效量的通过本发明的方法生产的人造微器官。
68.在某些实施方式中,所述糖尿病是i型糖尿病。在其他实施方式中,所述糖尿病是ii型糖尿病。在其他实施方式中,所述糖尿病由胰腺炎或其他类型的胰腺损伤引起。
69.在某些实施方式中,所述胰腺谱系的祖细胞的来源对于所述被治疗受试者来说是自体的。
70.从下面的描述、实例和附图,本发明的其他目的、特点和优点将变得清楚。
附图说明
71.图1.分化程序。(a)2d培养中的标准分化方案;(b)根据下文中实施例1所述的分化程序。
72.图2.根据下文中实施例2所述的从多能干细胞(ipsc)经定形内胚层、原肠、后前肠、胰腺内胚层和内分泌前体细胞(endo.细胞)到产胰岛素β细胞(ib)的分化程序。
73.图3.定形内胚层标志物cxcr4和c-kit的表达的facs分析(在根据下文中实施例2所述的分化方案的第4天)。
74.图4.按照下文中实施例2所述分化的β细胞的胰岛素表达。(a)在2d培养中分化的细胞中ins mrna表达的qpcr分析;(b)在2d培养中分化的细胞的胰岛素/dapi染色,20倍放大倍数;(c)在mom上完成分化的细胞的胰岛素/dapi染色,20倍放大倍数。
75.图5.根据下文中实施例2所述分化的β细胞的葡萄糖刺激的胰岛素分泌(gsis)测定。(a)在第15天接种在mom上并在mom上完成分化的细胞;(b)在2d培养中生长并在第21天-第24天之间簇集的细胞;(c)在2d培养板中生长为单层的细胞。
具体实施方式
76.本发明涉及使用来自于脱细胞化肺组织的天然基质将多能干细胞分化成有功能的产胰岛素β细胞。所述肺组织衍生的基质保留了它的复杂组织结构,其在复杂性方面类似于胰腺中β细胞的结构微环境,具有衬有基膜的大表面积。
77.正如本文中公开的,所述肺组织衍生的支架接种有胰腺谱系的祖细胞,并且所述祖细胞被诱导以通过逐步分化而分化成β细胞,在所述逐步分化中顺序施加多种分化因子。本发明的发明人显示,通过在根据本发明所述的支架上进行分化过程,可以获得与通过在2d培养中分化而获得的β细胞相比改进的β细胞。
78.令人吃惊的是,所述支架的肺组织来源对β细胞的分化没有负面影响,并且甚至引起改进的β细胞分化。
79.支架
80.当在本文中使用时,术语“支架”是指可以在其上培养细胞的三维基质。根据本发明所述的支架从也被称为“微器官”(mo)的具有显微厚度的组织外植体制备。微器官保留了原始组织的基本细胞-细胞、细胞-基质和细胞-间质体系结构。为了获得根据本发明所述的失活、脱细胞的组织衍生支架,对所述微器官外植体进行处理以去除细胞,产生“微器官衍生的基质”,缩写为“mom”。
81.当在本文中使用时,术语“失活”和“脱细胞”是指被处理以除去活的细胞物质(包括遗传物质)的组织或结构。失活、脱细胞的微器官是基本上不再包含任何细胞或其他活物质,不繁殖,不需供应营养物或气体,并且基本上是惰性的微器官外植体。在某些实施方式中,细胞被杀死然后从组织中除去,但是细胞也可以在不预先杀死的情况下除去。死细胞可以在液体中脱落,或者可以化学或机械去除。
82.适用于本发明的组织失活方法包括热失活、辐射、通过碱或酸处理化学剥离细胞、高渗或低渗失活、机械失活、去污剂、有机溶剂、它们的组合等。应当理解,由于失活的目的是提供用于细胞培养的脱细胞支架,因此适用于本发明的失活方法被选择成不破坏所述微器官的脱细胞组分的结构和生物化学完整性。us 7,297,540和us 10,093,896详述了用于失活细胞和从微器官去除细胞的示例性但非限制性方法。在一种示例性方法中,将微器官用氢氧化铵和去污剂(sds)处理并在盐水中充分洗涤以去除细胞物质。或者,可以将所述微器官用1-2m nacl和去污剂(例如triton、sds等)处理。在另一个实施方式中,将来自于冷冻保存组织的微器官在冷水或1m nacl中,然后用去污剂溶液反复和广泛洗涤,最后在使用前在含有或不含防腐剂(例如抗生素)的水中洗涤并储存。在又一个实施方式中,将所述失活、脱细胞的微器官基质冷冻储存直至使用。或者,将所述失活、脱细胞的微器官基质干燥(例如冻干),并在使用前在水或培养基中重新水合。
83.对所述mom的尺寸进行选择,以提供足够的营养物和气体例如氧气向接种在所述三维结构中的每个细胞的扩散以及细胞废物向所述mom外的扩散,以便最小化由废物位于所述mom中而造成的细胞毒性和伴随的死亡。
84.通常,根据本发明所述的失活的、脱细胞的、肺组织衍生的三维支架(mom)的尺寸被选择成使得所述支架内最深的点距所述支架的最近表面至少约100微米并且不超过约225微米。因此,当栖居有细胞时,位于所述支架内最深处的细胞距位于所述支架上形成的最近表面处的细胞至少约100微米并且不超过约250微米。
85.因此,在某些实施方式中,所述脱细胞的三维支架的尺寸被选择成使得所述支架内最深的点距所述支架的最近表面至少约100微米并且不超过约250微米。
86.在一个实施方式中,所述支架是厚度在100-500微米范围内的失活、脱细胞的组织切片。在另一个实施方式中,所述支架是约300微米厚的失活、脱细胞的组织切片。在又一个实施方式中,所述支架是约300微米厚、5-12mm宽、5-12mm长(包括所述范围内的每个值)的失活、脱细胞的组织切片。在又一个实施方式中,所述支架是约300微米厚、至少5、至少10、至少15、至少20、至少25、至少30、至少40、至少50mm长、至少5、至少10、至少15、至少20、至少25、至少30、至少40、至少50mm宽的失活、脱细胞的组织切片。每种可能性代表本发明的独立实施方式。
87.适用于制备本发明的微器官基质的微器官可以从源自于任何动物、优选为哺乳动物的肺组织制备。在某些特定实施方式中,所述肺组织是猪的肺组织。在某些实施方式中,所述微器官从在无菌条件下从新近杀死的动物切下、保持在冰上、用培养基(例如ringer或dmem)漂洗的肺制备,并使用组织切片机切成300微米切片。在另一个实施方式中,所述微器官从新鲜冷冻的冻存组织或冻存组织切片制备,将其融化到-2至-20℃以备切片,并使用例如预冷的组织切片机或切片器切片。
88.用于制备失活、脱细胞的三维支架的示例性程序详细描述在us10,093,896中。简
单来说,所述程序包括下述步骤:
89.首先,从例如猪肺制备肺组织衍生的微器官。将成体动物处死并在无菌条件下取出肺。将肺保持在冰上,漂洗,并使用组织切片机切成300μm切片,以形成mo。
90.将所述mo脱细胞,然后用例如0.1%paa灭菌30min,并在储存前用ddw洗涤3次,每次30min。为了脱细胞,可以将所述mo用0.5%sds中的0.67%氢氧化铵处理。在所有细胞物质被移除后,将剩余的细胞外(失活、脱细胞的)物质充分清洗,例如在更换5次的pbs中,此后所述基质已准备好用作三维支架。然后可以将细胞接种在所述mom上。任选地,可以将所述mom在需要使用之前在-20℃下冷冻,并在用于培养之前融化和清洗,例如在pbs中清洗3次并在培养基中清洗2次。
91.或者,mo的脱细胞可以通过将所述mo在下述溶液之一中浸泡45min的时长来进行:(a)10-50mm nh4oh+0.2-3%tritonx-100;(b)1-2m nacl;(c)1-2m nacl+0.2-3%triton x-100;或(d)1-2m nacl+0.01-0.1%sds。然后可以对所得到的失活、脱细胞的mom进行清洗,例如在无菌蒸馏h2o中5
×
15min清洗。在这个阶段,可以将所得到的mom在使用前在-80℃冷冻储存,或漂洗,例如在pbs中5
×
15min清洗。
92.或者,将所述器官(肺)新鲜切下,在水中洗涤,清洁,并任选地在冰上储存至多1.5小时。在切片之前,将所述器官切成12mm
×
12
×
20-40mm的长条并在-20℃至-80℃冷冻,并保持冷冻直至需要用于mom制备。在切片之前,将所述器官长条平衡到-2至-10℃,然后使用预冷的组织切片机切成200至500μm
×
12
×
12mm的切片。
93.然后可以如下所述从所述切片制备mom:
94.a.将切片在冷的无菌ddw中清洗1小时,并且每15分钟换水(每次清洗大约50ml ddw);
95.b.将切片在室温(r.t.)无菌ddw中继续清洗4小时,并且每20分钟换水(每次清洗大约50ml ddw);并且
96.c.将切片在最小体积的ddw中在-80℃下储存,直至需要用于接种。
97.或者:
98.a.将切片在室温无菌ddw中继续清洗4小时,并且每20分钟换水(每次清洗大约50ml ddw);并且
99.b.将切片在ddw中在4℃保持过夜;
100.c.然后将切片在最小体积的ddw中在-80℃下储存,直至需要用于接种。
101.或者:
102.a.将切片在室温无菌ddw中继续清洗4小时,并且每20分钟换水(每次清洗大约50ml ddw);并且
103.b.将切片在ddw中在4℃保持过夜;
104.c.将切片在含有10
×
抗生素的pbs中储存,1至10天后将细胞接种在所得到的mom上。
105.或者:
106.a.将切片在1m nacl中放置1小时,换液3次,每次20min;
107.b.将切片转移到0.5%triton在ddw中的溶液3小时,每30分钟换液;
108.c.将切片用ddw清洗3
×
15min;并且
109.d.将切片在含有10
×
抗生素的pbs中储存,1至10天后将细胞接种在所得到的mom上。
110.或者:
111.a.将切片在1m nacl中放置1小时,换液3次,每次20min;
112.b.将切片转移到0.5%triton在h2o中的溶液3小时,每30分钟换液;
113.c.将切片用h2o清洗5
×
15min;并且
114.d.将切片在最小体积的ddw中在-80℃下储存,直至需要用于接种。
115.将细胞接种在支架上的方法在本领域中是已知的。可以通过静态加载、通过接种在搅拌瓶生物反应器中、在旋转壁容器中或使用细胞在生物反应器中的培养基中的直接灌注,将细胞接种在所述支架上。所述细胞可以被直接接种在微器官基质支架上。培养基中的细胞可以被吸附到所述支架的内表面和外表面上。
116.细胞可以以不同密度接种。在某些实施方式中,细胞以每个微器官基质约1
×
104至约1
×
106个细胞的密度接种。在另外的实施方式中,细胞以每2-4个微器官基质2
×
105至约1
×
106个细胞的密度接种。在另外的实施方式中,细胞以每5-7个微器官基质2
×
105至约1
×
106个细胞的密度接种。
117.在某些实施方式中,在单个细胞培养容器中培养多个mom。
118.所述mom-细胞培养物可以维持在任何适合的培养容器例如12孔微孔板中,并且可以维持在37℃下5%co2中。
119.细胞群体和分化程序
120.细胞分化是未特化(未定型)或未充分特化的细胞获得特化细胞的特征的过程。
121.当在本文中使用时,细胞的谱系定义了它可以产生哪些细胞。
122.多能干细胞体外分化成分泌胰岛素的β细胞遵循模仿胰腺器官发生的一系列发育阶段,其始于分化成定形内胚层(de),然后通过几个阶段顺序分化,被称为“逐步分化”,其中顺序施加多种分化因子,直至获得β细胞。在每个阶段添加含有适合的分化因子的培养基,诱导细胞向下一阶段分化,然后将所述培养基用含有所述细胞向下一阶段分化所需的因子的培养基代替,以此类推。每个阶段通过由细胞表达的一种或多种标志物来表征。
123.当在本文中使用时,术语“分化因子”是指诱导细胞向所需细胞类型分化的分子,例如小分子、蛋白质或肽。例如,“定形内胚层分化因子”是指诱导向定形内胚层细胞分化的分化因子。“原肠分化因子”是指诱导向原肠细胞分化的分化因子,以此类推。
124.当在本文中使用时,“标志物”是在感兴趣的细胞中差异表达的核酸或多肽分子。在这种情形中,差异表达意味着与不同发育阶段的细胞相比,阳性标志物的水平提高并且阴性标志物的水平降低。与不同发育阶段的细胞相比,在所述感兴趣的细胞中所述核酸或多肽标志物的可检测水平提高或降低得足够多,使得可以使用本领域中已知的各种不同方法中的任一方法将所述感兴趣的细胞从其他细胞中鉴定和分辨出来。
125.当在本文中使用时,当在细胞中检测到特定标志物时,所述细胞对所述特定标志物是“阳性”的。当在细胞中未检测到特定标志物时,所述细胞对所述特定标志物是“阴性”的。细胞群体中某种标志物的表达可以定性确定,例如使用免疫染色技术,或者可以定量确定,例如使用facs,其中可以确定所述群体中表达所述标志物的细胞的百分率。
126.根据本发明所述的细胞通常是人类细胞。
[0127]“多能干细胞”是具有分化成所有三种胚层即内胚层、中胚层和外胚层组织的细胞的潜力的干细胞。多能干细胞的特征性标志物包括下述一者或多者:oct4,nanog,sox2,klf4,c-myc,cdh1。多能干细胞特有的其他标志物包括abcg2、cripto、foxd3、连接蛋白43、连接蛋白45、htert、utf1、zfp42(rex1)、ssea-3、ssea-4、tra 1-60、tra 1-81。多能干细胞的特征性标志物列于例如下述网址中:www.rndsystems.com/research-area/embryonic-and-induced-pluripotent-stem-cell-markers。
[0128]
多能干细胞可以使用各种不同的饲养层或使用基质蛋白包被的容器容易地在培养中扩增。所述容器可以用细胞外基质组分包被,例如源自于基膜或可以形成粘附分子受体-配体偶联的一部分的细胞外基质组分。例如,可以使用在商标matrigel
tm
下销售的重构基膜。matrigel
tm
是一种来自于engelbreth-holm swarm肿瘤细胞的可溶性制备物,其在室温下胶凝以形成重构的基膜。本领域中已知的其他细胞外基质组分和组分混合物适合作为替代物。
[0129]
可以将多能干细胞以适合的分布并在培养基存在下铺于所述基底上,所述培养基促进细胞存活、繁殖和所需特征的保留。适合的培养基包括例如无饲养细胞、无血清且完全的细胞培养基,例如mtesr
tm
。多能细胞可以使用酶、机械手段或使用各种不同的钙螯合剂例如edta(乙二胺四乙酸)容易地从培养板取出。或者,多能细胞可以在不存在任何基质蛋白或饲养层的情况下在悬液中扩增。
[0130]
在某些实施方式中,所述多能干细胞是胚胎干细胞。在其他实施方式中,所述多能干细胞不是胚胎干细胞。在另外的实施方式中,所述多能干细胞是诱导多能干细胞。
[0131]
可以使用的多能干细胞的类型包括已建立的多能细胞株系,其源自于妊娠后形成的组织,包括前胚胎组织(例如囊胚)、胚胎组织或在妊娠期间的任何时间、通常但不必定在大约妊娠10至12周之前获取的胎儿组织。非限制性实例是人类胚胎干细胞(hesc)或人类胚胎生殖细胞的已建立的株系,例如人类胚胎干细胞系hes-2、h1、h7和h9。从已在不存在饲养细胞的情况下培养的多能干细胞群体获取的细胞也是适合的。人类胚胎细胞优选地在不破坏人类胚胎的情况下制备,正如在例如chung等,2008,cell stem cell.,2(2):113-7中所描述的。
[0132]
诱导多能干细胞(ipsc)或重编程多能细胞也是适合的,它们可以使用大量与多能相关的转录因子例如oct4、nanog、sox2、klf4和zfp42的强制表达从成体体细胞衍生(loh等,annu rev genomics hum genet,2011,12:165-185)。所述细胞可以从自体来源或同种异体来源衍生。
[0133]
当多能干细胞向有功能的β细胞分化时,它们通过各种不同的阶段分化,每个阶段可以用特定标志物的存在或不存在来表征。细胞在这些阶段中的分化通过特定培养条件、包括添加到培养基的某些因子的存在或缺失来实现。适合的生长培养基包括含有足够量的维生素、矿物质、盐、葡萄糖和氨基酸的化学限定培养基。实例在下文中给出。
[0134]
在某些实施方式中,从多能干细胞到β细胞的分化包含:将多能干细胞分化成定形内胚层细胞;将定形内胚层细胞分化成原肠细胞:将原肠细胞分化成后前肠细胞;将后前肠细胞分化成胰腺内胚层细胞;将胰腺内胚层细胞分化成内分泌前体细胞(也被称为胰腺内分泌祖细胞);和将内分泌前体细胞分化成β细胞。
[0135]
在某些实施方式中,从多能干细胞到β细胞的分化包含:将多能干细胞分化成定形
内胚层细胞;将定形内胚层细胞分化成原肠细胞;将原肠细胞分化成后前肠细胞;将后前肠细胞分化成胰腺祖细胞1;将胰腺祖细胞1分化成胰腺祖细胞2;将胰腺祖细胞2分化成内分泌前体细胞(也被称为胰腺内分泌祖细胞);和将内分泌前体细胞分化成β细胞。
[0136]
当在本文中使用时,“祖细胞”是指未分化的细胞,其具有相对于它可以通过分化产生的细胞来说更加原始(例如与完全分化的细胞相比处于沿着发育途径或进展的更早步骤)的细胞表型。某些祖细胞可以产生能够分化成超过一种细胞类型的后代。据认为,祖细胞致力于特定的分化途径,并在适合条件下最终沿着这条途径分化。根据本发明所述的祖细胞是胰腺谱系的祖细胞。在某些实施方式中,所述胰腺谱系的祖细胞选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺内胚层细胞和内分泌前体细胞(也被称为胰腺内分泌祖细胞)。在另外的实施方式中,根据本发明所述的胰腺谱系的祖细胞选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺祖细胞1、胰腺祖细胞2和内分泌前体细胞(也被称为胰腺内分泌祖细胞)。
[0137]“定形内胚层细胞”(de细胞)是形成胃肠道及其衍生物例如胰腺或肝脏的细胞。定形内胚层细胞的特征性标志物包括下述标志物中的一者或多者:cxcr4,c-kit,pdx1,foxa2,gp2,sox17和gsc。根据本发明所述的定形内胚层细胞表达一种或多种、优选地两种或更多种、更优选地三种或更多种、甚至更优选地所有上述标志物。在某些实施方式中,根据本发明所述的定形内胚层细胞表达包括cxcr4和c-kit在内的标志物。定形内胚层细胞的其他特征性标志物包括hnf3β、gata4、cerberus、otx2、goosecoid、cd99和mixl1。定形内胚层细胞的特征性标志物列于例如下述网址中:www.rndsystems.com/research-area/early-endodermal-lineage-markers。
[0138]
从多能干细胞分化成定形内胚层细胞可以如下进行:将所述多能干细胞铺于包被有细胞外基质的组织培养基底上,并将所述多能干细胞在包含激活素a的化学限定的无血清和动物组分的完全培养基中培养,以获得定形内胚层细胞。示例性程序在下面的实施例部分中描述。
[0139]
在某些实施方式中,从多能干细胞分化成定形内胚层细胞可以通过包括下述步骤的过程来进行:
[0140]
(i)将所述多能干细胞铺于低附着性组织培养基底上,并将所述多能干细胞在包含bmp4的化学限定的无血清完全培养基中培养,以获得拟胚体;
[0141]
(ii)收集所述拟胚体,并将它们在包含bmp4、bfgf和激活素a的化学限定的无血清完全培养基中培养;以及
[0142]
(iii)从步骤(ii)收集拟胚体,并将它们在包含vegf、激活素a和bfgf的化学限定的无血清完全培养基中培养,以获得定形内胚层细胞。
[0143]
在某些实施方式中,从多能干细胞分化成定形内胚层细胞通过包括下述步骤的过程来进行:
[0144]
(i)将所述多能干细胞铺于低附着性组织培养基底上,并将所述多能干细胞在包含谷氨酰胺、抗坏血酸、单硫代甘油(mtg)和bmp4的化学限定的无血清完全培养基中培养24小时,以获得拟胚体;
[0145]
(ii)收集所述拟胚体,并将它们在包含谷氨酰胺、抗坏血酸、单硫代甘油(mtg)、bmp4、bfgf和激活素a的化学限定的无血清完全培养基中培养48-72小时;以及
[0146]
(iii)从步骤(ii)收集拟胚体,并将它们在包含谷氨酰胺、抗坏血酸、单硫代甘油(mtg)、vegf、激活素a和bfgf的化学限定的无血清完全培养基中培养至少24小时,以获得定形内胚层细胞。
[0147]
也被称为“原肠管细胞”或“肠管细胞”的“原肠细胞”(pg细胞)是从定形内胚层衍生的细胞,其表达包含下述标志物中的一者或多者的特征性标志物:foxa1,hnf1-β(hnf1b),hnf4-α(hnf4a)。根据本发明所述的原肠细胞表达一种或多种、优选地两种或更多种、更优选地所有上述标志物。原肠细胞的其他特征性标志物是hnf3-β(foxa2)。原肠细胞可以产生内胚层器官例如肝、胰腺、胃和肠。
[0148]
从定形内胚层细胞分化成原肠细胞可以通过在可能增补有诸如its-x、glutamax
tm
和/或b27的增补物并包含一种或多种原肠分化因子的化学限定培养基中培养来进行。原肠分化因子的实例包括kgf、fgf7和维生素c。每种可能性代表本发明的独立实施方式。在某些示例性实施方式中,所述原肠分化因子是kgf。
[0149]
也被称为“后肠管细胞”的“后前肠细胞”(pfg细胞)是表达包括下述标志物中的一者或多者的特征性标志物的细胞:pdx1,hnf6,sox9,prox1。后前肠细胞可以产生后胃、胰腺、肝和一部分十二指肠。
[0150]
从原肠细胞分化成后前肠细胞可以通过在可能增补有诸如its-x、glutamax
tm
和/或b27的增补物并包含一种或多种后前肠分化因子的化学限定培养基中培养来进行。后前肠分化因子的组合的实例包括kgf+sant-1+视黄酸(ra)+ldn-193189+pdbu;kaad-环巴胺+视黄酸(ra)+ldn-193189;和fgf7+维生素c+tpb+sant。每种可能性代表本发明的独立实施方式。在某些示例性实施方式中,所述后前肠分化因子是kgf+sant-1+视黄酸(ra)+ldn-193189+pdbu。
[0151]
在某些实施方式中,将所述原肠细胞分化成胰腺内胚层细胞,然后分化成内分泌前体细胞,最终分化成β细胞。这种程序在下文的实施例2中示例。本领域技术人员将会认识到,可以使用如下所述的涉及两个子阶段的可选途径:首先将所述原肠细胞分化成胰腺祖细胞1(pp1细胞),接下来分化成胰腺祖细胞2(pp2细胞),然后分化成内分泌前体细胞,并最终分化成β细胞。示例性程序提供在下文的实施例1中。
[0152]“胰腺内胚层细胞”是胰腺谱系发育中的一种中间细胞群体。胰腺内胚层细胞的特征性标志物包括下述标志物中的一者或多者:nkx6.1和pdx1。根据本发明所述的胰腺内胚层细胞表达一种或两种所述标志物。
[0153]
从后前肠细胞分化成胰腺内胚层细胞可以通过在可能增补有诸如its-x的增补物并包含一种或多种胰腺内胚层分化因子的化学限定培养基中培养来进行。胰腺内胚层分化因子的示例性组合是kgf+sant-1+ra+ibet151。
[0154]“胰腺祖细胞1(pp1细胞)”是胰腺谱系发育中的另一种中间细胞群体。pp1细胞的特征性标志物包括下述标志物中的一者或多者:pdx1,nkx6.1,hnf6,prox1,sox9,neurod1。根据本发明所述的pp1细胞表达一种或多种、优选地两种或更多种、更优选地三种更多种、甚至更优选地所有上述标志物。pp1细胞的其他特征性标志物包括foxa2、cdx2、sox9进而hnf4α。胰腺祖细胞1通过pdx1、foxa2、hnf6和nkx6-1的共表达来表征,其中与肠管细胞相比pdx1的表达提高。
[0155]
从后前肠细胞分化成pp1细胞可以通过在可能增补有诸如glutamax
tm
和b27的增补
物并包含一种或多种pp1分化因子的化学限定培养基中培养来进行。pp1分化因子的组合的实例包括egf+fgf7,kgf+视黄酸(ra)+sant1+y-27632+ldn-193189+pdbu,以及ra+环巴胺+头蛋白(noggin)、ibet和its。每种可能性代表本发明的独立实施方式。
[0156]
也被称为“胰腺祖细胞2(pp2细胞)”的“内分泌胰腺祖细胞”是胰腺谱系发育中的另一种中间细胞群体。pp2细胞的特征性标志物包括下述标志物中的一者或多者:nkx6.1,ptf1a,ngn3,nkx2.2。根据本发明所述的pp2细胞表达一种或多种、优选地两种或更多种、更优选地三种更多种、甚至更优选地所有上述标志物。pp2细胞的其他特征性标志物包括pdx1。
[0157]
从pp1细胞分化成pp2细胞可以通过在可能增补有诸如glutamax
tm
和b27的增补物并包含一种或多种pp2分化因子的化学限定培养基中培养来进行。pp2分化因子的组合的实例包括alk-5抑制剂+肝素+fgf7+y-27632,kgf+视黄酸+sant1+y-27632+激活素a、ibet和its。每种可能性代表本发明的独立实施方式。
[0158]
也被称为“胰腺内分泌祖细胞”和“内分泌祖细胞”的“内分泌前体细胞”(简写为en细胞)是指能够变成胰腺激素表达细胞的胰腺内胚层细胞。内分泌前体细胞的特征性标志物包括下述标志物中的一者或多者:pdx1,gp2,nkx6.1,ins,chga,gcg和sst。根据本发明所述的内分泌前体细胞表达一种或多种、优选地两种或更多种、更优选地三种更多种、甚至更优选地所有上述标志物。内分泌前体细胞的其他特征性标志物包括ngn3、nkx2.2、neurod1、isl1、pax4、pax6、arx。
[0159]
从胰腺内胚层细胞分化成内分泌前体细胞可以通过在可能增补有诸如its-x的增补物并包含一种或多种内分泌前体细胞分化因子的化学限定培养基中培养来进行。内分泌前体细胞分化因子的示例性组合是sant-1+ra+pi 3-k抑制剂xxi+alk5抑制剂ii(alk5i ii)+三碘甲状腺原氨酸(t3)+β细胞素。
[0160]
从pp2细胞分化成内分泌前体细胞可以通过在可能增补有诸如glutamax
tm
和b27的增补物并包含一种或多种内分泌前体细胞分化因子的化学限定培养基中培养来进行。内分泌前体细胞分化因子的组合的实例包括alk5抑制剂+硫酸锌+肝素+γ分泌酶抑制剂+y-27632,视黄酸+sant1+t3+xx1+alk5抑制剂+肝素+β细胞素。每种可能性代表本发明的独立实施方式。
[0161]“贝塔细胞”(“β细胞”)是能够表达胰岛素但不表达胰高血糖素、生长抑素、胃饥饿素和胰腺多肽的胰腺内分泌细胞。表达β细胞的特征性标志物的细胞可以通过胰岛素(ins)和下述标志物中的至少一者的表达来表征:pdx1,gp2,nkx6.1,c-肽和mafa。根据本发明所述的β细胞表达一种或多种、优选地两种或更多种、更优选地三种更多种、甚至更优选地所有上述标志物。β细胞可以通过对gcg、pc1/3、sst和chga为阴性进一步表征。
[0162]
在某些实施方式中,通过本发明的方法获得的β细胞在分化过程结束时包含至少20%的mafa+单激素细胞,例如在分化过程结束时至少30%、至少40%、至少50%、至少60%的mafa+单激素细胞。每种可能性代表本发明的独立实施方式。
[0163]
在某些实施方式中,通过本发明的方法获得的β细胞在分化过程结束时包含至少10%的nkx6-1+/c-肽+单激素细胞。在另外的实施方式中,通过本发明的方法获得的β细胞在分化过程结束时包含至少20%、至少30%、至少40%、至少50%、至少60%的nkx6-1+/c-肽+单激素细胞。每种可能性代表本发明的独立实施方式。
[0164]
在某些实施方式中,通过本发明的方法获得的β细胞群体中至少10%(例如至少20%、至少30%、至少40%、至少50%、至少60%)的细胞对ins、pdx1和nkx6.1为阳性,并且对gcg、pc1/3、sst和chga为阴性。其他特征性标志物包括nkx2.2、neurod1、isl1、glut2和pax6。
[0165]
β细胞也通过葡萄糖响应性胰岛素分泌来表征。具体来说,β细胞通过对葡萄糖刺激做出响应的双相胰岛素分泌来表征。在某些实施方式中,通过本发明的方法获得的β细胞群体中至少10%(例如至少20%、至少30%、至少40%、至少50%、至少60%)的细胞是胰岛素阳性的,优选地以双相葡萄糖响应方式分泌胰岛素,正如在下文中测试和示例的。
[0166]
从内分泌前体细胞(胰腺内分泌祖细胞)分化成β细胞可以通过在可能增补有诸如glutamax
tm
和b27的增补物并包含一种或多种β细胞分化因子的化学限定培养基中培养来进行。β细胞分化培养基的实例包括cmrl或rpmi加glutamax
tm
,其增补有10%fbs、1%b27和1%青霉素链霉素,并添加有分化因子例如y-27632、t3+alk5抑制剂(例如10μm alk5i ii+1μm t3)、alk5抑制剂+t3+n-cys+axl抑制剂。每种可能性代表本发明的独立实施方式。β细胞分化培养基的其他实例是增补有10%fbs并添加有分化因子alk5i ii、l-3,30,5-三碘甲状腺原氨酸(t3)和烟酰胺的cmrl。
[0167]
根据本发明所述的“产胰岛素β细胞”或“产胰岛素细胞”是表现出葡萄糖刺激的胰岛素分泌(“gsis”)的有功能的β-细胞。
[0168]
分化效率可以通过将细胞群体暴露于特异性识别由感兴趣的分化的细胞表达的蛋白质标志物的试剂例如抗体来确定。用于评估培养或分离的细胞中蛋白质和核酸标志物的表达的方法是本领域中的标准方法。这些方法包括rt-pcr、qrt-pcr、微阵列、northern印迹、原位杂交和免疫测定法例如免疫细胞化学分析、western印迹以及对于在完整细胞中可接近的标志物来说流式细胞术分析(facs)。
[0169]
在某些实施方式中,本发明的方法包括将选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺内胚层细胞和内分泌前体细胞的胰腺谱系的祖细胞接种在失活的、脱细胞的、肺组织衍生的三维支架上。待接种在所述支架上的祖细胞的每种可能性是本发明的独立实施方式。
[0170]
在某些实施方式中,本发明的方法包括将选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺祖细胞1(pp1)、内分泌胰腺祖细胞(pp2)和胰腺内分泌祖细胞的胰腺谱系的祖细胞接种在失活的、脱细胞的、肺组织衍生的三维支架上。待接种在所述支架上的祖细胞的每种可能性是本发明的独立实施方式。
[0171]
在某些实施方式中,本发明的方法包括接种至少处于胰腺内胚层阶段的胰腺谱系的祖细胞。根据这些实施方式,所述胰腺谱系的祖细胞可以选自胰腺内胚层细胞和内分泌前体细胞以及其间的任何阶段。在某些特定实施方式中,所述胰腺谱系的祖细胞是胰腺内胚层细胞。
[0172]
正如本文中所述,根据本发明所述的多能干细胞向β细胞的分化在2d培养中开始,并在3d支架上继续。
[0173]
在某些实施方式中,根据本发明所述的分化方法包括:在2d细胞培养中通过逐步分化将多能干细胞分化成胰腺内胚层细胞;将所述2d细胞培养中的培养基更换成包含一种或多种内分泌前体细胞分化因子的培养基,并将细胞温育1天;在包含一种或多种内分泌前
体细胞分化因子的培养基中温育1天后,将所述细胞接种在本文中所述的支架上,在包含一种或多种内分泌前体细胞分化因子的培养基中,以获得在所述支架上的内分泌前体细胞;并将所述带有得到的内分泌前体细胞的支架在包含一种或多种β细胞分化因子的培养基中培养,以获得在所述支架上的产胰岛素β细胞。
[0174]
在某些实施方式中,从多能干细胞分化成产胰岛素β细胞按照在下文实施例2中详述并在图2中说明的25天方案来进行。在某些实施方式中,接种在根据本发明所述的支架上的胰腺谱系的祖细胞是任何第4天-第18天细胞。在某些特定实施方式中,接种在根据本发明所述的支架上的胰腺谱系的祖细胞是第14天-第18天细胞,意味着将细胞在2d细胞培养中生长直至第14天、第15天、第16天、第17天或第18天,然后接种在支架上并在所述支架上继续分化过程。每种可能性代表本发明的独立实施方式。在某些示例性实施方式中,根据实施例2中详述和图2中说明的分化过程,接种在所述支架上的胰腺谱系的祖细胞是第15天细胞。
[0175]
在某些实施方式中,提供了一种产生产胰岛素β细胞群体的方法,所述方法包括:
[0176]
(i)将接种有胰腺内胚层细胞的失活的、脱细胞的、肺组织衍生的三维支架在包含一种或多种内分泌前体细胞分化因子的培养基中培养,以获得在所述支架上的内分泌前体细胞;以及
[0177]
(ii)将所述步骤(i)的培养基用包含一种或多种β细胞分化因子的培养基代替,以获得在所述支架上的β细胞。
[0178]
在某些实施方式中,提供了一种产生产胰岛素β细胞群体的方法,所述方法包括:
[0179]
(i)将接种有定形内胚层细胞的失活的、脱细胞的、肺组织衍生的三维支架在包含一种或多种原肠管分化因子的培养基中培养,以获得在所述支架上的原肠细胞;
[0180]
(ii)将所述步骤(i)的培养基用包含一种或多种后前肠分化因子的培养基代替,以获得在所述支架上的后前肠细胞;
[0181]
(iii)将所述步骤(ii)的培养基用包含一种或多种pp1分化因子的培养基代替,以获得在所述支架上的pp1细胞;
[0182]
(iv)将所述步骤(iii)的培养基用包含一种或多种pp2分化因子的培养基代替,以获得在所述支架上的pp2细胞;
[0183]
(v)将所述步骤(iv)的培养基用包含一种或多种胰腺内分泌祖细胞分化因子的培养基代替,以获得在所述支架上的胰腺内分泌祖细胞;以及
[0184]
(vi)将所述步骤(v)的培养基用包含一种或多种β细胞分化因子的培养基代替,以获得在所述支架上的β细胞。
[0185]
在某些实施方式中,本发明的方法还包括将多能干细胞在接种到所述支架上之前分化成所述祖细胞。
[0186]
在某些实施方式中,所述祖细胞是定形内胚层细胞,并且顺序施加多种分化因子包括:
[0187]
(i)将所述接种有定形内胚层细胞的支架在包含fgf7的培养基中培养,以获得原肠管细胞;
[0188]
(ii)将所述带有原肠管细胞的支架在包含kaad-环巴胺、视黄酸和ldn 193189的培养基中培养,以获得后前肠细胞;
[0189]
(iii)将所述带有后前肠细胞的支架在包含egf和fgf7的培养基中培养,以获得pp1细胞;
[0190]
(iv)将所述带有pp1细胞的支架在包含alk5抑制剂、肝素、fgf7和y-27632的培养基中培养,以获得pp2细胞;
[0191]
(v)将所述带有pp2细胞的支架在包含t3、alk5抑制剂、硫酸锌、肝素、γ分泌酶抑制剂和y-27632的培养基中培养,以获得胰腺内分泌祖细胞;以及
[0192]
(vi)将所述带有胰腺内分泌祖细胞的支架在包含fbs和y-27632的培养基中培养,以获得β细胞。
[0193]
根据本发明所述的用于β细胞的逐步分化和产生的示例性程序在下面的实施例部分中详述。可以使用在每个阶段利用不同分化因子的可选程序。例如,可以进行下述分化过程:
[0194]-通过在包含激活素a和chir-99021的培养基中培养将多能干细胞分化成定形内胚层(de)细胞;
[0195]-通过在包含kgf的培养基中培养将de细胞分化成原肠(pg)细胞;
[0196]-通过在包含fgf7的培养基中培养将pg细胞分化成后前肠(pfg)细胞;
[0197]-通过在包含kgf、视黄酸、sant1、y-27632、ldn-193189和pdbu的培养基中培养将pfg细胞分化成胰腺祖细胞(pp1);
[0198]-通过在包含kgf、视黄酸、sant1、y-27632和激活素a的培养基中培养将pp1细胞分化成内分泌胰腺祖细胞(pp2);
[0199]-通过在包含视黄酸、sant1、t3、xx1、alk-5抑制剂、肝素和β细胞素的培养基中培养将pp2细胞分化成胰腺内分泌祖细胞(en);以及
[0200]-通过在包含t3、alk-5抑制剂和cmrl的培养基中培养将en细胞分化成β细胞。
[0201]
在某些实施方式中,除了上述培养基和分化因子之外,向所述mom添加至少一种类型的支持细胞,以便支持所述分化细胞和随后得到的β细胞的分化和存活。本文中公开的支持细胞包括内皮细胞和间充质干细胞中的至少一者。在某些实施方式中,将内皮细胞和间充质干细胞两者接种在所述mom上作为支持细胞。
[0202]
内皮细胞例如huvec、来自于胰腺、肝的内皮细胞等,可以例如以5000个细胞/mom的密度使用。
[0203]
间充质干细胞(msc)例如来自于骨髓、脂肪组织、胎盘和沃顿胶(脐带)的msc,可以例如以10000个细胞/mom的密度使用。
[0204]
人造微器官
[0205]
当在本文中使用时,术语“人造微器官”或“工程化微器官”是指带有在其上培养的根据本发明所述分化的β细胞的微器官支架,其在培养时具有β细胞特异性功能并任选地组织成微器官样三维组织结构。
[0206]
在某些实施方式中,所述人造微器官包含在培养至少7天后表达至少一种细胞特异性蛋白的细胞。在其他实施方式中,所述细胞在培养至少10、至少15、至少20、至少30、至少50和可选地至少70天后表达所述至少一种细胞特异性蛋白。
[0207]
在某些实施方式中,特征性的β细胞功能包括但不限于pdx1和胰岛素的表达和葡萄糖响应性胰岛素分泌。用于监测β细胞特异性蛋白表达的方法包括但不限于用于相关基
因的转录的rt-pcr、免疫组织化学和定量免疫检测技术例如elisa。
[0208]
葡萄糖响应性胰岛素分泌可以通过当培养基中葡萄糖的浓度从“低葡萄糖”升高到“高葡萄糖”水平时β细胞-mom培养物的胰岛素分泌的变化来确定,正如由例如marchetti等(diabetes,1994;43:827-30)所描述的。这种使用3mm葡萄糖作为低水平并使用16.7mm葡萄糖作为高水平的方案,目前是用于在移植前测试β细胞功能的标准程序。
[0209]
在某些实施方式中,本发明的人造微器官的β细胞通过在培养至少7天、或培养至少10天、或培养至少14天、或培养至少20天、或培养至少24天、或培养至少28天、或培养至少35天、或培养至少40天、或培养至少50天、或培养至少60天、或培养至少70天或培养至少75天后的葡萄糖响应性胰岛素分泌来表征。每种可能性代表本发明的独立实施方式。在某些其他实施方式中,所述β细胞在培养至少7天、或培养至少14天、或培养至少20天、或培养至少28天或培养至少35天后表达pdx1。每种可能性代表本发明的独立实施方式。
[0210]
在某些实施方式中,通过本发明的分化程序获得的β细胞群体与在2d培养中分化的群体相比,包含的以葡萄糖响应性方式产生胰岛素的细胞的百分率提高。
[0211]
在某些实施方式中,通过本发明的分化程序获得的β细胞群体与在2d培养中分化的群体相比,对葡萄糖做出响应以更高的水平分泌胰岛素,和/或具有更好的葡萄糖刺激指数,正如通过在高葡萄糖与低葡萄糖下分泌的胰岛素的比率所计算的。
[0212]
在某些实施方式中,通过本发明的分化程序获得的β细胞群体与在2d培养中分化的群体相比表现出改进的胰岛素分泌动力学,例如通过葡萄糖灌注或使用其他胰岛素促分泌物的刺激测定法所确定的。
[0213]
当在本文中使用时,“2d培养”(2维培养)是指在容器例如板、包括用细胞外基质包被的孔中的分化。
[0214]
治疗用途
[0215]
当在本文中使用时,“糖尿病”是指在生物体、通常为人类中,由胰岛素生物合成或生产的缺陷造成的胰岛素绝对缺乏(1型糖尿病)或在存在胰岛素抗性的情况下胰岛素的相对缺乏(2型糖尿病)即胰岛素的作用受损而导致的疾病。因此,糖尿病患者具有绝对或相对胰岛素缺乏,并表现出血糖浓度升高、尿液中存在葡萄糖和排尿过多等症状和体征。
[0216]
在某些特定实施方式中,所述受试者患有1型糖尿病。
[0217]
在其他特定实施方式中,所述糖尿病是2型糖尿病。
[0218]
在某些实施方式中,所述糖尿病是由胰腺炎引起的糖尿病。胰腺炎是胰腺变得发炎的病症。由慢性胰腺炎引起的胰腺中产胰岛素细胞的损伤可以导致糖尿病。
[0219]
在某些实施方式中,所述糖尿病由胰腺炎症或胰腺功能障碍的其他病因引起。
[0220]
所述受试者通常是人类受试者。
[0221]
术语“治疗”是指在患有或被诊断为具有疾病、障碍或病症的个体中抑制或停止所述疾病、障碍或病症的发展和/或引起所述疾病、障碍或病症的减轻、缓解或消退。本领域技术人员将会认识到可用于评估疾病、障碍或病症的发展的各种不同方法和测定法,并且同样可以认识到可用于评估疾病、障碍或病症的减轻、缓解或消退的各种不同方法和测定法。
[0222]
当在本文中使用时,“移植”是指向接受者身体中的位置提供本发明的人造微器官。例如,所述人造微器官可以皮下(sc)或通过腹膜内(ip)注射来移植。
[0223]
应该认识到,可以同时向同一个体移植超过一个微器官。用于移植的微器官的剂
量和特点通常根据患者的体重和疾病状态,例如根据胰岛素缺乏的严重程度来确定。
[0224]
在一个实施方式中,在向β细胞的分化完成后不久将所述微器官移植到所述受试者中。或者,在移植之前可以将所述分化的细胞培养数小时、数天或数周。
[0225]
根据本发明的一个方面,提供了一种在受试者中治疗糖尿病的方法,所述方法包括将治疗有效量的根据本发明所述的包含在失活、脱细胞的肺组织衍生的基质上分化的β细胞的人造微器官移植到所述受试者中,从而治疗糖尿病。
[0226]
所述人造微器官可以自身或在药物组合物中移植到人类受试者,在所述药物组合物中将它与适合的载体或赋形剂混合。
[0227]
当在本文中使用时,“药物组合物”是指包含本文中描述的人造微器官和其他化学组分例如生理上适合的载体和赋形剂的制剂。药物组合物的目的是便于所述人造微器官向需要的受试者的给药。
[0228]
可以互换使用的短语“生理上可接受的载体”和“可药用载体”是指对受试者不造成显著刺激,并且不废除人造微器官的生物活性和特性的载体或稀释剂。
[0229]
术语“赋形剂”是指添加到药物组合物以进一步便于人造微器官的给药的惰性物质。
[0230]
药物组合物可以通过本领域中公知的方法来制造,例如利用常规的混合、溶解、成粒、糖衣丸制造、磨细、乳化、包胶、包埋或冻干方法。
[0231]
因此,根据本发明使用的药物组合物可以使用一种或多种生理上可接受的载体包括赋形剂和助剂,以常规方式来配制。适合的剂型依赖于所选的给药途径。
[0232]
对于注射来说,可以将所述人造微器官配制在水性溶液中,优选地配制在生理相容的缓冲液例如hank's溶液、林格氏溶液或生理盐水缓冲液中。
[0233]
适合在本发明的情形中使用的药物组合物包括其中以有效实现所打算的目的的量包含活性成分的组合物。更具体来说,治疗有效量意味着活性成分(工程化微器官)的有效预防、缓解或改善障碍(例如糖尿病)的症状的量。
[0234]
治疗有效量的确定在本领域技术人员的能力范围之内。
[0235]
试剂盒
[0236]
在某些实施方式中,本文提供了一种用于产生产胰岛素β细胞的试剂盒,所述试剂盒包含:
[0237]
(i)失活的、脱细胞的、肺组织衍生的三维支架;
[0238]
(ii)多种分化因子和任选的支持细胞(内皮细胞和msc),用于进行胰腺谱系的祖细胞向β细胞的逐步分化;和
[0239]
(iii)说明手册,其包含用于将胰腺谱系的祖细胞接种在所述支架上和在所述支架上进行逐步分化,使得在整个分化过程中细胞保留在所述支架上的技术指导。
[0240]
在另外的实施方式中,本文提供了一种用于产生产胰岛素β细胞的试剂盒,所述试剂盒包含:
[0241]
(i)接种有胰腺谱系的祖细胞的失活的、脱细胞的、肺组织衍生的三维支架;
[0242]
(ii)任选的接种在所述肺组织衍生的三维支架上的内皮细胞和msc,其支持所述分化细胞和随后得到的β细胞的分化、产生和存活;
[0243]
(iii)多种分化因子,用于进行所述胰腺谱系的祖细胞向β细胞的逐步分化;和
[0244]
(iv)说明手册,其具体说明了在所述支架上进行逐步分化,使得在整个分化过程中细胞保留在所述支架上的技术指导。
[0245]
在某些实施方式中,所述胰腺谱系的祖细胞选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺内胚层细胞和内分泌前体细胞。
[0246]
在另外的实施方式中,所述胰腺谱系的祖细胞选自定形内胚层细胞、原肠细胞、后前肠细胞、胰腺祖细胞1(pp1)、内分泌胰腺祖细胞(pp2)和内分泌前体细胞(也被称为胰腺内分泌祖细胞)。
[0247]
在某些实施方式中,所述试剂盒还包含一种或多种细胞培养基。
[0248]
在某些实施方式中,所述试剂盒还包含多种分化因子,用于在接种到所述支架上之前在2d细胞培养中进行多能干细胞向所述胰腺谱系的祖细胞的逐步分化。在某些实施方式中,所述说明手册还具体说明了用于在接种到所述支架上之前在2d细胞培养中进行多能干细胞向所述胰腺谱系的祖细胞的逐步分化的技术指导。
[0249]
在某些实施方式中,所述试剂盒还包含用于在分化后测试所述β细胞的因子和试剂。例如,用于测试胰岛素分泌的因子和试剂,用于测试特定标志物的表达的因子和试剂。
[0250]
在某些实施方式中,当所述试剂盒包含未预先接种有细胞的支架时,所述支架可以被冻干。
[0251]
提供下述实施例是为了更全面地说明本发明的某些实施方式。然而,它们决不应被解释为限制本发明的广阔范围。本领域技术人员可以容易地设计出本文公开的原理的许多变化和修改,而不脱离本发明的范围。
[0252]
实施例
[0253]
实施例1
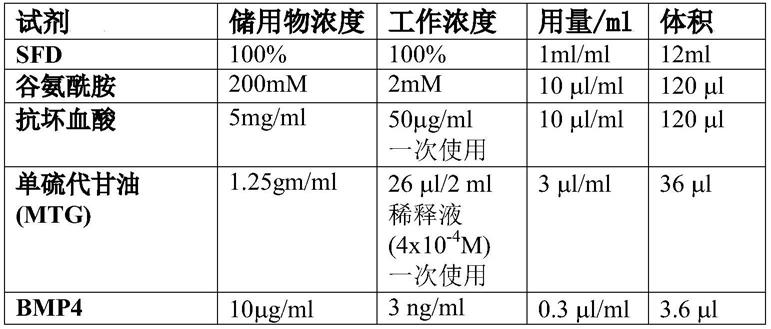
[0254]
在肺组织衍生的支架上多能干细胞向产胰岛素细胞的分化与在2d细胞培养中的分化的比较
[0255]
通用方案
[0256]
所述过程使用如以前所述(us 10,093,896)制备并在使用前一直冷冻的猪肺衍生的脱细胞的失活的微器官基质(mom)来进行。
[0257]
多能干细胞,包括选自源自于成体细胞例如皮肤成纤维细胞、淋巴细胞和包括β细胞在内的胰腺细胞的ipsc的人类诱导多能干细胞(ipsc),是适合的。
[0258]
在2d培养中的标准分化方案示意显示在图1a中。本实施例的程序示出在图1b中。
[0259]
在本实施例中,分化程序的第一步即从多能干细胞分化成定形内胚层(de)细胞在2d培养中进行,然后将所述de细胞的样品接种在mom上。进一步的步骤在2d培养中和mom上平行地进行。在每个分化阶段,在2d培养中和mom上两种情况下将细胞诱导到下一个分化阶段。
[0260]
此外,在每个分化阶段,从2d培养获取细胞样品并接种在新鲜的mom上,以在mom上继续分化。结果是一系列mom培养物,各自含有在不同分化阶段接种在mom上并在所述mom上完成分化的细胞。
[0261]
步骤1.多能阶段(第0天)
[0262]
2d培养:
[0263]
a.将板用1/30稀释的matrigel
tm
在37℃包被1小时
[0264]
b.将人类多能干细胞在20-30%融汇(confluency)时接种在mtesr
tm
培养基中的matrigel上
[0265]
c.当所述细胞达到80-90%融汇时,使用tryple
tm express酶使细胞脱离
[0266]
d.对细胞数目进行计数
[0267]
e.将细胞以每孔1,200,000(120万)个细胞的密度接种在用1/30稀释的matrigel
tm
在37℃包被1小时的6孔板中的mtesr
tm
培养基中
[0268]
f.将所述细胞在37℃、5%co2下温育24h。
[0269]
步骤2.定形内胚层(de)阶段(第1-4天)
[0270]
2d培养:
[0271]
使用stemdiff
tm
定形内胚层试剂盒(含有激活素a+chir99021,或gdf8+mcx-928,或激活素a+wnt3a)。
[0272]
a.第0-1天:按照制造商的说明书制备定形内胚层培养基1(将增补剂a和b混合),并向每个孔添加2ml。将细胞在37℃、5%co2下温育。
[0273]
b.第1-2.5天:按照制造商的说明书制备定形内胚层培养基2(将增补剂b与定形内胚层基础培养基混合(1:100)),并向每个孔添加2ml(培养基2代替培养基1)。将细胞在37℃、5%co2下温育。
[0274]
c.第2.5-4天:制备新鲜的定形内胚层培养基2(将增补剂b与定形内胚层基础培养基混合(1:100)),并向每个孔添加2ml。将细胞在37℃、5%co2下温育36h。
[0275]
从所述2d培养获取得到的定形内胚层(de)细胞的样品,并如下所述将细胞接种在12孔板中的mom上,以获得de-mom:
[0276]
105个de细胞/mom,密度为3mom/孔,在定形内胚层培养基2中。
[0277]
分析来自于2d和mom培养的细胞的选自下述的一种或多种de特异性标志物、优选为至少2-3种标志物的表达:cxcr4,pdx1,foxa2,c-kit,gp2,sox17和gsc。
[0278]
步骤3.原肠(pg)阶段(第4-6天)
[0279]
从de向pg的分化如下所述在2d培养中和接种有de细胞的mom(de-mom)上平行地进行:
[0280]
a.将细胞用增补有glutamax
tm
并含有1%青霉素-链霉素的rpmi1640培养基清洗。
[0281]
b.添加原肠培养基,其含有:
[0282]
i.rpmi 1640培养基+glutamax
tm
[0283]
ii.1%ps(青霉素-链霉素)
[0284]
iii.1%b27增补剂
[0285]
iv.50ng/ml fgf7
[0286]
c.将细胞在37℃、5%co2下温育48h。
[0287]
从所述2d培养获取得到的原肠(pg)细胞的样品,并如下所述将细胞接种在12孔板中的mom上,以获得pg-mom:
[0288]
105个pg细胞/mom,密度为3mom/孔,在如上所述的pg培养基中。
[0289]
分析来自于2d和mom培养的细胞的选自下述的一种或多种pg特异性标志物、优选为至少2种标志物的表达:foxa1,hnf1b,hnf4a。
[0290]
步骤4.后前肠(pfg)阶段(第6-8天)
[0291]
从pg向pfg的分化如下所述在2d培养中并在de-mom(其现在含有pg细胞)和pg-mom上平行地进行:
[0292]
a.将pg培养基用后前肠培养基代替,并向每个孔添加2ml,其含有
[0293]
i.dmem+glutamax
tm
[0294]
ii.1%ps
[0295]
iii.1%b27
[0296]
iv.0.25um kaad-环巴胺
[0297]
v.2um视黄酸
[0298]
vi.0.26um ldn-193189
[0299]
b.将细胞在37℃、5%co2下温育48h。
[0300]
从所述2d培养获取得到的后前肠(pfg)细胞的样品,并如下所述将细胞接种在12孔板中的mom上,以获得pfg-mom:
[0301]
105个pfg细胞/mom,密度为3mom/孔,在如上所述的pfg培养基中。
[0302]
分析来自于2d和mom培养的细胞的pfg特异性标志物pdx1的表达。
[0303]
步骤5.胰腺祖细胞(pp1)阶段(第8-12天)
[0304]
从pfg向pp1的分化如下所述在2d培养中、在de-mom和pg-mom(其现在含有pfg细胞)上并在pfg-mom上平行地进行:
[0305]
a.将pfg培养基用胰腺祖细胞1培养基代替,并向每个孔添加2ml,其含有:
[0306]
i.dmem+glutamax
tm
[0307]
ii.1%ps
[0308]
iii.1%b27
[0309]
iv.50ng/ml egf
[0310]
v.25ng/ml fgf7
[0311]
b.将细胞在37℃、5%co2下温育48h
[0312]
c.在第10天更新培养基,并将细胞在37℃、5%co2下继续温育48h。
[0313]
从所述2d培养获取得到的胰腺祖细胞(pp1)细胞的样品,并如下所述将细胞接种在12孔板中的mom上,以获得pp1-mom:
[0314]
105个pp1细胞/mom,密度为3mom/孔,在如上所述的胰腺祖细胞1(pp1)培养基中。
[0315]
分析来自于2d和mom培养的细胞的选自下述的一种或多种pp1特异性标志物、优选为至少2种标志物的表达:pdx1,hnf6,prox1,sox9。
[0316]
步骤6.内分泌胰腺祖细胞(pp2)阶段(第12-13天)
[0317]
对于2d培养来说,如下所述制备用于pp2阶段的细胞团:
[0318]
a.通过添加2ml aggrewell
tm
清洗液对aggrewell
tm
400 6孔板进行预处理。
[0319]
b.将板以1300g离心5min
[0320]
c.制备pp2细胞团培养基,其含有:
[0321]
i.rpmi+glutamax
tm
[0322]
ii.1%ps
[0323]
iii.1%b27
[0324]
iv.1um alk5抑制剂alk5受体抑制剂ii(alk5i ii)
[0325]
v.10ug/ml肝素
[0326]
vi.25ng fgf7
[0327]
vii.10um y-27632
[0328]
d.使用tryple
tm express将在前一步中获得的pp1细胞从板上脱离下来
[0329]
e.将细胞用细胞团培养基清洗,并将细胞悬液转移到aggrewell
tm
400 6孔板的孔中的2ml细胞团培养基中。
[0330]
g.将细胞在37℃、5%co2下温育24h。
[0331]
对于mom培养来说,除去来自于前一步的培养基(pp1培养基)并用pp2细胞团培养基代替。将所述mom在37℃、5%co2下培养24小时。
[0332]
从aggrewell
tm
板获取得到的胰腺祖细胞(pp2)的样品,并如下所述将细胞接种在12孔板中的mom上,以获得pp2-mom:
[0333]
105个pp2细胞/mom,密度为3mom/孔,在如上所述的细胞团培养基中。
[0334]
分析来自于aggrewell
tm
板和mom培养的细胞的选自下述的一种或多种pp2特异性标志物、优选为至少2种标志物的表达:nkx6.1,ptf1a,ngn3,nkx2.2。
[0335]
步骤7.胰腺内分泌祖细胞(en)阶段(第14-18天)
[0336]
对于2d培养来说,进行下述步骤:
[0337]
a.制备胰腺内分泌祖细胞阶段培养基,其含有:
[0338]
i.rpmi+glutamax
tm
[0339]
ii.1%ps
[0340]
iii.1%b27
[0341]
iv.1um t3
[0342]
v.10um alk5抑制剂
[0343]
vi.10um硫酸锌
[0344]
vii.10ug/ml肝素
[0345]
viii.100nmγ分泌酶抑制剂xxi
[0346]
ix.10um y-27632
[0347]
b.将来自于前一步的细胞团收集在50ml管中,用1ml内分泌祖细胞阶段(en)培养基清洗,并通过重力沉积
[0348]
c.将沉积物(细胞团)用内分泌祖细胞阶段培养基重悬浮,并将细胞团转移到低附着性6孔板中
[0349]
d.将所述板振摇并放置在37℃、5%co2培养箱中
[0350]
e.每隔一天更新培养基(通过重力收集并沉积细胞团)。
[0351]
对于mom培养来说,除去来自于前一步的培养基(pp2培养基)并用en培养基代替。将所述mom在37℃、5%co2下培养。每隔一天更新培养基。
[0352]
从板获取得到的胰腺内分泌祖细胞(en)细胞团的样品,并如下所述将所述细胞团接种在12孔板中的mom上,以获得en-mom:
[0353]
50-100个en细胞团/mom,密度为3mom/孔,在如上所述的en培养基中。
[0354]
分析来自于2d和mom培养的细胞的选自下述的一种或多种en细胞特异性标志物、优选为至少2-3种标志物的表达:pdx1,gp2,nkx6.1,chga,ins,gcg和sst。
[0355]
步骤8.β细胞阶段(第18-27天)
[0356]
从en向β细胞的分化如下所述在2d培养和mom培养中平行地进行:
[0357]
a.制备胰腺β细胞阶段培养基,其含有:
[0358]
i.rpmi+glutamax
tm
[0359]
ii.1%ps
[0360]
iii.1%b27
[0361]
iv.10%fbs
[0362]
v.10um y-27632
[0363]
b.将细胞在37℃、5%co2下温育,每隔一天更新培养基。
[0364]
分析来自于2d和mom培养的细胞的选自下述的一种或多种β细胞特异性标志物、优选为至少2-3种标志物、更优选为至少3-4种标志物的表达:ins+,gcg-,pc1/3-,sst-,chga-,pdx1+,gp2+,nkx6.1+c-肽和mafa+。
[0365]
实施例2
[0366]
在肺组织衍生的支架上多能干细胞向产胰岛素细胞的分化与在2d细胞培养中的分化的比较
[0367]
特定方案
[0368]
如前所述(us 10,093,896)制备猪肺衍生的脱细胞的失活的微器官基质(mom)并将其冷冻直至使用。
[0369]
使用了hes-2细胞。
[0370]
从多能干细胞向产胰岛素细胞的分化步骤示意显示在图2中。
[0371]
在本实施例中,在2d培养中进行完整的分化过程作为对照。平行地进行始于2d培养并在mom上完成的分化过程。更具体来说,在2d培养中进行至多到第15天的分化,然后将所述分化细胞接种在mom上并在mom上继续分化直至第25天。
[0372]
分化方案
[0373]
m1培养基:mcdb131(gibco)+8mm d-(+)-葡萄糖(sigma)+1.23g/l nahco3(sigma)+2%bsa(sigma)+0.25mm维生素c(sigmaaldrich)+1%pen/strep(lonza)+1%l-谷氨酰胺(lonza)
[0374]
m2培养基:mcdb131+20mm d-葡萄糖+1.754g/l nahco3+2%bsa+0.25mm维生素c+肝素10mg/ml(sigma)+1%pen/strep+1%l-谷氨酰胺。
[0375]
在分化过程之前,如下所述将hes-2细胞在无动物组分细胞培养基中传代一次:
[0376]
a.将板用1/30稀释的matrigel
tm
在37℃包被1小时
[0377]
b.将hes-2细胞在20-30%融汇时接种在mtesr
tm
培养基中的matrigel上
[0378]
c.当细胞达到80-90%融汇时,使用tryple
tm express酶将细胞脱离下来
[0379]
d.对细胞数目进行计数
[0380]
e.将细胞以每孔1,200,000(120万)个细胞的密度接种在用1/30稀释的matrigel
tm
在37℃包被1小时的6孔板中的mtesr
tm
培养基中
[0381]
f.将所述细胞在37℃、5%co2下温育24h。
[0382]
第0-3天:定形内胚层阶段
[0383]
按照制造商的说明书使用含有激活素a的stemdiff
tm
定形内胚层试剂盒
(stemcell)。
[0384]
在第4天,通过facs分析所述细胞的定形内胚层标志物cxcr4和c-kit的表达。结果示出在图3中。正如可以在图中看到的,在分化的第4天达到定形内胚层阶段,其中大约70%的细胞对cxcr4和c-kit为阳性。
[0385]
第4-6天:原肠阶段
[0386]
a.将细胞用m1培养基清洗
[0387]
b.添加原肠培养基(每孔2ml),其含有:
[0388]
i.m1培养基
[0389]
ii.50ng/ml kgf(peprotech)
[0390]
iii.its-x增补剂(invitrogen)1:50,000
[0391]
c.将细胞在37℃、5%co2下温育24h,然后将培养基更换成新鲜培养基,并将所述细胞在37℃、5%co2下继续温育24h。
[0392]
在第4天通过免疫染色和qpcr分析所述细胞的foxa2和pdx1的表达。也在第9天测试foxa2和pdx1的表达,以检查这两种标志物的表达的降低。
[0393]
第7-8天:后前肠阶段
[0394]
a.将原肠培养基用后前肠培养基代替,并向每个孔添加2ml,其含有:
[0395]
i.m1培养基
[0396]
ii.50ng/ml kgf
[0397]
iii.0.25μm sant-1(sigma)
[0398]
iv.2μm视黄酸(ra)(sigma)
[0399]
v.200nm ldn-193189(仅在第7天)(sigma)
[0400]
vi.500nm pdbu(millipore)
[0401]
vii.its-x增补剂1:200
[0402]
b.将细胞在37℃、5%co2下温育24h,然后将培养基更换成不含ldn-193189的后前肠培养基,并将所述细胞在37℃、5%co2下继续温育24h。
[0403]
第9-13天:胰腺内胚层阶段
[0404]
a.将后前肠培养基用胰腺内胚层培养基代替,并向每个孔添加2ml,其含有:
[0405]
i.m1培养基
[0406]
ii.50ng/ml kgf
[0407]
iii.0.25μm sant-1
[0408]
iv.100nm ra
[0409]
v.2μm ibet151(selleckchem)
[0410]
vi.its-x增补剂1:200
[0411]
b.将细胞在37℃、5%co2下温育直至第13天,每天进行培养基更换。
[0412]
第14-18天:内分泌前体阶段
[0413]
a.将胰腺内胚层培养基用内分泌前体培养基代替,其含有:
[0414]
i.m2培养基
[0415]
ii.0.25μm sant-1
[0416]
iii.100nm ra
[0417]
iv.1μm pi 3-k抑制剂xxi(millipore)
[0418]
v.10μm alk5抑制剂ii(alk5i ii)(selleckchem)
[0419]
vi.1μm l-3,30,5-三碘甲状腺原氨酸(t3)(sigma)
[0420]
vii.20ng/mlβ细胞素(r&d)
[0421]
viii.its-x增补剂1:200
[0422]
b.将细胞在37℃、5%co2下温育直至第18天,每天进行培养基更换。在第15天,获取在2d培养中分化的细胞的样品,并接种在如上所详述的胰腺内胚层培养基中的mom上。所述细胞以每个mom50,000-100,000个细胞,每孔3个mom的密度接种。分化过程的下一个阶段在2d培养中和mom上平行地进行。
[0423]
第18-25天:β细胞阶段
[0424]
a.将内分泌前体培养基(在2d培养中和mom培养中)用β细胞培养基代替,其含有:
[0425]
i.cmrl培养基
[0426]
ii.10%fbs
[0427]
iii.10μm alk5i ii(selleckchem)
[0428]
iv.1μm l-3,30,5-三碘甲状腺原氨酸(t3)(sigma)
[0429]
v.10mm烟酰胺(sigma)
[0430]
b.将细胞在37℃、5%co2下温育直至第25天,每天进行培养基更换。
[0431]
在第21天-第24天之间产生细胞团。更具体来说,将2d培养物分开,使得一部分细胞继续作为单层生长,另一部分细胞作为细胞团生长。
[0432]
所述细胞团如下所述产生:
[0433]-除去培养基
[0434]-添加1ml tryple
tm express酶并在室温等待2-3min
[0435]-除去tryple
[0436]-每孔添加2mlβ细胞培养基((a)中描述的培养基)并上下吸打几次以悬浮细胞
[0437]-将所述细胞放置在超低附着性孔中(将从2d培养板收集的每个孔转移到对应的超低附着性孔)。
[0438]
体外测定法
[0439]
胰岛素(ins)表达
[0440]
在整个分化过程中ins mrna的表达使用实时pcr来分析。rna提取使用qiagen试剂盒按照试剂盒的说明书进行。反转录使用quantabio试剂盒按照试剂盒的说明书进行。qpcr使用绿进行。此外,还通过免疫荧光染色分析了胰岛素表达。为了研究胰岛素阳性细胞,将细胞用抗胰岛素抗体在pbs-triton 0.5%中在4℃染色过夜。第二天,将细胞在pbs中清洗几次,并用第二抗体(488)在rt染色45分钟。将细胞用pbs清洗几次,并用dapi复染。
[0441]
结果概述在图4a-4c中。图4a示出了在2d培养中分化的细胞中的ins mrna表达。除非注明“细胞团”,否则结果是关于作为单层生长的细胞。正如可以在图中看到的,沿着分化过程,从第18天开始胰岛素表达提高。图4b示出了在第24天时细胞团的胰岛素/dapi染色。在分化的第24天,在细胞团内发现了一些胰岛素阳性细胞。图4c示出了在mom上完成分化的细胞的胰岛素/dapi染色。所述图示出了在第25天时的染色。与2d培养相比mom改进β细胞分化并产生明显更多的胰岛素阳性细胞,即与仅在2d培养中进行分化相比,当分化在mom上完
成时明显更多的细胞表达胰岛素。
[0442]
葡萄糖刺激的胰岛素分泌(gsis)测定法
[0443]
将细胞用低葡萄糖(lg,2.5mm葡萄糖)处理20分钟。然后将细胞用高葡萄糖(hg,11mm葡萄糖)继续处理20分钟,然后用高葡萄糖和kcl(均为11mm)继续处理20分钟(hg+kcl)。在起始点和随后每10分钟收集样品,直至60分钟。然后通过elisa分析样品的胰岛素分泌。
[0444]
结果示出在图5a-5c中。正如可以在图中看到的,与2d培养相比,mom改进分化的β细胞的胰岛素分泌和调控。在第15天接种在mom上并在mom上完成分化过程的分化的β细胞(图5a)以受调控的方式分泌胰岛素,而在2d培养板中作为细胞团或单层生长的分化的β细胞(图5b-5c)不显示出受调控的胰岛素分泌。
[0445]
正如本文中提到的,胰岛素分泌的调控意味着在lg中分泌的胰岛素的量低于在hg中分泌的量,并且在hg中分泌的量低于在hg+kcl中分泌的量。它进一步描述了对葡萄糖做出响应的胰岛素的双相分泌。增加的胰岛素分泌和对高葡萄糖刺激表现出第一和第二相胰岛素释放,是β细胞行为的关键特点。
[0446]
实施例3
[0447]
在肺组织衍生的支架上多能干细胞向产胰岛素细胞的分化与在2d细胞培养中的分化的比较
[0448]
改良方案
[0449]
对于第0-3天的方案进行了改良,其按照下述方案进行。
[0450]
第0天聚集
[0451]
细胞的密度:1个孔应该具有大约1百万个细胞,并且多能干细胞基质胶集落之间应该存在间隔(50至60%融汇)。
[0452]
需要的培养基:
[0453]-accutase
tm
(gibco a11105储用物-20℃,细胞培养物储存在4℃)
[0454]-终止培养基(含有l-谷氨酰胺和p/s的imdm:fcs;50:50)
[0455]-含有l-谷氨酰胺和p/s的imdm
[0456]-d0内胚层诱导培养基:
[0457][0458]
分化方案
[0459]
第0天
[0460]-从孔中除去培养基
[0461]-添加1ml/孔的accutase
tm
(gibco a11105储用物-20℃,4℃储存用于细胞培养),在室温下1分钟
[0462]-吸出accutase
tm
[0463]-添加1ml/孔的终止培养基+dnase(200ul/12ml)
[0464]-对细胞进行计数
[0465]-刮擦孔以产生细胞团块,添加1ml/孔的imdm增补培养基
[0466]-使用10ml移液管,吸打2-3次
[0467]-将来自于6个孔的溶液添加到含有imdm的14ml管中
[0468]-以1200rpm离心5分钟
[0469]-重悬浮在d0内胚层诱导培养基中,并以2ml/孔分发到低簇集板中。使用6孔低簇集板,设置与人工基膜板相同数目的板或每个10cm培养皿6个孔。
[0470]-在5%o2/5%co2/37℃培养箱中温育24小时。
[0471]
第1天:内胚层诱导——完全更换培养基
[0472]-从孔中取出拟胚体(eb),放置在14ml管中并允许eb完全沉积
[0473]-以1200rpm离心5min
[0474]-制备第1天内胚层诱导培养基,并在eb沉积时每孔添加1ml第1天培养基:
[0475][0476]-在5%o2/5%co2/37℃培养箱中温育48-72小时。
[0477]
第4天:内胚层诱导——完全更换培养基
[0478]-从孔中取出拟胚体(eb),放置在14ml管中并允许eb完全沉积
[0479]-制备第4天内胚层诱导培养基,并在eb沉积时每孔添加1ml第4天培养基(取决于细胞密度2ml/孔):
[0480]
[0481][0482]-在5%o2/5%co2/37℃培养箱中温育72小时。
[0483]
实施例4
[0484]
体外活性测定法
[0485]
对通过在mom上分化而获得的β细胞进行如下所述的分析,并与在2d培养中分化的β细胞进行比较:
[0486]-mrna基因表达分析:(a)胰岛素(ins)、胰高血糖素(gcg)和胰腺多肽(ppy);(b)β细胞成熟度标志物pdx1、nkx6.1和mafa;(c)细胞葡萄糖感应基因(slc2a1和gck);和(d)间隙连接基因(cdh1和cx36)。此外,确认多能性和祖细胞基因的下调。
[0487]-用于确认β细胞成熟的免疫化学分析:胰岛素(ins),胰高血糖素(gcg)和胰腺多肽(ppy),pdx1,nkx6.1和mafa。
[0488]-通过静态和动态(灌注测定法)葡萄糖刺激的胰岛素/c-肽分泌测定法(gsis),然后通过elisa进行的体外胰腺功能评估。
[0489]-在细胞裂解和elisa后胰岛素含量的定量。
[0490]-通过透射/扫描电子显微术(tem/sem)对分化的β细胞进行的超微结构分析,以研究包含在所述细胞内的分泌小泡。
[0491]
实施例5
[0492]
体内功能测定法
[0493]
将β细胞-mom组合物(5-10)皮下移植到免疫受损小鼠中,以测试它们的体内功能。具体来说,核实了在移植有β细胞-mom组合物的动物的血清中人类胰岛素和任选的c-肽是否可检测。
[0494]
在简短的手术恢复期(2周)后,将移植有β细胞-mom组合物的小鼠用葡萄糖注射,并在30min后收集血清。进行人类胰岛素和任选的c-肽的elisa测量,以定量分泌到宿主血流中的人类胰岛素/c-肽。
[0495]
为了测试β细胞-mom组合物是否对葡萄糖做出响应分泌胰岛素(体内gsis),在急性葡萄糖刺激之前(0min)和之后(30min)均在一部分小鼠的血流中测量人类胰岛素/c-肽。在移植后2周,计算在葡萄糖刺激后显示出血流中人类胰岛素/c-肽增加的移植小鼠的百分率。作为体内gsis的另一种度量,计算在葡萄糖刺激后相比于刺激前分泌的胰岛素的平均比率,并且其优选地应该≥1。对于胰岛移植来说,这种体内刺激指数在0.4至4.3的范围内。
[0496]
在移植后大约1个月,将动物处死并取出植入的β细胞-mom组合物用于组织学分析。进行ihc测定法以检查c-肽+/胰岛素+细胞。
[0497]
也对收获的植入物的下述标志物进行组织学评估:
[0498]
·
内分泌(胰岛素、胰高血糖素和生长抑素),
[0499]
·
干细胞性(sox2),
[0500]
·
胰腺内胚层(pdx1、nkx2.2和nkx6.1)。
[0501]
评估具有成熟特征以及与周围组织的形态整合和移植物与位点血管网络之间的功能整合的β细胞(cd31染色)。进行了下述组织病理学评估:
[0502]
a.植入的程度,细胞的存活率
[0503]
b.血管生成的程度
[0504]
c.细胞在emp中的浸润(h&e染色)
[0505]
d.emp的纤维化
[0506]
e.emp的降解
[0507]
上文特定实施方式的描述非常充分地揭示了本发明的总体本质,使得其他人可以使用现有的知识容易地对此类特定实施方式进行修改和/或改编以适应于各种不同的应用,而不需过多实验并且不背离所述一般性概念,因此,这些改编和修改应该并且打算被包含在所公开的实施方式的等同性含义和范围之内。应当理解,本文中使用的短语或术语是出于描述而非限制的目的。用于执行所公开的各种不同功能的手段、材料和步骤可能采取各种不同的替代形式而不背离本发明。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1