用于治疗特定患者的癌症的抗体组合
1.本发明涉及1)通过其fab区特异性结合fcγriib并通过其fc区结合fcγ受体的第一抗体分子,和2)特异性结合pd-1并通过其fc区结合至少一种fcγ受体的第二抗体分子在治疗在cd3阳性肿瘤浸润性淋巴细胞(til)上具有中等或高pd-1表达的患者的癌症中的组合使用。
背景技术:
2.免疫抑制检查点受体,例如ctla-4或pd-1(也表示为pd1),是细胞表面受体,它们在与其配体受体(分别例如b7家族成员cd80和cd86,以及pd-l1)结合时,将抑制性信号传输到细胞内部,从而限制细胞活化和增殖,防止过度炎症并有助于维持自身耐受性。在此类抑制性免疫检查点具有遗传缺陷的动物与加重的炎症性反应相关联,无法发展或维持对自身的耐受性,从而导致自身免疫性疾病。免疫检查点受体ctla-4和pd-1/pd-l1的抗体使患有各种癌症的患者的总体存活率提高,尤其是包括多种实体癌类型,例如黑色素瘤、肺癌、膀胱癌和头颈癌,并且此类抗体已获得美国食品和药物管理局的批准(pardoll,d.m.(2012)《自然综述-癌症(nat rev cancer)》12(4):252-264;topalian,s.l.等人(2015)《癌细胞(cancer cell)》27(4):450-461;sharma,p.等人(2017)《细胞(cell)》168(4):707-723)。
3.免疫抑制检查点轴pd-1/pd-l1的抗体已被证明在癌症免疫疗法中特别有效,在~20%的患者中引起客观反应(完全和部分反应)
–
相比于护理标准的显著改善(carretero-gonzalez,a.等人(2018)《肿瘤靶点(oncotarget)》9(9):8706-8715)。然而,正如反应率所证明的那样,目前可用的抗pd-1/pd-l1抗体仅在少数患者中具有活性。此外,一部分最初有反应的患者最终将发展出抗性,并无法再从治疗中受益。因此,对pd-1/pd-l1抗体的无反应性和抗性的机制是一个临床上重要的问题。鉴定并克服对pd-1/pd-l1抗体的抗性机制是针对这一临床重要药物类别改善癌症患者存活率的一项重大的挑战和机遇。
4.此外,人们普遍认为,用于鉴定最有可能对抗pd-1/pd-l1检查点阻断有反应的患者的预测性生物标志物是鉴定可能对疗法有反应的患者的重要策略。反过来说,防止使用经常与严重的、偶尔致命的耐受性问题相关联的这些药物对患者进行不必要的治疗也同样重要。由于成本高昂,这些疗法进一步给付款人和医疗保健系统带来巨大的负担。对抗pd-1/pd-l1抗体疗法具有临床意义的现有的预测性生物标志物的实例是micro satellite instability(msi)(le,d.t.等人(2015)《新英格兰医学杂志(n englj med)》372(26):2509-2520;le,d.t.等人(2017)《科学(science)》357(6349):409-413)、肿瘤突变负荷(gubin,m.m.等人(2014)《自然(nature)》515(7528):577-581;snyder,a.等人(2014)《新英格兰医学杂志》371(23):2189-2199;tran,e.等人(2014)《科学》344(6184):641-645,tran,e.等人(2015)《科学》350(6266):1387-1390),以及肿瘤pd-l1表达(gibney、weiner等人2016,topalian、taube等人2016).)、肿瘤突变负荷和肿瘤pd-l1表达。
5.fcγ受体(fcγr)是发现于免疫效应细胞的细胞表面上的膜蛋白,所述免疫效应细胞包括单核细胞、巨噬细胞、树突状细胞、中性粒细胞、肥大细胞、嗜碱性粒细胞、嗜酸性
粒细胞和自然杀伤细胞以及b淋巴细胞。名称衍生自其对抗体的fc区的结合特异性。fc受体发现于细胞膜上
–
所述细胞膜另外被称为质膜或细胞质膜。fcγr可以被细分为活化性fcγr和抑制性fcγr,已知所述活化性fcγr和抑制性fcγr通过簇集的免疫球蛋白g fc's的结合来协调地调节细胞活化,并且分别通过细胞内itam或itim基序将活化性或抑制性信号传输到细胞中。簇集的免疫球蛋白或免疫复合物的fcγr结合可以介导抗体进入细胞的内化并且可能导致抗体介导的吞噬、抗体依赖性细胞介导的细胞毒性,或抗原呈递或交叉呈递。已知fcγr还介导或增强抗体结合的细胞表面受体的交联。已知这种交联是一些(li,f.等人(2011)《科学》333(6045):1030-1034;white,a.l.等人(2011)《免疫学杂志(j immunol)》187(4):1754-1763)但并非所有(richman,l.p.等人(2014)《肿瘤免疫学(oncoimmunology)》3:e28610)抗体在靶向细胞中激活信号传导的能力所需要的,并且达到治疗效果可需要或可不需要所述交联。
6.在人中,fcγriib(cd32b)是抑制性fcγ受体,而fcγri(cd64)、fcγriia(cd32a)、fcγriic(cd32c)和fcγriiia(cd16a)是活化性fcγ受体。fcγgriiib是在中性粒细胞上表达的gpi连接受体,缺乏itam基序,并被认为充当抵消活化性fcγr信号传导的诱骗受体(treffers,l.w.等人(2018)《免疫学前沿(front immunol)》9:3124)。在小鼠中,活化性受体是fcγri、fcγriii和fcγriv。
7.众所周知,抗体可以通过与fcγ受体的相互作用来调节免疫细胞活性。具体地,抗体免疫复合物如何调节免疫细胞活化是通过其活化性和抑制性fcγ受体的相对接合来确定的。不同抗体同种型以不同亲和力与活化性和抑制性fcγ受体结合,从而产生不同的a:i比率(活化:抑制比率)(nimmerjahn等人;《科学》.2005年12月2日;310(5753):1510-2)。
8.通过利用其fc结构域与抑制性fcγ受体结合,抗体可以抑制、阻断和/或下调效应细胞功能。通过利用其fc结构域与抑制性fcγr结合,抗体可以通过抗体靶向的信号传导受体在靶细胞上的聚集来刺激细胞活化(li,f.等人(2011)《科学》333(6045):1030-1034;white,a.l.等人(2011)《免疫学杂志》187(4):1754-1763;white,a.l.等人(2011)《免疫学杂志》187(4):1754-1763white,a.l.等人(2014)《免疫学杂志》193(4):1828-1835)。
9.通过与活化性fcγ受体结合,抗体可以激活效应细胞功能并且由此触发以下机制,诸如抗体依赖性细胞毒性(adcc)、抗体依赖性细胞吞噬(adcp)、细胞因子释放和/或抗体依赖性内吞,以及在中性粒细胞的情况下的netosis(即net中性粒细胞细胞外陷阱的活化和释放)。抗体与活化性fcγ受体的结合还可能导致某些活化标志物,诸如cd40、mhcii、cd38、cd80和/或cd86的增加。
10.与活化性和抑制性fcγ受体对抗体诱导的效应细胞反应的协同调节一致,已显示活化性fcγ受体促进肿瘤细胞耗竭和肿瘤直接靶向抗体的治疗活性。临床前和临床研究表明,肿瘤直接靶向抗体(即治疗活性涉及直接结合并杀伤肿瘤细胞的抗体,例如抗cd20、抗her2和抗egfr抗体)的抗肿瘤活性在携带针对活化性fcγ受体的较高亲和力等位基因(cartron,g.等人(2002)《血液(blood)》99(3):754-758;musolino,a.等人(2008)《临床肿瘤学杂志(jclin oncol)》26(11):1789-1796;zhang,w.等人(2007)《临床肿瘤学杂志》25(24):3712-3718)并且具有与抑制性fcγ受体相比对活化性fcγ受体表现出更强结合(高a:i比率)的抗体同种型和形式(goede,v.等人(2014)《新英格兰医学杂志》370(12):1101-1110)的患者中增强。相反,肿瘤直接靶向抗体的治疗活性在缺乏抑制性fcγriib的动物中
(clynes,r.a.等人(2000)《自然医学(nat med)》6(4):443-446),或者如本发明的一些发明人最近表明的,当抑制性fcγriib被拮抗性抗fcγriib抗体阻断时(roghanian,a.等人(2015)《癌细胞》27(4):473-488)增强。
11.新出现的临床前和临床数据表明,fcγ受体还控制免疫调节抗体的功效,所述抗体包括靶向ctla-4、pd-1/pd-l1的免疫检查点抑制性抗体。在人和小鼠中,有证据表明抗ctla-4抗体的治疗活性通过活化性fcγ受体的接合促进;与表达较低亲和力fcγriiia等位基因的患者相比,携带fcγriiia基因的高亲和力等位基因的黑色素瘤患者对伊匹单抗作出反应而显示出改善的存活率。此外,在针对活化性和抑制性受体人源化的小鼠中,治疗功效显示为fcγr依赖性的,并通过具有高a:i比率的抗体同种型增强(arce vargas,f.等人(2018)《癌细胞》33(4):649-663e644)。
12.这些发现促使我们研究fcγriib阻断抗体增强抗ctla-4抗体活性的能力。本发明的一些发明人先前已产生并公开了两种不同类型的fcγriib阻断抗体(roghanian,a.等人(2015)《癌细胞》27(4):473-488);良好(proficient)结合活化性和抑制性人fcγr两者的人igg1,以及显示出通过其fc结构域与fcγr的结合严重受损的fc工程化变体。这两种不同类型的抗fcγriib抗体在阻断b细胞中的cd20内化和fcγriib信号传导方面表现出同样的拮抗作用,并且均在表达人fcγriib和人cd20的转基因动物中改善抗cd20 mab介导的b细胞耗竭。
13.在国际专利申请号pct/ep2019/050566中,我们证明了只有缺乏fc区或其fc区表现出与fcγr的结合减少或受损的抗fcγriib抗体才能增强抗ctla-4抗体的治疗活性。在不同的实体癌小鼠实验模型中,与fc:fcγr结合受损的抗fcγriib抗体,而不是fc:fcγr结合良好的抗fcγriib共同治疗提高了抗ctla-4的治疗活性,并在人源化pbmc体内模型中展示出临床相关抗ctla-4抗体伊匹单抗的treg耗竭增强。在与fc:fcγr结合受损的抗fcγriib抗体组合治疗后,观察到对针对il-2r(cd25)和pd-l1具有特异性的抗体的耗竭和/或治疗功效的类似增强作用,表明增强作用不限于特定的靶标或细胞类型。
14.临床前研究表明了fcγ受体在控制抗pd-1/pd-l1抗体的治疗活性方面的作用,但活化性和抑制性fcγ受体的单独作用尚不明确。dahan等人报道,针对pd-l1的小鼠抗体的抗肿瘤活性受益于fcγr接合,但相反地,抗pd-1抗体的活性因fcγr接合而受损(dahan,r.等人(2015)《癌细胞》28(3):285-295)。值得注意的是,与具有较低a:i比率(即抑制性fcγ受体的接合相对较强)的migg1同种型相比并且与具有fc:fcγr结合缺陷的抗pd-1变体抗体相比,具有高a:i比率(即,与抑制性fcγ受体相比提供活化性fcγ受体的强接合)的抗pd-1抗体同种型(migg2a)表现出较低的治疗活性。
15.使用临床上相关的人抗pd-1igg4抗体纳武单抗和具有所要求保护的类似fcγ受体结合特征的替代大鼠igg2a抗体,arlaukas和同事们类似地发现,fc:fcγr结合受损(去糖基化)的抗pd-1变体抗体与其fc:fcγr良好的野生型人igg4和大鼠igg2a抗pd-1对应物相比具有改善的治疗活性(arlauckas,s.p.等人(2017)《科学转化医学(sci transl med)》9(389))。然而,与dahan等人相反,使用针对单独fcγ受体的阻断抗体,作者将活化性小鼠fcγ受体iii和抑制性小鼠fcγ受体ii鉴定为抗pd-1抗体功效降低的潜在原因。因此,作为抗pd-1抗体功效降低的潜在原因的(单独)活化性和抑制性fcγ受体的相对重要性、它们如何限制临床相关的人抗pd-1抗体的功效,或哪些活化性或抑制性fcγr应被阻断以增强抗
pd-1抗体活性,从现有技术中尚不清楚。
技术实现要素:
16.本文公开了一种以下各项的组合:
17.第一抗体分子,其通过其fab区特异性结合fcγriib,并通过其fc区结合fcγ受体,以及
18.第二抗体分子,其特异性结合pd-1并通过其fc区结合至少一种fcγ受体;
19.所述组合用于治疗所具有的肿瘤浸润性t淋巴细胞具有中等或高pd-1表达的患者的癌症。
20.本文还公开了一种药物组合物,其包含:
21.(i)第一抗体分子,其通过其fab区特异性结合fcγriib,并通过其fc区结合fcγ受体,以及
22.(ii)第二抗体分子,其特异性结合pd-1并通过其fc区结合至少一种fcγ受体;
23.所述药物组合物用于治疗所具有的肿瘤浸润性t淋巴细胞具有中等或高pd-1表达的患者的癌症。
24.本文还公开了一种用于治疗所具有的肿瘤浸润性t淋巴细胞具有中等或高pd-1表达的患者的癌症的试剂盒,其包括:
25.(i)第一抗体分子,其通过其fab区特异性结合fcγriib,并通过其fc区结合fcγ受体,以及
26.(ii)第二抗体分子,其特异性结合pd-1并通过其fc区结合至少一种fcγ受体。
27.本文还公开了以下各项的用途:
28.(i)第一抗体分子,其通过其fab区特异性结合fcγriib,并通过其fc区结合fcγ受体,以及
29.(ii)第二抗体分子,其特异性结合pd-1并通过其fc区结合至少一种fcγ受体;
30.其用于制造用于治疗所具有的肿瘤浸润性t淋巴细胞具有中等或高pd-1表达的患者的癌症的药物。
31.本文还公开了一种用于治疗所具有的肿瘤浸润性t淋巴细胞具有中等或高pd-1表达的患者的癌症的方法,其包括施用:
32.(i)第一抗体分子,其通过其fab区特异性结合fcγriib,并通过其fc区结合fcγ受体,以及
33.(ii)第二抗体分子,其特异性结合pd-1并通过其fc区结合至少一种fcγ受体。
34.本文还公开了一种诊断测试,其用于确定患者是否将受益于使用以下各项的组合治疗:
35.(i)第一抗体分子,其通过其fab区特异性结合fcγriib,并通过其fc区结合fcγ受体,以及
36.(ii)第二抗体分子,其特异性结合pd-1并通过其fc区结合至少一种fcγ受体,
37.所述测试包括确定患者的肿瘤浸润性t淋巴细胞上的pd-1表达,其中中等或高pd-1表达指示患者将受益于组合治疗。相应地,t淋巴细胞上缺乏中等或高pd-1表达而是低pd-1表达则指示患者将不受益于组合治疗。
具体实施方式
38.在此,我们证明了只有fc:fcγr结合良好而非fc:fcγr结合受损的抗fcγriib抗体才能增强抗pd-1抗体的体内治疗功效,并防止由临床相关的人抗pd-1抗体引起的pd-1高表达t细胞的体外吞噬。这一发现是新颖且出乎意料的,因为上述关于fcγr在抗pd-1疗法中的作用的参考研究表明了与抑制性fcγr相比,活化性fcγr的广泛作用(dahan,r.等人(2015)《癌细胞》28(3):285-295),或作为受损的抗pd-1抗体活性的潜在原因的单独的活化性(fcγriii)和抑制性fcγriib(arlauckas,s.p.等人(2017)《科学转化医学》9(389))。
39.鉴于与针对其他免疫检查点的抗体(尤其包括抗ctla-4)有关的本发明人的一些早期发现,其中仅fc:fcγr结合受损的而非fc:fcγr结合良好的抗fcγriib抗体增强治疗活性,本发明更令人惊讶。
40.因此,本发明涉及以下各项的组合使用:
41.(i)通过其fab区特异性结合fcγriib并通过其fc区结合fcγ受体的抗体分子(在本文表示为第一抗体分子),以及
42.(ii)特异性结合pd-1并通过其fc区结合至少一种fcγ受体的抗体分子(在本文表示为第二抗体分子)
43.其用于治疗所具有的肿瘤浸润性t淋巴细胞具有中等或高pd-1表达的患者的癌症。
44.此组合旨在用于治疗患者的癌症,诸如实体癌,其目的是通过减少与fcγr(包括fcγriib)的结合改善特异性结合pd-1的抗体分子(即抗pd-1抗体)的治疗功效。
45.根据本发明的特异性结合fcγriib的抗体分子,即第一抗体,通过抗体的fab区与此fcγ受体结合或相互作用,即通过与抗原结合的抗体上的抗原结合区,所述抗原由重链和轻链中的每个重链和轻链中的一个恒定结构域和一个可变结构域构成。具体地,其与免疫效应细胞(例如巨噬细胞)上存在的fcγriib结合,并且具体地与免疫效应细胞表面上存在的fcγriib结合。
46.除上述之外,根据本发明的特异性结合fcγriib的抗体分子,即第一抗体分子,还通过fc区与fc受体之间的相互作用与活化性fcγ受体结合,如所已知的并且已针对人igg1同种型的抗体广泛表征的(bruhns,p.等人(2009)《血液》113(16):3716-3725)。
47.这至少具有以下治疗上重要的后果:活化性和抑制性fcγ受体以抗fcγriib抗体依赖性(fab和fc)方式被阻断,从而防止抗pd-1抗体包被的抗肿瘤t细胞的巨噬细胞吞噬或其他表达fcγ受体的免疫效应细胞的抗pd-1抗体介导的消除(在此上下文中包被是指抗pd-1抗体已与细胞结合)。所述机制还可涉及pd-1抗体从t细胞向表达fcγr的效应细胞(例如巨噬细胞)的巨噬细胞fcγr依赖性转移的抑制,如先前所述(arlauckas,s.p.等人(2017)《科学转化医学》9(389))。
48.表达fcγ受体的免疫效应细胞在本文中主要是指先天效应细胞,并且具体地包括巨噬细胞、中性粒细胞、单核细胞、自然杀伤(nk)细胞、嗜碱性粒细胞、嗜酸性粒细胞、肥大细胞和血小板。细胞毒性t细胞和记忆t细胞通常不表达fcγr,但是在特定情况下可能这样做。在一些实施方案中,免疫效应细胞是先天免疫效应细胞。在一些实施方案中,免疫效应细胞是巨噬细胞。
49.与pd-1特异性结合或相互作用的抗体分子,即第二抗体分子,具有与活化性fcγ
受体结合或相互作用的fc区,从而允许抗pd-1抗体包被的抗肿瘤t细胞的抗体pd-1抗体依赖性fcγr效应细胞依赖性消除。抗pd-1抗体分子结合的免疫细胞是赋予关键抗肿瘤活性的免疫细胞,诸如cd8+或cd4+t细胞。
50.因此,其fc区与活化性fcγ受体结合或相互作用达到导致表达pd-1的抗肿瘤t细胞的表达fcγr的效应细胞消除的程度的任何抗pd-1变体抗体,包括人igg4、igg1、igg2和igg3同种型的那些,可以与fc:fcγr结合良好的抗fcγriib抗体组合,即与通过其fab区特异性结合fcγriib并通过其fc区结合fcγ受体的抗体分子组合。
51.第二抗体是抗pd-1抗体。又称为cd279的pd-1(程序性细胞死亡蛋白1)是免疫检查点,即免疫细胞上的检查点蛋白。它促进淋巴结中抗原特异性t细胞的凋亡并减少调节t细胞的凋亡。pd-1抑制剂,诸如纳武单抗派姆单抗和西米普利单抗用于癌症治疗以激活免疫系统来攻击肿瘤。靶向pd-1或pd-l1的单克隆抗体可以阻断pd-1与pd-l1的结合,这可增强针对癌细胞的免疫反应。
52.抗pd-1抗体与在肿瘤内t细胞上表达的pd-1结合。
53.受益于根据本发明的治疗的患者是根据批准的含有抗pd-1抗体的方案的规范标准,有资格进行抗pd-1疗法并且此外所具有的肿瘤浸润性t淋巴细胞(即肿瘤浸润性cd3+淋巴细胞)具有中等或高pd-1表达的患者。有资格进行抗pd-1疗法的患者包括患有以下疾病的患者:黑色素瘤;肺癌,包括小细胞肺癌(sclc)和非小细胞肺癌(nsclc)(包括非鳞状nsclc和鳞状nsclc,并且包括转移性nsclc);头颈癌,包括头颈部鳞状细胞癌(hnscc);霍奇金淋巴瘤;原发性纵隔b细胞淋巴瘤(pmbcl);膀胱癌,包括晚期尿路上皮癌;结直肠癌,包括高度不稳定性(msi-h)和/或错配修复缺陷(dmmr)的癌症;胃癌,包括晚期胃癌和胃或胃食管结合部(gej)腺癌;宫颈癌;肝癌,包括肝细胞癌;默克尔细胞癌(merkel cell carcinoma,mcc);肾癌,包括肾细胞癌(rcc)和皮肤鳞状细胞癌(cscc),包括不适合进行根治性手术或根治性放射的患者的局部晚期cscc。正如本领域技术人员所知,可以治疗的适应症的数量随着新试验、新抗pd-1抗体和新组合而迅速扩大。
54.在导致本发明的工作中观察到,当将抗pd-1抗体施用于具有中等或高pd-1表达的t细胞时,这可导致抗pd-1抗体包被的t细胞,尤其是cd8阳性t细胞的吞噬作用。在导致本发明的工作中进一步发现,通过将通过其fab区特异性结合fcγriib并通过其fc区结合fcγ受体的抗体分子与抗pd-1抗体一起施用,对于具有中等或高pd-1表达的t细胞来说,这种吞噬作用可以被阻断。用于上述发现的体外测定的体内相关性(在以下实施例中进一步解释)在包括免疫活性小鼠的两种不同实体癌实验模型中得到证实,其中观察到与使用抗pd-1的单药治疗相比,使用fc:fcγr结合良好的抗fcγriib和抗pd-1抗体的组合治疗的存活率显著提高。这也在下面的实施例中更详细地示出。进一步支持体外测定的体内相关性,肿瘤内体内t细胞pd-1表达水平在两种环境中是类似的;体内肿瘤内t细胞pd-1表达范围为每个细胞~20,000至80,000个pd-1分子,跨越pd-1培养基(15,500至78,000个pd-1分子)和高表达(每个细胞65,000至391,000个pd-1分子)的人t细胞的体外表达水平,两者都对人抗pd-1介导的吞噬作用的fc:fcγr结合良好的抗fcγriib阻断敏感。
55.因此,在本发明的上下文中,可受益于本文所述的治疗的患者是所具有的至少10%的肿瘤浸润性t淋巴细胞具有中等或高pd-1表达的患者。
56.在本文中,中等或高表达是指对于至少10%的肿瘤浸润性t淋巴细胞,每个细胞表
达≥15,500个pd-1分子。如下文进一步解释,pd-1表达的绝对数量可取决于使用哪种抗pd-1抗体和/或使用那种方法测量pd-1表达而变化。因此,如本文所用的等于或高于每个细胞15,500个pd-1分子的中等或高表达使用本文所述的方法和/或使用抗人pd-1抗体eh12.2h7(可获自百进生技(biolegend))来测量。
57.与体内环境类似,个体患者的肿瘤内t细胞将表现出异质性pd-1表达。个体患者可具有pd-1表达不同的不同细胞群,诸如具有低表达的一个群和具有中等或高表达的一个群。在一些实施方案中,患者的至少15%肿瘤浸润性cd3+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少20%肿瘤浸润性cd3+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少25%肿瘤浸润性cd3+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少30%肿瘤浸润性cd3+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少35%肿瘤浸润性cd3+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少40%肿瘤浸润性cd3+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少45%肿瘤浸润性cd3+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少50%肿瘤浸润性cd3+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少55%肿瘤浸润性cd3+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少60%肿瘤浸润性cd3+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少65%肿瘤浸润性cd3+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少70%肿瘤浸润性cd3+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少75%肿瘤浸润性cd3+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少80%肿瘤浸润性cd3+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少85%肿瘤浸润性cd3+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少90%肿瘤浸润性cd3+t淋巴细胞具有中等或高pd-1表达。
58.在一些实施方案中,患者的肿瘤浸润性cd3阳性和cd8阳性(cd3+cd8+)t淋巴细胞具有中等或高pd-1表达。
59.在一些实施方案中,患者的至少10%肿瘤浸润性cd3+cd8+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少15%肿瘤浸润性cd3+cd8+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少20%肿瘤浸润性cd3+cd8+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少25%肿瘤浸润性cd3+cd8+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少30%肿瘤浸润性cd3+cd8+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少35%肿瘤浸润性cd3+cd8+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少40%肿瘤浸润性cd3+cd8+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少45%肿瘤浸润性cd3+cd8+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少50%肿瘤浸润性cd3+cd8+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少55%肿瘤浸润性cd3+cd8+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少60%肿瘤浸润性cd3+cd8+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少65%肿瘤浸润性cd3+cd8+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少70%肿瘤浸润性cd3+cd8+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少75%肿瘤浸润
性cd3+cd8+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少80%肿瘤浸润性cd3+cd8+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少85%肿瘤浸润性cd3+cd8+t淋巴细胞具有中等或高pd-1表达。在一些实施方案中,患者的至少90%肿瘤浸润性cd3+cd8+t淋巴细胞具有中等或高pd-1表达。
60.可以使用肿瘤活检来源的细胞或组织测量pd-1在个体患者的肿瘤细胞上的表达。更具体地,可以使用本文描述的或等效的流式细胞术和基于珠粒的抗体以及细胞表位定量试剂盒来对绝对t细胞表达水平进行定量。可替代地,可以使用肿瘤组织活检,将患者活检的抗pd-1染色与组织或细胞离心涂片的细胞的染色进行比较,表示与对抗pd-1抗体活性的抗fcγriib介导的增强敏感(每个细胞≥15,500个pd-1分子)或不敏感(每个细胞《15,500个pd-1分子)相关联的限定和确定的pd-1水平来通过免疫组织化学进行半定量分析。重要的是,如果确定人t细胞pd-1表达的方法与本文描述的定量方法不同,或使用不同的抗pd-1抗体克隆或荧光标记,则需要对测定进行比较和验证,例如针对在以下实施例中(尤其是参考图1在实施例1中)详细描述的方法。一般来说,一种对pd-1表达定量的方法,如实施例1中参考图1所举例说明的,是使用以限定比率用荧光染料标记的抗体;例如-并且如在一些实施方案中优选地-使用以1:1的比率用藻红蛋白(pe)标记的抗体。因此,使用具有限定数量的荧光染料(例如pe)分子的珠粒来生成标准曲线,可以确定与细胞结合的抗体分子的数量。待测试的细胞与标记的抗pd1抗体(诸如来自百进生技的抗人pd-1抗体eh12.2h7)一起孵育,并使用以使得珠粒和细胞可以在相同环境中跑样的方式设置的fac机器进行分析。生成标准曲线,例如通过相对于log荧光对每个珠粒的log分子数作图,然后使荧光染料标记的抗pd1抗体染色的细胞跑样,并使用log平均荧光强度(mfi)计算结合的抗体数量。
61.如上文所提及的,绝对数量可因用于测量的抗pd1抗体而异。
62.除了与免疫细胞上的pd-1特异性结合之外,第二抗体分子还通过其fc区与至少一种fcγ受体结合。在一些实施方案中,第二抗体分子通过其fc区与至少一种活化性fcγ受体结合。第二抗体可以能够通过其fc区结合活化性fcγ受体,诸如存在于免疫效应细胞上的活化性fcγ受体。为了能够结合活化性fcγ受体,至少在一些实施方案中,第二抗体的fc区可在位置297处被糖基化。这个位置中的碳水化合物残基有助于与fcγ受体结合。在一些实施方案中,优选的是,这些残基是含有glnnac、甘露糖、具有末端半乳糖残基和唾液酸的双触碳水化合物。其应该含有fc分子的ch2部分。
63.本发明还涉及一种诊断测试,其可以用于鉴定受益于本文所述的治疗的患者,所述治疗即使用以下各项的组合治疗:(i)通过其fab区特异性结合fcγriib并通过其fc区结合fcγ受体的第一抗体分子,和(ii)特异性结合pd-1并通过其fc区结合至少一种fcγ受体的第二抗体分子。基于与抗fcγriib介导的增强的抗pd-1抗体功效相关联的体内pd-1表达水平,以及并入治疗相关的人抗pd-1抗体以及人t细胞和巨噬细胞的体外吞噬作用测定,发明人已确定,某些t细胞pd-1受体表达水平与抗pd-1治疗功效的抗fcγriib介导的增强相关联,并且是其所必需的。根据本发明的诊断测试基于这一发现,并且因此包括测量样品中的肿瘤细胞上的pd-1表达,所述样品诸如从患者获得的肿瘤活检来源的细胞或组织。如上所述,可以使用t细胞上的pd-1表达水平的绝对或半定量分析。在一些实施方案中,诊断测试是基于抗pd1抗体eh12.2h7用于测量pd-1表达的用途;每个t淋巴细胞表达至少15,500个pd-1分子预示着患者可受益于根据本发明的组合治疗,如上文和实施例1中进一步描述的。
64.抗体是免疫学和分子生物学领域的技术人员众所周知的。通常,抗体包括两条重(h)链和两条轻(l)链。在本文中,有时将此完整抗体分子称为全尺寸(full-size)或全长(full-length)抗体。抗体的重链包括一个可变结构域(vh)和三个恒定结构域(ch1、ch2和ch3),并且抗体的分子轻链包括一个可变结构域(vl)和一个恒定结构域(cl)。可变结构域(有时统称为fv区)与抗体的靶标或抗原结合。每个可变结构域包括三个环,所述环被称为互补决定区(cdr),其负责靶标结合。恒定结构域不直接参与抗体与抗原的结合,而是表现出各种效应功能。根据抗体或免疫球蛋白的重链恒定区的氨基酸序列,所述抗体或免疫球蛋白可以被分配到不同类别。存在免疫球蛋白的五个主要类别:iga、igd、ige、igg和igm,并且在人中,这些类别中的几个类别被进一步划分为亚类(同种型),例如,igg1、igg2、igg3和igg4、iga1和iga2。
65.抗体的另一部分是fc区(另外被称为片段可结晶结构域),其包括所述抗体的重链中的每条重链的恒定结构域中的两个恒定结构域。如上文所提及的,fc区负责抗体与fc受体之间的相互作用。
66.如本文所使用的,术语抗体分子涵盖全长或全尺寸抗体以及全长抗体的功能性片段和此类抗体分子的衍生物。
67.全尺寸抗体的功能性片段具有与对应的全尺寸抗体相同的抗原结合特征,并且包括与对应的全尺寸抗体相同的可变结构域(即,vh和vl序列)和/或相同的cdr序列。功能性片段具有与对应的全尺寸抗体相同的抗原结合特征意味着所述功能性片段与全尺寸抗体结合在靶标上的同一表位。这种功能性片段可以与全尺寸抗体的fv部分相对应。可替代地,这种片段可以是fab,也表示为单价抗原结合片段f(ab)或二价抗原结合片段f(ab')2,所述单价抗原结合片段不含有fc部分,所述二价抗原结合片段含有通过二硫键或f(ab')(即f(ab')2的单价变体)连接在一起的两个抗原结合fab部分。这种片段也可以是单链可变片段(scfv)。
68.功能性片段并不总是含有对应的全尺寸抗体的所有六个cdr。应当理解的是,含有三个或更少cdr区(在一些情况下,甚至只是单个cdr或其一部分)的分子能够保留一个或多个cdr所源自的抗体的抗原结合活性。例如,在gao等人,1994,《生物化学杂志》,269:32389-93中,描述了整个vl链(包含所有三个cdr)对其底物具有高亲和力。
69.含有两个cdr区的分子描述于例如,vaughan和sollazzo 2001,《组合化学与高通量筛选(combinatorial chemistry&high throughput screening)》,4:417-430中。在第418页(右栏—3“设计策略(our strategy for design)”)中,描述了仅包含散布在框架区内的h1和h2 cdr高变区的微抗体。所述微抗体被描述为能够与靶标结合。vaughan和sollazzo引用了以下pessi等人,1993,《自然》,362:367-9和bianchi等人,1994,《分子生物学杂志(j.mol.biol.)》,236:649-59,并且所述文献更详细地描述了h1和h2微抗体和其性质。在qiu等人,2007,《自然生物技术(nature biotechnology)》,25:921-9中,证明了由两个连接的cdr组成的分子能够结合抗原。quiocho 1993,《自然》,362:293-4提供了“微抗体”技术的总结。ladner 2007,《自然生物技术》,25:875-7指出,含有两个cdr的分子能够保留抗原结合活性。
70.含有单个cdr区的抗体分子描述于例如,laune等人,1997,《生物化学杂志》,272:30937-44中,其中证明了衍生自cdr的一系列六肽显示出抗原结合活性,并且注意到完整的
单个cdr的合成肽显示出强结合活性。在monnet等人,1999,《生物化学杂志》,274:3789-96中,示出了一系列12聚体肽和相关框架区具有抗原结合活性,并且指出cdr3样肽单独能够结合抗原。在heap等人,2005,《普通病毒学杂志(j.gen.virol.)》,86:1791-1800中,报道了“微抗体”(含有单个cdr的分子)能够结合抗原,并且示出来自抗hiv抗体的环状肽具有抗原结合活性和功能。在nicaise等人,2004,《蛋白质科学(protein science)》,13:1882-91中,示出了单个cdr可以赋予抗原结合活性和对其溶菌酶抗原的亲和力。
71.因此,具有五个、四个、三个或更少的cdr的抗体分子能够保留其所衍生的全长抗体的抗原结合性质。
72.抗体分子也可以是全长抗体的衍生物或此抗体的片段。当使用一种衍生物时,所述衍生物应当具有与对应的全长抗体相同的抗原结合特征,在某种意义上所述衍生物与全长抗体结合在靶标上的同一表位。
73.因此,如本文所使用的,术语“抗体分子”包含所有类型的抗体分子及其功性能片段及其衍生物,包含:单克隆抗体、多克隆抗体、合成抗体、重组产生的抗体、多特异性抗体、双特异性抗体、人抗体、人来源抗体、人源化抗体、嵌合抗体、单链抗体、单链fv(scfv)、fab片段、f(ab')2片段、f(ab')片段、二硫键连接的fv(sdfv)、抗体重链、抗体轻链、抗体重链的同二聚体、抗体轻链的同二聚体、抗体重链的异二聚体、抗体轻链的异二聚体、此类同二聚体和异二聚体的抗原结合功能性片段。
74.进一步地,如本文所使用的术语“抗体分子”包含所有类别的抗体分子和功能片段,包含:igg、igg1、igg2、igg3、igg4、iga、igm、igd和ige,除非另有说明。
75.在一些实施方案中,第一抗体是人igg1。技术人员将认识到,小鼠igg2a和人igg1接合并能够阻断活化的fcγ受体,从而防止免疫效应细胞上的活化性fcγ受体的抗pd-1抗体介导的接合以及其后续的抗pd-1抗体包被的效应t细胞被例如adcp或adcc消除。如此,在小鼠igg2a是针对小鼠中的缺失的优选同种型的实施方案中,人igg1是在此类实施方案中针对人中的缺失的优选同种型。
76.在一些实施方案中,第一抗体是人igg1。在其他实施方案中,第一抗体是人igg4、igg3或igg2。在其他实施方案中,第一抗体是fc工程化以增强与fcγ受体的结合的人igg抗体。在一些实施方案中,人igg抗体被fc工程化以改善与一种或几种活化性fcγ受体的结合,和/或被工程化以与抑制性fcγ受体相比改善活化性fcγ受体的相对结合。在一些实施方案中,抗fcγriib抗体是fc工程化的人igg抗体。此类工程化的抗体变体的实例包括抗体与fcγriiia的结合选择性地改善的岩藻糖基化抗体,以及通过定向、突变或其它方式、导致与抑制性fcγriib相比,改善与一种或几种活化性fcγ受体的结合的氨基酸取代进行工程化的抗体(richards等人,2008“抗体与fcγriia的结合的优化增强了肿瘤细胞的巨噬细胞吞噬(optimization of antibody binding to fcgammariia enhances macrophage phagocytosis of tumor cells)”,《分子癌症疗法(mol cancer ther)》7:2517-27;lazar等人2006“具有增强的效应功能的工程化的抗体fc变体(engineered antibody fc variants with enhanced effector function)”,《美国国家科学院院刊(proc natl acad sci u s a)》,103:4005-10)。在一些实施方案中,被工程化以改善与活化性fcγ受体的结合的人igg抗体可以是在其fc部分中携带两个突变s239d和i332e或三个突变s239d、i332e和a330l和/或g236a突变的人igg抗体。在一些实施方案中,被工程化以改善与活化性fcγ
受体的结合的人igg抗体可以是岩藻糖基化的人igg抗体。
77.在一些实施方案中,第二抗体是人igg4,即fda目前批准的抗pd-1抗体的同种型纳武单抗、派姆单抗和赛普丽珠单抗(ceplizumab)。技术人员将认识到,几种鼠抗体同种型能够结合活化性和抑制性fcγ受体。重要的是,技术人员将知道,已知与小鼠活化性和抑制性fcγ受体结合的大鼠igg2a同种型与结合人活化性和抑制性fcγ受体的人igg4同种型非常相似(arlauckas,s.p.等人(2017)《科学转化医学》9(389))。技术人员将进一步知道,除了人同种型igg1和igg4之外,人igg3和igg2抗体可有效地与人fcγr接合(sanders,l.a.等人(1995)《传染与免疫(infect immun)》63(1):73-81),并在激活携带活化性fcγ受体的免疫细胞之后通过例如adcp和adcc介导抗体依赖性t细胞耗竭(arce vargas,f.等人(2018)《癌细胞》33(4):649-663e644)。因此,在一些实施方案中,第二抗体可以是人igg1或igg2或igg3抗体。
78.如上所述,本发明涵盖了不同类型和形式的抗体分子,并且是免疫学领域技术人员已知的。众所周知,用于治疗目的的抗体通常被修饰抗体分子性质的另外的组分修饰。
79.因此,包括:本发明的抗体分子或根据本发明使用的抗体分子(例如,单克隆抗体分子和/或多克隆抗体分子和/或双特异性抗体分子)包括可检测部分和/或细胞毒性部分。
[0080]“可检测部分”包括来自包括以下的组的一种或多种:酶;放射性原子;荧光部分;化学发光部分;生物发光部分。可检测部分允许抗体分子在体外和/或体内和/或离体可视化。
[0081]“细胞毒性部分”包括放射性部分和/或酶,其中所述酶是胱天蛋白酶和/或毒素,其中所述毒素是细菌毒素或毒液;其中所述细胞毒性部分能够诱导细胞裂解。
[0082]
进一步包括了抗体分子可以呈分离的形式和/或经纯化的形式,和/或可以是聚乙二醇化的。聚乙二醇化是向分子,诸如抗体分子或衍生物,添加聚乙二醇聚合物以修饰其行为,例如以通过增加其水动力学尺寸来延长其半衰期,从而防止肾清除的方法。
[0083]
如上文所讨论的,抗体的cdr与抗体靶标结合。向本文所描述的每个cdr分配氨基酸符合根据以下的定义:kabat ea等人,1991,“免疫学上所关注的蛋白质的序列(sequences of proteins of immunological interest)”第五版,nih出版号:91-3242,第xv-xvii页。
[0084]
如技术人员将了解的,还存在用于向每个cdr分配氨基酸的其它方法。例如,国际免疫遗传学信息系统(international immunogenetics information system)(imgt(r))(http://www.imgt.org/,以及lefranc和lefranc“免疫球蛋白概况(the immunoglobulin factsbook)”,由学术出版社(academic press)出版,2001)。
[0085]
在另一个实施方案中,本发明的抗体分子或根据本发明使用的抗体分子是能够与本文提供的特异性抗体竞争的抗体分子,例如,用于与特异性靶标结合的包括在例如seq id no:1-194中列出的氨基酸序列中的任何序列的抗体分子。
[0086]“能够竞争”意味着竞争性抗体能够至少部分地抑制或以其它方式干扰本文定义的抗体分子与特异性靶标的结合。
[0087]
例如,这种竞争性抗体分子可以能够将本文所描述的抗体分子的结合抑制至少约10%;(例如至少约20%或至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、约100%)和/或将本文所描述的抗体预防或降低与
特异性靶标结合的能力抑制至少约10%;(例如至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%或约100%)。
[0088]
可以通过本领域的技术人员众所周知的方法来确定竞争性结合,诸如酶联免疫吸附测定(elisa)。
[0089]
可以使用elisa测定来评价表位修饰或阻断抗体。适用于标识竞争性抗体的另外的方法公开于《抗体:实验室手册(antibodies:a laboratory manual)》,harlow和lane中,所述文献通过引用并入本文(例如,参见第567页到第569页、第574页到第576页、第583页以及第590到第612页,1988,冷泉港实验室(cshl),纽约(ny),isbn 0-87969-314-2)。
[0090]
众所周知的是,抗体与限定的靶分子或抗原特异性结合或相互作用,并且这意味着抗体优先地且选择性地结合其靶标而不是非靶标的分子。
[0091]
根据本发明的抗体的靶标或根据本发明使用的抗体的靶标在细胞表面上表达,即所述靶标是细胞表面抗原,其将包括抗体的表位(在此上下文中也被称为细胞表面表位)。细胞表面抗原和表位是免疫学或细胞生物学领域的技术人员容易理解的术语。
[0092]“细胞表面抗原”包括:细胞表面抗原暴露于细胞膜的细胞外侧,但可能仅短暂暴露于细胞膜的细胞外侧。“短暂暴露”包括:细胞表面抗原可以被内化到细胞中,或从细胞膜的细胞外侧释放到细胞外空间中。可以通过裂解从细胞膜的细胞外侧释放细胞表面抗原,所述裂解可以由蛋白酶介导。
[0093]
还包括:细胞表面抗原可连接到细胞膜,但可能仅与细胞膜短暂缔合。“短暂缔合”包括:细胞表面抗原可以从细胞膜的细胞外侧释放到细胞外空间中。可以通过裂解从细胞膜的细胞外侧释放细胞表面抗原,所述裂解可以由蛋白酶介导。
[0094]
进一步包括:细胞表面抗原可以是肽、或多肽、或碳水化合物、或寡糖链或脂质;和/或在蛋白质、糖蛋白或脂蛋白上存在的表位。
[0095]
评估蛋白质结合的方法是生物化学和免疫学的技术人员已知的。技术人员将理解,那些方法可以用于评估抗体与靶标的结合和/或抗体的fc区与fc受体的结合;以及相对强度或特异性,或那些相互作用中的抑制或预防或降低。可以用于评估蛋白质结合的方法的实例为,例如,免疫测定、biacore、蛋白质印迹、放射免疫测定(ria)和酶联免疫吸附测定(elisa)(关于抗体特异性的讨论参见《基础免疫学(fundamental immunology)》第二版,雷文出版社(raven press),纽约;第332-336页(1989))。
[0096]
因此,“特异性结合的抗体分子”或“靶标特异性抗体分子”包括:抗体分子特异性结合靶标但不与非靶标结合,或与靶标相比更弱地与非靶标结合(如具有低亲和力)。
[0097]
还包括以下含义:抗体与靶标特异性结合的强度是抗体与非靶标特异性结合的强度的至少两倍、或至少五倍、或至少10倍、或至少20倍、或至少50倍、或至少100倍、或至少200倍、或至少500倍、或至少约1000倍。
[0098]
另外,包括了以下含义:如果抗体以至少约10-1
kd、或至少约10-2
kd、或至少约10-3
kd、或至少约10-4
kd、或至少约10-5
kd、或至少约10-6
kd、或至少约10-7
kd、或至少约10-8
kd、或至少约10-9
kd、或至少约10-10
kd、或至少约10-11
kd、或至少约10-12
kd、或至少约10-13
kd、或至少约10-14
kd、或至少约10-15
kd的kd值与靶标结合,则所述抗体与靶标特异性结合。
[0099]
在一些实施方案中,特异性结合fcγriib的抗体分子是人抗体。
[0100]
在一些实施方案中,特异性结合fcγriib的抗体分子是人来源的抗体,即已经如
本文所描述的修饰的最初源自人的抗体。
[0101]
在一些实施方案中,特异性结合fcγriib的抗体分子是人源化抗体,即已经被修饰以增加其与人抗体的相似性的最初源自非人的抗体。人源化抗体可以是例如鼠抗体或lama抗体。
[0102]
在一些实施方案中,特异性结合fcγriib的抗体分子包括以下恒定区(ch和cl):
[0103]
igg1-ch[seq id no:1]
[0104]
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
[0105]
igg1-cl[seq id no:2]
[0106]
qpkaapsvtlfppsseelqankatlvclisdfypgavtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshrsyscqvthegstvektvaptecs
[0107]
在一些实施方案中,特异性结合fcγriib的抗体分子包括以下克隆中的一个或多个序列:
[0108]
抗体克隆:1a01
[0109]
1a01-vh[seq id no:3]
[0110]
evqllesggglvqpggslrlscaasgftfsdyymnwirqtpgkglewvsligwdggstyyadsvkgrftisrdnsentlylqmnslraedtavyycaraysgyeldywgqgtlvtvss
[0111]
1a01-vl[seq id no:27]
[0112]
qsvltqppsasgtpgqrvtiscsgsssnignnavnwyqqlpgtapklliydnnnrpsgvpdrfsgsksgtsaslaisglrsedeadyycaawddslnasifgggtkltvlg
[0113]
cdr区
[0114]
cdrh1:dyymn[seq id no:51]
[0115]
cdrh2:ligwdggstyyadsvkg[seq id no:52]
[0116]
cdrh3:aysgyeldy[seq id no:53]
[0117]
cdrl1:sgsssnignnavn[seq id no:54]
[0118]
cdrl2:dnnnrps[seq id no:55]
[0119]
cdrl3:aawddslnasi[seq id no:56]
[0120]
抗体克隆:1b07
[0121]
1b07-vh[seq id no:4]
[0122]
evqllesggglvqpggslrlscaasgftfssygmhwvrqapgkglewvaftrydgsnkyyadsvrgrftisrdnskntlylqmnslraedtavyycarenidafdvwgqgtlvtvss
[0123]
1b07-vl[seq id no:28]
[0124]
qsvltqppsasgtpgqrvtiscsgsssnignnavnwyqqlpgtapklliydnqqrpsgvpdrfsgsksgtsaslaisglrsedeadyyceawddrlfgpvfgggtkltvlg
[0125]
cdr区
[0126]
cdrh1:sygmh[seq id no:57]
[0127]
cdrh2:ftrydgsnkyyadsvrg[seq id no:58]
[0128]
cdrh3:enidafdv[seq id no:59]
[0129]
cdrl1:sgsssnignnavn[seq id no:60]
[0130]
cdrl2:dnqqrps[seq id no:61]
[0131]
cdrl3:wddrlfgpv[seq id no:62]
[0132]
抗体克隆:1c04
[0133]
1c04-vh[seq id no:5]
[0134]
evqllesggglvqpggslrlscaasgftfssyamswvrqapgkglewvssisdsgagryyadsvegrftisrdnskntlylqmnslraedtavyycarthdsgelldafdiwgqgtlvtvss
[0135]
1c04-vl[seq id no:29]
[0136]
qsvltqppsasgtpgqrvtiscsgsssnigsnhvlwyqqlpgtapklliygnsnrpsgvpdrfsgsksgtsaslaisglrsedeadyycaawddslngwvfgggtkltvlg
[0137]
cdr区
[0138]
cdrh1:syams[seq id no:63]
[0139]
cdrh2:sisdsgagryyadsveg[seq id no:64]
[0140]
cdrh3:thdsgelldafdi[seq id no:65]
[0141]
cdrl1:sgsssnigsnhvl[seq id no:66]
[0142]
cdrl2:gnsnrps[seq id no:67]
[0143]
cdrl3:aawddslngwv[seq id no:68]
[0144]
抗体克隆:1e05
[0145]
1e05-vh[seq id no:6]
[0146]
evqllesggglvqpggslrlscaasgftfstyamnwvrqvpgkglewvavisydgsnknyvdsvkgrftisrdnskntlylqmnslraedtavyycarnfdnsgyaipdafdiwgqgtlvtvss
[0147]
1e05-vl[seq id no:30]
[0148]
qsvltqppsasgtpgqrvtisctgsssnigagydvhwyqqlpgtapklliydnnsrpsgvpdrfsgsksgtsaslaisglrsedeadyycaawddslggpvfgggtkltvlg
[0149]
cdr区
[0150]
cdrh1:tyamn[seq id no:69]
[0151]
cdrh2:visydgsnknyvdsvkg[seq id no:70]
[0152]
cdrh3:nfdnsgyaipdafdi[seq id no:71]
[0153]
cdrl1:tgsssnigagydvh[seq id no:72]
[0154]
cdrl2:dnnsrps[seq id no:73]
[0155]
cdrl3:aawddslggpv[seq id no:74]
[0156]
抗体克隆:2a09
[0157]
2a09-vh[seq id no:7]
[0158]
evqllesggglvqpggslrlscaasgftfsnawmswvrqapgkglewvayisrdadithypasvkgrftisrdnskntlylqmnslraedtavyycttgfdyagddafdiwgqgtlvtvss
[0159]
2a09-vl[seq id no:31]
[0160]
qsvltqppsasgtpgqrvtiscsgsssnigsnavnwyqqlpgtapklliygnsdrpsgvpdrfsgsksg
tsaslaisglrsedeadyycaawddslngrwvfgggtkltvlg
[0161]
cdr区
[0162]
cdrh1:nawms[seq id no:75]
[0163]
cdrh2:yisrdadithypasvkg[seq id no:76]
[0164]
cdrh3:gfdyagddafdi[seq id no:77]
[0165]
cdrl1:sgsssnigsnavn[seq id no:78]
[0166]
cdrl2:gnsdrps[seq id no:79]
[0167]
cdrl3:aawddslngrwv[seq id no:80]
[0168]
抗体克隆:2b08
[0169]
2b08-vh[seq id no:8]
[0170]
evqllesggglvqpggslrlscaasgftfsdyymswvrqapgkglewvalighdgnnkyyldslegrftisrdnskntlylqmnslraedtavyycaratdsgydllywgqgtlvtvss
[0171]
2b08-vl[seq id no:32]
[0172]
qsvltqppsasgtpgqrvtiscsgsssnignnavnwyqqlpgtapklliyyddllpsgvpdrfsgsksgtsaslaisglrsedeadyycttwddslsgvvfgggtkltvlg
[0173]
cdr区
[0174]
cdrh1:dyyms[seq id no:81]
[0175]
cdrh2:lighdgnnkyyldsleg[seq id no:82]
[0176]
cdrh3:atdsgydlly[seq id no:83]
[0177]
cdrl1:sgsssnignnavn[seq id no:84]
[0178]
cdrl2:yddllps[seq id no:85]
[0179]
cdrl3:ttwddslsgvv[seq id no:86]
[0180]
抗体克隆:2e8-vh
[0181]
2e8-vh[seq id no:9]
[0182]
evqllesggglvqpggslrlscaasgftfsdyymswirqapgkglewvsaigfsddntyyadsvkgrftisrdnskntlylqmnslraedtavyycaggdgsgwsfwgqgtlvtvss
[0183]
2e8-vl[seq id no:33]
[0184]
qsvltqppsasgtpgqrvtiscsgsssnignnavnwyqqlpgtapklliydnnkrpsgvpdrfsgsksgtsaslaisglrsedeadyycatwddslrgwvfgggtkltvlg
[0185]
cdr区
[0186]
cdrh1:dyyms[seq id no:87]
[0187]
cdrh2:aigfsddntyyadsvkg[seq id no:88]
[0188]
cdrh3:gdgsgwsf[seq id no:89]
[0189]
cdrl1:sgsssnignnavn[seq id no:90]
[0190]
cdrl2:dnnkrps[seq id no:91]
[0191]
cdrl3:atwddslrgwv[seq id no:92]
[0192]
抗体克隆:5c04
[0193]
5c04-vh[seq id no:10]
[0194]
evqllesggglvqpggslrlscaasgftfsnygmhwvrqapgkglewvavisydgsnkyyadsvkgrft
isrdnskntlylqmnslraedtavyycarewrdafdiwgqgtlvtvss
[0195]
5c04-vl[seq id no:34]
[0196]
qsvltqppsasgtpgqrvtisctgsssnigagydvhwyqqlpgtapklliysdnqrpsgvpdrfsgsksgtsaslaisglrsedeadyycaawddslsgswvfgggtkltvlg
[0197]
cdr区
[0198]
cdrh1:nygmh[seq id no:93]
[0199]
cdrh2:visydgsnkyyadsvkg[seq id no:94]
[0200]
cdrh3:wrdafdi[seq id no:95]
[0201]
cdrl1:tgsssnigagydvh[seq id no:96]
[0202]
cdrl2:sdnqrps[seq id no:97]
[0203]
cdrl3:aawddslsgswv[seq id no:98]
[0204]
抗体克隆:5c05
[0205]
5c05-vh[seq id no:11]
[0206]
evqllesggglvqpggslrlscaasgftfstygmhwvrqapgkglewvavisydgsnkyyadsvkgrftisrdnskntlylqmnslraedtavyycarenfdafdvwgqgtlvtvss
[0207]
5c05-vl[seq id no:35]
[0208]
qsvltqppsasgtpgqrvtisctgsssnigagydvhwyqqlpgtapklliysnsqrpsgvpdrfsgsksgtsaslaisglrsedeadyycaawddslngqvvfgggtkltvlg
[0209]
cdr区
[0210]
cdrh1:tygmh[seq id no:99]
[0211]
cdrh2:visydgsnkyyadsvkg[seq id no:100]
[0212]
cdrh3:enfdafdv[seq id no:101]
[0213]
cdrl1:tgsssnigagydvh[seq id no:102]
[0214]
cdrl2:snsqrps[seq id no:103]
[0215]
cdrl3:aawddslngqvv[seq id no:104]
[0216]
抗体克隆:5d07
[0217]
5d07-vh[seq id no:12]
[0218]
evqllesggglvqpggslrlscaasgftfstygmhwvrqapgkglewvaviaydgskkdyadsvkgrftisrdnskntlylqmnslraedtavyycareyrdafdiwgqgtlvtvss
[0219]
5d07-vl[seq id no:36]
[0220]
qsvltqppsasgtpgqrvtisctgsssnigagydvhwyqqlpgtapklliygnsnrpsgvpdrfsgsksgttaslaisglrsedeadyycaawddsvsgwmfgggtkltvlg
[0221]
cdr区
[0222]
cdrh1:tygmh[seq id no:105]
[0223]
cdrh2:viaydgskkdyadsvkg[seq id no:106]
[0224]
cdrh3:eyrdafdi[seq id no:107]
[0225]
cdrl1:tgsssnigagydvh[seq id no:108]
[0226]
cdrl2:gnsnrps[seq id no:109]
[0227]
cdrl3:aawddsvsgwm[seq id no:110]
[0228]
抗体克隆:5e12
[0229]
5e12-vh[seq id no:13]
[0230]
evqllesggglvqpggslrlscaasgftfssygmhwvrqapgkglewvavisydginkdyadsmkgrftisrdnskntlylqmnslraedtavyycarerkdafdiwgqgtlvtvss
[0231]
5e12-vl[seq id no:37]
[0232]
qsvltqppsasgtpgqrvtisctgsssnigagydvhwyqqlpgtapklliysnnqrpsgvpdrfsgsksgtsaslaisglrsedeadyycatwddslnglvfgggtkltvlg
[0233]
cdr区
[0234]
cdrh1:sygmh[seq id no:111]
[0235]
cdrh2:visydginkdyadsmkg[seq id no:112]
[0236]
cdrh3:erkdafdi[seq id no:113]
[0237]
cdrl1:tgsssnigagydvh[seq id no:114]
[0238]
cdrl2:snnqrps[seq id no:115]
[0239]
cdrl3:atwddslnglv[seq id no:116]
[0240]
抗体克隆:5g08
[0241]
5g08-vh[seq id no:14]
[0242]
evqllesggglvqpggslrlscaasgftfnnygmhwvrqapgkglewvavisydgsnryyadsvkgrftmsrdnskntlylqmnslraedtavyycardrwngmdvwgqgtlvtvss
[0243]
5g08-vl[seq id no:38]
[0244]
qsvltqppsasgtpgqrvtiscsgsssnigagydvhwyqqlpgtapklliyannqrpsgvpdrfsgsksgtsaslaisglrsedeadyycaawddslngpwvfgggtkltvlg
[0245]
cdr区
[0246]
cdrh1:nygmh[seq id no:117]
[0247]
cdrh2:visydgsnryyadsvkg[seq id no:118]
[0248]
cdrh3:drwngmdv[seq id no:119]
[0249]
cdrl1:sgsssnigagydvh[seq id no:120]
[0250]
cdrl2:annqrps[seq id no:121]
[0251]
cdrl3:aawddslngpwv[seq id no:122]
[0252]
抗体克隆:5h06
[0253]
5h06-vh[seq id no:15]
[0254]
evqllesggglvqpggslrlscaasgftfssygmhwvrqapgkglewvavisydgsdtayadsvkgrftisrdnskntlylqmnslraedtavyycardhsvigafdiwgqgtlvtvss
[0255]
5h06-vl[seq id no:39]
[0256]
qsvltqppsasgtpgqrvtiscsgsssnigsntvnwyqqlpgtapklliydnnkrpsgvpdrfsgsksgtsaslaisglrsedeadyycssyagsnnvvfgggtkltvlg
[0257]
cdr区
[0258]
cdrh1:sygmh[seq id no:123]
[0259]
cdrh2:visydgsdtayadsvkg[seq id no:124]
[0260]
cdrh3:dhsvigafdi[seq id no:125]
[0261]
cdrl1:sgsssnigsntvn[seq id no:126]
[0262]
cdrl2:dnnkrps[seq id no:127]
[0263]
cdrl3:ssyagsnnvv[seq id no:128]
[0264]
抗体克隆:6a09
[0265]
6a09-vh[seq id no:16]
[0266]
evqllesggglvqpggslrlscaasgftfssygmhwvrqapgkglewvavtsydgntkyyansvkgrftisrdnskntlylqmnslraedtavyycaredcggdcfdywgqgtlvtvss
[0267]
6a09-vl[seq id no:40]
[0268]
qsvltqppsasgtpgqrvtisctgsssnigagydvhwyqqlpgtapklliygnsnrpsgvpdrfsgsksgtsaslaisglrsedeadyycaawddslnegvfgggtkltvlg
[0269]
cdr区
[0270]
cdrh1:sygmh[seq id no:129]
[0271]
cdrh2:vtsydgntkyyansvkg[seq id no:130]
[0272]
cdrh3:edcggdcfdy[seq id no:131]
[0273]
cdrl1:tgsssnigagydvh[seq id no:132]
[0274]
cdrl2:gnsnrps[seq id no:133]
[0275]
cdrl3:aawddslnegv[seq id no:134]
[0276]
抗体克隆:6b01
[0277]
6b01-vh[seq id no:17]
[0278]
evqllesggglvqpggslrlscaasgftfsnygmhwvrqapgkglewvavisydgsnkyyadsvkgrftisrdnskntlylqmnslraedtavyycardqlgeafdiwgqgtlvtvss
[0279]
6b01-vl[seq id no:41]
[0280]
qsvltqppsasgtpgqrvtisctgsssnigagydvhwyqqlpgtapklliydnnkrpsgvpdrfsgsksgtsaslaisglrsedeadyycatwddslsgpvfgggtkltvlg
[0281]
cdr区
[0282]
cdrh1:nygmh[seq id no:135]
[0283]
cdrh2:visydgsnkyyadsvkg[seq id no:136]
[0284]
cdrh3:dqlgeafdi[seq id no:137]
[0285]
cdrl1:tgsssnigagydvh[seq id no:138]
[0286]
cdrl2:dnnkrps[seq id no:139]
[0287]
cdrl3:atwddslsgpv[seq id no:140]
[0288]
抗体克隆:6c11
[0289]
6c11-vh[seq id no:18]
[0290]
evqllesggglvqpggslrlscaasgftfddygmswvrqapgkglewvsaisgsgsstyyadsvkgrftisrdnskntlylqmnslraedtavyycaggdidyfdywgqgtlsvtvss
[0291]
6c11-vl[seq id no:42]
[0292]
qsvltqppsasgtpgqrvtisctgsssnfgagydvhwyqqlpgtapklliyennkrpsgvpdrfsgsksgtsaslaisglrsedeadyycaawddslngpvfgggtkltvlg
[0293]
cdr区
[0294]
cdrh1:dygms[seq id no:141]
[0295]
cdrh2:aisgsgsstyyadsvkg[seq id no:142]
[0296]
cdrh3:gdidyfdy[seq id no:143]
[0297]
cdrl1:tgsssnfgagydvh[seq id no:144]
[0298]
cdrl2:ennkrps[seq id no:145]
[0299]
cdrl3:aawddslngpv[seq id no:146]
[0300]
抗体克隆:6c12
[0301]
6c12-vh[seq id no:19]
[0302]
evqllesggglvqpggslrlscaasgftfssygmhwvrqapgkglewvavisydgsnkyyadsvkgrftisrdnskntlylqmnslraedtavyycarerrdafdiwgqgtlvtvss
[0303]
6c12-vl[seq id no:43]
[0304]
qsvltqppsasgtpgqrvtisctgsssnigagydvhwyqqlpgtapklliysdnqrpsgvpdrfsgsksgtsaslaisglrsedeadyycatwdsdtpvfgggtkltvlg
[0305]
cdr区
[0306]
cdrh1:sygmh[seq id no:147]
[0307]
cdrh2:visydgsnkyyadsvkg[seq id no:148]
[0308]
cdrh3:errdafdi[seq id no:149]
[0309]
cdrl1:tgsssnigagydvh[seq id no:150]
[0310]
cdrl2:sdnqrps[seq id no:151]
[0311]
cdrl3:atwdsdtpv[seq id no:152]
[0312]
抗体克隆:6d01
[0313]
6d01-vh[seq id no:20]
[0314]
evqllesggglvqpggslrlscaasgftfssygmhwvrqapgkglewvavisydgsnkyyadsvkgrftisrdnskntlylqmnslraedtamyycardhsaagyfdywgqgtlvtvss
[0315]
6d01-vl[seq id no:44]
[0316]
qsvltqppsasgtpgqrvtiscsgsssnigsntvnwyqqlpgtapklliygnsirpsggpdrfsgsksgtsaslaisglrsedeadyycaswddslsspvfgggtkltvlg
[0317]
cdr区
[0318]
cdrh1:sygmh[seq id no:153]
[0319]
cdrh2:visydgsnkyyadsvkg[seq id no:154]
[0320]
cdrh3:dhsaagyfdy[seq id no:155]
[0321]
cdrl1:sgsssnigsntvn[seq id no:156]
[0322]
cdrl2:gnsirps[seq id no:157]
[0323]
cdrl3:aswddslsspv[seq id no:158]
[0324]
抗体克隆:6g03
[0325]
6g03-vh[seq id no:21]
[0326]
evqllesggglvqpggslrlscaasgftfgsygmhwvrqapgkglewvsgiswdsaiidyagsvkgrftisrdnskntlylqmnslraedtavyycakdeaaagafdiwgqgtlvtvss
[0327]
6g03-vl[seq id no:45]
[0328]
qsvltqppsasgtpgqrvtisctgsssnigagydvhwyqqlpgtapklliygntdrpsgvpdrfsgsksgtsaslaisglrsedeadyycaawddslsgpvvfgggtkltvlg
[0329]
cdr区
[0330]
cdrh1:sygmh[seq id no:159]
[0331]
cdrh2:giswdsaiidyagsvkg[seq id no:160]
[0332]
cdrh3:deaaagafdi[seq id no:161]
[0333]
cdrl1:tgsssnigagydvh[seq id no:162]
[0334]
cdrl2:gntdrps[seq id no:163]
[0335]
cdrl3:aawddslsgpvv[seq id no:164]
[0336]
抗体克隆:6g08
[0337]
6g08-vh[seq id no:22]
[0338]
evqllesggglvqpggslrlscaasgftlssygiswvrqapgkglewvsgisgsggntyyadsvkgrftisrdnskntlylqmnslraedtavyycassvgayandafdiwgqgtlvtvss
[0339]
6g08-vl[seq id no:46]
[0340]
qsvltqppsasgtpgqrvtisctgsssnigagydvhwyqqlpgtapklliygdtnrpsgvpdrfsgsksgtsaslaisglrsedeadyycaawddslngpvfgggtkltvlg
[0341]
cdr区
[0342]
cdrh1:sygis[seq id no:165]
[0343]
cdrh2:gisgsggntyyadsvkg[seq id no:166]
[0344]
cdrh3:svgayandafdi[seq id no:167]
[0345]
cdrl1:tgsssnigagydvh[seq id no:168]
[0346]
cdrl2:gdtnrps[seq id no:169]
[0347]
cdrl3:aawddslngpv[seq id no:170]
[0348]
抗体克隆:6g11
[0349]
6g11-vh[seq id no:23]_
[0350]
evqllesggglvqpggslrlscaasgftfssygmhwvrqapgkglewmavisydgsnkyyadsvkgrftisrdnskntlylqmnslraedtavyycarelydafdiwgqgtlvtvss
[0351]
6g11-vl[seq id no:47]
[0352]
qsvltqppsasgtpgqrvtisctgsssnigagydvhwyqqlpgtapklliyaddhrpsgvpdrfsgsksgtsaslaisglrsedeadyycaswddsqravifgggtkltvlg
[0353]
cdr区
[0354]
cdrh1:sygmh[seq id no:171]
[0355]
cdrh2:visydgsnkyyadsvkg[seq id no:172]
[0356]
cdrh3:elydafdi[seq id no:173]
[0357]
cdrl1:tgsssnigagydvh[seq id no:174]
[0358]
cdrl2:addhrps[seq id no:175]
[0359]
cdrl3:aswddsqravi[seq id no:176]
[0360]
抗体克隆:6h08
[0361]
6h08-vh[seq id no:24]
[0362]
evqllesggglvqpggslrlscaasgftfnnygmhwvrqapgkglewvavisydgsnkyyadsvkgrftiskdnskntlylqmnslraedtavyycareykdafdiwgqgtlvtvss
[0363]
6h08-vl[seq id no:48]
[0364]
qsvltqppsasgtpgqrvtisctgsssnigsntvnwyqqlpgtapklliydnnkrpsgvpdrfsgsksgtsaslaisglrsedeadyycqawgtgirvfgggtkltvlg
[0365]
cdr区
[0366]
cdrh1:nygmh[seq id no:177]
[0367]
cdrh2:visydgsnkyyad svkg[seq id no:178]
[0368]
cdrh3:eykdafdi[seq id no:179]
[0369]
cdrl1:tgsssnigsntvn[seq id no:180]
[0370]
cdrl2:dnnkrps[seq id no:181]
[0371]
cdrl3:qawgtgirv[seq id no:182]
[0372]
抗体克隆:7c07
[0373]
7c07-vh[seq id no:25]
[0374]
evqllesggglvqpggslrlscaasgftfssygmhwvrqapgkglewvavisydgsnkyyadsvkgrftisrdnsqntlylqmnslraedtavyycarefgyiildywgqgtlvtvss
[0375]
7c07-vl[seq id no:49]
[0376]
qsvltqppsasgtpgqrvtiscsgsssnigsntvnwyqqlpgtapklliyrdyerpsgvpdrfsgsksgtsaslaisglrsedeadyycmawddslsgvvfgggtkltvlg
[0377]
cdr区
[0378]
cdrh1:sygmh[seq id no:183]
[0379]
cdrh2:visydgsnkyyadsvkg[seq id no:184]
[0380]
cdrh3:efgyiildy[seq id no:185]
[0381]
cdrl1:sgsssnigsntvn[seq id no:186]
[0382]
cdrl2:rdyerps[seq id no:187]
[0383]
cdrl3:mawddslsgvv[seq id no:188]
[0384]
抗体克隆:4b02
[0385]
4b02-vh[seq id no:26]
[0386]
evqllesggglvqpggslrlscaasgftfsnhgmhwvrqapgkglewvavisydgtnkyyadsvrgrftisrdnskntlylqmnslraedtavyycaretwdafdvwgqgtlvtvss
[0387]
4b02-vl[seq id no:50]
[0388]
qsvltqppsasgtpgqrvtiscsgsssnigsnnanwyqqlpgtapklliydnnkrpsgvpdrfsgsksgtsaslaisglrsedeadyycqawdsstvvfgggtkltvlg
[0389]
cdr区
[0390]
cdrh1:nhgmh[seq id no:189]
[0391]
cdrh2:visydgtnkyyadsvrg[seq id no:190]
[0392]
cdrh3:etwdafdv[seq id no:191]
[0393]
cdrl1:sgsssnigsnnan[seq id no:192]
[0394]
cdrl2:dnnkrps[seq id no:193]
[0395]
cdrl3:qawdsstvv[seq id no:194]
[0396]
在一些实施方案中,有时是优选实施方案,特异性结合fcγriib的抗体分子包括以下cdr区:seq id no:171(cdrh1)、seq id no:172(cdrh2)、seq id no:173(cdrh3)、seq id no:174(cdrl1)、seq id no:175(cdrl2)和seq id no:176(cdrl3),即克隆6g11的cdr区。
[0397]
在一些实施方案中,有时是优选实施方案,特异性结合fcγriib的抗体分子包括以下恒定区:seq id no:1(ch)和seq id no:2(cl);以及以下可变区:seq id no:23(vl)和seq id no:47(vh),即克隆6g11的恒定区和可变区。
[0398]
在一些实施方案中,抗pd-1抗体分子是人抗体分子或人来源的抗体分子。在一些此类实施方案中,人抗体分子或人来源的抗体分子是igg抗体。在一些此类实施方案中,人抗体分子或人来源的抗体分子是igg4。
[0399]
抗pd-1抗体分子是与pd-1特异性结合的抗体分子。
[0400]
在一些实施方案中,抗pd-1抗体分子阻断pd-l1和/或pd-l2与pd-1的结合,并且因此可被视为pd-1拮抗剂。
[0401]
在一些实施方案中,抗pd-1抗体分子是人源化抗体分子。
[0402]
在一些实施方案中,抗pd-1抗体分子是嵌合抗体。
[0403]
如上文所提及的,抗pd-1抗体必须具有接合fcγr的能力。
[0404]
在一些实施方案中,抗pd-1抗体分子选自由以下组成的组:纳武单抗派姆单抗和西米普利单抗
[0405]
在一些实施方案中,将特异性结合fcγriib的抗体分子和抗pd-1抗体分子同时向患者施用,这意味着这两种抗体分子在一个时间点一起施用或在时间上彼此非常接近地分开施用。
[0406]
在一些实施方案中,在施用抗pd-1抗体分子之前,向患者施用特异性结合fcγriib的抗体分子。可通过暂时分离两种抗体来实现这种依次施用。可替代地,或与第一选项组合,依次施用还可通过以下来实现:空间分离两种抗体分子;以某种方式(诸如肿瘤内)施用特异性结合fcγriib的抗体分子,使得其在抗pd-1抗体分子之前到达癌症,然后以某种方式(诸如全身性)施用所述抗pd-1抗体分子,从而使其在特异性结合fcγriib的抗体分子之后到达癌症。
[0407]
在一些实施方案中,在施用特异性结合fcγriib的抗体分子之前,向患者施用抗pd-1抗体分子。与上述情况类似,可通过暂时分离两种抗体和/或通过空间分离两种抗体分子来实现这种依次施用。对于空间施用,以某种方式(诸如肿瘤内)施用抗pd-1抗体分子,使得其在特异性结合fcγriib的抗体分子之前到达癌症,然后以某种方式(诸如全身性)施用所述特异性结合fcγriib的抗体分子,从而使其在抗pd-1抗体分子之后到达癌症。
[0408]
医学领域的技术人员将理解,药物可以用不同添加剂来修饰,例如以改变身体吸收药物的速率;并且药物可以以不同形式修饰,例如以允许到身体的特定施用途径。
[0409]
因此,包括了本发明的组合物和/或抗体和/或药物可与赋形剂和/或药学上可接受的载剂和/或药学上可接受的稀释剂和/或佐剂组合。
[0410]
还包括了,本发明的组合物和/或抗体和/或药物可适合于肠胃外施用,本发明的组合物和/或抗体和/或药物包括:水性和/或非水性无菌注射溶液,其可含有抗氧化剂和/
或缓冲剂和/或抑菌剂和/或使调配物与预期接受者的血液等渗的溶质;和/或水性和/或非水性无菌悬浮液,其可包括悬浮剂和/或增稠剂。本发明的组合物和/或抗体和/或药剂和/或药物可存在于单位剂量或多剂量容器(例如密封的安瓿瓶和小瓶)中,并且可储存在仅需要在即将使用之前添加无菌液体载剂(例如,注射用水)的冷冻干燥(即冻干)条件中。
[0411]
可由前述种类的无菌粉末和/或颗粒和/或片剂制备临时注射溶液和悬浮液。
[0412]
对于人患者的肠胃外施用而言,以单剂量或分剂量施用的特异性结合fcγriib的抗体分子和/或抗pd-1抗体分子的每日剂量水平将通常是1mg/kg患者体重至20mg/kg,或在一些情况下甚至高达100mg/kg。在特殊情况下,例如在结合长期施用的情况下,可使用较低剂量。在任何情况下,医生将确定最适合于任何个体患者的实际剂量,并且所述实际剂量将随着特定患者的年龄、体重和反应而变化。上述剂量是一般情况的示例。当然,可以存在个别情况,其中更高或更低的剂量范围是理所当然的,并且此剂量处于本发明的范围内。
[0413]
通常,本发明的组合物和/或药物将含有浓度介于大约2mg/ml与150mg/ml之间或介于大约2mg/ml与200mg/ml之间的特异性结合fcγriib的抗体分子和/或抗pd-1抗体。在一个优选实施方案中,本发明的药物和/或组合物将含有浓度为10mg/ml的特异性结合fcγriib的抗体分子和/或抗pd-1抗体分子。
[0414]
通常,在人中,口服或肠胃外施用本发明的组合物和/或抗体和/或药剂和/或药物是最方便的优选途径。对于兽医学用途,根据正常兽医学实践将本发明的组合物和/或抗体和/或药剂和/或药物作为适当可接受的调配物施用,并且兽医将确定最适用于特定动物的给药方案和施用途径。因此,本发明提供了一种药物调配物,其包含一定量的可有效治疗各种病症的本发明的抗体和/或药剂(如上文所述和下文进一步描述的)。优选地,所述组合物和/或抗体和/或药剂和/或药物适合于通过选自包括以下的组的途径进行递送:静脉内(iv);皮下(sc);肌肉内(im)或肿瘤内。
[0415]
本发明还包括包含本发明的多肽结合部分的药学上可接受的酸加成盐或碱加成盐的组合物和/或抗体和/或药剂和/或药物。用于制备可用于本发明的上述碱化合物的药学上可接受的酸加成盐的酸是形成无毒酸加成盐的酸,即含有药理学上可接受的阴离子的盐,诸如盐酸盐、氢溴酸盐、氢碘酸盐、硝酸盐、硫酸盐、硫酸氢盐、磷酸盐、酸性磷酸盐、乙酸盐、乳酸盐、柠檬酸盐、酸性柠檬酸盐、酒石酸盐、酒石酸氢盐、琥珀酸盐、马来酸盐、富马酸盐、葡萄糖酸盐、蔗糖酸盐、苯甲酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐和双羟萘酸盐[即,1,1'-亚甲基-双-(2-羟基-3萘甲酸酯)]盐等。也可使用药学上可接受的碱加成盐来产生药学上可接受的盐形式的根据本发明的药剂。可用作试剂以制备在性质上为酸性的本发明药剂的药学上可接受的碱盐的化学碱是与此类化合物形成无毒碱盐的那些。此类无毒碱盐包括但不限于:衍生自此类药学上可接受的阳离子的碱盐,诸如碱金属阳离子(例如,钾和钠)和碱土金属阳离子(例如,钙和镁)的碱盐;铵或水溶性胺加成盐,诸如n-甲基葡糖胺-(葡甲胺);以及低级链烷醇铵和药学上可接受的有机胺的其它碱盐,等等。可将本发明的药剂和/或多肽结合部分冻干以用于储存,并在使用之前在合适的载剂中重构。可以采用任何合适的冻干方法(例如,喷雾干燥、滤饼干燥(cake drying))和/或重构技术。本领域的技术人员将理解,冻干和重构可能导致不同程度的抗体活性损失(例如,对于常规免疫球蛋白,igm抗体往往比igg抗体具有更大的活性损失),并且可能必须向上调整使用水平以进行补偿。在一个实施方案中,当再水化时,冻干的(冷冻干燥的)多肽结合部分损失其活性
(在冻干之前)的不超过约20%、或不超过约25%、或不超过约30%、或不超过约35%、或不超过约40%、或不超过约45%、或不超过约50%。
[0416]
特异性结合fcγriib的抗体分子与抗pd-1抗体分子的组合可以用于治疗癌症。
[0417]
如本文所使用的术语“患者”是指已经被诊断为患有fcγriib阴性癌症或诊断为患有被认为可能是fcγriib阴性癌症和/或表现出这种癌症的症状的癌症的动物,包括人。
[0418]
包括了患者可以是哺乳动物或非哺乳动物。优选地,患者是人或哺乳动物,诸如马、或牛、或羊、或猪、或骆驼、或狗或猫。最优选地,哺乳动物患者是人。
[0419]“表现”包括:受试者表现出癌症症状和/或癌症诊断标志物、和/或所述癌症症状和/或癌症诊断标志物可以被测量和/或评估和/或量化。
[0420]
对于医学领域的技术人员而言,容易理解的是:癌症症状和癌症诊断标志物将是什么以及如何测量和/或评估和/或量化癌症症状的严重程度是否降低或增加、或癌症诊断标志物是否减少或增加;以及如何可以使用那些癌症症状和/或癌症诊断标志物来形成癌症的预后。
[0421]
癌症治疗通常以一系列治疗的治疗形式施用,也就是说,治疗剂在一段时间内施用。一系列治疗的时间的长度将取决于许多因素,所述许多因素可以包含所施用的治疗剂的类型、所治疗的癌症的类型、所治疗的癌症的严重度以及患者的年龄和健康状况等其它原因。
[0422]“治疗期间”包括了,患者当前正在接受一系列治程和/或正在接受治疗剂、和/或正在接受一系列治疗剂。
[0423]
根据本发明待治疗的患者患有以pd-1阳性肿瘤为特征的癌症。
[0424]
在一些实施方案中,待治疗的癌症是实体癌。
[0425]
在一些实施方案中,待治疗的实体癌是治疗通常由使用抗pd-1抗体的免疫疗法组成或包括所述免疫疗法的癌症。
[0426]
在一些实施方案中,待治疗的癌症选自由以下组成的组:黑色素瘤;肺癌,包括小细胞肺癌(sclc)和非小细胞肺癌(nsclc)(包括非鳞状nsclc和鳞状nsclc,并且包括转移性nsclc);头颈癌,包括头颈部鳞状细胞癌(hnscc);霍奇金淋巴瘤;原发性纵隔b细胞淋巴瘤(pmbcl);膀胱癌,包括晚期尿路上皮癌;结直肠癌,包括高度不稳定性(msi-h)和/或错配修复缺陷(dmmr)的癌症;胃癌,包括晚期胃癌和胃或胃食管结合部(gej)腺癌;宫颈癌;肝癌,包括肝细胞癌;默克尔细胞癌(mcc);肾癌,包括肾细胞癌(rcc)和皮肤鳞状细胞癌(cscc),包括不适合进行根治性手术或根治性放射的患者的局部晚期cscc。本领域技术人员将知道,与抗pd-1免疫疗法相关的适应症的数量和类型正在迅速扩大。
[0427]
在一些实施方案中,癌症是难治性癌症。在一些此类实施方案中,难治性癌症是发现在治疗开始时就已经对使用抗pd-1抗体的治疗具有抗性的癌症。这种抗性可以通过患者对治疗完全没有反应或尽管治疗但仍存在癌症的某些进展来证明。在一些实施方案中,难治性癌症是在用抗pd-1抗体治疗期间变得对所述抗体具有抗性的癌症,这意味着患者停止对治疗作出反应或表现出对治疗的反应降低。在一些实施方案中,难治性癌症在用抗pd-1抗体成功治疗之后或在最后阶段具有抗性,这意味着如果癌症复发,抗pd-1抗体将没有效果或效果降低。
[0428]
上述癌症中的每一种癌症都是众所周知的,并且如用于治疗那些癌症的治疗剂一
样对症状和癌症诊断标志物进行了很好的描述。因此,症状、癌症诊断标志物和用于治疗以上提及的癌症类型的治疗剂将是医学技术人员已知的。
[0429]
对大量癌症的诊断、预后和进展的临床定义依赖于被称为分期的某些分类。那些分期系统用于核对许多不同癌症诊断标志物和癌症症状,以提供对癌症的诊断和/或预后和/或进展的概述。肿瘤学的技术人员将理解如何使用分期系统评估癌症的诊断和/或预后和/或进展,以及应该使用哪些癌症诊断标志物和癌症症状来进行评估。
[0430]“癌症分期”包括:rai分期,所述rai分期包括0期、i期、ii期、iii期和iv期;和/或binet分期,所述binet分期包括a期、b期和c期;和/或安娜堡分期(ann arbour staging),所述安娜堡分期包括i期、ii期、iii期和iv期。
[0431]
已知的是,癌症可以引起细胞形态的异常。这些异常通常可再现地发生在某些癌症中,这意味着在癌症的诊断或预后中可以使用检查形态的这些变化(另外被称为组织学检查)。用于使样品可视化以检查细胞形态并且用于制备用于可视化的样品的技术是本领域众所周知的;例如,光学显微镜或共聚焦显微镜。
[0432]“组织学检查”包括:存在小型成熟淋巴细胞;和/或存在具有狭窄细胞质边界的小型成熟淋巴细胞;存在具有缺乏可辨别的核仁的致密核的小型成熟淋巴细胞;和/或存在具有狭窄细胞质边界并且具有缺乏可辨别的核仁的致密核的小型成熟淋巴细胞;和/或存在非典型细胞和/或裂解的细胞和/或幼淋巴细胞。
[0433]
众所周知,癌症是细胞dna突变的结果,所述突变可能导致细胞避免细胞死亡或不可控制地增殖。因此,检查这些突变(也被称为细胞遗传学检查)可能是用于评估癌症诊断和/或预后的有用工具。这一点的实例是染色体位置13q14.1的缺失,这是慢性淋巴细胞性白血病的特征。用于检查细胞的突变的技术是本领域中众所周知的;例如,荧光原位杂交(fish)。
[0434]“细胞遗传学检查”包括检查细胞以及具体地染色体中的dna。细胞遗传学检查可以用于标识dna的变化,所述变化可能与难治性癌症和/或复发性癌症的存在相关联。此类变化可包括:染色体13的长臂中的缺失;和/或染色体位置13q14.1的缺失;和/或染色体12的三体性;和/或染色体12的长臂中的缺失;和/或染色体11的长臂中的缺失;和/或11q的缺失;和/或染色体6的长臂中的缺失;和/或6q的缺失;和/或染色体17的短臂中的缺失;和/或17p缺失;和/或t(11:14)易位;和/或(q13:q32)易位;和/或抗原基因受体重排;和/或bcl2重排;和/或bcl6重排;和/或t(14:18)易位;和/或t(11:14)易位;和/或(q13:q32)易位;和/或(3:v)易位;和/或(8:14)易位;和/或(8:v)易位;和/或t(11:14)和(q13:q32)易位。
[0435]
已知的是,患有癌症的患者表现出某些身体症状,所述身体症状通常是由于癌症对身体的负担引起的。那些症状通常再发生在同一癌症中,并且因此可以作为疾病的诊断和/或预后和/或进展的特征。医学领域的技术人员将理解哪些身体症状与哪些癌症相关联,以及评估那些身体系统如何与疾病的诊断和/或预后和/或进展相关。“身体症状”包括肝肿大和/或脾肿大。
附图说明
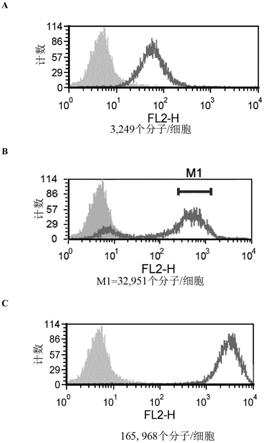
[0436]
在下文的实例中,参考以下附图:
[0437]
图1示出用pd-1转染的人jurkat t细胞上的pd-1表达。将pd-1转染的jurkat细胞
分选为低、中等和高pd-1表达细胞。扩增后,对三个不同亚群中的pd-1表达进行定量,并且pd-1分子数量/细胞在图1a(低)、图1b(中等)和图1c(高)中示出。
[0438]
图2示出bi-1206(6g11 wt)抑制中等和高表达细胞但不抑制低表达细胞的pd-1介导的吞噬作用。图2a展示了示出被吞噬的jurkat细胞的实例。y轴上的fl4描绘cd14+巨噬细胞并且x轴上的fl1描绘cfse标记的jurkat细胞。因此,被圈出的右上象限示出双阳性cd14+cfse+细胞,它们是被吞噬的jurkat细胞。该实例示出pd-1高表达的jurkat细胞的吞噬作用。图2b示出pd-1中表达的jurkat细胞的吞噬作用并且图2c示出高表达的jurkat细胞。所述值针对同种型调理作用(设置为0%)和抗cd3调理作用(okt3 higg1,设置为100%)进行归一化。该图示出bi-1206(图中表示为6g11 wt)在所有测试浓度下均抑制纳武单抗介导的吞噬作用。此外,该图示出6g11抗体需要完整的fc部分来抑制吞噬作用,因为通过诱导在位置297处从氨基酸天冬酰胺(n)突变为氨基酸谷氨酰胺(q)(即抗体在此处表示为6g11nq)导致的fcγr结合的破坏使其抑制纳武单抗介导的吞噬作用的能力降低。该图示出用于中表达细胞的2个实验和用于高表达细胞的3个实验。图2d示出在低表达细胞中不存在纳武单抗介导的吞噬作用。
[0439]
图3示出fc:fcγr结合良好的抗fcγriib(at-130-2migg2a和migg1),而不是fc:fcγr结合受损的抗fcγriib(at-130-2migg1 na),在体内增强抗pd-1抗体的治疗功效和存活率。将ct26(图a和b)或mc38(图3c和图3d)荷瘤小鼠用单独的或与200μg所指示的抗fcγriib抗体变体或同种型对照(wr17)组合的200μg抗pd-1(克隆29f.1a12;bioxcell)抗体治疗三次(皮下接种在100μl pbs中的5
×
105个肿瘤细胞后第8、12和15天)。对于第一次治疗,在抗pd1抗体之前6小时施用at130-2。对于后续治疗,两种抗体一起给予。所有注射均为腹膜内,在200μl pbs中。当肿瘤达到400mm2(对于ct26)或225mm2(对于mc38)的面积时被认为是终末期。图形示出动物的肿瘤生长(图3a和图3c)和存活率(图3b和图3d)。(**p《0.01;对数秩检验)。实验是在8-14周龄的雌性小鼠中进行的。
[0440]
图4示出荷瘤小鼠的免疫细胞上的pd-1表达。对来自小鼠肿瘤的免疫细胞进行pd-1表达的定量。向小鼠注射mc38细胞,并且在~20天后收集肿瘤。针对不同的t细胞亚群对细胞染色,并通过facs分析cd8+t细胞上的pd-1表达。将细胞上pd-1的平均荧光强度值与来自用相同的抗pd-1抗体染色的quantum
tm
simply 珠粒的值相关,以确定每个细胞的受体数量。
[0441]
图5示出表达不同水平的pd-1的jurkat细胞,即pd-1低、pd-1中等(中)和pd-1高。使用饱和浓度的alexa fluor 647人抗人pd-1(派姆单抗)定义pd-1表达。
[0442]
图6示出“jurkat pd-1中细胞”上的pd-1表达。门示出用于定义肿瘤样品上的pd-1“中-高”表达的下端的全宽/半高门(full width/half height gate)。
[0443]
图7展示了用于定义人肿瘤样品上的pd-1表达的门控策略。首先定义cd45+事件(a),然后定义活细胞(b),接着定义cd3+(c)或cd3+cd8+(d)。pd-1高门分别在cd3+(e)和cd3+cd8+群体(f)中设置。pd-1“高”门是基于pd-1转染的jurkat细胞定义的,并且下端根据pd-1中jurkat细胞的全宽/半高门的下端设置。(g)和(h)分别示出alexa fluor 647人抗人pd-1(派姆单抗)在cd3+和cd3+cd8+群体中的fmo。
[0444]
图8示出汇总了由其获得肿瘤样品的每个患者的数据的表格,包括患者特征,包括pd-1表达和预测反应。
[0445]
图9展示了pd-1中等-高表达的cd3+和cd3+cd8+淋巴细胞的百分比。虚线定义10%。字母(f、g、h等)对应于图8表格中的患者id。
[0446]
实施例
[0447]
现在将描述体现本发明的某些方面的具体非限制性实施例。这些实施例应与上文提供的附图说明一起阅读。
[0448]
实施例1
[0449]
jurkat细胞的转染
[0450]
对于jurkat细胞的转染,将细胞在含有10%胎牛血清、fcs(西格玛(sigma))、l-谷氨酰胺(生命科技(life technologies))、丙酮酸钠(生命科技)和pen-strep(生命科技)的rpmi-1640培养基中培养。转染前一天,将细胞分成0.5
×
106个/ml并培养过夜。为了转染细胞,将1
×
106个细胞以90
×
g离心10分钟,然后重悬于100μl的核转染溶液(nucleofector solution)(cell linekit v,龙沙(lonza))中,其中添加了2μg dna(在pcdna3中的hpd-1)。然后将混合物转移到核转染仪小槽(nucleofector cuvette)中。将小槽置于核转染仪ii机器中并用程序x-005进行核转染。在室温(大约18-22℃)下孵育10min后,将500ml培养基添加到小槽中并转移到含有1ml培养基的12孔板中。为了选择转染的细胞,在转染后48小时以1mg/ml添加遗传霉素。10-14天后,在facsaria ii机器上通过facs分选将阳性细胞纯化为低、中和高pd-1表达细胞。然后,将转染的细胞维持在含有1mg/ml遗传霉素的培养基中。
[0451]
pd-1的定量
[0452]
使用这组珠粒进行定量的基本原理是基于藻红蛋白(pe)以1:1的比率标记抗体这一事实。因此,通过使用具有限定数量的pe分子的珠粒来生成标准曲线,可以确定与细胞结合的抗体分子的数量。
[0453]
将jurkat细胞在4℃下在facs缓冲液(含2%fcs的pbs)中用pe标记的抗pd1抗体(eh12.2h7,百进生技)或同种型对照染色30分钟,然后在facs缓冲液中洗涤。将一管quantibrite
tm
珠粒(pe藻红蛋白定量试剂盒,bd生物科学(bd bioscience)(目录号340495)重悬于500μl pbs中。
[0454]
然后,设置fac机器,其方式使得quantibrite
tm
珠粒和jurkat细胞可以在相同的环境下跑样。将珠粒跑样直到收集到10000个事件,然后按照bd生物科学针对pe藻红蛋白荧光定量试剂盒的描述生成标准曲线,即通过相对于提供的4个quantibrite
tm
珠粒群的log mfi(荧光强度)对log每个珠粒的分子数(试剂盒中的批次特异性信息)作图。然后使用该标准曲线通过将其mfi转换为分子数量来计算细胞系上的分子数量。鉴于抗体以饱和浓度使用,并且每个细胞的抗体与pd-1分子1:1结合,因此每个细胞所结合的抗体数量与每个细胞中存在的pd-1分子的数量相对应。
[0455]
然后,将pd1-pe染色的jurkat细胞在facs上跑样,并使用感兴趣的样品的log平均荧光强度(mfi)来计算所结合抗体的数量。
[0456]
结果示出于图1中。
[0457]
从图1清楚地看出,具有低表达的细胞群包括一些具有中等表达的细胞(大约2%);然而,那是所述群体中可忽略不计的一部分,并且从下文所示的吞噬实验中清楚地看出(并在图2中证明),这一小部分不影响吞噬作用。类似地,可以清楚地看出,具有中等表达
的细胞群包括一些具有低表达的细胞,但是同样,这一小部分细胞不影响吞噬作用结果,如下文所示。
[0458]
低表达亚群(图1a)具有3,249个pd-1分子/细胞的平均值,其中底部5%截止值为1,253个pd-1分子/细胞并且顶部5%截止值为10,643个pd-1分子/细胞。中等表达亚群(图1b)具有32,951个pd-1分子/细胞的平均值,其中底部5%截止值为15,498个pd-1分子/细胞并且顶部5%截止值为77,822个pd-1分子/细胞。高表达亚群(图1c)具有165,968个pd-1分子/细胞的平均值,其中底部5%截止值为65,406个pd-1分子/细胞并且顶部5%截止值为390,946个pd-1分子/细胞。提供顶部和底部5%截止值以减少不同亚群之间的重叠。15,498的底部5%截止值,即如上文所测量的大约15,500个pd-1分子/细胞,在本文中用于定义中等或高表达的下限。
[0459]
吞噬作用
[0460]
将从获自南安普敦(southampton)的英国国家血液服务部(national blood service)的白细胞锥(leukocyte cone)中分离的人pbmc在具有rpmi培养基(生命科技)的板中孵育,所述rpmi培养基含有谷氨酰胺、丙酮酸盐、penstrep和来自西格玛的1%热灭活人血清。加热2小时以使单核细胞粘附。然后将培养基用含有谷氨酰胺、丙酮酸盐、penstrep和+10%fcs(西格玛)的rpmi培养基替换。24小时后添加mcsf(在南安普顿大学制备)。巨噬细胞扩增(derived)超过7天,有2次培养基变化(包括mcsf)。此后,通过去除培养基、添加2ml pbs并置于冰上15分钟,然后轻轻刮除来收获巨噬细胞。然后将巨噬细胞重新涂板在96孔板中,持续2小时。巨噬细胞用抗hfcγriib mab(6g11 wt或6g11 nq)以2
×
最终浓度预处理45分钟,然后添加以2
×
最终浓度用纳武单抗(higg4)调理15分钟的cfse(分子探针)标记的jurkat。细胞在37℃共培养1小时,然后通过在4℃下在facs缓冲液中孵育30min来用抗cd14(bd生物科学)染色,然后洗涤,并且接着在facs机器中读取。
[0461]
结果示出于图2中。
[0462]
实施例2-对来自荷瘤小鼠的免疫细胞进行pd-1定量
[0463]
使用quantum
tm
simply珠粒(邦斯实验室公司(bangs laboratories,inc.))确定来自小鼠肿瘤的免疫细胞上的pd-1受体数量。简而言之,将珠粒用大鼠抗pd-1抗体(克隆29f.1a12,百进生技)染色以创建标准曲线。然后对照曲线读取细胞样品以确定表达。
[0464]
对来自荷瘤小鼠的细胞进行定量。根据英国内政部(home office)的指导方针,在本地设施中饲养并维持小鼠。由泰康利(taconic)(丹麦博姆霍尔特(bomholt,denmark))供应六至八周龄的雌性c57/bl6小鼠并且将其维持在本地动物设施中。mc38细胞(atcc)在补充10%fcs的谷氨酰胺(glutamax)缓冲的rpmi中生长。当细胞半汇合时将其用胰蛋白酶分离并且以10
×
106个细胞/ml将其重悬于无菌pbs中。向小鼠皮下(s.c.)注射100μl细胞悬浮液,这对应于1
×
106个细胞/小鼠。使肿瘤生长~20天,然后收集。cd8+t细胞亚群使用cd45、cd3、cd4和cd8标志物(均来自bd生物科学)通过facs进行鉴定。使用具有相应同种型对照(百进生技)的商业大鼠抗pd-1抗体(克隆29f.1a12)对不同t细胞亚群上的pd-1表达进行定量。结果示出于图4中。
[0465]
实施例3-使用抗pd-1的体内组合效应
[0466]
小鼠细胞上的pd-1表达对应于转染的jurkat细胞上的“中与高”之间的表达水平
(实施例1,图1)。在吞噬作用测定中,bi-1206表现为显著降低这些“中和高”pd-1表达细胞的吞噬作用水平(实施例1,图2)。该数据与在体内在mc38模型中将抗pd-1与抗fcγriib(bi-1206小鼠替代物)组合时观察到的改善的治疗性抗肿瘤作用相结合(图3),表明了抗pd-1与bi-1206的组合在具有中等或高pd-1表达(即等于或高于15,500个pd-1分子/细胞的pd-1表达)的患者中的改善的治疗效果。
[0467]
实施例4-人t细胞上的pd-1表达的定量
[0468]
解离并有活力的冷冻肿瘤样品(参见图8中的表格)购自发现生命科学(discovery life sciences)。将细胞解冻并在磷酸盐缓冲盐水(pbs)中洗涤,然后用以下抗体的混合物染色:alexa fluor 700小鼠抗人cd45(克隆hi30,bd 560566)、bv605小鼠抗人cd8(克隆sk1,bd 564116)、percp-cy5.5小鼠抗人cd3(克隆ucht1,bd 560835)、alexa fluor 647人抗人pd-1(派姆单抗(keytruda),临床级,批号8snl80406,默沙东有限公司(merck sharp&dohme limited))。可固定活性染料(fixable viability dye)efluor 780也包括在抗体染色混合物(英杰(invitrogen),65-0865-14)中。染色在bd horizon brilliant染色缓冲液(bd 563794)中进行。在内部将抗人pd-1与alexa fluor 647缀合,并以预滴定实验所示的受体饱和浓度(5.5μg/ml)使用。其余抗体以制造商推荐的浓度使用。将细胞与抗体一起孵育20分钟,接着洗涤并重悬于pbs中,然后使用bd facsaria ii进行采集。使用flowjo软件进行分析。pd-1转染的jurkat细胞上的pd-1表达分析以类似方式进行,但在染色混合物中仅包括alexa fluor 647人抗人pd-1和可固定活性染料efluor 780。结果示出于图5中。在肿瘤样品中,pd-1表达分别在cd3+和cd3+cd8+群体中定义,其在活cd45+细胞上预先门控(图7)。pd-1高门是基于pd-1转染的jurkat细胞定义的,并且在下端根据pd-1中jurkat细胞的全宽/半高门的下端设置(图6)。
[0469]
图9分别示出从不同患者获得的各个肿瘤样品中pd-1中等-高表达的cd3+淋巴细胞和cd3+cd8+淋巴细胞的百分比。预期有10%的t细胞以中等或高水平表达pd-1的患者将受益于抗fcγriib与抗pd-1的组合,并且因此包括了10%表达处的虚线。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1