使用多(A)和多(U)聚合酶无模板酶促合成多核苷酸的制作方法
使用多(a)和多(u)聚合酶无模板酶促合成多核苷酸
1.背景
2.人们对通过使用无模板聚合酶(诸如末端脱氧核苷酸转移酶(tdt))的基于酶促的方法来补充或替代基于化学的合成方法产生了兴趣,因为这样的酶已被证明有效,并且具有反应条件温和无毒的益处,例如ybert等人,国际专利公布wo2015/159023;hiatt等人,美国专利5763594;jensen等人,biochemistry,57:1821-1832(2018);等等。大多数基于酶的合成方法限于dna合成并且需要使用可逆封闭的核苷三磷酸,以便在多核苷酸产物中获得期望的序列。遗憾地是,与未修饰的核苷三磷酸相比,天然tdt掺入这样的修饰的核苷三磷酸的效率降低。因此,已经有大量研究涉及开发新的对修饰的核苷三磷酸具有更好的掺入效率的tdt变体以合成dna,例如champion等人,美国专利公布us2019/0211315;ybert等人,国际专利公布wo2017/216472等。
3.鉴于以上情况,如果新的无模板聚合酶可用于合成dna和rna并改进可逆封闭的核苷三磷酸的掺入,那么基于无模板酶促的多核苷酸合成领域将得到发展。
4.发明概述
5.本发明涉及使用多(a)和多(u)聚合酶及其变体进行多核苷酸的无模板酶促合成的方法、试剂盒和组合物。在一些实施方案中,采用多(a)和多(u)聚合酶的方法用于合成具有预定序列的rna产物。在其他实施方案中,采用多(a)和多(u)聚合酶的方法用于合成具有预定序列的dna产物。
6.在一些实施方案中,本发明涉及合成具有预定序列的多核苷酸的方法,该方法包括以下步骤:a)提供3
’‑
末端核苷酸具有游离3
’‑
羟基的起始子;以及b)重复以下的循环直至形成所述多核苷酸:(i)在延长条件下使具有游离3
’‑
羟基的起始子或延长片段与3
’‑
o-封闭的-核苷三磷酸和无模板聚合酶接触,使得起始子或延长片段通过3
’‑
o-封闭的-核苷三磷酸的掺入被延长以形成3
’‑
o-封闭的-延长片段,和(ii)使延长片段去封闭以形成具有游离3
’‑
羟基的延长片段;其中无模板聚合酶是多(a)聚合酶(pap)或多(u)聚合酶。在另外的实施方案中,起始子可以通过5’端附接至支持物。在另外的实施方案中,支持物可以是固体支持物。
7.在一些实施方案中,上述方法可以包括从起始子裂解多核苷酸的步骤。
8.在一些实施方案中,多核苷酸是多-2
’‑
脱氧核糖核苷酸并且3
’‑
o-封闭的-核苷三磷酸是3
’‑
o-封闭的-2
’‑
脱氧核糖核苷三磷酸。在另外的实施方案中,3
’‑
o-封闭的-2
’‑
脱氧核糖核苷酸三磷酸是3
’‑
o-叠氮甲基-2
’‑
脱氧核糖核苷三磷酸或3
’‑
o-氨基-2
’‑
脱氧核糖核苷三磷酸。在另外的实施方案中,多核苷酸是多核糖核苷酸并且所述3
’‑
o-封闭的-核苷三磷酸是3
’‑
o-封闭的-核糖核苷三磷酸。在一些实施方案中,3
’‑
o-封闭的-核糖核苷三磷酸是3
’‑
o-叠氮甲基-核糖核苷三磷酸。在另外的实施方案中,3
’‑
叠氮甲基-o-核糖核苷三磷酸选自由以下组成的组:3
’‑
叠氮甲基-o-腺苷三磷酸、3
’‑
叠氮甲基-o-鸟苷三磷酸和3
’‑
叠氮甲基-o-胞苷三磷酸、3
’‑
叠氮甲基-o-尿苷三磷酸。
9.在一些实施方案中,本发明的方法中采用的多(a)聚合酶是这样的多(a)聚合酶变体,该多(a)聚合酶变体包含与选自seq id no:1、2、3、8、9、10、11、12、13、14、15、16、17、18、
19、20、21、22、23、24、25、26或27的氨基酸序列至少90%相同的氨基酸序列和以下位置处的甲硫氨酸的取代:关于seq id no:1的位置310处,关于seq id no:2的位置318处,关于seq id no:3的位置318处,关于seq id no:8的位置316处,关于seq id no:9的位置309处,关于seq id no:10的位置316处,关于seq id no:11的位置272处,关于seq id no:12的位置316处,关于seq id no:13的位置307处,关于seq id no:14的位置313处,关于seq id no:15的位置312处,关于seq id no:16的位置317处,关于seq id no:17的位置316处,关于seq id no:18的位置316处,关于seq id no:19的位置312处,关于seq id no:20的位置310处,关于seq id no:21的位置309处,关于seq id no:22的位置317处,关于seq id no:23的位置314处,关于seq id no:24的位置307处,关于seq id no:25的位置315处,关于seq id no:26的位置316处和关于seq id no:27的位置311处。特别地,所述位置处的所述甲硫氨酸的所述取代可以选自f、y、v、e或t。选自所述seq id no:1、2、3、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26或27的所述氨基酸序列还可以包含以下位置处的缬氨酸的取代:关于seq id no:1的位置234处,关于seq id no:2的位置240处,关于seq id no:3的位置240处,关于seq id no:9的位置232处,关于seq id no:10的位置240处,关于seq id no:11的位置196处,关于seq id no:12的位置240处,关于seq id no:13的位置229处,关于seq id no:14的位置236处,关于seq id no:15的位置236处,关于seq id no:16的位置241处,关于seq id no:17的位置233处,关于seq id no:18的位置240处,关于seq id no:19的位置240处,关于seq id no:20的位置234处,关于seq id no:21的位置233处,关于seq id no:22的位置237处,关于seq id no:23的位置238处,关于seq id no:24的位置231处,关于seq id no:25的位置239处,关于seq id no:26的位置240处和关于seq id no:27的位置235处。特别地,所述位置处的所述缬氨酸的所述取代可以是丙氨酸或甘氨酸。
10.在上述组合物的另外的实施方案中,与seq id no:2或3至少90%相同的氨基酸序列还包含关于seq id no:2或3的位置410处的丙氨酸的取代。在一些实施方案中,位置410处的丙氨酸的取代是缬氨酸。
11.在一方面,本发明涉及用于合成具有预定序列的多核糖核苷酸的方法和试剂盒,包括以下步骤:a)提供3
’‑
末端核苷酸具有游离3
’‑
羟基的起始子;以及b)重复以下的循环:(i)在延长条件下使具有游离3
’‑
o-羟基的起始子或延长片段与3
’‑
o-封闭的核糖核苷三磷酸和多(a)聚合酶接触,使得起始子或延长片段通过3
’‑
o-封闭的核糖核苷三磷酸的掺入被延长以形成3
’‑
o-封闭的延长片段,和(ii)使延长片段去封闭以形成具有游离3
’‑
羟基的延长片段,直至形成所述多核苷酸。在一些实施方案中,本发明的方法还包括从起始子裂解多核苷酸的步骤。在一些实施方案中,3
’‑
o-封闭的核糖核苷三磷酸是3
’‑
o-叠氮甲基-核糖核苷三磷酸。
12.在另一个方面,本发明涉及用于进行具有预定序列的多核糖核苷酸的无模板合成的试剂盒,该试剂盒包含多(a)聚合酶、附接至固体支持物的起始子和3
’‑
o-封闭的核糖核苷三磷酸单体。所述3
’‑
o-保护的核糖核苷三磷酸单体可以包括3
’‑
o-叠氮甲基-核糖腺苷三磷酸、3
’‑
o-叠氮甲基-核糖鸟苷三磷酸、3
’‑
o-叠氮甲基-核糖胞苷三磷酸、3
’‑
o-叠氮甲基-核糖胸苷三磷酸和3
’‑
o-氨基-核糖尿苷三磷酸中的一种或更多种。所述多(a)聚合酶可以包括这样的多(a)聚合酶变体,该多(a)聚合酶变体具有与seq id no:1至少90%相同的氨基酸序列并在m310处具有取代,或具有与seq id no:3至少90%相同的氨基酸序列并在
m318处具有取代;其中多(a)聚合酶变体能够(a)在没有模板的情况下合成核糖核酸片段以及(b)将所述3
’‑
o-叠氮甲基-核糖核苷三磷酸掺入到核糖核酸片段上。
13.在另一个方面,本发明涉及这样的多(a)聚合酶变体,该多(a)聚合酶变体包含与选自seq id no:1、2、3、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26或27的氨基酸序列至少90%相同的氨基酸序列和以下位置处的甲硫氨酸的取代:关于seq id no:1的位置310处,关于seq id no:2的位置318处,关于seq id no:3的位置318处,关于seq id no:8的位置316处,关于seq id no:9的位置309处,关于seq id no:10的位置316处,关于seq id no:11的位置272处,关于seq id no:12的位置316处,关于seq id no:13的位置307处,关于seq id no:14的位置313处,关于seq id no:15的位置312处,关于seq id no:16的位置317处,关于seq id no:17的位置316处,关于seq id no:18的位置316处,关于seq id no:19的位置312处,关于seq id no:20的位置310处,关于seq id no:21的位置309处,关于seq id no:22的位置317处,关于seq id no:23的位置314处,关于seq id no:24的位置307处,关于seq id no:25的位置315处,关于seq id no:26的位置316处和关于seq id no:27的位置311处,其中pap变体能够(a)在没有模板的情况下合成核糖核酸片段以及(b)将3
’‑
o-叠氮甲基-核糖核苷三磷酸掺入到核糖核酸片段上或将3
’‑
o-叠氮甲基-2
’‑
脱氧核糖核苷三磷酸掺入到脱氧核糖核酸片段中。特别地,所述位置处的所述甲硫氨酸的所述取代可以选自f、y、v、e或t。多(a)聚合酶变体还可以包含以下位置处的缬氨酸的取代:关于seq id no:1的位置234处,关于seq id no:2的位置240处,关于seq id no:3的位置240处,关于seq id no:9的位置232处,关于seq id no:10的位置240处,关于seq id no:11的位置196处,关于seq id no:12的位置240处,关于seq id no:13的位置229处,关于seq id no:14的位置236处,关于seq id no:15的位置236处,关于seq id no:16的位置241处,关于seq id no:17的位置233处,关于seq id no:18的位置240处,关于seq id no:19的位置240处,关于seq id no:20的位置234处,关于seq id no:21的位置233处,关于seq id no:22的位置237处,关于seq id no:23的位置238处,关于seq id no:24的位置231处,关于seq id no:25的位置239处,关于seq id no:26的位置240处和关于seq id no:27的位置235处。特别地,所述位置处的缬氨酸的所述取代可以是丙氨酸或甘氨酸。
14.在另一个方面,本发明涉及多(u)聚合酶(pup)变体,每个pup变体包含选自seq id no:4、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46或47的氨基酸序列至少90%相同的氨基酸序列和以下位置处的酪氨酸的取代:关于seq id no:4的位置212处,关于seq id no:28的位置189处,关于seq id no:29的位置184处,关于seq id no:30的位置227处,关于seq id no:31的位置478处,关于seq id no:32的位置192处,关于seq id no:33的位置186处,关于seq id no:34的位置243处,关于seq id no:35的位置196处,关于seq id no:36的位置253处,关于seq id no:37的位置284处,关于seq id no:38的位置182处,关于seq id no:39的位置187处,关于seq id no:40的位置203处,关于seq id no:41的位置224处,关于seq id no:42的位置204处,关于seq id no:43的位置337处,关于seq id no:44的位置296处,关于seq id no:45的位置291处,关于seq id no:46的位置218处和关于seq id no:47的位置366处,其中pup变体能够(a)在没有模板的情况下合成核糖核酸片段以及(b)将3
’‑
o-叠氮甲基-核糖核苷三磷酸掺入到核糖核酸片段上或将3
’‑
o-叠氮甲基-2
’‑
脱氧核糖核苷三磷酸掺入到脱氧核糖核酸片段中。特别地,所述位置处的所述酪氨酸的
所述取代可以是丙氨酸或甘氨酸。
15.本发明通过提供无模板聚合酶和3
’‑
o-修饰的核糖核苷三磷酸来有利地克服酶促多核苷酸合成领域中的上述问题,这提供了核糖核苷酸掺入生长的rna片段中的更高比率。
16.附图简述
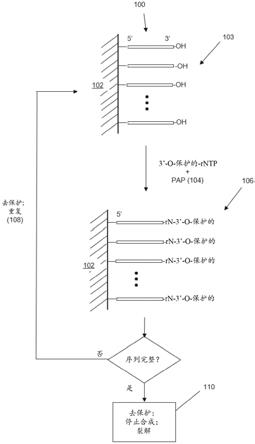
17.图1说明本发明的方法的实施方案的步骤。
18.图2a-图2c显示根据本发明的方法延伸1-5个核糖核苷酸的数据。
19.图3a-图3b显示在存在突变m310f/y/q/a/v/e/t的情况下使用单个3
’‑
o-保护的-ratp的延伸(3a)和使用rgtp的多鸟苷酸化(3b)的数据。
20.图4是由粟酒裂殖酵母(schizosaccharomyces pombe)pup产生的掺入产物的电泳图。“无延伸”意指,所示的列显示对应于引物的条带而没有任何延伸。
21.发明详述
22.这里更详细地公开了本发明的一般原理,特别地通过实例的方式,诸如在附图中示出并详细描述的那些。然而,应该理解的是,意图并不是将本发明限制于所描述的特定实施方案。本发明适用于各种修改和替代形式,其细节在若干实施方案中示出。意图是覆盖落入本发明的原理和范围内的所有修改、等同物和替代物。
23.除非另外指出,本发明的实践可以采用有机化学、分子生物学(包含重组技术)、细胞生物学和生物化学的常规技术和描述,这些都在本领域的技术内。这样的常规技术可以包括但不限于制备和使用合成肽、合成多核苷酸、单克隆抗体,核酸克隆、扩增、测序和分析以及相关技术。这样的常规技术的方案可在制造商的产品文献和标准实验室手册中找到,诸如genome analysis:a laboratory manual series(第i-iv卷);pcr primer:alaboratory manual;和molecular cloning:a laboratory manual(全部来自cold spring harbor laboratory press);lutz和bornscheuer,编辑,protein engineering handbook(wiley-vch,2009);hermanson,bioconjugate techniques,第二版(academic press,2008);以及类似的参考文献。
24.本发明涉及用于在同一合成中使用多(a)聚合酶(pap)、多(u)聚合酶(pup)或pap和pup二者来合成多核苷酸(多核糖核酸或多脱氧核糖核酸)的方法和组合物。在一些实施方案中,pap和/或pup用于使用3
’‑
o-可逆保护的-rntp前体合成多核糖核酸,其中单一的pup或pap变体可用于偶联所有核糖核苷三磷酸单体,或在可选的实施方案中,其中不同的pup和pap可用于在特定rna的合成中偶联不同种类的核糖核苷三磷酸单体。同样,在其他实施方案中,pap和/或pup可用于使用3
’‑
o-可逆保护的-dntp前体合成多脱氧核糖核酸,其中单一的pup或pap用于偶联所有脱氧核糖核苷三磷酸(dntp)单体,或在可选的实施方案中,其中不同的pup和pap聚合酶可用于偶联不同种类的脱氧核糖核苷三磷酸单体。在一些实施方案中,本发明的方法采用已通过遗传工程修饰的pap和/或pup变体以改进合成中3
’‑
o-封闭的-核糖核苷三磷酸和3
’‑
o-封闭的-2
’‑
脱氧核糖核苷三磷酸偶联到生长的多核苷酸链的效率。
25.本发明的方法,无论是用于合成rna还是dna,都包括诸如图1所示的重复的步骤循环,其中在每个循环中添加用于rna合成的预定核糖核苷酸单体(或用于dna合成的2
’‑
脱氧核糖核苷酸单体)。提供了例如附接至固体支持物(102)的起始子多核苷酸(100),其具有游离3
’‑
羟基基团(103)。对于合成rna,起始子通常是多核糖核苷酸,而对于合成dna,起始子
通常是多脱氧核糖核苷酸。在有效地将3
’‑
o-保护的-rntp(或3
’‑
o-保护的-dntp)酶促掺入到起始子多核苷酸(100)(或延长的起始子多核苷酸)的3’端上的条件(104)下,向起始子多核苷酸(100)(或后续循环中延长的起始子多核苷酸)中添加3
’‑
o-可逆保护的-rntp(或在dna合成的情况中,3
’‑
o-可逆保护的-dntp)和pap或pup。该反应产生其3
’‑
羟基被保护的延长的起始子多核苷酸(106)。如果延长的起始子多核苷酸含有完整的序列,那么3
’‑
o-保护基团被去除,或者去保护,并且期望的序列从原始起始子多核苷酸裂解。这样的裂解可以使用多种单链裂解技术中的任一种来进行,例如,通过在原始起始子多核苷酸内的预定位置处插入可裂解核苷酸来进行。示例性可裂解核苷酸可以是被尿嘧啶dna糖基化酶裂解的尿嘧啶核苷酸。此外,多种可裂解的连键(cleavable linkages)或可裂解的核苷酸可用于此目的。在一些实施方案中,裂解期望的多核苷酸在裂解链上留下天然的游离5
’‑
羟基;然而,在可选的实施方案中,裂解步骤可以留下可以在后续步骤中去除(例如通过磷酸酶处理)的部分(moiety),例如5
’‑
磷酸。裂解步骤可以通过化学、热、酶或光化学方法进行。在一些实施方案中,可裂解核苷酸可以是核苷酸类似物,诸如脱氧尿苷或8-氧代-脱氧鸟苷,它们被特定的糖基化酶(例如尿嘧啶脱氧糖基化酶,随后分别是核酸内切酶viii和8-氧代鸟嘌呤dna糖基化酶)识别。在一些实施方案中,裂解可以通过以下完成:为起始子提供脱氧肌苷作为倒数第二个3’核苷酸,脱氧肌苷可以在起始子的3’端被内切核酸酶v裂解,在释放的多核苷酸上留下5
’‑
磷酸。用于裂解单链多核苷酸的另外的方法在以下参考文献中公开,这些参考文献通过引用并入:美国专利第5,739,386号、第5,700,642号和第5,830,655号;和美国专利公布第2003/0186226号和第2004/0106728号;和在urdea和horn,美国专利5367066中。
26.如果延长的起始子多核苷酸不含有完整的序列,那么3
’‑
o-保护基团被去除以暴露游离3
’‑
羟基(103),并且使延长的起始子多核苷酸经历另一个循环的核糖核苷酸添加和去保护。
27.在一些实施方案中,合成多核糖核苷酸的方法包括以下步骤:(a)提供具有游离3
’‑
羟基的起始子;(b)在延伸条件下使具有游离3
’‑
羟基的起始子或延伸中间体(即延长的起始子多核苷酸)与pap在存在3
’‑
o-封闭的核糖核苷三磷酸的情况下反应,以产生3
’‑
o-封闭的延伸中间体;(c)使延伸中间体去封闭以产生具有游离3
’‑
羟基的延伸中间体;以及(d)重复步骤(b)和(c),直至合成所述多核糖核苷酸。(术语“延伸中间体”在本文中也可以称为“延长片段”或“延长的起始子多核苷酸”)。在一些实施方案中,如以上所述,起始子以例如通过其5’端附接至固体支持物的寡核苷酸提供。上述方法还可以包括在反应步骤或延伸步骤之后以及在去封闭步骤之后的洗涤步骤。例如,反应步骤可以包括在预定孵育时间段或反应时间之后去除未掺入的核糖核苷三磷酸(通过例如洗涤)的子步骤。这样的预定孵育时间段或反应时间可以是几秒钟(a few seconds),例如30秒,至数分钟(several minutes),例如30分钟。
28.在一些实施方案中,合成多核糖核苷酸的方法包括以下步骤:(a)提供具有游离3
’‑
羟基的起始子;(b)在延伸条件下使具有游离3
’‑
羟基的起始子或延伸中间体(即延长的起始子多核苷酸)与pap或pup在存在3
’‑
o-封闭的核糖核苷三磷酸的情况下反应,以产生3
’‑
o-封闭的延伸中间体;(c)使延伸中间体去封闭以产生具有游离3
’‑
羟基的延伸中间体;以及(d)重复步骤(b)和(c),直至合成所述多核糖核苷酸。(术语“延伸中间体”在本文中也可以称为“延长片段”或“延长的起始子多核苷酸”)。在一些实施方案中,如以上所述,起始
子以例如通过其5’端附接至固体支持物的寡核苷酸提供。上述方法还可以包括在反应步骤或延伸步骤之后以及在去封闭步骤之后的洗涤步骤。例如,反应步骤可以包括在预定孵育时间段或反应时间之后去除未掺入的核糖核苷三磷酸(通过例如洗涤)的子步骤。这样的预定孵育时间段或反应时间可以是几秒钟(a few seconds),例如30秒,至数分钟(several minutes),例如30分钟。
29.在一些实施方案中,合成多核苷酸的方法包括以下步骤:(a)提供具有游离3
’‑
羟基的起始子;(b)在延伸条件下使具有游离3
’‑
羟基的起始子或延伸中间体(即延长的起始子多核苷酸)与pap或pup在存在3
’‑
o-封闭的核苷三磷酸的情况下反应,以产生3
’‑
o-封闭的延伸中间体;(c)使延伸中间体去封闭以产生具有游离3
’‑
羟基的延伸中间体;以及(d)重复步骤(b)和(c),直至合成所述多核苷酸。(术语“延伸中间体”在本文中也可以称为“延长片段”或“延长的起始子多核苷酸”)。在一些实施方案中,如以上所述,起始子以例如通过其5’端附接至固体支持物的寡核苷酸提供。上述方法还可以包括在反应步骤或延伸步骤之后以及在去封闭步骤之后的洗涤步骤。例如,反应步骤可以包括在预定孵育时间段或反应时间之后去除未掺入的核糖核苷三磷酸(通过例如洗涤)的子步骤。这样的预定孵育时间段或反应时间可以是几秒钟(a few seconds),例如30秒,至数分钟(several minutes),例如30分钟。
30.上述方法还可以包括在反应步骤或延伸步骤之后以及在去封闭步骤之后的加帽步骤以及洗涤步骤。如以上提及的,在一些实施方案中,可以包括加帽步骤,其中非延伸的游离3
’‑
羟基与阻止加帽链任何进一步延伸的化合物反应。在一些实施方案中,这样的化合物可以是双脱氧核苷三磷酸。在其他实施方案中,具有游离3
’‑
羟基的非延伸链可以通过将其用3
’‑
外切核糖核酸酶活性,例如rna酶r(epicentre)处理来降解。同样,在一些实施方案中,未能去封闭的链可以被处理以去除该链或使其对进一步的延伸呈惰性。
31.在一些包括寡核糖核苷酸的系列合成的实施方案中,加帽步骤可能是不期望的,因为加帽可能会阻止多于一种寡核苷酸的等摩尔量的产生。在没有加帽的情况下,序列将具有均匀分布的缺失错误,但是多于一种寡核糖核苷酸中的每一种将以等摩尔量存在。在未延伸片段被加帽的情况下,情况将不会如此。
32.在一些实施方案中,使用pap或pup的延伸或延长步骤的反应条件可以包括以下:反应条件1(用于引物+am-ratp):250um am-ratp、0.1um atto488-(ra)5、1um pap、1x atp缓冲液(20mm tris-hcl、0.6mm mncl2、0.02mm edta、0.1%bsa、10%甘油、100mm咪唑,ph 7-8),37℃,30分钟。反应条件2(用于引物+am-rgtp):250um rgtp、0.1um atto488-(ra)5、1um pap、1x gtp缓冲液(0.6mm mncl2、0.1%bsa、10mm咪唑、ph 6),37℃,30分钟。在上文中,“am-rntp”是指3
’‑
叠氮甲基-o-核糖核苷三磷酸。
33.根据具体应用,去封闭和/或裂解的步骤可以包括多种化学或物理条件,例如光、热、ph、特定试剂诸如能够裂解指定化学键的酶的存在。选择3
’‑
o-封闭基团和相应的去封闭条件的指导可以在诸如wuts,green’s protection groups in organic chemistry,第五版(wiley 2014)的参考文献中发现。在一些实施方案中,裂解剂(有时也称为去封闭试剂或去封闭剂)是化学裂解剂,诸如,例如,二硫苏糖醇(dtt)。在可选的实施方案中,裂解剂可以是酶促裂解剂,诸如,例如,可以裂解3
’‑
磷酸封闭基团的磷酸酶。本领域技术人员将理解,去封闭剂的选择取决于所使用的3
’‑
核苷酸封闭基团的类型、是使用一种还是多于一种封闭基团、起始子是否被附接至活细胞或生物体或固体支持物等,这些都需要温和的处理。
例如,膦诸如三(2-羧乙基)膦(tcep)可以用于裂解3’o-叠氮甲基基团,钯络合物可以用于裂解3’o-烯丙基基团和3
’‑
o-炔丙基基团,或亚硝酸钠可以用于裂解3’o-氨基基团。
34.如以上所述,在一些实施方案中,期望采用可以使用正交去封闭条件去除的两种或更多种封闭基团。以下示例性的封闭基团对可用于平行合成实施方案中,其中两种或更多种序列在相同的反应混合物中合成。应当理解,其他的封闭基团对,或者包含多于两种封闭基团的组可以可用于在本发明的这些实施方案中使用。
[0035][0036]
如本文所用,“起始子”(或等同术语,诸如,“起始片段”、“起始子核酸”、“起始子寡核苷酸”等)是指具有游离3
’‑
末端的短寡核苷酸序列,其可被无模板聚合酶(诸如pap或pup)进一步延长。在一种实施方案中,起始片段是dna或rna起始片段。在可选的实施方案中,起始片段是rna起始片段。在一种实施方案中,起始片段具有3个和100个之间的核苷酸,特别地,具有3个和20个之间的核苷酸。在一种实施方案中,起始片段是单链的。在可选的实施方案中,起始片段是双链的。在特定的实施方案中,用5
’‑
伯胺合成的起始子寡核苷酸可以使用制造商的方案共价连接至磁珠。同样,用3
’‑
伯胺合成的起始子寡核苷酸可以使用制造商的方案共价连接至磁珠或琼脂糖珠。适用于本发明实施方案的各种其他附接化学是本领域中熟知的,例如integrated dna technologies手册,“strategies for attaching oligonucleotides to solid supports,”v.6(2014);hermanson,bioconjugate techniques,第二版(academic press,2008);和类似的参考文献。
[0037]
本发明中采用的3
’‑
o-封闭的rntp中的许多可以从商业供应商(例如jena bioscience、mychemlabs等)购买或使用公开的技术合成,例如美国专利7057026;国际专利公布wo2004/005667、wo91/06678;canard等人,gene(以上引用);metzker等人,nucleic acids research,22:4259-4267(1994);meng等人,j.org.chem.,14:3248-3252(3006);美国专利公布2005/037991;zavgorodny等人,tetrahedron letters,32(51):7593-7596(1991)。
[0038]
在另外的特定实施方案中,3
’‑
封闭的核苷酸三磷酸被3
’‑
o-炔丙基、3
’‑
o-叠氮甲基、3
’‑
o-nh2或3
’‑
o-烯丙基基团封闭。
[0039]
在仍其他实施方案中,本发明的3
’‑
o-封闭基团包括3
’‑
o-甲基、3
’‑
o-(2-硝基苄基)、3
’‑
o-烯丙基、3
’‑
o-胺、3
’‑
o-叠氮甲基、3
’‑
o-叔丁氧基乙氧基、3
’‑
o-(2-氰乙基)和3
’‑
o-炔丙基。
[0040]
多(a)聚合酶和有用的变体
[0041]
多种pap可用于本发明的方法,包括为了改进的特性而工程化的pap变体,改进的特性诸如3
’‑
o-保护的rntp的更高掺入率(对于特定保护基团,包括诸如,3
’‑
o-叠氮甲基)、更大的稳定性和保质期、热稳定性、溶解度等。特别地,相对于野生型pap,具有在m310(seq id no:1)或其他pap(诸如来自各种不同物种的pap)中的功能等同的残基处的突变的酵母
pap显示出3
’‑
o保护的rntp的改进的掺入。在一些实施方案中,本发明的酵母pap变体具有seq id no:1的氨基酸序列,除了在m310处的取代。在一些实施方案中,这样的取代选自m310f/y/v/e/t。特别地,取代m310f/y允许3
’‑
o-氨基-ratp的掺入,并且取代m310v/e/t改进3
’‑
o-保护的-rgtp的掺入率。在其他实施方案中,本发明的酵母pap变体具有与seq id no:1有至少90%同一性的氨基酸序列,除了在m310处的取代。
[0042]
用于本发明的pap变体包括下表1中列出的那些。在一些实施方案中,本发明的pap变体包含至少在表1中所示的第二位置处的取代。在其他实施方案中,本发明的pap变体的实施方案包含至少在表1中所示的第一位置处的取代。
[0043]
表1
[0044]
pap变体:取代的位置
[0045][0046]
在一些实施方案中,如表1中所示的第一位置处的取代是a或g(因此,例如,对于
seq id no:1,取代可写作v234a/g)。在一些实施方案中,如表1中所示的第二位置处的取代是f、y、v、e或t(因此,例如,对于seq id no:1,取代可写作m310f/y/v/e/t)。
[0047]
在一些实施方案中,本发明的pap变体具有表1的取代中的一种或更多种和与所示的seq id no具有至少80%同一性的同一性百分比值;在一些实施方案中,上述同一性百分比值是与所示的seq id no至少90%同一性;在一些实施方案中,上述同一性百分比值是与所示的seq id no至少95%同一性;在一些实施方案中,上述同一性百分比值是至少97%同一性;在一些实施方案中,上述同一性百分比值是至少98%同一性;在一些实施方案中,上述同一性百分比值是至少99%同一性。
[0048]
在一些实施方案中,采用热稳定的pap使得该方法可以在减少或消除正在合成的rna或dna中的二级结构的形成的温度实践。在一些实施方案中,热稳定pap出现最高掺入率的温度范围高于40℃。在一些实施方案中,热稳定pap出现最高掺入率的温度范围高于50℃。在一些实施方案中,热稳定pap出现最高掺入率的温度范围在40℃和85℃之间。在一些实施方案中,热稳定pap出现最高掺入率的温度范围在50℃和85℃之间。
[0049]
多(u)聚合酶和有用的变体
[0050]
与pap一样,多种pup可用于本发明的方法,包括为了改进的特性而工程化的pup变体,改进的特性诸如3
’‑
o-保护的-rntp的更高掺入率(对于特定保护基团,包括诸如3
’‑
o-叠氮甲基)、更大的稳定性和保质期、热稳定性、溶解度等。用于本发明的pup变体包括下表2中列出的那些。在一些实施方案中,本发明的pup变体包含至少在表2中所示的第一位置处的取代。在其他实施方案中,本发明的pup变体的实施方案包含至少在表2中所示的第二位置处的取代。
[0051]
表2
[0052]
pup变体:取代的位置
[0053][0054]
在一些实施方案中,如表2中所示的第一位置处的取代是a或g(因此,例如,对于seq id no:4,取代可写作y212a/g)。在一些实施方案中,如表2中所示的第二位置处的取代是f、y、v、e或t(因此,例如,对于seq id no:4,取代可写作h336f/y/v/e/t)。
[0055]
在一些实施方案中,本发明的pup变体具有表2中的取代中的一种或更多种和与所示的seq id no具有至少80%同一性的同一性百分比值;在一些实施方案中,上述同一性百分比值是与所示的seq id no至少90%同一性;在一些实施方案中,上述同一性百分比值是与所示的seq id no至少95%同一性;在一些实施方案中,上述同一性百分比值是至少97%同一性;在一些实施方案中,上述同一性百分比值是至少98%同一性;在一些实施方案中,上述同一性百分比值是至少99%同一性。
[0056]
在一些实施方案中,采用热稳定的pup使得该方法可以在减少或消除正在合成的rna或dna中的二级结构的形成的温度实践。在一些实施方案中,热稳定pup出现最高掺入率的温度范围高于40℃。在一些实施方案中,热稳定pup出现最高掺入率的温度范围高于50
℃。在一些实施方案中,热稳定pup出现最高掺入率的温度范围在40℃和85℃之间。在一些实施方案中,热稳定pup出现最高掺入率的温度范围在50℃和85℃之间。
[0057]
pap和pup变体的产生
[0058]
本发明的变体可以通过将已知的参考或野生型pap编码多核苷酸或pup编码多核苷酸突变、然后使用常规分子生物学技术表达它来产生。例如,编码具有期望序列的多肽的期望基因或dna片段可以使用常规分子生物学技术,例如使用由以下描述的方案从合成片段组装:stemmer等人,gene,164:49-53(1995);kodumal等人,proc.natl.acad.sci.,101:15573-15578(2004);等,或者这样的基因或dna片段可以使用常规方案从选定物种的细胞中直接克隆。
[0059]
可将编码期望的pap或pup变体的分离基因插入表达载体中以给出表达载体,表达载体然后可用于使用常规方案制备和表达变体pap或pup蛋白。可以将具有正确序列的载体转化到大肠杆菌(e.coli)生产菌株中。
[0060]
以下程序是针对pap变体描述的,但本领域普通技术人员可以将类似的程序应用于pup变体。使用常规技术培养转化的菌株,从沉淀物提取pap蛋白。例如,将先前制备的沉淀物在30℃至37℃的水浴中解冻。完全解冻后,将沉淀物重悬于包含50mm tris-hcl(sigma)ph 7.5、150mm nacl(sigma)、0.5mm巯基乙醇(sigma)、5%甘油(sigma)、20mm咪唑(sigma)和1片(用于100ml)蛋白酶抑制剂混合物(thermofisher)的裂解缓冲液中。仔细地进行重悬,以便避免过早裂解和残留聚集物。通过若干次弗氏压碎器循环将重悬的细胞裂解,直至获得完全的颜色均匀性。通常使用的压力是14,000psi。然后将裂解物以10,000rpm离心1h至1h 30min。将离心液通过0.2μm过滤器,以在柱纯化前去除所有残渣。
[0061]
pap蛋白可以通过一步亲和程序从离心液中纯化。例如,ni-nta亲和柱(ge healthcare)可以用于结合pap聚合酶。最初,将柱用15倍柱体积的50mm tris-hcl(sigma)ph 7.5、150mm nacl(sigma)和20mm咪唑(sigma)洗涤和平衡。平衡后pap聚合酶与柱结合;然后,洗涤缓冲液,例如包含50mm tris-hcl(sigma)ph 7.5、500mm nacl(sigma)和20mm咪唑(sigma),可以以15倍柱体积应用于柱。这样的洗涤后,用50mm tris-hcl(sigma)ph 7.5、500mm nacl(sigma)和0.5m咪唑(sigma)洗脱pap聚合酶。收集对应于最高浓度的感兴趣的pap聚合酶的级分并汇集成单个样品。将汇集的级分用透析缓冲液(20mm tris-hcl ph 6.8、200mm nacl、50mm mgoac、100mm[nh4]2so4)透析。透析液随后在浓缩过滤器(amicon ultra-30,merk millipore)的帮助下进行浓缩。将浓缩的酶分成小的等分试样,添加最终50%的甘油,并且然后将这些等分试样冷冻于-20℃并长期储存。在sds-page凝胶中分析5μl的各种纯化的酶的级分。
[0062]
在一些实施方案中,pap变体可以可操作地连接到包括共价键或非共价键的接头部分;氨基酸标签(例如,多氨基酸标签、多his标签、6his标签等);化学化合物(例如,聚乙二醇);蛋白-蛋白结合对(例如,生物素-亲和素);亲和偶联物(affinity coupling);捕获探针或这些的任何组合。接头部分可以与pap变体分开或作为pap变体的一部分。用于本发明的pap变体的示例性his-标签是masshhhhhhssgsenlyfqtgssg-(seq id no:5)。标签-接头部分不干扰pap变体的核苷酸结合活性或催化活性。
[0063]
上述方法或等同方法产生分离的pap或pup变体,其可能混合有多种试剂诸如盐、ph缓冲液、载体化合物等,这些试剂对于活性和/或保存是必需的或有用的。
[0064]
核苷酸掺入活性的测量
[0065]
本发明的变体的核苷酸掺入效率可以通过延伸或延长测定来测量,例如,如在boule等人(下文引用);bentolila等人(下文引用);和hiatt等人,美国专利5808045中描述的,后者通过引用并入本文。简言之,在这样的测定的一种形式中,将荧光标记的具有游离3
’‑
羟基的寡核苷酸在pap延伸条件下与待测试的pap变体在存在可逆封闭的核糖核苷三磷酸的情况下反应预定持续时间,之后停止延伸反应,并在通过凝胶电泳分离后定量延伸产物和未延伸起始子寡核苷酸的量。通过这样的测定,可以容易地将pap变体的掺入效率与其他变体的效率或野生型或参考pap或其他聚合酶的效率进行比较。在一些实施方案中,pap变体效率的量度可以是使用pap变体的延伸产物的量与在等同测定中使用野生型pap的延伸产物的量的比率(以百分比给出)。将试剂从水开始然后按表3的顺序添加到管中。
[0066]
表3
[0067]
延伸活性测定试剂
[0068][0069]
测定的产物可以通过常规的聚丙烯酰胺凝胶电泳进行分析。例如,上述测定的产物可以在16%的聚丙烯酰胺变性凝胶(bio-rad)中进行分析。凝胶在即将分析前通过将聚丙烯酰胺倾入玻璃板中并使其聚合而制备。将玻璃板中的凝胶安装在填充了tbe缓冲液(sigma)的合适的槽中,用于电泳步骤。将待分析的样品加载到凝胶的顶部。在室温,在凝胶的顶部和底部之间施加500v至2,000v的电压3h至6h。分离后,凝胶荧光使用例如typhoon扫描仪(ge life sciences)来扫描。使用image j软件(imagej.nih.gov/ij/)或其等同软件分析凝胶图像,以计算修饰核苷酸的掺入百分比。
[0070]
试剂盒
[0071]
本发明包括用于进行本发明的方法的试剂盒。在一些实施方案中,本发明的试剂盒包含多(a)聚合酶和腺苷、鸟苷、尿苷和胞苷中的一种或更多种的3
’‑
o-封闭的核糖核苷三磷酸。在其他实施方案中,这样的试剂盒还可以包含多(u)聚合酶。在一些实施方案中,本发明的试剂盒包含多(a)聚合酶和脱氧腺苷、脱氧鸟苷、脱氧胸苷和脱氧胞苷中的一种或更多种的3
’‑
o-封闭的-2
’‑
脱氧核糖核苷三磷酸。在其他实施方案中,这样的试剂盒还可以包含多(u)聚合酶。在一些实施方案中,本发明的试剂盒可以包含通过5’端附接至支持物的具有游离3
’‑
羟基的起始子。在一些实施方案中,这样的支持物是固体支持物。这样的固体支持物可以包括珠诸如磁珠或琼脂糖珠,平面固体诸如玻璃载玻片或膜等。在一些实施方案中,本发明的试剂盒还可以包含能够从掺入的3
’‑
o-封闭的核苷酸中去除3’封闭基团的去封闭剂。在一些实施方案中,试剂盒可以包含酵母pap(诸如seq id no:1的酵母pap)的m310突变体,或来自不同物种的pap中的与m310功能等同的残基的突变体。在一些实施方案中,试剂盒可以包含pap变体,该变体包含与选自seq id no:1、2或3的氨基酸序列至少90%相同的氨基酸序列以及在关于seq id no:1的位置310处的甲硫氨酸或在关于seq id no:2和
3的位置318处的甲硫氨酸的取代,其中该变体能够(a)在没有模板的情况下合成核糖核酸片段以及(b)将3
’‑
o-叠氮甲基-核糖核苷三磷酸掺入到核糖核酸片段上或将3
’‑
o-叠氮甲基-2
’‑
脱氧核糖核苷三磷酸掺入到脱氧核糖核酸片段中。
[0072]
在一些实施方案中,在前述试剂盒的pap变体中,在seq id no:1的位置310处的甲硫氨酸或seq id no:2或3的位置318处的甲硫氨酸的取代选自m310f/y/v/e/t。在一些实施方案中,在前述试剂盒的pap变体中,具有关于seq id no:1的位置234处的缬氨酸和关于seq id no:2和3的位置240处的缬氨酸的取代。在一些实施方案中,在前述试剂盒的pap变体中,在seq id no:1的位置234处的缬氨酸和关于seq id no:2和3的位置240处的缬氨酸的取代是丙氨酸。在一些实施方案中,在前述试剂盒的pap变体中,具有关于在seq id:no 2或3的位置410处的丙氨酸的取代。
[0073]
在一些实施方案中,本发明的试剂盒可以包含具有与选自表1的seq id no:1-3和8-27的序列至少80%相同的氨基酸序列的pap变体,该变体具有在如表1中所示的这样的所选序列的第一位置的取代或在第二位置的取代或在这两个位置的取代。在一些实施方案中,所选序列的这样的同一性百分比是至少90%同一性。在一些实施方案中,本发明的试剂盒可以包含具有与选自表2的seq id no:4和28-47的序列至少80%相同的氨基酸序列的pup变体,该变体具有在如表2中所示的这样的所选序列的第一位置的取代或在第二位置的取代或在这两个位置的取代。在一些实施方案中,所选序列的这样的同一性百分比是至少90%同一性。
[0074]
实施例1
[0075]
向固定在固体支持物上的起始子多核苷酸添加一至五个核糖核苷酸
[0076]
在存在pap(thermo)的情况下,用3
’‑
o-叠氮甲基-核糖核苷三磷酸(am-ntp)对cp-rna引物的2-3个循环的延伸。实验程序:1)cp-珠的制备:100ul cp-珠(珠上cp引物的浓度~1um)+1ul 100um synrda_dna-synrda_rna;在室温孵育30分钟,用3x200 ul结合缓冲液(bb)(200mm caco,licl)洗涤珠,将珠重悬于25ul bb中;2)+1添加反应:250um 3’o-封端核苷酸、3.2um cp-synrda_dna-synrda_rna、1x pap_酵母thermo反应缓冲液、100u/ul pap_酵母(thermo),20ul终体积;在eppendorf管中;30分钟、37℃、热混合器、1500rpm;3)洗涤+1产物:3x 200ul bb;4)tcep去保护:将珠重悬于50ul 200um tcep,ph 7.0(从新打开的安瓿中稀释),37℃、15分钟、热混合器、1500rpm;5)洗涤去保护的+1产物:3x 200ul结合缓冲液;6)+2/去保护/+3添加:参见1)-5);7)洗脱+凝胶:添加20ul b-blue、涡旋、洗脱、应用于凝胶上。所用的cp-rna珠按以下方式制备:i)用dna寡核苷酸(tcatttcactctcaca-nh2)(seq id no:6)对显示末端羧酸基团的商用dynabead m-270(购自thermo fisher)进行共价官能化。这些珠被命名为cp-珠。然后将cp-珠与序列atto488-tgtgagagtgaaatgaggrurgrurgrargrargrur-grararar urgrargrg(命名为synrda_dna-synrda_rna)(seq id no:7)的dna-rna杂种引物一起孵育。
[0077]
结果如图2a-图2c中所示。该数据显示:i)对于3
’‑
o-am-ratp和3
’‑
o-am-rutp,使用相同的核苷酸可以实现至少5个循环的添加/去保护;ii)使用两种不同的3
’‑
o-am-rntp(a和u)可以实现至少2个循环的添加/去保护;和iii)可以实现对3
’‑
o-am-保护的rna的至少》95%的去保护。
[0078]
实施例2
[0079]
papm310突变对am-ratp延长和核糖鸟苷酸化活性的影响
[0080]
在本实验中,检查了pap位置m310的突变对rna引物的am-ratp延长(图3a)和rna引物的核糖鸟苷酸化(3b)活性的影响。在存在延长am-ratp缓冲液(20mm tris-hcl、0.6mm mncl2、0.02mm edta、0.1%bsa、10%甘油、100mm咪唑,ph 7-8)中0.1um atto488-(ra)5引物、0.5um pap突变体、250um am-ratp的情况下,在37℃、20ul的总反应体积,进行rna引物的am-ratp延长(图3a)持续30分钟。在存在rgtp聚合缓冲液(0.6mm mncl2、0.1%bsa、10mm咪唑,ph 6.2)中0.1um atto488-(ra)5引物、0.5um pap突变体、250um am-ratp的情况下,在37℃、20ul的总反应体积,进行rna引物的核糖鸟苷酸化(图3b)持续30分钟。
[0081]
实施例3
[0082]
梭孢壳属pap变体对am-rntp掺入的影响
[0083]
梭孢壳属pap(seq id no:3)使用常规技术经工程化具有三个取代(v240a、m318t和a410v),之后表达和纯化修饰的多肽。通过进行实施例2中描述的测定比较野生型梭孢壳属pap和突变的pap掺入am-ntp的能力,但以下条件除外:0.1μm atto488-(ra)7、3.0μm pap、250μm am-ntp。反应结果在下表4中给出。
[0084]
表4
[0085][0086]
数据显示,梭孢壳属pap变体掺入am-rgtp和am-rctp单体的效率比对应的野生型pap大得多。
[0087]
实施例4
[0088]
通过pup掺入am-ntp
[0089]
在本实验中,粟酒裂殖酵母pup(seq id no:4)用于使用实施例3的实验方案将am-ntp掺到起始子中。通过凝胶电泳分离延伸产物,以给出图4中所示的电泳图。
[0090]
定义
[0091]
氨基酸由它们的单字母或三字母代码根据以下命名法表示:a:丙氨酸(ala);c:半胱氨酸(cys);d:天冬氨酸(asp);e:谷氨酸(glu);f:苯丙氨酸(phe);g:甘氨酸(gly);h:组氨酸(his);i:异亮氨酸(ile);k:赖氨酸(lys);l:亮氨酸(leu);m:甲硫氨酸(met);n:天冬酰胺(asn);p:脯氨酸(pro);q:谷氨酰胺(gln);r:精氨酸(arg);s:丝氨酸(ser);t:苏氨酸(thr);v:缬氨酸(val);w:色氨酸(trp)和y:酪氨酸(tyr)。
[0092]
提及取代残基时的“功能等同”意指变体pap的取代残基与另一个具有与seq id no:1同源的序列的pap序列中的残基具有相同的功能作用。功能等同的残基可以通过使用序列比对,例如,使用mutalin line比对软件(http://multalin.toulouse.inra.fr/multalin/multalin.html;1988,nucl.acids res.,16(22),25 10881-10890)来鉴定。比对后,功能等同的残基位于所考虑的不同序列的同源位置处。序列比对和功能等同残基的鉴定可以在任何pap和它们的天然变体之间(包括物种间)进行确定。
[0093]
提及蛋白时的“分离的(isolated)”意指这样的化合物,所述化合物已经被鉴定并与其自然环境的组分分离和/或回收或从非均相反应混合物中分离和/或回收。自然环境或
反应混合物中的污染物组分是会干扰蛋白功能的物质,并可以包括酶、激素和其他蛋白或非蛋白溶质。在一些实施方案中,本发明的蛋白被纯化(1)至按蛋白重量计大于95%,并且最优选地按重量计大于99%,如通过lowry法确定的,(2)至通过使用旋转杯测序仪(spinning cup sequenator)足以获得至少15个n末端或内部氨基酸序列的残基的程度,或(3)至使用考马斯蓝或优选地银染的还原或非还原条件下的sds-page的均一性。当通过重组方法制备时,本发明的分离的蛋白可以包括在重组细胞内原位的本发明的蛋白,因为该蛋白的自然环境中的至少一种组分将不存在。通常,本发明的分离的蛋白通过至少一个纯化步骤来制备。
[0094]“试剂盒”是指用于递送用于实施本发明的方法的材料或试剂的任何递送系统。在反应测定的情况下,这样的递送系统包括允许反应试剂(例如,适当的容器中的pap酶、受保护的rntp单体等)和/或支持材料(例如,缓冲液,用于进行测定的书面说明等)储存、从一个位置到另一个位置的运输或递送的系统和/或化合物(诸如稀释剂、表面活性剂、载体等)。例如,试剂盒包含含有相关反应试剂和/或支持材料的一种或更多种外罩(例如盒子)。这样的内含物可以一起或单独地被递送到预期的接收者。例如,第一个容器可以含有酶,而第二个或更多个容器可以含有rntp单体、缓冲液、具有起始子的固体支持物等。
[0095]
可互换使用的“突变体”或“变体”是指这样的多肽:来源于seq id no:1并且在一个或更多个位置包含修饰或改变,即取代、插入和/或缺失,且兼有无模板聚合酶活性和掺入一种或更多种可逆封闭的核苷三磷酸前体的能力。变体可以通过本领域熟知的各种技术获得。特别地,用于改变编码野生型蛋白的dna序列的技术的实例包括但不限于定点诱变、随机诱变和合成寡核苷酸构建。诱变活性包括在蛋白或者在本发明的情况下聚合酶的序列中缺失、插入或取代一个或数个(several)氨基酸。以下术语用于指定取代:l238a表示参考序列或野生型序列的位置238处的氨基酸残基(亮氨酸,l)被改变为丙氨酸(a)。a132v/i/m表示亲本序列的位置132处的氨基酸残基(丙氨酸,a)被以下氨基酸之一取代:缬氨酸(v)、异亮氨酸(i)或甲硫氨酸(m)。取代可以是保守的或非保守的取代。保守取代的实例是在以下组内的取代:碱性氨基酸(精氨酸、赖氨酸和组氨酸)、酸性氨基酸(谷氨酸和天冬氨酸)、极性氨基酸(谷氨酰胺、天冬酰胺和苏氨酸)、疏水性氨基酸(甲硫氨酸、亮氨酸、异亮氨酸、半胱氨酸和缬氨酸)、芳香族氨基酸(苯丙氨酸、色氨酸和酪氨酸)和小氨基酸(甘氨酸、丙氨酸和丝氨酸)。
[0096]“多核苷酸”或“寡核苷酸”被可互换地使用并且均意指核苷酸单体的线性聚合物或其类似物。构成多核苷酸和寡核苷酸的单体能够通过单体与单体相互作用的常规模式(诸如watson-crick类型的碱基配对、碱基堆积、hoogsteen或反向hoogsteen类型的碱基配对等)与天然多核苷酸特异性结合。这样的单体及其核苷间连键可以是天然存在的,或者可以是其类似物,例如天然存在的或非天然存在的类似物。非天然存在的类似物可以包括pna、硫代磷酸核苷间连键、含有允许标记物(诸如荧光团或半抗原等)附接的连接基团的碱基。每当寡核苷酸或多核苷酸的使用要求酶促加工(例如通过聚合酶延伸、通过连接酶连接等)时,普通技术人员将理解,在那些实例中,寡核苷酸或多核苷酸会在任何或一些位置处不含有核苷间连键、糖部分或碱基的某些类似物。通常多核苷酸的尺寸范围为几个单体单元例如5-40(此时多核苷酸通常被称为“寡核苷酸”)至数千个单体单元。除非另外指定或从上下文明显的,每当多核苷酸或寡核苷酸以字母(大写或小写)序列诸如“atgcctg”表示时,
应该理解的是该核苷酸从左至右是5
’→3’
的顺序,并且“a”表示脱氧腺苷,“c”表示脱氧胞苷,“g”表示脱氧鸟苷,并且“t”表示胸苷,“i”表示脱氧肌苷,“u”表示尿苷。相应的核糖核苷酸可以被指定为“ra”、“rc”、“rg”和“rt”。除非另外说明,否则术语和原子编号惯例将遵循在strachan和read,human molecular genetics 2(wiley-liss,new york,1999)中公开的那些。通常多核苷酸包含由磷酸二酯键连接的四种天然核苷(例如,脱氧腺苷、脱氧胞苷、脱氧鸟苷、脱氧胸苷(对于dna)或它们的核糖对应物(对于rna));然而,它们还可以包含非天然的核苷酸类似物,例如包含修饰的碱基、糖或核苷间连键。本领域技术人员清楚,在酶的活性要求特定的寡核苷酸或多核苷酸底物(例如单链dna、rna/dna双链体等)的情况下,则选择寡核苷酸或多核苷酸底物的合适组成完全是在普通技术人员的知识范围内,特别是在来自专著,诸如sambrook等人,molecular cloning,第二版(cold spring harbor laboratory,new york,1989)以及类似的参考文献的指导下。同样,寡核苷酸和多核苷酸可以指单链形式或双链形式(即寡核苷酸或多核苷酸及其相应互补物的双链体)。根据术语使用的上下文,普通技术人员将清楚哪种形式是意图的或是否两种形式都是意图的。
[0097]“引物”意指能够在与多核苷酸模板形成双链体后充当核酸合成的起始点并且从其3’末端沿模板延伸,使得形成延伸的双链体的天然或合成的寡核苷酸。引物的延伸通常用核酸聚合酶例如dna或rna聚合酶进行。在延伸过程中添加的核苷酸的顺序由模板多核苷酸的序列决定。通常引物通过dna聚合酶延伸。引物通常具有14个至40个核苷酸的范围内或者18个至36个核苷酸的范围内的长度。引物用于各种核酸扩增反应,例如使用单种引物的线性扩增反应,或采用两种或更多种引物的聚合酶链式反应。选择用于特定应用的引物的长度和序列的指导是本领域普通技术人员熟知的,如由以下参考文献表明的,这些参考文献通过引用并入本文:dieffenbach,编辑,pcr primer:a laboratory manual,第二版(cold spring harbor press,new york,2003)。
[0098]“序列同一性”是指两个序列(诸如两个多肽序列或两个多核苷酸序列)之间的匹配(例如相同的氨基酸残基)的数目(或分数,通常以百分比表示)。序列同一性可以通过将序列对齐使得重叠和同一性最大化同时使序列空位最小化时对序列进行比较来确定。特别地,序列同一性可以使用许多数学全局或局部比对算法中的任何一种来确定,这取决于两个序列的长度。相似长度的序列优选地使用全局比对算法(例如,needleman和wunsch算法;needleman和wunsch,1970)进行比对,该算法将序列在整个长度上最优地对齐,而具有明显不同长度的序列优选地使用局部比对算法(例如,smith和waterman算法(smith和waterman,1981)或altschul算法(altschul等人,1997;altschul等人,2005))进行比对。以确定氨基酸序列同一性百分比为目的的比对可以以本领域技术范围内的各种方式,例如,使用可在互联网网站诸如http://blast.ncbi.nlm.nih.gov/或ttp://www.ebi.ac.uk/tools/emboss/上可得的公开可得的计算机软件来实现。本领域技术人员可以确定用于测量比对的合适参数,包括在被比较序列的全长上实现最大对齐所需的任何算法。出于本文的目的,%氨基酸序列同一性值是指使用逐对序列比对程序emboss needle生成的值,该程序使用needman-wunsch算法产生两个序列的最佳全局比对,其中所有检索参数被设置为默认值,即评分矩阵=blosum62,空位开放=10,空位延伸=0.5,末端空位罚分=假,末端空位开放=10并且末端空位延伸=0.5。
[0099]“取代”意指氨基酸残基被另一种氨基酸残基替代。优选地,术语“取代”是指氨基
酸残基被选自以下的另一种氨基酸残基替代:天然存在的20种标准氨基酸残基、罕见的天然存在的氨基酸残基(例如羟脯氨酸、羟赖氨酸、别羟赖氨酸、6-n-甲基赖氨酸、n-乙基甘氨酸、n-甲基甘氨酸、n-乙基天冬酰胺、别异亮氨酸、n-甲基异亮氨酸、n-甲基缬氨酸、焦谷氨酰胺、氨基丁酸、鸟氨酸、正亮氨酸、正缬氨酸)和通常合成获得的非天然存在的氨基酸残基(例如环己基-丙氨酸)。优选地,术语“取代”是指氨基酸残基被选自天然存在的20种标准氨基酸残基的另一种氨基酸残基替代。符号“+”指示取代的组合。
[0100]
在本文中氨基酸由它们的单字母或三字母代码根据以下命名法表示:a:丙氨酸(ala);c:半胱氨酸(cys);d:天冬氨酸(asp);e:谷氨酸(glu);f:苯丙氨酸(phe);g:甘氨酸(gly);h:组氨酸(his);i:异亮氨酸(ile);k:赖氨酸(lys);l:亮氨酸(leu);m:甲硫氨酸(met);n:天冬酰胺(asn);p:脯氨酸(pro);q:谷氨酰胺(gln);r:精氨酸(arg);s:丝氨酸(ser);t:苏氨酸(thr);v:缬氨酸(val);w:色氨酸(trp)和y:酪氨酸(tyr)。在本文件中,以下术语用于指定取代:l238a表示亲本序列的位置238处的氨基酸残基(亮氨酸,l)被改变为丙氨酸(a)。a132v/i/m表示亲本序列的位置132处的氨基酸残基(丙氨酸,a)被以下氨基酸之一取代:缬氨酸(v)、异亮氨酸(i)或甲硫氨酸(m)。取代可以是保守的或非保守的取代。保守取代的实例是在以下组内的取代:碱性氨基酸(精氨酸、赖氨酸和组氨酸)、酸性氨基酸(谷氨酸和天冬氨酸)、极性氨基酸(谷氨酰胺、天冬酰胺和苏氨酸)、疏水性氨基酸(甲硫氨酸、亮氨酸、异亮氨酸、半胱氨酸和缬氨酸)、芳香族氨基酸(苯丙氨酸、色氨酸和酪氨酸)和小氨基酸(甘氨酸、丙氨酸和丝氨酸)。
[0101]
本公开内容不意图限于所阐述的特定形式的范围,而是意图涵盖本文描述的变化形式的替代、修改和等同物。此外,本公开内容的范围完全包含鉴于本公开内容对本领域技术人员可以变得明显的其他变化形式。本发明的范围仅由所附权利要求书限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1