用于将剂递送至细胞和组织中的新型肽、组合物和方法
文档序号:30235279发布日期:2022-06-01 09:58阅读:508来源:国知局
导航: X技术> 最新专利>有机化合物处理,合成应用技术
用于将剂递送至细胞和组织中的新型肽、组合物和方法
1.相关申请的交叉引用
2.本专利申请要求2019年7月2日提交的美国临时专利申请号62/869,831的优先权的权益,其被通过引用以其整体并入本文。
3.关于联邦资助研究的声明
4.本发明是在美国陆军授予的项目号为w81xwh-16-1-0650的政府资助下完成的。政府对本发明享有一定的权利。
5.序列表
6.本技术随附了一份序列表,并以名为“166118_00949_st25.txt”的ascii文本文件的序列表提交,该文件大小为2.09kb,且创建于2020年6月15日。序列表与本技术一起通过efs-网络以电子方式提交,且该序列表被通过引用以其整体并入本文。
7.引言
8.对于大多数药物来说,质膜是其转移到细胞质或细胞核中的不可渗透屏障。为了克服这一屏障,对细胞穿膜肽(cpp)的开发存在很大兴趣(guidotti等人,2017年)。已描述了多种cpp,其能够将包括蛋白质、肽、dna、sirna和小分子药物在内的生物活性偶联物递送到细胞和组织中(bechara和sagan,2013年)。cpp被分组为多个类:a)阳离子型,包括hiv tat、穿模素(penetratin)或聚精氨酸;b)两亲型,包括转运素(transportan)和pep-1以及c)疏水型,包括pep-7
–
这些cpp及其一般特性已在其他地方被综述(guidotti等人,2017年)。虽然已经鉴定了具有对跨过质膜递送分子有用的特性的cpp,但单个肽的效率取决于被靶向的组织的类型而变化。
9.尽管制药业取得了进步,但眼部疾病和损伤仍然是重要的医学问题。根据美国国立卫生研究院,导致失明的眼部疾病是美国最常见的致残原因之一[国立眼科研究所(1999-2003).a report of the national eye council,美国国立卫生研究院]。眼睛的自然防御系统使药物到眼部组织的递送复杂化。眨眼动作清洗眼表并更新泪膜,泪膜含有免疫球蛋白和抗微生物蛋白。泪膜对药物的快速清除使得分子局部递送到眼表困难,导致给定药物损失超过95%。此外,由于房水的再循环,能够穿透到眼内室的药物的半衰期通常很短。因此,改进向眼部组织递送药物的方法是一项重要的医疗需求。
[0010]
在本技术中,提供了高效靶向视网膜和角膜的cpp。这些cpp的独特之处在于,它们不需要cpp与异源分子之间的化学偶联来将异源分子穿过质膜递送,因此提供了有前景的将治疗药物递送至视网膜以治疗疾病和损伤的方法。
[0011]
概述
[0012]
本文提供的肽可作为细胞穿膜肽,其可有效地将剂递送至细胞或组织。在一些实施方案中,肽未与剂偶联或连接,且仍能穿过细胞膜并递送剂。本发明提供包含seq id no:1或与seq id no:1具有90%序列同一性的肽,其中seq id no:1中的x表示可选的柔性接头区域。本发明还提供具有包含seq id no:2或seq id no:4的氨基酸序列或由seq id no:2或seq id no:4组成的氨基酸序列的肽,或与seq id no:2或seq id no:4具有90%序列同一性的肽,其中seq id no:2中的每个x表示可选的柔性接头区域。
[0013]
提供了包含一种剂和本发明所述肽的药物组合物。还提供了编码本发明所述肽的多核苷酸和核酸构建体。
[0014]
还提供了包括编码本发明所述肽的多核苷酸的重组病毒。本发明所述肽可插入在病毒衣壳蛋白中。可以使用包括aav9的腺相关病毒(aav)。
[0015]
此外,本发明提供了通过使细胞或组织与所公开的组合物或与一种剂和所公开的肽或包含肽的组合物接触而将该剂递送至细胞或组织的方法。
[0016]
还提供了将一种剂递送至受试者的细胞或组织的方法,该方法通过先配制包含该剂和本发明所述肽的药物,然后将该药物施用于受试者。
[0017]
还提供了通过使细胞或组织与本发明的病毒和肽二者接触来将病毒递送至细胞或组织的方法。
[0018]
本文提供的组合物、肽和病毒递送机制可用于治疗需要治疗病况或疾病的受试者。所述病况或疾病可选自包括退行性眼病、与炎症或氧化应激相关的疾病、新血管形成或纤维化和眼损伤的那些。
[0019]
附图简要说明
[0020]
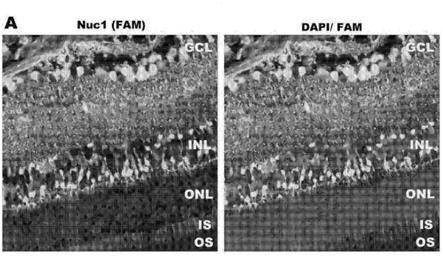
图1显示了荧光显微镜图像,其表明在玻璃体内注射之后nuc1肽穿透了视网膜组织和细胞。玻璃体内注射后,fam标记的nuc1定位到视网膜的所有层,包括gcl、inl、is和os(a)。免疫染色使用微管蛋白(b)、pkc(c)、视杆视蛋白(d)和谷氨酰胺合成酶(e)。gcl,神经节细胞层;onl,外核层;is,内节;os,外节。对于一些图,还呈现了放大倍数更高的图像。
[0021]
图2显示了代表性的荧光显微镜图像,其表明nuc 1促进重组蛋白渗透到视网膜细胞中。将mcherry/rfp和fam标记的nuc1共同注射到成年小鼠的玻璃体中导致mcherry被摄取到多种视网膜细胞类型中,在onl中最为丰富(a)。呈现了更高放大倍数的onl(a)。将用mcherry和未标记的nuc1共同注射的小鼠的冷冻切片进行神经节细胞的微管蛋白(b)、双极细胞的pkc(c)、米勒细胞的谷氨酰胺合成酶(d)或视锥视蛋白(e)染色。值得注意的是,重组mcherry/rfp蛋白在单独玻璃体内注射时没有明显地穿透视网膜(f),如通过中央图中rfp信号的缺失所示。gcl,神经节细胞层;onl,外核层;is,内节;os,外节。对于一些图,还呈现了放大倍数更高的图像。
[0022]
图3表明nuc1促进功能性蛋白递送到视网膜中。在正常小鼠、mnu、mnu+xiap或mnu+xiap+nuc1注射的小鼠中进行了凋亡细胞的tunel染色。使用pbs对小鼠进行攻击,以确定凋亡细胞的正常水平或mnu诱导的凋亡。相对于仅注射xiap的小鼠相比,nuc1与xiap的共同注射显著抗凋亡(a)。在视网膜脱离模型中,还观察到在nuc1+xiap后凋亡受到显著抑制(b)。gcl,神经节细胞层;onl,外核层;inl,内核层。
[0023]
图4表明nuc1促进抗体递送到视网膜中。抗vegf抗体抑制激光诱导的新血管形成(cnv),其可通过抗vegf抗体与nuc1联合施用来增强;玻璃体内注射(a)或以每日局部滴剂递送10天(b)。上图显示了用fitc偶联加纳籽凝集素i染色的rpe/脉络膜铺片的荧光显微镜图像,将激光光斑的面积在下面的散点图中被定量。
[0024]
图5表明nuc1增强核心蛋白聚糖治疗碱烧伤和脉络膜新血管形成(cnv)的效力。对从碱烧伤小鼠模型中采集的角膜冷冻切片进行α-肌动蛋白(纤维化的标志物(红色))染色,细胞核经dapi(蓝色)染色(a)。经玻璃体内注射单独的核心蛋白聚糖或核心蛋白聚糖与nuc1肽的组合(核心蛋白聚糖+nuc1)治疗的激光诱导cnv小鼠眼睛的异凝集素和α-平滑肌
eyela或aav-ikv-gfp。
[0033]
图14显示局部应用与nuc1共同递送的核心蛋白聚糖(核心蛋白聚糖+nuc1)减少角膜混浊并减轻碱烧伤后的角膜增厚。图a显示未暴露于碱烧伤和治疗(对照)或暴露于碱烧伤和局部治疗之一(磷酸盐缓冲盐水(pbs)、单独的核心蛋白聚糖或核心蛋白聚糖+nuc1)的小鼠眼睛的代表性图像。图b显示未暴露于碱烧伤和治疗(对照)或暴露于碱烧伤和局部治疗之一(pbs、单独的核心蛋白聚糖或核心蛋白聚糖+nuc1)的小鼠角膜的苏木精(细胞核;蓝色)和伊红(细胞外基质和细胞质;粉色)染色的横向石蜡切片(放大10倍和20倍)。ep,上皮;st,间质;en,内皮。
[0034]
图15显示局部应用核心蛋白聚糖+nuc1显著减少暴露于碱烧伤的小鼠角膜中的新血管形成和纤维化。图15的图a显示未暴露于碱烧伤和治疗(对照)或暴露于碱烧伤和局部治疗之一(pbs、单独的核心蛋白聚糖或核心蛋白聚糖+nuc1)的小鼠角膜冷冻切片的代表性图像。将冷冻切片进行gslⅰ(异凝集素;绿色,上图)或平滑肌肌动蛋白(sma,α-肌动蛋白;红色,中图)染色。合并后的图像显示在下图中。角膜细胞核用dapi染色(蓝色)。epi,上皮;str,间质;endo,内皮。图15的图b显示定量染色的条形图。第一张图显示在来自三个治疗组(pbs、单独的核心蛋白聚糖和核心蛋白聚糖+nuc1)的每一组的角膜中指示新血管形成和血管生成的gsl i(异凝集素)染色的定量。第二张图显示在来自三个治疗组(pbs、单独的核心蛋白聚糖和核心蛋白聚糖+nuc1)的每一组的角膜中指示纤维化的sma(α-肌动蛋白)染色的定量。*p《0.05(学生t检验)
[0035]
图16显示核心蛋白聚糖+nuc1显著减少暴露于碱烧伤的小鼠角膜中的炎性细胞浸润。图16的图a显示未暴露于碱烧伤和治疗(对照)或暴露于碱烧伤和局部治疗之一(pbs、单独的核心蛋白聚糖或核心蛋白聚糖+nuc1)的小鼠角膜冷冻切片的代表性图像。冷冻切片进行炎症标志物cd45(绿色,上图)和f4/80(红色,下图)染色。角膜细胞核还用dapi染色(蓝色)。epi,上皮;str,间质;endo,内皮。图16的图b显示定量染色的条形图。第一张图显示在来自三个治疗组(pbs、单独的核心蛋白聚糖和核心蛋白聚糖+nuc1)的每一组的角膜中cd45染色的定量。第二张图显示在来自三个治疗组(pbs、单独的核心蛋白聚糖和核心蛋白聚糖+nuc1)的每一组角膜中f4/80染色的定量。
[0036]
图17a显示,核心蛋白聚糖+nuc1显著降低暴露于碱烧伤的小鼠角膜中细胞因子(il-1β除外)的表达。这些图表显示从未暴露于碱烧伤和治疗(对照)或暴露于碱烧伤和局部治疗之一(pbs、单独的核心蛋白聚糖或核心蛋白聚糖+nuc1)的小鼠角膜中提取的裂解物中细胞因子白细胞介素(il)-1β(il-1β)、il-6、il-17、干扰素-γ(ifn-g)和肿瘤坏死因子α(tnf-α)的表达水平(皮克/毫升,pg/ml)。
[0037]
图17b显示未暴露于碱烧伤和治疗(对照)或暴露于碱烧伤和局部治疗之一(pbs、单独的核心蛋白多糖或核心蛋白多糖+nuc1)的小鼠角膜冷冻切片的代表性图像。冷冻切片用针对炎性细胞因子,转化生长因子β(tgf-β1,红色)的抗体染色。epi,上皮;str,间质;endo,内皮。
[0038]
图18显示核心蛋白聚糖+nuc1显著降低暴露于碱烧伤的小鼠角膜中caspase-3的活化。左侧显示未暴露于碱烧伤和治疗(对照)或暴露于碱烧伤和局部治疗之一(pbs、单独的核心蛋白聚糖或核心蛋白聚糖+nuc1)的小鼠角膜冷冻切片的代表性图像。冷冻切片用针对活化caspase-3的抗体染色(红色)。角膜细胞核用dapi染色(蓝色)。右侧的条形图显示3
个治疗组(pbs、单独的核心蛋白聚糖或核心蛋白聚糖+nuc1)中每一组的角膜中活化caspase-3染色的定量。
[0039]
图19显示核心蛋白聚糖+nuc1显著减少暴露于碱烧伤的小鼠角膜中的细胞死亡。图19a显示未暴露于碱烧伤和治疗(对照)或暴露于碱烧伤和局部治疗之一(pbs、单独的核心蛋白聚糖或核心蛋白聚糖+nuc1)的小鼠角膜冷冻切片的代表性图像。冷冻切片用tunel测定染色(红色)。角膜细胞核用dapi染色(蓝色)。对于每种治疗,左图显示dapi和tunel染色的叠加,而右图显示单独的tunel染色。epi,上皮;str,间质;endo,内皮。图19b显示对来自3个治疗组(pbs、单独核心蛋白聚糖或核心蛋白聚糖+nuc1)中每一组的角膜中tunel阳性细胞的定量的条形图。
[0040]
图20显示核心蛋白聚糖+nuc1显著减少暴露于碱烧伤的小鼠角膜中的神经胶质增生。显示未暴露于碱烧伤和治疗(对照)或暴露于碱烧伤和局部治疗之一(pbs、单独的核心蛋白聚糖或核心蛋白聚糖+nuc1)的小鼠角膜冷冻切片的代表性图像。将冷冻切片进行胶质纤维酸性蛋白(gfap,红色)染色。视网膜细胞核用dapi染色(蓝色)。gcl,神经节细胞层;inl/onl,内/外核细胞层。
[0041]
图21显示在玻璃体内注射4μg cre重组酶(含和不含nuc1(1μg))后,ai9小鼠视网膜冷冻切片的代表性共聚焦显微镜图像。在神经节细胞层(gcl)、内核层(inl)、外核层(onl)和视网膜色素上皮(rpe)中观察到摄取,通过自报告转基因的tdtomato表达指示(红色)。右侧显示经nuc1+cre治疗的视网膜的更高放大倍数的图像。
[0042]
图22显示在玻璃体内注射cas9-gfp(含和不含nuc1)后4小时,c57bl/6j小鼠视网膜冷冻切片的代表性共聚焦显微镜图像。在神经节细胞层(gcl)、内核层(inl)和外核层(onl)观察到gfp信号。
[0043]
图23显示视网膜下注射与核糖核蛋白颗粒偶联的cas9(cas9-rnp)后,ai9小鼠视网膜冷冻切片的代表性共聚焦显微镜图像。注射后6周,td-tomato表达定位于视网膜色素上皮(rpe)和少数光感受器。图23a显示10x放大图像,而图23b显示40x图像。
[0044]
图24显示在玻璃体内注射与核糖核蛋白颗粒偶联的cas9(cas9-rnp)后,ai9小鼠视网膜冷冻切片的代表性共聚焦显微镜图像。td-tomato表达定位于神经节细胞层(gcl)和内核层(inl)。
[0045]
详述
[0046]
对于大多数药物,质膜代表不可渗透的屏障。然而,特殊的一类称为细胞穿膜肽(cpp)的蛋白质可以穿过完整的质膜,并促进货物分子的摄取。因此,cpp能够将包括蛋白质、肽、dna、sirna和小分子药物在内的生物活性偶联物递送到细胞和组织中(bechara和sagan,2013年)。cpp提供制备容易、快速摄取、低毒性和免疫反应[jones et al.2005 br j pharmacol 145:1093-1102]。经过充分研究的cpp包括人类免疫缺陷病毒(hiv)tat蛋白[frankel et al.1988 cell 55:1189-1193]、单纯疱疹病毒(hsv)vp22蛋白[phelan et al.1998 nat biotechnol 16:440-443]和果蝇黑腹(drosophila melanogaster)触角足同源结构域蛋白[derossi et al.1994 j bioi chem 269:10444-10450]。例如,hiv tat已显示出作为cpp的功能,其可压缩dna并将其递送到培养的细胞中[ignatovich i a et al.2003 j biol chem 278:42625-42636]。然而,除hiv tat外,关于cpp在体内神经元组织中性能的可用信息非常有限。此外,cpp通常需要与货物分子化学偶联才能通过质膜递送,
并且这种修饰可能对货物分子的功能产生不利影响。
[0047]
本发明提供了用于将剂递送到细胞或组织中,特别是递送到眼部细胞和组织中的肽。本发明所述肽包括seq id no:1和seq id no:2以及本文提供的其他肽。虽然具有这种能力的肽已经在前面描述过,例如在美国专利8,778,886中,但本发明所述肽是例外的,因为它们不需要与剂化学偶联或连接而把剂有效递送到细胞或组织中。实施例表明一种这样的肽,称为“nuc1”并以seq id no:3表示,可能是迄今描述的最有效的穿透视网膜的肽。此外,nuc1能够向眼部组织递送各种各样的剂,包括重组蛋白、抗体、蛋白聚糖、类固醇、病毒和核糖核蛋白。
[0048]
本文所用的肽是由定制肽的商业供应商合成的。可以使用固相技术进行肽合成[robertge et al.995 science 269:202],并实现自动化合成,例如,使用431a多肽合成仪(applied biosystems,加利福尼亚州福斯特市)。本领域技术人员应理解,除了化学合成之外,可以使用其它手段来产生肽,包括但不限于使用蛋白质和肽表达系统。
[0049]
实施例中所述的cpp(nuc1)包括针对其靶向眼部细胞的潜在能力被选择的两个氨基酸序列。这些序列中的第一个序列asikvavsa(seq id no:4)源自较长的序列csrarkqaasikvavsadr(seq id no:8),其表示基底膜糖蛋白层粘连蛋白-1的核仁素结合区。第二个序列dkprr(seq id no:5)源自稍长的序列cdkprr(seq id no:7),其形成特定亚型的血管内皮生长因子(vegf165)的硫酸乙酰肝素结合域。重要的是,在视网膜组织表面发现了核仁素和硫酸乙酰肝素,这可能解释了这些“靶向肽”进入该组织的能力。
[0050]
本发明的肽任选地包括柔性接头区域。nuc1(seq id no:3)包括通过包含两个甘氨酸残基的氨基酸接头连接至seq id no:5的seq id no:4,并且在实施例中被示为充当细胞穿膜肽(cpp)。本领域技术人员应理解,可以在不影响cpp功能的情况下改变接头区域。因此,本文提供的肽由seq id no:1表示,其中该序列中的xaa氨基酸表示柔性接头区域。将nuc1设计为在靶向肽序列(层粘连蛋白-1和vegf165衍生肽)之间包含柔性接头区域。“接头”是用于连接肽(任选通过肽键连接)的氨基酸残基的序列。根据本发明,柔性接头区域包含1个或更多个氨基酸残基,优选1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个或更多个残基。在本发明的优选实施方案中,接头包含2个残基。“柔性”接头是在溶液中没有必需的固定结构(二级或三级结构)的氨基酸序列。因此,这种柔性接头可自由接受多种构象,并由多种氨基酸组成。接头可以作为靶向肽中存在的接头序列提供,或者通过在靶向肽之间插入一个或更多个氨基酸残基来提供。接头可以包含基本上不阻碍靶向肽与其相应靶分子相互作用的任何氨基酸序列。柔性接头序列的优选氨基酸残基包括甘氨酸、丙氨酸、丝氨酸、苏氨酸、赖氨酸、精氨酸、谷氨酰胺和谷氨酸,但不限于此。在实施例中,柔性接头序列包含两个甘氨酸残基,使得nuc1肽具有包含seq id no:3的氨基酸序列。本领域技术人员应理解,可以使用其他残基,并且可以改变接头的长度,而不会对肽的功能产生不利影响。在某些实施方案中,肽不包含接头区域。通常,接头是作为编码接头和靶向肽二者的重组核酸的一部分来制备的。接头也可以通过肽合成制备,随后与靶向肽结合。操纵核酸和肽合成的方法是本领域熟知的。
[0051]
在本技术中,术语“蛋白质”或“肽”或“多肽”可互换地用于指氨基酸序列。本文所述的肽不是天然的,而是工程肽序列。“氨基酸”和“氨基酸序列”可包括天然存在的组分和非天然存在的组分(即,氨基酸衍生物或氨基酸类似物,其取代了一个或更多个天然存在的
氨基酸)。此外,在两个相邻残基之间具有一个或更多个非肽键或拟肽键的氨基酸序列包括在该定义中。
[0052]
关于本文所述的肽,措辞“%序列同一性”、“百分比同一性”或“%同一性”是指使用标准化算法比对的至少两个氨基酸序列之间的残基匹配百分比。氨基酸序列比对的方法是众所周知的。有些比对方法考虑了保守性氨基酸置换。如下文更详细解释的,这种保守性置换通常保留取代位点的电荷和疏水性,从而保留多肽的结构(并因此保留功能)。氨基酸序列的百分比同一性可以按本领域所理解的来确定。(参见,例如,美国专利号7,396,664,其被通过引用以其整体并入本文)。美国国家生物技术信息中心(ncbi)的基础局部比对算法的搜索工具(blast)提供了一套常用且可免费获得的序列比对算法,可在其网站从多个来源(包括ncbi,马里兰州贝塞斯达)获得。blast软件套件包括各种序列分析程序,包括“blastp”,用于将已知氨基酸序列与来自多个数据库的其他氨基酸序列进行比对。
[0053]
多肽序列同一性可以在整个被定义例如由特定的seq id号定义的多肽序列的长度上测量,或者可以在较短的长度上测量,例如,在取自较大的被定义的多肽序列的片段长度上测量,所述片段例如,至少10个、至少15个、至少20个或更多个相邻残基的片段。此类长度仅为示例性的,且应理解,由本文(在表、图或序列表中)所示序列支持的任何片段长度可用于描述可测量百分比同一性的长度。
[0054]
实施例表明,可将nuc1递送至视网膜的所有层,包括神经节细胞、米勒细胞、双极细胞和光感受器视杆细胞和视锥细胞(图1)。值得注意的是,nuc1向视网膜中的渗透明显优于我们先前描述的任何视网膜穿膜肽,使nuc1成为治疗多种眼部疾病的有前景的候选药物。例如,光感受器的转导将应用于治疗例如视网膜色素病变等疾病,而视网膜色素上皮细胞的转导将应用于治疗年龄相关性黄斑变性,且神经节细胞的转导将应用于治疗青光眼。然而,本发明的靶向细胞或组织不限于眼睛,因为nuc1可用于其他组织,包括口腔、生殖器、软骨(软骨细胞)、肝、肾、神经、脑、上皮、心脏和肌肉组织。特别是,基于视网膜神经元的性质,我们预期本发明的方法可以扩展到其他神经元组织,例如大脑。在实施例中,cpp能够允许将剂递送至光感受器、视网膜色素上皮、神经节细胞、双极细胞、米勒细胞、脉络膜内皮细胞、晶状体上皮、角膜内皮、角膜基质、小梁网或虹膜。
[0055]
利用这种进入细胞和组织的能力,本发明的cpp能够将多种剂递送至靶位点。在某些实施方案中,剂是治疗剂、可检测剂或细胞毒性剂。在一些实施方案中,剂选自以下:低分子量药物、肽、脂质、碳水化合物、蛋白质、抗体、免疫原、基因治疗或基因工程构建体、病毒或病毒载体或疫苗。在其他实施方案中,剂是核酸,例如cdna、mrna、mirna、trna或小干扰rna。在优选的实施方案中,剂是抗凋亡、抗炎、抗血管生成或抗纤维化剂。如实施例所示,剂可以是x-连锁凋亡抑制蛋白、核心蛋白聚糖、针对血管内皮生长因子的抗体、来自bcl-xl的bh4结构域肽、nrf2或地塞米松,但许多其他剂对本领域技术人员来说是明显的。在其他优选的实施方案中,剂是基因治疗剂或基因编辑剂。剂可以是重组病毒或cas9核糖核蛋白。例如,血管内皮生长因子或视紫红质可以是基因编辑的合适靶标。简而言之,在基因治疗中,基因通常以dna或rna分子的形式递送到细胞中。基因作为表达构建体的一部分被包括,该构建体还包括启动子/增强子元件以指导基因在靶细胞内的表达。当基因被表达时,所得的蛋白质产物在靶细胞内提供所需的功能。该功能可以纠正缺陷或异常(突变、异常表达等),或者它可以保证另一种有治疗价值的蛋白的表达。基因治疗可以在体外对从体内提取的细
胞进行,这些细胞在修饰后被重新引入,或者基因治疗可以直接在体内适当的组织中进行。因此,在基因编辑中,改变细胞内或选定组织细胞内的基因,以用修饰的基因替换该细胞基因拷贝。
[0056]
在本发明的优选实施方案中,剂没有化学偶联或连接至cpp。偶联会对附接到cpp的货物或剂的功能产生不利影响。因此,本发明的cpp递送未偶联的货物分子的能力代表了对现有技术的重大改进。此外,由于易于生产,该能力使cpp用途极其广泛。例如,它允许对许多货物分子或潜在剂的疗效进行串联测试。它还节省了每次测试潜在货物分子时生产新的偶联分子所花费的时间和金钱。
[0057]
此外,提供编码本发明的cpp的多核苷酸,以及其中这些多核苷酸可操作地连接到启动子的核酸构建体。如本文所用,措辞“可操作地连接至启动子”是指多核苷酸与启动子并置,使得当在启动子处起始基因表达时,多核苷酸包含在所得基因产物中。
[0058]
本发明还提供包含编码cpp的多核苷酸和核酸构建体的病毒。在优选的实施方案中,病毒是腺相关病毒(aav)。已显示aav载体是将基因递送至人体组织,特别是眼部、神经系统和肝组织的可行且有效的方法。然而,在本发明中也可以使用经修饰用于基因治疗应用的其他病毒,包括逆转录病毒、腺病毒、慢病毒、甲病毒、黄病毒、弹状病毒、麻疹病毒、新城疫病毒、痘病毒、微小核糖核酸病毒和单纯疱疹病毒。在实施例中,使用了具有aav9假型衣壳(aav2/9)的aav2载体。然而,任一aav血清型,包括但不限于aav2/2、aav2/8或aav2/5,均可用于本发明[khabou et al.2016biotechnol bioeng 113(12):2712-2724]。
[0059]
在一些实施方案中,将cpp掺入病毒衣壳蛋白中。在此,插入的肽优选nuc1的较短部分,其仅包含源自层粘连蛋白-1的靶向肽asikavsa(seq id no:4)。在实例中,该序列的两侧是两个甘氨酸残基,形成序列gasikvavsag(seq id no:6),并且被克隆在aav血清型9衣壳蛋白的氨基酸588和589之间。先前已经描述了将异源序列掺入aav衣壳或其他病毒载体的外膜或衣壳蛋白的其他位点。任一端上的甘氨酸残基是柔性接头区域,该区域可被本领域技术人员改变以包括不同的氨基酸残基,或在长度上可多于一个氨基酸。因此,本文提供的肽由seq id no:2表示,其中序列中的xaa氨基酸表示柔性接头区域(如上定义),其在长度上可以是一个或更多个氨基酸,并且可以使用不同的氨基酸残基。
[0060]
本文所述的病毒可以是重组病毒或病毒样颗粒(vlp),并且包括基因治疗载体或vlp。如上所述,可将cpp序列插入多种病毒或病毒载体中,并可对其进行工程改造以允许多肽在靶细胞中递送和表达。考虑与没有插入或表达本文所提供肽的类似病毒载体相比,本文所述的病毒载体和病毒将更有效地递送目的多核苷酸并允许表达用于基因治疗目的的多肽,以允许增加向靶组织或靶组织细胞的递送速率。此外,这些表达或掺入cpp的重组病毒或病毒载体也可与可溶性cpp一起递送,以进一步增加向靶细胞或组织的递送。在一个实施方案中,将seq id no:4或6的层粘连蛋白肽序列掺入到病毒载体中,并将可溶性nuc1(seq id no:1或3)肽与病毒共递送,以增加病毒及其货物的递送。
[0061]
在相关实施方案中,肽的两侧是包含至少一个氨基酸的不同柔性接头区域。如实施例中所示,当视网膜下或玻璃体内注射时,在aav衣壳(实例中称为aav-ikv)中包括nuc1的这一部分显著改善了视网膜细胞的感染。值得注意的是,当病毒(在病毒衣壳中含或不含seq id no:4或seq id no:6)与nuc1共同注射时,可以进一步增强该重组病毒的感染。
[0062]
本发明提供了将剂递送至细胞或组织的方法。这些方法包括使细胞或组织与所述
剂和本发明的cpp接触。细胞可以在体内、体外或离体直接或间接地与剂接触。接触包括施用至细胞、组织、哺乳动物、患者或人。此外,接触细胞包括向细胞培养物添加剂或局部添加。其他合适的方法可包括使用本文所定义的合适的施用程序和途径将剂引入或施用至细胞、组织、哺乳动物或患者。在该方法的某些实施方案中,细胞或组织正在培养中。或者,细胞或组织在体内。
[0063]
肽介导的分子递送已用于治疗人类眼部疾病以及其他疾病。因此,本发明还提供了将剂递送至受试者的细胞或组织的方法。这些方法包括配制包括所述剂和本发明的cpp的药物,并将其施用于受试者。治疗湿性年龄相关性黄斑变性的现行护理标准包括每月玻璃体内注射抗vegf抗体(如兰尼单抗或阿瓦斯丁)(comparison of age-related macular degeneration treatments trials research et al.,2012)。如实施例所示,这些抗体与nuc1共同递送增强其效力,这可能降低有效剂量所需的抗体浓度或降低给药频率。在一些实施方案中,玻璃体内或视网膜下注射可以用局部施用代替。加入nuc1允许剂穿过角膜到达细胞,从而实现治疗,而无需昂贵的就医和侵入性医疗操作。这种增强药物效力的能力对降低治疗成本和降低由于脱靶活性引起的潜在毒性都有影响。受试者包括但不限于脊椎动物、哺乳动物(合适的话)、人(合适的话)、牛、猫、狗、猪或小鼠。也可以使用其他动物感染模型。
[0064]
本发明的药物或药用组合物可以任选地与一种或更多种合适的药学上可接受的载体一起配制。药学上可接受的载体包括溶剂、稀释剂或其他液体媒介物、分散助剂或悬浮助剂、表面活性剂、等渗剂、增稠剂或乳化剂、防腐剂、固体粘合剂和润滑剂中的任一种及全部。《雷明登药学大全》[by gennaro,mack编辑easton,pa.出版,1995]描述了用于配制药物组合物的各种不同的载体及已知的其制备技术。药物还可任选地包含一种或更多种其他治疗剂。其他治疗剂可以选自由以下组成的组:生长因子、抗炎剂、血管加压剂、胶原酶抑制剂、局部类固醇、间质金属蛋白酶抑制剂、抗坏血酸盐、血管紧张素ⅱ、血管紧张素钙网蛋白、四环素、纤连蛋白、胶原、血小板反应蛋白、b族维生素和透明质酸。
[0065]
所提供的方法包括使用对治疗受试者有效的任何量和任何施用途径施用药物。具体剂量由医师个人根据待治疗的患者选择。调整剂量和施用,以提供足够水平的活性剂或维持预期效果。被考虑的其他因素包括疾病状态的严重程度,例如疾况的程度、病史;患者的年龄、体重和性别;饮食、施用时间和频率;药物组合;反应敏感性;以及对治疗的耐受性/反应。对于任何活性剂,可在细胞培养测定或动物模型(通常为小鼠、兔子、狗或猪)中初步估计治疗有效剂量。动物模型还用于确定所需的浓度范围和施用途径。
[0066]
在靶组织是眼部的实施方案中,可以通过多种途径(包括经眼、玻璃体内、局部、经脉络膜、前房内、脉络膜上、经皮、视网膜下、腹膜内、皮下和静脉途径)将药物施用于受试者的眼睛。值得注意的是,眼部的自然防御使药物至眼部的局部递送困难。然而,如实施例所示,nuc1的局部施用可增强药物向角膜的递送。本应用尤其有用,因为局部施用后只有不到1%的可用药物渗入眼组织[shell j w 1984 survey opthalmol 29:117-128]。另外,替代施用途径包括:口服、直肠、胃肠外、脑池内、阴道内、腹膜内、口腔或鼻腔途径。
[0067]
对于眼部施用,液体剂型包括缓冲剂和增溶剂、优选稀释剂(例如水)、防腐剂(例如thymosol)以及用于调节溶液的一种或更多种生物聚合物或聚合物(例如聚乙二醇、羟丙基甲基纤维素、透明质酸钠、聚丙烯酸钠或罗望子胶)。药物的局部或经皮施用的剂型包括
滴剂、软膏、糊剂、霜剂、洗剂、凝胶、粉剂、溶液、喷雾剂、吸入剂或贴剂。除了本发明的活性剂之外,软膏、糊剂、霜剂和凝胶还可含有赋形剂,例如动物和植物脂肪、油、蜡、石蜡、淀粉、黄芪胶(tragacanth)、纤维素衍生物、聚乙二醇、硅酮、膨润土、硅酸、滑石、氧化锌或其混合物。除了本发明所述剂外,粉剂和喷雾剂还可含有赋形剂,例如滑石、硅酸、氢氧化铝、硅酸钙、聚酰亚胺粉末或这些物质的混合物。喷雾剂还可含有常规推进剂,如氯氟烃。
[0068]
根据已知技术使用合适的分散剂或湿润剂和悬浮剂配制可注射制剂(例如无菌可注射水性或油性混悬液)。无菌可注射制剂也是在无毒的胃肠外可接受稀释剂或溶剂中的无菌可注射溶液、混悬剂或乳剂,如作为1,3-丁二醇溶液。可接受的媒介物和溶剂包括水、林格氏溶液、u.s.p.和等渗氯化钠溶液。此外,无菌不挥发性油通常用作溶剂或悬浮介质。为此目的,可以使用任何温和的不挥发性油,包括合成的单甘油酯或双甘油酯。此外,脂肪酸(如油酸)用于制备注射剂。可将注射制剂灭菌,例如,通过细菌截留过滤器过滤,或通过掺入固体组合物形式的灭菌剂,其可在使用前溶解或分散于无菌水或其他无菌注射介质中。为了延长活性剂的体内作用,通常希望减缓剂来自皮下或肌肉注射的剂的吸收。胃肠外施用的活性剂的延迟吸收是通过将剂溶解或悬浮在油性媒介物中实现的。通过在生物可降解聚合物(如聚乳酸
–
聚羟基乙酸)中形成该剂的微胶囊基质,可制成可注射的贮库剂型。根据活性剂与聚合物的比例以及所用特定聚合物的性质,可以控制活性剂的释放速率。其他生物可降解聚合物的实例包括聚原酸酯和聚酸酐。可注射贮库制剂也可通过将剂包裹在与人体组织相容的脂质体或微乳液中来制备。
[0069]
药物或药用组合物的施用可以是治疗性的或预防性的。将预防性制剂应用于可能的伤口部位,或伤口来源,例如隐形眼镜、隐形眼镜清洁和冲洗溶液、用于隐形眼镜储存或运输的容器、用于隐形眼镜处理的装置、滴眼液、手术冲洗溶液、滴耳液、眼用贴片和用于眼部区域的化妆品(包括霜剂、洗剂、睫毛膏、眼线和眼影),以及眼科器械、手术器械、听力器械。
[0070]
在一些实施方案中,受试者患有眼部疾病、障碍或损伤。一些常见的视网膜疾病包括年龄相关性黄斑变性、视网膜色素变性和青光眼,其分别与视网膜色素上皮、光感受器和视网膜神经节细胞的变性有关[hartong,et al.2006 lancet 368:1795-1809;rattner et al.2006 nat rev neurosci 7:860-872]。受试者可能患有其他疾病和状况,包括视网膜裂孔、视网膜脱离、糖尿病性视网膜病、视网膜前膜、黄斑裂孔、黄斑变性、突眼、白内障、cmv视网膜炎、视网膜母细胞瘤、糖尿病黄斑水肿、高眼压症、眼性偏头痛、视网膜脱离、碱或其他化学烧伤、眼前房积血、角膜擦伤、角膜炎、圆锥形角膜、结膜下出血、增殖性玻璃体视网膜病变、尤塞氏综合征和葡萄膜炎。还可治疗患有其他感染、营养不良或移植角膜排斥反应的受试者。
[0071]
本公开不限于本文所述的构建、成分排列或方法步骤的具体细节。本文公开的组合物和方法能够以各种方式进行、实践、使用、实施和/或形成,根据以下公开内容,这些方式对于本领域技术人员来说是明显的。本文中所用的措词和术语仅用于说明目的,而不应视为对权利要求范围的限制。在说明和权利要求书中用来指各种结构或方法步骤的顺序指示(例如第一、第二和第三)并不意味着被解释为指示任何特定结构或步骤,或此类结构或步骤的任何特定顺序或配置。除非本文另有说明或与上下文明显矛盾,本文所述的所有方法都可以以任何合适的顺序进行。本文提供的任何和所有实施例或示例性语言(例如,“诸
如”)的使用仅旨在为本公开提供便利,并且不暗含对本公开的范围的任何限制,除非另有声明。说明书中的任何语言以及附图中所示的结构均不应被解释为指示任何未请求保护的要素对于本公开主题的实践是必不可少的。本文中术语“包括(including)”、“包含/包括(comprising)”或“具有”及其变体的使用意指包括其后列出的要素及其等效要素,以及附加要素。叙述为“包括”、“包含”或“具有”某些要素的实施方案也被设想为“主要由那些特定要素组成”和“由那些特定要素组成”。
[0072]
除非本文另有说明,否则本文对值的范围的叙述仅旨在作为单独述及该范围内的每个单独值的简写方法,并且将每个单独值并入本说明书中,如同其在本文中被单独叙述一样。例如,如果将浓度范围规定为1%至50%,则意图是本说明书中明确列举2%至40%、10%至30%或1%至3%等的值。这些只是具体意图的实例,并且列举的最低值和最高值之间以及包括最低值和最高值的所有可能的数值组合都应视为是在本公开中被明确提及。使用“大约”一词来描述具体被叙述的量,或量的范围意在指示非常接近被叙述的量的值包括在该量中,例如,由于制造公差、仪器和形成测量值时的人为误差等可能或自然将被考虑的值。除非另有说明,所有涉及量的百分比均按重量计。
[0073]
没有做出对任何参考文献(包括本说明书中引用的任何非专利或专利文件)构成现有技术的承认。特别地,应当理解,除非另有说明,否则本文对任何文件的引用不构成承认这些文件中的任一文件在美国或任何其他国家形成本领域公知常识的一部分。对参考文献的任何讨论都叙述其作者的主张,且申请人保留对本文引用的任何文件的准确性和相关性提出质疑的权利。除非另有明确说明,否则本文引用的所有参考文献均通过引用完全并入。如果引用的参考文献中存在的任何定义和/或描述之间存在差异,则应以本公开为准。
[0074]
以下实施例仅是说明性的,而并不意味着对本发明或所附权利要求范围的限制。
实施例
[0075]
实施例1-用于将小分子和大分子递送到视网膜细胞和组织中的新型细胞穿膜肽nuc1
[0076]
细胞穿膜肽(cpp)的设计可考虑所讨论组织的生物学特性。例如,先前描述的称为pod(用于眼部组织运输的肽)的肽是针对大量存在于视网膜中的蛋白质(特别是酸性和碱性成纤维细胞生长因子)的糖胺聚糖结合区域建模的(johnson等人,2010年)。已知糖胺聚糖硫酸软骨素大量存在于成人视网膜中(clark等人,2011年),而硫酸乙酰肝素在发育过程中大量存在于视网膜中。蛋白质-糖胺聚糖相互作用的分子模型导致了pod的产生,发现pod是视网膜中测试到的最有效的cpp之一(johnson等人,2010年)。竞争研究指示,发现pod的细胞穿透特性受细胞表面硫酸乙酰肝素水平的显著影响(johnson等人,2010年),从而将视网膜组织上的硫酸乙酰肝素蛋白聚糖鉴定为cpp靶向视网膜的候选部分。硫酸乙酰肝素对cpp功能的重要性已针对另一种形式的称为vectocell肽的cpp被描述(de coupade等人,2005年)。
[0077]
血管内皮生长因子(vegf)在视网膜稳态中起着关键作用(jin等人,2002年;robinson等人,2001年)。vegf的vegfa165同工型包含一个高度碱性的结构域,其允许该亚型的vegf与富含硫酸乙酰肝素的细胞外基质相互作用并定位于其中(krilleke等人,2009年)。一种来自肾上皮细胞的vegfa剪接变体vegfa165b除最后六个氨基酸外,与vegfa165相
同。vegfa165b和vegfa165以相似的亲和力结合vegf受体1和2。然而,vegfa165b仅与硫酸乙酰肝素弱结合(cebe suarez等人,2006年),表明vegf165的c末端(seq id no:7 cdkprr)牵涉硫酸乙酰肝素结合。
[0078]
层粘连蛋白是细胞外基质中的大型基底膜糖蛋白。层粘连蛋白影响组织发育、细胞分化、迁移和粘附(aumailley,2013年)。层粘连蛋白是异源三聚体蛋白,每个蛋白都含有α链、β链和γ链。该三聚体蛋白相交形成叉形样结构,可以与其他细胞膜和细胞外基质分子结合。迄今为止,已鉴定出五种α变体、四种β变体和三种γ变体。这些链的不同组合产生大量的层粘连蛋白分子。迄今为止,已在哺乳动物中鉴定出大约16种层粘连蛋白分子。至少有7条层粘连蛋白链(α3、α4、α5、β2、β3、γ2和γ3)定位于光感受器周围的基质和第一突触层,在这里光感受器与视网膜中间神经元形成突触(libby等人,2000年)。层粘连蛋白还与其他基底膜成分(包括硫酸乙酰肝素蛋白聚糖)结合,并介导与基底层的细胞相互作用。层粘连蛋白-1的羧基球附近的区域(seq id no:8 csrarkqaasikvavsadr)是细胞粘附的活性位点(tashiro等人,1989年)。有趣的是,该区域还与核仁素结合(kibbey等人,1995年),核仁素是通常存在于快速分裂细胞的细胞核和表面的蛋白质(hovanessian等人,2010年;koutsioumpa和papadimitriou,2014年;mongelard和bouvet,2007年),但也存在于视网膜(包括光感受器)上(hollander等人,1999年)。
[0079]
我们假设,由来自层粘连蛋白-1的核仁素结合区的一部分与vegfa165的硫酸乙酰肝素蛋白聚糖结合区域的组合(通过柔性聚甘氨酸接头连接)构成的新型肽序列可能具有细胞粘附和细胞穿透特性。因此,我们测试了序列asikvavsaggdkprr(seq id no:3)的这些性质。虽然我们在此证明了该肽nuc1(seq id no:3)可能在视网膜中有效发挥作用,但它也可能在与视网膜组织具有共同细胞外基质和细胞表面特性的其他组织例如脑中发挥作用。
[0080]
材料和方法:
[0081]
肽合成:由赛默飞世尔科技(thermo fisher scientific)合成荧光标记的nuc1肽序列fluo(5/6fam)-asikvavsaggdkprr[cooh](seq id no:3),纯度》99%。还合成了没有荧光标记的相同序列。
[0082]
动物:本研究根据美国视觉和眼科研究协会(arvo)制定的《关于在眼科和视力研究中使用动物的声明》进行,并得到塔夫茨大学实验动物护理和使用委员会(iacuc)批准。6至8周龄的c57bl/6j小鼠购自jackson laboratory(bar harbor,me)并在12h明/12h暗循环条件下笼养。
[0083]
玻璃体内和视网膜下注射:通过腹膜内注射含有氯胺酮(100mg/kg,phoenix
tm
,st joseph,mo)和甲苯噻嗪(10mg/kg,lloyed,shenandoah,iowa)的混合物麻醉小鼠,然后局部应用0.5%盐酸普鲁卡因(akorn inc.,lake forest,il,美国)用于角膜局部镇痛。麻醉期间对小鼠保暖。如先前所述,使用32号针和5μl玻璃注射器进行玻璃体内和视网膜下注射(cashman等人,2015年)。对于nuc1摄取实验,注射的肽量在结果中指示。为了研究nuc1对mcherry摄取的影响,如结果所述,与或不与nuc1一起玻璃体内注射1μl mcherry(4μg)。注射后4小时(如所示),摘除眼睛并固定在4%多聚甲醛中。与或不与nuc1一起对每只眼玻璃体内和视网膜下注射总计1μl aav(剂量在结果中描述)。使用micron 550低温恒温器进行视网膜冷冻切片。
[0084]
激光诱导的脉络膜新血管形成(cnv):如前所述进行激光光凝治疗。简言之,使用
2.5%盐酸苯肾上腺素(bausch&lomb)和1%托吡卡胺(bausch&lomb)扩张镇静小鼠的瞳孔。应用2.5%羟丙甲纤维素(hypermellose)(goniovisc)将角膜不适降至最低。使用光斑直径75μm、330mh、100ms脉冲时间的氩激光(532nm,iris medical light solutions,iridem;iridex)在每只眼产生四个激光光斑。
[0085]
凝集素和α-肌动蛋白染色:光凝后7天,用co2对动物实施安乐死,并摘除眼睛。固定眼杯,摘除晶状体和角膜。在溶于0.1m磷酸盐缓冲液的4%多聚甲醛中固定过夜后,取出视网膜,并在pbs中洗涤巩膜/脉络膜/rpe复合体。用溶于pbs的5%bsa封闭眼杯,并用溶于pbs的100μg/l荧光素偶联的异凝集素(vectashield)染色1小时。然后将眼杯在pbs中洗涤3次,每次5分钟,并与1:200稀释的cy3偶联小鼠抗α-sma单克隆抗体(c6198,sigma)于4℃孵育过夜。次日,将眼杯用pbs洗涤3次,每次5分钟,平铺在载玻片上,并使用带有相关滤镜的倒置显微镜(ix51;olympus)、数码相机(retiga 2000r-fast;q-imaging)和qcapture pro软件(q-imaging)进行成像。用荧光显微镜(leica)捕捉cnv区域的图像。使用imagej软件(nih)测量cnv区域。
[0086]
细胞培养:将子代hek293细胞培养物维持在添加10%胎牛血清(fbs;hyclone laboraties,south logan,ut)的dulbecco改良的eagle培养基(dmem,gibco)的15cm平板上。每3-4天对细胞传代,使其维持指数生长期。
[0087]
载体构建:为了生产aav-ikv-gfp和aav-nucl-gfp病毒,用dralll消化paav9/rep-cap质粒,凝胶提取1.4kb cap dna片段并克隆到pbsx中以产生pbsx1.4。该肽的dna序列是商业合成的。通过使用tthlll1和bamhi限制性消化,将这些序列克隆到pbsx1.4(包含1.4kb cap区)中,以产生ppbsx1.48和pbsx1.4n。最后,用sbfl和bsiwi消化ppbsxl.48和pbsx1.4n,凝胶提取1.4kb dna片段并克隆到含有反向末端重复序列(itr)的paav2/9rep-cap中,生成paav2/9ikv和paav2/9nuc1。
[0088]
重组aav的产生和纯化:aav病毒是使用先前所描述的方案的修改版生成的(birke等人,2014年)。使用磷酸钙三重转染上述aav质粒进行转染。简言之,转染前2小时,将生长在15cm板中的80-90%汇合hek293细胞换液至dmem-10%fbs。使用磷酸钙法沉淀足量的质粒,比例为2:1:1(辅助质粒:顺式质粒:反式质粒),并滴加到20个平板上。转染后24小时将培养基更换为dmem-10%fbs。转染后96小时收获细胞和培养基。对收集的细胞沉淀进行裂解,并将14ml澄清的裂解液应用到按以下顺序填充到40ml速封离心管(beckman instruments,palo alto,ca)中的梯度碘克沙醇(optiprep;sigma-aldrich,st louis,mo)溶液中:4ml 15%碘克沙醇、9ml 25%碘克沙醇、9ml 40%碘克沙醇和5ml 54%碘克沙醇。试管在70ti转子(beckman instruments)中以69,000rpm的速度在18℃离心,除去40%碘克沙醇层中的4ml分级溶液。使用最终的乳酸林格氏溶液和加至5%的甘油进一步渗滤和浓缩该级分。然后将级分等分并储存在-80℃以备将来使用。
[0089]
aav滴定:用smal消化aav-cag-gfp质粒并凝胶提取,以生成gfp转基因的标准曲线。用dnasel消化aav以去除基因组dna,并进一步与蛋白酶k一起孵育以消化aav衣壳。dna用苯酚-氯仿法提取和纯化,并溶解于te缓冲液中。制备了从2
×
104基因组拷贝至2
×
108基因组拷贝范围的标准曲线。进行定量pcr,根据标准曲线对病毒进行定量。
[0090]
免疫组化:为进行视网膜细胞免疫组化,将视网膜冷冻切片在pbs中再水化15分钟,用溶于pbs的6%正常山羊血清或使用mouse on mouse试剂盒封闭1小时,并在湿盒中用
适量的抗pkc一抗(双极细胞)孵育过夜。随后,清洗切片并用alex-fluor 544或488(分子探针,eugene,or)标记的二抗孵育,以定位视网膜切片中的相应抗体。在含有dapi(vectashield-dapi;vector laboratories,burlingame,ca)的防褪色(anti-fade)介质中封片,以复染细胞核,并使用徕卡共焦显微镜捕捉图像。
[0091]
结果
[0092]
nuc1在玻璃体内注射后穿透视网膜组织和细胞
[0093]
为了检查nuc1肽在玻璃体内注射后是否能穿透视网膜并进入视网膜细胞,我们用荧光染料fam荧光标记nuc1,并将混悬在1μl h2o中的总共1μg nuc1注射到成年(6周龄)c57bl/6j小鼠的玻璃体中。注射后4小时,摘除这些小鼠的眼睛并固定在4%多聚甲醛中。使用micron 550低温恒温器生成视网膜冷冻切片,并使用荧光显微镜对切片成像。我们发现,尽管6-fam不能穿透视网膜(数据未显示),但fam标记的nuc1定位于视网膜的所有层,包括神经节细胞层(gcl)、内核层(inl)、外核层(onl)、内节(is)和外节(os)(图1a)。这些冷冻切片经与靶向微管蛋白(图1b)、蛋白激酶c(图1c)、视杆视蛋白(图1d)或谷氨酰胺合成酶(图1e)的抗体的共染色显示nuc1分别靶向神经节细胞、双极细胞、光感受器和米勒细胞。有趣的是,nuc1对视网膜的穿透显著优于我们先前描述的任何视网膜穿透肽,包括pod(binder等人,2011年;johnson等人,2010年)。据我们所知,相对于先前描述的用于视网膜的任何细胞穿膜肽,nuc1具有优越的视网膜穿透特性。
[0094]
nuc 1帮助重组蛋白渗透到视网膜中
[0095]
注射到玻璃体中的大的功能性蛋白质通常无法穿透深入到视网膜中并且无法穿过视网膜细胞的质膜。使用与异源蛋白物理连接的细胞穿膜肽(cpp),如pod,可以克服这一固有的局限性(johnson等人,2010年)。然而,pod和其他cpp通常需要与异源蛋白化学偶联才能通过质膜递送,并且对蛋白的此类修饰可能会对蛋白功能产生不利影响。我们假设异源蛋白可以在不与nuc1偶联的情况下被递送到视网膜细胞中。为了检验这一假设,我们将4μg重组红色荧光蛋白(rfp/mcherry)和1μg fam标记的nuc1共同注射到成年(6周龄)c57bl/6j小鼠的玻璃体中。4小时后,如上所述处理组织。当单独注射时,没有mcherry显著渗透到视网膜组织或细胞中(图2f),而与fam标记的nuc1共同注射的mcherry显示mcherry被明显摄取到多种视网膜细胞中(图2a),在onl最丰富。值得注意的是,在视网膜onl内的许多细胞中检测到fam信号(绿色)与mcherry信号(红色)的共定位(黄色)(图2a)。
[0096]
当用未标记的nuc1替换fam标记的nuc1并与mcherry共同注射时,再次观察到mcherry的稳健摄取,证明rfp信号不是从fam通道渗出的结果(图2b-2e)。用针对微管蛋白(图2b)、pkc(图2c)、谷氨酰胺合成酶(图2d)或视锥视蛋白(图2e)的抗体对视网膜切片进行共同染色,显示mcherry分别定位于神经节细胞、双极细胞、米勒细胞和视锥细胞。由于小鼠眼睛尺寸小,因此在动物之间观察到一些可变性,但是,所有视网膜均显示onl中信号最强。
[0097]
nuc1促进xiap蛋白递送到视网膜中并减弱凋亡
[0098]
接下来,我们考察了nuc1的特性是否适用于具有潜在治疗意义的异源蛋白。程序性细胞死亡或凋亡是例如色素性视网膜病变等疾病中由于视网膜变性而激活的共同途径(cottet和schorderet,2009年)。先前使用转基因动物或病毒基因递送的研究已经发现,在多种视网膜变性动物模型中,凋亡抑制剂(如x-连锁凋亡抑制蛋白(xiap))的表达升高减轻视网膜变性(leonard等人,2007年)。作为转基因递送的替代方案,可以设想递送xiap蛋白
用于治疗视网膜变性疾病。这种治疗方法类似于目前湿性年龄相关性黄斑变性(amd,见下文)的护理标准,其中玻璃体内注射重组蛋白(如阿柏西普)以靶向vegf。相对于基因递送,对于给药方案,蛋白质递送可能更容易滴定。小鼠腹膜内注射n-甲基-n-亚硝脲(mnu)可选择性诱导视网膜外核层(onl)的凋亡,且因此该模型可用于测试凋亡抑制剂的疗效(petrin等人,2003年)。
[0099]
为了检验纯化的功能性重组人xiap可通过玻璃体内注射递送至视网膜细胞并抑制mnu诱导的视网膜细胞凋亡的假设,向c57bl/6j小鼠(雄性,6-8周龄)玻璃体内注射1.4μg重组人xiap(n=6只眼)或xiap与0.4μg nuc1(n=6只眼)共同注射。4小时后,对小鼠腹膜内注射50mg/lkg mnu。一些小鼠腹膜内仅注射pbs,作为对视网膜中背景细胞凋亡的量度。再过24小时后,将小鼠的眼睛摘除并按上述方法处理。为了检测凋亡细胞,根据制造商的说明,使用原位细胞死亡检测试剂盒,tmr red(sigma),对冷冻切片采用末端脱氧核苷酸转移酶介导的dutp-生物素缺口末端标记(tunel)法。如先前所述,使用imagej(fiji版本和插件)对眼切片进行成像并用于tunel阳性细胞的定量(maidana等人,2015)。
[0100]
正如预期的,相对于注射pbs的动物,腹膜内注射mnu在onl诱导了广泛的凋亡,这从这组动物中大量的tunel阳性细胞可以明显看出(图3)。在mnu注射之前仅注射xiap蛋白(玻璃体内)的眼睛显示tunel阳性细胞的数量相对于仅注射mnu没有显著减少(2.2%,p=0.9902)(图3a)。换句话说,xiap本身并没有显著减弱onl的细胞凋亡。相比之下,在注射mnu之前共同注射重组xiap蛋白和nuc1(玻璃体内)的动物显示tunel阳性细胞数量显著减少(65.7%,p<0.0001)。这表明nuc1使功能性xiap蛋白穿透视网膜并抑制onl中的细胞凋亡。值得注意的是,虽然我们在之前的研究中表明重组xiap蛋白可以递送到视网膜并抑制mnu诱导的细胞凋亡,但在本研究中,xiap不需要与递送试剂化学偶联。因此,本研究揭示了在向视网膜细胞递送功能性蛋白的发展方面取得了重大进展(talreja等人,2018)。
[0101]
既已证明了功能性xiap在与nuc1共同注射时可被递送至视网膜,我们希望检验我们的发现是否可应用于其他视网膜凋亡模型。孔源性、牵引性和渗出性视网膜脱离与失明风险相关。视网膜脱离导致视网膜外层、内层中的视网膜细胞凋亡(arroyo等人,2005)。我们希望在小鼠视网膜脱离模型中检验nuc1和重组xiap联合应用可抑制视网膜细胞凋亡的假设。为了检验这一假设,我们使用连接到5μl玻璃注射器(hamilton)的32g针头,将3μl(10mg/ml)的透明质酸钠(healon,advanced medical optics,瑞典)注射到视网膜下间隙,造成小鼠视网膜脱离。视网膜脱离后一天,向动物玻璃体内共同注射1.4μg xiap和0.4μg nuc1。72小时后,将眼睛固定在4%多聚甲醛中,使用micron 550低温恒温器进行冷冻切片,并如上所述进行tunel染色。我们发现,当nuc1和xiap的组合被注射到视网膜时,tunel阳性细胞的数量相对于仅healon的对照大约减少了60%(p=0.0061)(图3b)。
[0102]
nuc1促进抗体向视网膜递送
[0103]
尽管我们的上述结果表明重组蛋白可能易于用于潜在的视网膜疾病的治疗,但目前治疗湿性年龄相关性黄斑变性(amd)的临床护理标准包括每月玻璃体内注射抗vegf抗体(如兰尼单抗或阿瓦斯丁)(comparison of age-related macular degeneration treatments trials research et al.,2012)。为了确定nuc1是否可以改善抗体向视网膜细胞或组织的递送,我们检查了抗vegf抗体在湿性amd小鼠模型中的疗效。激光诱导的脉络膜新血管形成(cnv)通过在视神经头周围应用四个激光光斑(功率为330mw,持续时间为
100ms)产生。随后向小鼠玻璃体内单独注射0.3ng抗vegf抗体或联合注射0.3ng抗vegf抗体与1μg nuc1。这些研究中使用的抗vegf抗体的量是通过初步研究确定的(即,滴定3μg至0.3μg的抗vegf,数据未显示)。对剂量进行计算使得单独的抗vegf抗体不能显著抑制激光诱导的cnv。在激光治疗后7天,收获眼球并制备用fitc偶联的加纳籽凝集素i染色的rpe/脉络膜铺片。激光光斑通过荧光显微镜成像,且激光光斑的面积采用lmagej软件定量。我们发现,相对于单独的抗vegf抗体,当抗vegf抗体与nuc1共同注射时,cnv光斑的尺寸显著减少(>60%;p<0.0001)(图4a)。因此,玻璃体内施用nuc1显著增强抗vegf抗体对激光诱导的cnv的穿透和疗效。nuc1的这种特性可能有助于增强或降低抗体的疗效,改变给定剂量抗体的效力,使得需要更多或更少来达到治疗效果。
[0104]
虽然玻璃体内注射抗体是目前湿性amd的临床护理标准,但这对患者来说是一种侵入性和“不舒服”的程序,并与视网膜脱离和眼内炎有关。此外,它需要患者(通常是老年人)经常去看眼科医生,导致患者依从性降低。因此,局部施用药物将是药物递送的优选方法。我们检查了nuc1是否能增强局部应用的抗vegf抗体的效力。考虑到局部应用于眼部时抗体的穿透极为受限,我们使用了相对于玻璃体内注射较高剂量的抗体。具体而言,单独施用1.8μg抗vegf抗体或1.8μg抗vegf抗体与4μg nuc1联合施用。在激光诱导cnv后,将含有抗体和nuc1的局部滴剂应用于角膜,每天两次,持续十天。nuc1局部递送显著增强了局部应用抗vegf抗体的疗效,导致激光诱导的cnv(图4b)的尺寸相对于单独的抗体减小约60%(p<0.02)。因此,在激光诱导的湿性amd模型中,nuc1显著增强了局部应用的抗体的效力。
[0105]
nuc1促进核心蛋白聚糖蛋白向视网膜中的递送并抑制纤维化
[0106]
为了进一步评估nuc1作为向眼部组织递送蛋白质的平台的潜力,我们检查了其他眼部疾病模型。角膜碱烧伤导致纤维化、血管生成和炎症,如果不进行治疗,则导致视力明显下降。核心蛋白聚糖是已知具有抗血管生成和抗纤维化特性的蛋白聚糖(gubbiotti等人,2016;jarvelainen等人,2015)。
[0107]
为了检测nuc1协助核心蛋白聚糖穿透角膜治疗纤维化的能力,将小鼠麻醉,并通过在右眼角膜中央应用1n氢氧化钠(naoh)浸泡的2mm滤纸片30秒,在角膜中诱导碱烧伤。轻轻移除滤纸,用磷酸盐缓冲盐水(pbs)冲洗角膜10次。在暴露于naoh 24小时后开始局部应用pbs、核心蛋白聚糖(0.5μg)或核心蛋白聚糖(0.5μg)+nuc1(0.5μg)。治疗为局部应用,每天一次,持续七天。7天后,通过吸入co2处死小鼠。将眼睛摘除并固定在4%多聚甲醛中。使用micron 550低温恒温器进行角膜冷冻切片,并进行纤维化标志物α-肌动蛋白染色。我们发现,单独局部应用核心蛋白聚糖使α-肌动蛋白染色相对于pbs减少33.3%(p<0.025),而应用核心蛋白聚糖+nuc1使α-肌动蛋白染色相对于pbs减少46.2%(p<0.0028),从而证明nuc1增强了核心蛋白聚糖的抗纤维化效力(图5a)。鉴于这些有前景的结果,,为了治疗角膜化学烧伤后的血管生成、纤维化和炎症,随后对nuc1将核心蛋白聚糖递送至角膜的用途进行了更详细的研究(见实施例2)。
[0108]
此外,我们检查了nuc1是否能增强核心蛋白聚糖对激光诱导的脉络膜新血管形成(cnv)小鼠(上一节描述的小鼠湿性amd模型)的效力。激光治疗后,小鼠立即接受单独的0.5μg人重组核心蛋白聚糖或其与nuc1肽(0.5μg)的联合玻璃体内注射,7天后收获眼睛。cnv生长的尺寸通过用加纳籽异凝集素对视网膜色素上皮(rpe)染色来测量,纤维化通过对α-肌动蛋白(α-sma,图5b)染色来测量。使用非配对t检验,我们发现,在核心蛋白聚糖和核心蛋
白聚糖+nuc1治疗组中,cnv面积(异凝集素,p<0.0072)和纤维化(α-sma,p<0.0001)的统计学上显著的减少(图5c)。值得注意的是,与单用核心蛋白聚糖相比,nuc1存在时cnv和纤维化减少了大约70%,这强烈表明nuc1增强了核心蛋白聚糖的穿透性和效力,从而改善激光诱导的cnv和纤维化的影响。
[0109]
nuc1促进肽和小分子向视网膜中的递送
[0110]
比全蛋白明显更小的分子具有作为治疗剂的潜力。例如,已知来自bcl-xl的bh4结构域肽在体内具有抗凋亡活性(rong等人,2009)。然而,bh4似乎没有任何显著的细胞穿透特性。因此,几个小组已经通过与细胞穿膜肽tat化学连接将bh4递送至细胞(donnini等人,2009;hotchkiss等人,2006;park,2011)。为了考察nuc1是否可以在不需要化学连接的情况下增强视网膜对bh4的摄取,我们将单独的4μg荧光标记的bh4肽或4μg标记的bh4肽与4μg nuc1的组合经玻璃体内注射至6周龄的c57bu6j小鼠。虽然视网膜对单独bh4肽的摄取有限,但当bh4与nuc1结合时,荧光标记的bh4肽的摄取有显著的定性增加(图6a)。
[0111]
包括类固醇在内的小分子可用作抗炎剂。然而,类固醇(如地塞米松)在注入玻璃体后产生显著的副作用,包括形成白内障或诱导眼压升高(phulke等人,2017年;pleyer等人,2013年;zhang等人,2018年)。我们假设nuc1可能有助于类固醇向组织中的渗透,从而可应用减小剂量的类固醇而不丧失疗效。为了检验这一假设,我们单独注射1μg荧光标记的地塞米松或1μg荧光标记的地塞米松与1μg nuc1联合注射。我们发现,单独的地塞米松和地塞米松与nuc1都被吸收到视网膜中。然而,当地塞米松与nuc1共同注射时,其摄取定性地更大(图6b)。
[0112]
nuc 1增强体内视网膜细胞的病毒感染
[0113]
重组病毒,如腺相关病毒(aav),是将重组基因递送至视网膜的极佳媒介物(bennett,2017年)。然而,通常需要高滴度的病毒才能实现“治疗性”水平的细胞转导。尽管视网膜下和玻璃体腔具有免疫隔离性质,但这些区域重组aav的免疫反应已得到充分证明(boyd等人,2016年;kotterman等人,2015年;reichel等人,2017年)。低剂量的病毒通常产生较少的免疫反应。为了确定nuc1是否能增强aav感染的效力,从而减少对高剂量或更高剂量病毒的需要,我们将表达gfp的重组aav血清型2(aav 9假型衣壳;aav2/9)(aav-cag-gfp)注射到成年c57/b16j小鼠的眼睛中。正如预期的那样,aav-cag-gfp的视网膜下递送使转基因(gfp)能够在视网膜色素上皮(rpe)和光感受器中表达(图7)。令人惊讶的是,当aav2/9与1μg nuc1共同注射时,转基因表达定性地优于aav2/9单独注射(图7a)。
[0114]
相比之下,当玻璃体内注射时,aav2/9不会感染视网膜内层或外层(图7b)。然而,我们发现向aav-cag-gfp悬浮液中加入1μg nuc1增强了视网膜内层和外层(包括onl)的感染性(图7b)。这种感染的改善在整个视网膜上是不同的,如通过活体动物的眼底摄影(图7c)观察到在贴剂中发生的。病毒感染的定量通过rt-pcr进行(见下文)。
[0115]
将nuc 1掺入aav衣壳不会显著增强感染
[0116]
为了确定如果将nuc1序列掺入aav衣壳包衣中,aav2/9是否会更有效,而不需要外部肽,我们构建了表达gfp的重组aav2/9,其在aav9的vp1衣壳中含有nucl序列(两端各有一个甘氨酸)。nuc1序列被插入氨基酸588和589之间,如(khabou等人,2016年)所定义,生成aav-nuc1-cag-gfp。这种修饰并未导致通过视网膜下途径的病毒感染性相对于aav-cag-gfp显著增强(图8a)。此外,aav-nuc1-cag-gfp在玻璃体内注射后不会感染视网膜内层或外
层(图8b)。然而,当通过玻璃体内途径共同注射aav-nuc1-cag-gfp与nuc1肽时,aav-nuc1-cag-gfp的感染可被增强(图8c),但这一结果是高度可变的,因为所检查的一些视网膜在视网膜外层中的gfp表达非常有限(图8c,gfp插图)。对此结果的一种可能解释是nuc1肽和病毒衣壳中nuc1序列之间的竞争。事实上,更大量的nuc1导致总体aav-nuc1-cag-gfp感染性降低(数据未显示)。
[0117]
视网膜穿透性aav
[0118]
为了确定nuc1中vegfa165的硫酸乙酰肝素结合区是否干扰病毒感染性,我们构建了缺失硫酸乙酰肝素结合序列的aav-nuc1-cag-gfp版本,因此病毒现在包含来自层粘连蛋白-1的部分序列asikvavsa(seq id no:4)。这段较短的序列两端各有一个甘氨酸残基,形成序列gasikvavsag(seq id no:6),并且如上所述将其类似地克隆在aav衣壳的588和589氨基酸之间,以形成称为aav-ikv-gfp的病毒。我们发现,将aav-ikv-gfp视网膜下注射到6周龄的c57bl/6j小鼠体内可显著改善视网膜细胞的感染(图9a-9d)。用视杆视蛋白(图9a)、视锥视蛋白(图9b)、谷氨酰胺合成酶(图9c)、pkc(图9d)对aav-ikv-gfp感染的视网膜切片的复染揭示,aav-ikv-gfp分别感染视杆细胞、视锥细胞、米勒细胞和双极细胞。
[0119]
令人惊讶的是,当将aav-ikv-gfp玻璃体内注射到6周龄c57bl/6j小鼠并用视锥视蛋白(图10a)、视杆视蛋白(图10b)、pkc(图10c)或微管蛋白(图10d)复染切片时揭示,aav-ikv-gfp分别感染视锥细胞光感受器、视杆细胞光感受器、双极细胞和神经节细胞。在一些视网膜中,基于与谷氨酰胺合成酶的共染色,还观察到米勒细胞在某些区域呈阳性(图10e)。
[0120]
接下来,我们考虑了玻璃体内注射aav-ikv-gfp是否可以通过与nuc1联合施用得到进一步增强。我们的上述研究表明,当与nuc1肽共同施用时,掺入病毒衣壳的完整nuc1序列受到抑制,这可能是由于竞争细胞进入。随着衣壳中掺入的nuc1序列减少,我们发现玻璃体内注射的aav-ikv-gfp具有迄今为止观察到的最强效的视网膜感染,在整个视网膜中稳健表达(图11a)。对图11a中方框区域的更仔细检查揭示,高密度的光感受器、rpe和令人惊讶地脉络膜呈gfp阳性(图11b)。这种gfp表达模式并不局限于特定区域,因为活体动物的眼底摄影显示gfp穿过视网膜的极大区域(图11c)。此外,图11b中方框区域的更长时间曝光揭示内丛状层(ipl)和神经节细胞层(gcl)也呈gfp阳性,尽管明显低于onl或rpe(图11d)。对双极细胞的pkc复染揭示,除onl和rpe外,大量双极细胞呈gfp阳性(图11e)。
[0121]
为了测量玻璃体内注射的各种病毒构建体的mrna表达水平,我们对视网膜组织进行了定量rt-pcr。我们发现nuc1显著增强了自每种受试病毒的mrna表达水平。相对于单独的aav-cag-gfp的表达水平,共同注射nuc1将mrna水平增强约4.3倍。nuc1还将aav-ikv-gfp的表达增强约8.5倍(图11f)。相对于aav-gfp,aav-ikv-gfp+nuc1具有大约300倍高的mrna水平。因此,nuc1增强了重组aav的感染,且当与在aav衣壳中掺入部分nuc1序列结合时,我们观察到通过玻璃体内途径感染的相对增加最大。
[0122]
通过玻璃体内aav递送对视网膜外层氧化应激的抑制作用
[0123]
nrf2(红系核因子2p45相关因子2)是一种主转录因子,其调节防止由损伤和炎症引发的氧化损伤的抗氧化蛋白的表达。nrf2靶向250多个基因。在稳态状态,kelch样ech关联蛋白-1(keap1)和cullin 3将nrf2隔离在细胞质中,通过泛素化降解nrf2。氧化应激破坏泛素化,nrf2随后转位到细胞核,并与许多抗氧化基因上游启动子区的抗氧化应答元件
(are)结合,从而启动其转录。先前已发现nrf2的表达在视网膜变性,包括amd、色素性视网膜病变、青光眼、葡萄膜炎和糖尿病性视网膜病的多种动物模型中具有治疗作用;并且在许多老年疾病,包括阿尔茨海默病、肌萎缩侧索硬化和friedrich氏共济失调中具有治疗作用。
[0124]
腹膜内注射mnu在视网膜中导致明显的氧化应激。在细胞核dna和线粒体dna中,8-羟基-2-脱氧鸟苷(8-ohdg)是自由基诱导的氧化损伤的主导表现形式之一,因此该标志物已广泛用作氧化应激的生物标志物。我们希望确定aav-ikv主链与nuc1结合是否能通过玻璃体内途径将人nrf2转基因递送至小鼠视网膜外层,并抑制mnu诱导的氧化应激。为了检验该假设,向成年c57bl/6j小鼠玻璃体内注射aav-ikv-nrf2(+nuc1)或作为阴性对照的aav-ikv-gfp(+nuc1)。转基因表达3周后,向小鼠注射50mg/kg mnu。24小时后收获眼睛,按上述方法处理,并对8-ohdg、gfp或nrf2的存在染色。我们发现,相对于注射aav-ikv-gfp的眼睛,注射aav-ikv-nrf2的c57/bl6j小鼠的眼睛的8-ohdg染色显著减少(图12a)。类似地,相对于注射aav-ikv-gfp的眼睛,注射aav-ikv-nrf2的nrf2敲除(nrf2-/-)小鼠表现出显著减少的8-ohdg染色(图12b)。对这些视网膜的定量证实,onl中的8-ohdg染色显著减少(图12c)。
[0125]
通过玻璃体内aav递送抑制视网膜外层中脉络膜新血管形成和纤维化
[0126]
综上,我们发现核心蛋白聚糖由于其已知的同时抑制细胞外基质中vegf和tgf-β的特性能够抑制激光诱导的cnv。我们希望检验该假设,即相对于对照gfp或用于治疗amd的重组抗vegf分子eyelea(阿柏西普),视网膜外层中核心蛋白聚糖的表达将是高度有效的。在成年c57bl/6j小鼠中,将表达gfp、eyelea或核心蛋白聚糖的重组ikv-aav载体与nuc1玻璃体内共同注射。三周后,类似于上述对于核心蛋白聚糖和抗vegf抗体的研究,将小鼠暴露于激光诱导的cnv并在一周后进行检查。异凝集素和α-平滑肌肌动蛋白(sma)定量cnv显示,aav-ikv-核心蛋白聚糖在抑制cnv和纤维化方面显著优于aav-ikv-eyela(图13)。
[0127]
讨论
[0128]
在本研究中,我们描述了一种称为nuc1的新型肽。该肽是基于层粘连蛋白-1的核苷结合特性和vegf165a的硫酸乙酰肝素结合特性而设计的。据我们所知,nuc1是迄今为止描述的穿透视网膜最有效的肽。重要的是,与视网膜中之前使用的大多数细胞穿膜肽(johnson等人,2008年)或适体(leaderer等人,2015年、2016年;talreja等人,2018年)不同,nuc1不需要肽与货物的化学偶联。在不需要物理连接的情况下,将蛋白质递送到视网膜细胞和组织中的能力大大扩展了cpp对于治疗目的的效用。尽管蛋白质和肽之间的物理或化学连接已被充分描述,但这种连接可能对蛋白质功能产生不利影响。(zhang等人,2018年)。理论上,本发明的递送系统能够采用任何已知具有功能活性的蛋白质,并使其穿过质膜递送到细胞中,而不需要复杂的化学手段。
[0129]
我们证明,在被nuc1促进视网膜递送后,异源蛋白保留了功能。例如,重组xiap抑制mnu诱导的视网膜凋亡和视网膜脱离诱导的视网膜凋亡。此外,当将nuc1应用于化学烧伤后的角膜时,其增强了抗纤维化蛋白(如核心蛋白聚糖)的效力。鉴于nuc1是专门针对视网膜设计的,这一观察结果是出乎意料的。因此,nuc1可能会在视网膜和角膜以外的组织中发挥作用,但这仍有待确定。
[0130]
通过玻璃体内注射来递送抗体是目前的临床护理标准(comparison of age-related macular degeneration treatments trials research et al.,2012)。我们证
function study.biochem soc trans 37,1201-1206.
[0164]
leaderer,d.,cashman,s.m.,kumar-singh,r.,2015.topical application of a g-quartet aptamer targeting nucleolin attenuates choroidal neovascularization in a model of age-related macular degeneration.exp eye res140,171-178.
[0165]
leaderer,d.,cashman,s.m.,kumar-singh,r.,2016.g-quartet oligonucleotide mediated delivery of proteins into photoreceptors and retinal pigment epithelium via intravitreal injection.exp eye res 145,380-392.
[0166]
leonard,k.c.,petrin,d.,coupland,s.g.,baker,a.n.,leonard,b.c.,lacasse,e.c.,hauswirth,w.w.,korneluk,r.g.,tsilfidis,c.,2007.xiap protection of photoreceptors in animal models of retinitis pigmentosa.plos one 2,e314.
[0167]
libby,r.t.,champliaud,m.f.,claudepierre,t.,xu,y.,gibbons,e.p.,koch,m.,burgeson,r.e.,hunter,d.d.,brunken,w.j.,2000.laminin expression in adult and developing retinae:evidence of two novel cns laminins.j neurosci 20,6517-6528.
[0168]
maidana,d.e.,tsoka,p.,tian,b.,dib,b.,matsumoto,h.,kataoka,k.,lin,h.,miller,j.w.,vavvas,d.g.,2015.a novellmagej macro for automated cell death quantitation in the retina.invest ophthalmol vis sci 56,6701-6708.
[0169]
michalska-malecka,k.,kabiesz,a.,kimsa,mw.,strzalka-mrozik,b.,forminska-kapuscik,m.,nita,m,mazurek,u.,2016.effects of intravitreal ranibizumab on the untreated eye and systemic gene expression profile in age-related macular degeneration.clin interv aging 11,357-365.
[0170]
mongelard,f.,bouvet,p.,2007.nucleolin:a multifaceted protein.trends cell biol 17,80-86.park,k.,2011.cardioprotective properties of tat-bh4 and pip2b-bh4 in vivo.j control release 156,117.
[0171]
petrin,d.,baker,a.,coupland,s.g.,liston,p.,narang,m.,damji,k.,leonard,b.,chiodo,v.a.,timmers,a.,hauswirth,w.,korneluk,r.g.,tsilfidis,c.,2003.structural and functional protection of photoreceptors from mnu-induced retinal degeneration by the x-linked inhibitor of apoptosis.invest ophthalmol vis sci 44,2757-2763.
[0172]
phulke,s.,kaushik,s.,kaur,s.,pandav,s.s.,2017.steroid-induced glaucoma:an avoidable irreversible blindness.j curr glaucoma pract 11,67-72.
[0173]
pleyer,u.,ursell,p.g.,rama,p.,2013.lntraocular pressure effects of common topical steroids for post-cataract inflammation:are they all the same?ophthalmol ther 2,55-72.
[0174]
reichel,f.f.,dauletbekov,d.l.,klein,r.,peters,t.,ochakovski,g.a.,seitz,i.p.,wilhelm,b.,ueffing,m.,biel,m.,wissinger,b.,michalakis,s.,bartz-schmidt,k.u.,fischer,m.d.,consortium,r.-c.,2017.aav8 can induce innate and adaptive immune response in the primate eye.mol ther 25,2648-2660.
[0175]
robinson,g.s.,ju,m.,shih,s.c.,xu,x.,mcmahon,g.,caldwell,rb.,smith,
l.e.,2001.nonvascular role for vegf:vegfr-1,2 activity is critical for neural retinal development.faseb j 15,1215-1217.
[0176]
rong,y.p.,bultynck,g.,aromollaran,a.s.,zhong,f.,parys,j.b.,de smedt,h.,mignery,g.a.,!roderick,h.l.,bootman,m.d.,distelhorst,c.w.,2009.the bh4 domain of bcl-2 inhibits er calcium release and apoptosis by binding the regulatory and coupling domain of the ip3 receptor.proc natl acad sci us a 106,14397-14402.
[0177]
talreja,d.,cashman,s.m.,dasari,b.,kumar,b.,kumar-singh,r.,2018.g-quartet oligonucleotide mediated delivery of functional x-linked inhibitor of apoptosis protein into retinal cells following intravitreal injection.exp eye res 175,20-31.
[0178]
tashiro,k.,sephel,g.c.,weeks,b.,sasaki,m.,martin,g.r.,kleinman,h.k.,yamada,y.,1989.a synthetic peptide containing the ikvav sequence from the a chain of laminin mediates cell attachment,migration,and neurite outgrowth.j biol chem 264,16174-16182.zhang,g.,liu,s.,yang,l.,li,y.,2018.the role of dexamethasone in clinical pharmaceutical treatment for patients with cataract surgery.exp ther med 15,2177-2181.
[0179]
实施例2-使用细胞穿膜肽nuc1局部递送核心蛋白聚糖增强小鼠的碱烧伤诱导的角膜损伤的恢复
[0180]
角膜损伤约占所有完全视力丧失病例的4%。大约80%的眼部损伤本质上是化学性的,其中碱性剂和酸性剂导致大约11-22%的眼部损伤和所有职业性损伤的4%[1-3]。角膜上皮作为外界环境与眼睛内部之间的屏障起作用[4]。当角膜表面受损时激活多种反应,包括纤维化、血管生成和炎症,以治愈损伤并防止眼睛免受进一步损伤。然而,如果过度,这些反应本身可能会导致进一步的损害[5]。眼前段急性炎症和新血管形成可导致上皮组织异常愈合和角膜瘢痕形成。由于亲脂性,碱性剂迅速穿透眼部组织,引起坏死和缺血[6]。碱烧伤所致角膜损伤患者患青光眼和不可逆性视力丧失的风险增加。
[0181]
碱烧伤导致角膜巨噬细胞和白细胞浸润,以及促炎细胞因子如il-1β、tnf-α、il-6和血管内皮细胞生长因子a(vegf-a)的上调。角膜中促血管生成分子和抗血管生成分子的失衡触发新血管形成[7,8]。通过细胞增殖和基质角膜细胞凋亡实现的上皮再生发生在烧伤/损伤部位附近[9]。除角膜损伤外,据报道,碱烧伤可导致视网膜神经节细胞凋亡以及视神经损伤。
[0182]
眼睑是眼部防御的第一道防线,保护眼睛免受过敏原、异物和病原体的侵害。眨眼动作会清洗眼表并更新泪膜,泪膜由免疫球蛋白a和g以及抗微生物蛋白如溶菌酶,β-赖氨酸和金属螯合剂组成[10,11]。然而,与将分子局部递送至眼表相关的挑战之一是泪膜将药物从表面快速清除,导致95%以上的药物损失。由于房水的再循环,能够穿透内室的药物的半衰期通常很短。据我们所知,尚无将蛋白质局部递送至角膜用于治疗碱烧伤的报道。
[0183]
核心蛋白聚糖是小的、富含亮氨酸的蛋白聚糖,通过调节角膜中的多种生长因子(如tgf-β)而在调节细胞增殖、存活和分化中发挥重要作用[12-16]。核心蛋白聚糖还通过抑制瘢痕形成和血管生长,在维持角膜透明度方面发挥关键作用。已显示核心蛋白聚糖中
6.0分析数据。
[0193]
tunel测定:为了检测细胞死亡,使用原位细胞死亡检测试剂盒,tmrred(sigma)按照制造商的说明对角膜冷冻切片进行末端脱氧核苷酸转移酶介导的dutp-生物素缺口末端标记(tunel)法。如上所述对切片进行成像,并且如前所述,使用imagej(fiji版本和插件)将图像用于定量tunel阳性细胞[18]。
[0194]
统计分析:实验值以平均值
±
sem表示。采用单因素anova检验分析多于两个组之间的统计学差异,采用非配对t检验分析两组间差异。将p值小于或等于0.05视为统计学显著的。
[0195]
结果
[0196]
nuc1增强核心蛋白聚糖减少角膜混浊和细胞浸润的能力
[0197]
为了测试局部单独应用核心蛋白聚糖和核心蛋白聚糖与nuc1联合(核心蛋白聚糖+nuc1)应用对角膜混浊的影响,如方法中所述将小鼠暴露于碱烧伤。碱烧伤后24小时,应用单独核心蛋白聚糖、核心蛋白聚糖+nuc1或pbs,每日一次,持续7天。第7天,处死小鼠进行角膜成像(图14a)。观察到未暴露于碱烧伤或药物治疗的对照小鼠的角膜光滑透明(图14a)。相比之下,观察到用pbs治疗7天的碱烧伤暴露小鼠的角膜在整个角膜表面具有弥漫性“混浊”。此外,角膜具有不规则的表面,存在明显的血管(图14a)。暴露于碱烧伤、随后局部单独应用核心蛋白聚糖的小鼠显示出与用pbs治疗的小鼠相似的角膜外观,具有明显的混浊、不规则表面和血管(图14a)。然而,相对于暴露于碱烧伤的用pbs治疗的小鼠,暴露于碱烧伤并随后应用核心蛋白聚糖+nuc1的小鼠表现出更光滑的角膜表面和明显减少的角膜混浊,并且没有明显的血管(图14a)。根据anderson等人[19]描述的方法对小鼠进行临床混浊评分。根据评分系统,碱烧伤后接受pbs治疗的小鼠评分为4分(完全不透明,看不到瞳孔),接受核心蛋白聚糖的小鼠评分为2.8分(不透明,几乎无法检测到瞳孔),接受核心蛋白聚糖+nuc1的小鼠评分为1.5分(轻微模糊,仍可检测到虹膜和瞳孔)。
[0198]
对上述每种方法治疗的碱烧伤暴露小鼠的角膜横向切片用苏木精和伊红染色(h+e;图14b)。相对于未治疗的对照小鼠的角膜,用pbs治疗的碱烧伤暴露小鼠的角膜显示较薄的角膜和上皮细胞层的细胞损失(图14b)。此外,角膜内和角膜下有明显的细胞浸润。相对于用pbs治疗的角膜,在用核心蛋白聚糖治疗的碱烧伤暴露小鼠的角膜中观察到上皮厚度增加(图14b)。但是,用核心蛋白聚糖治疗的角膜空泡化明显。相比而言,在用核心蛋白聚糖+nuc1治疗的碱烧伤暴露小鼠的角膜中,上皮的上细胞层修复明显,角膜表面的完整性增加(图14b)。
[0199]
核心蛋白聚糖+nuc1显著减少碱烧伤角膜中的新血管形成和纤维化
[0200]
碱烧伤后,角膜易于发生新血管形成和纤维化。转化生长因子β(tgf-β)的上调促进角膜上皮细胞和角膜细胞向碱烧伤部位迁移,在此处角膜细胞分化为肌成纤维细胞[20]。肌成纤维细胞的不受控制和持续激活导致病理性纤维化。我们记录了碱烧伤后角膜中血管内皮细胞的存在和肌成纤维细胞标志物α平滑肌肌动蛋白(sma)的表达[21]。为了确定单独核心蛋白聚糖或核心蛋白聚糖+nuc1对碱烧伤诱导的角膜新血管形成和纤维化的影响,使小鼠暴露于碱烧伤并如上所述进行治疗。在治疗后7天,处死小鼠,收获其角膜用于冷冻切片,并用fitc偶联的加纳籽凝集素i(gsl i)/异凝集素和针对α平滑肌肌动蛋白(sma)的抗体染色。在未治疗的对照小鼠的角膜中,观察到很少或没有异凝集素(绿色)或sma(红
色)染色(图15a)。然而,接受pbs治疗的碱暴露小鼠的角膜遍布角膜所有层均显示广泛的异凝集素和sma染色,提示存在广泛的新血管形成和纤维化。对碱烧伤暴露的角膜局部应用核心蛋白聚糖显示,角膜上皮、基质和内皮以及房水中的异凝集素染色明显减少(图15a),表明新血管形成减少。在用核心蛋白聚糖治疗的角膜中,一定程度的sma染色减少是明显的,尤其是在后角膜和房水中。然而,对暴露于碱烧伤的角膜局部应用核心蛋白聚糖+nuc1显示,基质、内皮和房水中的异凝集素和sma染色几乎完全消失,其中上皮中的这两种染色均显著减少(图15a)。这表明,在暴露于碱烧伤的角膜中,核心蛋白聚糖+nuc1介导了非常显著的新血管形成和纤维化保护。
[0201]
对角膜的异凝集素染色的定量(图15b)显示,尽管局部单用核心蛋白聚糖明显减少了角膜中的异凝集素染色,但gsl i染色的量与pbs治疗的角膜无显著差异。然而,对暴露于碱烧伤的角膜局部应用核心蛋白聚糖+nuc1显示,异凝集素染色相对于pbs治疗的角膜显著减少83.9%(p<0.042),指示新血管形成显著减少。对角膜的sma染色的定量显示,相对于pbs治疗的角膜,局部单用核心蛋白聚糖使sma染色显著减少33.25%(p<0.025)。然而,相对于pbs治疗的角膜,对暴露于碱烧伤的角膜局部应用nuc1+核心蛋白聚糖导致sma染色更显著的减少,即46.22%(p<0.0028)(图15b),表明核心蛋白聚糖+nuc1具有相对于单独应用核心蛋白聚糖增强的纤维化保护能力。
[0202]
核心蛋白聚糖+nuc1显著降低碱烧伤模型的角膜中的炎症细胞浸润
[0203]
接下来,我们考察了在pbs、单独核心蛋白聚糖或核心蛋白聚糖+nuc1治疗后,碱烧伤暴露小鼠的角膜的炎症。对角膜横向切片进行cd45和f4/80染色,以确定白细胞,特别是巨噬细胞的存在。如预期的,在未治疗的对照小鼠的角膜中,角膜中很少或没有cd45或f4/80抗体染色(图16a)。在暴露于碱烧伤并随后用pbs治疗的小鼠角膜中,整个基质中存在cd45(绿色通道)和f4/80(红色通道)抗体的广泛染色(图16a),指示这些角膜中炎症细胞的大量浸润。暴露于碱烧伤然后局部单用核心蛋白聚糖或核心蛋白聚糖+nuc1治疗的小鼠的角膜显示,基质前部(靠近上皮)的cd45和f4/80染色减少。对角膜中cd45染色的定量显示,相对于用pbs治疗的角膜,单用核心蛋白聚糖治疗的角膜中cd45阳性细胞数量显著减少39.6%(p<0.0147)(图16b)。相对于用pbs治疗的角膜,用核心蛋白聚糖+nuc1局部治疗的角膜也显示cd45染色显著减少59.8%(p<0.0017)(图16b)。然而,单用核心蛋白聚糖治疗的角膜与使用核心蛋白聚糖+nuc1治疗的角膜之间的cd45染色没有显著差异(图16b)。对角膜中f4/80染色的定量显示,相对于用pbs治疗的角膜,用核心蛋白聚糖+nuc1治疗的角膜的染色显著减少57.9%(p<0.0052)(图16b),指示这些角膜中巨噬细胞浸润明显减少。相比而言,相对于用pbs治疗的角膜,单用核心蛋白聚糖治疗的角膜中f4/80染色没有显著减少(图16b)。该数据表明,局部应用核心蛋白聚糖+nuc1对碱烧伤暴露小鼠的角膜中炎性细胞浸润的改善作用比局部单用核心蛋白聚糖更有效,尤其是对巨噬细胞而言。
[0204]
炎症标志物cd45和f4/80在损伤部位处细胞因子/趋化因子的产生中起重要作用,其负责进一步的组织破坏和瘢痕形成。因此,我们使用bioplex测定进一步确定了th17细胞因子的表达水平。在暴露于碱烧伤的小鼠治疗7天后收集角膜裂解物,并测定il-1β、il-6、肿瘤坏死因子α(tnf-α)、干扰素γ(ifn-g)、il-17和il-10的水平。相对于未治疗的未暴露于碱烧伤的对照小鼠的角膜,在暴露于碱烧伤并用pbs治疗的小鼠的角膜中观察到五种细胞因子(tnf-α、il-1β、il-6、il-17和ifn-g)升高(图17a)。在对照组和治疗组中,细胞因子
il-10的水平都低于测定的检测限(数据未显示)。相对于pbs治疗的小鼠,我们观察到单用核心蛋白聚糖或核心蛋白聚糖+nuc1治疗后tnf-α、ifn-g、il-17和il-6表达降低(图17a)。值得注意的是,与单用核心蛋白聚糖治疗的小鼠相比,使用核心蛋白聚糖+nuc1治疗的小鼠的表达降低更多。有趣的是,在单用核心蛋白聚糖和核心蛋白聚糖+nuc1治疗的小鼠角膜中观察到il-1β表达增加(图17a)。
[0205]
碱烧伤还导致炎症细胞因子,转化生长因子β(tgf-β1)的产生,其在角膜细胞向肌成纤维细胞分化中起重要作用,并通过诱导细胞因子的进一步表达而加重角膜组织的损伤,进而形成炎症反馈环。使用针对tgf-β1的抗体染色,我们观察到小鼠角膜碱烧伤用pbs治疗后,角膜上皮、基质和内皮中tgf-β1显著表达(图17b)。虽然单用核心蛋白聚糖治疗导致tgf-β1表达降低,但相对于单用核心蛋白聚糖,使用核心蛋白聚糖+nuc1治疗的小鼠的tgf-β1水平显著更低(图17b)。
[0206]
nuc1核心蛋白聚糖+nuc1显著减少碱烧伤小鼠模型角膜中的细胞死亡
[0207]
已显示caspase-3介导的细胞凋亡发生在暴露于碱烧伤的小鼠角膜中。为了确定单独核心蛋白聚糖或核心蛋白聚糖+nuc1是否对碱烧伤诱导的细胞死亡有影响,对在治疗后第7天采集的小鼠角膜的横向冷冻切片进行活化caspase-3染色(图18)。未暴露于碱烧伤的未治疗对照小鼠的角膜中没有可检测到的活化caspase-3(图18)。然而,在用pbs治疗的碱烧伤暴露小鼠的角膜所有层(上皮、基质和内皮)中观察到活化caspase-3染色(图18)。相对于pbs治疗小鼠的角膜,在暴露于碱烧伤且局部单用核心蛋白聚糖治疗的小鼠中,角膜基质和内皮中活化caspase-3染色显著减少,上皮中可能也减少(图18)。然而,相对于pbs治疗的小鼠,在暴露于碱烧伤并用核心蛋白聚糖+nuc1局部治疗的小鼠角膜中,角膜的所有三层(包括上皮)中的活化caspase-3染色均显著减少。对来自每个治疗组和“未治疗”组的角膜中活化caspase-3染色的荧光信号的定量显示,单用核心蛋白聚糖(51.5%)或核心蛋白聚糖+nuc1(74.6%,p<0.0001,图18)治疗的小鼠角膜中活化caspase-3染色显著减少。相对于单用核心蛋白聚糖治疗的角膜,使用核心蛋白聚糖+nuc1治疗的角膜中活化caspase-3染色量也显著减少(47.6%,p=0.0001)(图18)。
[0208]
还通过角膜冷冻切片的tunel染色评估了大体细胞死亡(图19a)。在未暴露于碱烧伤的对照小鼠的未治疗角膜中,很少或没有观察到tunel染色(图19a)。在暴露于碱烧伤并随后用pbs治疗的小鼠角膜的基质和上皮中观察到指示细胞死亡的tunel染色(图19a)。暴露于碱烧伤并单用核心蛋白聚糖治疗的小鼠角膜基质中的tunel染色显著减少(图19a),但这些小鼠上皮中的tunel染色减少很小或没有明显减少。在暴露于碱烧伤并用核心蛋白聚糖+nuc1治疗的小鼠角膜中,任何角膜层中的tunel染色很少或没有,表明这些小鼠角膜中的细胞死亡几乎被完全防止(图19b)。对这些角膜中tunel染色的定量指示,相对于pbs治疗的小鼠,暴露于碱烧伤并单用核心蛋白聚糖治疗的小鼠角膜中的tunel染色显著减少(44.8%,p<0.0882)(图19b)。然而相对于pbs治疗组,观察到暴露于碱烧伤并用核心蛋白聚糖+nuc1治疗的角膜中tunel染色更大量和显著的减少(90.45%,p<0.006)(图19b)。
[0209]
核心蛋白聚糖+nuc1显著降低碱烧伤小鼠模型角膜中的神经胶质增生
[0210]
神经胶质增生是视网膜中米勒神经胶质细胞的活化,是对碱损伤的快速应激反应。胶质纤维酸性蛋白(gfap)表达的增加是神经胶质增生的标志。先前的研究表明,响应于碱烧伤的促炎细胞因子tnf-a的增加导致视网膜神经胶质增生的诱导[22]。为了确定局部
单用核心蛋白聚糖或核心蛋白聚多+nuc1治疗暴露于碱烧伤的小鼠角膜是否导致保护视网膜免受神经胶质细胞活化的影响,我们对遭受角膜碱烧伤的、并用pbs、单独核心蛋白聚糖或核心蛋白聚糖+nuc1局部治疗7天的小鼠视网膜的横向冷冻切片进行gfap染色(图20)。观察到未暴露于碱烧伤的对照小鼠视网膜的gfap染色模式与缺乏活化的神经胶质细胞时一致(图20)。在对照视网膜中,仅在前视网膜的星形胶质细胞和米勒细胞终足中观察到gfap。观察到暴露于碱烧伤并用pbs治疗的小鼠的视网膜具有与米勒神经胶质活化一致的gfap染色模式(图20),遍布米勒细胞观察到gfap,其从神经节细胞层(gcl)延伸穿过内核层并进入外核层(inl/onl)。暴露于碱烧伤并单用核心蛋白聚糖治疗的小鼠视网膜也具有与米勒细胞活化一致的gfap染色模式,但相对于使用pbs治疗的小鼠视网膜,染色减少(图20)。在这些视网膜中,观察到gfap染色从gcl延伸穿过米勒细胞进入内网层,但在这些视网膜的inl或onl中未观察到。然而,在暴露于碱烧伤并用核心蛋白聚糖+nuc治疗的小鼠视网膜中,gfap染色相对于单用核心蛋白聚糖治疗的小鼠视网膜显著减少。在这些视网膜中,染色多局限于gcl中的米勒细胞终足,内丛状层偶见米勒细胞染色(图20)。这些数据表明,在暴露于碱烧伤的小鼠中,单独核心蛋白聚糖和核心蛋白聚糖+nuc1均在碱烧伤小鼠中介导视网膜神经胶质增生的减少。但是,我们不能排除单独的核心蛋白聚糖和核心蛋白聚糖+nuc1直接影响视网膜米勒细胞活化的可能性。
[0211]
讨论
[0212]
提高递送至眼睛的药物的保留率和疗效是提高局部治疗的生物效率和治疗反应的关键。由于角膜前泪膜的高周转率,水性药物的快速清除是一个主要挑战,因为它会降低递送至角膜的药物的疗效。强化局部药物施用途径或侵入性药物递送方法(包括结膜下或玻璃体内注射)常伴有并发症。在药物无效的情况下,通常需要手术治疗或去除由此产生的角膜瘢痕,增加了发病风险和治疗后患者不适的持续时间。
[0213]
眼部烧伤通常与威胁视力的并发症有关,对眼科医生来说是一个临床挑战。目前的医疗旨在通过谨慎使用皮质类固醇或预防性抗生素来控制炎症。碱烧伤小鼠模型已有充分记载,并为评估重组人核心蛋白聚糖的抗瘢痕形成和抗纤维化作用提供了稳健的临床相关手段。局部施用核心蛋白聚糖蛋白(有或无细胞穿膜肽nuc1)在7天的局部治疗后导致角膜混浊水平显著降低。角膜混浊的这种减少可能对患者有长期益处,从而保持视力。有趣的是,我们观察到该治疗不仅预防纤维化,而且还与炎症显著减少有关,从而预防了视网膜神经胶质增生。我们的结果与先前的研究一致,这些研究指示碱烧伤后角膜产生促炎细胞因子tnf-α导致神经胶质增生[22-24]。炎症的这种减少也是有益的,因为它通过抑制caspase-3依赖性细胞凋亡途径的激活来保护角膜的上皮和基质层。局部施用核心蛋白聚糖也能够调节与碱烧伤相关的病理学,这可能是由于其能够穿透受损角膜已被破坏的微环境。此外,核心蛋白聚糖与nuc1联合使用导致碱烧伤后的雾度、混浊、纤维化和炎症显著降低。我们的结果表明,nuc1可能通过提高核心蛋白聚糖蛋白的保留时间从而提高其治疗效率,来增强核心蛋白聚糖蛋白加速愈合过程的固有能力。
[0214]
碱烧伤会导致对角膜结构的多种破坏,包括上皮层变薄、基质水肿和细胞浸润物沉积。与泪膜和顶端粘膜一起,上皮是眼睛的第一道防线。核心蛋白聚糖与肽nuc1一起局部施用恢复了上皮形态,减少了基质水肿以及角膜的总厚度。此外,先前的研究报告称,核心蛋白聚糖调节角膜成纤维细胞的几种生长因子和信号通路(经tgf-β的smad2和smad3),从
而减轻纤维化时的瘢痕形成。由于碱烧伤本质上是急性的,因此内源性核心蛋白聚糖可能无法中和过度活跃的tgf-β分子,从而允许下游纤维化级联反应激活。
[0215]
碱烧伤引起的前段大量炎症导致对视网膜内外层以及视神经的广泛损害。最近的一份报告记录了经历波士顿人工角膜植入的碱烧伤患者表现出眼压升高(即青光眼)。尽管采取了积极的治疗措施和手术,但与未烧伤的植入患者相比,烧伤患者的眼睛恶化加快。碱烧伤后损伤视网膜的机制尚未阐明,但有少数研究表明后部碱扩散(posterior alkali diffusion)的可能性。也有报道表明视网膜的损伤是由于炎性细胞因子特别是tnf-α的产生引起的,而不仅仅是扩散[25]。此外,促炎细胞因子tnf-α和il-1β造成几种感染性和非感染性眼部病理学的炎症。il-6在角膜炎性疾病中也起着重要的作用,因为il-6r拮抗剂减少角膜炎症和新血管形成[25]。炎症的增加产生反馈回路,其导致促炎基因被进一步上调[26]。炎性环境破坏血液-视网膜屏障,并导致来自血液的免疫细胞浸润,主要是中性粒细胞和巨噬细胞[26]。这些浸润性免疫细胞激活眼中的常驻免疫细胞。此外,来自米勒神经胶质的突触信号传导[27]触发视网膜中细胞因子的产生,引起眼前段和后段的细胞应激。前期研究已报道了,由前房ph值升高引起的小鼠和兔视网膜的inl和onl中的细胞凋亡,引起葡萄膜炎的炎症[27,28]。在我们的研究中,我们在碱烧伤七天后观察到,视网膜中稳健的神经胶质增生和角膜中的细胞凋亡,其伴随角膜裂解物中炎性细胞因子tnf-α、il-6和ifn-g水平升高。局部施用核心蛋白聚糖有助于减轻炎症,进而控制神经胶质增生和细胞凋亡。尽管这些结果令人鼓舞,但核心蛋白聚糖在碱烧伤治疗中的多重保护作用需要进一步研究。
[0216]
总之,尽管广泛的临床前安全性研究是必要的,但我们已证明局部递送抗纤维化蛋白即核心蛋白聚糖联合nuc1可能是安全的,并且nuc1可穿透发炎的角膜并将货物蛋白递送至角膜组织中。核心蛋白聚糖联合nuc1可有效挽救碱烧伤后的角膜表面。碱烧伤属于严重眼外伤的范畴,且目前治疗选择很少。在我们的研究中,核心蛋白聚糖保留了其治疗潜力,并与眼表保持足够长的接触,使其能够显著减少角膜瘢痕形成。因此,由于对抗眼部纤维化、炎症和细胞死亡的能力,局部应用核心蛋白聚糖联合nuc1是一种有前景的碱烧伤治疗方案。
[0217]
实施例3-nuc1增强基因编辑剂的视网膜递送
[0218]
为补充基因治疗和蛋白质治疗,对基因编辑领域的兴趣极大。用于基因编辑的常用蛋白质是cas9。与基因治疗相比,转基因的长期表达是期望的,通过基因编辑蛋白(如cas9)的瞬时表达可以避免脱靶效应。此外,cas9及其功能相关物是细菌蛋白,因此,如果在人体细胞中无限表达,则具有免疫原性和毒性。转基因表达在体内受到调控的基因治疗方法是复杂的。因此,对上述问题更实用的解决方案是将基因编辑蛋白瞬时递送到细胞核中。一旦那些被外源递送的蛋白完成了它们的基因编辑功能,它们就应该在细胞内以基本上所有胞内蛋白共有的方式被自然降解。为了使这种方法成功,必须克服细胞屏障,以允许cas9被递送到靶细胞。我们假设cpp nuc1可用于此目的。
[0219]
nuc 1增强视网膜对cre重组酶的摄取并促进基因编辑
[0220]
为了检验这一假设,我们首先研究了nuc1是否可促进或增强ai9小鼠对cre重组酶蛋白的摄取。在这些小鼠中,当cre重组酶切除flox化的终止密码子时,tdtomato报告转基因表达盒启动。我们向成年(约6周龄)ai9小鼠经玻璃体内单独注射或与1微克nuc1联合注
fibrosis.invest ophthalmol vis sci,2017.58(1):p.9-20.
[0246]
22.paschalis,e.i.,etal.,the role of microglia and peripheral monocytes in retinal damage after corneal chemical injury.am j pathol,2018.188(7):p.1580-1596.
[0247]
23.paranthan,r.r.,et al.,a robust model for simultaneously inducing corneal neovascularization and retinal gliosis in the mouse eye.mal vis,2011.17:p.1901-8.
[0248]
24.zhou,c.,et al.,sustained subconjunctival delivery of infliximab protects the cornea and retina following alkali burn to the eye.invest ophthalmol vis sci,2017.58(1):p.96-105.
[0249]
25.chen,y.,et al.,mk2 inhibitor reduces alkali bum-induced inflammation in rat cornea.sci rep,2016.6:p.28145.
[0250]
26.ogura,s.,et al.,sustained inflammation after pericyte depletion induces irreversible blood-retina barrier breakdown.jcl insight,2017.2(3):p.e90905.
[0251]
27.wizeman,j.w.and r.mohan,expression of peptidyiarginine deiminase 4 in an alkali injury model of retinal gliosis.biochem biophys res commun,2017.487(1):p.134-139.
[0252]
28.kumar,b.,s.m.cashman,and r.kumar-singh,complement-mediated activation of the nlrp3 jnflammasome and its inhibition by aav-mediated delivery of cd59 in a model of uveitis.mol ther,2018.26(6):p.1568-1580.
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:R
- 技术所有人:塔夫茨学院托管部
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
精彩留言,会给你点赞!
专利分类正在加载中....