可优先结合IL-2Rα的IL-2融合蛋白的制作方法
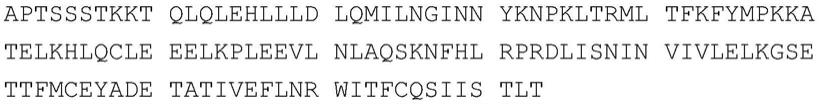
可优先结合il-2r
α
的il-2融合蛋白
1.相关申请的交叉引用
2.本技术要求以下申请的优先权:于2019年8月12日提交的美国临时申请第62/885,471号;于2020年4月26日提交的美国临时申请第63/015,644号;于2020年5月2日提交的美国临时申请第63/019,319号;以及于2020年6月25日提交的美国临时申请第63/044,294号。优先权申请的内容以全文引用的方式并入本文中。
3.序列表
4.本技术含有已经以ascii格式电子提交的序列表,并且特此以全文引用的方式并入。创建于2020年8月12日的所述ascii副本命名为025471_w0005_sl.txt并且大小为163,708字节。
背景技术:
5.白细胞介素-2(il-2)在淋巴细胞生成、存活和体内平衡中起着核心作用。所述il-2具有133个氨基酸并由四个反平行、两亲性α螺旋组成,所述螺旋形成对其功能至关重要的四级结构(smith,《科学(science)》(1988)240:1169-76;bazan,《科学》(1992)257:410-13)。il-2通过与il-2受体(il-2r)结合来发挥其活性,所述il-2受体由至多三个单独的亚基组成。α(cd25或tac抗原)、β(cd122)和γ(γc、共同γ链或cd132)亚基的缔合产生il-2的三聚体高亲和力受体(kd~0.01nm)。由β和γ亚基组成的二聚体il-2受体被称为中间亲和力il-2r(kd~1nm)。单独的α亚基形成单体低亲和力il-2受体(kd~10nm)。参见例如kim等人,《细胞因子生长因子评论(cytokine growth factor rev.)》(2006)17:349-66)。尽管二聚体中间亲和力il-2受体结合il-2的亲和力是三聚体高亲和力受体的大约1/100,但二聚体和三聚体il-2受体两者可以在il-2结合时传输信号(minami等人,《免疫学年度综述(annu rev immunol)》(1993)11:245-68)。因此,虽然有助于赋予受体与il-2的高亲和力结合,但α亚基似乎对il-2信号转导而言不是必需的。然而,β和γ亚基对il-2信号转导而言是至关重要的(krieg等人,《美国国家科学院院刊(proc natl acad sci.)》(2010)107:11906-11)。三聚体il-2受体由cd4
+
foxp3
+
调节性t(treg)细胞表达。treg细胞在体内持续表达最高水平的il-2rα(fontenot等人,《自然免疫学(nature immunol.)》(2005)6:1142-51)。三聚体il-2受体也在常规活化t细胞上瞬时诱导,而在静息状态下,这些细胞仅表达二聚体il-2受体。
6.基于已发布的il-2/il-2r复合物的晶体结构(wang等人,《科学》(2005)310:1159-63),研究人员已在il-2中进行突变以调节其与cd25、cd122和/或cd132的相互作用。在一个实例中,据报道,人il-2的d20、n88或q126处的突变在激活t细胞及nk细胞方面示出了不同的效力(美国专利6955807)。在另一个实例中,示出了在位置69和74处发生突变的il-2与cd25紧密结合,而在位置88或91处的突变阻断了其与cd122的相互作用,并且在位置126处的突变阻断了其与cd132的相互作用(pct公开wo 2009/061853)。
7.treg细胞对于抑制自身免疫和调节炎症是至关重要的。foxp3-cd25
+
t效应细胞(teff)可能是cd4
+
或cd8
+
细胞,两者均在炎症、自身免疫、器官移植排斥或移植物抗宿主疾
病(gvhd)中发挥作用。il-2刺激的stat5信号转导对于正常的treg细胞生长和存活以及高foxp3表达是至关重要的。
8.尽管il-2在treg活性中发挥作用,但临床上尚未证明用于调节treg活性的安全且有效的基于il-2的疗法。因此,仍然需要开发优先扩增或刺激treg细胞以治疗炎症和自身免疫性疾病的基于il-2的疗法。
技术实现要素:
9.本公开提供了一种分离的il-2融合分子,其包括载体部分、细胞因子部分和一个或多个掩蔽部分,其中所述细胞因子部分与所述载体部分或掩蔽部分融合,所述一个或多个掩蔽部分与所述载体部分或所述细胞因子部分融合,所述细胞因子部分包括il-2多肽,所述il-2多肽包括:(i)c125a或c125s取代;或(ii)il-2氨基酸序列,所述il-2氨基酸序列包括选自t3a、c125s、v69a和q74p的一个或多个取代(根据seq id no:1编号),所述一个或多个掩蔽部分与所述细胞因子部分结合,并抑制所述细胞因子部分与免疫细胞(例如,t细胞和nk细胞)上的il-2rβ和/或il-2rγ结合,但不抑制其与il-2rα结合。在一些实施例中,il-2多肽以类似于或高于野生型il-2的亲和力结合il-2rα。
10.本公开还提供了一种治疗炎性病状或自身免疫性疾病的方法,所述方法包括向有需要的受试者施用治疗量的分离的il-2融合分子,所述分离的il-2融合分子包括载体部分、细胞因子部分和一个或多个掩蔽部分,其中所述细胞因子部分与所述载体部分或掩蔽部分融合,所述一个或多个掩蔽部分与所述载体部分或所述细胞因子部分融合,所述细胞因子部分包括il-2多肽,并且所述一个或多个掩蔽部分与所述细胞因子部分结合,并抑制所述细胞因子部分与免疫细胞(例如,t细胞和nk细胞)上的il-2rβ和/或il-2rγ结合,但不抑制其与il-2α结合。在一些实施例中,所述炎性病状或自身免疫性疾病选自由以下组成的组:哮喘、i型糖尿病、类风湿性关节炎、过敏症、全身性红斑狼疮、多发性硬化症、器官移植排斥和移植物抗宿主疾病。
11.在一些实施例中,所述il-2多肽以类似于或高于所述野生型il-2的亲和力结合il-2rα。
12.在一些实施例中,il-2rβecd或其功能类似物具有与seq id no:3至少95%(例如,至少97%、至少98%或至少99%)相同的氨基酸序列。在一些实施例中,所述il-2rγecd或其功能类似物具有与seq id no:6至少95%(例如,至少97%、至少98%或至少99%)相同的氨基酸序列。在一些实施例中,所述il-2多肽包括与seq id no:1至少95%相同的氨基酸序列,任选地其中所述氨基酸序列为seq id no:2。
13.在一些实施例中,所述il-2融合分子包括掩蔽部分,所述掩蔽部分包括il-2rβ或il-2rγ的胞外结构域(ecd)或其功能类似物,其中所述掩蔽部分在具有或不具有肽接头的情况下与所述载体部分融合。在其它实施例中,所述il-2融合分子包括:第一掩蔽部分,所述第一掩蔽部分包括il-2rβ或il-2rγ的胞外结构域(ecd)或其功能类似物,其中所述第一掩蔽部分在具有或不具有肽接头的情况下与所述载体部分融合;以及第二掩蔽部分,所述第二掩蔽部分包括il-2rγ或il-2rβ的ecd或其功能类似物,其中所述第二掩蔽部分在具有或不具有肽接头的情况下与所述细胞因子部分融合或与所述第一掩蔽部分融合。在一些实施例中,本公开的il-2融合分子包括至少两个掩蔽部分,所述两个掩蔽部分中的一个掩蔽
部分是il-2rα的ecd或其功能类似物,其中所述il-2rαecd掩蔽部分通过可切割肽接头与所述细胞因子部分、所述载体部分或另一个掩蔽部分融合。在特定实施例中,所述il-2rαecd部分包括与seq id no:7至少95%相同的氨基酸序列。
14.在一些实施例中,所述细胞因子部分通过不可切割的肽接头与所述载体部分或掩蔽部分融合,并且所述掩蔽部分通过不可切割的肽接头与所述载体部分或所述细胞因子部分融合。在特定实施例中,所述掩蔽部分通过肽接头与所述载体部分或所述细胞因子部分融合,所述肽接头包括至少16个氨基酸、至少18个氨基酸、至少20个氨基酸、至少22个氨基酸、至少25个氨基酸、至少30个氨基酸或至多44个氨基酸。
15.在一些实施例中,所述载体部分选自peg分子、白蛋白、白蛋白片段、抗体fc结构域、抗体或其抗原结合片段。在一些实施例中,所述载体部分是抗体fc结构域,并且所述融合分子是异二聚体,所述异二聚体包括:第一多肽链,所述第一多肽链从n端到c端包括选自f1-l1-e1、f1-l1-e1-l2-e2和f1-l1-e2-l2-e1的分子式;以及第二多肽链,所述第二多肽链从n端到c端包括分子式f2-l3-c,其中f1和f2是所述fc结构域的亚基,l1、l2和l3是肽接头,e1是il-2rβecd或其功能类似物,并且e2是il-2rγecd或其功能类似物,并且c是所述细胞因子部分。在其它实施例中,所述载体部分是抗体fc结构域,并且其中所述融合分子是异二聚体,所述异二聚体包括:第一多肽链,所述第一多肽链从n端到c端包括选自e1-l1-f1、e1-l1-e2-l2-f1和e2-l1-e1-l2-f1的分子式;以及第二多肽链,所述第二多肽链从n端到c端包括分子式c-l3-f2,其中f1和f2是所述fc结构域的亚基,l1、l2和l3是肽接头,e1是il-2rβecd或其功能类似物,并且e2是il-2rγecd或其功能类似物,并且c是所述细胞因子部分。在其它实施例中,所述载体部分是抗体fc结构域,并且其中所述融合分子是包括第一多肽链和第二多肽链的异二聚体,所述第一多肽链和所述第二多肽链从n端到c端包括选自以下对的分子式:
16.f1-l1-e1和f2-l2-c-l3-e2;
17.f1-l1-e1和f2-l2-e2-l3-c;
18.f1-l1-e2和f2-l2-c-l3-e1;
19.f1-l1-e2和f2-l2-e1-l3-c;
20.e1-l1-f1和e2-l2-c-l3-f2;
21.e1-l1-f1和c-l2-e2-l3-f2;
22.e2-l1-f1和e2-l2-c-l3-f2;以及
23.e2-l1-f1和c-l2-e1-l3-f2,其中
24.f1和f2是所述fc结构域的亚基,l1、l2和l3是肽接头,e1是il-2rβecd或其功能类似物,并且e2是il-2rγecd或其功能类似物,并且c是所述细胞因子部分。在一些实施例中,所述肽接头l1、l2和l3是不可切割的。在特定实施例中,l1、l2和l3独立地具有选自seq id no:40-46、55-57和59的氨基酸序列。在其它特定实施例中,l1、l2和l3中的至少一个具有包括20-44个氨基酸的氨基酸序列。
25.在特定实施例中,本公开的所述il-2融合分子包括:第一多肽链,所述第一多肽链包括与seq id no:50、51或52至少99%相同的氨基酸序列;以及第二多肽链,所述第二多肽链包括与seq id no:53或54至少99%相同的氨基酸序列。在特定实施例中,本公开的所述il-2融合分子包括:第一多肽链,所述第一多肽链包括与seq id no:50至少99%相同的氨
基酸序列;以及第二多肽链,所述第二多肽链包括与seq id no:53至少99%相同的氨基酸序列。
26.在一些实施例中,本公开的所述il-2融合分子具有以下特性中的一项或多项:
27.(a)所述il-2融合分子与具有α、β和γ亚基的高亲和力il-2受体(il-2rαβγ)结合的亲和力是与具有β和γ亚基的中间亲和力il-2受体(il-2rβγ)结合的亲和力的至少100倍;
28.(b)所述il-2融合分子以大于约5nm或大于10nm的kd与il-2rβγ结合,如在37℃下在表面等离子体共振测定中测量的;
29.(c)在ctll-2细胞增殖测定中,所述il-2融合分子的ec50值小于约1nm且大于0.01nm、0.25nm或0.05nm;
30.(d)在nk92细胞增殖测定中,所述il-2融合分子的ec50值大于约0.05nm、0.1nm、0.25nm或0.5nm;
31.(e)在nk92细胞增殖测定中,所述il-2融合分子在存在中和cd25抗体的情况下的emax值为在不存在所述中和cd25抗体的情况下的emax值的至多1/5或至多1/10;
32.(f)相对于t效应细胞或nk细胞,所述il-2融合分子优先地刺激foxp3+t调节性细胞;
33.(g)所述il-2融合分子促进foxp3+调节性t细胞生长或存活;以及
34.(h)所述il-2融合分子在foxp3+t细胞中诱导stat5磷酸化,但在foxp3-t细胞中诱导stat5磷酸化的能力降低。
35.在其它方面,本公开还提供:一种药物组合物,所述药物组合物包括本公开的il-2融合分子以及药学上可接受的赋形剂;一种或多种多核苷酸,所述一种或多种多核苷酸编码所述il-2融合分子;一种或多种表达载体,所述一种或多种表达载体包括所述一种或多种多核苷酸;以及包括所述载体的宿主细胞,其中所述宿主细胞可以是原核细胞或真核细胞,如哺乳动物细胞。在一些实施例中,所述哺乳动物宿主细胞中编码upa、mmp-2和/或mmp-9的基因被敲除(例如,含有这些基因中的一个或多个基因的无效突变)。因此,本公开还提供了一种制备所述il-2融合分子的方法,所述方法包括:在允许所述il-2融合分子表达的条件下培养宿主细胞,其中所述宿主细胞是哺乳动物细胞;以及分离所述il-2融合分子。
36.本发明的其它特征、目的和优点在下面详细描述中是显而易见的。然而,应理解,详细描述虽然指示了本发明的实施例和方面,但其仅以说明而非限制的方式给出。根据详细描述,本发明范围内的各种变化和修改对于本发明所属领域的技术人员而言将是显而易见的。
附图说明
37.图1a和1b是il-2融合分子的示意性图示,其中il-2rβ胞外结构域(ecd)和il-2多肽与fc结构域的c端融合。il-2多肽通过不可切割的接头与一个fc多肽的c端融合。il-2rβecd通过不可切割的接头(图1a)或可切割的接头(图1b)与另一个fc多肽的c端融合。“杵臼(knobs-into-holes)”表示fc多肽中的杵臼突变。
38.图2a和2b是il-2融合分子的示意性图示,其中il-2rβecd和il-2多肽与fc结构域的c端融合,并且il-2rγecd与il-2rβecd的c端融合。il-2多肽通过不可切割的接头与一个
fc多肽的c端融合。il-2rβecd通过不可切割的接头与另一个fc多肽的c端融合。il-2rγecd通过不可切割的接头(图2a)或可切割的接头(图2b)与il-2rβecd的c端融合。
39.图3a和3b是il-2融合分子的示意性图示,其中il-2rγecd和il-2多肽与fc结构域的c端融合,并且il-2rβecd与il-2rγecd的c端融合。il-2多肽通过不可切割的接头与一个fc多肽的c端融合。il-2rγecd通过不可切割的接头与另一个fc多肽的c端融合。il-2rβecd通过不可切割的接头(图3a)或可切割的接头(图3b)与il-2rγecd的c端融合。
40.图4a和4b是il-2融合分子的示意性图示,其中il-2rβecd和il-2多肽与fc结构域的c端融合,并且il-2rγecd与il-2多肽的c端融合。il-2多肽通过不可切割的接头与一个fc多肽的c端融合。il-2rγecd通过可切割的接头与il-2多肽的c端融合。il-2rβecd通过不可切割的接头(图4a)或可切割的接头(图4b)与另一个fc多肽的c端融合。
41.图5a和5b是il-2融合分子的示意性图示,其中il-2rγecd和il-2多肽与fc结构域的c端融合,并且il-2rβecd与il-2多肽的c端融合。il-2多肽通过不可切割的接头与一个fc多肽的c端融合。il-2rβ通过可切割的接头与il-2多肽的c端融合。il-2rγecd通过不可切割的接头(图5a)或可切割的接头(图5b)与另一个fc多肽的c端融合。
42.图6a和6b是il-2融合分子的示意性图示,其中l-2rβecd和il-2rγecd与fc结构域的c端融合,并且il-2多肽与il-2rβecd或il-2rγecd的c端融合。在图6a中,il-2rγecd通过可切割的接头与一个fc多肽的c端融合,il-2rβecd通过不可切割的接头与另一个fc多肽的c端融合,并且il-2多肽通过不可切割的接头与il-2rβecd的c端融合。在图6b中,il-2rβecd通过可切割的接头与一个fc多肽的c端融合,il-2rγecd通过不可切割的接头与另一个fc多肽的c端融合,并且il-2多肽通过不可切割的接头与il-2rγecd的c端融合。
43.图7a和7b是il-2融合分子的示意性图示,其中il-2rβecd和il-2多肽与fc结构域的n端融合。il-2多肽与一个fc多肽的n端融合。il-2rβecd通过不可切割的接头(图7a)或可切割的接头(图7b)与另一个fc多肽的n端融合。
44.图8示出了具有如图1b中所展示的示意性结构的il-2融合分子jr3.116.5的sds-page分析,所述融合分子包括如分别在seq id no:12和23中所示的两条具有氨基酸序列的多肽链。
45.图9示出了il-2融合分子jr3.116.5在通过蛋白酶处理激活之前和之后的基于ctll2的生物活性测定的结果。
46.图10a和10b是il-2融合分子982c1、982c2、982d1和982d2的示意性图示。982c1和982c2具有两个掩蔽部分,il-2rβecd和il-2rγecd,并且il-2突变蛋白与igg
4 fc结构域的c端融合。图10a示出了通过(g4s)2aa(g4s)2(seq id no:59)不可切割的接头与一个igg
4 fc多肽的c端融合的il-2rγecd。il-2rβecd通过43个氨基酸长的不可切割的接头与il-2rγecd的c端融合,如在seq id no:46中示出的。il-2突变蛋白通过不可切割的接头与另一个igg4多肽的c端融合。il-2突变蛋白具有c125a取代(982cl)或取代t3a/c125s/v69a/q74p(982c2)。图10b示出了通过(g4s)2aa(g4s)2(seq id no:59)不可切割的接头与一个igg
4 fc多肽的c端融合的il-2rβecd。il-2突变蛋白通过不可切割的接头与另一个igg4多肽的c端融合。il-2突变蛋白具有c125a取代(982d1)或取代t3a/c125s/v69a/q74p(982d2)。
47.图11示出了982d1、982d2、il-2和参考分子在存在或不存在抗cd25的中和抗体的情况下的nk92细胞增殖测定。参考分子(982ref)是fc-il-2融合分子,其中il-2具有突变
v91k和c125a。982-ref是每条链包括seq id no:58的氨基酸序列的同型二聚体fc-融合-il-2突变蛋白分子。
48.图12示出了il-2融合分子982d1和982d2与大鼠cd4
+
t细胞的结合。n.c.代表阴性对照。
49.图13a和13b示出了il-2融合分子982d1、982c1和982d2以及982ref与cd4
+
cd25
+
t细胞和cd4
+
cd25-t细胞的结合。n.c.代表阴性对照。
50.图14示出了由982d1、982c1、982d2和982ref il-2融合分子诱导的cd4
+
cd25
+
t细胞和cd4+cd25-t细胞的浓度依赖性增殖。还测试了单独的il-2。
51.图15示出了大鼠pk研究中982c1、982d1和982ref il-2融合分子的血清血浆浓度随时间推移的变化。向大鼠皮下注射所述分子。
52.图16示出了来自第二大鼠pk研究中的982c1、982d1和982ref il-2融合分子的血清血浆浓度随时间推移的变化。
53.图17a和17b示出了由982c1、982d1和982ref il-2融合分子诱导的大鼠cd4
+
t细胞中的cd4
+
foxp3
+
和cd4
+
foxp3-细胞的百分比随时间推移的变化。
54.图18a和18b示出了由来自第一pk研究的大鼠中的982c1、982d1和982ref诱导的cd4
+
cd25
+
和cd4
+
cd25-细胞的增殖状态(如增殖标志物ki67所示)随时间推移的变化。
55.图19a和19b示出了由大鼠cd4
+
t细胞中的982il-2融合分子诱导的cd4
+
foxp3
+
和cd4
+
foxp3-细胞的百分比随时间推移的变化。
56.图20a和20b示出了由大鼠中的982il-2融合分子诱导的cd4
+
cd25
+
和cd4
+
cd25-细胞的增殖状态随时间推移的变化。
57.图21示出了在982d1、982d2和982ref的单次皮下施用后各个处理组的体重。
具体实施方式
58.如在本文中和所附权利要求书中所使用的,单数形式“一个或一种(a)”、“或(or)”和“所述(the)”包含复数指代物,除非上下文另有明确指明。本文中提及“约”值或参数包括(及描述)针对所述值或参数本身的变化。例如,提及“约x”的描述包含对“x”的描述。此外,在任何数字系列之前使用“约”包含“约”所述系列中列举的每个数字。例如,提及“约x、y或z”的描述旨在描述“约x、约y或约z”。
59.术语“抗原结合部分”是指与抗原特异性地结合的多肽或一组相互作用的多肽,并且包含但不限于抗体(例如,单克隆抗体、多克隆抗体、多特异性抗体、双特异性抗体(dual specific or bispecific antibody)、抗独特型抗体或双功能杂合抗体)或其抗原结合片段(例如,fab、fab'、f(ab')2、fv、二硫键连接的fv、scfv、单结构域抗体(dab)或双功能抗体)、单链抗体和含有fc的多肽,如免疫粘附素。在一些实施例中,抗体可以属于任何重链同种型(例如,igg、iga、igm、ige或igd)或亚型(例如,igg1、igg2、igg3或igg4)。在一些实施例中,抗体可以属于任何轻链同种型(例如,κ或λ)。抗体可以是人、非人(例如,来自小鼠、大鼠、兔、山羊或另一个非人动物)、嵌合(例如,具有非人可变区和人恒定区)或人源化(例如,具有非人cdr和人框架和恒定区)。在一些实施例中,抗体是衍生后的抗体(derivatized antibody)。
60.术语“细胞因子激动剂多肽”是指野生型细胞因子或其类似物。野生型细胞因子的
类似物具有与野生型细胞因子相同的生物学特异性(例如,与相同的受体结合并激活相同的靶细胞),即使类似物的活性水平可能不同于野生型细胞因子的活性水平。类似物可以是例如野生型细胞因子的突变蛋白(即突变多肽),并且可以包括相对于野生型细胞因子的至少一个突变、至少两个突变、至少三个突变、至少四个突变、至少五个突变、至少六个突变、至少七个突变、至少八个突变、至少九个突变或至少十个突变。
61.术语“细胞因子拮抗剂”或“细胞因子掩蔽剂(mask)”是指与细胞因子结合由此抑制细胞因子与其在靶细胞表面上的受体结合和/或在被拮抗剂或掩蔽剂结合时发挥其生物学功能的部分(例如,多肽)。细胞因子拮抗剂或掩蔽剂的实例包含但不限于源自与细胞因子接触的细胞因子的天然受体的胞外结构域的多肽。
62.术语“有效量”或“治疗有效量”是指足以治疗具体病症、病状或疾病,如改善、缓和、减轻和/或延缓其症状中的一种或多种症状的化合物或组合物的量。
63.术语“功能类似物”是指具有与参考分子相同的生物学特异性(例如,与相同配体结合)和/或活性(例如,激活或抑制靶细胞)的分子。
64.关于两个多肽序列的术语“融合(fused)”或“融合(fusion)”是指两个多肽序列通过主链肽键接合。两个多肽可以直接融合或通过一个或多个氨基酸长的肽接头融合。融合多肽可以通过重组技术从含有两个融合配偶体的相应编码序列的编码序列制备,在其间具有或不具有肽接头的编码序列。在一些实施例中,融合涵盖化学缀合。
65.术语“药学上可接受的赋形剂”当用于指组合物中的成分时意指所述赋形剂适合施用于治疗受试者,所述受试者包含人类受试者,而不会对受试者产生过度有害的副作用并且不影响活性药物成分(api)的生物活性。
66.术语“受试者”是指哺乳动物,并且包含但不限于人、宠物(例如,犬科动物或猫科动物)、农场动物(例如,牛或马)、啮齿动物或灵长类动物。
67.如本文所使用的,“治疗(treatment)”或“治疗(treating)”是用于获得有益或期望的临床结果的方法。有益或期望的临床结果包含但不限于以下中的一项或多项:缓解由疾病引起的一种或多种症状、减轻疾病程度、改善疾病状态、稳定疾病(例如,预防或延缓疾病的恶化或进展)、预防或延缓疾病的传播(例如,转移)、预防或延缓疾病的复发、提供疾病的部分或全部缓解、减少治疗疾病所需的一种或多种其它药物的剂量、提高患者的生活质量和/或延长存活期。本公开的方法涵盖这些治疗方面中的任何一个或多个方面。
68.应理解,本文所描述的各个实施例中的一个、一些或所有特性可以组合以形成本发明的其它实施例。本文中使用的章节标题仅出于组织目的,而不应被解释为对下面所描述的主题进行限制。
69.分离的il-2融合分子
70.本公开提供了可用于治疗炎性疾病和自身免疫性疾病的il-2融合分子。令发明人惊讶的是,在不需要切割或去除掩蔽部分的情况下,同样可实现期望的体内活性。与可切割的经掩蔽的il-2融合分子相比,具有不可切割的肽接头的经掩蔽的il-2融合分子具有许多显著优势。例如,可切割的经掩蔽的il-2分子需要蛋白酶切割接头并去除掩蔽部分以被激活。由于疾病部位处的蛋白酶分布不均匀,所以其细胞因子激活水平将发生变化,这可能增加治疗功效的可变性。此外,循环中和/或生产期间也可能发生非特异性激活,从而增加可切割经掩蔽分子的安全问题和生产复杂性。
71.在一些实施例中,本公开的il-2融合分子具有相对于中间亲和力il-2rβγ降低的亲和力(例如,kd高于1nm、高于5nm、高于10nm、高于100nm或高于1μm),同时保留对il-2rα(cd25)的野生型亲和力(例如,kd为约10nm),或者具有与il-2rα的野生型亲和力类似的亲和力(例如,kd为约1-20nm),甚至高于野生型亲和力的亲和力(例如,kd低于10nm、低于5nm或低于1nm)。分离的il-2融合分子可以包括il-2多肽(细胞因子部分)、载体(载体部分)和il-2拮抗剂(掩蔽部分或细胞因子拮抗剂),其中所述il-2多肽直接或通过可切割或不可切割的肽接头与载体融合,并且所述il-2拮抗剂通过不可切割或可切割的肽接头与所述il-2多肽或所述载体连接。在一些实施例中,细胞因子部分可以与掩蔽部分融合,所述掩蔽部分可以直接或通过可切割或不可切割的接头与载体部分融合。
72.在优选的实施例中,il-2多肽通过不可切割的肽接头与载体融合,并且il-2拮抗剂通过不可切割的肽接头与载体或il-2多肽连接。例如,il-2拮抗剂可以通过seq id no:59的不可切割的肽接头与载体融合。在一些实施例中,il-2多肽是野生型il-2多肽或不包括降低多肽对cd25的结合亲和力的突变。
73.本发明的il-2融合分子可以包括与载体部分连接并被细胞因子拮抗剂(掩蔽部分)掩蔽(结合)的il-2多肽(细胞因子部分)。细胞因子拮抗剂选自以下:il-2rβ(cd122)的胞外结构域(ecd)、il-2rβecd的功能类似物、il-2rγecd(cd132)、il-2rγecd的功能类似物以及il-2rβecd和il-2rγecd的组合。在一些实施例中,细胞因子拮抗剂抑制细胞因子部分与有需要的患者的t细胞上的il-2rγ和/或il-2rβ结合,而与il-2rα(cd25)结合的细胞因子部分保持完整。因为il-2rα(cd25)优先在treg细胞上表达,因此本发明的il-2融合分子可以优先地刺激treg细胞增殖,而对非treg细胞的影响最小。
74.在一些实施例中,载体部分是fc结构域。在一些实施例中,本发明的il-2融合分子是异二聚体,所述异二聚体包括:第一多肽链,所述第一多肽链从n端到c端包括选自f1-l1-e1、f1-l1-e1-l2-e2和f1-l1-e2-l2-e1的分子式;以及第二多肽链,所述第二多肽链从n端到c端包括分子式f2-l3-c,其中f1和f2是异二聚体fc结构域的亚基,l1、l2和l3是肽接头,e1是il-2rβecd或其功能类似物,e2是il-2rγecd或其功能类似物,并且c是包括il-2多肽(例如,野生型人il-2或其突变蛋白)的细胞因子部分。
75.在一些实施例中,本发明的il-2融合分子是异二聚体,所述异二聚体包括:第一多肽链,所述第一多肽链从n端到c端包括选自e1-l1-f1、e1-l1-e2-l2-f1和e2-l1-e1-l2-f1的分子式;以及第二多肽链,所述第二多肽链从n端到c端包括分子式c-l3-f2,其中f1和f2是异二聚体fc结构域的亚基,l1、l2和l3是肽接头,e1是il-2rβecd或其功能类似物,e2是il-2rγecd或其功能类似物,并且c是包括il-2多肽(例如,野生型人il-2或其突变蛋白)的细胞因子部分。
76.在一些实施例中,本发明的il-2融合分子是包括第一多肽链和第二多肽链的异二聚体,所述第一多肽链和所述第二多肽链从n端到c端包括选自以下对的分子式:
77.a.f1-l1-e1和f2-l2-c-l3-e2;
78.b.f1-l1-e1和f2-l2-e2-l3-c;
79.c.f1-l1-e2和f2-l2-c-l3-e1;
80.d.f1-l1-e2和f2-l2-e1-l3-c;
81.e.e1-l1-f1和e2-l2-c-l3-f2;
82.f.e1-l1-f1和c-l2-e2-l3-f2;
83.g.e2-l1-f1和e2-l2-c-l3-f2;以及
84.h.e2-l1-f1和c-l2-e1-l3-f2;
85.其中f1和f2是异二聚体fc结构域的亚基,l1、l2和l3是肽接头,e1是il-2rβecd或其功能类似物,e2是il-2rγecd或其功能类似物,并且c是细胞因子部分。
86.在一些实施例中,肽接头l1、l2和l3独立地具有选自seq id no:40-49和55-57的氨基酸序列。
87.在一些实施例中,肽接头l1、l2和l3中的至少一个具有包括至少20-44个氨基酸(例如,至少20个氨基酸、至少25个氨基酸、至少30个氨基酸、至少35个氨基酸、至少40个氨基酸、至少45个氨基酸或至少55个氨基酸)的氨基酸序列。在一些实施例中,肽接头中的至少一个具有至少16个氨基酸、18个氨基酸、20个氨基酸、22个氨基酸、24个氨基酸、26个氨基酸、27个氨基酸、28个氨基酸、29个氨基酸、31个氨基酸、32个氨基酸、33个氨基酸、34个氨基酸、36个氨基酸、37个氨基酸、38个氨基酸、39个氨基酸、41个氨基酸或42个氨基酸。
88.在一些实施例中,本发明的il-2融合分子具有如在图1a、图1b、图2a、图2b、图3a、图3b、图4a、图4b、图5a、图5b、图6a、图6b、图7a或图7b中所展示的结构。在特定实施例中,il-2融合分子具有在图10a或10b中所展示的结构。
89.在一些实施例中,分离的融合分子包括:第一多肽链,所述第一多肽链包括与任一选自seq id no:50、51和52的氨基酸序列至少99%相同的氨基酸序列;以及第二多肽链,所述第二多肽链的氨基酸序列与任一选自seq id no:53和54的氨基酸序列至少99%相同。
90.分离的il-2融合分子982c1、c2、d1、d2和982ref包括两条具有在表1中示出的氨基酸序列的多肽链。982cl和982c2分子均包括两个掩蔽部分,所述两个掩蔽部分是il-2rγecd和il-2rβecd。982dl和982d2各自均包括一个掩蔽部分,所述一个掩蔽部分是il-2rβecd。982c2和982d2的il-2部分均包括突变t3a、v69a、p74q和c125s(根据seq id no:1编号)。
91.表1.982c1、c2、d1、d2和982ref的序列
92.分子名称多肽链1多肽链2982clseq id no:50seq id no:53982c2seq id no:52seq id no:54982d1seq id no:50seq id no:53982d2seq id no:52seq id no:54982refseq id no:58seq id no:58
93.a.il-2多肽或突变蛋白
94.在本发明的il-2融合分子中,il-2多肽可以是野生型il-2多肽,如野生型人il-2多肽(seq id no:1),或者il-2突变蛋白,如源自人il-2的il-2突变蛋白。il-2突变蛋白是保留il-2生物学活性中的至少一个或多个方面的il-2衍生物。在一些实施例中,il-2突变蛋白包括与seq id no:1至少95%相同的氨基酸序列。在某些实施例中,il-2突变蛋白具有与seq id no:1相同的长度,但与其不同的是不超过7个氨基酸残基(例如,不超过6个氨基酸残基、不超过5个氨基酸残基、不超过4个氨基酸残基、不超过3个氨基酸残基或不超过2个氨基酸残基)。il-2突变蛋白可以具有针对cd 122和/或cd132降低的亲和力,并且可以包括
选自以下的一个或多个突变:l12g、l12k、l12q、l12s、q13g、el5a、e15g、e15s、h16a、h16d、h16g、h16k、h16m、h16n、h16r、h16s、h16t、h16v、h16y、l19a、l19d、l19e、l19g、l19n、l19r、l19s、l19t、l19v、d20a、d20e、d20f、d20g、d20t、d20w、m23r、r81a、r81g、r81s、r81t、d84a、d84e、d84g、d84i、d84m、d84q、d84r、d84s、d84t、s87r、n88a、n88d、n88e、n88f、n88g、n88m、n88r、n88s、n88v、n88w、n90t、n90s、v91d、v91e、v91g、v91s、i92k、i92r、i92t、i92s、e95g、q126e、q126f、q126g、q126i、q126l、q126m、q126n、q126r、q126v和q126y。除非另有说明,il-2中的所有残基编号均按照seq id no:1的编号。在一些实施例中,il-2突变蛋白可以具有导致对cd25的亲和力增强的突变。此类突变可以选自位置69和74处的突变。在一些实施例中,il-2突变蛋白可以包括选自以下的一个或多个突变:t3a、c125a、c125s和c125g。
95.b.分离的il-2融合分子的掩蔽部分
96.本发明的分离的il-2融合分子中的细胞因子拮抗剂,即掩蔽部分,是il-2rβ或il-2rγ胞外结构域或其功能类似物,如源自人的il-2rβ或il-2rγ(例如,seq id no:3-6之一)。在一些实施例中,il-2融合分子包括至少一个掩蔽部分。例如,融合分子可以包括il-2rβecd和il-2rγecd两者或这些ecd中的仅一个。ecd可以包括人il-2rβ或il-2rγ的整个胞外结构域,或者仅含有其中一部分,只要所述部分仍然能够与il-2部分结合或以其它方式抑制il-2部分与t细胞上的il-2rβ或il-2rγ结合。
97.在一些实施例中,il-2融合分子包括另外的掩蔽部分,所述掩蔽部分是il-2rα的ecd(例如,seq id no:7)或其功能类似物,其中il-2rαecd掩蔽部分通过可切割的肽接头与融合分子中的细胞因子部分、载体部分或另一个掩蔽部分融合。通过可切割的接头与融合分子连接的il-2rα掩蔽部分的存在允许融合分子归巢到靶向位点,而不与非靶向位点中的细胞结合;一旦在靶向位点处,可切割的接头被在靶向位点处以高浓度存在的蛋白酶裂解,从而允许激活的融合分子在靶向位点处结合细胞(例如,treg细胞)上的il-2rα并刺激经结合的细胞。
98.il-2r亚基(α、β或γ)的ecd的功能类似物是指对il-2具有与野生型ecd类似的亲和力的多肽。例如,功能类似物含有野生型ecd的il-2结合核心区并且在类似物的整个长度上可以具有与野生型ecd(例如,seq id no:3-7,下文)至少95%(例如,至少96%、97%、98或99%)相同的序列。
99.c.分离的il-2融合分子的载体部分
100.本发明的il-2融合分子的载体部分可以是抗原结合部分或不是抗原结合部分的部分。载体部分可以改善细胞因子激动剂多肽的pk特性,如血清半衰期,并且还可以将细胞因子激动剂多肽靶向身体中的靶位点,如肿瘤位点。
101.1.抗原结合载体部分
102.载体部分可以是抗体或其抗原结合片段,或免疫粘附素。在一些实施例中,抗原结合部分是具有以下的全长抗体:两条重链和两条轻链、fab片段、fab'片段、f(ab')2片段、fv片段、二硫键连接的fv片段、单结构域抗体、纳米抗体或单链可变片段(scfv)。在一些实施例中,抗原结合部分是双特异性抗原结合部分并且可以与两种不同的抗原或同一抗原上的两种不同的表位结合。抗原结合部分可以为细胞因子激动剂多肽提供另外的和潜在协同的治疗功效。
103.il-2多肽及其掩蔽剂可以与抗原结合部分的轻链和/或重链的n端或c端融合。举
例来说,il-2多肽及其掩蔽剂可以与抗体重链或其抗原结合片段融合或与抗体轻链或其抗原结合片段融合。在一些实施例中,il-2多肽与抗体的一条或两条重链的c端融合,而细胞因子掩蔽剂通过不可切割或可切割的肽接头与细胞因子部分的另一端融合。在一些实施例中,il-2多肽与抗体的重链之一的c端融合,而细胞因子掩蔽剂通过不可切割或可切割的肽接头与抗体的另一重链的c端融合,其中两条重链含有允许两条不同重链特异性配对的突变。
104.形成异二聚体的策略是众所周知的(参见例如spies等人,《分子免疫学(mol imm.)》(2015)67(2)(a):95-106)。例如,分离的il-2融合分子中的两条重链多肽可以通过“杵臼”突变形成稳定的异二聚体。进行“杵臼”突变以促进形成抗体重链的异二聚体,并且所述突变通常用于制备双特异性抗体(例如参见美国专利8,642,745)。例如,抗体的fc结构域可以包括“杵链”的ch3结构域中的t366w突变以及“臼链”的ch3结构域中的t366s、l368a和/或y407v突变。还可以使用ch3结构域之间的另外的链间二硫键,例如通过将y349c突变引入到“杵链”的ch3结构域中并且将e356c或s354c突变引入到“臼链”的ch3结构域中(参见例如merchant等人,《自然生物技术(nature biotech)》(1998)16:677-81)。在其它实施例中,抗体部分可以包括两个ch3结构域之一中的y349c和/或t366w突变以及另一个ch3结构域中的e356c、t366s、l368a和/或y407v突变。在某些实施例中,抗体部分可以包括两个ch3结构域之一中的y349c和/或t366w突变以及另一个ch3结构域中的s354c(或e356c)、t366s、l368a和/或y407v突变,其中另外的y349c突变位于一个ch3结构域中并且另外的e356c或s354c突变位于另一个ch3结构域中,从而形成链间二硫键(始终根据kabat的eu指数编号;kabat等人,《具有免疫学意义的蛋白质序列(sequences of proteins of immunological interest)》,第5版,马里兰州贝塞斯达国立卫生研究院公共卫生署(public health service,national institutes of health,bethesda,md.)(1991))。可以可替代地或另外地使用其它杵臼技术,如在ep1870459a1中所述的杵臼技术。因此,抗体部分的杵臼突变的另一个实例是具有在“杵链”的ch3结构域中的r409d/k370e突变以及在“臼链”的ch3结构域中的d399k/e357k突变(eu编号)。
105.在一些实施例中,分离的il-2融合分子中的抗体部分包括其fc结构域中的l234a和l235a(“lala”)突变。lala突变消除了补体结合和固定以及fcγ依赖性adcc(参见例如,hezareh等人,《病毒学杂志(j.virol.)》(2001)75(24):12161-8)。在另外的实施例中,抗体部分中除了杵臼突变之外,还存在lala突变。
106.在一些实施例中,抗体部分包括fc结构域中的m252y/s254t/t256e(“yte”)突变。yte突变允许同时调节血清半衰期、组织分布和igg1的活性(参见dall'acqua等人,《生物化学杂志(j biol chem.)》(2006)281(33):23514-24;以及robbie等人,《抗微生物剂与化疗(antimicrob agents chemother.)(2013)57(12):6147-53)。在另外的实施例中,除了杵臼突变之外,yte突变存在于抗体部分中。在特定实施例中,抗体部分具有yte、lala和杵臼突变或其任何组合。
107.在一些实施例中,抗原结合部分与il-1β、il-1β受体、il-4、il-4受体、il-6、il-6受体、il-13、il-13受体、il-17、il-17受体、il-23、il-23受体、tnfα或tnfα受体结合。
108.2.其它载体部分
109.其它非抗原结合载体部分可以用于本发明的分离的il-2融合分子。例如,可以使
用抗体fc结构域(例如,人igg1、igg2、igg3或igg
4 fc)、聚合物(例如,peg)、白蛋白(例如,人白蛋白)或其片段或纳米颗粒。
110.举例来说,il-2多肽及其拮抗剂可以与抗体fc结构域融合,从而形成fc融合蛋白。在一些实施例中,il-2多肽(直接或通过肽接头)与fc结构域多肽链之一的c端或n端融合,并且细胞因子掩蔽剂通过不可切割或可切割的肽接头与另一fc结构域多肽链的c端或n端融合,其中两条fc结构域多肽链含有允许两条不同fc链特异性配对的突变。在一些实施例中,fc结构域包括上述臼到臼突变。在另外的实施例中,fc结构域还可以包括上述yte和/或lala突变。在一些实施例中,fc结构域包括在n297处的突变(eu编号)。
111.分离的il-2融合分子的载体部分可以包括白蛋白(例如,人血清白蛋白)或其片段。在一些实施例中,白蛋白或白蛋白片段与人血清白蛋白或其片段约85%或更多、约90%或更多、约91%或更多、约92%或更多、约93%或更多、约94%或更多、约95%或更多、约96%或更多、约97%或更多、约98%或更多、约99%或更多、约99.5%或更多、或约99.8%或更多相同。
112.在一些实施例中,载体部分包括长度为以下的白蛋白片段(例如,人血清白蛋白片段):约10个氨基酸或更多个氨基酸、20个氨基酸或更多个氨基酸、30个氨基酸或更多个氨基酸、40个氨基酸或更多个氨基酸、50个氨基酸或更多个氨基酸、60个氨基酸或更多个氨基酸、70个氨基酸或更多个氨基酸、80个氨基酸或更多个氨基酸、90个氨基酸或更多个氨基酸、100个氨基酸或更多个氨基酸、120个氨基酸或更多个氨基酸、140个氨基酸或更多个氨基酸、160个氨基酸或更多个氨基酸、180个氨基酸或更多个氨基酸、200个氨基酸或更多个氨基酸、250个氨基酸或更多个氨基酸、300个氨基酸或更多个氨基酸、350个氨基酸或更多个氨基酸、400个氨基酸或更多个氨基酸、450个氨基酸或更多个氨基酸、500个氨基酸或更多个氨基酸或550个氨基酸或更多个氨基酸。在一些实施例中,白蛋白片段的长度介于约10个氨基酸与约584个氨基酸之间(如长度介于约10个氨基酸与约20个氨基酸之间、介于约20个氨基酸与约40个氨基酸之间、介于约40个氨基酸与约80个氨基酸之间、介于约80个氨基酸与约160个氨基酸之间、介于约160个氨基酸与约250个氨基酸之间、介于约250个氨基酸与约350个氨基酸之间、介于约350个氨基酸与约450个氨基酸或介于约450个氨基酸与约550个氨基酸之间)。在一些实施例中,白蛋白片段包括sudlow i结构域或其片段,或sudlow ii结构域或其片段。
113.d.分离的融合分子的接头部分
114.il-2多肽可以在具有或不具有肽接头的情况下与载体部分融合。肽接头可以是可切割的或不可切割的。在一些实施例中,细胞因子部分通过肽接头与载体融合,其中所述肽接头选自seq id no:40-46和55-57。在特定实施例中,肽接头包括seq id no:42、44、45、46、55、56或57的氨基酸序列。掩蔽部分可以通过不可切割或可切割接头或不使用肽接头与细胞因子部分或载体融合。可切割的接头可以包含一个或多个(例如,两个或三个)可切割的部分(cm)。每个cm可以是选自以下的酶或蛋白酶的底物:豆荚蛋白、纤溶酶、tmprss-3/4、mmp-2、mmp-9、mt1-mmp、组织蛋白酶、胱天蛋白酶、人中性粒细胞弹性蛋白酶、β分泌酶、upa和psa。在一些实施例中,掩蔽部分通过肽接头与载体融合,其中所述肽接头选自seq id no:40-46、55、56和57。在特定实施例中,肽接头包括seq id no:42、44、45、46、55、56或67的氨基酸序列。在一些实施例中,所述肽接头至少包括10个氨基酸、12个氨基酸、14个氨基酸、
16个氨基酸、17个氨基酸、18个氨基酸、19个氨基酸、20个氨基酸、21个氨基酸、22个氨基酸、25个氨基酸、27个氨基酸或30个氨基酸。
115.在下文序列部分中示出了il-2多肽、细胞因子掩蔽剂、载体、肽接头和分离的il-2融合分子的具体的非限制性实例。此外,本公开的分离的融合分子可以通过众所周知的重组技术制备。例如,包括分离的融合分子的多肽链的编码序列的一个或多个表达载体可以转染到哺乳动物宿主细胞(例如,cho细胞)中,并且在允许表达编码序列并将经表达的多肽组装到分离的il-2融合分子复合物中的条件下培养细胞。
116.药物组合物
117.包括本公开的分离的il-2融合分子(即活性药物成分或api)的药物组合物可以通过将具有期望纯度的api与一种或多种任选的药学上可接受的赋形剂以冻干调配物或水溶液的形式混合来制备(例如参见《雷明顿药物科学(remington's pharmaceutical sciences)》,第16版,osol,a.编著(1980))。药学上可接受的赋形剂(或载体)通常在所采用的剂量和浓度下对接受者无毒并且包含但不限于:含有例如磷酸盐、柠檬酸盐、琥珀酸盐、组氨酸、乙酸盐或另一种无机或有机酸或其盐的缓冲液;抗氧化剂,包含抗坏血酸和甲硫氨酸;防腐剂(如十八烷基二甲基苄基氯化铵;氯化六烃季铵;苯扎氯铵;苄索氯铵;酚醇、丁醇或苯甲醇;烷基对羟苯甲酸酯,如甲基或丙基对羟苯甲酸酯;邻苯二酚;间苯二酚;环己醇;3-戊醇;以及间甲酚);低分子量(少于约10个残基)多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其它碳水化合物,包含蔗糖、葡萄糖、甘露糖或糊精;螯合剂,如edta;糖,如蔗糖、甘露醇、海藻糖或山梨糖醇;成盐反离子,如钠;金属络合物(例如,zn-蛋白络合物);和/或非离子表面活性剂,如聚乙二醇(peg)。
118.缓冲液用于将ph控制在优化治疗效果的范围内,尤其是在稳定性取决于ph的情况下。缓冲液优选地以范围为约50mm到约250mm的浓度存在。与本发明一起使用的合适缓冲液包含有机酸和无机酸及其盐,如柠檬酸盐、磷酸盐、琥珀酸盐、酒石酸盐、富马酸盐、葡糖酸盐、草酸盐、乳酸盐和乙酸盐。此外,缓冲液可以包括组氨酸和三甲胺盐,如tris。
119.添加防腐剂以减缓微生物生长,并且通常以0.2%-1.0%(w/v)的范围存在。与本发明一起使用的合适的防腐剂包含:十八烷基二甲基苄基氯化铵;氯化六烃季铵;苄烷铵卤化物(例如氯化物、溴化物、碘化物)、苄索氯铵;硫柳汞、苯酚、丁醇或苯甲醇;烷基对羟苯甲酸酯,如甲基或丙基对羟苯甲酸酯;邻苯二酚;间苯二酚;环己醇、3-戊醇和间甲酚。
120.张力剂,有时称为“稳定剂”,的存在用以调节或维持组合物中液体的张力。当与如蛋白质和抗体等大的带电的生物分子一起使用时,张力剂通常被称为“稳定剂”,因为其可以与氨基酸侧链的带电的基团相互作用,由此降低分子间和分子内相互作用的可能性。考虑到其它成分的相对量,张力剂可以以介于0.1重量%到25重量%之间或更优选地介于1重量%到5重量%之间的任何量存在。优选的张力剂包含多元糖醇,优选地三元或更高的糖醇,如甘油、赤藓糖醇、阿拉伯糖醇、木糖醇、山梨糖醇和甘露糖醇。
121.存在非离子表面活性剂或去污剂(也称为“润湿剂”)以帮助溶解治疗剂并保护治疗性蛋白免受搅动诱导的聚集,这也允许调配物暴露于剪切表面应力而不会造成活性治疗性蛋白或抗体的变性。非离子表面活性剂存在的范围为约0.05mg/ml到约1.0mg/ml,优选地约0.07mg/ml到约0.2mg/ml。
122.适合的非离子表面活性剂包含聚山梨酸酯(20、40、60、65、80等)、泊洛沙姆(184、188等)、多元醇、聚氧乙烯脱水山梨糖醇单醚(-20、-80等)、聚桂醇400、聚氧乙烯40硬脂酸酯、聚氧乙烯氢化蓖麻油10、50和60、单硬脂酸甘油酯、蔗糖脂肪酸酯、甲基纤维素和羧甲基纤维素。可以使用的阴离子去污剂包含月桂基硫酸钠、十六烷磺基琥珀酸钠和二辛基磺酸钠。阳离子去污剂包含苯扎氯铵或苄索氯铵。
123.药物载体、赋形剂或稀释剂的选择可以根据预期施用途径和标准药物实践进行选择。药物组合物可以另外地包括任何合适的粘结剂、润滑剂、悬浮剂、涂层剂或增溶剂。
124.根据不同的递送系统,可能有不同的组合物/调配物要求。举例来说,本发明中有用的药物组合物可以调配成使用微型泵或通过粘膜途径施用,例如作为用于吸入或可摄取溶液的鼻喷雾剂或气溶胶,或通过可注射的形式调配组合物以用于肠胃外递送,通过例如静脉内途径、肌肉内途径或皮下途径。
125.在一些实施例中,本公开的药物组合物是冻干蛋白制剂。在其它实施例中,药物组合物可以是水性液体制剂。
126.治疗方法
127.il-2融合分子可以用于治疗炎性疾病或自身免疫性疾病。在一些实施例中,一种治疗受试者的疾病(如自身免疫性疾病)的方法包括向受试者施用有效量的本文公开的分离的il-2融合分子。在一些实施例中,炎性疾病或自身免疫性疾病选自由以下组成的组:哮喘、糖尿病(例如,i型糖尿病或潜伏性自身免疫性糖尿病)、狼疮(例如,全身性红斑狼疮)、关节炎(例如,类风湿性关节炎)、过敏症、器官移植排斥、gvhd、艾迪生氏病(addison's disease)、强直性脊柱炎、抗肾小球基底膜疾病、自身免疫性肝炎、皮炎、古德帕斯丘综合征(goodpasture's syndrome)、肉芽肿性多血管炎、格雷夫斯氏病(graves'disease)、格林-巴利综合征(guillain-barre syndrome)、桥本氏甲状腺炎(hashimoto's thyroiditis)、溶血性贫血、亨-舍二氏紫癜(henoch-schonlein purpura,hsp)、青少年肌炎、川崎氏病(kawasaki disease)、炎性肠病(如克罗恩氏病(crohn's disease)和溃疡性结肠炎)、多发性硬化症、重症肌无力、视神经脊髓炎、pandas、银屑病、银屑病关节炎、干燥综合征(sjogren's syndrome)、全身性硬皮病、全身性硬化症、血小板减少性紫癜、葡萄膜炎、血管炎、白癜风和原田氏病(vogt-koyanagi-harada disease)。
128.通常,本发明的药物组合物的施用剂量和途径是根据标准药学实践根据受试者的体型和病状测定的。在一些实施例中,药物组合物通过任何途径施用于受试者,包含口服施用、经皮施用、通过吸入施用、静脉内施用、动脉内施用、肌肉内施用、直接应用到伤口部位、应用到外科手术部位、腹膜内施用、通过栓剂施用、皮下施用、皮内施用、经皮施用、通过雾化施用、胸膜内施用、心室内施用、关节内施用、眼内施用、颅内施用或脊柱内施用。在一些实施例中,将组合物静脉内施用于受试者。
129.在一些实施例中,药物组合物的剂量是单个剂量或重复剂量。在一些实施例中,所述剂量每天一次、每天两次、每天三次、或每天四次或更多次向受试者给予。在一些实施例中,一周内给予约1个或更多个(例如,约2个、3个、4个、5个、6个或7个或更多个)剂量。在一些实施例中,药物组合物每周施用一次、每2周施用一次、每3周施用一次、每4周施用一次、3周中的两周每周施用一次或4周中的3周每周施用一次。在一些实施例中,在几天、几周、几
个月或几年的过程中给予多剂量。在一些实施例中,一个疗程为约1个剂量或更多个剂量(如约2个剂量、3个剂量、4个剂量、5个剂量、7个剂量、10个剂量、15个剂量或20或更多个剂量)。
130.除非本文另外定义,否则结合本公开使用的科学和技术术语应具有本领域的普通技术人员通常理解的含义。下文描述了示例性方法和材料,但是与本文所述的那些方法和材料类似或等同的方法和材料也可以用于本公开的实践或测试。在发生冲突的情况下,应以本说明书(包含定义)为准。通常,本文所述的与细胞和组织培养、分子生物学、免疫学、微生物学、遗传学、分析化学、合成有机化学、药用和药物化学以及蛋白质和核酸化学和杂交结合使用的术语表和技术是本领域众所周知和常用的术语表和技术。如本领域通常实现的或如本文所描述的来根据制造商的说明执行酶促反应和纯化技术。此外,除非上下文另外要求,否则单数术语应包含复数含义并且复数术语应包含单数含义。贯穿本说明书和实施例,词语“具有(have)”“包括(comprise)”或如“具有(has)”、“具有(having)”“包括(comprises)”或“包括(comprising)”等变体应当被理解为暗示包含所陈述整数或整数组,但不排除任何其它整数或整数组。应当理解,本文所述的本发明的方面和变体包含“由方面和变体组成”和/或“基本上由方面和变体组成”。本文提及的所有出版物和其它参考文献以全文引用的方式并入。尽管本文引用了许多文件,但此引用并不构成承认这些文件中的任何文件形成本领域公知常识的一部分。
131.示例性实施例
132.本公开的另外的特定实施例描述如下。这些实施例旨在说明本公开中描述的组合物和方法,并不旨在限制本公开的范围。
133.1.一种il-2rβ-ecd突变体,其包括一个或多个点突变,其中所述il-2rβ-ecd突变体与野生型相比具有增强的热稳定性。
134.2.根据实施例1所述的il-2rβ-ecd突变体,其包括选自以下的位置处的一个或多个突变:δl-5(前五个氨基酸的缺失)f11、v21、l28、w38、l51、p52、v53,163、p67,177、v88、v92、m93,195、m107,1110、vi15、p156、l157、q162、q164、w166、p174、l187、f191、p196、p200、p207、w90、h150、w152、w166、w194和w197(根据seq id no:3编号)。
135.3.根据实施例1所述的il-2rβ-ecd突变体,其包括选自以下组的位点处的突变(根据seq id no:3编号):
136.a.f11和f191;
137.b.l51、p52和v53;
138.c.v92、m93、195;
139.d.m107、p196、1110;以及
140.e.p156和l157。
141.4.根据实施例2或3所述的il-2rβ-ecd突变体,其中所述疏水性氨基酸突变为选自s、g、n、t和q的亲水性氨基酸。
142.5.根据实施例3所述的il-2rβ-ecd突变体,其包括选自以下组的突变(根据seq id no:3编号):
143.a.f11s和f191g;
144.b.l51s、p52g和v53s;
145.c.v92s、m93g、i95g;
146.d.m107g、p196s、i110g;以及
147.e.p156s和l157g;
148.f.w166n;
149.g.q164e;
150.h.w166n、v115s;
151.i.w152n;
152.j.w152n、w166n;
153.k.v92s;
154.l.w166n、v92s;
155.m.l157s;
156.n.w165n、w157s。
157.6.根据实施例1所述的il-2rβ-ecd突变体,其包括选自seq id no:47、48和49的氨基酸序列。
158.7.一种可用于治疗炎性疾病和自身免疫性疾病的分离的il-2融合分子,所述分离的il-2融合分子包括细胞因子部分和掩蔽部分,其中所述细胞因子部分包括il-2多肽或il-2突变蛋白,并且所述掩蔽部分包括il-2rβ的胞外结构域(ecd)或其功能类似物或突变体;并且其中所述融合分子在体外测定中相对于其它t细胞或nk细胞优先地刺激t调节性细胞。
159.8.根据实施例7所述的分离的il-2融合分子,其中所述融合分子在ctll-2细胞增殖测定中的ec50值小于约1nm。
160.9.根据实施例7所述的分离的il-2融合分子,其中所述融合分子在ctll-2细胞增殖测定中的ec50值小于约0.1nm。
161.10.根据实施例7到9中任一项所述的分离的融合分子,其中所述掩蔽部分包括根据实施例1到6中任一项所述的il-2rβ-ecd突变体。
162.11.根据实施例7到10中任一项所述的分离的融合分子,其进一步包括il-2rγ的胞外结构域(ecd)或其功能类似物。
163.12.根据实施例7到11中任一项所述的分离的融合分子,其进一步包括载体。
164.13.根据实施例12所述的分离的融合分子,其中所述掩蔽部分通过可切割或不可切割的肽接头与载体部分连接。
165.14.根据实施例7到13中任一项所述的分离的融合分子,其中所述il-2多肽或il-2突变蛋白包括与seq id no:1至少95%相同的氨基酸序列;并且其中所述il-2rβecd或其功能类似物或突变体具有与seq id no:3至少95%相同的氨基酸序列。
166.15.根据实施例7到13中任一项所述的分离的融合分子,其中所述il-2突变蛋白具有如在seq id no:2示出的氨基酸序列。
167.16.根据实施例7到13中任一项所述的分离的融合分子,其中所述il-2突变蛋白具有选自以下的至少一个突变:l12g、l12k、l12q、l12s、q.13g、e15a、e15g、e15s、hi6a、h16d、h16g、h16k、h16m、h16n、h16r、h16s、h16t、h16v、h16y、l19a、l19d、l19e、l19g、l19n、l19r、l19s、l19t、l19v、d20a、d20e、d20f、d20g、d20t、d20w、m23r、r81a、r81g、r81s、r81t、d84a、
d84e、d84g、d84i、d84m、d84q d84r、d84s、d84t、s87r、n88a、n88d、n88e、n88f、n88g、n88m、n88r、n88s、n88v、n88w、n90t、n90s、v91d、v91e、v91g、v91s、i92k、i92r、i92t、i92s、e95g、q126e、q126f、q126g、q126i、q126l、q126m、q126n、q126r、q126v和q126y(根据seq id no:1编号)。
168.17.根据实施例7到16中任一项所述的分离的融合分子,其中所述载体部分选自:peg分子、白蛋白、白蛋白片段、抗体fc结构域或抗体或其抗原结合片段。
169.18.根据实施例17所述的分离的融合分子,其中所述载体部分包括在n297处具有突变和/或突变l234a和l235a(“lala”)的抗体fc结构域(eu编号)。
170.19.根据实施例17或18所述的分离的融合分子,其中所述载体部分包括抗体fc结构域,所述抗体fc结构域包括杵臼突变,并且其中所述细胞因子部分和所述掩蔽部分与所述抗体fc结构域的不同多肽链融合。
171.20.根据实施例19所述的分离的融合分子,其中所述细胞因子部分和所述掩蔽部分与所述fc结构域的所述两条不同多肽链的c端融合或与所述抗体的两条不同重链的c端融合。
172.21.根据实施例19所述的分离的融合分子,其中所述载体是抗体fc结构域,并且其中所述细胞因子部分和所述掩蔽部分与所述fc结构域的所述两条不同多肽链的n端融合。
173.22.根据实施例12所述的分离的融合分子,其中所述载体部分是抗体fc结构域,并且其中所述分离的融合分子包括:第一多肽链,所述第一多肽链包括选自f1-l1-e1、f1-l1-e1-l2-e2和f1-l1-e2-l2-e1的分子式;以及第二多肽链,所述第二多肽链包括分子式f2-l3-c,其中所述f1和f2是形成异二聚体的所述fc结构域的亚基,l1、l2和l3是肽接头,e1是il-2rβecd或其功能类似物,并且e2是il-2rγecd或其功能类似物,并且c是所述细胞因子部分。
174.23.根据实施例12所述的分离的融合分子,其中所述载体部分是抗体fc结构域,并且其中所述分离的融合分子包括:第一多肽链,所述第一多肽链包括选自e1-l1-f1、e1-l1-e2-l2-f1和e2-l1-e1-l2-f1的分子式;以及第二多肽链,所述第二多肽链包括分子式c-l3-f2,其中所述f1和f2是形成异二聚体的所述fc结构域的亚基,l1、l2和l3是肽接头,e1是il-2rβecd或其功能类似物,并且e2是il-2rγecd或其功能类似物,并且c是所述细胞因子部分。
175.24.根据实施例12所述的分离的融合分子,其中所述载体部分是抗体fc结构域,并且其中所述分离的融合分子包括第一多肽链和第二多肽链,所述第一多肽链和所述第二多肽链包括选自以下对的分子式:
176.a.f1-l1-e1和f2-l2-c-l3-e2;
177.b.f1-l1-e1和f2-l2-e2-l3-c;
178.c.f1-l1-e2和f2-l2-c-l3-e1;
179.d.f1-l1-e2和f2-l2-e1-l3-c;
180.e.e1-l1-f1和e2-l2-c-l3-f2;
181.f.e1-l1-f1和c-l2-e2-l3-f2;
182.g.e2-l1-f1和e2-l2-c-l3-f2;以及
183.h.e2-l1-f1和c-l2-e1-l3-f2;
184.其中所述f1和f2是形成异二聚体的fc结构域的亚基,l1、l2和l3是肽接头,e1是il-2rβecd或其功能类似物,并且e2是il-2rγecd或其功能类似物,并且c是所述细胞因子部分。
185.25.根据实施例22到24中任一项所述的分离的融合分子,其中所述il-2rβecd具有与seq id no:3的氨基酸序列至少95%相同的氨基酸序列,所述il-2rγecd具有如在seq id no:6中示出的氨基酸序列,并且所述细胞因子部分包括具有与seq id no:2的氨基酸序列至少95%相同的氨基酸序列的il-2突变蛋白。
186.26.根据实施例21到25中任一项所述的分离的融合分子,其中所述fc结构域包括杵臼突变。
187.27.根据实施例18到26中任一项所述的分离的融合分子,其中所述杵臼突变包括在所述fc结构域的多肽链上的t366y“杵”突变以及在所述fc结构域的另一多肽中的y407t“臼”突变(eu编号)。
188.28.根据实施例18到21和26中任一项所述的分离的融合分子,其中所述杵臼突变包括在“杵链”的ch3结构域中的y349c和/或t366w突变以及在“臼链”的ch3结构域中的e356c、t366s、l368a和/或y407v突变(eu编号)。
189.29.根据实施例12所述的分离的融合分子,其中所述载体部分是抗体fc结构域,并且其中所述融合分子包括:第一多肽链,所述第一多肽链包括与任一选自seq id no:8-11、28、29和30的氨基酸序列至少99%相同的氨基酸序列;以及第二多肽链,所述第二多肽链具有与任一选自seq id no:16-21的氨基酸序列至少99%相同的氨基酸序列。
190.30.根据实施例12所述的分离的融合分子,其中所述载体部分是抗体fc结构域,并且其中所述融合分子包括:第一多肽链,所述第一多肽链包括与任一选自seq id no:12-15、31、32和33的氨基酸序列至少99%相同的氨基酸序列;以及第二多肽链,所述第二多肽链具有与任一选自seq id no:22-27的氨基酸序列至少99%相同的氨基酸序列。
191.31.根据实施例29或30所述的分离的融合分子,其中所述fc结构域进一步包括n297a或n297g的突变(eu编号)。
192.32.根据实施例12所述的分离的融合分子,其中所述载体是igg4 fc,其还包括杵臼突变。
193.33.根据实施例32所述的分离的融合分子,其包括:第一多肽链,所述第一多肽链包括与任一选自seq id no:50、51和52的氨基酸序列至少99%相同或100%相同的氨基酸序列;以及第二多肽链,所述第二多肽链具有与任一选自seq id no:53和54的氨基酸序列至少99%相同或100%相同的氨基酸序列。
194.34.根据实施例22到24中任一项所述的分离的融合分子,其中所述肽接头l1、l2和l3独立地具有选自seq id no:40-46、55-57、59和60的氨基酸序列。
195.35.根据实施例22到24中任一项所述的分离的融合分子,其中所述肽接头l1、l2和l3中的至少一个具有包括20-44个氨基酸的氨基酸序列。
196.36.根据实施例7到11中任一项所述的分离的融合分子,其中所述融合分子与具有α、β和γ亚基的高亲和力il-2受体(il-2rαβγ)结合的亲和力是与用β和γ亚基形成的中等亲和力il-2受体(il-2rβγ)结合的亲和力的至少100倍。
197.37.根据实施例7到11中任一项所述的分离的融合分子,其以大于约5nm的结合解
离平衡常数(kd)与il-2rβγ结合,如在37℃下在表面等离子共振测定中测量的。
198.38.根据实施例7到37中任一项所述的分离的融合分子,其在体外促进foxp3阳性调节性t细胞生长或存活。
199.39.根据实施例7到37中任一项所述的分离的融合分子,其离体诱导foxp3阳性t细胞中的stat5磷酸化,所述foxp3阳性t细胞包括功能性il-2受体复合物,但诱导foxp3阴性t细胞中的stat5磷酸化的能力降低。
200.40.根据实施例7到11中任一项所述的融合分子,其进一步包括il-2rα的胞外结构域(ecd)或其功能类似物;其中所述il-2rαecd或其功能类似物通过可切割的肽接头与所述融合分子连接。
201.41.根据实施例40所述的融合分子,所述il-2rαecd或其功能类似物包括与在seq id no:7示出的氨基酸序列至少95%相同的氨基酸序列。
202.42.一种多核苷酸,其编码根据实施例7到41中任一项所述的融合分子或根据实施例1到6中任一项所述的il-2rβ-ecd突变体。
203.43.一种表达载体,其包括根据实施例42所述的多核苷酸。
204.44.一种宿主细胞,其包括根据实施例43所述的载体。
205.45.一种制备根据实施例7到41中任一项所述的分离的融合分子的方法,所述方法包括在允许表达所述融合分子的条件下培养根据权利要求44所述的宿主细胞并分离所述融合分子。
206.46.一种药物组合物,其包括根据实施例7到41中任一项所述的分离的融合分子以及药学上可接受的赋形剂。
207.47.一种治疗受试者的炎性疾病或自身免疫性疾病的方法,所述方法包括向有需要的受试者施用治疗有效量的根据实施例7到41中任一项所述的分离的融合分子。
208.48.一种治疗受试者的炎性疾病或自身免疫性疾病的方法,所述方法包括向有需要的受试者施用治疗有效量的根据实施例到46所述的药物组合物。
209.49.根据实施例48所述的方法,其中所述炎性疾病或自身免疫性疾病选自由以下组成的组:哮喘、糖尿病、关节炎、过敏症、器官移植排斥和移植物抗宿主疾病。
210.实例
211.瞬时转染
212.对于使用hek293细胞的瞬时转染,使用pei(聚乙烯亚胺)以2.5-3μg/ml将表达质粒共转染到3
×
106个细胞/ml的自由式hek293细胞中。对于基于fc的il-2分离的il-2融合分子,fc-il-2突变蛋白融合多肽与fc掩蔽部分融合多肽的比率为1:2。对于基于抗体的il-2分离的il-2融合分子,杵重链(含有il-2激动剂多肽)与臼重链(含有掩蔽部分)与轻链dna的摩尔比为2:1:2。转染后6天,通过以9,000rpm离心持续45分钟,随后进行0.22μm过滤,采集细胞培养物。
213.对于使用expicho细胞的瞬时转染,使用expifectamine cho试剂以1-2μg/ml将表达质粒共转染到6
×
106个细胞/mlexpicho-s细胞中。对于982d1,杵重链il-2突变蛋白融合多肽与臼重链(含有β-掩蔽部分多肽)的比率为1:4。类似地,对于982d2,il-2e突变蛋白多肽杵重链与臼重链(含有β-掩蔽部分多肽)的比率为1:4。转染后大约7天,通过以12,000rpm离心持续40分钟,随后进行0.2或0.45μm过滤,采集细胞培养物。
214.蛋白质纯化
215.使用protein a亲和色谱树脂(马萨诸塞州沃尔瑟姆瑞普利金公司(repligen,waltham,ma))对蛋白质il-2融合分子(蛋白质)进行纯化。对于982ref、982c1和982c2样品,使用阴离子交换色谱法在流通模式下用q ff树脂或q hp树脂进行进一步纯化,随后使用capto
tm
mmc impres树脂进行第三柱步骤。对于982d1和982d2样品,使用阴离子交换色谱法在流通模式下用q hp树脂进行进一步纯化,随后使用capto
tm
sp impres树脂进行第三柱步骤。所有和capto
tm
树脂均从电气医疗生命科学公司(ge healthcare life sciences)(现为马萨诸塞州马尔伯勒思拓凡公司(cytiva,marlborough,ma))订购。在体内研究之前,通过sec-hplc分析将样品纯化到至少98%的纯度。在20mm组氨酸、7%蔗糖、0.03%聚山梨酸酯-20中调配样品。将样品储存在-80℃冰箱中,直至使用。
216.蛋白水解处理
217.用1mm的对氨基苯汞乙酸盐(apma,西格玛(sigma)编号a-9563)激活0.1μg/μl的人mmp2(义翘神州(sino biological)编号10082-hnah)。在37℃下,将两百(200)μg的il-2融合分子与0.5μg的人mmp2在含有2mm cac12和10μm znc12的hbs缓冲液(20mm hepes,150mm nac12,ph 7.4)中一起温育持续16小时(过夜)。
218.sds-page分析
219.将十(10)μl的培养上清液或20μg的经纯化的蛋白样品与具有或不具有还原试剂的bolt
tm
lds样品缓冲液(诺威克公司(novex))混合。将样品在70℃下加热持续3分钟,并且然后将其装载到nupage
tm
4-12%的bistris凝胶(英杰公司(invitrogen))中。将凝胶在nupage
tm
mops sds运行缓冲液(英杰公司)中以200伏特运行持续40分钟,并且然后用考马斯蓝染色。
220.图8示出了分离的il-2融合分子jr3.116.5在通过上述蛋白酶处理激活之前(未还原和还原)和激活之后的sds-page分析结果。jr3.116.5包括氨基酸序列分别在seq id no:12和23中示出的两条多肽链,并且具有如图1b所展示的结构。数据表明,蛋白a柱池的大部分是jr3.116.5的预期异二聚体分子。似乎有一小条带的臼链同型二聚体(seq id no:23)。令人惊讶的是,没有明显的未配对链条带或杵链的任何同型二聚体。细胞因子部分与掩蔽剂部分之间的相互作用可能促进杵链(seq id no:12)与臼链(seq id no:23)之间的正确异二聚体化。
221.ctll-2测定
222.使ctll-2细胞在补充有l-谷氨酰胺、10%胎牛血清、10%非必需氨基酸、10%丙酮酸钠和55μmβ-巯基乙醇的rpmi 1640培养基中生长。ctll-2细胞是非贴壁细胞,并在具有100ng/ml的il-2的培养基中维持在5
×
10
4-1
×
106个细胞/ml下。通常,细胞每周分裂两次。对于生物测定,最好在传代后不少于48小时使用细胞。
223.将样品在96孔板中以2
×
浓度在50μl/孔中稀释。将il-2标准品从20ng/ml(2
×
浓度)滴定到12孔的3
×
连续稀释液。适当时,对样品进行滴度测试。将ctll-2细胞洗涤5次以去除il-2,将5000个细胞/孔分配在50μl中并与样品一起培养过夜或至少18小时。随后,添加100μl/孔细胞滴度glo试剂(普洛麦格公司(promega))并测量发光。图9示出了ctll-2分
析的结果。数据表明掩蔽部分将jr3.116.5的活性降低了大约20倍。此外,此掩蔽效应是可逆的,因为通过蛋白酶切割掩蔽部分的激活恢复了融合分子的活性。
224.nk92细胞增殖测定
225.nk92细胞系是一种需要il-2才能生长和存活的因子依赖性细胞系。在测定之前,洗涤nk92细胞以去除il-2并在没有生长因子的情况下培养过夜。采集细胞并再次洗涤以去除残留的生长因子。将细胞重新悬浮到4000,000个细胞/ml。然后将细胞(20,000/孔)添加到96孔板中。将抗cd25抗体,即巴利昔单抗(basiliximab)以10μg/ml添加到一半的板(48孔)中。将细胞温育持续15分钟。将il-2融合分子的连续滴定以50μl/孔添加到每个孔中。将板温育过夜,并且在测量发光之前添加细胞滴度glo(普洛麦格公司)。这提供了作为细胞活力指标的atp水平的量度。图11示出了982d1、982d1和982ref在存在和不存在抗cd25中和抗体的情况下的nk92增殖测定。参考分子(982ref)是il-2具有取代突变v91k和c125a的il-2融合分子(根据seq id no:1编号的il-2部分)。对于用抗cd25抗体进行的测定,将抗cd25抗体以10μg/ml添加到细胞中。
226.数据表明,982ref在刺激nk92细胞增殖方面比982d1和982d2具有更强的活性。当加入中和抗cd25抗体时,所有被测融合分子均示出最小活性。
227.结合测定:大鼠cd4+t细胞
228.对从带有颈静脉套管的雄性斯普拉-道来氏大鼠(sprague-dawley rat)采集的血液样品进行裂解以去除红细胞。将剩余细胞与各种浓度的测试制品982d1或982d2在冰上一起温育持续大约60分钟。将检测抗体、山羊抗人igg fcγ-apc(杰克逊免疫研究实验室(jackson immunoresearch lab.)目录号109-135-170)添加到每个孔中。在温育和随后的洗涤后,添加抗大鼠cd4抗体(bd生物科学公司(bd bioscience),目录号554866)以对大鼠cd4 t细胞进行染色。再次洗涤经染色的样品,并且然后进行流式细胞术分析,以检测il-2融合分子与大鼠cd4
+
t细胞的结合。
229.图12示出了982d1和982d2与大鼠cd4
+
t细胞的结合活性。n.c.代表不相关的ab对照。令人惊讶的是,982d1与大鼠cd4+t细胞的结合在最低程度上仍强于82d2,但差异不显著。
230.结合测定:人cd4+cd25+t细胞
231.将人外周血单核细胞(hpbmc)从血沉棕黄层血液(bioivt和rbc)中分离,并在含有10%的fbs(生命科技公司(life technologies),目录号10099141)的完整培养基rpmi 1640(生命科技公司,目录号12633-020)中培养过夜。第二天,用抗人cd3抗体(百进生物科技公司(biolegend),目录号317302)处理人pbmc持续2天,用完全培养基rpmi 1640洗涤3次,然后静置持续3天。用洗涤缓冲液将细胞调节到4-5
×
106个细胞/ml的浓度,然后将50μl的细胞(200-250k细胞/孔),随后将50μl的il-2融合分子982c1、982d1、982d2和982ref以各种浓度装载到96孔板的对应孔中。在与阴性对照相同的各种浓度范围内添加不相关的ab。在冰上温育持续大约60分钟后,洗涤细胞,然后添加检测抗体、山羊抗人igg fcγ-apc(杰克逊免疫研究实验室,目录号109-135-170)。在充分洗涤以去除游离igg fcγ-apc后,将fitc缀合的小鼠抗人cd4ab(bd生物科学公司,目录号555346)和pe缀合的小鼠抗人cd25 ab(bd生物科学公司,目录号555432)添加到孔中以进行细胞染色。最后,对经染色的样品进行流式细胞术分析,以检测il-2融合分子分别与treg(cd4
+
cd25+)和t
eff
(cd4
+
cd25-)细胞的结
合。
232.图13a和13b示出了982c1、982d1和982ref与人cd4
+
/cd25
+
t细胞和cd4
+
/cd25-t细胞的结合。结果示出,982ref对cd4
+
/cd25
+
t细胞的结合亲和力比982d2、982d1和982c1的结合亲和力强。在此测定中,用抗cd3抗体处理pbmc持续2天,静置持续3天,并且然后在室温下与各种浓度的il-2融合分子982c1、982d1、982ref和缓冲液对照(n.c.)一起孵育持续大约40分钟。添加抗hfc次级抗体,随后进行抗cd4和抗cd25抗体染色。对经染色的样品进行流式细胞术分析,以检测il-2融合分子分别在treg(cd4
+
cd25
+
)和t
eff
(cd4
+
cd25-)细胞上的结合。随后在982c1、982d1和982d2之间的效力比较示出结合效力的等级顺序为982d2》982d1》982c1。982d2的il-2部分包括增强其与cd25结合的两个点突变。这些结果表明,用il-2rβ-ecd掩蔽降低了982d1的结合,而用il-2rβ-ecd和il-2rγ-ecd进行双重掩蔽导致经掩蔽的il-2融合分子982c1的结合进一步降低。尽管在cd4
+
cd25-t细胞中观察到类似的结合活性等级顺序,但982ref、982d1、982d2和982cl结合的相应mfi与在cd4
+
cd25
+
t细胞中相比相对较低,表明il-2融合分子优先结合cd4
+
cd25
+
t细胞。
233.t细胞增殖测定
234.用抗cd3抗体(百进生物科技公司,目录号317302)处理从血沉棕黄层血液(bioivt和rbc)中分离的人pbmc持续2天,并且然后静置持续3天。将细胞与如所指示的各种浓度的il-2融合分子982c1、982d1、982d2或982ref或il-2在37℃、5%的co2温育箱中一起温育持续3天。然后对细胞进行裂解/固定/透化处理,随后用小鼠抗人cd4-fitc(bd生物科学公司,目录号555346)、小鼠抗人cd25-pe(bd生物科学公司,目录号555432)和小鼠抗人ki67 alex-647(bd生物科学公司,目录号558615)进行抗体染色。洗涤后,经染色的细胞分别对treg(cd4
+
cd25
+
)和t
eff
(cd4
+
cd25-)细胞上的ki67+(增殖标志物)细胞进行流式细胞术分析。
235.图14示出了由982d1、982c1、982d2和982ref il-2融合分子诱导的cd4
+
cd25
+
t细胞和cd4+cd25-t细胞的浓度依赖性增殖。在此测定中,用抗cd3抗体处理pbmc持续2天,并静置持续3天。然后,将pbmc与如所指示的各种浓度的il-2融合分子982c1、982d1、982d2或982ref或il-2在37℃、5%的co2温育箱中一起温育持续3天。然后对细胞进行裂解/固定/透化处理,并用抗cd4、cd25和ki67抗体进行染色。洗涤后,经染色的细胞分别对treg(cd4
+
cd25
+
)和teff(cd4
+
cd25-)细胞上的ki67
+
(增殖标志物)细胞进行流式细胞术分析。
236.il-2融合分子在体外的活性从强到弱的顺序如下:982ref、982d2、982d1和982c1,其中在cd4
+
cd25
+
t细胞中观察到的总体增殖比在cd4
+
cd25-t细胞中观察到的总体增殖大得多。总之,结果示出982ref在所有三种体外测定中具有最强的活性,顺序依次为982d2、982d1和982c1。这些结果与在图13中示出的结合活性结果一致。
237.大鼠pk和pd研究
238.向带有颈静脉套管的雄性斯普拉-道来氏大鼠皮下给药1mg/kg或3mg/kg的il-2融合分子。在0-144小时的不同时间点对血液进行取样。
239.对于pk分析,通过elisa对测试制品的血清样品进行测定。简而言之,将elisa板在pbs中以2μg/ml涂覆有100μl/孔的f(ab')2山羊抗人iggfcγ(杰克逊免疫研究实验室,目录号109-006-170)。将板在4℃下孵育过夜。用100μl/孔的pbs/10%山羊血清封闭板。在孵育1小时并随后洗涤(用di水洗涤四次)后,将100μl的在pbs/10%山羊血清或标准品中稀释的
血清样品添加到每个孔中。在温育(1小时)和洗涤(用di水洗涤6次)后,向每个孔中添加100μl在pbs/10%山羊血清中的0.5μg/ml的第二抗体(抗il2-生物素(r&d系统公司(r&d systems)baf202)。在温育(1小时)和洗涤(用di水洗涤6次)后,向每个孔中添加100μl在pbs/10%山羊血清中的链霉亲和素-hrp(杰克逊免疫研究实验室,目录号016-30-84,1:1000)。在温育(1小时)和洗涤(用di水洗涤8次)后,通过向每个孔中添加100μl的tmb底物开始显色反应。通过添加100μl/孔的in h2so4溶液终止反应。然后测量od450。
240.图15示出了来自大鼠pk研究的982c1、982d1和982ref il-2融合分子的血清血浆浓度随时间推移的变化。在此测定中,向带有颈静脉套管的雄性斯普拉-道来氏大鼠皮下给药1mg/kg的il-2融合分子982c1、982d1和982ref。在0小时、1小时、3小时、6小时、10小时、24小时、48小时、72小时、96小时、120小时和144小时对血液进行取样。通过elisa使用山羊抗人igg fcγ捕获和抗人il-2生物素作为检测试剂来测定血清样品中的il-2融合分子。982c1的auc
(0-t)
(浓度时间曲线下的面积到最后可测量的浓度)大于982d1,而两者的auc
(0-t)
均显著大于982ref。
241.图16示出了来自第二大鼠研究的982d1、982ref和982d2 il-2融合分子的血清血浆浓度随时间推移的变化。在此测定中,向带有颈静脉套管的雄性斯普拉-道来氏大鼠皮下注射1mg/kg的il-2融合分子982d1、982d2和982ref以及3mg/kg的982d1,如所指示的。在0小时、1小时、3小时、6小时、10小时、24小时、48小时、72小时、96小时、120小时和144小时对血液进行取样。通过elisa使用山羊抗人igg fcγ捕获和抗人il-2生物素作为检测试剂来测定血清样品中的测试制品。982d2的auc
(0-t)
大于982d1,而两者的auc
(0-t)
均显著大于982ref。随时间推移变化的血清血浆浓度结果示出,经掩蔽的il-2融合分子比982ref具有更好的pk特性,所述982ref在其il-2部分中具有v91k突变。
242.对于pd分析,在皮下注射982个分子后0-144小时之间的不同时间点对血液进行取样。根据制造商的建议,通过将一体积的每种血液样品与新制备和预温热的bd phosflow
tm
裂解/固定缓冲液(1
×
,bd生物科学公司,目录号558049)混合来裂解和固定从用982il-2融合分子处理的大鼠身上采集到k2 edta采血管中的血液样品。然后,根据制造商的说明,用含有2%fbs的pbs洗涤血液样品2次,随后用冷透化缓冲液ii(bd生物科学公司,目录号558052,-20℃)在冰上进行透化处理持续30分钟。然后用含有2%fbs的pbs充分地洗涤细胞4次,并且将细胞沉淀储存在4℃下或重新悬浮在染色缓冲液中。
243.对于foxp3和ki67测量,将来自每次取样的50μl/孔的上述固定/透化处理的大鼠血细胞(300k-400k细胞/孔)的等分试样添加到96孔工作板中。然后将含有小鼠抗大鼠cd4-fitc(百进生物科技公司,目录号201505)、小鼠抗大鼠cd25-pe(bd生物科学公司,目录号554866)和小鼠抗大鼠foxp3-apc(百进生物科技公司,目录号320014);或小鼠抗ki67-apc(百进生物科技公司,目录号320514)的50μl的ab混合物添加到每个孔中,并将板中的细胞在室温下温育持续1小时。将板用facs缓冲液洗涤2次,并且然后分别对treg(cd4
+
foxp3
+
)和teff(cd4
+
foxp3-)细胞进行流式细胞术分析,以得到随时间推移变化的变化%。所述板还分别对门控treg(cd4
+
cd25
+
)和t
eff
(cd4
+
cd25-)细胞中的ki67
+
(增殖标志物)细胞进行流式细胞术分析,以得到随时间推移变化的变化%。
244.图17a和17b示出了由982c1、982d1和982ref il-2融合分子在cd4
+
/foxp3
+
和cd4
+
/foxp3-细胞(在大鼠体内)中诱导的变化。图18a和18b示出了由来自第一研究的大鼠中的
982c1、982d1和982ref il-2融合分子诱导的cd4
+
cd25
+
和cd4
+
cd25-细胞的增殖。向带有颈静脉套管的雄性斯普拉-道来氏大鼠皮下给药1mg/kg的il-2融合分子982c1、982d1和982ref。在0小时、24小时、48小时、96小时和144小时对血液进行取样,并在血液样品裂解/固定/透化处理后进行ab染色。随后分别对treg(cd4
+
foxp3
+
)和teff(cd4
+
foxp3-)细胞进行流式细胞术分析,以得到随时间推移变化的变化%(图17a和17b)或分别对门控treg(cd4
+
cd25
+
)和t
eff
(cd4xd25-)细胞中的ki67+(增殖标志物)细胞进行流式细胞术分析,以得到随时间变化的变化%(图18a和18b)。图19a和19b示出了由大鼠中的982il-2融合分子诱导的cd4
+
/foxp3
+
和cd4
+
/foxp3-细胞变化的结果。图20a和20b示出了大鼠中的cd4
+
/cd25
+
和cd4
+
/cd25-细胞的982-il-2融合分子诱导的增殖的结果。向带有颈静脉套管的雄性斯普拉-道来氏大鼠皮下给药1mg/kg和3mg/kg的il-2融合分子982d1、1mg/kg的982d2和1mg/kg的982ref。在0小时、24小时、48小时、72小时、96小时、120小时和144小时对血液进行取样,并在血液样品裂解/固定/透化处理后进行ab染色。随后分别对treg(cd4
+
foxp3
+
)和teff(cd4
+
foxp3-)细胞进行流式细胞术分析,以得到随时间推移变化的变化%(图19a和19b)或分别对门控treg(cd4
+
cd25
+
)和t
eff
(cd4
+
cd25-)细胞中的ki67+(增殖标志物)细胞进行流式细胞术分析,以得到随时间推移变化的变化%(图20a和20b)。
245.结果表明,982d1相较于982ref对cd4
+
foxp3
+
t细胞和cd4
+
cd25
+
t细胞具有更强的作用效果和更长的作用时间。令人惊讶的是,观察到考虑到982ref的体外活性显著较高。在第二体内大鼠研究中进行了类似的观察(图19a、19b、20a和20b)。令人惊讶的是,982d1在刺激大鼠中的cd4
+
/foxp3
+
t细胞和cd4
+
/cd25
+
以及cd4
+
/cd25-细胞的增殖方面也示出比982d2(图19a、19b、20a和20b)更大的体内功效。这与在结合测定中示出982d1对大鼠cd4 t细胞的结合活性略高于982d2对大鼠cd4 t细胞的结合活性的发现非常吻合(图12)。然而,在982d1与982d2之间观察到的活性差异在体内比在体外更明显(图19a和20a)。
246.虽然982d1和982ref两者在优先刺激treg细胞方面而不是t
eff
细胞方面示出了选择性,但显然982d1比982ref具有更好的选择性,如与982ref相比,982d1在刺激t
eff
细胞方面几乎无活性(图18b和20b)。
247.体重
248.为了评估il-2融合分子的安全性,在6天研究过程中还测量了动物的体重。动物接受单次皮下施用1mg/kg和3mg/kg的il-2融合分子982d1、1mg/kg的982d2和1mg/kg的982ref。在第0天(给药)与第6天之间每天测量每只动物的体重(bw)。在图21中示出了结果。数据表明,接受单次注射1mg/kg和3mg/kg的982d1的大鼠比接受1mg/kg的982ref的大鼠体重增加更多。
249.总之,上述体外和体内研究表明,经掩蔽的il-2融合分子982d1比982ref具有更令人惊讶的pk特性,所述982ref是在其il-2部分中包括突变v91k和c125a的同型二聚体il-2融合分子。令人惊讶的是,982d1在刺激大鼠中的cd4+cd25+t细胞和cd4+foxp3+t细胞的增殖方面具有比982ref更强的体内活性(图17a、17b、18a、18b、19a、19b、20a和20b)。此外,所有三种经掩蔽的il-2融合分子(982c1、982d1和982d2)的pk均比982ref长(图15和16)。同样令人惊讶的是,982d1在大鼠中的体内活性比982d2在大鼠中的体内活性更强。尽管与982d2和982ref相比,982d1在体外的活性相对适中,但与在同一大鼠研究中测试的其它分子相比,982d1也具有更好的体内活性。此外,体重数据(图21)表明982d1可能比982ref更安全。
同样令人惊讶的是,经掩蔽的il-2融合分子982d1的有效且选择性的体内活性可以在不需要蛋白酶依赖性切割和去除掩蔽部分的情况下实现,因为982d1不包括任何可切割的肽接头。这种新的作用模式是期望的,因为蛋白酶在疾病部位处的分布可能不均匀,并且掩蔽部分的非特异性切割和去除(或“泄漏”)可能在循环中发生或在其它正常组织和疾病部位之外发生。
250.在不希望受理论束缚的情况下,pk特性的差异可能部分地解释了982d1相较于982ref的优越的体内活性。物种交叉反应性可能部分解释了在982d1与d2之间观察到的体内活性的差异。在不希望受理论束缚的情况下,当内源性il-2rα和il-2rγ两者同时存在时,在融合分子与cd25结合后,982d1中的掩蔽部分与载体之间的长接头也可能促进内源性il-2rβecd与掩蔽部分的竞争。细胞因子部分与内源性il-2rβ和il-2rγ两者的结合是982d1刺激treg细胞的扩增所必需的。掩蔽部分il-2rβ-ecd与载体之间的长接头可以提供细胞因子部分与内源性il-2rα、il-2rβ和il-2rγ形成四聚体复合物所需的灵活性。如果掩蔽部分il-2rβ-ecd与载体之间的接头短,并且尤其是如果细胞因子部分与载体之间的接头也短,则所述掩蔽部分将可能成为形成四聚体复合物的特殊约束。图11示出了982d2与大鼠cd4
+
t细胞的结合略弱于dl,尽管982d2与人t细胞的体外活性比982d1强。然而,与大鼠cd4
+
细胞结合的差异相对适中,并且可能无法解释d1与d2(图19a、19b、20a和20b)之间的体内活性的显著差异。
251.序列
252.在下面的序列中,加框的残基表示突变。可切割接头中的下划线表示蛋白酶底物序列。
253.seq id no:1-人il-2
[0254][0255]
seq id no:2-人il-2突变蛋白
[0256][0257]
其中x
aa3
选自t和a,并且x
aa125
选自a、s和g。
[0258]
seq id no:3-人il-2受体β亚基胞外结构域(https://www.uniprot.org/uniprot/p147 84)
[0259][0260]
seq id no:4-人il-2受体β亚基胞外结构域突变体d68e(https://www.uniprot.org/uniprot/p14784)
[0261][0262]
seq id no:5-人il-2受体β亚基胞外结构域突变体e136q/h138r(https://www.uniprot.org/uniprot/p147 84)
[0263][0264]
seq id no:6-人il-2受体γ亚基胞外结构域(http://www.uniprot.org/uniprot/p317 85)
[0265][0266]
seq id no:7il-2rα胞外结构域
[0267][0268]
seq id no:8-igg1fc(具有lala和杵)-il-2-t3a/c125s
[0269][0270]
seq id no:9-igg1fc(具有lala和杵)-il-2-t3a/c125s/n88r
[0271]
[0272]
seq id no:10-igg1fc(具有lala和杵)-il-2-t3a/c125s/v91k
[0273][0274]
seq id no:11-igg1fc(具有lala和杵)-il-2-t3a/c125s/q126n
[0275][0276]
seq id no:12-igg1fc(具有lala/yte和杵)-il-2-t3a/c125s
[0277][0278]
seq id no:13-igg1fc(具有lala/yte和杵)-il-2-t3a/c125s/n88r
[0279][0280]
seq id no:14-igg1fc(具有lala/yte和杵)-il-2-t3a/c125s/v91k
[0281][0282]
seq id no:15-igg1fc(具有lala/yte和杵)-il-2-t3a/c125s/q126n
[0283][0284]
seq id no:16-具有lala/臼/il-2rβ的igg1fc
[0285][0286]
seq id no:17-具有lala/臼/il-2rβ/可切割接头的igg1fc
[0287][0288]
seq id no:18-具有lala/臼/il2rβ/il2rγ的igg1fc
[0289][0290]
seq id no:19-具有lala/臼/il2rγ/il2rβ的igg1fc
[0291][0292]
seq id no:20-具有lala/臼/il2rβ/可切割接头/il2rγ的igg1fc
[0293][0294]
seq id no:21-具有lala/臼/il2rγ/可切割接头/il2rβ的igg1fc
[0295][0296][0297]
seq id no:22-具有yte/lala/臼/il-2rβ的igg1fc
[0298][0299]
seq id no:23-具有yte/lala/臼/il-2rβ/可切割接头的igg1fc
[0300][0301]
seq id no:24-具有yte/lala/臼/il2rβ/il2rγ的igg1fc
[0302][0303]
seq id no:25-具有yte/lala/臼/il2rγ/il2rβ的igg1fc
[0304][0305]
seq id no:26-具有yte/lala/臼/il2rβ/可切割接头/il2rγ的igg1fc
[0306][0307]
seq id no:27-具有yte/lala/臼/il2rγ/可切割接头/il2rβ的igg1fc
[0308][0309]
seq id no:28-igg1fc(具有lala和杵)-il-2-t3a/c125s/q126g
[0310][0311]
seq id no:29-igg1fc(具有lala和杵)-il-2-t3a/c125s/q126e
[0312][0313]
seq id no:30-igg1fc(具有lala和杵)-il-2-t3a/c125s/i92t
[0314][0315]
seq id no:31-igg1fc(具有lala/yte和杵)-il-2-t3a/c125s/q126g
[0316][0317]
seq id no:32-igg1fc(具有lala/yte和杵)-il-2-t3a/c125s/q126e
[0318][0319]
seq id no:33-igg1fc(具有lala/yte和杵)-il-2-t3a/c125s/i92t
[0320][0321]
seq id no:34-il-2-t3a/c125s/n88r
[0322][0323]
seq id no:35-il-2-t3a/c125s/v91k
[0324][0325]
seq id no:36-il-2-t3a/c125s/q126n
[0326][0327]
seq id no:37-il-2-t3a/c125s/q126g
[0328][0329]
seq id no:38-il-2-t3a/c125s/q126e
[0330][0331]
seq id no:39-il-2-t3a/c125s/i92t
[0332][0333]
seq id no:40-46不可切割的肽接头
[0334][0335]
seq id no:47-49可切割的肽接头
[0336]
gplgvr(seq id no:47)
[0337]
gpanvr(seq id no:48)_
[0338]
gpasge(seq id no:49)
[0339]
seq id no:50-982_cx7_56_5,igg4 fc-il2(c125a),杵链
[0340][0341]
seq id no:51-982_cx7_56_5,igg4 fc-il2(c125a),杵链
[0342][0343]
seq id no:52-982cx7 72 2,fc-igg4-杵-2xg4saa2xg4s-il2(c125s,v69a/q74p)
[0344][0345]
seq id no:53-982_cx7_56_6,具有长接头的igg4 fc-il2rβ-ecd,臼链
[0346]
seq id no:54-982_cx7_56_4,在γ与βecd之间具有较长肽接头的臼链
[0347][0348]
gggsgpasge ggggs(seq id no:55)
[0349]
ggggsgggsg pasgeggggs(seq id no:56)
[0350]
ggggsgggsg pasgeggggs ggggs(seq id no:57)
[0351]
seq id no:58-具有包括突变v91k和c125a的il-2突变蛋白的982-ref
[0352][0353]
seq id no:59-(g4s)2aa(g4s)2接头
[0354]
ggggsggggs aaggggsgggg s
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1