血管内皮干细胞的制造方法
1.本发明涉及血管内皮干细胞的制造方法。
背景技术:
2.与血管相关的疾病被统称为血管病,例如存在恶性肿瘤、视网膜病、慢性炎性疾病、动脉硬化、缺血性疾病等多种疾病。针对这样的疾病,正在积极开发通过控制血管形成来改善疾病的治疗方法。其中,通过使血管再生来改善疾病的治疗被称为治疗性血管新生(therapeutic angiogenesis),是针对因各种原因而导致血管数的降低、血管功能的降低的疾病使血管再生来谋求病情改善的治疗方法。例如,可以列举:1)对心肌缺血、脑缺血、下肢缺血等诱导新血管来改善缺血的治疗、即改善作为血管原来的功能的血液输送的治疗方法;2)针对通常因遗传因素、后天因素使由血管内皮细胞分泌的因子从血管内皮细胞的分泌被抑制从而导致疾病等的疾病(例如,血管内皮细胞中的凝固因子的产生降低而发病的血友病等)的血管再生的治疗方法;3)使疾病器官的血管正常化而使器官的功能恢复的血管再生(例如,针对肝纤维化、肝硬化、肺不张、骨质疏松症、肾功能障碍等的血管再生)等。
3.虽然在基础医学上也开始证明治疗性血管再生对如上所述的疾病是有效的,但实际在临床上应用的是细胞治疗、细胞因子(基因)治疗。例如,作为细胞治疗,有使用存在于骨髓中的血管内皮祖细胞使血管再生的方法。但是,该祖细胞不是干细胞,因此认为由该祖细胞形成的血管不能长期维持。另外,还有注入脂肪组织等的间充质干细胞来诱导血管再生的方法。该方法被认为是通过由间充质干细胞分泌的诱导血管形成的物质使原有血管的血管内皮细胞增殖而使血管再生的方法。但是,不能用于血管再生能力减弱的患者。
4.除了细胞治疗以外,还实施了给用使血管内皮细胞增殖的生长因子的方法。血管内皮细胞生长因子(vascular endothelial growth factor;vegf)为能够最强地诱导血管内皮细胞的增殖的细胞因子。在2000年前后实施了将表达编码该vegf的基因的质粒注入到陷入缺血的区域而使血管再生的治疗。但是,vegf使血管透过性亢进,发生大量血液成分的组织内积存所引起的水肿。由于该副作用,现在不再进行使用vegf的治疗。另一方面,使用肝细胞增殖因子(hepatocyte growth factor:hgf)基因的血管再生的治疗也在临床上使用。显示其有效性的数据也在被介绍,但还没有提及长期的效果。
5.例如,如在骨髓移植中为了利用他人的骨髓重构骨髓而需要造血干细胞那样,为了长期地维持再生的血管,需要利用具有干细胞特性的细胞重构血管。本发明人发现,在原有血管的血管内皮细胞中,虽然比例非常小,但存在产生血管内皮细胞的能力极高的细胞(非专利文献1、2)。明确了该血管内细胞与存在于骨髓中的血管内皮祖细胞不同,是能够长期作为血管内皮细胞作出贡献的细胞。本发明人发现,这样的产生血管内皮细胞的能力极高的细胞作为药剂排出能力高的血管内皮细胞存在于原有血管中。
6.此外,本发明人为了详细地分析该产生血管内皮细胞的能力极高的血管内皮细胞作为干细胞的特征,进行了在该血管内皮细胞上表达的表面标记的分离,发现了在血管内皮干细胞上表达cd157和cd200(非专利文献2、专利文献1)。cd200阳性cd157阳性的血管内
皮细胞群具有维持未分化性并进行分裂(自我复制)、并且最终大量产生cd200阴性cd157阴性的分化的血管内皮细胞的能力。另外明确了,由该血管内皮细胞再生的血管不会退化,长期维持为血管。具体而言,不仅维持了血液输送功能,而且还维持了应由血管内皮细胞分泌的分子(例如凝固因子viii等)的长期产生功能。以下,将本发明人发现的具有干细胞特性的血管内皮细胞称为“血管内皮干细胞”。
7.在诱导血管再生时,需要利用这样的具有干细胞特性的血管内皮细胞的血管再生,通过移植血管内皮干细胞,可能成为对没有血管再生的预备能力的患者也带来治疗效果的治疗。但是,血管内皮干细胞在生物体内极微量地存在,对每个进行血管再生的患者采集患者自身的血管内皮干细胞效率非常差。另外,还存在患者的血管内皮干细胞功能受到阻碍的可能性。因此,期望开发由某些细胞人工制造血管内皮干细胞的方法。
8.现有技术文献
9.专利文献
10.专利文献1:国际公开wo2019/098264a1
11.非专利文献
12.非专利文献1:naito h.et al.,identification and characterization of a resident vascular stem/progenitor cell population in preexisting blood vessels,embo j.2012feb 15;31(4):842-55.
13.非专利文献2:wakabayashi t.et al.,cd157 marks tissue-resident endothelial stem cells with homeostatic and regenerative properties,cell stem cell.2018mar 1;22(3):384-397.
技术实现要素:
14.发明所要解决的问题
15.本发明的目的在于提供由血管内皮干细胞以外的细胞人工制造血管内皮干细胞的方法。
16.用于解决问题的方法
17.为了解决上述问题,本发明包含以下的各发明。
18.[1]一种血管内皮干细胞的制造方法,其特征在于,包括使不具有干细胞特性的血管内皮细胞与由新生儿期或幼年期的哺乳动物的器官分泌的因子接触的步骤。
[0019]
[2]如上述[1]所述的制造方法,其特征在于,上述步骤通过以下的(1)或(2)中的任意一个来进行:
[0020]
(1)将上述不具有干细胞特性的血管内皮细胞移植到非人哺乳动物的器官中;或者
[0021]
(2)使用包含由新生儿期或幼年期的哺乳动物的器官分泌的因子的培养系统培养上述不具有干细胞特性的血管内皮细胞。
[0022]
[3]如上述[1]或[2]所述的制造方法,其中,上述新生儿期或幼年期的哺乳动物为新生儿期的哺乳动物。
[0023]
[4]如上述[1]~[3]中任一项所述的制造方法,其中,上述不具有干细胞特性的血管内皮细胞为由新生儿期或幼年期的哺乳动物取得的细胞。
[0024]
[5]如上述[4]所述的制造方法,其中,上述不具有干细胞特性的血管内皮细胞为由新生儿期的哺乳动物取得的细胞。
[0025]
[6]如上述[1]~[5]中任一项所述的制造方法,其中,上述器官为肝脏。
[0026]
[7]一种血管内皮干细胞诱导剂,其含有由新生儿期或幼年期的哺乳动物的器官分泌的因子。
[0027]
[8]如上述[7]所述的血管内皮干细胞诱导剂,其中,含有包含上述因子的由新生儿期或幼年期的哺乳动物的器官制备的细胞的培养上清或包含上述因子的新生儿期或幼年期的哺乳动物的器官提取液。
[0028]
[9]如上述[7]或[8]所述的血管内皮干细胞诱导剂,其中,上述新生儿期或幼年期的哺乳动物为新生儿期的哺乳动物。
[0029]
[10]如上述[7]~[9]中任一项所述的血管内皮干细胞诱导剂,其中,上述器官为肝脏。
[0030]
发明效果
[0031]
根据本发明,能够提供由不具有干细胞特性的血管内皮细胞人工制造血管内皮干细胞的方法。
附图说明
[0032]
图1为表示将通过流式细胞术由小鼠的活体取得的血管内皮细胞(cd31阳性cd45阴性细胞)在使用op9基质细胞作为饲养细胞的培养系统中进行培养而得到的结果的图,(a)为由胎生第15天的胎儿小鼠取得的血管内皮细胞的结果,(b)为由8周龄的成体小鼠肝脏取得的血管内皮细胞的结果。
[0033]
图2为表示由胎生第15天的胎儿小鼠、出生后第1天、第7天、第14天和第21天的新生儿~幼年小鼠分别摘取肝脏并制作冷冻切片、使用抗cd31抗体进行免疫染色而得到的结果的图。
[0034]
图3为表示对通过流式细胞术由胎生第15天的胎儿小鼠、出生后第7天、第14天、第21天、第28天的新生儿~幼年小鼠的肝脏取得的血管内皮细胞(cd31阳性cd45阴性细胞)进行赫斯特染色(hoechst stain)并进行流式细胞术分析而得到的结果的图,(a)为赫斯特染色的流式细胞术分析结果,(b)为表示药剂排出能力高的级分(sp细胞级分)的比例的图。
[0035]
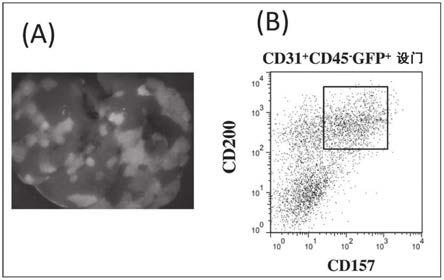
图4为表示将由出生后第1天的绿色荧光小鼠(green mouse)(c57bl/6-tg(cag-egfp))肝脏取得的药剂排出能力低的级分(mp细胞级分)的血管内皮细胞(cd31阳性cd45阴性细胞)移植到出生后7日龄的肝脏损伤模型小鼠(c57bl/6)的肝脏中并分析2个月后的肝脏损伤模型小鼠的肝脏而得到的结果的图,(a)为利用荧光实体显微镜观察剖腹后的肝脏而得到的结果,(b)为通过流式细胞术分析(a)的肝脏中的cd31阳性gfp阳性细胞的存在而得到的结果,(c)为通过流式细胞术分析(b)的cd31阳性gfp阳性细胞中的sp细胞的存在而得到的结果。
[0036]
图5为表示对通过流式细胞术由胎生第13天、第15天和第18天的胎儿小鼠、出生后第1天、第4天、第7天和第14天的新生儿小鼠和第8周的成体小鼠的肝脏取得的血管内皮细胞(cd31阳性cd45阴性细胞)中的cd200阳性cd157阳性细胞的存在进行流式细胞术分析而得到的结果。
[0037]
图6为表示将由胎生第15天的绿色荧光小鼠(c57bl/6-tg(cag-egfp))肝脏取得的cd200阴性cd157阴性的血管内皮细胞(cd31阳性cd45阴性细胞)移植到出生后第7天的小鼠的肝脏中并分析2个月后的小鼠的肝脏而得到的结果的图,(a)为利用荧光实体显微镜观察剖腹后的肝脏而得到的结果,(b)为通过流式细胞术分析(a)的肝脏中的cd31阳性cd45阴性gfp阳性细胞中的cd200阳性cd157阳性细胞的存在而得到的结果。
[0038]
图7为表示将人脐带静脉血管内皮细胞(huvec)与出生后第4天的新生儿小鼠的肝脏制备的细胞共培养并通过流式细胞术分析共培养前后的huvec中的cd157的表达而得到的结果的图。
具体实施方式
[0039]
[血管内皮干细胞的制造方法]
[0040]
本发明提供血管内皮干细胞的制造方法。本发明的血管内皮干细胞的制造方法(以下称为“本发明的制造方法”)的特征在于,包括使不具有干细胞特性的血管内皮细胞与由新生儿期或幼年期的哺乳动物的器官分泌的因子接触的步骤。新生儿期或幼年期的哺乳动物的器官可以为新生儿期的哺乳动物的器官。
[0041]
在本说明书中,血管内皮干细胞是指具有在未分化状态下进行分裂的能力(自我复制能力)和分化为血管内皮细胞的能力的细胞。通过本发明的制造方法得到了血管内皮干细胞这一点通过确认由单一细胞能够形成集落的血管内皮细胞的存在来明确。即,可以将具有高集落形成能力的血管内皮细胞判断为血管内皮干细胞。除此之外,也可以确认通过本发明的制造方法得到的细胞具有以下中的至少一种特性:其为药剂排出能力高的细胞;以及其为cd200阳性cd157阳性细胞。药剂排出能力的确认可以使用例如赫斯特染色法等。是否为cd200阳性cd157阳性细胞可以通过利用抗cd200抗体和抗cd157抗体对细胞进行染色等来进行。
[0042]
血管内皮细胞为保证血管内腔的一层扁平状细胞,可以指定为cd31阳性cd45阴性细胞。通过常规方法作为cd31阳性cd45阴性细胞取得的血管内皮细胞能够适合作为供于本发明的制造方法的不具有干细胞特性的血管内皮细胞使用。
[0043]
不具有干细胞特性的血管内皮细胞为哺乳动物的血管内皮细胞即可。哺乳动物没有特别限定,例如可以列举人、猴、牛、猪、绵羊、山羊、狗、猫、小鼠、大鼠、兔等。在哺乳动物为人的情况下,能够将通过本发明的制造方法制造的血管内皮干细胞安全地用于人的细胞治疗等。
[0044]
不具有干细胞特性的血管内皮细胞可以由任意器官制备。器官可以为例如肝脏、视网膜、脑、心脏、皮肤、肌肉(骨骼肌)、肺、肾脏、胎盘、脐带、脂肪组织等。优选为肝脏、脐带。不具有干细胞特性的血管内皮细胞的制备方法没有特别限定,例如可以列举如下的方法等:将分离出的器官利用市售的细胞分散用试剂进行消化、分散而制备细胞悬浮液,利用抗cd31抗体和抗cd45抗体将该细胞悬浮液染色,然后使用流式细胞术技术回收cd31阳性cd45阴性细胞。
[0045]
不具有干细胞特性的血管内皮细胞只要是由哺乳动物取得的血管内皮细胞即可,取得时期没有特别限定。可以为由新生儿期或幼年期的哺乳动物取得的血管内皮细胞,优选为由新生儿期的哺乳动物取得的血管内皮细胞。在本说明书中,新生儿期是指从出生起
到断奶时为止,幼年期是指从断奶时起到获得生殖能力为止。本发明人确认了,与成体小鼠的血管内皮细胞相比,新生儿期的血管内皮细胞容易被重编程为血管内皮干细胞。
[0046]
使不具有干细胞特性的血管内皮细胞与由新生儿期或幼年期的哺乳动物的器官分泌的因子接触的步骤例如可以通过移植到新生儿期或幼年期的非人哺乳动物的器官中来进行。非人哺乳动物没有特别限定,例如可以列举猴、牛、猪、绵羊、山羊、狗、猫、小鼠、大鼠、兔等。优选为猪或绵羊。器官没有特别限定,例如可以列举肝脏、视网膜、脑、心脏、皮肤、肌肉(骨骼肌)、肺、肾脏、胎盘、脂肪组织等。优选为肝脏。移植可以通过例如将宿主动物在麻醉下剖腹并利用注射等向对象器官中接种不具有干细胞特性的血管内皮细胞的方法等来进行。
[0047]
使不具有干细胞特性的血管内皮细胞与由新生儿期或幼年期的哺乳动物的器官分泌的因子接触的步骤例如可以通过使用包含由新生儿期或幼年期的哺乳动物的器官分泌的因子的培养系统培养不具有干细胞特性的血管内皮细胞来进行。具体而言,可以将由新生儿期或幼年期的哺乳动物的器官制备的细胞与不具有干细胞特性的血管内皮细胞共培养。由器官制备细胞的操作例如可以列举将分离出的器官利用市售的细胞分散用试剂进行消化、分散的方法等。共培养中,将不具有干细胞特性的血管内皮细胞和由器官制备的细胞在同一培养容器内培养即可。此时,可以以使不具有干细胞特性的血管内皮细胞与由器官制备的细胞不直接接触的方式将培养插件等器具安装到培养容器中来进行共培养。
[0048]
另外,也可以使用适当的培养基培养由新生儿期或幼年期的哺乳动物的器官制备的细胞,回收其培养上清,添加到不具有干细胞特性的血管内皮细胞的培养基中。另外,也可以制备新生儿期或幼年期的哺乳动物的器官提取液,将该提取液添加到不具有干细胞特性的血管内皮细胞的培养基中。作为新生儿期或幼年期的哺乳动物的器官提取液,例如可以适当使用器官的匀浆上清。
[0049]
使不具有干细胞特性的血管内皮细胞与由新生儿期或幼年期的哺乳动物的器官分泌的因子接触的期间没有特别限定,可以通过预备研究等设定得到目标血管内皮干细胞的适当期间。例如,在移植到新生儿期或幼年期的非人哺乳动物的器官中的情况下,可以为1天以上、2天以上、3天以上、4天以上,也可以为100天以下、50天以下、10天以下、5天以下。例如,在与由新生儿期或幼年期的非人哺乳动物的器官制备的细胞共培养的情况下,可以为1天以上、2天以上、3天以上、4天以上,也可以为100天以下、50天以下、10天以下、5天以下。
[0050]
通过使不具有干细胞特性的血管内皮细胞与由新生儿期或幼年期的哺乳动物的器官分泌的因子接触一定期间,不具有干细胞特性的血管内皮细胞被重编程,变成血管内皮干细胞。在通过移植到非人哺乳动物的器官中的方法进行制造的情况下,摘取移植部位,使用利用市售的细胞分散用试剂进行消化、分散的方法等制备细胞悬浮液,确认存在具有高集落形成能力的血管内皮细胞(cd31阳性cd45阴性细胞),由此能够判断为制造出了血管内皮干细胞。在通过使用包含由新生儿期或幼年期的哺乳动物的器官分泌的因子的培养系统的方法进行制造的情况下,确认在培养后的细胞中存在具有高集落形成能力的血管内皮细胞(cd31阳性cd45阴性细胞),由此能够判断为制造出了血管内皮干细胞。此外,也可以确认具有高集落形成能力的血管内皮细胞为药剂排出能力高的细胞和/或为cd200阳性cd157阳性细胞。所得到的血管内皮干细胞例如可以通过将形成了集落的细胞分离并使其增殖来
回收。另外,也可以将药剂排出能力高的细胞、cd200阳性cd157阳性细胞作为指标来回收。
[0051]
[血管内皮干细胞诱导剂]
[0052]
本发明提供含有由新生儿期或幼年期的哺乳动物的器官分泌的因子的血管内皮干细胞诱导剂。新生儿期或幼年期的哺乳动物的器官可以为新生儿期的哺乳动物的器官。
[0053]
哺乳动物没有特别限定,例如可以列举人、猴、牛、猪、绵羊、山羊、狗、猫、小鼠、大鼠、兔等。哺乳动物可以为人。器官没有特别限定,例如可以列举肝脏、视网膜、脑、心脏、皮肤、肌肉(骨骼肌)、肺、肾脏、胎盘、脂肪等。器官也可以为肝脏。
[0054]
本发明的血管内皮干细胞诱导剂只要是含有由新生儿期或幼年期的哺乳动物的器官分泌的因子的形态,则可以为任何形态。本发明的血管内皮干细胞诱导剂例如可以含有由新生儿期或幼年期的哺乳动物的器官制备的细胞的培养上清,也可以含有新生儿期或幼年期的哺乳动物的器官提取液。在这样的培养上清、器官提取液中含有由器官分泌的因子。上述培养上清例如可以通过使用适当的培养基培养通过将分离出的器官利用市售的细胞分散用试剂进行消化、分散而得到的细胞来取得。上述器官提取液例如可以通过将器官进行均质化和离心分离来取得。
[0055]
本发明的血管内皮干细胞诱导剂可以在培养不具有干细胞特性的血管内皮细胞时添加到培养基中来使用。推荐根据培养条件等适当设定其添加量。
[0056]
本发明包含以下的各发明。
[0057]
一种血管内皮干细胞的诱导方法,其包括使用包含由新生儿期或幼年期的哺乳动物的器官分泌的因子的培养基培养不具有干细胞特性的血管内皮细胞的步骤。
[0058]
由新生儿期或幼年期的哺乳动物的器官分泌的因子在诱导血管内皮干细胞中的应用。
[0059]
由新生儿期或幼年期的哺乳动物的器官制备的细胞的培养上清在诱导血管内皮干细胞中的应用。
[0060]
新生儿期或幼年期的哺乳动物的器官提取液在诱导血管内皮干细胞中的应用。
[0061]
由新生儿期或幼年期的哺乳动物的器官分泌的因子在制造血管内皮干细胞诱导剂中的应用。
[0062]
由新生儿期或幼年期的哺乳动物的器官制备的细胞的培养上清在制造血管内皮干细胞诱导剂中的应用。
[0063]
新生儿期或幼年期的哺乳动物的器官提取液在制造血管内皮干细胞诱导剂中的应用。
[0064]
实施例
[0065]
以下,通过实施例详细说明本发明,但本发明不限于此。
[0066]
[实施例1:胎儿期和出生后的血管内皮细胞的干细胞特性的研究]
[0067]
1-1实验方法
[0068]
使用c57bl/6小鼠(日本slc)的胎生第15天(e15)的胎儿小鼠和出生后第8周(8w)的成体小鼠。e15胎儿使用整个胎儿,8w小鼠使用摘取的肝脏,使用眼科用剪刀尽可能切碎,将切碎组织浸渍在分散酶ii(dispase ii,roche applied science公司制造)、胶原酶(collagenase,wako公司制造)和ii型胶原酶(type ii collagenase,worthington biochemical公司制造)的混合溶液中,在37℃下振荡,消化细胞外基质。使包含消化后的细
胞的溶液通过孔径为40μm的过滤器,得到分散的细胞悬浮液。利用ack(ammonium-chloride-potassium,氯化钾铵)溶液(0.15m nh4cl、10mm khco3和0.1mm na
2-edta)使红细胞溶血,将剩余的细胞供于以下的实验。
[0069]
对所制备的细胞进行免疫荧光染色,进行流式细胞术分析。作为单克隆抗体,使用抗cd31抗体(clone mec13.3,bd biosciences公司制造)、抗cd45抗体(clone 30-f11,bd biosciences公司制造)。向染色后的细胞中加入碘化丙啶(pi,2μg/ml,sigma-aldrich公司制造),对死细胞的核进行染色并除去死细胞。在流式细胞术分析中使用soap facsaria(bd bioscience公司制造)和flowjo软件(treestar software公司制造)。在使用op9基质细胞(riken细胞库)作为饲养细胞的培养系统中,将通过流式细胞术得到的cd31阳性cd45阴性的血管内皮细胞各5000个接种到直径3cm的培养板中,培养7天。
[0070]
1-2结果
[0071]
将结果示于图1。(a)为培养由胎儿小鼠得到的血管内皮细胞的结果,(b)为培养由成体小鼠的肝脏得到的血管内皮细胞的结果。在由胎儿得到的血管内皮细胞中存在少数具有增殖而形成集落的能力的细胞。另一方面可知,在由成体肝脏回收的血管内皮细胞中存在形成非常大的集落的血管内皮细胞。根据该结果,认为可能是内皮干细胞在胎儿期并不存在、而是在出生后产生。
[0072]
[实施例2:肝脏中的窦状血管的形成的研究]
[0073]
2-1实验方法
[0074]
分别从c57bl/6小鼠(日本slc)的胎生第15天的胎儿小鼠、出生后第1天、第7天、第14天和第21天的新生儿~幼年小鼠摘取肝脏,按照常规方法制作肝脏的冷冻切片。使用抗cd31抗体(clone mec13.3,bd biosciences公司制造)对冷冻切片进行免疫染色。使用pe标记的抗大鼠igg(bd biosciences公司制造)作为二次抗体。
[0075]
2-2结果
[0076]
将结果示于图2。在出生后第21天的幼年小鼠的肝脏中,以中心静脉为中心,从该中心静脉以放射状形成了窦状血管。可知该以放射状形成的肝脏特异性血管结构在胎儿期的小鼠的肝脏内没有形成,而是在出生后逐渐形成。本发明人阐明了,作为肝脏特有的血管结构的窦状血管被血管内皮干细胞诱导(wakabayashi t.et al.,cell stem cell.2018mar 1;22(3):384-397),因此,认为可能是血管内皮干细胞在胎儿期并不存在、而是在出生后产生。
[0077]
[实施例3:关于包含能够利用药剂排出能力高这一点来分离的血管内皮干细胞的级分(sp细胞级分)的产生方式的分析]
[0078]
3-1实验方法
[0079]
分别从c57bl/6小鼠(日本slc)的胎生第15天(e15)的胎儿小鼠、出生后第1天(p1)、第7天(p7)、第14天(p14)、第21天(p21)、第28天(p28)的新生儿~幼年小鼠和第8周(8w)的成体小鼠摘取肝脏。与实施例1同样地使用眼科用剪刀将摘取的肝脏尽可能切碎,将切碎组织浸渍在分散酶ii(roche applied science公司制造)、胶原酶(wako公司制造)和ii型胶原酶(worthington biochemical公司制造)的混合溶液中,在37℃下振荡,消化细胞外基质。使包含消化后的细胞的溶液通过孔径为40μm的过滤器,得到分散的细胞悬浮液。对所得到的细胞悬浮液进行赫斯特染色。对于赫斯特染色,将1
×
106个细胞悬浮在1ml的含有
hoechst的培养基(含有2%fbs(sigma-aldrich)、1mm hepes(gibco)、5μg/ml hoechst33342(sigma-aldrich)的dmem(sigma-aldrich))中,在37℃下进行90分钟。在免疫荧光染色中使用与实施例1相同的抗cd31抗体和抗cd45抗体。向染色后的细胞中加入碘化丙啶(pi,2μg/ml,sigma-aldrich公司制造),对死细胞的核进行染色并除去死细胞。通过流式细胞术进行cd31阳性cd45阴性pi阴性细胞(除去死细胞后的血管内皮细胞)的赫斯特染色分析。在流式细胞术分析中使用soap facsaria(bd bioscience公司制造)和flowjo软件(treestar software公司制造)。
[0080]
3-2结果
[0081]
将结果示于图3。(a)为表示胎儿期、新生儿~幼年期的代表性的流式细胞术分析结果的图,(b)为表示sp细胞级分的比例的图。在胎儿期的血管内皮细胞中没有观察到包含血管内皮干细胞的sp细胞级分的细胞(sp细胞),仅观察到作为非血管内皮干细胞的mp细胞级分的细胞(mp细胞)。可知sp细胞在出生后逐渐出现,在21日龄(p21)的幼年小鼠中,sp细胞的比例为与8周龄(8w)的成体小鼠相匹敌的约1%左右。根据该结果暗示了,血管内皮干细胞在出生后的体内环境中产生。
[0082]
[实施例4:mp细胞在肝脏的环境中变化为sp细胞]
[0083]
4-1实验方法
[0084]
从日本slc购买并使用c57bl/6小鼠和c57bl/6-tg(cag-egfp)小鼠(以下称为“绿色荧光小鼠”)。从出生后第1天(1日龄)和第8周(8周龄)的绿色荧光小鼠摘取肝脏,通过与实施例3相同的方法制备细胞悬浮液。利用与实施例3相同的方法进行赫斯特染色和免疫荧光染色(抗cd31抗体、抗cd45抗体、pi),通过流式细胞术回收血管内皮细胞的mp细胞。将回收的mp细胞(1
×
105个)移植到肝损伤模型小鼠中。肝血管损伤模型小鼠如下制作:对于出生后7天(7日龄)和8周(8周龄)的c57bl/6小鼠,以300mg/kg的用量腹腔内给药野百合碱(sigma-aldrich公司制造),当天全身照射30rads/g的放射线。在从mp细胞的移植起2个月后,在麻醉下将小鼠剖腹,利用荧光实体显微镜(leica公司制造)观察肝脏。然后,摘取肝脏,通过与实施例3相同的方法制备细胞悬浮液,进行赫斯特染色和免疫荧光染色(抗cd31抗体、抗cd45抗体、pi),通过流式细胞术分析sp细胞的存在。
[0085]
4-2结果
[0086]
将1日龄的绿色荧光小鼠肝脏的mp细胞移植到7日龄的肝脏损伤模型小鼠中而得到的结果示于图4。(a)为观察移植2个月后的肝脏损伤模型小鼠的肝脏而得到的结果,(b)为通过流式细胞术分析(a)的小鼠肝脏中的cd31阳性gfp阳性细胞的存在而得到的结果,(c)为通过流式细胞术分析(b)的cd31阳性gfp阳性细胞中的sp细胞的存在而得到的结果。如(a)所示,观察到移植到肝脏损伤模型小鼠的肝脏中的来自绿色荧光小鼠的gfp阳性细胞。另外,如(b)所示,检测到大量的cd31阳性gfp阳性细胞,因此可知,绿色荧光小鼠的血管内皮细胞在宿主的肝脏中形成了血管。此外,如(c)所示可知,在cd31阳性gfp阳性细胞中存在1.5%的sp细胞。该结果表明,mp细胞能够在适当的环境下重编程为sp细胞。
[0087]
将新生儿小鼠(1日龄)和成体小鼠(8周龄)的gfp阳性mp细胞分别移植到新生儿肝脏损伤模型小鼠(7日龄)和成体肝脏损伤模型小鼠(8周龄)中而得到的结果汇总示于表1。明确了:移植到成体小鼠的肝脏中的mp细胞未被重编程为sp细胞,但移植到新生儿小鼠的肝脏中的mp细胞被重编程为sp细胞。另外表明,与成体小鼠的mp细胞相比,新生儿小鼠的mp
细胞更容易被重编程为sp细胞。该结果暗示,在新生儿的肝脏中含有大量使mp细胞重编程为sp细胞的因子,在成体的肝脏中几乎不存在这样的因子。另外认为,新生儿的肝脏内的mp细胞比成体的mp细胞更容易受到重编程因子的影响,容易被重编程为sp细胞。
[0088]
[表1]
[0089][0090]
[实施例5:cd157阳性cd200阳性的血管内皮干细胞的产生过程的分析]
[0091]
5-1实验方法
[0092]
分别从c57bl/6小鼠(日本slc)的胎生第13天(e13)、第15天(e15)、第18天(e18)的胎儿小鼠、出生后第1天(p1)、第4天(p4)、第7天(p7),第14天(p14)的新生儿小鼠和第8周(8w)的成体小鼠摘取肝脏,与实施例1、3同样地制备细胞悬浮液。作为单克隆抗体,使用抗cd31抗体(clone mec13.3,bd biosciences公司制造)、抗cd45抗体(clone 30-f11,bd biosciences公司制造)、抗cd157抗体(clone bp3,biolegend公司制造)、抗cd200抗体(clone ox90,biolegend公司制造)。向染色后的细胞中加入碘化丙啶(pi,2μg/ml,sigma-aldrich公司制造),对死细胞的核进行染色并除去死细胞。在流式细胞术分析中使用soap facsaria(bd bioscience公司制造)和flowjo软件(treestar software公司制造)。
[0093]
5-2结果
[0094]
将结果示于图5。将肝脏内的cd31阳性cd45阴性细胞作为肝脏的血管内皮细胞进行设门,利用流式细胞术分析cd200和cd157的表达时,到e15为止,血管内皮细胞全部为cd200阴性cd157阴性细胞,与此相对,在e18中出现了微量cd200阳性cd157阴性细胞。到出生后时,在p1中cd200阳性cd157阴性细胞群开始与cd200阴性cd157阴性细胞群完全分级,但几乎未出现cd200阳性cd157阳性细胞群。到p4时,出现微量cd200阳性cd157阳性细胞,在p7、p14中cd200阳性cd157阳性细胞逐渐增加,在8w的成体小鼠中,全部血管内皮细胞中的4%~6%为cd200阳性cd157阳性细胞。虽然未示出数据,但在此以后,在肝脏内以几乎相同的比例存在cd200阳性cd157阳性细胞的血管内皮干细胞。该结果与实施例3的利用赫斯特排除法的sp细胞中的血管内皮干细胞相同。即,明确了:在胎儿期的肝脏内不存在血管内皮干细胞,在即将出生前出现一部分具有部分干细胞特性、但比干细胞分化更快的血管内皮祖细胞,在出生后的肝脏内产生血管内皮干细胞。
[0095]
[实施例6:cd157阴性cd200阴性细胞血管内皮细胞在新生儿肝脏内环境中变化为血管内皮干细胞]
[0096]
6-1实验方法
[0097]
摘取胎生第15天(e15)绿色荧光小鼠的肝脏,利用与实施例3相同的方法制备细胞悬浮液,利用与实施例5相同的抗cd31抗体、抗cd45抗体、抗cd157抗体、抗cd200抗体进行染色并供于流式细胞术,回收cd200阴性cd157阴性血管内皮细胞(cd31阳性cd45阴性细胞)。与实施例4同样地将回收的细胞移植到出生后第7天(7日龄)的肝损伤模型小鼠(c57bl/6)
的肝脏中。肝损伤模型小鼠利用与实施例4相同的方法来制作。在从移植起2个月后,在麻醉下将小鼠剖腹,利用荧光实体显微镜(leica公司制造)观察肝脏。进一步摘取肝脏,利用与实施例3相同的方法制备细胞悬浮液,利用与实施例5相同的抗cd31抗体、抗cd45抗体、抗cd157抗体进行染色,进行流式细胞术分析。
[0098]
6-2结果
[0099]
将结果示于图6。(a)为观察移植2个月后的宿主小鼠的肝脏而得到的结果,(b)为通过流式细胞术分析(a)的宿主小鼠肝脏中的cd31阳性cd45阴性gfp阳性细胞中的cd200阳性cd157阳性细胞的存在而得到的结果。如(a)所示可知,观察到在宿主小鼠的肝脏中存在大量来自绿色荧光小鼠的gfp阳性细胞,绿色荧光小鼠胎儿的cd200阴性cd157阴性血管内皮细胞(cd31阳性cd45阴性gfp阳性细胞)在新生儿的肝脏环境下获得对窦状血管的贡献性。另外,如(b)所示可知,移植后的绿色荧光小鼠胎儿的cd200阴性cd157阴性血管内皮细胞的一部分被重编程为cd200阳性cd157阳性血管内皮干细胞。
[0100]
[实施例7:从人血管内皮细胞向血管内皮干细胞的变化]
[0101]
7-1实验方法
[0102]
作为刚出生后的人的血管内皮细胞,使用人脐带静脉血管内皮细胞(human umbilical vein endothelial cells;huvec)(龙沙公司)。huvec使用humedia-eg2(kurabo,osaka,japan)培养液来进行培养。将huvec以1.0
×
105个/孔接种到6孔板上,将孔尺寸1.0μm的培养插件(corning,ny,usa)设置在孔中。摘取出生后第4天的新生儿小鼠(c57bl/6)的肝脏,利用与实施例1相同的方法制备细胞悬浮液。将细胞悬浮液中的细胞2.0
×
106个接种到培养插件中,在huvec与来自新生儿小鼠的细胞不直接接触的状态下共培养5天。回收共培养后的huvec,利用cd157抗体进行染色,然后利用流式细胞术进行分析。
[0103]
7-2结果
[0104]
将结果示于图7。共培养前的huvec为cd157阴性,但通过与来自新生儿小鼠肝脏的细胞共培养,cd157的表达被诱导为阳性。由该结果证实了,新生儿的肝脏内的细胞具有诱导cd157、从内皮细胞分化诱导为内皮干细胞的能力,另外暗示了由肝脏分泌的体液因子与该分化转化有关。
[0105]
需要说明的是,本发明不限于上述各实施方式和实施例,在权利要求书所示的范围内可以进行各种变更,将不同实施方式中分别公开的技术手段适当组合而得到的实施方式也包含在本发明的技术范围内。另外,本说明书中记载的学术文献和专利文献的全部内容在本说明书中作为参考来援引。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1