合成抗微生物肽的制作方法
合成抗微生物肽
1.相关申请的交叉引用
2.本技术要求2019年8月29日提交的美国临时申请62/893,633的优先权权益,所述临时申请以引用的方式整体并入本文。
技术领域
3.本发明的领域是抗生素,特别是具有抗生素性质的肽。
背景技术:
4.由于抗生素过度使用,抗微生物剂耐药性是21世纪的新出现的问题。美国疾病控制与预防中心(cdc)估计,在美国每年200万感染者中有23,000人死于细菌耐药性。此外,最近的全球报告估计,到2050年,每年将有约1000万人死于抗微生物剂耐药性。临床报告的病原微生物包括引起人和动物的感染性疾病的屎肠球菌、金黄色葡萄球菌、肺炎克雷伯氏菌、鲍氏不动杆菌、铜绿假单胞菌和大肠杆菌(eskape)(el-mahallawy等人,2016)。它们在存在几类抗生素的情况下适应并生长,这导致了被称为抗微生物剂耐药性(amr)的现象(和malmsten 2017)。
5.这个问题导致白宫在2014年开展了一项全国性的努力,以对抗抗生素耐药性细菌。在新抗感染剂的发现和开发下降的时期内,与一些一线抗生素(如针对革兰氏阳性细菌的万古霉素以及针对革兰氏阴性细菌的碳青霉烯和粘菌素)相关的耐药型病原体和毒性的流行增加。因此,迫切需要开发具有针对多重耐药性细菌(mdrb)的活性的新型化合物来解决这一紧迫的公共卫生问题。
6.多药微生物耐药性对感染的管理提出了重大挑战。耐药性病原体流行率的增加是在新抗感染剂的发现和开发急剧放缓的时候发生的。为了在耐药性感染中重占优势,现代抗生素发现计划的首要目标应该是开发限制耐药性出现的新的抗微生物剂。此外,由于存在严重的副作用、细菌存在主动外排机制和/或由于渗透屏障而限制了细菌的摄取,许多市售抗生素的递送具有挑战性。
7.抗微生物肽(amp)是在许多生物体中响应于微生物入侵而广泛产生作为宿主抗微生物肽和致炎因子的一类抗菌剂(ageitos等人2017)。它们已从各种生物体(如微生物、植物、青蛙、甲壳类动物和哺乳动物)中分离出来(robert等人,2008)。在自然界中,存在脂肽amp,例如多粘菌素和达托霉素,它们被fda批准为临床使用的抗菌肽。例如,达托霉素(第一种获批用于治疗革兰氏阳性细菌病原体的脂肽抗生素)起源于玫瑰孢链霉菌。万古霉素(一种支链三环糖基化肽)从不同于β-内酰胺抗生素青霉素的位点作用于肠球菌,并且头孢菌素获自东方链霉菌(domhan等人,2018)。通常,amp作为前药存在于自然界中,并且以无毒化合物形式储存在宿主体内,但它们作为致命武器释放在入侵寄生微生物上(seo等人,2012)。
8.然而,由于以下挑战,amp作为抗菌剂的临床使用和应用存在缺陷。首先,许多肽在血清中不稳定,尤其是当暴露于血清中发现的蛋白水解酶和各种盐时(knappe等人,2010)。
其次,它们可能对红细胞表现出高水平的细胞毒性和溶血作用(de smet等人,2005)。此外,几种amp具有窄谱抗菌活性。例如,万古霉素针对革兰氏阳性细菌具有活性,并且被认为是用于耐甲氧西林金黄色葡萄球菌(mrsa)的一线药物治疗,并且针对革兰氏阴性细菌没有活性。另一方面,美罗培南是用于治疗诸如铜绿假单胞菌的多重耐药性革兰氏阴性细菌的首选药物。同样,革兰氏阳性细菌和革兰氏阴性细菌可通过改变细胞表面的净电荷和渗透性、从而降低带正电荷的肽对细胞壁的吸引力而对amp产生耐药性(kumar等人,2018)。因此需要新的抗微生物肽及其制备和使用方法。本文公开的组合物和方法解决了这些和其他需要。
技术实现要素:
9.正如本文中体现和广泛描述的,根据所公开的组合物和方法的目的,所公开的主题涉及合成抗微生物肽及其制备和使用方法。在具体实例中,所公开的主题涉及一种包含氨基酸序列xnym的合成肽,其中x表示带正电荷的氨基酸,y表示疏水性氨基酸,并且n和m两者均大于2。还公开了抗微生物组合物,所述抗微生物组合物包含如权利要求中的一项所述的合成肽和纳米颗粒,其中所述合成肽与纳米颗粒组合。更进一步,公开了使用本文公开的合成肽和抗微生物组合物抑制或阻止微生物生长的方法,以及用于治疗感染的用途。还公开了包含如本文公开的合成肽和药学上可接受的载体的制剂。更进一步,公开了所公开的合成肽的聚乙二醇化形式。在另外的方面中,本文公开了包含合成肽的组合物,其中所述合成肽包含偶联所述肽的两个相邻氨基酸的非肽键。还公开了药盒,所述药盒包括如本文公开的合成肽;以及以有效抑制或阻止微生物生长的方式施加所述合成肽的说明书。
10.所公开的方法的另外优点将部分地阐述于随后描述中,并且部分地将从描述中显而易见或者可通过本发明的实践而得知。所公开的方法的优点将借助在所附权利要求书中特别指出的要素和组合来实现和达到。应理解,以上概述和以下详述两者均仅是示例性和解释性的,并且不限制要求保护的所公开的方法。
附图说明
11.并入本说明书且构成其一部分的附图说明了本公开的若干方面,并连同描述一起用于解释本公开的原理。
12.图1.之前由我们报告的[r4w4](1)、r4w4(2)、[r4w3](3)和r4w3(4)(oh等人,2014)。
[0013]
图2.含精氨酸残基和非天然疏水性残基的肽,其中精氨酸残基和疏水性残基的数量相等。
[0014]
图3.具有四个精氨酸残基和三个疏水性残基的含精氨酸残基和非天然疏水性残基的肽。
[0015]
图4.含精氨酸残基和在不同位置与一个色氨酸组合的两个非天然疏水性3,3-二苯基-l-丙氨酸残基的肽的实例。
[0016]
图5.含精氨酸残基和在不同位置与一个色氨酸组合的两个非天然疏水性3-(2-萘基)-l-丙氨酸残基的肽的实例。
[0017]
图6.具有广谱抗菌活性的线性和环状肽的实例。
[0018]
图7.具有抗生素的抗菌肽缀合物。
[0019]
图8.四环素与肽[r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)、ifx-031和ifx-067-l与11种市售抗生素的mic结果。
[0020]
图9.四环素与肽[r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)和[ifx135]的mic结果。
[0021]
图10.妥布霉素与肽[r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)和[ifx135]的mic结果。
[0022]
图11.左氧氟沙星与肽[r5w4]、(ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)、ifx-031和ifx-067-1的mic结果。
[0023]
图12.左氧氟沙星与肽[r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)和[ifx135]的mic结果。
[0024]
图13.环丙沙星与肽[r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)、ifx-031和ifx-067-1的mic结果。
[0025]
图14.环丙沙星与肽r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)和[ifx135]的mic结果。
[0026]
图15.克林霉素与肽[r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)、ifx-031和ifx-067-l的mic结果。
[0027]
图16.克林霉素与肽[r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)和[ifx135]的mic结果。
[0028]
图17.达托霉素与肽[r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)、ifx-031和ifx-067-1的mic结果。
[0029]
图18.达托霉素与肽[r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)和[ifx135]的mic结果。
[0030]
图19.多粘菌素与肽[r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)、ifx-031和ifx-067-l的mic结果。
[0031]
图20.多粘菌素与肽[r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)和[ifx135]的mic结果。
[0032]
图21.卡那霉素与肽[r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)、ifx-031和ifx-067-l的mic结果。
[0033]
图22.卡那霉素与肽[r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)和[ifx135]的mic结果。
[0034]
图23.美罗培南与肽[r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)、ifx-031和ifx-067-l的mic结果。
[0035]
图24.美罗培南与肽[r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)和[ifx135]的mic结果。
[0036]
图25.万古霉素与肽[r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)、ifx-031和ifx-067-l的mic结果。
[0037]
图26.美罗培南与肽r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)和[ifx135]的mic结果。
[0038]
图27.甲硝唑与肽[r5w4](ifx-301)、[r5w4k](ifx-315)、[r6w4](ifx-318)、ifx-031
和ifx-067-l的mic结果。
[0039]
图28.美罗培南与[r5w4k]ifx-315的缀合物的mic结果。
[0040]
图29a-29b.(图29a)ifx-031、ifx-031-1和ifx-111;(图29b)万古霉素对mrsa 33952生物膜形成的抑制。
[0041]
图31.ifx-031、ifx-031-1和ifx-111对肺炎克雷伯氏菌baa-2470生物膜形成的抑制。
[0042]
图32.环丙沙星对铜绿假单胞菌47085生物膜形成的抑制。
[0043]
图33.ifx-031、ifx-031-1和ifx-111对铜绿假单胞菌47085生物膜形成的抑制。
[0044]
图34.替加环素对大肠杆菌baa-2471生物膜形成的抑制。
[0045]
图35.ifx-031、ifx-031-1和ifx-111对大肠杆菌baa-2471生物膜形成的预防。
[0046]
图36.肽在肝细胞系(heparg,thermofisher hrpgc10)中的细胞毒性。
[0047]
图37.肽在肝细胞系(heparg,thermofisher hrpgc10)中的细胞毒性。
[0048]
图38.肽在人皮肤成纤维细胞系(heka,atcc pcs-200-011)中的细胞毒性。
[0049]
图39.肽在心脏/心肌细胞(h9c2,atcc编号crl 1446)中的细胞毒性。
[0050]
图40.肽在心脏/心肌细胞(h9c2,atcc编号crl 1446)中的细胞毒性。
[0051]
图41.肽在心脏/心肌细胞(h9c2,atcc编号crl 1446)中的细胞毒性。
[0052]
图42.肽在心脏/心肌细胞(h9c2,atcc编号crl 1446)中的细胞毒性。
[0053]
图43.肽在人肺成纤维细胞(mrc-5,atcc ccl-171)中的细胞毒性。
[0054]
图44.肽在人肺成纤维细胞(mrc-5,atcc ccl-171)中的细胞毒性。
[0055]
图45.肽在人肺成纤维细胞(mrc-5,atcc ccl-171)中的细胞毒性。
[0056]
图46.肽在人肺成纤维细胞(mrc-5,atcc ccl-171)中的细胞毒性。
[0057]
图47.通过uv测定的由肽产生金纳米颗粒。
[0058]
图48.通过uv测定的由肽产生金纳米颗粒。
[0059]
图49.[r5w4](ifx-301)-au-np与四环素之间的组合的物理混合物mic测定。四环素与[r5w4]au-np的mic结果显示针对psa和大肠杆菌的累加效应。
[0060]
图50.妥布霉素与肽[r5w4]au-np的mic结果显示针对mrsa和kpc的累加效应。
[0061]
图51.美罗培南与肽[r5w4]au-np的mic结果显示没有增强。
[0062]
图52.左氧氟沙星与肽[r5w4]au-np的mic结果显示针对大肠杆菌的累加效应。
[0063]
图53.环丙沙星与肽[r5w4]au-np的mic结果显示针对psa和大肠杆菌的累加效应。
[0064]
图54.克林霉素与肽[r5w4]au-np的mic结果显示针对大肠杆菌的累加效应。
[0065]
图55.卡那霉素与肽[r5w4]au-np的mic结果显示没有增强。
[0066]
图56.多粘菌素与肽[r5w4]au-np的mic结果显示没有增强。
[0067]
图57.达托霉素与肽[r5w4]au-np的mic结果显示没有增强。
[0068]
图58.万古霉素与肽[r5w4]au-np的mic结果显示没有增强。
[0069]
图59.肽[r5w4](ifx-301)然后与抗生素(1∶1比例)的混合物用于au-np比例的合成。四环素与肽[r5w4]au-np的mic结果显示针对psa和大肠杆菌以及kpc的累加效应。
[0070]
图60.肽[r5w4](ifx-301)然后与抗生素(1∶1比例)的混合物用于au-np比例的合成。妥布霉素与肽[r5w4]au-np的mic结果显示针对mrsa、kpc和大肠杆菌的显著增强。
[0071]
图61.肽[r5w4](ifx-301)然后与抗生素(1∶1比例)的混合物用于au-np比例的合
成。美罗培南与肽[r5w4]au-np的mic结果显示针对mrsa和psa的显著增强以及针对kpc和大肠杆菌的累加效应。
[0072]
图62.肽[r5w4](ifx-301)然后与抗生素(1∶1比例)的混合物用于au-np比例的合成。左氧氟沙星与肽[r5w4]au-np的mic结果显示在mrsa、psa和大肠杆菌情况下的显著增强以及针对kpc的累加效应。
[0073]
图63.肽[r5w4](ifx-301)然后与抗生素(1∶1比例)的混合物用于au-np比例的合成。环丙沙星与肽[r5w4]au-np的mic结果显示针对mrsa和psa的显著增强以及针对kpc和大肠杆菌的累加效应。
[0074]
图64.肽[r5w4](ifx-301)然后与抗生素(1∶1比例)的混合物用于au-np比例的合成。克林霉素与肽[r5w4]au-np的mic结果显示针对kpc、psa和大肠杆菌的显著增强。
[0075]
图65.肽[r5w4](ifx-301)然后与抗生素(1
·
1比例)的混合物用于au-np比例的合成。卡那霉素与肽[r5w4]au-np的mic结果显示在psa和大肠杆菌情况下的显著增强,以及在mrsa和kpc情况下的累加效应。
[0076]
图66.肽[r5w4](ifx-301)然后与抗生素(1∶1比例)的混合物用于au-np比例的合成。多粘菌素与肽[r5w4]au-np的mic结果显示针对mrsa和大肠杆菌的显著增强,以及针对kpc和psa的累加效应。
[0077]
图67.肽[r5w4](ifx-301)然后与抗生素(1∶1比例)的混合物用于au-np比例的合成。达托霉素与肽[r5w4]au-np的mic结果显示针对mrsa和psa的显著增强,以及在kpc和大肠杆菌情况下的累加效应。
[0078]
图68.肽[r5w4](ifx-301)然后与抗生素(1∶1比例)的混合物用于au-np比例的合成。万古霉素与[r5w4]au-np的mic结果显示针对mrsa和大肠杆菌的显著增强,以及针对kpc和psa的累加效应。
[0079]
图69.肽单独和与瑞德西韦组合对人冠状病毒229e(hcov-229e)的抗病毒活性展示显著协同活性。
[0080]
图70.分别使用0.2%triton x和pbs缓冲液(ph 7.4)作为阳性对照和阴性对照,环状肽[w4r4](ifx-326)针对人红细胞的溶血测定结果。
[0081]
图71.用肽[w4r4](ifx-326)和四环素处理的大蜡螟(g.mellonella)的时间依赖性存活率。
具体实施方式
[0082]
通过参考所公开主题的具体方面的以下详细描述以及其中包括的实施例和图,可更容易地理解本文中描述的材料、化合物、组合物、物品和方法。
[0083]
在公开和描述本发明的材料、化合物、组合物、制品、装置和方法之前,应理解下文描述的方面不限于具体合成方法或具体试剂,因此当然可以变化。还应理解,本文所使用的术语仅出于描述特定方面的目的,并且不意图是限制性的。
[0084]
此外,贯穿本说明书提及了多个出版物。这些出版物的公开内容特此以引用的方式整体并入本技术以便更充分地描述所公开的主题涉及的领域的现状。所公开的参考文献也以引用的方式个别或具体地并入本文,因为其中所含的材料在依赖参考文献的语句中论述。
[0085]
如本文所用并且除非上下文另有规定,否则术语“偶联至”旨在包括直接偶联(其中彼此偶联的两个要素彼此接触)和间接偶联(其中至少一个另外的要素位于两个要素之间)。因此,术语“偶联至”和“与......偶联”同义使用。
[0086]
对于本领域技术人员显而易见的是,在不脱离本文的发明概念的情况下,除了已描述的那些之外的更多修改是可能的。因此,除了以所附权利要求的精神之外,本发明主题不受限制。此外,在解释说明书和权利要求书时,所有术语应当以与上下文一致的最广泛的可能方式来解释。特别地,术语“包含(comprises)”和“包含(comprising)”应被解释为:是指要素、组分或非排他方式的步骤,指示可能存在或被利用的所标记的要素、组分或步骤,或者与没有标记的其他要素、组分或步骤的组合。在说明书权利要求是指选自由a、b、c......和n组成的组中的某物的至少一个时,文本应当被解释为仅需要来自所述组的一个要素,而不是a加n、或b加n等。
[0087]
在一些实施方案中,用于描述和要求本发明的某些实施方案的表示成分、性质(诸如浓度、反应条件等)的量的数值在一些情况下应理解为由术语“约”修饰。因此,在一些实施方案中,在书面描述和权利要求书中阐述的数值参数是可随特定的实施方案设法获得的所需性质而变化的近似值。在一些实施方案中,应根据报告的有效数字的数量并且通过应用一般的舍入技术来解释数值参数。尽管阐述本发明的一些实施方案的广泛范围的数值范围和参数是近似值,但是在具体实施例中阐述的数值尽可能精确地报告。在本发明的一些实施方案中提供的数值可含有由在它们的相应试验测量中见到的标准偏差必然产生的某些误差。
[0088]
除非上下文另有明确指示,否则如在本文的描述和随后的整个权利要求中所使用的“一个/种(a/an)”和“所述”的含义包含复数指示物。此外,除非上下文另有明确指示,否则如本文的描述中所使用,“在......中”的含义包括“在......中”和“在......上”。
[0089]
本文中对值范围的列举仅仅意图充当单独提及落入所述范围内的每个单独值的简易方法。除非本文另外指明,否则每个单独数值均并入在本说明书中,如同本文单独列举每个单独数值一样。除非在本文另外指示或以其他方式与上下文明显相矛盾,否则本文所描述的所有方法可按任何合适的顺序进行。使用相对于本文中的某些实施方案提供的任何和所有实例或示例性语言(例如,“诸如”)的目的仅仅是希望更好地阐明本发明而不对另外要求的本发明施加限制。说明书中的任何语言都不应解读为指示任何未要求保护的要素是实施本发明所必需的。
[0090]
本文所公开的本发明的替代要素或实施方案的分组不应解读为是限制性的。每个组的成员可单独地提及并要求保护,或以与所述组的其它成员或本文中出现的其它要素的任何组合形式提及并要求保护。出于便利性和/或可专利性的原因,一组的一个或多个成员可包括在一个组中或从一个组中删除。当发生任何这种包括或删除时,本说明书在本文中应被视为含有所修改的组,因而符合所附权利要求书中使用的所有马库什(markush)组的书面描述。
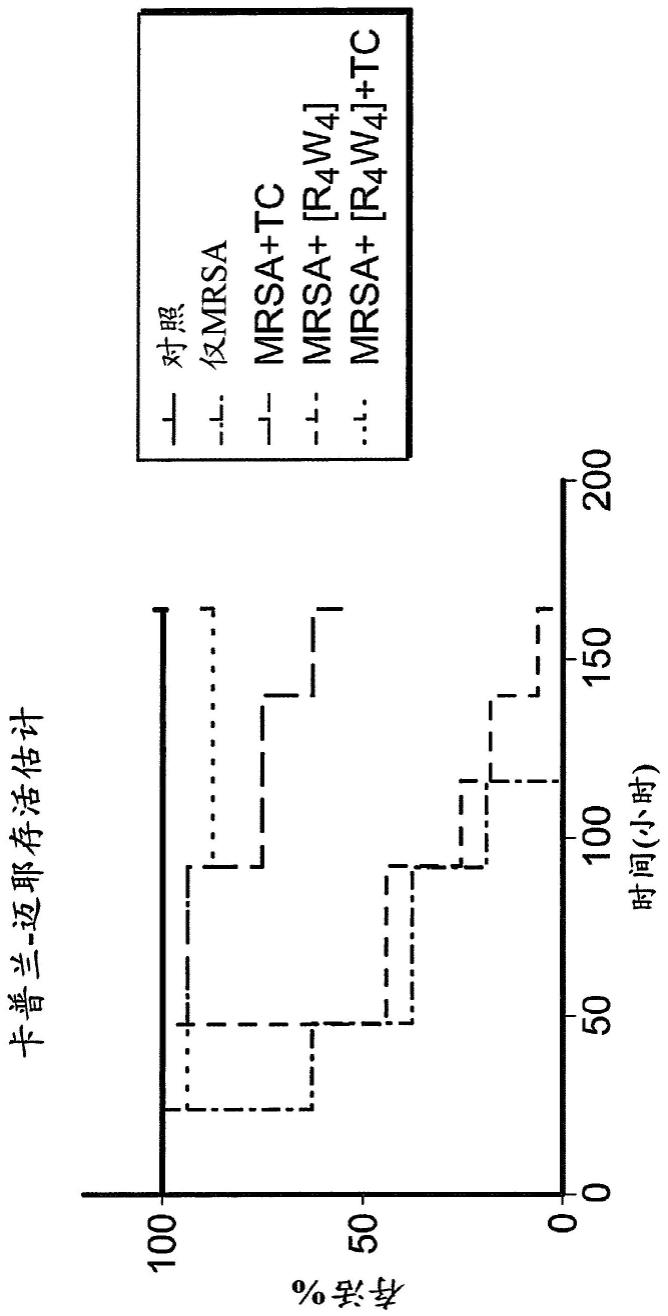
[0091]
因此,仍然需要有效的抗微生物化合物,特别是当针对对常规抗生素具有耐药性的微生物时安全且有效的抗微生物化合物。
[0092]
在本发明概念的实施方案中,提供了在相对侧掺入疏水性氨基酸和带正电荷的氨基酸两者的合成肽,所述合成肽针对革兰氏阳性细菌和革兰氏阴性细菌(包括它们的抗生
素耐药性菌株)具有广谱抗菌活性。此类肽的氨基酸可以是天然存在的或非天然存在的,并且可以d或l异构体形式存在。在一些实施方案中,所述合成肽与增强或增加它们的抗菌作用的其他化合物诸如抗生素、金属纳米颗粒以及抗生素和金属纳米颗粒缀合和/或组合使用。优选的肽化合物防止或减少细菌生物膜产生。
[0093]
应当理解,所公开的技术提供了许多有利的技术效果,包括对现有技术抗生素疗法具有耐药性的感染的安全且有效的治疗。
[0094]
本发明概念的组合物和方法包括含有天然和/或非天然的带正电荷的氨基酸和疏水性残基的线性和环状肽作为抗菌剂。之前合成并评估了几种环状肽和线性肽(图1),所述肽展示了针对耐甲氧西林金黄色葡萄球菌(mrsa)和铜绿假单胞菌(pa01)的抗菌活性(oh等人2014)。先前已证明含有带正电荷的精氨酸(r)和疏水色氨酸(w)残基的环状肽[w4r4]具有抗菌活性。环状肽[w4r4](1,图1)分别针对mrsa和铜绿假单胞菌具有2.67μg/ml(1.95μm)和42.8μg/ml(31.3μm)的mic。
[0095]
本发明与以前的工作不同,因为它包括化学修饰,如用d-氨基酸取代l-氨基酸以避免蛋白水解酶,用非天然氨基酸取代带正电荷的精氨酸或疏水性残基,以及产生尚未发现的序列,并且针对革兰氏阳性细菌和革兰氏阴性细菌以及多重耐药菌性株具有显著更高的广谱活性。一些序列在图2-6中示出。
[0096]
合成了具有疏水性残基和带正电荷的残基作为其基本结构中的氨基酸序列的线性和环状肽。改变了结构中的氨基酸成分,以确定衍生化合物的抗菌活性有效性并建立结构-活性关系。所述策略是基于结构-活性关系改变衍生化合物的净疏水性和正电荷,并评估抗菌潜力。观察到适当的带正电荷的残基和疏水性残基增强了环状肽的固有穿透性质,从而增加了抗菌活性。此外,环状或线性肽与抗生素、金纳米颗粒或抗生素和金纳米颗粒的组合或缀合产生了针对革兰氏阳性和革兰氏阴性多重耐药性临床报告的细菌病原体的广谱活性。
[0097]
优选的化合物可用作治疗细菌感染的独立疗法。化合物也可与当前的抗菌药物和/或金或银纳米颗粒组合使用,以提供用于治疗感染的有效疗法。数据支持用于治疗革兰氏阳性感染和革兰氏阴性感染两者。这些化合物代表了一类新的抗菌剂。这些系列的化合物的结构与目前的抗菌药物的结构不同。因此,这些化合物可能不会受到现有耐药机制的影响。这些肽与抗生素、金纳米颗粒或抗生素和金纳米颗粒的组合的累加和协同性质表明共同施用以对抗细菌感染的潜力。在此总结了所使用的氨基酸、肽序列、其结构的实例、体外抗菌活性、溶血测定和初步体内活性。
[0098]
优选的肽化合物可与抗生素和抗病毒剂物理混合以产生协同抗菌和抗病毒活性。
[0099]
与抗生素组合或缀合。这些肽可单独使用或与当前的临床抗生素组合使用,以提供对细菌感染的增强治疗。肽可与抗生素物理混合,或者可与抗生素缀合作为抗生素-肽缀合物(apc)(图7)。
[0100]
抗微生物肽可用于改善抗生素通过细菌膜的递送,使其对正常细胞的毒性最小化,并克服细菌耐药性。与抗生素组合或缀合将提供协同活性并绕过外排机制。一些抗微生物肽被发现具有分子转运蛋白性质,所述性质可能有助于递送可能遭受诸如外排、耐药性、毒性和稳定性的若干限制的其他抗生素,诸如美罗培南、环丙沙星、特地唑胺和左氧氟沙星。当与四环素组合时,这些肽中的一些在体外模型中显示出具有累加和协同活性。例如,
色氨酸)、其它n-杂芳族和疏水性氨基酸以及脂肪氨基酸nh
2-(ch2)
x-cooh(x=1-20)或nh
2-(ch2)
x-(ch=ch)
y-cooh(x=1-15,y=1-15,z或e构型)。
[0108]
序列。这些肽的优选序列包括线性肽(xnym)或环状肽[xnym]或杂合肽(环状-线性)[xn]ym或xn[ym],其中x是带正电荷的氨基酸,y是疏水性残基,并且n和m=2-9。在具体实例中,n可以是2、3、4、5、6、7、8或9。在其它实例中,m可以是2、3、4、5、6、7、8或9。其它氨基酸可插入在带正电荷的残基之间、疏水性残基之间或带正电荷的残基与疏水性残基之间,而多个带正电荷的残基或多个疏水性氨基酸彼此相邻,从而在一侧产生带正电荷的组分并且在另一侧产生疏水性组分。具有上式的环状肽包括通过n-至c-末端环化、二硫化物环化、钉合法、点击环化和任何其它环化方法形成的那些。环状肽包括具有[x]n[y]m的双环肽,其中一个环状肽含有带正电荷的氨基酸,并且另一个环状肽含有疏水性氨基酸。环状肽可通过氨基酸或适当的接头直接连接。相似或不同的带正电荷的残基或疏水性残基可位于同一肽中。换言之,带正电荷的氨基酸可相同或不同。类似地,同一序列中的疏水性氨基酸可相同或不同。肽可具有杂合结构,其中环状肽含有分别连接至线性疏水性残基或带正电荷的残基的带正电荷的残基或疏水性残基。一些序列显示在表1和表2以及图2-6中。
[0109]
在另一个方面,本发明中的肽单独或与其他抗病毒剂组合可具有针对冠状病毒或其他病毒的抗病毒活性。
[0110]
所述肽与针对sars-cov-2使用的当前抗病毒剂如瑞德西韦具有协同活性。
[0111]
在另一个方面,肽可呈组合物的形式,所述组合物可用于治疗或预防covid-19和其他冠状病毒相关疾病的感染、传播或获得。
[0112]
合成的化合物针对sars-cov-2和其他冠状病毒具有活性,并且可具有作为抗病毒剂的潜在活性。
[0113]
发明人相信,本发明概念的化合物可表现出针对广泛范围的病毒,特别是包膜病毒的抗病毒活性。合适的dna病毒的实例包括(但不限于)疱疹病毒、痘病毒、嗜肝dna病毒和非洲猪瘟病毒科。合适的rna病毒包括(但不限于)黄病毒、甲病毒、披膜病毒、冠状病毒、丁型肝炎、正粘病毒、副粘病毒、弹状病毒、布尼亚病毒、丝状病毒、逆转录病毒和逆转录病毒。特别地,申请人相信,本发明概念的化合物针对由冠状病毒如covid-19引起的疾病可以是有效的。
[0114]
在另一个方面,合成肽可与另一种化合物化学连接以提供物质组合物并且可含有载体或赋形剂,并且可用于通过递送呈可注射剂、固体或半固体形式,如片剂、薄膜、凝胶、乳膏、软膏、子宫托等形式的物质组合物来治疗、预防或减轻细菌性疾病的方法中。
[0115]
本发明概念的化合物可通过任何合适的途径提供给需要治疗的个体。合适的途径包括注射、输注、局部施加至皮肤、局部施加至粘膜(例如口腔、鼻腔、阴道和/或直肠粘膜)、施加至眼表、引入胃肠道和/或吸入。施加模式可根据所治疗的细菌性疾病、细菌性疾病的阶段和/或所治疗个体的特征而变化。在一些实施方案中,药物的施加方式可在治疗过程中改变。例如,呈现急性症状的个体最初可通过注射或输注进行治疗,以便快速提供有用的药物浓度,然后开始摄入(例如,丸剂或片剂)以随时间推移保持这样的有用浓度。
[0116]
因此,包含本发明概念的药物的制剂可以不同的形式且与不同的赋形剂一起提供。例如,提供用于摄取的制剂可以液体、在服用前溶解于液体中的粉末、丸剂、片剂或胶囊形式提供。提供用于摄取的固体形式可提供有肠溶衣或提供药物在胃肠道的选定部分(例
如小肠)中的释放和/或提供药物随时间推移的持续释放的类似特征。意图用于局部施加的制剂可以液体、凝胶、糊剂、软膏和/或粉末形式提供。此类制剂可作为敷料、薄膜或放置在体表上的类似器具的一部分提供。意图用于注射(例如皮下、肌内、眼内、腹膜内、静脉内等)或输注的制剂可以液体或以在使用前溶解或悬浮于液体中的干燥形式(如粉末)提供。意图用于吸入的制剂可类似地以液体形式或在使用前悬浮或溶解于液体中的干燥形式提供,或以具有适合于吸入的粒度的干粉形式提供。此类吸入制剂可以雾化喷雾形式提供或经受雾化以在空气或其他适合吸入的气体载体中产生液滴悬浮液。
[0117]
液体制剂可呈溶液、悬浮液、胶束悬浮液和/或乳液的形式。类似地,干燥或颗粒制剂可以冻干或喷雾干燥的微粒形式提供,所述微粒在一些实施方案中可单独封装。
[0118]
本发明概念的化合物可以提供适当有效的抗菌作用的任何量提供。应当理解,对于给定化合物,这可根据施用途径、所治疗的细菌和所治疗个体的特征而变化。合适的剂量可在0.1μg/kg至100mg/kg体重或0.01μg/ml至100mg/ml w/w/浓度的范围内。
[0119]
应用于本发明概念的化合物的给药方案可根据所治疗的细菌、施加方式、疾病状态的严重性和个体的特征而变化。在一些实施方案中,药物的施加可基本上是恒定的,例如,通过输注、掺入正在进行的静脉内疗法中和/或吸入。在其他实施方案中,本发明概念的化合物可施加一次。在其他实施方案中,本发明概念的化合物可在合适的时间段内周期性地提供。例如,本发明概念的化合物可每2小时、每3小时、每4小时、每6小时、每8小时、每12小时、每日、隔日地、每周两次、每周一次、每两周、每月、每2个月、每3个月、每6个月或每年提供。
[0120]
如上所述,本发明概念的化合物的制剂、剂量和给药方案可根据细菌性疾病的状态而变化。在一些实施方案中,可将这样的化合物提供给需要预防性治疗的个体,例如提供给未感染的个体,以预防在暴露后由细菌或病毒引起感染。在其他实施方案中,可将本发明概念的化合物提供给感染了细菌或病毒但无症状的个体。在其他概念中,可将本发明概念的化合物提供给感染了细菌或病毒并且有症状的个体。如上所述,化合物的给药、途径和给药方案可随着活动性病毒感染的症状变化而调整。
[0121]
在一些实施方案中,如上所述的化合物可与一种或多种其他活性伴随化合物组合使用。合适的伴随化合物包括抗菌化合物、抗病毒化合物、抗真菌化合物、抗炎化合物、支气管扩张剂和治疗疼痛的化合物。发明人预计,协同作用(即大于累加作用)可关于抗菌或抗病毒作用、疾病时间进程的减少、症状严重程度的降低和/或发病率由此类组合产生。
[0122]
类似地,在一些实施方案中,可组合使用如上所述的两种或更多种化合物。发明人预计,协同作用(即大于累加作用)可关于抗菌作用、疾病时间进程的减少、症状严重程度的降低和/或发病率由此类组合产生。
[0123]
抗微生物肽具有抗微生物性质和抗生素的分子转运蛋白。所述肽分别通过干扰细菌膜和成为膜透化剂而具有抗微生物性质和细胞穿透性质。具有内在抗菌活性的细胞穿透肽可捕获抗生素并增强抗生素跨膜的摄取。抗微生物性质将优先被细菌吸收,其中它们逐渐释放它们的货物抗生素,从而通过双管机制产生持续局部抗菌作用,而不会对正常细胞造成显著毒性。所述肽与目前的抗生素具有协同作用。
[0124]
细菌菌株。细菌包括革兰氏阳性细菌和革兰氏阴性细菌以及由任何这些细菌菌株中的任一者产生的生物膜。细菌的一些实例是耐甲氧西林金黄色葡萄球菌(mrsa)、鲍氏不
动杆菌、粪肠球菌、艰难梭菌、肺炎克雷伯氏菌、大肠杆菌、表皮葡萄球菌、肺炎链球菌、变形链球菌、酿脓链球菌、铜绿假单胞菌、结核分枝杆菌、耐碳青霉烯肠杆菌科(cre)肠道细菌和淋病奈瑟氏菌。表3示出细菌的一些实例。
[0125]
采用微量肉汤稀释法来确定每种合成肽的最小抑制浓度,使用万古霉素和美罗培南分别作为针对革兰氏阳性菌株和革兰氏阴性菌株的阳性对照。所有测试的细菌病原体均在临床上报告了多重耐药性菌株。测试针对革兰氏阴性菌株,即铜绿假单胞菌(psa)、肺炎克雷伯氏菌(kpc)、大肠杆菌(escherichia coli)(大肠杆菌(e coli))和革兰氏阳性耐甲氧西林金黄色葡萄球菌(mrsa)的抗菌活性。最小抑制浓度(mic)是抗生素的抑制微生物生长的最低浓度。mic是通过目视检查或使用分光光度计板读取器来确定培养基浊度而确定的。另一方面,最低杀菌浓度(mbc)是杀死99%的细菌生长的最低浓度。许多化合物的mic和mbc值显示在以下表4-23中。与抗生素组合的抗菌活性显示在表24-31和图8-27中。抗生素与肽的缀合物的抗菌活性显示在表32和图28中。肽对生物膜形成的影响在图29a-35中示出。肽在肝细胞系、人皮肤成纤维细胞系、心脏/心肌细胞和人肺成纤维细胞中的细胞毒性在图36-46中示出)。通过uv确定的由肽产生金纳米颗粒在图47和48中示出。肽和肽封端的au-np针对革兰氏阳性细菌的mic显示在表33和34中。肽和肽封端的au-np针对革兰氏阴性细菌的mic显示在表35和36中。肽和肽封端的金纳米颗粒的抗菌活性显示在表37中。在通过肽形成金纳米颗粒、然后添加抗生素时[r5w4](ifx-315)-au-np与抗生素之间的组合的物理混合物mic测定显示在图49-58中。肽[r5w4](ifx-301)首先与抗生素(1∶1比例)混合、然后用于合成au-np在抗菌活性方面的效果在图59-68中示出。
[0126]
数据揭示,许多线性和环状肽具有针对革兰氏阳性菌株和革兰氏阴性菌株的广谱抗菌活性。
[0127]
数据揭示肽与瑞德西韦的组合针对人冠状病毒229e(hcov-229e)产生了显著协同活性(图69)。
[0128]
实施例
[0129]
材料。本研究中使用的树脂上的所有氨基酸结构单元和预负载的氨基酸均购自aapptec。其他试剂、化学品和溶剂购自sigma-aldrich。线性和环状肽、中间体以及最终产物的化学结构通过来自bruker inc.的高分辨率maldi-tof(gt-204)进行表征。用于进一步研究的最终化合物通过采用来自shimadzu(lc-20ap)的反相高效液相色谱使用乙腈0.1%tfa和水0.1%tfa的二元梯度系统和反相制备型柱(x bridge beh130 prep c18,10μm 18
×
250μm waters,inc)进行纯化。米勒欣顿(mueller hinton)ii琼脂(mh)、耐甲氧西林金黄色葡萄球菌mrsa(atcc baa-1556)、铜绿假单胞菌(atcc 27883)、肺炎克雷伯氏菌(atcc baa-1705)和大肠杆菌(atcc 25922)购自atcc。人红细胞(hrbc)购自bioivt用于溶血测定。
[0130]
肽合成;通用。使用适当的树脂和fmoc保护的氨基酸,通过fmoc/tbu固相肽合成方法进行线性和环状肽的合成。例如,受保护的氨基酸-2-氯三苯甲基树脂用作结构单元,并在肽合成玻璃容器中在n,n-二甲基甲酰胺(dmf)中溶胀1小时。在hctu或六氟磷酸2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基脲鎓(hbtu)、羟基苯并三唑(hobt)和dmf中的二异丙基乙胺dipea存在下使用fmoc氨基酸结构单元缀合序列中的氨基酸。每次偶联后,用dmf中的20%(v/v)哌啶裂解fmoc保护基团。在将序列中的下一个氨基酸添加在序列中之前将树脂洗涤3次。分别在新鲜制备的裂解混合物试剂三氟乙酸/三异丙基硅烷/水(92.5%∶2.5%
·
50%,
v/v/v,9.25μl,2.5μl和5μl)存在下通过分析一些树脂珠粒监测反应的进程,并振荡1小时。使用乙醚使肽沉淀,并使用maldi-tof质谱法以α-氰基羟基肉桂酸(chca)作为基质进行表征。一旦线性肽组装在树脂上,就通过与裂解混合物二氯甲烷/三氟乙醇/乙酸7∶2∶1(v/v/v)一起搅拌3小时除去树脂。使用旋转蒸发仪在添加己烷和dcm的混合物情况下在减压下蒸发溶剂,这产生受保护的线性肽的白色固体沉淀物。在无水dmf/dcm(4∶1v/v,200ml∶40ml)混合物中使用1-羟基-7-氮杂苯并三唑(hoat)和n,n
′‑
二异丙基碳二亚胺(dic)在搅拌下使合成的线性肽环化。通过使用裂解混合物试剂三氟乙酸/三异丙基硅烷/水(92∶3∶5,v/v/v)将环化肽完全去保护3小时。使用冷乙醚沉淀环化肽并离心以获得粗固体肽。通过反相高效液相色谱(rp-hplc)采用使用水中的含0.1%tfa(v/v)的溶剂a和乙腈中的溶剂b 0.1%tfa(v/v)的二元梯度以在214nm波长下监测的8ml/min的流速将粗环状肽纯化1小时。将显示所需化合物的级分在多次纯化运行后合并。使用旋转蒸发器除去溶剂并冻干以获得具有tfa盐的粉末状肽。
[0131]
线性肽的合成。通过使用固相合成策略来合成线性肽类似物。负载有氨基酸的2cl-trt树脂和fmoc-氨基酸结构单元用于以0.3mmol的规模进行合成。hbtu/dipea分别用作偶联和活化试剂。dmf中的哌啶(20%v/v)用于fmoc去保护。使用tfa/苯甲醚/茴香硫醚(90∶2.5v/v/v)的裂解混合物使肽裂解3小时。将粗产物通过添加冷乙醚沉淀,使用反相hplc使用0%-90%乙腈(0.1%tfa)和水(0.1%tfa)的梯度使用c-18柱在60分钟内纯化。将纯化的肽冻干以产生白色粉末(100mg)。使用质荷比(m/z)质谱法阐明所有合成肽的化学结构,离子源是基质辅助激光解吸/电离(maldi),并且质量分析仪是飞行时间(tof)分析仪。
[0132]
通过头尾酰胺环化合成环状肽。使用适当的环化方法从侧链保护的线性肽合成环状肽。负载有氨基酸的trt树脂和fmoc-氨基酸结构单元用于以0.3mmol规模进行合成。hbtu和dipea分别用作偶联和活化试剂。dmf中的哌啶(20%v/v)用于fmoc去保护。将侧链保护的肽通过tfe/乙酸/dcm[2∶1∶7(v/v/v)]从树脂脱离,然后在无水dmf/dcm混合物中使用hoat和dic进行环化过夜。使用tfa/苯甲醚/茴香硫醚(90∶2∶5v/v/v)的裂解混合物持续3小时除去所有保护基团。将粗产物通过添加冷乙醚沉淀,并使用反相hplc使用0%-90%乙腈(0.1%tfa)和水(0.1%tfa)的梯度使用c-18柱在60分钟内纯化。将纯化的肽冻干以产生白色粉末(100mg)。使用质荷比(m/z)质谱法阐明所有合成肽的化学结构,离子源是基质辅助激光解吸/电离(maldi),并且质量分析仪是飞行时间(tof)分析仪。
[0133]
二硫化物环化肽的合成。将约30mg含游离(sh)基团的线性肽溶解于10%dmso-h2o溶液(150ml)中。将反应混合物在开口圆底烧瓶中在室温下搅拌24小时。使用0%-90%乙腈(0.1%tfa)和水(0.1%tfa)的梯度使用c-18柱在60分钟内将反应混合物直接注入反相hplc中。将纯化的肽冻干以产生白色粉末(20mg)。使用质荷比(m/z)质谱法阐明所有合成肽的化学结构,离子源是基质辅助激光解吸/电离(maldi),并且质量分析仪是飞行时间(tof)分析仪。
[0134]
抗菌测定。使用美罗培南和万古霉素hcl作为阳性对照针对这些以下临床报告的菌株评估合成的线性肽和环化肽的抗菌活性:耐甲氧西林金黄色葡萄球菌mrsa(atcc baa-1556)、铜绿假单胞菌(atcc 27883)、肺炎克雷伯氏菌(atcc baa-1705)和大肠杆菌(atcc 25922)。通过微量肉汤稀释确定最小抑制浓度(mic),其中最小浓度被确定为在不存在可见细菌生长的孔中的浓度。将细菌的过夜培养物的等分试样在稀释于1ml生理盐水中的胰蛋
白酶大豆肉汤(tsb)或luria肉汤(lb)中生长,以达到0.5mcfarland浊度(1.5
×
108个细菌细胞cfu/ml)。将60μl的0.5mcfarland溶液添加至8940μl的mh培养基中(这是1/150稀释度)。此外,从样品的储备溶液制备512μg/ml的化合物,以用于在lb培养基中进行测试。除第一个孔外,将100μl量的mh培养基吸移至无菌板孔中。通过移液管将200μl量的512μg/ml化合物样品添加至第一个孔中,并使用多尖端移液管用mh培养基沿无菌96孔进行连续稀释,最后一个孔除外。将100μl量的细菌溶液等分试样添加至每个孔中,并将板在37℃下孵育18-24小时。所有实验一式三份进行。
[0135]
最低杀菌浓度(mbc)是在一组特定条件下,在固定时间端(如24小时)内杀死细菌所需的抗菌剂的最低浓度。通过在琼脂板上传代培养并在37℃下孵育24小时,从mic测试的肉汤稀释液确定了有希望的肽的mbc。mbc是通过确定使初始细菌接种物的活力(达到杀菌效果所需的肽浓度)降低≥99.9%的最低抗菌剂浓度来确定的。
[0136]
用抗生素测定肽的最小抑制浓度(mic)的方法。使用11种市售抗生素将所有合成肽的物理混合物(1∶1w/w比)针对四种临床报告的菌株进行了评估:耐甲氧西林金黄色葡萄球菌mrsa(atcc baa-1556)、铜绿假单胞菌(psa,atcc 27883)、肺炎克雷伯氏菌(kpc,atcc baa-1705)和大肠杆菌(大肠杆菌,atcc 25922)。通过微量肉汤稀释确定mic,其中最小浓度被确定为在不存在可见细菌生长的孔中的浓度。将细菌的过夜培养物的等分试样在稀释于1ml生理盐水中的luria肉汤(lb)中生长,以达到0.5mcfarland浊度(1.5
×
108个细菌细胞cfu/ml)。将60μl的0.5mcfarland溶液添加至8940μl的mh培养基中(这是1/150稀释度)。从样品的储备溶液制备128μg/ml(1∶1比例)的测试肽和抗生素,以用于在米勒欣顿肉汤mh培养基中进行测试。除第一个孔外,将100μl量的mh培养基吸移至无菌96孔板中。通过移液管将200μl量的128μg/ml化合物样品添加至第一个孔中,并使用多尖端移液管用mh培养基沿无菌96孔进行连续稀释,最后一个孔除外(未处理的孔)。将100μl量的细菌溶液等分试样添加至每个孔中,并将板在37℃下孵育24小时。所有实验一式三份进行。
[0137]
肽ifx-301、ifx-315、ifx-318、ifx-031和ifx-067与11种市售抗生素的物理混合物的mic测定以评估协同活性。组合疗法为对抗抗生素耐药性和最大化市售抗生素的活性的有效策略提供了一个视角。体外协同结果表明可有效抑制不同临床分离的耐药性菌株中的细菌生长的最合适的组合疗法。选择了几种肽用于与11种市售抗生素(四环素、妥布霉素、左氧氟沙星、环丙沙星、美罗培南、万古霉素、卡那霉素、多粘菌素、达托霉素、克林霉素和甲硝唑)组合的协同测定,针对四种临床报告的菌株(mrsa、kpc、psa和大肠杆菌)进行了评估。通过微量肉汤稀释确定mic,其中最小浓度被确定为在不存在可见细菌生长的孔中的浓度。将细菌的过夜培养物的等分试样在稀释于1ml生理盐水中的luria肉汤(lb)中生长,以达到0.5mcfarland浊度(1.5
×
108个细菌细胞cfu/ml)。将60μl的0.5mcfarland溶液添加至8940μl的mh培养基中(这是1/150稀释度)。从样品的储备溶液制备512μg/ml的测试化合物,以用于在米勒欣顿肉汤mh培养基中进行测试。除第一个孔外,将100μl量的mh培养基吸移至无菌96孔板中。通过移液管将200μl量的512μg/ml化合物样品添加至第一个孔中,并使用多尖端移液管用mh培养基沿无菌96孔进行连续稀释,最后一个孔除外。将100μl量的细菌溶液等分试样添加至每个孔中,并将板在37℃下孵育24小时。所有实验一式三份进行。
[0138]
协同棋盘式测定。第一步,mic针对选择的菌株进行测试以确定用于协同测试的合适的测试浓度范围。将细菌的过夜培养物的等分试样在稀释于1ml生理盐水中的luria肉汤
(lb)中生长,以达到0.5mcfarland浊度(1.5
×
108个细菌细胞cfu/ml)。将60μl的0.5mcfarland溶液添加至8940μl的mh培养基中(这是1/150稀释度)。抗生素以十一(11)点、跨测定板的两倍连续稀释(从1-11)与七(7)点的组合、肽沿测定板的两倍连续稀释进行测试。为了确定每种测试化合物的mic值,在h行(从1-11)中对单独的抗生素进行两倍连续稀释。在沿测定板向下的第12列(a-g)中,对单独肽进行两倍连续稀释。将测定板用100微升的细菌悬浮液接种,在37℃下孵育24小时。
[0139]
棋盘式测定的数据分析。棋盘式测定用于确定抗微生物剂的组合与它们的个别活性相比对抗微生物效力的影响。这种比较表示为分数抑制浓度(fic)指数值。fic指数值考虑了从个体的mic产生最大变化的抗微生物剂的组合。为了定量所测试的抗微生物剂之间的相互作用(fic指数),使用以下等式:
[0140]
a/mica+b/micb=fica+ficb=fic指数
[0141]
其中a和b是组合的每种抗微生物剂的mic(在单个孔中),并且mica和micb是单独每种药物的mic。
[0142]
然后使用fic指数值对测试的两种抗生素的相互作用进行分类。
[0143]
协同作用。当化合物的组合产生≤0.5的fic值时,则与单独化合物相比,化合物的组合增加一种或两种化合物的抑制活性(mic降低)。
[0144]
累加或无差异。当化合物的组合产生<0.5-4的fic值时,由于两种化合物组合的累加效应,所述组合的抑制活性没有增加或抑制活性略有增加。
[0145]
拮抗作用。当化合物的组合产生>4的fic值时,化合物的组合增加mic,或降低化合物的活性。
[0146]
ifx-031、ifx-031-1(、和ifx-111针对代表性eskape病原体的最小生物膜抑制浓度(mbic)测定。将每种化合物以40mg/ml溶解于dmso中并储存在4℃。下文总结了并行评估的阳性对照抗生素及其溶解信息。
[0147]
化合物来源储备液浓度溶剂万古霉素sigma10mg/mldh2o环丙沙星sigma10mg/mldh2o替加环素sigma10mg/mldmso
[0148]
细菌。这些测定中使用的细菌菌株来自美国典型培养物保藏中心(atcc)。每种菌株按照atcc的建议进行繁殖,并且每种菌株作为冷冻甘油储备液储存在-80℃下。下文列出了菌株及其分类和性质。
[0149]
细菌菌株和特征
[0150][0151]
细菌繁殖。使用如表1所示在适当琼脂上生长的细菌菌落接种适当的肉汤,并在如表1所示的适当条件下孵育培养物。孵育后,将培养物在阳离子调节的米勒欣顿肉汤(camhb)中稀释至0.1的光密度625nm(od
625
),其等效于1 x 108cfu/ml。将培养物进一步稀释至用于测定的1 x 106cfu/ml。
[0152]
测定添加spl7013对抑制生物膜形成的时间效应。将每种细菌菌株调整至1 x 106cfu/ml的浓度,并以100ml的体积添加至96孔平底板中。将一百微升(100ml)的每种化合物以10种浓度添加在一式三份孔中。将培养物在每种生物体的适当生长条件下在37℃下孵育24小时。孵育后,除去培养基,并将形成的生物膜在60℃下固定1小时。将二百微升(200ml)的0.06%结晶紫添加至孔中持续5至10分钟,然后用去离子h2o轻轻洗涤孔3次以除去结晶紫。在结晶紫染色后,将200ml的70%乙醇添加至孔中。将相同体积转移至96孔圆底板中,并在molecular devices spectramax plus 384板读取器上测量od
600
。
[0153]
评估了ifx-031、ifx-031-1和ifx-111防止mrsa、肺炎克雷伯氏菌、铜绿假单胞菌和大肠杆菌形成生物膜的能力。所有三种化合物都能够抑制mrsa和铜绿假单胞菌的生物膜形成,但不能抑制肺炎克雷伯氏菌。由于所使用的大肠杆菌菌株是较差的生物膜生产者,因此无法评估对大肠杆菌的抑制作用。还应注意的是,当mrsa暴露于ifx-111时,在较低浓度下生物膜形成增加。当肺炎克雷伯菌氏暴露于ifx-031和ifx-111和大肠杆菌时,在较高浓度下也观察到增加。这些结果并不少见,并且已在科学文献中报告。
[0154]
耐甲氧西林金黄色葡萄球菌。评估了ifx-031、ifx-031-1和ifx-111抑制耐甲氧西林金黄色葡萄球菌菌株atcc 333592形成生物膜的能力。对于ifx-031和ifx-031-1在50μg/ml至0.78μg/ml范围内的浓度下并且对于ifx-111在25μg/ml至1.56μg/ml范围内的浓度下观察到百分之五十(50%)的抑制。在较低浓度的ifx-111下观察到生物膜形成增加。对万古霉素进行了并行评估,并在5mg/ml下具有大约97%抑制,并且在所有其它浓度(2.5μg/ml至0.001μg/ml)下保持大约50%抑制。数据呈现于图29a和29b中。
[0155]
肺炎克雷伯氏菌。评估了ifx-031、ifx-031-1和ifx-111抑制肺炎克雷伯氏菌菌株atcc baa-2470形成生物膜的能力。对于ifx-031在12.5μg/ml下并且对于ifx-031-1在3.13μg/ml和1.56μg/ml下观察到小于或等于50%(≤50%)的抑制。在所评估的任何浓度下,
ifx-111对生物膜形成的抑制均不超过23%。对于ifx-031和ifx-111在50μg/ml和25μg/ml下观察到生物膜形成增加。对替加环素进行了并行评估,并且在50mg/ml至0.78mg/ml范围内的浓度下具有≤50%抑制,并且在两个最低浓度02mg/ml和0.1mg/ml下生物膜形成增加。数据呈现于图3以及图30和31中。
[0156]
铜绿假单胞菌。评估了ifx-031、ifx-031-1和ifx-111抑制铜绿假单胞菌菌株atcc 47085形成生物膜的能力。对于ifx-031在50μg/ml和25mg/ml下观察到小于或等于50%(≤50%)抑制。ifx-031-1在50μg/ml至6.25mg/ml范围内的浓度下显示≤50%抑制。ifx-111在50μg/ml至12.5μg/ml范围内的浓度下显示≤50%抑制。对环丙沙星进行了并行评估,并且在50μg/ml至0.31μg/ml范围内的浓度下具有≤50%抑制。数据呈现于图32和33中。
[0157]
大肠杆菌。评估了ifx-031、ifx-031-1和ifx-111抑制大肠杆菌菌株atcc baa-2471形成生物膜的能力。这种大肠杆菌菌株没有产生可用于准确评估化合物抑制的生物膜。从这些数据可确定,当细菌暴露于ifx-031和ifx-111时,在较高浓度的化合物下生物膜形成增加。为了准确评估化合物抑制,将需要对为生物膜形成的更好生产者的大肠杆菌菌株进行评估。数据呈现于图33和图34中。
[0158]
广谱活性的评估。将每种化合物以40mg/ml溶解于dmso中并储存在4℃。下文总结了并行评估的阳性对照抗生素及其溶解信息。
[0159]
对照抗生素
[0160][0161][0162]
细菌。这些测定中使用的细菌菌株来自美国典型培养物保藏中心(atcc)。每种菌株按照atcc的建议进行繁殖,并且每种菌株作为冷冻甘油储备液储存在-80℃下。下文列出了菌株及其分类和性质。
[0163]
细菌菌株和特征
[0164]
[0165][0166]
细菌繁殖。使用如表1所示在适当琼脂上生长的细菌菌落接种适当的肉汤,并在如表1所示的适当条件下孵育培养物。孵育后,将培养物在阳离子调节的米勒欣顿肉汤(camhb)中稀释至0.1的光密度625nm(od
625
),其等效于1 x 108cfu/ml。将培养物进一步稀释至用于测定的1 x 106cfu/ml。对于肺炎链球菌菌株,需要camhb+2.5%裂解的马血用于测定,并且艰难梭菌使用bhib。
[0167]
最小抑制浓度(mic)测定-细菌。根据临床和实验室标准协会(clsi)推荐的方法,通过使用肉汤微量稀释分析确定每种化合物的mic来评估细菌生物体对测试化合物的敏感性。每种生物体针对测试样品的敏感性的评估包括阳性对照抗生素,并且对于耐药性生物体包括阴性对照抗生素。对于每种生物体,通过将用测定开始前18至20小时新鲜涂铺的菌落制备的肉汤培养物在如表1所示的适当培养基中稀释至0.1的od
625
(相当于0.5mcfarland标准或1 x 108cfu/ml)来制备标准化接种物。将细菌以4000rpm离心,重新悬浮在适当的培养基中,并将悬浮的接种物稀释至大约1 x 106cfu/ml的浓度。将一百微升(100μl)的这种悬浮液添加至96孔板的一式三份孔中,所述板含有100μl在适当培养基中连续稀释2倍的测试化合物和对照化合物。还将一百微升(100μl)的接种物添加至含有100μl阳性对照抗生素的两倍连续稀释液的一式三份孔中和仅含有100μl培养基的孔中。这种稀释方案产生的每种微生物的最终浓度估计为5 x 105cfu/ml。将板在每种生物体的适当生长条件下孵育24小时,并且通过在molecular devices spectramax plus-384板读取器上测量od
625
并针对细菌生长将孔目测评分为+/-来确定在每种化合物浓度下的微生物生长。每种化合物的mic被确定为完全抑制微生物生长的最低化合物稀释度。
[0168]
溶血测定。研究了化合物对新鲜人红细胞的溶血作用(溶血测定)以确定化合物的细胞毒性。结果如下文所示。使用1%triton x、0.2%triton x和ph 7.4的pbs缓冲液作为对照,通过连续稀释进行溶血测定。tritonx是能够通过其极性头部与细胞脂质双层中存在的氢键合的相互作用来裂解细胞的非离子表面活性剂。将来自肽储备(5mg/ml)溶液的2.5μl等分试样添加至17.5μl pbs缓冲液(ph 7.4)中,以在溶液中达到640μg/ml的浓度。将pbs缓冲溶液(20μl的640μg/ml)在板中连续稀释,以达到320μg/ml、160μg/ml、80μg/ml、40μg/ml和20μg/ml。通过添加约10ml pbs缓冲液(ph 7.4)多次洗涤3ml新鲜血液样品并在4000g下离心直到清除上清液。将洗涤的血液样品稀释至20ml体积以用于研究中。将190μl血液样品的等分试样添加至eppendorf管中的10μl化合物样品中,并孵育30分钟。孵育后,将其在4000g下离心5分钟。用1ml pbs缓冲液稀释100μl上清液等分试样,并在567nm处测量样品的吸光度。
[0169]
溶血%计算如下:
[0170][0171]
其中a
x
是不同系列浓度下的吸光度
[0172]
a0是pbs缓冲液(ph 7.4)的吸光度
[0173]
0.2%triton x对照的a
x
吸光度等于100%
[0174]
这些化合物表明它们在测定的浓度范围内引起红细胞的低溶血。作为溶血测定结果的实例在图70中示出。所有结果在表4-14示出。
[0175]
细胞毒性。使用人肺成纤维细胞(mrc-5,atcc编号ccl-171)、肝细胞系(heparg,thermofisher hprgc10)、心脏/心肌细胞(h9c2,atcc编号crl 1446)和人皮肤成纤维细胞系(heka,atcc pcs-200-011)评估肽的体外细胞毒性,以确定肽的毒性。在实验前24小时,将所有细胞以每孔5,000个接种在96孔板中的0 1ml培养基中。将heparg细胞接种在含有glutamax补充剂的威廉姆氏e(william
′
s e)培养基中。将肺细胞和心脏细胞接种在含有fbs(10%)的dmem培养基中。将肽以1-100μm的可变浓度一式三份添加至每个孔中,并在5%co2的湿润气氛中在37℃下孵育72小时。孵育期后,将mts溶液(20μl)添加至每个孔中。然后将细胞在37℃下孵育2小时,并通过使用spectramaxm2微板分光光度计测量490nm处的吸光度来确定细胞活力。细胞存活百分比被计算为[(用化合物的测试混合物处理的细胞的od值)-(培养基的od值)]/[(对照细胞的od值)-(培养基的od值)]
×
100%。
[0176]
美罗培南-[r5w4k]缀合物的合成,所述缀合物针对4种细菌菌株(mrsa、kpc、psa和大肠杆菌)的mic的测定。
[0177]
[r5w4k](ifx-315)的合成。树脂(h-arg(pbf)-2-氯三苯甲基树脂)上预负载的氨基酸和fmoc-氨基酸结构单元用于以0.3mmol的规模进行合成。hbtu/dipea分别用作偶联和活化试剂。dmf中的哌啶(20%v/v)用于fmoc去保护。将侧链保护的肽通过tfe/乙酸/dcm[2∶1∶7(v/v/v)]从树脂脱离,然后在无水dmf/dcm混合物中使用hoat和dic进行环化过夜。使用tfa/苯甲醚/茴香硫醚(90∶2
·
5v/v/v)的裂解混合物持续3小时除去所有保护基团。将粗产物通过添加冷乙醚沉淀,使用反相hplc使用0%-90%乙腈(0.1%tfa)和水(0.1%tfa)的梯度使用c-18柱在60分钟内纯化。将纯化的肽冻干以产生白色粉末(100mg)。使用质荷比(m/z)质谱法阐明合成肽的化学结构,离子源是基质辅助激光解吸/电离(maldi),并且质量分
析仪是飞行时间(tof)分析仪。
[0178]
mic测定。使用美罗培南和[r4w4]作为阳性对照针对四种临床报告的菌株评估了合成缀合物的抗菌测定:耐甲氧西林金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌和肺炎克雷伯氏菌。通过微量肉汤稀释确定mic,其中最小浓度被确定为在不存在可见细菌生长的孔中的浓度。将细菌的过夜培养物的等分试样在稀释于1ml生理盐水中的luria肉汤(lb)中生长,以达到0.5mcfarland浊度(1.5
×
108个细菌细胞cfu/ml)。将60μl的0.5mcfarland溶液添加至8940μl的mh培养基中(这是1/150稀释度)。从样品的储备溶液制备512μg/ml的测试肽,以用于在米勒欣顿肉汤mh培养基中进行测试。除第一个孔外,将100μl量的mh培养基吸移至无菌96孔板中。通过移液管将200μl量的512μg/ml化合物样品添加至第一个孔中,并使用多尖端移液管用mh培养基沿无菌96孔进行连续稀释,最后一个孔除外。将100μl量的细菌溶液等分试样添加至每个孔中,并将板在37℃下孵育24小时。所有实验一式三份进行。
[0179]
ifx301的体内毒性研究。1在给药当天新鲜制备剂量制剂。剂量从低水平开始到高水平,并在动物剂量之间以4小时至24小时交错。如果测试化合物似乎总体上耐受性良好或不耐受,则递增或减少剂量。笼侧观察每天进行两次。临床观察在随机分组之前和之后每天给药进行(给药后前4小时至少每小时一次)以及终止死亡率、发病率检查和临床体征之前进行。在随机分组之前和之后每天给药以及终止之前监测体重。在第8天对所有计划的动物进行大体尸检。进行了全面的大体尸检,这包括对身体外表面、所有孔口、颅腔、大脑外表面和脊髓切割表面以及颅腔、胸腔、腹腔和骨盆腔和它们的内脏、颈部区域、胴体和生殖器的宏观检查;对表38中鉴定的动物鉴定和选定组织(性别适当)进行取样并保存在10%中性缓冲福尔马林(nbf)中。对于计划外的动物(发现死亡和垂死的牺牲动物):进行大体尸检,并保存组织以进行可能的组织学以确定死因。对肾上腺、脑、盲肠、结肠、十二指肠、心脏、回肠、空肠、肾脏、肝脏、直肠、脾脏、胃、胸腺肺、胰腺和睾丸(卵巢)进行了组织病理学;共16个组织/小鼠。对于所有动物,临床观察结果未显示任何异常(表38)。
[0180]
体内大蜡螟测定。在显示出抗菌活性的肽中,[r4w4](1)因其低mic而被选择用于体内研究。大蜡螟(galleria mellonella)是大蜡螟(greater wax moth)的幼虫,并且它已被用作抗真菌和抗菌研究的无脊椎动物模型。通过将mrsa接种物注射到幼虫的前腿中来污染幼虫。然后将肽1与四环素一起注射到感染的幼虫中,并监测它们的存活率一周。评估了肽1的抗菌活性以及它与四环素针对mrsa的协同作用(图71)。测定一周后,87.5%的用肽1和四环素处理的幼虫存活。然而,56.3%和所有幼虫在一周后被杀死,其分别用四环素和肽单独处理。
[0181]
表1.含有混合d-精氨酸(arg)或l-精氨酸(arg)作为带正电荷残基以及疏水性3,3-二苯基-l-丙氨酸(dip)、3(2-萘基)-l-丙氨酸(nai)、3,3-二苯基-d-丙氨酸(dip)、3(2-萘基)-d-丙氨酸(nai)的肽的实例。
[0182]
[0183]
[0184]
[0185][0186]
表2.本公开涵盖的肽的实例。
[0187]
[0188]
[0189]
[0190]
[0191]
[0192][0193]
表3.肽可具有抗菌活性的细菌的实例。
[0194]
[0195]
[0196]
[0197][0198]
表4.含有各种阳离子和疏水性残基的环状肽的抗菌和溶血活性。
[0199]
[0200][0201]
表5.含有各种阳离子和疏水性残基的线性肽的抗菌和溶血活性。
[0202]
[0203][0204]
表6.含有l-或d-精氨酸和l-或d-色氨酸的环状肽的抗菌和溶血活性。
[0205][0206]
表7.含有l-精氨酸和取代的色氨酸残基的环状肽的抗菌和溶血活性
[0207][0208]
表8.含有直接连接或通过间隔基如dab或peg连接的各种阳离子和疏水性残基的环状肽的抗菌和溶血活性。
[0209]
[0210][0211]
表9.含有d-或l-精氨酸和3,3-二苯基-l-丙氨酸(dip)或3,3-二苯基-d-丙氨酸(dip)的环状肽的抗菌和溶血活性。
[0212][0213]
表10.含有d-或l-精氨酸和萘基-l-丙氨酸(nai)或3(2-萘基-d-丙氨酸(nai)的环状肽的抗菌和溶血活性。
[0214]
[0215][0216]
表11.含有d-或l-精氨酸和d-或l-3,3-二苯基丙氨酸和色氨酸的环状肽的抗菌和溶血活性。
[0217][0218]
表12.含有d-或l-精氨酸、d-或l-3(2-萘基)-丙氨酸和色氨酸的环状肽的抗菌和溶血活性。
[0219]
[0220][0221]
表13.含有d-或l-精氨酸与d-或l-3,3-二苯基丙氨酸和色氨酸或与d-或l-3(2-萘基)丙氨酸和色氨酸的线性肽的抗菌和溶血活性。
[0222][0223]
表14.含有d-或l-精氨酸或赖氨酸与d-或l-3(2-萘基)丙氨酸和色氨酸的环状肽的抗菌和溶血活性。
[0224]
[0225][0226]
表15.本发明中的肽针对革兰氏阳性细菌的广谱活性。
[0227]
[0228]
[0229]
[0230][0231]
表16.本发明中的肽针对革兰氏阴性细菌的广谱活性。
[0232]
[0233]
[0234]
[0235][0236]
表17.三种化合物针对艰难梭菌的最小抑制浓度(mic)测定。
[0237][0238]
表18.ifx-111和ifx-135在血清和各种生理相关盐存在下的抗菌活性(mic在补充有各种盐离子(150mm nacl、4.5mm kcl、6mm nh4cl、1mm mgcl2和2mm cacl2)或fbs(25%)的mh肉汤中测量。
[0239][0240][0241]
表19.含有精氨酸和色氨酸残基的环状肽的抗菌活性。
[0242][0243]
表20.选定环状肽的mbc(μg/ml)。
[0244][0245]
表21.含有精氨酸、色氨酸和半胱氨酸残基的环状肽和线性肽的mic(μg/ml)
[0246]
[0247][0248]
表22.含有精氨酸、色氨酸和半胱氨酸残基的环状肽和线性肽的mbc μg/ml
[0249]
[0250][0251]
表23.在盐和血清存在下肽的mic值。
[0252][0253][0254][0255][0256][0257]
表24.ifx-318[r6w4]与抗生素的组合研究。
[0258]
[0259][0260]
表25.ifx-301[r5w4]与抗生素的组合研究。
[0261]
[0262]
[0263][0264]
表26.ifx-315[r5w4k]与抗生素的组合研究。
[0265]
[0266][0267]
表27.ifx-315[r5w4k]与抗生素的组合研究。
[0268]
[0269][0270]
表28.ifx-031与抗生素的组合的抗菌活性
[0271]
[0272][0273]
表29.[r6w4](ifx-318)与抗生素的组合的抗菌活性
[0274]
[0275][0276]
表30.[r5w4k](ifx-315)与抗生素的组合的抗菌活性
[0277]
[0278][0279]
表31.[r5w4](ifx-301)与抗生素的组合的抗菌活性
[0280]
[0281][0282]
表32.美罗培南与ifx-315的缀合物的抗菌活性。
[0283]
[0284][0285]
表33.肽和肽封端的au-np针对革兰氏阳性细菌的mic。
[0286][0287]
表34.肽和肽封端的au-np针对革兰氏阳性细菌的mic。
[0288]
[0289][0290]
表35.肽和肽封端的au-np针对革兰氏阴性细菌的mic。
[0291][0292]
表36.肽和肽封端的au-np针对革兰氏阴性细菌的mic。
[0293]
[0294][0295]
表37.肽和肽封端的金纳米颗粒的抗菌活性。
[0296]
[0297][0298]
表38.ifx301的体内毒性研究。
[0299]
[0300][0301][0302]
[0303][0304]
[0305]
[0306]
[0307]
[0308]
[0309]
[0310]
peptides (amps)ancient compounds that represent a novel weapons in the fight of bacteria biochem.pharmacol 133 177-138
[0314]
domhan c,uhl p,meinhardt a,zimmermann s,kleist c,linder t,leotta k,mer w,wink m 2018 a novel tool against multi-resistant bacterial pathogens lipopeptide modification of the natural antimicrobial peptide renalexm for enhanced antimicrobial activity and improved pharmacokinetics int j antimicrob agents 52(1)52-62
[0315]
de smet k,contreras r 2005 human antimicrobial peptides
·
defensins,cathelicidms and histatms biotechnol lett 27(18)1337-1347
[0316]
el-mahallawy ha,hassan ss,el-wakil m,moneer mm 2016 bacteremia due to eskape pathogens an emerging problem in cancer patients j egypt natl canc inst 28 157-162
[0317]
knappe d,henklem p,hilpert k 2010 easy strategy to protect antimicrobial peptides from fast degradation in serum antimicrob agents chemother 54(9)4003-4005
[0318]
nordstrom r,malmsten m 2017 delivery systems of antimicrobial peptides adv colloid interface sci 242 17-34)
[0319]
oh d,sun j,nasrolahi shirazi a,laplante k l,rowley d c.,parang k 2014 antibacterial activities of amphiphihc cyclic cell-penetrating peptides against multidrug resistant pathogens mol pharmaceutics 11,3528-3536
[0320]
kumar p,kizhakkedathu jn,straus sk 2018 antimicrobial peptides diversity,mechanism of action and strategies to improve the activity and biocompatibility in vivo biomolecules 8(1)4
[0321]
robert s,rothenburger m,graninger w,joukhadar c 2008 daptomycin a review 4 years after first approval pharmacology 81(2)79-91
[0322]
seo m-d won h-s,kim,j h,mishig-ochir t,lee b j 2012 antimicrobial peptides for therapeutic applications a review molecules 17 12276-12286
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1