重组改造的、脂肪酶/酯酶缺陷型哺乳动物细胞系的制作方法
1.本发明涉及人工改造的哺乳动物细胞系、其产生方法、在所述细胞系中产生重组蛋白的方法以及包含其中产生的重组蛋白的组合物。
背景技术:
2.哺乳动物细胞,例如中国仓鼠卵巢(cho)细胞,广泛用于生物制药(biopharmaceutical)工业以生产重组蛋白,包括治疗用蛋白、多肽和单克隆抗体(mab)。在生物产品(bioproduct)制造过程中,需要去除或减少伴随产生的宿主细胞蛋白(hcps),以生产安全且有效的含有重组蛋白的药物、诊断和/或研究试剂产品。在生物产品制造中,已经采用了多种纯化技术来纯化重组蛋白。然而,hcps可难以与哺乳动物细胞中产生的重组蛋白分开。因此,hcps可能对重组蛋白的生产提出重大挑战,特别是对于治疗用生物产品的制造。用于降低用于制造生物产品的哺乳动物细胞中有问题的hcps的表达或活性的方法可以大大降低制造重组蛋白所需的纯化过程的复杂性。使用具有降低的hcps的细胞系经常导致更稳定、更安全和/或更有效的基于重组蛋白的药物、诊断学和/或诊断研究试剂。
3.在重组蛋白产品的生产中,聚山梨醇酯经常用于生物医学制剂中,以改善制造、装运和储存过程中蛋白的稳定性。聚山梨醇酯可以通过减少聚集和颗粒形成来改善生物产品稳定性,特别是由于界面应力和活性成分的表面黏附。然而,在有某些脂肪酶/酯酶的情况下聚山梨醇酯(其是聚氧乙烯山梨糖醇酐的脂肪酸酯)可经历降解以释放长链脂肪酸。这可以例如通过酯水解发生。聚山梨醇酯降解可降低表面活性剂在保护活性药物成分(api)中的有效性,并随着时间的过去导致制剂混浊和颗粒形成,从而使产品不合格(incompliant),限制其贮存期限,且聚山梨醇酯降解产物可能代表对患者安全危险的危险。通过减少或消除负责酶促降解聚山梨醇酯去污剂的细胞脂肪酶/酯酶,可以增加重组生产的含有聚山梨醇酯去污剂的生物产品制剂的贮存期限。增加的贮存期限在重组产品的有效供应中是重要的,从而减少浪费和使得分销网络成为可能。
4.国际专利申请公开wo 2017/053482、wo 2016/138467、wo 2018/039499和wo 2015/095568描述了减少哺乳动物细胞中有问题的hcps(包括各种脂肪酶/酯酶)表达的方法。然而,经常不清楚哪些脂肪酶/酯酶导致与聚山梨醇酯降解相关的具体问题。因此,仍然非常需要人工改造的脂肪酶/酯酶缺陷型哺乳动物细胞,其更有效地处理重组蛋白生产方法和含有聚山梨醇酯的生物产品制剂中残留哺乳动物细胞脂肪酶/酯酶活性的问题。本发明除了别的以外还提供了基因工程宿主细胞,其使得能够制造具有显著较少的聚山梨醇酯降解性宿主细胞蛋白污染物的生物产品,从而导致显著提高的含聚山梨醇酯的生物产品制剂的稳定性。
技术实现要素:
5.在一个方面,提供了哺乳动物细胞,其具有降低的至少一种内源性棕榈酰蛋白硫酯酶(ppt)和至少一种选自溶酶体酸性脂肪酶(lal)、脂蛋白脂肪酶(lpl)、磷脂酶a2和磷脂
酶d的hcp的表达和/或活性。
6.在另一个方面,提供了用于减少蛋白制剂中聚山梨醇酯降解的方法,其包括以下步骤:(a)修饰宿主细胞以减少或消除棕榈酰蛋白硫酯酶1(ppt1)蛋白的表达;(b)修饰宿主细胞以减少或消除溶酶体酸性脂肪酶(lal)、脂蛋白脂肪酶(lpl)、磷脂酶d3(pld3)和/或磷脂酶a2(lpla2)的表达;(c)用编码生物产品的多核苷酸转染细胞;(d)从宿主细胞提取包含感兴趣的蛋白的蛋白级分;(e)使所述蛋白级分与层析介质接触,所述层析介质是a蛋白亲和(pa)层析或另一种亲和层析方法、阳离子交换(cex)层析、阴离子交换(aex)层析或疏水作用层析(hic);和(f)从培养基收集感兴趣的蛋白;(g)将生物产品与脂肪酸酯组合;和(h)任选地,添加缓冲液;和(i)任选地,添加一种或多种药学上可接受的载体、稀释剂或赋形剂。
7.在另一个方面,提供了用于减少蛋白制剂中聚集或颗粒形成的方法,其包括以下步骤:(a)修饰宿主细胞以减少或消除棕榈酰蛋白硫酯酶1(ppt1)蛋白的表达;(b)修饰宿主细胞以减少或消除溶酶体酸性脂肪酶(lal)、脂蛋白脂肪酶(lpl)、磷脂酶d3(pld3)和/或磷脂酶a2(lpla2)的表达;(c)用编码感兴趣的生物产品的多核苷酸转染细胞;(d)从宿主细胞提取包含感兴趣的蛋白的蛋白级分;(e)使所述蛋白级分与层析介质接触,所述层析介质是a蛋白亲和(pa)层析或另一种亲和层析方法、阳离子交换(cex)层析、阴离子交换(aex)层析或疏水作用层析(hic);和(f)从培养基收集感兴趣的蛋白;和(g)将感兴趣的蛋白与脂肪酸酯组合;和(h)任选地,添加缓冲液;和(i)任选地,添加一种或多种药学上可接受的载体、稀释剂或赋形剂。
8.在另一个方面,提供了用于产生稳定的配制的生物产品的方法,其包括以下步骤:(a)修饰宿主细胞以减少或消除棕榈酰蛋白硫酯酶1(ppt1)蛋白的表达;(b)修饰宿主细胞以减少或消除溶酶体酸性脂肪酶(lal)、脂蛋白脂肪酶(lpl)、磷脂酶d3(pld3)和/或磷脂酶a2(lpla2)的表达;(c)用编码生物产品的多核苷酸转染细胞;(d)从宿主细胞提取包含生物产品的蛋白级分;(e)使所述蛋白级分与层析介质接触,所述层析介质是a蛋白亲和(pa)层析或另一种亲和层析方法、阳离子交换(cex)层析、阴离子交换(aex)层析或疏水作用层析(hic);(f)从培养基收集生物产品;(g)将生物产品与脂肪酸酯组合;(h)任选地,添加缓冲液;和(i)任选地,添加一种或多种药学上可接受的载体、稀释剂或赋形剂。
是裂解脂质(脂肪、蜡、固醇、甘油酯和磷脂)的酯酶的亚属。“磷脂酶”是裂解磷脂的脂肪酶的亚属。
16.棕榈酰蛋白硫酯酶1(ppt1)是棕榈酰蛋白硫酯酶家族的成员,且是溶酶体酶,其与溶酶体降解过程中脂质修饰的蛋白的分解代谢有关,并将由脂肪酸棕榈酸酯形成的硫酯从蛋白中的半胱氨酸残基裂解。在实施方案中,中国仓鼠ppt1包含seq id no: 1的氨基酸序列。在实施方案中,ppt1在seq id no: 8的结合/切割区核酸序列处被zfn修饰。溶酶体酸性脂肪酶(lal),也称为溶酶体脂肪酶、脂肪酶a、溶酶体酸和胆固醇酯酶,是在溶酶体中起作用的细胞内脂肪酶。lal催化胆固醇酯键裂解。在实施方案中,中国仓鼠lal包含seq id no:2的氨基酸序列。在实施方案中,lal在seq id no:7的结合/切割区核酸序列处被zfn修饰。
17.脂蛋白脂肪酶同工型x2(本文称为lpl)是由实质细胞分泌并与毛细血管腔内皮细胞结合的糖基化同型二聚体。在实施方案中,中国仓鼠lpl包含seq id no:3的氨基酸序列。在实施方案中,lpl在seq id no:6的结合/切割区核酸序列处被zfn修饰。
18.第xv组溶酶体磷脂酶a2同工型x1(本文称为lpla2)是关键脂质代谢酶家族的成员,且从膜磷脂的sn-2位裂解脂肪酸。在实施方案中,中国仓鼠lpla2包含seq id no:4的氨基酸序列。在实施方案中,lpla2在seq id no:5的结合/切割区核酸序列处被zfn修饰。
19.pld3是磷脂酶d(pld)脂质信号传导酶超家族的成员。已知pld家族成员水解磷脂酰胆碱以产生磷脂酸和胆碱。pld3是n-糖基化的ii型跨膜蛋白,其保留了显示在其他pld家族成员(例如pld1和pld2)中赋予磷酸二酯水解活性的hkd 基序。在实施方案中,中国仓鼠pld3包含seq id no:9的氨基酸序列。在实施方案中,pld3在seq id no: 10的结合/切割区核酸序列处被zfn修饰。
20.术语“哺乳动物细胞”和“宿主细胞”在本文中可互换使用,且指通常用于使用重组dna技术生产生物产品的哺乳动物细胞。例如,中国仓鼠卵巢(cho)细胞、人胚肾293(hek 293)和小鼠骨髓瘤细胞,包括ns0和sp2/0细胞,是用于蛋白表达的常用哺乳动物细胞。优选地,哺乳动物细胞是cho,包括但不限于cho-k1、cho pro-3、dukx-x11、dg44、chok1sv或chok1sv gs-ko。还可以通过插入、敲除或敲低(knock-down)影响重组生物产品多肽的关键质量属性或其他翻译后修饰或编码重组生物产品的基因的表达的基因来修饰亲本细胞系。在实施方案中,宿主细胞是中国仓鼠卵巢(cho)细胞。在一个实施方案中,宿主细胞是cho-k1 细胞、chok1sv细胞、dg44 cho细胞、duxb11 cho细胞、cho-s、cho gs敲除细胞(谷氨酰胺合成酶)、chok1sv fut8敲除细胞、chozn或cho衍生的细胞。cho gs敲除细胞(例如,gsko细胞)是例如cho-k1sv gs敲除细胞(lonza biologics, inc.)。cho fut8敲除细胞是例如potelligent
®ꢀ
chok1sv fut8敲除(lonza biologics, inc.)。在实施方案中,宿主细胞是hela、mdck、sf9、sf21、tn5、ht1080、nb324k、flyrd18、hek293、hek293t、ht1080、h9、hepg2、mcf7、jurkat、nih3t3、pc12、per.c6、bhk(幼仓鼠肾(baby hamster kidney))、vero、sp2/0、ns0、yb2/0、y0、eb66、c127、l细胞、cos(例如,cos1和cos7)、qc1-3、chok1、chok1sv、potelligent
™
(chok1sv fut8-ko)、cho gs敲除、xceed
™
(chok1sv gs-ko)、chos、cho dg44、cho dxb11或chozn细胞,或源自其的任何细胞。
21.本文中的术语“亲本细胞系”指通常用于人工改造蛋白表达的非转基因表达蛋白产物的哺乳动物细胞。在本发明的一些实施方案中,亲本细胞系是cho、hek293或ns0细胞系。优选地,亲本细胞系是cho细胞系,包括但不限于gs-cho(chok1sv或chok1sv gs-ko)细
胞系。
22.术语“表达产物的细胞系”指“亲本细胞系”,其中已插入了一种或多种编码至少一种生物产品的基因,并且其能够表达这种一种或多种蛋白。优选地,“表达产物的细胞系”表达抗体或其抗原结合片段。
23.术语“插入/缺失”指细胞基因组中核酸碱基的插入或缺失。
24.如本文所用的术语“生物产品”指使用重组dna技术衍生自基因工程哺乳动物细胞的基于重组蛋白的感兴趣的产品。例如,生物产品可以包括抗体、其抗原结合片段、疫苗、生长因子、细胞因子、激素、肽、酶、融合蛋白。优选地,生物产品在治疗、诊断、工业中有用和/或用于研究应用。
25.术语“灭活的基因”指这样的基因,其已以这样的方式改变以致于其1)不表达可检测水平的最初由未改变的野生型基因编码的蛋白;和/或2)与最初由未改变的野生型基因编码的蛋白相比,由改变的基因编码的蛋白在表型上没有功能。
26.术语“破坏的基因
”ꢀ
指这样的基因,其已以这样的方式改变以致于1)未改变的野生型基因最初编码的蛋白的表达降低,和/或2)与由未改变的野生型基因编码的蛋白的活性相比,由改变的基因编码的蛋白的活性降低。
27.术语“蛋白”和“多肽”在本文中可互换使用,以指任何长度的氨基酸多聚体。多聚体可以是线型或支化的,其可以包含修饰的氨基酸,并且其可以被非氨基酸中断。所述术语还包括已天然或通过干预修饰的氨基酸多聚体;例如,二硫键形成、糖基化、脂质化(lipidation)、乙酰化、磷酸化或任何其他操作或修饰,例如与标记组分的缀合。所述定义中还包括例如含有一种或多种氨基酸类似物(包括例如非天然氨基酸等)以及本领域已知的其他修饰的蛋白。蛋白的实例包括但不限于抗体、肽、酶、受体、激素、调节因子、抗原、结合剂、细胞因子、fc融合蛋白(例如,与感兴趣的肽/蛋白遗传连接的igg的fc结构域)、免疫黏附素分子等。
28.在本发明的一个方面,提供了哺乳动物细胞,其具有降低的至少一种内源性棕榈酰蛋白硫酯酶(ppt)和至少一种选自溶酶体酸性脂肪酶(lal)、脂蛋白脂肪酶(lpl)、磷脂酶a2和磷脂酶d的hcp的表达和/或活性。在本发明的另一个方面,哺乳动物细胞被进一步修饰以表达至少一种生物产品。生物产品可以是例如1)多肽,2)抗体或其片段,包括但不限于其抗原结合片段,或3)蛋白-蛋白融合物,包括但不限于仅限于fc-融合蛋白。
29.在本发明的一个方面,提供了哺乳动物细胞,其具有降低的内源性棕榈酰蛋白硫酯酶1(ppt1)和至少一种选自溶酶体酸性脂肪酶(lal)、脂蛋白脂肪酶(lpl)、磷脂酶a2(lpla2)和磷脂酶d3(pld3)的hcp的表达和/或活性。
30.在本发明的一个方面,提供了哺乳动物细胞,其在编码溶酶体酸性脂肪酶(lal)蛋白、脂蛋白脂肪酶(lpl)蛋白、磷脂酶a2(lpla2)蛋白和棕榈酰蛋白硫酯酶1(ppt1)蛋白的多核苷酸的编码序列中具有修饰,其中相对于没有任何所述修饰的细胞的表达水平,所述修饰降低了具有修饰的细胞中的lal蛋白、lpl蛋白、lpla2蛋白和ppt1蛋白的表达水平。
31.在本发明的另一个方面,哺乳动物细胞被进一步修饰以表达至少一种生物产品。生物产品可以是例如1)多肽,2)抗体或其片段,包括但不限于其抗原结合片段,或3)fc-融合蛋白。
32.在本发明的另一个方面,提供了哺乳动物细胞,其中所述细胞的编码内源性ppt和
至少一种选自lal、lpl、lpla2和pld3的其他降解聚山梨醇酯的hcp的基因已经被修饰,从而使得内源性ppt1和其他选择的hcps的表达和/或活性降低。优选地,内源性ppt1和至少一种选自lal、lpl、lpla2和pld3的hcp的活性和/或表达已经显著降低或完全消除。在另一个方面,提供了生产哺乳动物细胞的方法,其中编码内源性ppt1和至少一种选自lal、lpl、lpla2和pld3的hcp的基因已经被修饰,从而使得那些hcps的表达和/或活性减少。优选地,内源性ppt1和至少一种选自lal、lpl、lpla2和pld3的hcp的活性和/或表达已经显著降低或完全消除。在本发明的另一个方面,提供了在如本文所述的哺乳动物细胞的实施方案中产生重组蛋白的方法。由本文描述的哺乳动物细胞实施方案产生的材料显示没有或显著降低的水解聚山梨醇酯降解,并且基本上没有相关的脂肪酶活性可以被测量(例如用脂解活性测定)。
33.在一些实施方案中,由本发明的哺乳动物细胞产生的生物产品提供相对于在没有任何修饰的基本上相似的细胞中产生的相同生物产品的聚山梨醇酯降解活性具有显著降低的聚山梨醇酯降解活性的a蛋白结合级分。在一些实施方案中,相对于由在相应的未修饰产物表达细胞系中产生的相同生物产品产生的完整聚山梨醇酯的降解,由在本发明的产物表达细胞系中产生的生物产品产生的完整聚山梨醇酯的降解减少大于约20%、大于25%、大于约30%、大于约35%、大于约40%、大于约45%、大于约50%、大于约55%、大于约60%、大于约65%、大于约70%、大于约75%或大于约80%。在一些实施方案中,相对于由在相应的未修饰产物表达细胞系中产生的相同生物产品产生的完整聚山梨醇酯的降解,由在本发明的产物表达细胞系中产生的生物产品产生的完整聚山梨醇酯的降解减少大于20%、大于25%、大于30%、大于35%、大于40%、大于约45%、大于50%、大于55%、大于60%、大于65%、大于70%、大于75%或大于80%。
34.在一些实施方案中,相对于由在相应的未修饰产物表达细胞系中产生的相同生物产品产生的完整聚山梨醇酯的降解,由在本发明的产物表达细胞系中产生的生物产品产生的完整聚山梨醇酯的降解减少约20%至约80%、约30%至约75%、约35%至约70%、约40%至约65%或约45%至约60%。
35.在一些实施方案中,相对于由在相应的未修饰产物表达细胞系中产生的相同生物产品产生的完整聚山梨醇酯的降解,由在本发明的产物表达细胞系中产生的生物产品产生的完整聚山梨醇酯的降解减少20%
ꢀ‑
80%、30%-75%、35%-70%、40%-65%和45%-60%。
36.在本发明的一个方面,使用基因编辑方法以靶向编码内源性ppt1的基因和编码选自lal、lpl、lpla2和pld3的至少一种hcp的一种或多种基因,以编辑、破坏和/或灭活它们,例如,由于基因组基因座的修饰、插入或缺失。在一些实施方案中,内源性宿主细胞蛋白ppt1和至少一种选自lal、lpl、lpla2和pld3的hcp的一个或两个等位基因被从本文所述的人工改造宿主细胞(例如,cho细胞)的基因组敲除。例如,基因编辑方法包括但不限于使用锌指核酸酶(zfn)、 规律间隔成簇短回文重复序列(clustered, regularly interspaced, short palindromic repeats)(crispr)、转录激活因子样效应物核酸酶(transcription activator-like effector nuclease)(talen)和大范围核酸酶系统。
37.在本发明的一个方面,提供了重组改造的哺乳动物细胞,其包含编码lal蛋白、lpl蛋白、lpla2蛋白和内源性ppt1蛋白的多核苷酸序列中的修饰。在本发明的另一个方面,与缺乏修饰的细胞例如野生型哺乳动物细胞的表达水平相比,修饰降低了lal蛋白、lpl蛋白、lpla2蛋白和ppt1蛋白的表达水平。
38.在一些实施方案中,靶hcp基因通过基因缺失被编辑、破坏和/或灭活。如本文所用的,“基因缺失”指从基因或在基因附近去除dna序列的至少一部分。在一些实施方案中,经受基因缺失的序列包含基因的外显子序列。在一些实施方案中,经受基因缺失的序列包含基因的启动子序列。在一些实施方案中,经受基因缺失的序列包含基因的侧翼序列。在一些实施方案中,经受基因缺失的序列包含编码靶向hcp的信号肽的序列。在一些实施方案中,从靶hcp基因或从相对非常接近靶hcp基因的区域中去除一部分靶hcp基因序列。在一些实施方案中,从染色体中去除完整的靶hcp基因序列。在一些实施方案中,哺乳动物细胞在靶hcp基因附近包含基因缺失。在一些实施方案中,通过基因缺失编辑、破坏和/或灭活靶hcp基因,其中基因序列中至少一个核苷酸或核苷酸碱基对的缺失导致非功能性基因产物。在一些实施方案中,通过基因缺失编辑、破坏和/或灭活靶hcp基因,其中基因序列的至少一个核苷酸的缺失导致基因产物不再具有最初基因产物功能或活性,或功能异常。
39.在一些实施方案中,通过基因增加或置换来编辑、破坏和/或灭活靶hcp基因。如本文所用的,“基因增加”或“基因置换”指靶hcp基因序列的改变,包括插入或置换一个或多个核苷酸或核苷酸碱基对。在一些实施方案中,靶hcp基因的内含子序列被改变。在一些实施方案中,靶hcp基因的外显子序列被改变。在一些实施方案中,靶hcp基因的启动子序列被改变。在一些实施方案中,靶hcp基因的侧翼序列被改变。在一些实施方案中,编码靶hcp的信号肽的序列被改变。在一些实施方案中,将一个核苷酸或核苷酸碱基对添加至靶hcp基因序列。在一些实施方案中,将至少一个连续的核苷酸或核苷酸碱基对添加至靶hcp基因序列。在一些实施方案中,靶hcp基因通过基因增加或置换被失活,其中将至少一个核苷酸或核苷酸碱基对添加或置换到靶hcp基因序列中导致非功能性基因产物。在一些实施方案中,靶hcp基因通过基因失活而灭活,其中将至少一个核苷酸并入或置换至靶hcp基因序列导致基因产物不再具有最初基因产物功能或活性,或者功能异常。
40.通常,crispr系统包括胱天蛋白酶蛋白,例如cas9,和包含核苷酸序列的rna序列,称为指导序列,其与感兴趣的序列互补。胱天蛋白酶和rna序列形成复合物,其识别哺乳动物细胞的dna序列,且接着胱天蛋白酶的核酸酶活性允许切割dna链。胱天蛋白酶同种型具有单链dna或双链dna核酸酶活性。crispr系统中使用的指导rna序列的设计和指导rna序列的数目允许去除具体的基因段和/或添加dna序列。
41.在一些实施方案中,本发明的方法包括使用至少一种选自crispr、talen、zfn和大范围核酸酶系统的基因组编辑系统编辑、破坏和/或灭活编码内源性ppt1的基因和编码选自lal、lpl、lpla2和pld3的至少一种hcp的一种或多种基因。
42.通常,talen系统包括允许识别dna序列和接着发生的双链dna切割的一种或多种限制性核酸酶和两种或更多种蛋白复合物。talen系统的蛋白复合物包括许多各自识别具体的核苷酸的转录激活因子样效应物(tales)和限制性核酸酶的结构域。通常,talen系统被这样设计从而使得各自包含tales和限制性核酸酶的结构域的两个蛋白复合物将以允许限制性核酸酶的两个结构域(每个蛋白复合物一个)形成活性核酸酶并切割具体dna序列的方式单独结合至dna序列。talen系统中蛋白复合物的数目和要切割的序列的设计允许去除具体的基因段和/或添加dna序列。
43.在一些实施方案中,本发明的方法包括使用talen系统编辑、破坏和/或灭活编码内源性ppt1的基因和编码选自lal、lpl、lpla2和pld3的至少一种hcp的一种或多种基因。
44.在一些实施方案中,产生哺乳动物细胞的方法,其中所述哺乳动物细胞具有降低水平的内源性ppt1和降低水平的选自lal、lpl、lpla2和pld3的至少一种hcp,包括使用talen系统编辑、破坏和/或灭活内源性ppt1和至少一种其他靶hcp基因(即,lal、lpl、lpla2和pld3)。
45.通常,zfn系统包括允许识别dna序列和接着发生的双链dna切割的一种或多种限制性核酸酶和两种或更多种蛋白复合物。zfn系统的蛋白复合物包括许多各自识别具体的核苷酸密码子的锌指和限制性核酸酶的结构域。通常,zfn系统被这样设计从而使得各自包含锌指和限制性核酸酶的结构域的两个蛋白复合物将以允许限制性核酸酶的两个结构域(每个蛋白复合物一个)形成活性核酸酶并切割具体dna序列的方式单独结合至dna序列。zfn系统中蛋白复合物的数目和要切割的序列的设计允许去除具体的基因段和/或添加dna序列。
46.在一些实施方案中,本发明的方法包括使用zfn系统编辑、破坏和/或灭活编码内源性ppt1的基因和编码选自lal、lpl、lpla2和pld3的至少一种hcp的一种或多种基因。
47.在一些实施方案中,产生哺乳动物细胞的方法,其中所述哺乳动物细胞具有降低水平的内源性ppt1和降低水平的选自lal、lpl、lpla2和pld3的至少一种hcp,包括使用zfn系统编辑、破坏和/或灭活内源性ppt1和至少一种其他靶hcp基因(即,lal、lpl、lpla2和pld3)。
48.通常,大范围核酸酶系统包括一种或多种允许识别dna序列和接着发生的双链dna切割的大范围核酸酶。
49.在一些实施方案中,本发明的方法包括使用大范围核酸酶系统编辑、破坏和/或灭活编码内源性ppt1的基因和编码选自lal、lpl、lpla2和pld3的至少一种hcp的一种或多种基因。
50.在一些实施方案中,产生哺乳动物细胞的方法,其中所述哺乳动物细胞具有降低水平的内源性ppt1和降低水平的选自lal、lpl、lpla2和pld3的至少一种hcp,包括使用大范围核酸酶系统编辑、破坏和/或灭活内源性ppt1和至少一种其他靶hcp基因(即,lal、lpl、lpla2和pld3)。
51.本文所述的人工改造的宿主细胞(例如,cho细胞)可以包含额外的基因组修饰以改变在那些细胞中产生的抗体的糖基化模式。已证明改变的糖基化模式,例如减少的岩藻糖基化,增加抗体的抗体依赖性细胞毒作用(adcc)活性。例如,敲除fut8(岩藻糖基转移酶8,或a-1,6-岩藻糖基转移酶)的两个等位基因的宿主细胞可以产生具有增强的adcc活性的抗体(参见美国专利no. 6946292)。在一些实施方案中,本文所述的人工改造的宿主细胞(例如,cho细胞)包含减少抗体岩藻糖基化的基因修饰。在一些实施方案中,本文所述的人工改造的宿主细胞(例如,cho细胞)包含编辑、破坏和/或灭活的fut8基因,例如,由于fut8基因组基因座的修饰、插入或缺失。在一些实施方案中,将fut8的一个或两个等位基因从本文所述的人工改造的宿主细胞(例如,cho细胞)的基因组敲除。在这种fut8敲除宿主细胞中产生的抗体可能具有增加的adcc活性。负责糖基化的其他酶包括gdp-甘露糖4,6-脱水酶、gdp-酮-6-脱氧甘露糖3,5-差向异构酶4,6-还原酶(reductase)、gdp-β-l-岩藻糖焦磷酸化酶、n-乙酰葡糖胺转移酶iii和岩藻糖激酶。在一些实施方案中,本文所述的人工改造的宿主细胞(例如,cho细胞)可包含编码一种或多种这些酶的灭活的基因。在实施方案中,中国
仓鼠fut8包含seq id no: 11的氨基酸序列。
52.本文所述的人工改造的宿主细胞(例如,cho细胞)还可以包含影响它们表达的重组蛋白稳定性的额外的基因组修饰。例如,组织蛋白酶d(catd)已被鉴定为与fc-融合重组蛋白的降解有关的cho hcp(参见robert, f.;等人“degradation of an fc-fusion recombinant protein by host cell proteases: identification of a cho cathepsin d protease.
”ꢀ
biotechnology and bioengineering 2009, 104(6), 1132-1141)。在一些实施方案中,本文所述的人工改造的宿主细胞(例如,cho细胞)包含编辑、破坏和/或灭活的catd基因,例如,由于catd基因组基因座的修饰、插入或缺失。在一些实施方案中,catd的一个或两个等位基因从本文所述的人工改造的宿主细胞(例如,cho细胞)的基因组敲除。在这种敲除宿主细胞中产生的重组蛋白在生产过程中可能经历较少的降解。在实施方案中,中国仓鼠catd包含seq id no: 12的氨基酸序列。在实施方案中,catd在seq id no: 13的结合/切割区核酸序列处被zfn修饰。
53.本文所述的人工改造的宿主细胞(例如,cho细胞)还可以包含影响它们表达的重组蛋白的异质性的额外的基因组修饰。例如,羧肽酶d(cpd)能够从igg1、igg2和igg4单克隆抗体同种型切割c-末端赖氨酸(参见国际专利申请公开wo 2017/053482)。这可导致电荷变体,其可以增加制造控制策略的复杂性。在一些实施方案中,本文所述的人工改造的宿主细胞(例如,cho细胞)包含编辑、破坏和/或灭活的cpd基因,例如,由于cpd基因组基因座的修饰、插入或缺失。在一些实施方案中,cpd的一个或两个等位基因从本文所述的人工改造的宿主细胞(例如,cho细胞)的基因组敲除。在这种敲除宿主细胞中产生的重组蛋白可能具有降低的电荷变体异质性。在实施方案中,中国仓鼠cpd包含seq id no: 14的氨基酸序列。在实施方案中,cpd在seq id no: 15的结合/切割区核酸序列处被zfn修饰。
54.本文所述的人工改造的宿主细胞(例如,cho细胞)还可以包含影响用于制造重组蛋白的下游过程的额外的基因组修饰。例如,磷脂酶b-样2(plbl2)和过氧化物氧还蛋白-1(prdx1)是hcps,其已被鉴定为蛋白捕获层析后在cho细胞中产生的重组蛋白中的污染物(参见wo 2016/138467和doneanu, c.;等人“analysis of host-cell proteins in biotheraputic proteins by comprehensive online two-dimensional liquid chromatography/mass spectrometry.
”ꢀ
mabs 2012, 4(1), 24-44)。在一些实施方案中,本文所述的人工改造的宿主细胞(例如,cho细胞)包含编辑、破坏和/或灭活的一种或多种编码由plbl2和prdx1组成的组中的一种或两种蛋白的基因,例如,由于一个或多个基因组基因座的修饰、插入或删除。在一些实施方案中,编码由plbl2和prdx1组成的组中的一种或两种蛋白的一种或多种基因的一个或两个等位基因从本文所述的人工改造宿主细胞(例如,cho细胞)的基因组敲除。在这种敲除宿主细胞中产生的重组蛋白可能具有与野生型相比减少的hcp污染,并且可能需要更少的下游纯化步骤。在实施方案中,中国仓鼠plbl2包含seq id no: 16的氨基酸序列。在实施方案中,plbl2在seq id no: 17的结合/切割区核酸序列处被zfn修饰。在实施方案中,中国仓鼠prdx1包含seq id no: 18的氨基酸序列。在实施方案中,prdx1在seq id no: 19的结合/切割区核酸序列处被zfn修饰。
55.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是他尼组单抗(tanezumab)(参见例如,wo 2004/058184)。
56.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是
来瑞组单抗(lebrikizumab)(参见例如,wo 2005/062967)。
57.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是米吉珠单抗(mirikizumab)(参见例如,wo 2014/137962)。
58.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是索兰珠单抗(solanezumab)(参见例如,wo 2001/62801)。
59.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是多奈单抗(donanemab)(参见例如,wo 2012/021469)。
60.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是泽格特奈单抗(zagotenemab)(参见例如,wo 2016/137811)。
61.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是雷莫芦单抗(ramucirumab)(参见例如,wo 2003/075840)。
62.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是伽奈珠单抗(galcanezumab)(参见例如,wo 2011/156324)。
63.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是依奇珠单抗(ixekizumab)(参见例如,wo 2007/070750)。
64.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是杜拉鲁肽(dulaglutide)(参见例如,wo 2005/000892)。
65.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是耐昔妥珠单抗(necitumumab)(参见例如,wo 2005/090407)。
66.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是奥拉单抗(olaratumab)(参见例如,wo 2006/138729)。
67.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是西妥昔单抗(cetuximab)。
68.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是促血管生成素(angiopoietin)2 mab(参见例如,wo 2015/179166)。
69.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是胰岛素-fc融合蛋白(参见例如,wo 2016/178905)。
70.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是cd200r激动剂抗体(参见例如,wo 2020/055943)。
71.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是上皮调节蛋白(epiregulin)/转化生长因子α(上皮调节蛋白/tgfα)mab(参见例如,wo 2012/138510)。
72.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是促血管生成素样3/8(angptl 3/8)抗体(参见例如,wo 2020/131264)。
73.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是b-和t-淋巴细胞弱化子(btla)抗体激动剂(参见例如,wo 2018/213113)。
74.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是cxc趋化因子受体1/2(cxcr1/2)配体抗体(参见例如,wo 2014/149733)。
75.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是
生长/分化因子15(gdf15)激动剂(参见例如,wo 2019/195091)。
76.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是白细胞介素33(il-33)抗体(参见例如,wo 2018/081075)。
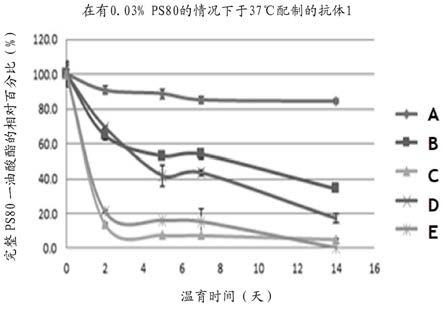
77.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是垂体腺苷酸环化酶激活多肽-38(pacap38)抗体(参见例如,wo 2019/067293)。
78.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是程序性细胞死亡-1(pd-1)抗体激动剂(参见例如,wo 2017/025016)。
79.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是焦谷氨酸-aβ(pglu-aβ,也称为n3pg aβ)mab(参见例如,wo 2012/021469)。
80.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是肿瘤坏死因子α/白细胞介素23(tnfα/il-23)双特异性抗体(参见例如,wo 2019/027780)。
81.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是抗-α-突触核蛋白抗体(参见例如,wo 2020/123330)。
82.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是分化簇(cluster of differentiation)226(cd226)激动剂抗体(参见例如,wo 2020/023312)。
83.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是一元羧酸转运蛋白1(mct1)抗体(参见例如,wo 2019/136300)。
84.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是严重急性呼吸综合征冠状病毒2(sars-cov-2)中和抗体。
85.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是抗-fcγ受体iib(fcgriib或fcγriib)抗体。
86.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是抗白细胞介素34(il-34)抗体。
87.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是抗分化簇19(cd 19)抗体。
88.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是在髓样细胞上表达的触发受体2(trem2)抗体。
89.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其是松弛素类似物。
90.在一些实施方案中,本发明的哺乳动物细胞(例如,cho细胞)编码重组蛋白,其选自他尼组单抗、来瑞组单抗、米吉珠单抗、索兰珠单抗、多奈单抗、泽格特奈单抗、雷莫芦单抗、伽奈珠单抗、依奇珠单抗、杜拉鲁肽、耐昔妥珠单抗、奥拉单抗、西妥昔单抗、促血管生成素2 mab、胰岛素-fc融合蛋白、cd200r激动剂抗体、上皮调节蛋白/tgfα mab、angptl 3/8抗体、btla抗体激动剂、cxcr1/2配体抗体、gdf15激动剂、il-33抗体、pacap38抗体、pd-1激动剂抗体、pglu-aβ、也称为n3pg aβ mab、tnfα/il-23双特异性抗体、抗-α-突触核蛋白抗体、cd226激动剂抗体、mct1抗体、sars-cov-2中和抗体、fcgriib抗体、il-34抗体、cd 19抗体、trem2抗体和松弛素类似物。
91.本发明的实施方案还提供了药物组合物,其包含聚山梨醇酯和选自他尼组单抗、
来瑞组单抗、米吉珠单抗、索兰珠单抗、多奈单抗、泽格特奈单抗、雷莫芦单抗、伽奈珠单抗、依奇珠单抗、杜拉鲁肽、耐昔妥珠单抗、奥拉单抗、西妥昔单抗、促血管生成素2 mab、胰岛素-fc融合蛋白、cd200r激动剂抗体、上皮调节蛋白/tgfα mab、angptl 3/8抗体、btla抗体激动剂、cxcr1/2配体抗体、gdf15激动剂、il-33抗体、pacap38抗体、pd-1激动剂抗体、pglu-aβ、也称为n3pg aβ mab、tnfα/il-23双特异性抗体、抗-α-突触核蛋白抗体、cd226激动剂抗体、mct1抗体、sars-cov-2中和抗体、fcgriib抗体、il-34抗体、cd 19抗体、trem2抗体和松弛素类似物的生物产品,其中所述生物产品由本发明的重组哺乳动物细胞产生。在各种实施方案中,聚山梨醇酯是聚山梨醇酯80(ps80)、聚山梨醇酯20(ps20)、聚山梨醇酯40(ps40)、聚山梨醇酯60(ps60)、聚山梨醇酯65(ps65)或它们的组合。本发明的药物组合物中聚山梨醇酯的浓度可以为按在本发明的组合物中的重量/体积(w/v)计约0.01%至约1%,优选约0.01%至约0.10%,更优选约0.01%至约0.05%,甚至更优选约0.02%至约0.05%。在其他实施方案中,本发明的药物组合物进一步包含一种或多种药学上可接受的载体、稀释剂或赋形剂。包含使用本发明的细胞系生产的生物产品的药物组合物可以通过本领域众所周知的方法进一步配制(例如,remington: the science and practice a/pharmacy,第19版(1995),(a. gennaro等人,mack publishing co.)。
附图说明
92.图1:描绘ps80一油酸酯在有ppt1的情况下随着时间的过去的温度依赖性降解的图,其证明ppt1随着时间的过去以温度依赖性方式降解ps80。
93.图2:描绘在配制的mab样品中ps80一油酸酯随着时间的过去的降解的图:对照(a),以及分别掺加(b)lal
ꢀ‑ꢀ
1 ppm、(c)lpl
ꢀ‑ꢀ
1 ppm、(d)ppt1
ꢀ‑ꢀ
1 ppm,和(e)lpla2
ꢀ‑ꢀ
0.1 ppm,从而证明在有这些蛋白的情况下,存在于制剂中的ps80一油酸酯随着时间的过去比所配制的mab对照降解更大的程度。
94.图3:描绘ps80一油酸酯在对照样品(a)中和在有0.25 un/ml pld4(b)、2.5 un/ml pld4(d)、0.25 un/ml pld7(c)和2.5 un/ml pld7(e)的情况下随着时间的过去降解的图。所述数据定性地证明了pld家族成员随着时间的过去降解ps80的能力。
95.在不限制本发明范围的情况下,以下制剂和实施例为本领域技术人员提供了制备和使用本文所述方法和组合物的方式。
具体实施方式
96.实施例实施例1
–
ppt1的聚山梨醇酯水解活性的表征通过液相层析-质谱分析法(lcms)的聚山梨醇酯降解分析
–
通用程序a在配备有waters synapt
® g2-si质谱仪的waters acquity uplc(i类)上进行lcms分析;柱:agilent plrp-s 2.1
×
50 mm,1000
ꢀå
,5
ꢀµ
m颗粒大小;流动相:a
ꢀ–ꢀ
在水中的0.05%三氟乙酸(tfa),b
ꢀ–
在乙腈中的0.04% tfa。用2% ps80和10 mm柠檬酸盐缓冲液制备标准溶液,以得到0.001、0.002、0.005、0.01、0.025、0.05% ps80溶液。获得在10 mm柠檬酸盐缓冲液中制备的ps80溶液的标准曲线,以通过聚山梨醇酯一油酸酯的lcms提取的离子层析谱定量样品中完整的ps80。使用标准曲线,针对时间 = 零计算每个样品作为一油酸酯的
完整ps80的相对百分比(%)。
97.实施例1a
–
在有ppt1的情况下的聚山梨醇酯80降解聚山梨醇酯80(ps80)和ppt1的样品制备如下:在10 mm柠檬酸盐缓冲液(ph 6)中的0.5 ml 0.02% w/v ps80与5.6
ꢀµ
l 0.3 mg/ml ppt1溶液(通过重组表达制备的)混合且样品在研究期间保持于4、15、25和35℃。每隔一段时间取这些溶液的样品(50
ꢀµ
l),并与5
ꢀµ
l在水中的5%甲酸混合用于lcms分析。使用通用程序a随着时间的过去通过lcms监控作为一油酸酯的剩余完整ps80的百分比。这些数据显示在图1中,并证明ppt1随着时间的过去以温度依赖性方式降解ps80。
98.实施例1b
–
掺加lal、lpl、ppt1和lpla2的mab制剂样品中的聚山梨醇酯80降解配制的mab的样品(抗体1,在20 mm乙酸钠缓冲液中100 mg/ml,ph 5.0,具有0.03% w/v ps80)分别掺加了1 ppm lal、lpl和ppt1以及0.1 ppm lpla2(从重组表达获得的)。样品在研究期间于37℃温育。每个样品用20 mm乙酸钠缓冲液以1:2的比例稀释,且然后使用通用程序a通过lcms进行分析。随着时间的过去作为一油酸酯的剩余完整ps80的百分比显示在表1和图2中。
99.表1:掺加了lal、lpl、ppt1和lpla2的抗体1的样品中完整ps80的相对百分比(%)对时间零注:表1中的所有结果代表n=2这些数据证明在有这些蛋白的情况下,存在于制剂中的ps80一油酸酯随着时间的过去比所配制的mab对照降解更大的程度。
100.所述实施例中的数据一起证明了这些蛋白(lal、lpl、ppt1和lpla2)在溶液中随着时间的过去降解ps80的能力。
101.实施例2
–
fc-融合蛋白制剂中ppt1的鉴定将fc-融合蛋白(fc-融合蛋白1)的两个分开的培养物批次经受a蛋白层析。将a蛋白主流的等分部分(25
ꢀµ
l)与 1m tris-hcl缓冲液、ph 8(5
ꢀµ
l)、barnstead水(172
ꢀµ
l)、蛋白标准混合物(0.8
ꢀµ
l)和2.5 mg/ml牛r-胰蛋白酶(2
ꢀµ
l)混合。将样品于37℃温育16小时。
将样品与2
ꢀµ
l的50 mg/ml二硫苏糖醇(dtt)溶液混合,且然后于90℃加热10分钟。将样品以10,000g离心2分钟,并将上清液转移到小瓶中。然后将样品用在h2o中的5% tfa(5
ꢀµ
l)酸化,并通过lcms进行分析。lcms分析在配备有thermofisher q exactive
™ꢀ
plus质谱仪的waters acquity uplc上进行;柱:waters uplc csh c18,2.1
×
50 mm,1.7
ꢀµ
m颗粒大小;流动相:a
ꢀ–ꢀ
在水中的0.10%甲酸(fa),b
ꢀ–ꢀ
在乙腈中的0.10% fa,柱浸没在冰水中。在所述实验中,于0.5
±
0.1 ppm(n=2)通过非靶蛋白质组学(dda)方法在a蛋白纯化后的fc-融合蛋白1的样品中鉴定了ppt1。
102.实施例3
–
重组改造的lpla2、lal、lpl和ppt1敲除cho细胞系的产生除非另外指出,否则所使用的细胞培养基指补加有8 mm谷氨酰胺的无血清细胞培养基。此外,除非另外指出,否则所使用的哺乳动物细胞是谷氨酰胺合酶缺陷型 cho(gs-cho)细胞系。
103.细胞系的人工改造是通过使用定制的锌指核酸酶(zfn)试剂来完成的,所述试剂被设计为特异于每种靶hcp基因,由sigma aldrich构建(compozr
® custom zinc finger nuclease, 目录号cstzfn, sigma aldrich, st. louis, mo)。lpla2、lpl、lal和ppt1的zfn结合/切割区核酸序列在表2中给出。
104.表2:lpla2、lpl、lal和ppt1的zfn结合/切割区。2:lpla2、lpl、lal和ppt1的zfn结合/切割区。
105.用于基因破坏的细胞的准备
–
通用程序b将装有细胞的小瓶于36℃水浴中解冻,直到只剩下冰的薄片为止。将细胞接种到摇瓶培养中的细胞培养基中。将亲本细胞系的培养物传代培养到细胞培养基中,并按3-天/4-天的时间表进行维持和传代。如上文所指出的,将细胞培养物以0.2
×
10
6 vc/ml种子密度接种在30 ml适当的维持培养基中。在转染日,对细胞进行计数并收获适当体积的细胞。
106.zfn转染和大批培养物(bulk culture)恢复
–
通用程序c使用nucleofector
™
技术和相关的cgmp nucleofector
™
试剂盒v(目录号vga-1003, lonza, basel, 瑞士)进行zfn转染。简而言之,通过离心收集足够用于单核转染(nucleofection)反应的细胞(2
ꢀ‑ꢀ
4.5
×
10
6 vc)。根据制造商的规程,完全去除上清液后,将细胞沉淀悬浮在添加了补充物的100
ꢀµ
l nucleofector
™
溶液v中。将悬浮的细胞通过研磨轻轻混合并转移到含有等分部分的zfn mrna的小瓶中[由sigma aldrich(st. louis, mo)产生的定制zfn试剂盒的一部分]。然后将细胞/mrna混合物转移到nucleofector
™
试剂盒中提供的2 mm杯中,将杯插入nucleofector
™
设备中,并对细胞进行电穿孔。电穿孔后,细胞在杯中于室温下静置30-60秒,且然后使用无菌移液管将它们转移到含有3 ml细胞培
养基的标记的6-孔平板(falcon目录号351146, corning, durham, nc)的孔中。转染的细胞于36℃,6% co2在湿润培养箱中在6-孔平板中维持静止达1-4天,然后将它们转移到在细胞培养基中,36℃,6% co2,125 rpm摇动的摇瓶培养中,直到生存力》90%为止。一旦细胞从转染完全恢复(如通过在摇瓶培养中的生存力所测量的),就使用facs技术对大批培养物进行单细胞分选。
[0107]
对于每种靶hcp的zfn转染可以在单细胞分选之前进行单次。另一方面,对于任何特定靶hcp的zfn转染可以进行两次,在第二次zfn转染之前有完全细胞恢复。不止一轮的zfn转染可能增加相应靶hcp中含有双等位基因(bi-allelic)突变的细胞数目,从而使筛选更有效。
[0108]
大批培养物中zfn-介导的靶hcp序列修饰的检测
–
通用程序d转染后2至7天,收获来自部分恢复到完全恢复的zfn大批培养物的细胞用于进行评价,以评估转染的zfn的活性。surveyor
®
突变检测测定(mutation detection assay)(mda)(transgenomic inc., omaha, ne)用于根据制造商的规程检测zfn程序在靶hcp位点生成修饰的效率。简而言之,使用compozr
®
定制锌指核酸酶(custom zinc finger nuclease)试剂盒(sigma, st. louis, mo)中提供的引物对zfn结合区进行pcr扩增。然后将pcr产物变性并重退火。mda试剂盒中提供的cel-i内切核酸酶(surveyor核酸酶s)用于检测衍生自由天然或野生型序列组成的pcr产物和包含插入/缺失的那些退火的dna错配“泡(bubbles)”,这是因为cel-i将识别这些错配“泡”并切割dna。cel-i消化后,产物然后在2%或4% tbe琼脂糖凝胶(reliant gel, lonza, basel, 瑞士)上分离。在没有dna错配“泡”的情况下,将不发生dna切割,且将出现仅一条带,从而代表pcr产物。如果发生任何非同源末端连接(nhej),从而代表zfn活性,则将在凝胶上观察到两条(或更多)条带形式的切割产物。只有那些在mda中显示出阳性反应的zfn大批培养物才被向前处理到单细胞分选。
[0109]
通过荧光激活细胞分选术进行单细胞分选
–
通用程序e回收的大批培养物通过荧光激活细胞分选术(facs)技术进行分选。用于单细胞克隆的规程和方法是本领域众所周知的。对于克隆,细胞分选仪(moflo
™ꢀ
xdp,beckman coulter)用于根据本领域众所周知的方法通过测量前向和侧向散射方向中的激光衍射来鉴定和分选单个活细胞(参见,例如,krebs, l.等人(2015)
ꢀ“
statistical verification that one round of fluorescence-activated cell sorting (facs) can effectively generate a clonally-derived cell line.
”ꢀ
bioprocess j 13(4): 6-19)。
[0110]
将细胞分选到含有无动物组分分选培养基(ex-cell cho克隆培养基,safc c6366)+ 20% 条件细胞培养基 + 酚红(sigma p0290))的96-孔微量滴定板(falcon,目录号35-3075)中。为了制备条件细胞培养基,将亲本细胞以1
×
10
6 vc/ml的密度接种到不含谷氨酰胺的细胞培养基中,并于36℃,6% co2,125 rpm在摇瓶中温育20-24小时。将培养物离心以去除细胞,并通过无菌0.22
ꢀµ
m过滤器过滤条件培养基。单细胞分选后7到10天,所有平板用每孔50
ꢀµ
l细胞培养基进料。在单细胞分选后第14-15天,分析平板的克隆生长物(outgrowth)。通过使用cloneselect imager(molecular devices, sunnyvale, ca)对分选平板成像或借助于镜子手动地和/或通过观察从红色到橙色/黄色的培养基颜色变化来确定生长物。
[0111]
对克隆衍生的细胞系进行zfn-介导的靶hcp序列修饰的筛选
–
通用程序f
克隆衍生的细胞系(cdcls)当它们变成可见的集落时从源自回收的zfn大批培养物的96-孔平板挑取,并转移到含有细胞培养基的深96-孔平板(greiner,目录号780271)。将克隆衍生的细胞系合并到含有150
ꢀµ
l细胞培养基的深孔平板中。将培养物在静止条件下按3-天/4-天进料/传代时间表维持在细胞培养基中,直到筛选和表征完成为止。
[0112]
使用surveyor
® mda对克隆衍生的细胞系(cdcls)进行插入/缺失的筛选。根据制造商的规程,使用promega wizard
® sv 96基因组dna纯化试剂盒(目录号a2371, promega, madison, wi)从每种细胞系分离基因组dna。zfn pcr反应根据制造商的规程使用phusion
®
高保真性dna聚合酶(new england biolabs, ipswich, ma)进行。mda消化产物在2% tbe琼脂糖凝胶上分离。通过通用程序g或通用程序h对已鉴定的在mda中阳性的细胞系进行表征。
[0113]
使用rt-pcr表征cdcls中的插入/缺失
–
通用程序g:通过对使用靶基因rt-pcr反应的zfn pcr产物进行测序来表征cdcls。根据制造商的规程,使用rneasy micro试剂盒(qiagen, 目录号74004, germantown, md)从每种潜在的ko细胞系分离总rna。根据制造商的规程,使用用于rt-pcr 的superscript
™ꢀ
iii第一链合成系统(目录号18080-051, invitogen, carlsbad, ca)进行反转录反应,继之以根据制造商的规程使用phusion
®
高保真性dna聚合酶(new england biolabs, ipswich, ma)的pcr反应。rt-pcr产物在1% tae琼脂糖凝胶上分离,从而鉴定具有改变的rt-pcr产物的细胞系。选择用于向前处理的细胞系缺乏rt-pcr产物,并且依据lcms不含靶hcp蛋白。
[0114]
使用下一代测序(next-generation sequencing)(ngs)表征cdcls中的插入/缺失
–
通用程序h:mda-阳性cdcls被合并到96-孔深孔平板中用于进行进一步维持。合并时,使用由genewiz提供的下一代测序(ngs)对那些显示“不正常”pcr和/或mda结果的细胞系进行表征。通过lcms评价在靶hcp基因座位中含有可接受的双等位基因插入/缺失的细胞系,从而推进不含靶hcp蛋白的细胞系。
[0115]
调节(scaling)和储存(banking)敲除细胞系
–
通用程序i:基于最初的筛选/表征工作,使得有理由进一步评价的那些cdcls从96-孔深孔平板(dwps)调节到摇瓶,并生成研究细胞库(rcb)。从dwp中,将来自适当孔的细胞转移到含有3 ml细胞培养基的6-孔平板中适当标记的孔中。调节cdcls于36℃,6% co2在湿润培养箱中在6-孔平板中维持静止达3-4天,然后将它们转移到含有15 ml细胞培养基,36℃,6% co2,于125 rpm摇动的摇瓶中。摇瓶培养物至少传代一次,以建立用于储存的适当细胞团。对于每种细胞系,在freezing menstrum(90:10细胞培养基:dmso)中生成3
ꢀ–ꢀ
10小瓶每小瓶10
ꢀ‑ꢀ
13
×
10
6 vc的rcb。将小瓶置于-80℃的聚苯乙烯泡沫塑料(styrofoam)支架“夹层”中至少24小时,以允许细胞的可控速度冷冻。一旦小瓶完全冷冻,它们就于-80℃贮藏。
[0116]
实施例3a
–
lpla2敲除cho细胞系根据通用程序b准备cho细胞用于基因破坏。然后根据通用程序c使细胞经受单次zfn转染和大批培养物回收。使用通用程序d,检测大批培养物中的序列修饰。根据通用程序e将在mda中显示阳性反应的大批培养物向前处理至单细胞分选。根据通用程序f对从其中获得的克隆衍生的细胞系进行靶hcp序列修饰的筛选。根据通用程序g表征插入/缺失,并且选择依据lcms不含可检测量的lpla2蛋白的细胞系。根据通用程序i生成rcb,以产生lpla2敲除cho细胞系。
[0117]
实施例3b
–
lpla2/lpl敲除cho细胞系根据通用程序b准备来自实施例3a的lpla2敲除cho细胞用于基因破坏。然后根据通用程序c使细胞经受两次zfn转染和大批培养物回收。使用通用程序d,检测大批培养物中的序列修饰。根据通用程序e将在mda中显示阳性反应的大批培养物向前处理至单细胞分选。根据通用程序f对从其中获得的克隆衍生的细胞系进行靶hcp序列修饰的筛选。根据通用程序h表征插入/缺失,并且选择依据lcms不含可检测量的lpl蛋白的细胞系。根据通用程序i生成rcb,以产生lpla2/lpl敲除cho细胞系。
[0118]
实施例3c
–
lpla2/lpl/lal敲除cho细胞系根据通用程序b准备来自实施例3b的lpla2/lpl敲除cho细胞用于基因破坏。然后根据通用程序c使细胞经受两次zfn转染和大批培养物回收。使用通用程序d,检测大批培养物中的序列修饰。根据通用程序e将在mda中显示阳性反应的大批培养物向前处理至单细胞分选。根据通用程序f对从其中获得的克隆衍生的细胞系进行靶hcp序列修饰的筛选。根据通用程序h表征插入/缺失,并且选择依据lcms不含可检测量的lal蛋白的细胞系。根据通用程序i生成rcb,以产生lpla2/lpl/lal敲除cho细胞系。
[0119]
实施例3d
–
lpla2/lpl/lal/ppt1敲除cho细胞系根据通用程序b准备来自实施例3c的lpla2/lpl/lal敲除cho细胞用于基因破坏。然后根据通用程序c使细胞经受两次zfn转染和大批培养物回收。使用通用程序d,检测大批培养物中的序列修饰。根据通用程序e将在mda中显示阳性反应的大批培养物向前处理至单细胞分选。根据通用程序f对从其中获得的克隆衍生的细胞系进行靶hcp序列修饰的筛选。根据通用程序h表征插入/缺失,然而,没有一种细胞系在靶向的ppt1区域中含有双等位基因突变。通过lcms评价含有单等位基因或双等位基因插入/缺失的细胞系,从而推进依据lcms评价不含可检测量的ppt1蛋白的细胞系。根据通用程序i生成rcb,以产生lpla2/lpl/lal/ppt1敲除cho细胞系。
[0120]
实施例 4
–
配制的在lpla2/lpl/lal/ppt1敲除cho细胞系中表达的mabs中聚山梨醇酯稳定性与对照的比较fc-融合蛋白(fc-融合蛋白1)和抗体(抗体2)由lpla2、lpl、lal和ppt1被敲除的表达产物的cho细胞系(称为“脂肪酶/酯酶ko细胞系”)以及也由作为对照的没有lpla2、lpl、lal或ppt1敲除的表达产物的cho细胞系产生。fc-融合蛋白1在与0.02% ps80配制之前通过a蛋白层析、低ph病毒灭活、阴离子交换层析(aex)、阳离子交换(cex)层析和切向流过滤(tff)浓缩进行处理。抗体2在与0.02% ps80配制之前通过a蛋白层析、低ph病毒灭活、cex层析和tff浓缩进行处理。fc-融合蛋白1和抗体2的配制的样品在研究期间保持于25℃并直接用于使用通用程序a的lcms分析,以监控随着时间的过去作为一油酸酯的剩余完整ps80的百分比。结果列于表3,且表明使用ko细胞系生产的fc-融合蛋白1和抗体2中的ps80比对照样品更稳定。
[0121]
表3:抗体2和fc-融合蛋白1的样品中完整ps80的相对百分比(%)对时间零
注:所有结果代表n=3实施例5
–
单克隆抗体制剂中pld3的鉴定已通过a蛋白捕获、低ph病毒灭活、阴离子交换(aex)层析和通过切向流过滤(tff)的浓缩处理至150 mg/ml的浓度的含有1 mg抗体3的样品与tris-hcl缓冲液(1 m, ph 8, 5
ꢀµ
l)和水混合以达到195
ꢀµ
l的体积。每种溶液于37℃用5
ꢀµ
l胰蛋白酶和蛋白标准混合物(20
ꢀµ
l 2.5 mg/ml r-牛胰蛋白酶,20
ꢀµ
l蛋白标准混合物和60
ꢀµ
l水)处理过夜。每种样品与1,4-二硫苏糖醇(dtt, 50 mg/ml, 2
ꢀµ
l)混合并加热至90℃10分钟,从而观察到白色沉淀物。然后将样品以13000g离心2分钟,并将上清液转移到hplc小瓶中。在基本如实施例2所述的lcms分析之前,用5
ꢀµ
l在水中的10%甲酸酸化样品。在所述实验中,于17
±
6 ng/mg(n=2)抗体3在抗体3样品中鉴定了pld3。
[0122]
实施例6
–
pld4和pld7的聚山梨醇酯水解活性的表征与pld3一样,pld4和pld7是磷脂酶d家族成员。pld4和pld7的水解活性以基本上如实施例1中所述的方式进行评估。将含有0.02% ps80的样品与0.25和2.5单位/毫升(un/ml)的pld4和pld7于35℃温育,且使用通用程序a随着时间的过去通过lcms监控作为一油酸酯的剩余完整ps80的百分比。在这些条件下35小时温育后,ps80在有2.5 un/ml pld4和pld7的情况下分别是》30%和》80%水解的。这些数据显示在图3中,并定性地证明了pld家族成员随着时间的过去降解ps80的能力。
[0123]
序列表seq id no:1
–
中国仓鼠棕榈酰蛋白硫酯酶1(ppt1)
seq id no:2
–
中国仓鼠溶酶体酸性脂肪酶(lal)seq id no:3
–
中国仓鼠脂蛋白脂肪酶同工型x2(lpl)seq id no:4
–
中国仓鼠第xv组磷脂酶a2同工型x1(lpla2)seq id no:5
–
lpla2的zfn结合/切割核酸序列
seq id no:6
–
lpl的zfn结合/切割核酸序列seq id no:7
–
lal的zfn结合/切割核酸序列seq id no:8
–
ppt1的zfn结合/切割核酸序列seq id no:9
–
中国仓鼠磷脂酶d3(pld3)中国仓鼠磷脂酶d3(pld3)seq id no:10
–
pld3的zfn结合/切割核酸序列seq id no:11
–
中国仓鼠岩藻糖基转移酶8(fut8)seq id no:12
–
中国仓鼠组织蛋白酶 d(catd)
seq id no:13
–
catd的zfn结合/切割核酸序列seq id no:14
–
中国仓鼠羧肽酶d(cpd)seq id no:15
–
cpd的zfn结合/切割核酸序列
seq id no:16
–
中国仓鼠磷脂酶b-样2(plbl2)seq id no:17
–
plbl2的zfn结合/切割核酸序列seq id no:18
–
中国仓鼠过氧化物氧还蛋白-1(prdx1)seq id no:19
–
prdx1的zfn结合/切割核酸序列
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1