具有抗HIV活性的CD4模拟物化合物
具有抗hiv活性的cd4模拟物化合物
技术领域
1.本发明涉及具有抗hiv活性的新型cd4模拟物化合物。更详细而言,本发明涉及体内动力学提高的cd4模拟物化合物。
背景技术:
2.人类免疫缺陷病毒(human immunodeficiency virus:hiv)被认为是一种引起获得性免疫缺陷综合征(acquired immunodeficiency syndrome:aids)的病毒。hiv的感染途径主要有性接触、输血或血液制剂导致的感染、母子感染三种,没有空气感染的危险性。截至目前,全球约有7490万人感染hiv,其中3200万人死于与aids有关的疾病。目前,通过使用药剂的化学疗法成功地抑制了aids,但是还没有实现aids的根治。
3.在hiv中存在hiv-1及hiv-2,进而hiv-1被分类为a~k亚型。hiv-1多见于西半球、欧洲、亚洲、非洲中部、南部、东部,hiv-2多见于非洲西部。与感染例多的hiv-1相比,hiv-2的感染力弱,流行地区也有限,因此抗hiv药和艾滋病疫苗开发主要以hiv-1为靶进行。
4.hiv-1是逆转录病毒的一种。成熟的病毒是直径100-110nm的球状,具有炮弹型的核心结构,包含两拷贝的单链rna基因组或逆转录酶、整合酶等,包裹在由脂双层膜和外壳蛋白组成的包膜结构中。在病毒粒子的表面,作为外壳蛋白的gp120和gp41形成三聚体而存在,它们与作为人cd4阳性t细胞的辅助性t细胞或巨噬细胞上存在的cd4、cxcr4、ccr5特异性结合,在hiv向宿主细胞的侵入中发挥重要的作用。
5.目前,临床上使用的抗hiv药以“逆转录酶抑制剂”、“蛋白酶抑制剂”、“整合酶抑制剂”等抑制hiv特有的酶的作用的酶抑制剂为主。已经建立了将多种药剂组合给药的多剂并用疗法(anti-retroviral therapy:art),但抑制hiv向细胞侵入的侵入抑制剂少,仅有作为膜融合抑制剂的恩夫韦肽(enfuvirtide)、作为ccr5抑制剂的马拉维诺(maraviroc)在临床上应用。但是,这些药剂需要终生定期给药,因为它们虽然能够抑制病毒生长,但不能杀灭病毒。因此,长期给药导致的副作用蓄积的危险性、及高额的治疗费用成为问题。进而,由于hiv容易引起变异,因此耐药性病毒的出现成为大问题,另外疫苗开发也困难。
6.hiv-1侵入宿主细胞的第一阶段是hiv-1的外壳蛋白gp120与宿主细胞表面蛋白cd4(第一受体)的相互作用。伴随该相互作用,gp120的结构大幅变化,被称为v3环的区域露出。接着,该v3环与第二受体(共同受体、ccr5或cxcr4)相互作用,从而gp41露出于表面,穿过宿主细胞的膜,经过膜融合而侵入宿主细胞。
7.2005年,通过hiv-1的合胞体形成抑制筛选,报道了具有抑制上述侵入的作用的低分子化合物nbd-556(非专利文献1)。nbd-556还能够与作为cd4的相互作用部位的gp120的phe43-空穴结合而诱导gp120的结构变化,因此作为低分子cd4模拟体(模拟物)化合物而受到关注(非专利文献2~4)。但是,nbd-556存在抗hiv活性低、细胞毒性高、水溶性低等问题,以nbd-556为先导化合物的结构活性相关研究正在积极开展(非专利文献5~8)。
8.本发明人等组迄今为止发现,改变nbd-556的哌啶环部位,合成具有两个环己基的化合物har-171,该化合物与nbd-556相比细胞毒性低,显示更强的抗hiv活性(非专利文献
6)。另外,用在nbd-556的哌啶环中导入了一个环己基的单环己基型的化合物设计、合成提高了亲水性的各种新型衍生物,进行了它们的抗hiv活性、细胞毒性、gp120结构变化诱导能力的评价、及通过使用了综合计算化学系统molecular operating environment(moe,chemical computing group inc.)的对接模拟进行的相互作用方式的预测,结果能够获得具有优异的抗hiv活性,并且细胞毒性低的物质(专利文献1)。还发现当这些化合物与特异性识别在hiv侵入机制中途露出的v3环的中和抗体并用时,带来协同的抗hiv效果。
9.在上述专利文献1中报道的化合物中,作为与nbd-556相比抗hiv活性显著高、细胞毒性大幅降低的cd4模拟物化合物之一,发现了具有下述的结构的n
1-(4-氯苯基)-n
2-(1-(2-(5-胍基戊酰胺)乙基)-2-环己基哌啶-4-基)草酰胺(在本说明书中记载为yir-821)。
10.[化学式1]
[0011][0012]
专利文献1:国际公开第2016/190331号公报
[0013]
非专利文献1:qian,z.et al.,virology 339,213-225(2005)
[0014]
非专利文献2:schon,a.et al.,biochemistry 45,10973-10980(2006)
[0015]
非专利文献3:madani,n.et al.,structure 16,1689-1701(2008)
[0016]
非专利文献4:hillel,h.et al.,plos pathogens 5,e1000360(2009)
[0017]
非专利文献5:yamada,y.et al.,bioorg.med.chem.lett.20,354-358(2010)
[0018]
非专利文献6:narumi,t.et al.,bioorg.med.chem.19,6735-6742(2011)
[0019]
非专利文献7:nguyen,w.et al.,bioorg.med.chem.lett.22,7106-7109(2012)
[0020]
非专利文献8:narumi,t.et al.,bioorg.med.chem.21,2518-2526(2013)
技术实现要素:
[0021]
如上所述,本发明人等报道了具有高的抗hiv活性,并且细胞毒性低,且在与中和抗体并用时能够带来协同的抗hiv活性的cd4模拟物化合物,但是通过进一步推进结构活性相关研究,以获得体内动力学进一步提高的化合物为课题进行了各种研究。
[0022]
鉴于上述的课题,以上述yir-821为母体化合物合成各种衍生物,反复研究的结果是,本发明人等通过在yir-821上加成peg链或烷基链作为侧链,成功地获得了在体外及体内具有比yir-821显著长的半衰期、因此可持续长期效果的新型cd4模拟物化合物,从而完成了本发明。
[0023]
即,本发明提供以下内容。
[0024]
1.下述的通式(i)表示的化合物或其盐,
[0025]
[化学式2]
[0026][0027]
[式中,r1表示c2h4(oc2h4)
n-och3、或c
mh2m+1
,r2表示o或nh,n为3~25,m为4~22]。
[0028]
2.根据上述1所述的化合物或其盐,由下述式表示,
[0029]
[化学式3]
[0030][0031]
[式中,n为3~25]。
[0032]
3.根据上述2所述的化合物或其盐,n为4~23。
[0033]
4.一种hiv感染抑制剂,包含上述1~3中任一项所述的化合物或其盐作为有效成分。
[0034]
5.一种用于治疗或预防hiv感染的药物组合物,包含上述4所述的hiv感染抑制剂。
[0035]
6.根据上述4所述的hiv感染抑制剂、或上述5所述的药物组合物,其特征在于,与抗-hiv抗体组合给药。
[0036]
7.根据上述6所述的hiv感染抑制剂、或药物组合物,抗-hiv抗体是hiv-1表面上的v3环特异性中和抗体。
[0037]
本说明书包含本技术的优先权所依据的日本专利申请号2019-195967号的公开内容。
[0038]
根据本发明,能够提供具有高的抗hiv活性、并且细胞毒性低、且半衰期显著延长的cd4模拟物化合物;及包含其作为有效成分的新型hiv感染抑制剂。
附图说明
[0039]
图1示出通过静脉内注射给药后的yir-821的血中浓度变化。
[0040]
图2示出通过静脉内注射给药后的tkb-002
·
2tfa的血中浓度变化。
[0041]
图3示出释放烷基链的yir-821衍生物在体外随时间的降解。
[0042]
图4示出释放peg链的yir-821衍生物在体外随时间的降解。
具体实施方式
[0043]
以下,详细说明本发明。
[0044]
如上所述,本发明提供由通式(i)表示的化合物或其盐,
[0045]
[化学式4]
[0046][0047]
[式中,r1表示c2h4(oc2h4)
n-och3、或c
mh2m+1
,r2表示o或nh,n为3~25,m为4~22]。
[0048]
上述的化合物是在yir-821的侧链具有peg链或烷基链的yir-821衍生物。为了使其具有适合作为cd4模拟物化合物的活性、毒性低且具有适合的溶解性,peg链长或烷基链长的范围必须在特定的范围内,因此,在上述的通式中,在具有peg链的衍生物中n在3~25的范围内,例如n可在4~23、3~7、3~5、9~13、10~12、21~25、22~24的范围内。在具有烷基链的衍生物中m优选在4~22的范围内,例如m可在5~21、6~20、7~19、8~18的范围内。
[0049]
在一实施方式中,本发明的化合物是具有peg链的化合物,上述的通式(i)中的r1为c2h4(oc2h4)
n-och3,r2为nh。该实施方式的化合物由下述的式表示,释放peg链的降解反应难以产生,可带来更长的半衰期。
[0050]
[化学式5]
[0051][0052]
[式中,n为3~25。]
[0053]
在另一实施方式中,本发明的化合物是具有peg链的化合物,上述的通式(i)中的r1为c2h4(oc2h4)
n-och3,r2为o。该实施方式的化合物由下述的式表示,通过-c(=o)o-基团的水解释放peg链的反应可在比较早期产生。
[0054]
[化学式6]
[0055][0056]
[式中,n为3~25。]
[0057]
在一实施方式中,本发明的化合物是具有烷基链的化合物,上述的通式(i)中的r1为c
mh2m+1
,r2为nh。该实施方式的化合物由下述的式表示,释放烷基链的降解反应难以产生,可带来更长的半衰期。
[0058]
[化学式7]
[0059][0060]
[式中,m为4~22。]
[0061]
在另一实施方式中,本发明的化合物是具有烷基链的化合物,上述的通式(i)中的r1为c
mh2m+1
,r2为o。该实施方式的化合物由下述的式表示,通过-c(=o)o-基团的水解释放烷基链的反应可在比较早期产生。
[0062]
[化学式8]
[0063][0064]
[式中,m为4~22。]
[0065]
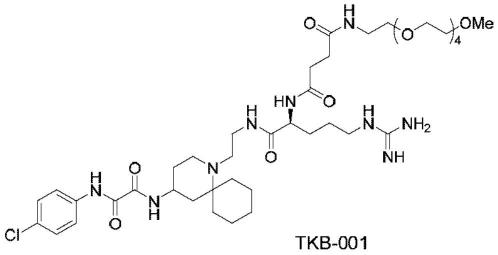
在本发明的优选方案中,本发明的化合物是具有下述的结构的化合物,其中上述的通式(i)中的r1为c2h4(oc2h4)
n-och3,r2为nh,且n为4。在本说明书中,将下述的化合物称为tkb-001。
[0066]
[化学式9]
[0067][0068]
在本发明的另一优选方案中,本发明的化合物是具有下述的结构的化合物,其中上述的通式(i)中的r1为c2h4(oc2h4)
n-och3,r2为nh,且n为11。在本说明书中,将下述的化合物称为tkb-002。如实施例所示,发现tkb-002的血中半衰期比yir-821长3.48倍,即使在人肝微粒体的共存下也是稳定的。
[0069]
[化学式10]
[0070][0071]
在本发明的再一优选方案中,本发明的化合物是具有下述的结构的化合物,其中上述的通式(i)中的r1为c2h4(oc2h4)
n-och3,r2为nh,且n为23。在本说明书中,将下述的化合物称为tkb-003。
[0072]
[化学式11]
[0073][0074]
本发明的化合物能够使用本技术说明书的记载、及本领域中通常使用的技术,例如通过从作为母体化合物的yir-821出发的合成途径来合成,但合成方法没有特别限定。yir-821的合成没有限定,但例如能够基于国际公开第2016/190331号公报的记载来进行。
[0075]
本发明的化合物能够在哌啶环氮原子及胍基的氮原子的任一部分或两者上与无机或有机碱形成盐。作为盐,没有特别限定,但优选药学上可接受的盐,例如能够优选使用盐酸盐、硫酸盐、磷酸盐、琥珀酸盐、富马酸盐、甲磺酸盐、对甲苯磺酸盐、氢溴酸盐、乙酸盐、三氟乙酸盐等。
[0076]
本发明的化合物或其盐作为cd4模拟物化合物发挥功能,能够竞争性地抑制hiv的gp120的phe43-空穴与cd4的结合。另外,不受任何理论的束缚,但由本发明的化合物或其盐引起的gp120的结构变化与通过与cd4的相互作用产生的变化不同,使v3环露出,但不产生随后与共同受体的结合,因此能够抑制hiv向宿主细胞的侵入。因此,本发明提供包含上述的本发明的化合物或其盐作为有效成分的hiv感染抑制剂。
[0077]
本发明的化合物或其盐也能够直接作为hiv感染抑制剂给药,但除了该有效成分以外,还能够适当添加药物组合物中通常使用的载体、赋形剂、防腐剂、氧化稳定剂等,作为药物组合物给药。因此,本发明还提供用于治疗或预防hiv感染的药物组合物,其包含上述的hiv感染抑制剂。
[0078]
本发明的hiv感染抑制剂及药物组合物能够经口给药及非经口给药,例如可举出经口、通过向静脉内、肌内、经皮、皮下、皮内、腹腔内的注射或注入给药等,但没有特别限定。给药途径可优选为静脉内、肌内或皮下注射。本领域技术人员能够适当确定用于给药本发明的hiv感染抑制剂及药物组合物的优选给药途径。
[0079]
本发明的hiv感染抑制剂对人的给药量取决于待给药患者的年龄、体重、症状等,没有特别限定,例如能够是每天100μg/kg体重~100mg/kg体重,优选500μg/kg体重~50mg/kg体重,更优选1mg/kg~30mg/kg体重的范围。
[0080]
进而,本发明的hiv感染抑制剂能够单独使用,但也意图与具有根据不同机制的抑制作用的其它抗hiv药剂并用。作为其它抗hiv药剂,没有特别限定,可举出逆转录酶抑制剂、蛋白酶抑制剂、整合酶抑制剂等。例如作为逆转录酶抑制剂,可举出齐多夫定、拉米夫定、阿巴卡韦、替诺福韦、恩曲他滨、依法韦仑等,作为蛋白酶抑制剂,可举出阿他扎那韦、达纳那韦、利托那韦等,作为整合酶抑制剂,可举出雷特格韦等,但并不意图加以限定。抗hiv感染抑制剂和其它抗hiv药剂能够包含在相同或不同的药物组合物中。本发明的hiv感染抑制剂和其它抗hiv药剂的给药可以同时、连续或完全不同。另外,本发明的hiv感染抑制剂和其它抗hiv药剂的给药途径可以相同或不同。
[0081]
另外,本发明的hiv感染抑制剂还意图与hiv特异性抗体并用。作为抗体,没有特别限定,但由于本发明的hiv感染抑制剂通过与hiv的结合而在gp120中引起结构变化,能够使v3环露出,因此优选使用中和抗体、特别是hiv的v3环特异性中和单克隆抗体及其功能性片段。
[0082]
关于抗hiv单克隆抗体,在本领域进行了各种研究开发,作为针对hiv的v3环的单克隆抗体的代表,可举出现在临床试验正在进行中的kd-247(通用名称:舒维组单抗(suvizumab))。抗hiv单克隆抗体的细节例如可举出journal of virology,june 2006,p.5552-5562;journal of virology,june 2006,p.5563-5570;化学及血清疗法研究所报道黎明,23:42-54(2014);专利第2989862号及专利第5526386号等,kd-247的vh及vl区域的氨基酸序列也公开在上述的journal of virology,june 2006,p.5552-5562中。本领域技术人员能够基于这些信息获得kd-247抗体及其它抗hiv抗体。
[0083]
因此,本技术发明提供上述的hiv感染抑制剂、或上述的药物组合物,其特征在于,与抗hiv抗体组合给药。没有限定,但在优选的实施方式中,抗-hiv抗体是hiv-1表面上的v3环特异性中和抗体。
[0084]
本发明的hiv感染抑制剂和抗hiv抗体的给药可以同时、连续或完全不同。另外,本发明的hiv感染抑制剂和抗hiv抗体的给药途径可以相同或不同。
[0085]
实施例
[0086]
通过以下的实施例具体说明本发明,但本发明不受这些实施例的限定。
[0087]
[参考例1yir-821的血中半衰期的测定]
[0088]
对猕猴(mm616、体重8.00kg)静脉内注射192mg(10.1mg/ml)的yir-821,21分钟、39分钟、63分钟、91分钟、98分钟、113分钟、143分钟、201分钟、328分钟、453分钟后采血,通过hplc测定血中浓度。
[0089]
hplc条件如下所述。
[0090]
测定装置:jasco pu-2089plus(jasco corporation,ltd.)
[0091]
色谱柱:cosmosil 5c
18-arii色谱柱(4.6
×
250mm,nacalai tesque,inc.)
[0092]
溶剂a:含有0.1%(v/v)tfa的h2o
[0093]
溶剂b:含有0.1%(v/v)tfa的ch3cn
[0094]
梯度:溶剂a中20-50%溶剂b、30分钟
[0095]
流速:1cm3/分钟
[0096]
检测:通过260nm的uv进行检测
[0097]
其结果,yir-821的血中浓度如图1所示推移,算出血中半衰期为31.0分钟。
[0098]
[实施例1本发明的化合物的合成1]
[0099]
通过以下的步骤的合成方案合成具有peg链的本发明的化合物。
[0100]
[化学式12]
[0101][0102]
在0℃下向化合物1(13.0g,20.0mmol)的meoh(67ml)溶液中添加socl2(1.6ml,22mmol)。将反应混合液在室温下搅拌17小时,然后将混合液减压浓缩得到粗混合物,为白色粉末。向ch2cl2(219ml)中的粗混合物中添加哌啶(9.32g,109.5mmol)。将反应混合液在室温下搅拌2小时,然后经硅胶柱色谱(chcl3/meoh=10/1)纯化,得到化合物3(n
ω-((2,2,4,6,7-五甲基-2,3-二氢苯并呋喃-5-基)磺酰基)-l-精氨酸甲酯),为白色粉末(7.61g,收率87%)。
[0103]1h nmr(500mhz,cdcl3)δ1.45(s,6h),1.59-1.66(m,2h),1.79-1.82(m,1h),1.87(s,3h),2.09(s,3h),2.51(s,3h),2.57(s,3h),2.95(s,2h),3.16-3.21(m,2h),3.48-3.51(m,1h),3.69(s,3h),6.22(br,2h),6.31(br,1h);
13
c nmr(500mhz,cdcl3)δ12.6,18.1,19.4,25.9,28.8,31.5,41.1,43.5,51.0,52.4,54.1,86.6,117.7,124.8,132.5,133.3,138.6,156.4,159.0,176.1;[α]d=+4.90(c 1.02,chcl3);hrms(esi),c
20h33
n4o5s
+
[m+h]
+
m/z:计算值441.2166,实测值441.2165。
[0104]
[化学式13]
[0105][0106]
在室温下向化合物3(6.81g,15.5mmol)的ch2cl2(155ml)溶液中添加琥珀酸酐(1.64g,16.3mmol)及et3n(2.38ml,17.1mol)。将反应混合液在室温下搅拌17小时,然后将混合液减压浓缩,经硅胶柱色谱(chcl3/meoh=5/1)纯化,得到化合物4((s)-4-((1-甲氧基-1-氧代-5-(3-((2,2,4,6,7-五甲基-2,3-二氢苯并呋喃-5-基)磺酰基)胍基)戊烷-2-基)氨基)-4-氧代丁酸),为白色粉末(5.04g,9.32mmol,收率60%)。
[0107]1h nmr(400mhz,cdcl3)δ1.46(s,7h),1.58(b,2h),1.68-1.75(m,1h),1.89-1.91(m,1h),2.09(s,3h),2.44-2.48(m,4h),2.55-2.66(m,6h)2.78-2.85(m,1h),2.95(s,2h),3.18(b,2h),3.73(s,3h),4.60(b,1h),6.36(b,2h),6.91(b,1h);
13
c nmr(500mhz,cdcl3)δ
12.8,18.2,19.6,25.1,28.9,29.8,31.0,41.0(2c),43.5,52.0,52.1,52.2,53.0,86.9,118.0,125.1,132.9,138.9,156.6,159.4,172.8,173.1,176.5;[α]d=+22.7(c 1.02,chcl3);hrms(esi),c
24h35
n4o8s-[m-h]-m/z:计算值539.2181,实测值539.2179。
[0108]
[化学式14]
[0109][0110]
在0℃下向化合物4(540mg,1mmol)的chcl3(10ml)溶液中添加hobt
·
h2o(203mg,1.5mmol)、edci
·
h2o(288mg,1.5mmol)、m-peg4-胺
·
hcl(288mg,1mmol)、及dipea(697μl,4mmol)。将反应混合液在室温下搅拌过夜,然后添加饱和nh4cl水溶液使反应停止,用ch2cl2萃取,然后将有机相经mgso4浓缩至干。在室温下向thf(10ml)中的粗混合物中添加1m lioh水溶液(2ml)。将反应混合液在室温下搅拌30分钟,然后过滤混合液,添加1n hcl水溶液淬灭,用chcl3萃取。将有机相经mgso4干燥,减压浓缩得到化合物6(n
2-(18-氧代-2,5,8,11,14-五氧杂-17-氮杂二十一烷-21-酰基)-n
ω-((2,2,4,6,7-五甲基-2,3-二氢苯并呋喃-5-基)磺酰基)-l-精氨酸)。
[0111]
[化学式15]
[0112][0113]
在0℃下向化合物7(49.7mg,127.8μmol)的thf(1.3ml)溶液中添加lialh4(16.0mg,421.7μmol)。将混合液在室温下搅拌1.5小时,然后在0℃下添加饱和酒石酸钾钠水溶液,用1m naoh水溶液(ph=13~14)碱化。用chcl3萃取,将有机相经mgso4干燥,减压浓缩。将粗混合物溶解于ch2cl2(1ml),在0℃下添加hobt
·
h2o(10.4mg,71.1μmol)、edci
·
h2o(13.6mg,71.1μmol)、上述的化合物6(49.1mg)、及dipea(22μl,129.2μmol)。将反应混合液在室温下搅拌16小时,然后添加饱和nahco3水溶液使反应停止,用chcl3萃取,然后将有机相经mgso4干燥。在0℃下将粗生成物溶解于tfa(540μl)/h2o(30μl)。将混合液在室温下搅拌1小时,然后用饱和nahco3水溶液淬灭,用chcl3萃取。将有机相经mgso4干燥。减压浓缩,然后通过hplc纯化,得到化合物10的三氟乙酸盐(n
1-((2s)-1-((2-(4-(2-((4-氯苯基)氨基)-2-氧代乙酰胺基)-1-氮杂螺[5.5]十一烷-1-基)乙基)氨基)-5-胍基-1-氧代戊烷-2-基)-n
4-(2,5,8,11,14-五氧杂十六烷-16-基)琥珀酰胺
·
2tfa(tkb-001三氟乙酸盐)),为无色的油(34.3mg,30.9μmol,收率24%(3步));tr=11.7分钟(a中的b的线性梯度,15分钟30~50%);hrms(esi),c
54h96
fn
10o17+
[m+h]
+
m/z计算值882.4850,实测值882.4852。
[0114]
[实施例2本发明的化合物的合成2]
[0115]
以与实施例1同样的方式,合成peg链长不同的化合物。
[0116]
[化学式16]
[0117][0118]
在0℃下向化合物4(1.06g,1.97mmol)的chcl3(17.9ml)溶液中添加hobt
·
h2o(301.7mg,1.97mmol)、edci
·
h2o(0.378g,1.97mmol)、m-peg11-胺(1.00g,1.79mmol)、及dipea(0.61ml,3.58mmol)。将反应混合液在室温下搅拌过夜,然后添加饱和nh4cl水溶液使反应停止,用ch2cl2萃取,然后将有机相经mgso4浓缩至干。在室温下向thf(19.7ml)中的粗混合物中添加1n lioh水溶液(0.39ml)。将反应混合液在室温下搅拌30分钟,然后过滤混合液,添加1n hcl水溶液淬灭,用chcl3萃取。将有机相经mgso4干燥,减压浓缩得到化合物12(n
2-(39-氧代-2,5,8,11,14,17,20,23,26,29,32,35-十二氧杂-38-氮杂四十二烷-42-酰基)-n
ω-((2,2,4,6,7-五甲基-2,3-二氢苯并呋喃-5-基)磺酰基)-l-精氨酸)。
[0119]
[化学式17]
[0120][0121]
以与实施例1同样的方式,得到上述化合物14的三氟乙酸盐(n
1-((2s)-1-((2-(4-(2-((4-氯苯基)氨基)-2-氧代乙酰胺基)-1-氮杂螺[5.5]十一烷-1-基)乙基)氨基)-5-胍基-1-氧代戊烷-2-基)-n
4-(2,5,8,11,14,17,20,23,26,29,32,35-十二氧杂三十七烷-37-基)琥珀酰胺
·
2tfa(tkb-002三氟乙酸盐)),为无色的油。
[0122]
tr=15.3分钟(a中的b的线性梯度,15分钟30~50%);hrms(esi),c
55h97
cln9o
17+
[m+h]
+
m/z计算值1190.6685,实测值1190.6688。
[0123]
[实施例3本发明的化合物的合成3]
[0124]
以与实施例1同样的方式,合成peg链长不同的化合物。
[0125]
[化学式18]
[0126][0127]
在0℃下向化合物4(49mg,91.9μmol)的ch2cl2(91μl)溶液中添加m-peg23-胺(100mg,91.9μmol)、edci
·
h2o(19.4mg,101μmol)、hobt
·
h2o(13.7mg,101μmmol)、及dipea(32μl,184μmol)。将反应混合液在室温下搅拌过夜,然后用饱和nh4cl水溶液使反应停止,用ch2cl2萃取,然后将有机相经mgso4浓缩至干。在室温下向thf(426μl)中的粗混合物中添加1n lioh水溶液(92.2μl)。将反应混合液在室温下搅拌30分钟,然后过滤混合液,用nh4cl水溶液淬灭,用chcl3萃取。将有机相经mgso4浓缩至干,得到化合物16(n
2-(75-氧代-2,5,8,11,14,17,20,23,26,29,32,35,38,41,44,47,50,53,56,59,62,65,68,71-四氧杂-74-氮杂七十八烷-78-酰基)-n
ω-((2,2,4,6,7-五甲基-2,3-二氢苯并呋喃-5-基)磺酰基)-l-精氨酸)。
[0128]
[化学式19]
[0129][0130]
以与实施例1同样的方式,得到上述化合物18的三氟乙酸盐(n
1-((2s)-1-((2-(4-(2-((4-氯苯基)氨基)-2-氧代乙酰胺基)-1-氮杂螺[5.5]十一烷-1-基)乙基)氨基)-5-胍基-1-氧代戊烷-2-基)-n
4-(2,5,8,11,14,17,20,23,26,29,32,35,38,41,44,47,50,53,56,59,62,65,68,71-四氧杂七十三烷-73-基)琥珀酰胺
·
2tfa(tkb-003三氟乙酸盐),为无色的油。
[0131]
tr=16.8分钟(a中的b的线性梯度,15分钟30~50%);hrms(esi),c
79h145
cln9o
29+
[m+h]
+
m/z计算值1718.9831,实测值1718.9830。
[0132]
[实施例4本发明的化合物的血中半衰期的测定]
[0133]
以与参考例1同样的方式,将在实施例2中获得的tkb-002的三氟乙酸盐23.4μmol(33.2mg/20ml)静脉内注射到猕猴(mm616、体重8.78kg)中,在注射前、给药期间、给药后10分钟、37分钟、1小时、2.5小时、4.5小时、6.5小时、24小时采集血液,使用与参考例1相同的条件,通过hplc测定血中浓度。
[0134]
其结果,tkb-002三氟乙酸盐的血中浓度如图2所示推移,算出血中半衰期为107.9分钟,与yir-821相比,确认半衰期为3.48倍。
[0135]
[实施例5本发明的化合物的合成4]
[0136]
通过以下的合成方案,合成具有烷基链的本发明的化合物。
7.84(m,1h),8.09-8.10(m,1h);
13
c nmr(125mhz,cdcl3)δ14.0,22.6,26.8,27.8,29.2,29.5(12c),30.9,31.8,39.8,43.1,71.6,125.2,128.2,129.0,130.9,132.8,133.6,148.0,171.8,172.4;hrms(esi),c
31h52
n3o9s[m+h]
+
m/z计算值640.3273,实测值640.3275。
[0145]
[化学式22]
[0146][0147]
在0℃下向dmf(2.82ml)中的化合物23(543mg,0.846mmol)的溶液中添加hobt
·
h2o(216mg,1.41mmol)、edci
·
hcl(270mg,1.41mmol)、化合物8(111mg,0.282mmol)及net3(0.273ml,1.97mmol)。将反应混合液在室温下搅拌12小时,然后在0℃下添加饱和nahco3水溶液淬灭,用chcl3萃取。将有机相经na2so4干燥,然后减压浓缩,经柱色谱(chcl3/meoh=10/1~6/1)纯化得到化合物24(1-((2-(4-(2-((4-氯苯基)氨基)-2-氧代乙酰胺基)-1-氮杂螺[5.5]十一烷-1-基)乙基)氨基)-5-((4-硝基苯基)磺酰胺基)-1-氧代戊烷-2-基4-(十六烷基氨基)-4-氧代丁酸酯)(116.5mg,收率41%),为固体。
[0148]1h-nmr(500mhz,meoh)δ0.84-0.87(t,3h),1.10-1.14(m,3h),1.23(m,28h),1.34-1.65(m,12h),1.88-1.93(m,4h),2.13-2.34(m,3h),2.53-2.80(m,6h),2.94-3.00(m,2h),3.09(m,2h),3.14-3.37(m,4h),3.93-3.98(m,1h),5.20-5.22(m,1h),5.70-5.84(m,2h),7.29-7.31(m,2h),7.57-7.60(m,2h),7.71-7.73(m,2h),7.82-7.84(m,1h),8.08-8.11(m,1h),9.36(br,1h);
13
c nmr(125mhz,cdcl3)δ14.1,22.2,22.6,24.9,25.1,26.0,26.9,28.4,28.6,29.6(12c),30.9,31.4,31.8,37.4,37.7,38.0,39.8,43.1,44.5,45.2,46.1,46.3,56.5,72.9,120.9(2c),125.2(2c),128.1,129.0,131.0,132.7,133.5,135.0,148.0,157.5,158.9,169.1,171.0,171.7;hrms(esi),c
51h79
cln7o
10
s[m+h]
+
m/z计算值1016.5292,实测值1016.5292。
[0149]
[化学式23]
[0150][0151]
在室温下向mecn(0.64ml)中的化合物24(65.0mg,0.064mmol)的溶液中添加phsh(0.014ml,0.14mmol)及i-pr2net(0.023ml,0.14mmol)。将反应混合液在室温下搅拌43小时,然后减压浓缩,经柱色谱(chcl3/meoh=10/1~6/1)纯化得到化合物25(5-氨基-1-((2-(4-(2-((4-氯苯基)氨基)-2-氧代乙酰胺基)-1-氮杂螺[5.5]十一烷-1-基)乙基)氨基)-1-氧代戊烷-2-基4-(十六烷基氨基)-4-氧代丁酸酯)(38.5mg,收率72%),为白色粉末。
[0152]1h-nmr(500mhz,meoh)δ0.84-0.87(t,3h),1.10-1.13(m,4h),1.23(m,28h),1.45-1.65(m,10h),1.86-1.99(m,5h),2.14-2.31(m,2h),2.44-2.86(m,7h),2.98-3.01(m,1h),3.14-3.36(m,4h),3.97(m,1h),5.22(m,1h),6.05(br,2h),7.29-7.31(m,2h),7.43(m,1h),7.57-7.59(m,2h),9.39(br,1h);
13
c nmr(125mhz,cdcl3)δ14.1,22.2,22.6,24.0,25.2,26.0,27.0,28.7,29.3,29.7(12c),31.0,31.3,33.9,37.2,37.8,39.8,44.4,45.3,46.2,46.5,56.8,70.5,72.9,120.9(2c),129.1(2c),130.2,135.0,157.6,159.0,169.5,171.3,171.7;hrms(esi),c
45h76
cln6o6[m+h]
+
m/z计算值831.5509,实测值831.5505。
[0153]
[化学式24]
[0154][0155]
在室温下向dmf(0.96ml)中的化合物25(39.9mg,0.048mmol)的溶液中添加i-pr2net(0.01ml,0.059mmol)及1h-吡唑-1-羧基脒盐酸盐(7.7mg,0.053mmol)。将反应混合液在室温下搅拌45小时,然后减压浓缩,经hplc纯化得到化合物26的三氟乙酸盐(1-((2-(4-(2-((4-氯苯基)氨基)-2-氧代乙酰胺基)-1-氮杂螺[5.5]十一烷-1-基)乙基)氨基)-5-胍基-1-氧代戊烷-2-基4-(十六烷基氨基)-4-氧代丁酸酯),为白色粉末(36.7mg,收率88%)。将化合物26命名为yis-527的三氟乙酸盐。化合物yis-527是具有烷基链的化合物,其中在本说明书中的通式(i)中,r1为c
16h33
(r1表示c
mh2m+1
,m为16),r2为o。
[0156]1h-nmr(500mhz,meoh)δ0.87-0.90(t,3h),1.26(m,26h),1.48(m,3h),1.54-1.99(m,15h),2.17-2.23(m,2h),2.56-2.78(m,5h),2.91-2.93(m,1h),3.13-3.23(m,4h),3.38(m,2h),3.58-3.78(m,4h),4.16(m,1h),5.07(m,1h),7.33-7.35(m,2h),7.72-7.74(m,2h);
13
c nmr(125mhz,cdcl3)δ14.4,18.4,22.4,22.7,23.7,25.0,25.7,28.1,29.7,30.3(12c),31.0,33.1,34.9,36.8,37.8,40.6,41.8,42.8,49.8,51.4,58.3,74.6,79.5,122.9(2c),129.9(2c),131.1,137.4,158.7,159.4,161.4,162.3,174.1,175.1;hrms(esi),c
46h78
cln8o6[m+h]
+
m/z计算值873.5727,实测值873.5724。
[0157]
[实施例6本发明的化合物的合成5]
[0158]
以与实施例5同样的方式,合成具有peg链的本发明的化合物。
[0159]
[化学式25]
[0160][0161]
化合物28(2-(2-(2-甲氧基乙氧基)乙氧基)乙基4-甲基苯磺酸盐)由化合物27按照先前报道的方式合成(sheik,da.等,j.am.chem.soc.9,1829-1836(2015))。
[0162]
[化学式26]
[0163][0164]
化合物29(2,5,8,11,14-五氧杂十六烷-16-醇)由化合物28按照先前报道的方式合成(zhao,b.等,macromolecules.38,9509-9517(2005))。
[0165]
[化学式27]
[0166][0167]
化合物30(2,5,8,11,14-五氧杂十六烷-16-基4-甲基苯磺酸盐)由化合物29按照先前报道的方式合成(wolfe,al.等,j.med.chem.56,6845-6857(2013))。
[0168]
[化学式28]
[0169][0170]
在室温下向dmf(2ml)中的化合物30(813mg,2mmol)的搅拌溶液中添加nan3(308mg,1.61mmol)。将反应混合液在80℃下搅拌11.5小时,然后减压浓缩。滤出沉淀得到化合物31(16-叠氮基-2,5,8,11,14-五氧杂十六烷)(355mg,收率57%),为固体。
[0171]1h-nmr(400mhz,cdcl3)δ3.37-3.40(m,5h),3.53-3.56(m,2h),3.63-3.68(m,16h;
13
c nmr(125mhz,cdcl3)δ50.7,59.0,70.0,70.6(7c),71.9;hrms(esi),c
11h23
n3nao5[m+h]
+
m/z计算值300.1530,实测值300.1526。
[0172]
[化学式29]
[0173][0174]
化合物32(2,5,8,11,14-五氧杂十六烷-16-胺)由化合物31按照先前报道的方式合成(wolfe,al.等,j.med.chem.56,6845-6857(2013))。
[0175]
[化学式30]
[0176][0177]
在室温下向dcm(50ml)中的化合物32(2.4g,10mmol)的溶液中添加琥珀酸酐(1.1g,11mmol)及et3n(2.77ml,20mmol)。将反应混合液在室温下搅拌3小时,然后减压浓缩。残余物从丙酮中结晶得到化合物33(18-氧代-2,5,8,11,14-五氧杂-17-氮杂二十一烷-21-羧酸)(3.34g,收率98%),为黄色油。
[0178]1h-nmr(400mhz,cdcl3)δ2.53-2.56(t,2h),2.65-2.68(t,2h),3.37(s,3h),3.43-3.46(m,2h),3.53-3.70(m,18h);
13
c nmr(125mhz,cdcl3)δ28.7,30.9,39.5,58.9,70.2,70.4(7c),71.8,172.6,172.7;hrms(esi),c
15h30
n7o8[m+h]
+
m/z计算值352.1966,实测值352.1967。
[0179]
[化学式31]
[0180][0181]
在室温下向dme(16.7ml)及ch2cl2(16.7ml)中的化合物33(1.05g,2.5mmol)及n-羟基琥珀酰亚胺(575mg,5mmol)的搅拌溶液中添加edci
·
hcl(800mg,4.175mmol)。2小时后,用etoac稀释反应混合液,用水、1%hcl、5%nahco3水溶液、h2o、及盐水洗涤。然后将有机相干燥(na2so4)、浓缩得到活化的酯。将中间体溶解于mecn(20ml),在室温下添加dmap(1.83g,15mmol)及化合物22(1.43g,4.5mmol)。将反应混合液搅拌12小时,然后在0℃下用hcl(0.1m)酸化至ph2。用etoac萃取溶液,合并萃取物用h2o及盐水洗涤。将混合物干燥(na2so4)、浓缩。残余物经柱色谱(1%acoh中ch3cl/meoh=30/1)纯化得到化合物35(2-((4-(十六烷基氨基)-4-氧代丁酰基)氧基)-5-((4-硝基苯基)磺酰胺基)戊酸)(36.3mg,收率2%),为黄色油。
[0182]1h-nmr(500mhz,meoh)δ1.65-1.72(m,2h),1.71-1.98(m,2h),2.61-2.64(m,2h),2.68-2.78(m,2h),3.11-3.15(m,2h),3.34(s,3h),3.45-3.68(m,20h),5.01-5.03(m,1h),5.58(br,1h),7.37(br,1h),7.74-7.76(m,2h),7.84-7.86(m,1h),8.10-8.11(m,1h);
13
c nmr(125mhz,cdcl3)δ25.3,27.7,29.8,30.9,39.8,43.0,58.7,69.2,69.7(7c),71.5,71.9,
125.4,131.0,132.9,133.4,133.7,148.0,172.2,172.4,174.1;hrms(esi),c
26h42
n3o
14
s[m-h]-m/z计算值650.2236,实测值650.2233。
[0183]
[化学式32]
[0184][0185]
在0℃下向dmf(0.51ml)中的化合物35(99.0mg,0.152mmol)的溶液中添加hobt
·
h2o(38.8mg,0.25mmol)、edci
·
hcl(48.5mg,0.25mmol)、化合物8(20mg,0.05mmol)及net3(0.026ml,0.15mmol)。将反应混合液在室温下搅拌12小时,然后用0℃的饱和nahco3水溶液淬灭,用chcl3萃取。将有机相经na2so4干燥,然后减压浓缩,经柱色谱(chcl3/meoh=10/1~6/1)纯化得到化合物36(1-((2-(4-(2-((4-氯苯基)氨基)-2-氧代乙酰胺基)-1-氮杂螺[5.5]十一烷-1-基)乙基)氨基)-5-((4-硝基苯基)磺酰胺基)-1-氧代戊烷-2-基18-氧代-2,5,8,11,14-五氧杂-17-氮杂二十一烷-21-羧酸酯)(21.3mg,收率41%),为黄色油。
[0186]1h-nmr(500mhz,meoh)δ1.12-1.43(m,9h),1.60-1.73(m,7h),1.86-1.92(m,4h),2.22-2.36(m,2h),2.58-2.80(m,7h),3.05-3.10(m,4h),3.36(s,3h),3.46-3.72(m,20h),3.95-3.99(m,1h),5.21-5.22(m,1h),7.31-7.32(m,2h),7.57-7.59(m,2h),7.71-7.73(m,2h),7.81-7.84(m,1h),8.10-8.11(m,1h),9.32(br,1h);
13
c nmr(125mhz,cdcl3)δ18.4,22.1,22.2,25.0,25.1,25.9,28.5,29.6,30.4,30.6,37.4,39.4,43.1,44.3,50.7,58.4,59.0,69.7(2c),70.1(7c),70.4,71.8,72.8,120.9(2c),125.2(2c),129.2,130.3,131.0,132.6,133.4,133.6,135.0,148.0,157.4,159.0,169.4,171.4,171.7;hrms(esi),c
46h69
cln7o
15
s[m+h]
+
m/z计算值1026.4255,实测值1026.4251。
[0187]
[化学式33]
[0188][0189]
在室温下向mecn(0.21ml)中的化合物36(21.3mg,0.021mmol)的溶液中添加phsh(0.005ml,0.05mmol)及i-pr2net(0.007ml,0.04mmol)。将反应混合液在室温下搅拌37小时,然后减压浓缩,经柱色谱(chcl3/meoh=10/1~6/1)纯化得到化合物37(5-氨基-1-((2-(4-(2-((4-氯苯基)氨基)-2-氧代乙酰胺基)-1-氮杂螺[5.5]十一烷-1-基)乙基)氨基)-1-氧代戊烷-2-基18-氧代-2,5,8,11,14-五氧杂-17-氮杂二十一烷-21-羧酸酯)(24.3mg,收率99%),为黄色油。
[0190]1h-nmr(500mhz,meoh)δ1.11-1.33(m,11h),1.53-1.72(m,7h),1.83-2.01(m,4h),2.18-2.31(m,2h),2.56-3.02(m,9h),3.26(s,3h),3.53-3.65(m,20h),3.95-3.97(m,1h),4.43(br,2h),5.30-5.32(m,1h),7.31-7.33(m,2h),7.57-7.59(m,2h),9.30(br,1h);
13
c nmr(125mhz,cdcl3)δ18.4,22.2,22.3,25.0,25.2,26.1,28.6,29.6,30.2,31.5,37.3,39.6,44.6,45.5,46.6,56.5,58.9,69.9(2c),70.2(7c),70.4,71.6,72.9,120.9(2c),129.2(2c),130.3,135.0,157.5,159.0,169.5,170.8,172.6;hrms(esi),c
40h66
cln6o
11
[m+h]
+
m/z计算值841.4473,实测值841.4476。
[0191]
[化学式34]
[0192][0193]
在室温下向dmf(0.58ml)中的化合物37(24.3mg,0.029mmol)的溶液中添加i-pr2net(0.06ml,0.035mmol)及1h-吡唑-1-羧基脒盐酸盐(4.6mg,0.032mmol)。将反应混合液在室温下搅拌18小时,然后减压浓缩,通过hplc纯化得到化合物38(1-((2-(4-(2-((4-氯苯基)氨基)-2-氧代乙酰胺基)-1-氮杂螺[5.5]十一烷-1-基)乙基)氨基)-5-胍基-1-氧代戊烷-2-基18-氧代-2,5,8,11,14-五氧杂-17-氮杂二十一烷-21-羧酸酯)的三氟乙酸盐,为黄色油(24.1mg,收率45%)。将化合物38命名为yis-540的三氟乙酸盐。化合物yis-540是具有peg链的化合物,其中在本说明书中的通式(i)中,r1为c2h4(oc2h4)
n-och3(r1表示-c2h4(oc2h4)
n-och3,n为4),r2为o。
[0194]1h-nmr(500mhz,meoh)δ1.12-1.26(m,3h),1.42-1.48(m,3h),1.68-2.18(m,17h),2.18-2.31(m,2h),2.68-2.82(m,5h),3.20(br,2h),3.36-3.77(m,23h),4.10(m,1h),5.10(m,1h),7.32-7.34(m,2h),7.57-7.59(m,2h);
13
c nmr(125mhz,cdcl3)δ18.1,21.2,21.4,24.5,28.1,28.5,28.7,29.3,29.7,30.1,33.4,35.1,35.3,39.3,39.4,40.5,41.7,50.7,58.6,69.7,69.9,70.0(7c),71.4,72.9,121.1(2c),129.3(2c),130.6,134.8,157.0,159.6,160.4,172.2,173.6;hrms(esi),c
41h68
cln8o
11
[m+h]
+
m/z计算值883.4691,实测值883.4694。
[0195]
[实施例7本发明的化合物的稳定性1]
[0196]
由于烷基链经由-c(=o)o-基团与yir-821的侧链结合,因此假定实施例5中得到的化合物(yis-527)在体外及体内水解。因此,在本实施例中,测定了烷基链的体外释放。
[0197]
其结果,在37℃、ph7.4的pbs中观察到下述的降解反应。结果示于图3。
[0198]
[化学式35]
[0199][0200]
[实施例8本发明的化合物的稳定性2]
[0201]
以与实施例7同样的方式,对实施例6中得到的peg链经由-c(=o)o-基团与yir-821的侧链结合的化合物(yis-540),测定了peg链的体外释放。
[0202]
其结果,在37℃、ph7.4的pbs中观察到下述的降解反应。结果示于图4。
[0203]
[化学式36]
[0204][0205]
[实施例9活性评价1]
[0206]
对于实施例1~3中合成的tkb-001、tkb-002、tkb-003,与作为抗病毒药之一的依法韦仑(efv)、nbd-556、及yir-821一起评价细胞毒性及抗hiv活性。在本实施例中,使用tzm-bl细胞(购自nih aids reagent program(https://www.aidsreagent.org/index.cfm))进行任何评价。tzm-bl细胞是表面具有cd4/ccr5/cxcr4且通过hiv感染而萤光
素酶表达的指示剂细胞。在该细胞中,整合有与hiv-1ltr序列连结的β-半乳糖苷酶基因,当感染hiv-1时,从感染的hiv-1的tat基因表达转录激活因子tat,通过该tat作用于ltr的启动子区域而构成为表达β-半乳糖苷酶。通过向其中添加底物,发生酶切割,生成半乳糖和萤光素,因此,通过光度计检测萤光素被萤光素酶氧化而发出的化学发光量,能够测定hiv-1感染细胞数。
[0207]
1)cc
50
(细胞毒性的算出)
[0208]
逐步稀释各化合物,然后加入1x104个tzm-bl细胞,培养48小时后回收,添加luc报告试剂,测定发光量(试剂名ctg),算出cc
50
值。
[0209]
2)ic
50
(抗hiv活性的算出)
[0210]
逐步稀释各化合物,然后加入tzm-bl细胞1x104cells,添加100tcid
50
的hiv分离株(kp5mvcr),培养48小时,然后回收细胞,添加luc报告试剂,测定发光量,算出感染抑制率(ic
50
)。hiv分离株(kp5mvcr)是mvc耐性hiv克隆,其通过将mvc抗性kp-5env置于nl43的载体中制成,所述mvc抗性kp-5env是在mvc存在下将临床分离株的kp-5(yta)在pm1 ccr5细胞中进行48次传代得到的(yoshimura k,et al.,j.gen.virol.,95,1816-1826,2014)。
[0211]
各化合物的结果(cc50、ic50、及si(selectivity index))示于下述的表1。
[0212]
[表1]
[0213][0214]
从表1的结果可以看出,本发明的化合物tkb-001、tkb-002、及tkb-003均被证实细胞毒性低且具有高的抗hiv活性,因此具有与现有的抗病毒药相当的有效性。另外,si的结果表明tkb-002具有特别高的安全性和良好的效果。
[0215]
[实施例10活性评价2]
[0216]
对于实施例5及6中合成的yis-527及yis-540,以与实施例9同样的方式评价细胞毒性及抗hiv活性。
[0217]
yis-527及yis-540的活性评价结果与作为对照化合物的yir-821的结果一起示于下述的表2。
[0218]
[表2]
[0219]
[0220]
从表2的结果可以看出,本发明的化合物yis-527及yis-540均被证实与yir-821同程度地细胞毒性低,且具有高的抗hiv活性。
[0221]
[实施例11稳定性评价]
[0222]
对于实施例2中合成的tkb-002,进行生物稳定性评价。
[0223]
具体而言,将tkb-002的三氟乙酸盐溶解在100mm的磷酸钠缓冲液(napb、ph7.4)中,制成0.3mm的溶液。将183μl的该溶液在100mm napb(ph7.4)中与2μl的20mm的nadph、及5μl的20mg/ml的人肝微粒体(human microsomes,50donors(thermofisher scientific,cat#:hmmcpl,lot#:pl050e-a))混合。将混合液在37℃下预孵育5分钟,然后向其中添加10μl的20mm nadph溶液,在温和搅拌下在37℃下孵育60分钟。
[0224]
然后,添加200μl的乙酸乙酯使反应停止,用涡旋混合器搅拌,以3,000rpm离心分离5分钟。过滤上清液,然后用氮气除去乙酸乙酯。
[0225]
向该混合液中添加50μl的含有0.1%tfa的mecn,使用与参考例1、实施例4同样的条件通过hplc进行分析。
[0226]
其结果,tkb-002在使用的hplc条件下在保持时间约20分钟的位置作为单一的峰被检测出,但与人肝微粒体一起孵育60分钟后也显示出与孵育前同样的峰强度,表明在人肝微粒体的存在下是非常稳定的。
[0227]
产业上的可利用性
[0228]
本发明的cd4模拟物化合物能够提供为具有与以往报道的抗病毒药及本发人等先前开发的cd4模拟物化合物同等程度以上的抗hiv活性,并且细胞毒性低,且体外及体内的半衰期长的化合物,因此能够期待更长时间的作用持续,因此能够降低治疗成本。
[0229]
本说明书引用的所有出版物、专利及专利申请均以引用的方式直接并入本说明书。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1