源自噬菌体T5的纳米颗粒的生产和功能化以及治疗用途
源自噬菌体t5的纳米颗粒的生产和功能化以及治疗用途
技术领域
1.本发明涉及细菌病毒学、生物化学和病毒治疗领域。本发明涉及噬菌体t5衣壳,其没有来自噬菌体的基因组dna并在衣壳的表面上暴露至少一种目的融合蛋白,尤其是具有治疗目的的融合蛋白。本发明还涉及这种衣壳的生产方法和能够生产其的载体。本发明还涉及暴露在衣壳上的目的融合蛋白和编码所述融合蛋白的核酸。本发明还涉及包含这些功能化衣壳的纳米颗粒、包含这些纳米颗粒和/或这些功能化衣壳的药物组合物及其治疗用途,特别是作为药物和/或疫苗的治疗用途。
背景技术:
2.噬菌体(或细菌噬菌体)是在整个生物圈普遍存在的细菌病毒。细菌病毒的最大科包括有尾细菌噬菌体,其由含有病毒基因组(其是双链dna分子)的二十面体衣壳和可以将基因组注入宿主细胞的尾部组成。这些病毒的二十面体衣壳是极其稳定的大分子装配体,通常在其表面暴露所谓的“装饰”蛋白。可以对这些蛋白进行基因修饰以产生带有嵌合蛋白的病毒,所述嵌合蛋白由天然蛋白与具有治疗或生物技术目的的功能性蛋白融合而成(tao等人,2013;razazan等人,2018)。迄今为止开发的用于获得病毒或者仅病毒的用嵌合蛋白装饰的衣壳的方法包括:修饰在病毒基因组或质粒中的装饰蛋白,然后从对其细菌宿主的感染中生产病毒颗粒。然而,病毒基因组被整合到由此生产的颗粒和衣壳中,从而限制了其治疗和生物技术应用。事实上,由此生产的颗粒仍然具有传染性以及具有不可忽视的基因突变风险(特别是能够导致逆转为野生型)。除了健康和治疗风险外,基因突变还给工业规模的同质化生产带来了问题。
3.在这种情况下,能够消除病毒核酸的存在似乎是必须的。
4.然而,仍未探索出生产没有dna的衣壳、纯化所述衣壳并用功能化的蛋白以定制方式装饰所述衣壳的可能性。虽然,这种衣壳至少具有安全并且没有治疗和健康风险的优点,而且能够进行大规模生产(尤其是工业规模)。事实上,病毒基因组的缺失使其有可能消除任何突变或逆转到野生型的风险,并确保高水平的繁殖以及完全受控的和受到监测的体内增殖,由这些颗粒和外壳的定制功能提供潜在的生物技术和治疗应用。因此,强烈需要开发既具有功能化又没有基因组核酸的噬菌体颗粒和衣壳。
5.感染大肠杆菌的细菌噬菌体t5有一个直径为90nm的衣壳,其通过不同的结构状态进行自装配,所述衣壳的成熟过程遵循明确的步骤顺序(图1)。二十面体前衣壳起初由主要衣壳蛋白pb8、门户蛋白pb7和加工蛋白酶pb11装配而成。前衣壳由蛋白酶pb11加工,产生出一个空衣壳,准备好接收病毒基因组。dna的衣壳化由分子驱动子确保,该步骤伴随着衣壳蛋白亚基的结构重组,导致衣壳扩增。然后,单体的装饰蛋白pb10可以装饰由此获得的扩增的成熟形式的外表面,从而可以暴露120个拷贝。
6.已经表明,可以生产和纯化不含病毒基因组的未装饰的空衣壳(preux等人,2013)。可以在体外诱导衣壳扩增。由此获得的未修饰的衣壳与传染性颗粒的衣壳具有相同的几何形状(图1b和preux等人2013的文章)。
7.已经表明,装饰蛋白pb10以高亲和力(测量为解离常数kd=10-12
m)结合噬菌体t5的衣壳。装饰蛋白pb10的结构显示了由两个独立结构域所组成的蛋白:用于结合衣壳的n末端结构域和暴露于溶剂的外部c末端结构域(图1c,vernhes等人2017)。然而,尚未研究由装饰蛋白与具有治疗或生物技术目的的功能性蛋白融合形成的嵌合装饰蛋白与衣壳的亲和力。因此,尚未探索生产没有病毒基因组dna的、暴露功能化蛋白的t5衣壳的可能性。
8.因此,非常需要开发不具有感染或逆转风险的功能化噬菌体t5的颗粒和衣壳,以及大规模生产此类颗粒和衣壳的方法,以适用于治疗和生物技术用途。
9.本发明可以回应这些需求。发明人设计了新的嵌合蛋白,其由完整的蛋白pb10与目的蛋白融合组成、或仅由pb10的n末端结构域与替换掉c末端结构域的目的蛋白融合组成。发明人尤其首次证明,这些修饰的蛋白(称为融合蛋白)可以正确地暴露在完全没有基因组dna的t5衣壳的表面,并且具有很高的效力。数据特别表明,完全出乎意料的是,这些修饰蛋白与天然蛋白pb10对噬菌体t5衣壳的亲和力相同。因此,空的t5衣壳(没有基因组)构成了一种生物来源的纳米颗粒,其是安全的并且能够在其表面上暴露120个拷贝的蛋白,所述蛋白的功能可以根据与装饰蛋白融合的目的分子的性质而变化。
10.发明人还以完全出人意料的方式表明,有可能不通过生产突变体噬菌体就生产这些功能化的空衣壳。这是更加有利和出人意料地,因为迄今为止生产没有dna的衣壳的方案需要用突变噬菌体感染细菌培养物的步骤。然而,该步骤需要在衣壳生产上游生产大量噬菌体。此外,在感染过程中,观察到高频率地逆转到野生型,这减少了空衣壳的产率。为了克服这些限制,并且从增加衣壳生产规模的角度出发,发明人开发了完全不依赖于细菌噬菌体t5的衣壳生产和装饰的系统。该系统基于重组质粒的构建,该重组质粒带有独特的编码细菌噬菌体t5衣壳蛋白的基因。由于这个系统,可以直接生产空的、装饰的和功能性的衣壳,或生产扩增的和未装饰的衣壳、然后可以在第二步中通过与目的融合蛋白的简单接触对其进行装饰。数据完全出人意料地表明,这些质粒在细菌中的表达导致衣壳的装配,所述衣壳的形态与使用完整噬菌体(突变体或其他)通过常规方法生产的衣壳相似,并且所述衣壳的装饰特性与由完整噬菌体生产的衣壳的装饰特性相当。事实上,数据表明由衣壳基因的异位表达(噬菌体t5的病毒周期之外)所得的衣壳的自装配特性是保守的。因此,本发明人开发了一种用于大规模生产没有基因组dna的重组衣壳的简化方法,所述衣壳可以通过两种不同的方式进行装饰:i)通过体外添加纯化的装饰蛋白;ii)通过原位共同生产装饰蛋白。
11.发明人还首次验证了由此功能化的空噬菌体t5衣壳的生物技术应用(尤其是治疗应用)的潜力。因此,发明人的数据以完全出人意料的方式表明,在小鼠模型中施用这些由抗原功能化的衣壳诱导有效免疫,其显著诱导体液反应(抗体)和细胞反应。这种免疫导致这些小鼠的有效接种。这些出人意料的结果表明,这些衣壳所暴露的融合蛋白保留其所有特性和功能。在本发明人获得的并在随后的实施例部分中实质呈现的数据方面,可以看出随可构建的不同融合蛋白,本发明具有多种生物技术和治疗应用。
技术实现要素:
12.在本发明的上下文中,发明人以完全出人意料的方式开发了没有噬菌体基因组dna的并在其表面暴露目的融合蛋白的空的噬菌体t5衣壳。这些功能化的衣壳可以大规模
生产,同时避免了噬菌体t5的病毒周期,具有很高的再现性。此外,这些功能化衣壳能够在体内发挥所用的目的融合蛋白的功能和活性。
13.因此,本发明涉及没有所述噬菌体的基因组dna并在其表面暴露至少一种融合蛋白的噬菌体t5衣壳以及生产这些的方法,所述融合蛋白包含至少一个与装饰蛋白pb10的片段具有至少80%的同一性的肽或蛋白片段。本发明尤其涉及生产这种衣壳的方法,所述方法包括获得编码噬菌体t5衣壳蛋白的载体,以及所述载体。
14.本发明还涉及暴露在衣壳上的目的融合蛋白和编码其的核酸。本发明还涉及包含这些功能化衣壳的纳米颗粒、包含这些纳米颗粒和/或这些功能化衣壳的药物组合物及其治疗用途,特别是作为药物和/或疫苗的治疗用途。
附图说明
15.图1显示了噬菌体t5的成熟周期。a)细菌噬菌体t5的阴性染色的电子显微镜图像和根据低温电子显微镜数据重建的细菌噬菌体t5衣壳。装饰蛋白pb10染成红色(结合在衣壳表面的120个拷贝)。b)细菌噬菌体t5衣壳的装配机制图。主要衣壳蛋白的前体pb8p由支架结构域(称δ结构域的)(残基1至159,由灰色三角形表示)和成熟的结构结构域pb8m(残基160至458,由紫色矩形表示)组成。pb8p自装配成二十面体前衣壳(称为前头部i),其包含门户蛋白(pb7)的十二聚体复合物。还位于前头部i内部的蛋白酶(pb11)切割pb8p亚基的δ结构域和门户蛋白的10个n末端氨基酸,并且其在两端进行蛋白自水解以形成前头部ii。通过末端酶通过门户复合物对基因组的衣壳化诱导衣壳的扩增和装饰蛋白(pb10)结合在衣壳表面。最后,衣壳被封口蛋白p144封闭,该蛋白与门户蛋白形成连接子,允许连接单独装配的噬菌体尾部。c)通过噬菌体t5(其在末端酶基因中发生突变因而无法将dna衣壳化)感染细菌,导致前头部i形式的积累,所述前头部i可在体外纯化和扩增,然后由装饰蛋白pb10装饰。
16.图2通过sds-page分析嵌合蛋白po和pno的纯度-在superdex75 hr10/300柱(ge healthcare)上进行尺寸排阻色谱后洗脱的级分。
17.图3显示了用蛋白pb10、po和pno装饰纯的空衣壳的测试。已调整不同装饰蛋白与衣壳的相应浓度以具有[蛋白]/[衣壳上的结合位点]的浓度比=1+/-0.1。
[0018]
图4显示:a.针对增加的蛋白浓度(0.312;0.625;1.25;2.5)测量的蛋白pb10、po和pno的结合和解离曲线(共振单位(ru)作为时间的函数)。b.由蛋白pb10、po和pno中每一种的动力学常数ka和kd计算亲和常数kd。
[0019]
图5显示了pb10 h6、pb10-mcherryh6和n-ter pb10-mcherryh6蛋白在空噬菌体t5衣壳上的表面等离子共振(spr)结合曲线以及通过spr测量的动力学常数计算亲和常数。
[0020]
图6显示了载体petcapt5(seq id 12)的示意图。
[0021]
图7显示了载体petcapt5δdec(seq id 13)的示意图。
[0022]
图8显示:a)通过低温电子显微镜对重组的和纯化的质粒生产的衣壳进行分析。从左到右:由终止酶基因突变的噬菌体t5生产的对照衣壳、由质petcapt5δpb10和petcapt5生产的衣壳。b)在天然琼脂糖凝胶上分析装饰有蛋白pb10的衣壳(操作方案描述在vernhes等人)。衣壳与蛋白pb10以不同的比率[pb10拷贝数]/[pb10结合位点数](1/1、2/1或4/1)孵育。对于从突变噬菌体生产的“天然”衣壳和从质粒petcapt5δdec生产的衣壳而言,分别在
比率为1/1和2/1时获得衣壳在pb10中的饱和。质粒petcapt5生产的衣壳迁移到在pb10中饱和的衣壳的位置,表明其在细菌中装配时得到完全地装饰。
[0023]
图9显示用针对pb10的多克隆抗体揭示的蛋白印迹的结果,其证明衣壳上存在pb10。1:从质粒petcapt5δdec获得的纯化的衣壳;2:从质粒petcapt5获得的衣壳。
[0024]
图10显示了pb10融合蛋白诱导的抗卵清蛋白(ova)抗体反应的动力学。单独、或者与纯化的噬菌体衣壳或完全弗氏佐剂相结合使用一剂po或pno融合蛋白,对小鼠进行皮下免疫。在施用后的不同时间通过elisa对总抗ova抗体(igg)进行定量。a-e每条曲线代表单个小鼠(n=6)的结果。f每组的抗体反应动力学(平均值
±
标准差)。
[0025]
图11显示了pb10融合蛋白诱导的抗体性质的表征。单独、或者其与纯化的t5噬菌体衣壳或完全弗氏佐剂相结合使用一剂po或pno融合蛋白,对小鼠进行皮下免疫。在第42天通过elisa对同种型igg1、igg2b、igg2c和igg3的抗ova抗体进行定量。数据对应于平均值+标准差sem(n=6)anova检验,然后是tukey检验:
*
,p《0.005;
**
,p《0.01;
***
,p《0.001;ns,差异不显著。
[0026]
图12显示了pb10融合蛋白与ova诱导的细胞反应的分析。单独、或者与纯化的t5噬菌体衣壳相结合使用一剂po或pno融合蛋白,对小鼠进行皮下免疫。然后,小鼠在第196天接受了相同的疫苗制剂的第二次施用。10天后,通过elispot定量产生ifnγ的脾细胞的数量来测量脾细胞对肽
ova257-264
刺激的反应。条形显示对每组获得的平均值,圆形显示对每只小鼠(n=6)获得的单个结果。anova检验,之后是tukey检验:
**
,p《0.01;
***
,p《0.001;ns,差异不显著。
[0027]
图13显示了对由蛋白pno诱导的细胞反应的分析。单独、或者与纯化的t5噬菌体衣壳或完全弗氏佐剂相结合使用一剂po融合蛋白,对小鼠进行皮下免疫。然后,小鼠在第59天接受了相同的疫苗制剂的第二次施用。10天后,通过产生ifnγ的脾细胞的数量(a)、或者通过测量在脾细胞培养物上清液中ifnγ的量(b),测量和定量脾细胞对肽ova
257-264
抗原刺激的反应。条形显示每组获得的平均值,圆形显示每只小鼠(n=5)获得的单个结果。anova检验,之后是tukey检验:
**
,p《0.01;
***
,p《0.001;ns,差异不显著。
具体实施方式
[0028]
定义
[0029]“噬菌体”或“细菌噬菌体”或“细菌病毒”是指感染细菌的病毒。噬菌体是在整个生物圈中普遍存在的细菌病毒。在2000年代初,观察和描述了超过5000种不同的细菌噬菌体。最早描述的噬菌体(其是结构被研究得最多的噬菌体),通常由蛋白外壳或衣壳(包裹和保护中心的核酸分子)和特异于复合结构的装置(尾部)组成,噬菌体通过该装置与细菌宿主结合以将噬菌体的核酸(遗传物质或基因组)注入细菌宿主。然而,并非所有的细菌噬菌体都符合这种常规模型,其目前可分为四个主要形态组:有尾部的双链dna噬菌体(超过所述噬菌体的95%);具有立方对称性的、无尾部的单链dna的噬菌体;rna噬菌体;具有单链dna的丝状噬菌体。还描述了等长细菌噬菌体(含有dna),其含有12%至14%的脂质,所述脂质以双层的形式位于病毒衣壳(噬菌体pm2)的外壳和内壳之间。噬菌体尺寸从24至200nm不等。当遗传物质是双链dna分子(已知噬菌体的95%都是这种情况)时,其长度可以在5到650千碱基(kbp)之间变化。
[0030]
因此,可以采用不同的标准将噬菌体划分为不同的形态类型,并将噬菌体分配到科中。这些标准特别考虑头部的形状和尺寸、尾部的结构、有无收缩性尾鞘、底板的结构(原基的或复合的)、病毒体的整体尺寸、核酸的性质(双链dna、单链dna、rna)等。例如,有尾部的噬菌体分类至有尾噬菌体(caudovirales)科(也称为有尾噬菌体或有尾病毒)。尾部的形态可以将该大科细分为3组:
[0031]-长尾噬菌体科(siphoviridae),特征是长的、非收缩的尾部,其形成最大科(有尾病毒的60%;例如:噬菌体t5);
[0032]-肌尾噬菌体科(myoviridae)具有长且可收缩的尾部,其由外管组成,当病毒位于其细菌宿主表面时,该外管围绕中央刚性管收缩。然后,刚性管刺穿细菌壁,为噬菌体dna创造通道(例如:噬菌体t4)。
[0033]-短尾噬菌体科(podoviridae)有小的、非收缩性的尾部。其将蛋白整合到其衣壳中,在病毒体形成过程中用于将dna包装进衣壳中,并排出到宿主壁中,随后排出dna(例如:噬菌体t7和p22)。
[0034]
噬菌体需要细菌宿主才能繁殖,噬菌体将其遗传物质注入细菌宿主中。当病毒基因组进入细菌宿主时,其通常由宿主酶和核糖体复制和翻译(在某些情况下,一些病毒蛋白也可能参与其中),形成大量的噬菌体拷贝,这些噬菌体拷贝随着细菌宿主的裂解而从宿主中释放出来,这称为裂解或生产周期。对于一些细菌噬菌体,遗传物质被复制并整合到细菌染色体中(或以质粒形式存在),但并未表达形成病毒体。因此,病毒被称为术语前噬菌体,其被传递给受感染细菌的后代(溶原系),这被称为溶原性或溶原性周期。溶原性感染在对诱导(例如:对细菌应激)的应答中切换到裂解周期。
[0035]
因此,噬菌体也可以根据其复制周期进行分类:
[0036]-称为“毒性噬菌体”的噬菌体:这些是严格裂解的;
[0037]-称为“温和噬菌体”的噬菌体,其可产生裂解感染或溶原性感染;
[0038]-慢性感染噬菌体,其不会诱导受感染细胞的裂解,而是在细菌膜上出芽但并不破坏细菌膜(慢性感染)。丝状噬菌体(例如,大肠杆菌的m13或f1)就是这种情况。
[0039]
裂解噬菌体的特征还在于存在“裂解斑”。单个噬菌体感染细菌细胞可在20至30分钟末诱导细菌细胞的裂解,并释放数以十计或数以百计的噬菌体颗粒。在实验室中,由此释放的每个颗粒都会感染新的细菌并重新开始裂解循环。作为这些微型的级联裂解的结果,在琼脂表面的细菌苔中形成“裂解斑”,从而可以用肉眼识别测试结果。这些裂解斑的大小和外观有助于表征噬菌体的表型。
[0040]“噬菌体t5”是指属于昆塔病毒属(tequintavirus)的病毒(同义词:t5-样噬菌体、t5-样病毒、t5样病毒),包括在德默莱兹噬菌体科(demerecviridae)中,本身属于有尾病毒(caudovirales)目(也称为“有尾”病毒)。
[0041]
t5属于有尾病毒目中的双股dna病毒(siphoviridae)亚目。因此,t5有长的、无收缩性的尾部。这是专门感染大肠杆菌的严格裂解噬菌体。噬菌体t5由直径为90nm的二十面体衣壳和250nm尾部组成,在所述衣壳中包含其基因组(含有121,000个碱基对(121kbp)的双链dna),所述尾部使噬菌体可以识别靶标细菌并将噬菌体基因组注入细菌中。尾部的末端由锥体形状终止,在锥体形状的尖端存在特异于t5受体的结合蛋白。该受体是细菌外膜的蛋白(在t5的情况下,是fhua,对其他昆塔病毒属而言是其他膜受体)。尾部还配备了三根
附着在锥体基部的长丝,所述丝与细菌表面的脂多糖的糖部分相互作用。
[0042]
细菌噬菌体t5的基因组可分为三部分,分布如下:
[0043]-约8%的总基因组,在最先注入端。这部分基因组,称为“直接末端重复”,与位置92-100%的dna另一端以相同方向重复。它编码的蛋白参与阻止细菌复制/转录/翻译和破坏宿主dna,以及脱氧核糖核苷酸酶;
[0044]-8至67%的基因组,编码早期基因(在病毒dna注入的末期表达)。这些基因编码的蛋白参与dna复制、核苷酸代谢和细胞裂解因子;
[0045]-67%至92%的基因组,主要包括晚期基因(感染后12至13分钟表达)。这些主要是所谓的“结构”基因,其编码的蛋白用于新病毒体的装配。
[0046]
细菌噬菌体t5衣壳通过不同的结构状态进行自我装配,其成熟遵循明确的步骤顺序(图1)。二十面体前衣壳最初装配,由775个拷贝的主要衣壳蛋白pb8组成,组装为11个五聚体(形成衣壳12个顶点中的11个)和120个六聚体(形成面)。蛋白pb8(51kda)以包含δ结构域的前体形式合成,所述δ结构域对应于蛋白的159个n末端氨基酸,在衣壳装配过程中用作支架结构域。衣壳的第十二个顶点由门户蛋白pb7(47kda)的十二聚体形成,其构成了dna的入口孔。该前衣壳还含有蛋白酶pb11,其确保切割下775个拷贝的pb8的δ结构域,切下门户蛋白的10个n末端残基并蛋白自水解以生产空衣壳,准备接收病毒基因组。dna的衣壳化由分子驱动子确保,该步骤伴随着775个衣壳蛋白的亚单位的结构重组,导致衣壳扩增。成熟的扩增形式在六聚体的中心具有单体蛋白pb10(17.3kda)的结合位点,所述单体蛋白pb10的120个拷贝将装饰二十面体的外表面。
[0047]“衣壳”或“噬菌体衣壳”是指包围噬菌体基因组(核酸、dna或rna)的没有尾部的结构。它由非常多的蛋白单元组成,其组合在一起形成相同的结构装配体,称为衣壳体。核衣壳是由噬菌体衣壳(存在于无包膜或有包膜的噬菌体中,包膜不是衣壳而是围绕衣壳的脂蛋白包膜)和病毒基因组(rna或dna)装配形成的。根据衣壳体彼此之间展现的几何比例以及衣壳所包裹和保护的基因组,可以定义三类核衣壳:
[0048]-螺旋对称的核衣壳;
[0049]-二十面体的核衣壳,其展现二十面体的全部或部分对称元素,因此其结构接近测地线;
[0050]-混合对称核衣壳,可以具有与二十面体结构相结合的螺旋对称结构。
[0051]“空衣壳”是指不包含噬菌体基因组的衣壳(没有噬菌体核酸)。因此,空衣壳是没有将噬菌体基因组衣壳化(装入)的衣壳。例如,在噬菌体t5的情况下,空衣壳是没有噬菌体t5基因组dna的衣壳。优选地,噬菌体的空衣壳是没有所述噬菌体的任何核酸的衣壳。更优选地,空衣壳是没有任何核酸的衣壳(例如,没有源自噬菌体、宿主细胞和生产细胞的核酸,优选地没有污染的核酸)。“没有核酸”或“不包含核酸”是指包含少于5%核酸的物质、优选少于4%、优选少于3%、优选少于2%、优选少于1%、优选少于0.5%,优选少于0.1%,优选少于0.01%,优选少于0.001%,优选少于0.0001%,优选少于0.00001%,优选少于0.000001%的核酸(以摩尔质量计)。
[0052]“衣壳蛋白”或“衣壳结构蛋白”是指参与噬菌体衣壳结构的蛋白。换言之,衣壳结构蛋白是指作为衣壳的部分的组分。在噬菌体t5的情况下,这些蛋白尤其包括主要衣壳蛋白pb8、门户蛋白pb7、蛋白酶pb11和装饰蛋白pb10。
[0053]“噬菌体t5衣壳装饰蛋白”或“装饰蛋白pb10”或“蛋白pb10”或“pb10”是指噬菌体t5的单体蛋白,其结合至噬菌体t5衣壳的外表面,优选结合在形成噬菌体t5衣壳的面的六聚体上,优选结合在形成噬菌体t5衣壳的面的六聚体上存在的结合位点上,更优选结合在形成噬菌体t5衣壳的面的六聚体中心存在的结合位点上。装饰蛋白pb10,由164个氨基酸组成(pb10的参考示例:genbank:aau05286.1或ncbi:yp_006979.1,如seq id:16所示),包含两个独立的结构域,用于与衣壳结合的n末端结构域和暴露在外的c末端结构域(即显示在衣壳的外部)。这两个结构域由多脯氨酸类型的短“接头”或铰链隔开。装饰蛋白pb10具有,例如氨基酸序列seq id no:1,其在n末端和c末端位置分别包含一个和两个额外的氨基酸,可以根据克隆需要引入。或者,如果用于pb10表达的克隆技术不在pb10的氨基酸序列中引入任何改变,则装饰蛋白pb10可具有天然蛋白的准确序列(这是,例如,氨基酸序列seq id no:16的情况)。术语“噬菌体t5衣壳装饰蛋白”、“装饰蛋白pb10”、“蛋白pb10”和“pb10”在此可互换使用。
[0054]“蛋白pb10的n末端结构域”是指位于蛋白pb10的n末端位置的结构域,即蛋白pb10的结构域,其包含(或基本上由或由以下组成)蛋白pb10序列的前80个氨基酸(即从第1位到第80位的氨基酸,包括端点)。蛋白pb10的n末端结构域尤其包含衣壳结合结构域。蛋白pb10的n末端结构域具有,例如,对应于seq id no:1的前80个连续氨基酸的氨基酸序列seq id no:3。蛋白pb10的n末端结构域可以可选择性地具有,例如,对应于seq id no:16的前77个连续氨基酸的氨基酸序列,或甚至对应于包含在seq id no:16的第2位和第77位(包括端点)之间的76个连续氨基酸的氨基酸序列。“蛋白pb10的c末端结构域”指位于蛋白pb10的c末端位置的结构域,即包含(或基本上由其组成、或由其组成)蛋白pb10序列的后92个氨基酸的结构域,如在seq id no:1中所定义的(即从第74位到第165位的氨基酸,包括端点)。蛋白pb10的c末端结构域尤其包含暴露的外部结构域,即显示在衣壳的外部部分。
[0055]“主要衣壳蛋白pb8”或“pb8”是噬菌体t5蛋白,其组织成11个五聚体(以形成t5衣壳的12个顶点中的11个顶点)和形成面的120个六聚体。蛋白pb8(51kda)以51kda的前体形式合成,包含对应于蛋白的159个n末端氨基酸的δ结构域。δ结构域在前衣壳装配过程中用作支架,然后该结构域被蛋白酶pb11切割以形成衣壳。主要衣壳蛋白pb8具有,例如氨基酸序列seq id no:8。
[0056]“门户蛋白pb7”或“pb7”指噬菌体t5蛋白,其组织成十二聚体以形成噬菌体t5衣壳的12个顶点中的1个顶点。该十二聚体是噬菌体dna的进入孔。蛋白pb7约为47kda。门户蛋白pb7具有,例如氨基酸序列seq id no:7。
[0057]“蛋白酶pb11”或“pb11”指噬菌体t5蛋白,其确保切割下775个拷贝的pb8的δ结构域,切下门户蛋白的10个n末端残基并蛋白自水解以生产空衣壳,准备接收病毒基因组。蛋白酶pb11具有,例如氨基酸序列seq id no:9。
[0058]“装饰的衣壳”是指包含至少一个暴露在衣壳表面上的装饰蛋白和/或至少一个暴露在衣壳表面上的融合蛋白的衣壳。通常,装饰蛋白暴露在至少一个构成衣壳的面上。
[0059]“衣壳的成熟扩增形式”或“扩增形式”是指通过低温电子显微镜测量的直径为90nm+/-2nm的细菌噬菌体t5衣壳,如参考文献preux等人,2013(doi:10.1016/j.jmb.2013.03.002)所述,其能够结合120个拷贝的装饰蛋白pb10,通过天然琼脂糖凝胶阻滞实验评估的特性显示针对[pb10拷贝数]/[pb10结合位点数]的比率=1+/-0.1时,衣壳电
泳迁移率降低,如参考vernhes等人,2017(doi:10.1038/srep41662)和图3所述。
[0060]“核酸分子”或“核酸”旨在表示任何长度的脱氧核糖核酸(dna)的聚合物或多脱氧核糖核苷酸,尤其包括互补的dna或cdna、基因组dna、质粒、载体、病毒基因组、分离的dna、探针、引物及其任何混合物;或任何长度的核糖核酸(rna)的聚合物或多核糖核苷酸,尤其包括信使rna或mrna、反义rna;或混合的多核糖-多脱氧核糖核苷酸。它们涵盖单链或双链、线性或环状、天然或合成的多核苷酸。此外,多核苷酸可以包含非天然核苷酸,并且可以被非核苷酸组分中断。
[0061]
在本发明的上下文中,术语“核酸”、“核酸分子”、“多核苷酸”和“核苷酸序列”可互换使用。
[0062]“基因组”是指以物种的脱氧核糖核酸(dna)或物种的核糖核酸(rna)中编码的物种的遗传物质的集合。特别是dna或rna包含编码蛋白的或对应于结构rna的所有基因。它分为编码序列(转录成信使rna并翻译成蛋白)和非编码序列(不转录,或转录成rna但不进行翻译)。因此,“基因组dna”是指以dna形式存在的基因组。
[0063]“噬菌体基因组dna”是指以dna形式存在的噬菌体遗传物质的集合。
[0064]“没有噬菌体基因组dna的衣壳”是指衣壳,其包含以摩尔质量计少于5%的噬菌体基因组dna(全基因组dna或片段)、优选以摩尔质量计少于4%、优选少于3%、优选少于2%、优选少于1%,优选少于0.5%,优选少于0.4%,优选少于0.3%,优选少于0.2%,优选少于0.1%,优选少于0.01%,优选少于0.001%,优选少于0.0001%,优选少于0.00001%,优选少于0.000001%的噬菌体基因组dna。有利地,没有噬菌体基因组dna的衣壳不包含任何痕量的噬菌体基因组dna。换句话说,衣壳完全没有噬菌体基因组dna。更有利地,没有噬菌体基因组dna的衣壳不包含任何痕量的任何其他噬菌体核酸。换言之,衣壳完全没有噬菌体核酸。根据一个有利的实施方案,没有噬菌体基因组dna的衣壳不包含细菌基因组dna和/或不包含细菌质粒dna,或不包含任何dna,或不包含任何核酸。有利地,没有噬菌体基因组dna的衣壳包含以摩尔质量计少于5%的来自细菌的dna(全基因组dna或片段、质粒),优选少于4%,优选少于3%,优选少于2%,优选少于1%,优选少于0.5%,优选少于0.4%,优选少于0.3%,优选少于0.2%,优选少于0.1%,优选少于0.01%,优选少于0.001%,优选少于0.0001%,优选少于0.00001%,优选少于0.000001%。
[0065]“分离的分子”指从其自然环境中提取(即从其天然相关的至少一个其他组分中分离出)的分子,尤其是蛋白、多肽、肽、核酸分子、质粒载体、病毒载体或宿主细胞。
[0066]“多肽”、“蛋白”和“肽”指氨基酸残基的聚合物,其包含通过肽键结合的至少九个氨基酸。该聚合物可以是直链、支链或环状的。该聚合物可以包含天然氨基酸和/或氨基酸类似物,并且其可以被非氨基酸残基中断。作为一般说明,因而不将其束缚于本技术中,如果氨基酸聚合物包含多于50个氨基酸残基,则优选地称其为多肽或蛋白,而如果该聚合物由50个或更少氨基酸组成,则优选地称其为“肽”。这里所用的多肽、蛋白和肽的氨基酸序列的读写方向是常规的读写方向。对多肽、蛋白和肽的氨基酸序列的常规读写将胺末端放在左侧,然后从胺末端(n末端)至羧基末端(c末端)从左到右读写序列。
[0067]“载体”指运载体,优选核酸分子或病毒颗粒,其包含使一个或多个核酸分子能够被施用于宿主细胞或生物、并且在宿主细胞或生物中繁殖和/或表达所必需的元件。
[0068]
从功能的角度来看,该术语涵盖用于维持的载体(克隆载体)、在各种宿主细胞或
生物中表达的载体(表达载体)、染色体外载体(例如,多拷贝质粒)或整合载体(例如,其被设计用于整合进入宿主细胞的基因组,并且当宿主细胞复制时生产其包含的核酸分子的其他拷贝)。该术语还涵盖穿梭载体(例如,在原核宿主和/或真核宿主中均起作用)和转移载体(例如,用于将核酸分子转移至宿主细胞的基因组中)。
[0069]
从结构的角度来看,载体可以是天然的、合成的或人工遗传来源的,或天然和人工的遗传元件的组合。
[0070]
因此,在本发明的上下文中,术语“载体”应被广义地理解为包括质粒和病毒载体。
[0071]
如本文所用的“质粒”指可复制的dna构建体。通常,质粒载体包含选择性标记基因,在存在选择性标记物所对应的化合物时,允许鉴定和/或正选择或负选择携带质粒的宿主细胞。多种正或负选择性标记基因是本领域已知的。例如,抗生素抗性基因可以用作正选择性标记物,可以在存在相应抗生素时选择宿主细胞。
[0072]
如本文所用的术语“病毒载体”是指包含病毒基因组的至少一个元件并且可以包装在病毒颗粒中的核酸载体、或病毒颗粒。病毒载体可以是具有复制能力的或选择性的(例如,设计成在特定宿主细胞中更好地复制或选择性),或者可以是基因失活的使得其是复制不足的或复制缺陷的。
[0073]“宿主细胞”是指细胞,其含有至少一个根据本发明的衣壳,或至少一个能够通过根据本发明的生产方法获得的衣壳,或至少一个根据本发明的载体,或至少一个根据本发明的核酸分子或这些的任何混合物。有利地,宿主细胞能够表达由根据本发明的载体编码的基因和/或能够生产本发明的载体。更有利地,宿主细胞能够被噬菌体(优选噬菌体t5)感染和/或生产噬菌体t5和/或生产噬菌体t5衣壳(空的或其他的,装饰的或其他的)。更有利地,宿主细胞能够产生装饰有根据本发明的融合蛋白的空噬菌体t5衣壳。更有利地,宿主细胞能够产生呈扩增的成熟形式的空噬菌体t5衣壳,优选装饰有根据本发明的融合蛋白。
[0074]
宿主细胞可以由单一类型的细胞、或不同类型的细胞组所组成。宿主细胞也可以是杂交细胞,即由至少两种不同类型的细胞融合而成。
[0075]
宿主细胞可以属于培养的细胞系、原代细胞、干细胞或增殖的细胞。术语“宿主细胞”包括原核细胞、低等真核细胞(如酵母细胞)和其他真核细胞,如真菌细胞、昆虫细胞、植物细胞、藻细胞、微藻细胞、寄生生物细胞、动物细胞和哺乳动物细胞(例如,人或非人,优选非人)。宿主细胞可以是分化细胞、多能细胞、全能细胞、干细胞、诱导多能干细胞、诱导全能干细胞或甚至胚胎细胞、或胚胎干细胞。在胚胎细胞或胚胎干细胞的情况下,细胞优选是非人细胞。
[0076]
术语“宿主细胞”更广泛地包括含有或已经含有根据本发明的核酸分子的细胞,以及此类细胞的后代。
[0077]
宿主细胞可以例如,被分离或组织在组织、器官中,或者甚至在完整的生物内。当宿主细胞是在完整生物中的情况下,所述生物非人。
[0078]
宿主细胞有利地是细菌,优选肠杆菌科(enterobacteriaceae)的细菌,更优选埃希氏杆菌属(escherichia)的细菌,更优选大肠杆菌。
[0079]“同一性”或“序列同一性”指两个多肽之间或两个氨基酸分子之间的准确的序列对应性。在本发明的公开内容的上下文中提及的同一性百分比是在对要比较的序列进行最佳比对后确定的,因此其可以包括一个或多个添加、缺失、截短和/或替换。该同一性的百分
比可以通过本领域技术人员熟知的任何分析方法来计算。同一性的百分比可以通过待比较序列以其整体对其全长进行整体比对后确定。除手动比对之外,还可以使用needleman-wunsch算法(1970)进行整体序列比对。
[0080]
对于核苷酸序列,可以使用本领域技术人员公知的任何软件(例如,如needle软件)来执行序列比较。有用的参数尤其可以如下:“空位开放”等于10.0,“空位延伸”等于0.5以及ednafull矩阵(ncbi nuc4.4的emboss版本)。
[0081]
对于氨基酸序列,可以使用本领域技术人员公知的任何软件(例如,如needle软件)来执行序列比较。有用的参数尤其可以如下:“空位开放”等于10.0,“空位延伸”等于0.5以及blosum62矩阵)。
[0082]
优选地,在本发明的上下文中定义的同一性的百分比可以通过待比较序列以其全长进行整体比对的方式确定。作为说明,如本文所用的“至少80%的序列同一性”表示80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性。
[0083]“融合蛋白”指人工蛋白,其通过蛋白(以下称为“蛋白f”)、或蛋白的一个或多个部分(以下称为“蛋白f的部分”)与一个或多个不同蛋白(或不同蛋白的一个或多个部分)(即,所述一个或多个蛋白和一个或多个蛋白部分不同于蛋白f和/或其任何部分)、或与一个或多个非蛋白分子(或非蛋白分子的部分)、或混合分子(即,包含蛋白(或蛋白的部分)和非蛋白分子(或非蛋白分子的部分)的分子;或混合分子的部分)结合获得。所述一个或多个蛋白(或蛋白的一个或多个不同部分)和/或所述一个或多个非蛋白分子(或非蛋白分子的部分)和/或所述混合分子,具体地是外源性的(即,来自与融合蛋白的蛋白f所来源的不同/不相同的生物)。当融合蛋白包含蛋白和/或蛋白的一个或多个部分和/或混合分子时,所述蛋白和/或所述蛋白的一个或多个部分和/或所述混合分子优选包含至少10个连续的氨基酸,更优选至少12个连续氨基酸,更优选至少15个连续氨基酸,更优选至少20个连续氨基酸,更优选至少30个连续氨基酸。当融合蛋白包含蛋白和/或蛋白的一个或多个部分和/或混合分子时,所述蛋白和/或所述蛋白的一个或多个部分和/或所述混合分子优选在非变性条件下(例如,蛋白通常不变性的条件,尤其是不存在变性剂和/或离液剂的条件)具有三维结构,
[0084]“非蛋白分子”有利地指碳水化合物、糖、糖苷、脂质、核酸、神经递质或这些的任何组合。
[0085]“混合分子”是指经过翻译后修饰(例如,乙酰化、酰基化、生物素化、糖基化、羟基化、脂酰化、磷酸化、酰胺化、泛素化、sumo化、脱氨等)的任何蛋白(或蛋白的部分),或已经与非蛋白分子(或非蛋白分子的部分)结合的任何蛋白(或蛋白的部分),例如,与碳水化合物、糖、糖苷、脂质、核酸、神经递质或其任何部分结合的蛋白(或蛋白的部分)或这些的任何组合。例如,混合分子包含糖蛋白。有利地,与融合蛋白的蛋白(即与融合蛋白的蛋白f)(或与蛋白的一个或多个部分)结合的蛋白(或蛋白的部分)、或非蛋白分子(或非蛋白分子的部分)或混合分子(或混合分子的部分)的示例,包括抗原、毒素、受体、定位或靶向或转运信号、酶、激素、抗体、其任何片段(优选功能片段),以及这些的任何组合。
[0086]“肽或蛋白片段”或“肽或蛋白部分”是指肽或蛋白的一部分,即构成所述肽或所述蛋白(称为该片段所来自的肽或蛋白)的连续氨基酸序列的一部分。“分子片段”或“分子部分”是指非蛋白分子或混合分子的一部分。“功能片段”指具有该片段所源自的肽、蛋白或分
子的至少一种原始功能的任何肽或蛋白片段或任何分子片段。优选地,功能片段执行所述功能的功效等于所述肽或所述蛋白或所述分子的至少30%,优选所述肽或所述蛋白或所述分子的功效至少40%,优选至少45%,优选至少50%,优选至少55%,优选至少60%,优选至少65%,优选至少70%,优选至少75%,优选至少80%,优选至少85%,优选至少90%,优选至少91%,优选至少92%,优选至少93%,优选至少94%,优选至少95%,优选至少96%,优选至少97%,优选至少98%,优选至少99%,优选至少100%。当片段是肽、蛋白或混合分子片段时,该片段优选包含其所源自的肽、蛋白或混合分子的至少10个连续氨基酸;更优选包含其所源自的肽或蛋白或混合分子的至少12个连续氨基酸,更优选至少15个连续氨基酸,更优选至少20个连续氨基酸,更优选至少30个连续氨基酸。当片段是肽、蛋白或混合分子片段时,该片段优选在非变性条件下(例如,通常不用于变性蛋白的条件下,尤其是不存在变性剂和/或离液剂的条件下)具有三维结构。
[0087]“三维结构”或“三级结构”是指分子在空间中的固有折叠。具有三维结构的分子是具有稳定的空间构型(通常称为折叠)的分子,该构型是其特定的并且与其功能密切相关:当该结构通过使用变性剂或离液剂解离时,分子称为变性的并失去其功能。特别地,三维结构是不够柔性的结构。相反,非三维结构可以采用一套随时间不断变化的动态构型。在蛋白、肽、混合分子或其片段的情况下,三维结构是多肽链在空间中的折叠。在这种情况下,三维结构不是可以采用一套随时间不断变化的动态构型的线性氨基酸(其不是没有任何空间构型的线性连续的氨基酸)。蛋白、肽、包含蛋白或肽的混合分子或其片段的三维结构通过各种相互作用来维持,这些相互作用可以是:
[0088]
·
共价相互作用(半胱氨酸之间的二硫键)
[0089]
·
静电相互作用(离子键、氢键)
[0090]
·
范德华相互作用
[0091]
·
与溶剂和环境(离子、脂质等)的相互作用
[0092]“纳米颗粒”是指三个维度都在纳米级的物体,即公称直径小于约100nm的颗粒(例如,如由标准iso ts/27687定义的)。“噬菌体纳米颗粒”是指包含至少一个噬菌体或至少一个噬菌体片段的纳米颗粒;或基本上由至少一个噬菌体或至少一个噬菌体片段组成的纳米颗粒;或由至少一个噬菌体或至少一个噬菌体片段组成(此处使用的与噬菌体有关的术语片段与如上文所定义的与肽、蛋白和分子有关的术语片段具有相同含义)的纳米颗粒。有利地,纳米颗粒包含至少一个衣壳或一个衣壳片段;或基本上由至少一个衣壳或至少一个衣壳片段组成,或由至少一个衣壳或至少一个衣壳组成。有利地,所述衣壳如上所定义。所述衣壳优选以成熟的扩增形式、空的或这些的任何组合被装饰。
[0093]“操纵子”是指功能性dna片段,其包含在同一启动子的信号下操纵的基因。这些基因优选地一起转录成信使rna,并且优选地同时执行相同的生理功能。有利地,因为操纵子的所有基因都在同一启动子的控制之下,所以操纵子的所有基因一起被转录或者都不被转录。
[0094]“启动子”是指一段dna,其触发由rna聚合酶识别的一段dna的转录。
[0095]“抗原”是指被生物免疫系统的抗体或细胞识别的,并能够在生物中触发免疫反应的天然或合成的分子。因此,任何引入体内的外来物质或任何微生物都可以充当抗原,即在体内诱导生产称为抗体的特殊蛋白,其具有中和外来物质的有害效果的特性。抗原通常是
肽、蛋白、糖(例如,多糖)及其脂质衍生物。抗原也可以是核酸或半抗原(即,抗原片段)。抗原作为身体外源制剂的标志物,是适应性免疫反应的基础。这是由具有免疫能力的细胞直接或通过抗原提呈细胞(cpa)识别抗原,从而激活特异性免疫。在蛋白抗原的情况下,被抗体或淋巴细胞受体识别的抗原部分称为“表位”或“抗原决定簇”。同一抗原可以具有若干表位(相同或不同),从而诱导不同的免疫反应。有对应于氨基酸序列的连续表位,以及与蛋白结构相关的因而对变性敏感的构象表位。淋巴细胞对抗原的识别取决于表位的性质。b细胞通过其膜上的免疫球蛋白直接结合构象表位。t细胞识别由抗原提呈细胞提呈的连续表位。抗原可以是外源的,即对个体来说是外来的(在这种情况下,它可以是同种异体的(来源于同一物种的个体)或异种的(来源于其他物种)),或者其也可以是内源的,即属于宿主的抗原(自身抗原)。抗原优选为微生物、植物、藻、微藻、细菌、病毒、寄生生物、酵母、真菌、昆虫、动物或肿瘤抗原;优选为真核或原核病原体的抗原或癌的抗原;优选为细菌、病毒、寄生生物、酵母、真菌或肿瘤的蛋白、脂质或糖抗原。不同的抗原分类是本领域技术人员公知的,其尤其可以参考本领域的参考文献(例如g.j.v.nossal,g l ada,antigens,lymphoid cells and the immune response,academic press,1971;marc h.v.van regenmortel,structure of antigens,第3卷crc press,1995年12月20日;edouard drouhet,garry t.cole,louis de repentigny,jean latge,fungal antigens:isolation,purification,and detection,springer science&business media,2013年11月11日;graziano d.f.,finn o.j.(2005)tumor antigens and tumor antigen discovery.in:khleif s.n.(编)tumor immunology and cancer vaccines.cancer treatment and research,第123卷.springer,boston,ma;wang m,claesson mh,methods mol biol.2014;1184:309-17.classification of human leukocyte antigen(hla)supertypes;以及专业的数据库,例如描述在galperin,fern
á
ndez-su
á
rez,rigden,the 24th annual nucleic acids research database issue:alook back and upcoming changes,nar,第45卷,第d1期,2017年1月,第d1-d11页;特别是pmapp数据库,人自身抗原数据库(可在aagatlas.ncpsb.org获得)所述。
[0096]“毒素”是指对一个或多个活的生物有毒的物质。毒素通常由活的生物(细菌、毒蘑菇、毒虫或蛇)合成,并赋予其致病性。由细菌产生的毒素称为细菌毒素,由真菌产生的毒素称为真菌毒素,由植物产生的毒素称为植物毒素,由藻产生的毒素称为藻毒素,由动物产生的毒素称为动物毒素。毒素可以是化学分子、肽、蛋白、糖蛋白、糖、糖苷、脂质、核酸或这些的任何组合。若干科的细菌在其定殖的组织中分泌生物毒素(内毒素)。其他细菌(革兰氏阴性)在其自身中保留了大部分的毒性化合物,其仅在通过化学、物理或机械手段作用的细胞裂解过程中释放(内毒素)。植物毒素通过其次生代谢产物产生毒素:这些分子与初级毒素(蛋白、脂质、碳水化合物、氨基酸等)不同,它们是在确保生存所必需的代谢途径(因此是初级代谢物)之外产生的。植物毒素可分为三类:酚类、氮类和萜类。毒素可以是神经毒素(作用于神经系统的毒素)、肌毒素(作用于肌肉的收缩,尤其是心脏上的心脏毒素以及其他毒素,例如,作用于呼吸肌的士的宁)、血液毒素(作用于血液)、细胞毒素(作用于细胞)、皮肤毒素(作用于皮肤和粘膜)、肝毒素(作用于肝脏)、肾毒素(作用于肾脏)、肠毒素(作用于消化道)等。毒素可以是类毒素;即,一种经过加工以保留其抗原效力并失去其毒性效力的毒素。毒素优选为微生物、植物、藻、微藻、细菌、病毒、寄生生物、酵母、真菌、昆虫、动物或肿瘤
毒素;优选为真核或原核病原体的毒素或癌的毒素。不同类别的毒素是本领域技术人员所公知的,他们尤其可以参考本领域的参考文献(例如michael w.parker,protein toxin structure,springer science&business media,2013年6月23日;michael r.dobbs,clinical neurotoxicology e-book:syndromes,substances,environments,elsevier health sciences,2009年7月22日;walker aa,robinson sd,yeates dk,jin j,baumann k,dobson j,fry bg,king gf.entomo-venomics:the evolution,biology and biochemistry of insect venoms.toxicon.2018年11月;154:15-27;n,louzao mc,abal p,cagide e,carrera c,vieytes mr,botana lm.human poisoning from marine toxins:unknowns for optimal consumer protection.toxins(basel).2018年8月9日;10(8);以及专业数据库,例如描述在galperin,fern
á
ndez-su
á
rez,rigden,the 24th annual nucleic acids research database issue:a look back and upcoming changes,nar,第45卷,第d1期,2017年1月,第d1-d11页;特别是比较毒物基因组学数据库(comparative toxicogenomics database),例如描述在davis,grondin murphy,johnson,lay,lennon-hopkins,saraceni-richards,sciaky,king,rosenstein,wiegers,mattingly,比较毒物基因组学数据库:2013年更新,nar,第41卷,第d1期,2013年1月1日,第d1104-d1114页(可从ctdbase.org获取)。
[0097]“受体”是指细胞膜或细胞质或细胞核的分子,其特异性结合特定的因子(配体,如神经递质、激素或其他物质),诱导对该配体的细胞反应。由配体诱导的受体行为变化导致构成配体的生物学效应的生理变化。受体可以至少包含:肽、蛋白、糖蛋白、糖、糖苷、脂质、核酸或这些的任何组合。受体通常是蛋白或混合蛋白(修饰的蛋白和/或与另一分子结合的蛋白)。受体可以是质膜外部上的受体、嵌入细胞膜的脂质双层中的跨膜受体(通常,例如作为激素和神经递质受体发挥作用的跨膜蛋白)。这些受体或者与g蛋白偶联、或者具有酶或离子通道活性(其在响应配体结合时可以激活信号转导代谢途径),或是细胞内受体(这些受体有时可以在响应配体激活时进入细胞核,以调节特定基因的表达)。受体优选为微生物、植物、藻、微藻、细菌、病毒、寄生生物、酵母、真菌、昆虫、动物或肿瘤受体;优选为真核或原核病原体的受体、或癌的受体;优选为细菌、病毒、寄生生物、酵母、真菌或肿瘤的蛋白或糖蛋白受体。不同的受体分类是本领域技术人员公知的,其尤其可以参考本领域的参考文献(例如,thomas d.pollard,william c.earnshaw,jennifer lippincott-schwartz,graham johnson cell biology e-book,elsevier health sciences,2016年11月1日;mohammed zourob,recognition receptors in biosensors,doi 10.1007/978-1-4419-0919-0,springer-verlag new york 2010;abbas,lichtman,pillai,cellular and molecular immunology e-book,elsevier health sciences,2014年8月12日;以及专门的数据库,例如描述在galperin,fern
á
ndez-su
á
rez,rigden,the 24th annual nucleic acids research database issue:a look back and upcoming changes,nar,第45卷,第d1期,2017年1月,第d1-d11页;特别是gpcrdb数据库,例如描述在isberg v.,mordalski s.,munk c.,rataj k.,harpsoe k.,hauser a.s.,vroling b.,bojarski a.j.,vriend g.,gloriam d.e.gpcrdb:an information system for g protein-coupled receptors.nucleic acids res.2016;44:d356
–
d364(可以在gpcrdb.org上获得))。
[0098]“定位或靶向或转运信号”或“信号传导分子”或“信号”或“细胞信号”是指肽和蛋
白的定位序列、能够转运和/或细胞间转运的分子,以及受体配体(如上定义的受体)。定位序列是氨基酸的短序列,通常位于蛋白的n末端,用于标示必须被定位的蛋白并指示其目的地。因此,定位或靶向或转运信号可以是用于定位或靶向或转运至/朝向细胞核的信号;用于定位或靶向或转运至/朝向细胞质的信号;用于定位或靶向或转运至/朝向细胞液的信号;用于定位或靶向或转运至/朝向细胞膜的信号;用于定位或靶向或转运至/朝向线粒体的信号;用于定位或靶向或转运至/朝向过氧化物酶体的信号;用于定位或靶向或转运至/朝向溶酶体的信号;用于定位或靶向或转运至/朝向内质网的信号;来自分泌通路的用于定位或靶向或转运的信号;以及受体的配体,优选膜或跨膜受体,优选在选自细胞膜、细胞外膜、细胞质膜或核膜的膜中的膜受体或跨膜受体。定位或靶向或转运信号可以至少包含:肽、蛋白、糖蛋白、糖、糖苷、脂质、核酸或这些的任何组合。优选地,定位或靶向或转运信号包含至少一个肽、蛋白、糖蛋白或核酸。信号优选是原核生物、真核生物或病毒信号,优选动物、植物、藻、微藻、微生物、细菌、寄生生物、酵母、真菌、昆虫、病毒或癌信号;更优选哺乳动物信号,例如人信号。不同的信号分类是本领域技术人员公知的,其尤其可以参考本领域的参考文献(例如,thomas d.pollard,william c.earnshaw,jennifer lippincott-schwartz,graham johnson cell biology e-book,elsevier health sciences,2016年11月1日;mohammed zourob,recognition receptors in biosensors,doi10.1007/978-1-4419-0919-0,springer-verlag new york 2010;abbas,lichtman,pillai,cellular and molecular immunology e-book,elsevier health sciences,2014年8月22日)。
[0099]“酶”是指具有催化特性的蛋白。实际上,所有能够在细胞中催化化学反应的生物分子都是酶。然而,一些催化的生物分子由rna组成,因此是核酶而不是酶。酶的作用是降低化学反应的活化能,从而提高反应速度。酶在反应过程中没有变化。初始分子是酶的底物,由这些底物形成的分子是反应产物。酶的特征特别在于其非常高的特异性。此外,酶具有可重复使用的特性。
[0100]
酶通常是球状蛋白,其单独起作用或以几种酶或亚基的复合物起作用。像所有蛋白一样,酶由一条或多条多肽链构成,这些多肽链折叠形成与其天然状态相对应的三维结构。
[0101]
酶是比其底物大得多的分子。其尺寸可以从五十或一百个残基至多于2,000个残基不等。只有酶的一小部分(通常在2至4个残基之间,但有时更多)直接参与催化。这称为催化位点(或催化结构域)。该位点可位于一个或多个结合位点附近,在该位点处结合和定向底物以催化化学反应。催化位点和结合位点形成酶的活性位点。
[0102]
酶在生物中发挥着许多功能。例如,它们可以参与信号转导机制和细胞过程的调节、运动的产生、跨膜主动转运、消化、新陈代谢、免疫系统、核酸的消化或切割机制、核酸生产(本文称为“核酸作用酶”)和前药转化机制(前药到药物的转化)。
[0103]
酶优选是原核生物、真核生物或病毒的酶,优选动物、植物、藻、微藻、昆虫、微生物、细菌、寄生生物、酵母、真菌或病毒的酶;更优选是哺乳动物的酶,例如人的酶。不同类别的酶是本领域技术人员所公知的,他们可以特别参考本领域的参考文献(例如schomburg d.,schomburg i.,springer handbook of enzymes.第二版heidelberg:springer;2001-2009;li
é
becq c.,iupac-iubmb joint commission on biochemical nomenclature(jcbn)and nomenclature committee of iubmb(nc-iubmb)biochem.mol.biol.int.1997;
43:1151
–
1156;iubmb(1992),enzyme nomenclature 1992,academic press,san diego;以及专业的数据库,例如,描述在schomburg d,schomburg i.methods mol biol.2010;609:113-28.酶数据库;特别是brenda数据库(可获自brenda-enzymes.org);如描述在,例如,chang a,schomburg i,placzek s,jeske l,ulbrich m,xiao m,sensen cw,schomburg d,nucleic acids res.2015年1月;43.2014年11月5日brenda in 2015:exciting developments in its 25th year of existence)。
[0104]“酶活性”或“催化活性”或甚至酶的“活性”旨在表示在给定环境中酶将底物转化成产物的效率。本文中酶的效率考虑到酶将底物转化成产物的速度和酶将底物转化成产物的程度。“酶将底物转化为产物的程度”在此旨在表示对于限定量的酶,获得的最终产物的量相对于底物的初始量之间的比率。例如,在本发明的含义内,酶活性可以表示为在给定体积中产物的间苯三酚的量(g/l)。
[0105]“激素”是指一种具有生物活性的化学物质,通常由腺细胞合成(通常在刺激后)并分泌在其循环的内部环境中(通过血液、淋巴或汁液中)。激素以化学方式传递信息(通常作用于靶细胞的特定受体),因此在生物中扮演信使的角色。它能够以非常小的剂量起作用。
[0106]
激素有利地是植物或动物激素。植物激素也称为植物激素或生长因子。它们通常起到确保植物生长或形态发生的作用。动物激素在大多数情况下由内分泌系统(内分泌腺或内分泌组织)产生。
[0107]
有利地,激素是脊椎动物激素,优选选自以下化学类别:
[0108]-源自胺的激素,由单个氨基酸(酪氨酸或色氨酸)组成,但呈衍生物形式。
[0109]-肽激素,其是氨基酸链,因此,是称为最短的肽的蛋白。
[0110]-类固醇激素,其是源自胆固醇的类固醇。
[0111]-基于脂质和磷脂的激素。
[0112]
激素优选选自肽或蛋白激素、胺衍生的激素、类固醇激素和脂质激素。激素优选是动物或植物激素,优选是哺乳动物激素,优选是人激素。不同类别的激素是本领域技术人员所公知的,他们可以特别参考本领域的参考文献(例如davies p.j.(2010)the plant hormones:their nature,occurrence,and functions.in:davies p.j.(编)plant hormones.springer,dordrecht;aw norman,g litwack,hormones,academic press,1997;a kastin,handbook of biologically active peptides,academic press,2013)。
[0113]“抗体”是指免疫系统用于以特定方式检测和中和病原体的复合蛋白或糖蛋白。在哺乳动物中,抗体主要由源自b细胞的细胞:浆细胞来分泌。抗体(也称为免疫球蛋白)构成血液的主要球蛋白。抗体还包括自身抗体(例如,在自身免疫疾病的情况下产生的)。
[0114]
抗体是免疫球蛋白超家族的蛋白或糖蛋白,其由4条多肽链(150,000amu或道尔顿)组成:两条重链(h各为50,000amu)和两条轻链(l各为25,000amu),它们通过数量不等的二硫桥连接在一起,确保分子聚合。这些链形成y形结构(每条轻链构成y的每个臂的一半)并由可包含约110个氨基酸的免疫球蛋白结构域组成。每条轻链由一个恒定结构域和一个可变结构域组成。重链由一个可变片段以及三个或四个恒定片段(取决于同种型)组成。对于给定的抗体,两条重链是相同的,两条轻链也是如此。恒定结构域特征在于氨基酸序列从一种抗体到另一种抗体非常相似,这是物种和同种型的特征。每条轻链都有以cl表示的拷贝。重链(取决于同种型)包含三个或四个恒定结构域ch1、ch2、ch3和(如果适用的话)ch4。
恒定结构域通常不参与抗原识别,而是干预补体系统的激活,以及由具有恒定片段受体(fcr)的免疫细胞消除免疫复合物(与其抗原结合的抗体)。抗体在两个臂的末端具有四个可变结构域。由重链(vh)承载的可变结构域与由轻链(vl)承载的相邻可变结构域之间的结合是抗原的识别位点(或互补位)。因此,免疫球蛋白分子有两个与抗原结合的位点,在每条臂的末端各有一个。这两个位点是相同的(但用于不同的表位),因此每个抗体可能结合两个抗原分子。
[0115]
特异性酶促切割可以分离不同的片段:
[0116]-fc片段(可结晶)。其支持免疫球蛋白的生物学特性,特别是免疫球蛋白被免疫效应子识别或激活补体的能力。其由铰链区以外的重链恒定片段(ch2)组成。fc不识别抗原;
[0117]-fv片段。这是保留免疫球蛋白抗体特性的最小片段。其独特地由可变区vl和vh组成,因此以与完整抗体相同的亲和力结合抗原并且是单价的;
[0118]-fab片段。其对抗原的亲和力与完整抗体相同。fab片段由整个轻链(vl+cl)和部分重链(vh+ch1)组成。其是单价的;
[0119]-f(ab')2片段。其对应于由重链的一小部分恒定部分(铰链区)连接的两个fab片段的结合。其对抗原的亲和力与抗体相同并且是二价的。
[0120]
单克隆抗体是仅识别给定抗体上单一类型表位的抗体。单克隆抗体在定义上是完全相同的,并且是由单个浆细胞克隆所产生的。多克隆抗体是识别给定抗原上不同表位的抗体混合物,每种独特型由不同的浆细胞克隆分泌。在免疫反应期间,生物合成针对抗原的几个表位的抗体:这种反应称为多克隆。抗体可以是抗体的功能片段。在这种情况下,所述片段可以选自抗体的fc片段、抗体的fv片段、抗体的fab片段和抗体的f(ab')片段。抗体优选是动物抗体,优选哺乳动物抗体,优选人或人源化抗体。有利地,抗体是单克隆抗体。不同类别的抗体是本领域技术人员所公知的,他们可以特别参考本领域的参考文献(例如,thomas d.pollard,william c.earnshaw,jennifer lippincott-schwartz,graham johnson cell biology e-book,elsevier health sciences,2016年11月1号;mohammed zourob,recognition receptors in biosensors,doi 10.1007/978-1-4419-0919-0,springer-verlag new york 2010;abbas,lichtman,pillai,cellular and molecular immunology e-book,elsevier health sciences,2014年8月22号);bayer v.,an overview of monoclonal antibodies.semin oncol nurs.2019年9月2号:150927;wang w,wang eq,balthasar jp.monoclonal antibody pharmacokinetics and pharmacodynamics.clin pharmacol ther.2008年11月;84(5):548-58)。
[0121]“微生物”是指微型的活的生物。微生物尤其包括细菌、微型真菌、古细菌、原生生物、微型绿藻、浮游动物、涡虫和变形虫。可以区分出,在一方面是不具有细胞核的原核微生物(例如,细菌和古细菌),在另一方面是具有细胞核的真核生物。微型真核生物包括真菌(例如,酵母)和两种原生生物:藻和原生动物。微生物通常是单细胞的,但有些物种可以是多细胞的。单细胞原生生物可以是裸眼可见的,而一些多细胞物种是微型的。细菌细胞的平均尺寸为0.5至1μm,但也有一些细菌大于50μm。真核细胞的直径为5至100μm。
[0122]“原核生物”(或原核生物)是指其细胞结构不包含细胞核并且几乎不包含膜细胞器(唯一的例外是蓝藻中的类囊体)的生物。它们是特别简单的单细胞生物,例如细菌(包括古细菌和真细菌)。在将生物分类为七界时,原核生物形成了并系分类群,从而将具有相似
且简单的细胞结构的生物归为一类。
[0123]
根据公认的分类,该分类群与“真核生物”相对,所述真核生物的特征为存在细胞核和多个其他细胞器。因此,“真核生物”(或真核生物)是指属于真核生物域的生物,真核生物域包括所有单细胞或多细胞生物,其特征在于存在细胞核和一般专门用于呼吸的细胞器,具体地在需氧菌中是线粒体以及在厌氧菌中是氢酶体。
[0124]“细菌”是指存在于各种环境中的属于细菌界的微型原核生物。这里的术语细菌指的是真细菌和古细菌或古细菌)。
[0125]“藻”是指能够进行生氧光合作用并且其生命周期通常发生在水生环境中的生物。藻尤其包括蓝藻和真核藻。“蓝藻”是指属于蓝藻(cyanobacteria)组的原核生物,也称为蓝绿藻。“真核藻”指属于真核藻组的真核生物,包括青藻门(glaucophyta)或青囊藻门(glaucocystophyta)、红藻门(rhodophyta)、绿藻门(chlorobionta)或绿色植物科(viridiplantae)、隐藻门(cryptophyta)、裸藻门(euglenozoa)、尾藻门(cercozoa)、触藻门(haptophyta)或棱藻门(prymnesiophyta)、甲藻门(dinophyta)和黄藻门(ochrophyta)或异形藻门(heterokontophyta)群。根据本发明的真核藻特别包括具有单细胞物种的各种组(裸藻属(eugl
é
nophytes)、隐藻属(cryptophytes)、触藻属(haptophytes)、青藻属(glaucophytes)等),具有单细胞或多细胞物种的其他组(例如,“红藻”或红藻门(rhodophyta)、原生藻(stramenopiles)(具体分组在硅藻(diatom
é
es)和“褐藻”或褐藻科(ph
é
ophyc
é
es),以及与陆地植物相当接近的植物(例如,“绿藻”,其中包括石藻科(ulvophyc
é
es)等)。
[0126]“微藻”是指微型的藻,有时也称为微植物。它们是单细胞的、或未分化的多细胞的且一般是光合的真核微生物。微藻还可以包括原核生物,包括所有蓝藻(蓝绿藻)。它们生活在高度含水的环境中,可以进行鞭毛运动。它们在所有见光的生物群落中定殖。然而,绝大多数微藻能够通过渗透营养型在夜间进食,因此是混合营养型。微藻在碳循环中发挥重要作用,更通常是在湖泊和海洋的生化循环中发挥重要作用。微藻可以在光生物反应器或工业发酵器中进行单克隆生长。
[0127]“动物”是指属于动物界的生物。根据常规分类,动物是异养生物,即以有机物为食。动物也指现代科学分类中名为动物界(animalia)的动物分类群(linnaeus于1758年根据国际动物命名法(iczn)创建)或后生动物(metazoa)(haeckel于1874年创建的初级同义词)。动物是一种复杂的多细胞生物(后生动物)。无论使用何种术语或保留的分类(进化或遗传分类),这里的动物指多细胞的真核生物,其通常是可移动的和异养的。动物尤其包括脊椎动物组。“脊椎动物”是指属于脊椎动物组(也称为脊椎动物门)的生物,是动物界的一个亚门。脊椎动物具有骨骼或软骨骨架,特别是包括脊柱。这些两侧对称动物属于脊索动物门,包括所有的鱼以及四足动物。还包括盲鳗(无颌鱼),尽管其没有真正的脊柱。
[0128]“哺乳动物”是指属于包含脊椎动物的哺乳动物(也称为哺乳类)的分类群或进化枝(生物系的进化组)或分类的动物。哺乳动物在全球分布。它们已经征服了大型动物的大部分生态位,并且自始新世以来一直是主要的分类群之一。该进化枝的主要特征是幼仔吸吮专门的皮肤-腺体分泌物(称为乳汁)。新生动物由于出生时其消化系统不成熟(乳汁是它们重要的和专一的食物来源),经常需要亲代的照顾。其他特征可以将哺乳动物与其他分类群(包括化石)区分开来。
[0129]“人”属于哺乳动物进化枝。
[0130]“植物”是指属于植物界的生物。根据经典的科学分类,植物界包括发芽系:即其像植物一样呼吸、摄取养分和生长。植物界是光合作用生物的多源组合,因此细胞具有由纤维素组成的壁。术语植物既指陆生植物(或绿色植物)也指绿藻(其构成绿藻门的分类单元)、以及红藻、褐藻和真菌。因此,植物组由两个系组成,一个是藻;另一个是绿色植物(尤其是陆生植物),其包括苔藓植物(苔藓和苔类植物)、蕨类(蕨类植物)、裸子植物和被子植物。有利的是,植物是绿色植物。
[0131]“昆虫”(或昆虫纲)是指节肢动物门和六足动物亚门的一类无脊椎动物。它们的特点是身体分为三个部分(头部,其具有外口器、一对触角和至少一对复眼;胸部,其有三对有关节的腿和两对或多或少经过改造的翅膀;腹部,其没有附属物),由角化层保护,形成由甲壳素组成的外骨骼,并有呼吸气管。
[0132]“寄生生物”是指至少部分靠寄生生活的生物。寄生是两种异种生物之间的一种长期的生物学关系,其中的一个主角(寄生生物)利用宿主生物获得食物、居所或繁殖。这种关系会对宿主产生负面影响。非寄生的生物能够“自由生活”。寄生生物遍布生物世界。一些组几乎完全由寄生生物组成(例如,单种扁虫),尽管大多数既有寄生生物也有自由生活的物种(例如,线虫)。脊椎动物包括一些寄生物种(例如,吸血蝙蝠、七鳃鳗、吸血鬼鱼(或牙签鱼)等)。许多寄生生物可以改变其宿主的行为以利于寄生生物。
[0133]
有利地,寄生生物是动物,优选是人的寄生生物。动物的寄生生物通常是后生动物或原生动物。本文的动物的寄生生物既不包括病毒(病毒感染),也不包括细菌(细菌感染)或真菌(霉菌病)。生物中存在寄生生物称为寄生虫病。在寄生虫病期间,存在嗜酸性粒细胞多形核白细胞的作用。寄生虫病的特征是嗜曙红细胞过多,这对应于血液中防御细胞的增加。晶体(主要蛋白)负责这种抗寄生生物作用。动物寄生生物的示例包括:
[0134]-原生动物(包括以下分类:肠道根足虫纲(变形虫);鞭毛虫;孢子虫:和纤毛虫;)
[0135]-后生动物(包括蠕虫(helminth)(蠕虫);扁形虫(扁虫,非几丁质);吸虫(不分节);血吸虫;绦虫(分节);绦虫;线虫(蛔虫、几丁质、不分节、性别分开)、丝虫等);
[0136]-节肢动物门(包括节肢动物和昆虫寄生生物或寄生生物载体)。
[0137]“真菌”或“真菌”是指属于真菌界的真核生物,也称为真菌门。该界构成了一个庞大而多样化的组,从微型的单细胞生物(酵母)或多细胞生物(霉菌)至通常来说具有茎和帽的“高等真菌”。真菌的特别特征是同时存在外周细胞壁和细胞质中的膨胀的液泡、其未分化的营养体和其肽-多糖苷壁,以及不存在叶绿体、叶绿素和淀粉。其是碳异养生物。
[0138]“酵母(levure)”是指能诱导动物或植物有机物发酵的单细胞真菌。酵母通常具有氧化呼吸代谢,也可以利用酒精发酵代谢。这些真核微生物的形状因物种而异(球形、卵形或椭圆形、瓶形、三角形或顶尖形(像柠檬一样在每端各有一个点),但通常呈椭圆形,约6至10微米,至多50微米,通过出芽或分裂(裂殖生殖)倍增。酵母通常能够为了在不利环境中休眠或出于传播目的而实现孢子繁殖。酵母的一般特征在于:细胞壁(由外层和内层组成,外层由甘露糖蛋白与葡聚糖结合,内层由葡聚糖与少量的几丁质结合),其围绕着质膜并保护酵母免受外部环境的物理化学损害;细胞质膜,其主要由双层磷脂组成;细胞核,其含有酵母染色体基因组的遗传信息;线粒体,在酵母有氧呼吸和atp产生中起重要作用。一些酵母在动物中可能是致病性的,导致念珠菌真菌病(念珠菌属)。酵母的示例包括酵母
(saccharomyces)属(例如,酿酒酵母(saccharomyces cerevisiae)或裂殖酵母属(schyzosaccharomyces)的酵母。
[0139]“病毒”是指需要宿主(通常是细胞)的传染性病原体,其使用宿主的代谢和组分用于自身复制。病毒在其周期中会改变形式,经过两个阶段:
[0140]-细胞外的形式(当存在衣壳时称为病毒体的独立物质单位,或者对于某些形式称为类病毒)。在细胞外形式中,病毒是至少由通常包裹在蛋白衣壳中的核酸组成的颗粒的、传染性物体;
[0141]-细胞内的形式(病毒以休眠形式整合或主动劫持细胞机制以利于病毒自身复制)。在病毒的细胞内形式中(在宿主细胞内),病毒是可以通过寄生在宿主细胞的全部或部分代谢中进行复制的遗传元件,无论其整合到宿主基因组的染色体上(称为前病毒),或与之并行(例如,病毒体工厂的情况)。
[0142]
病毒优选是真核病毒(即,感染真核生物,更特别是真核细胞的病毒),更优选是动物病毒(即,感染动物,更特别是动物细胞的病毒),更优选是哺乳动物病毒(即,感染哺乳动物,更特别是哺乳动物细胞的病毒),更优选人病毒(即,感染人,更特别是人细胞的病毒)。病毒也可以是植物病毒(即,感染植物以及更特别是植物细胞的病毒),优选绿色植物病毒(即,感染绿色植物,更特别是绿色植物细胞的病毒)。
[0143]
病毒优选是致病病毒。
[0144]“疾病”或“病状”或“病症”或“病理”是指对活的生物的功能或健康的损害。我们说的疾病既指一般疾病(指所有健康损害),也指“一种疾病”,其指以其自身的原因、症状、进展和治疗可能性表征的具体疾病。
[0145]“感染”或“传染病”是指由传染性微生物或病原体传播(病毒、细菌、寄生生物、真菌、原生动物)引起的疾病。
[0146]“自身免疫性疾病”是指由于免疫系统异常导致其攻击身体的正常部分(“自身”)而导致的疾病。
[0147]“代谢疾病”是指影响细胞代谢,特别是能量产生的医学病状。一般来说,代谢疾病会阻碍生物对糖、脂肪和蛋白的顺利转化。
[0148]“皮肤病”是指皮肤、粘膜和覆盖物(指甲、头发、体毛)的疾病。
[0149]“心血管疾病”或“心血管-神经血管疾病”是指涉及心脏和血流的疾病。
[0150]“呼吸系统疾病”是指影响呼吸系统的疾病。呼吸系统是允许呼吸(即,在生物与环境之间进行气体交换)的器官的集合。在哺乳动物(如人)中,呼吸系统包括鼻、口、咽、喉、气管、膈肌和肺。肺包括支气管、细支气管、肺泡和腺泡。“肺部疾病”或“肺病”是指影响肺部的呼吸系统疾病。呼吸和/或肺部疾病可以是传染性的、病毒性的、遗传的或环境起源的或由这些因素的组合引起的。
[0151]“神经退行性疾病”是指一种可以缓慢而离散地发展的慢性、致残性的疾病。其通常会导致神经细胞,特别是神经元功能的恶化,这会导致细胞死亡(或神经变性)。由神经退行性疾病引起的病症多种多样,可以是认知行为、感觉或运动障碍。
[0152]“遗传疾病”是指由于一条或多条染色体上的一个或多个异常导致生物的某些细胞功能缺陷所引起的疾病。遗传疾病取决于负责的等位基因是否是显性(在个体中,每个基因由两个等位基因表示)而称为显性的或隐性的。遗传疾病可以根据导致异常的基因的位
置进行分类。如果该基因位于一对性染色体上,则该疾病称为“性连锁的”,如果该基因位于一对同源染色体上,则该疾病称为“常染色体的”。
[0153]“激素疾病”或“内分泌疾病”是指由内分泌腺分泌的激素的功能紊乱所引起的疾病。
[0154]“精神疾病”或“心理疾病”或“精神障碍”或“心理障碍”是指一组来源非常不同的病状和障碍,导致个人和/或其周围人的生活困难、遭受情感和行为障碍。精神病状不分性别或年龄影响每个群体。这些障碍可以是偶发的、慢性的或持续的。
[0155]“癌症”或“癌性疾病”是指由细胞的异常转化和过度增殖(这称为不受控制的增殖)引起的疾病。这些失调的细胞最终可以形成称为肿瘤的肿块(通常是恶性肿瘤)。癌细胞通常倾向于侵袭邻近组织并从肿瘤中逃逸。它们还可以通过血管和淋巴管迁移形成另一种肿瘤:这称为转移。癌症汇集了一系列形式和后果都非常不同的病理现象,但无论哪种癌症都有一套非常典型的特征。在大多数癌中尤其可以发现以下组织学因素:
[0156]-癌细胞不依赖通常刺激细胞倍增的信号;
[0157]-癌细胞对抗增殖信号和机制不敏感;
[0158]-无限的增殖能力(无限增长,通常会导致赘生物);
[0159]-这些癌细胞中细胞凋亡现象消失,也称为以患者为代价的侵略性“永生”形式;
[0160]-细胞退化或去分化朝向越来越让人想起胚胎干细胞的形式(因此,癌细胞可以从特化/分化细胞状态转变为非特化、未成熟、多能或多能细胞状态);
[0161]-异常的血管生成能力;
[0162]-通常在晚期获得侵袭的能力;
[0163]-无论是否存在组织侵袭都有周围组织的病变(坏死);
[0164]-除了极少数例外,它们来源于患有该癌症的个体的细胞(它们是自身细胞)。
[0165]“肿瘤”是指没有特定原因的组织的体积增加。这是一种发生在细胞生长失调之后的身体组织的新形成(瘤形成),有良性或恶性(当肿瘤为恶性肿瘤时称为癌)。瘤形成可以涉及任何类型的组织。根据肿瘤的位置和受影响组织的功能,它可能导致器官功能障碍并损害整个生物,甚至导致其死亡。肿瘤可以发生在所有多细胞生物中,包括植物。良性肿瘤和恶性肿瘤的区别:
[0166]-良性肿瘤(如疣或痣)通常不是严重的肿瘤,即它们不会引起继发性肿瘤(转移)。然而,良性肿瘤可通过其机械作用导致严重的并发症(压迫、炎症等)。
[0167]-恶性肿瘤通常用术语癌表示。除了攻击周围组织外,这些肿瘤会通过血液或淋巴传播产生继发性肿瘤(转移)。
[0168]
这里的“肿瘤”优选是指恶性肿瘤。
[0169]“与感染相关的疾病和/或与暴露于毒素相关的疾病”是指由至少一种感染和/或一次性的、偶然的、规律的、长期的或反复暴露于至少一种毒素所引发的、导致的、扩大的和/或维持的疾病,优选为非感染性的。
[0170]“预防”或“预防疾病”或“预防疾病发作”是指降低疾病的发作、发展或扩大,疾病的原因,疾病的症状,疾病的影响(或疾病的后果,优选是不利的、有害的影响/后果)或这些的任何组合;和/或延缓疾病的发作、发展或扩大,疾病的原因,疾病的症状,疾病的影响(或后果,优选是不利的、有害的影响/后果)或这些的任何组合。
[0171]
术语“治疗”和“疾病的治疗”指降低、抑制和/或解决疾病、疾病的原因、疾病的症状、疾病的影响(或疾病的后果,优选是不利的、有害的影响/后果)或这些的任何组合
[0172]“疫苗”或“疫苗组合物”是指病原体或肿瘤物质,其优选以无害形式接种到个体中以赋予个体对疾病的免疫力(或防御疾病)。一般来说,疫苗会刺激生物的免疫反应。疫苗可以起到预防作用,防止疾病发作。疫苗也可以是治疗性的,帮助患者对抗正在进展的疾病。
[0173]“药物”是指对人或动物疾病具有治疗或预防特性的任何物质或组合物。因此,药物包含可用于人或动物、或可施用于人或动物的任何物质或组合物,其目的是通过发挥药理学、免疫学或代谢作用来建立医学诊断,或恢复、纠正或改变人或动物的生理功能。
[0174]
在下面的详述中,技术人员可以单独考虑实施方案或将其以适当方式组合。
[0175]
衣壳
[0176]
发明人以完全出人意料的方式开发了没有噬菌体基因组dna的,并能够在其表面暴露目的融合蛋白的空的噬菌体t5衣壳。此外,这些功能化衣壳尤其能够在体内发挥使用的目的融合蛋白的功能和活性。
[0177]
因此,本发明涉及没有所述噬菌体的基因组dna的并在其表面暴露至少一种融合蛋白的噬菌体t5,所述融合蛋白包含至少一个与装饰蛋白pb10的片段具有至少80%的同一性的肽或蛋白片段,优选与装饰蛋白pb10的片段具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;所述装饰蛋白pb10的片段包含(或基本上由或由以下组成)优选蛋白pb10的至少76个连续氨基酸,优选蛋白pb10的至少77个连续氨基酸,更优选蛋白pb10的至少80个连续氨基酸;更优选蛋白pb10的n末端结构域的至少76个连续氨基酸,更优选蛋白pb10的n末端结构域的至少77个连续氨基酸,更优选蛋白pb10的n末端结构域的至少80个连续氨基酸。
[0178]
有利地,融合蛋白还包含至少一个分子,优选外源分子。
[0179]
本发明特别涉及噬菌体t5衣壳,其没有所述噬菌体的基因组dna并在其表面暴露至少一个融合蛋白;所述融合蛋白包含:
[0180]-至少一个与装饰蛋白pb10的片段具有至少80%的同一性的肽或蛋白片段,优选与装饰蛋白pb10的片段具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;所述装饰蛋白pb10的片段包含(或基本上由或由以下组成)优选蛋白pb10的至少76个连续氨基酸,优选蛋白pb10的至少77个连续氨基酸,更优选蛋白pb10的至少80个连续氨基酸;所述装饰蛋白pb10的片段以特别优选的方式包含蛋白pb10的n末端结构域的至少76个连续氨基酸,更优选蛋白pb10的n末端结构域的至少77个连续氨基酸,更优选蛋白pb10的n末端结构域的至少80个
连续氨基酸;所述装饰蛋白pb10的片段特别包含至少包含在蛋白pb10的位置1和80之间的连续氨基酸,或包含在蛋白pb10的位置1至77之间的连续氨基酸,或包含在蛋白pb10的位置2至77之间的连续氨基酸;和
[0181]-至少一个抗原的功能片段,或至少一个毒素的功能片段,或至少一个受体片段,或至少一个定位或靶向或转运信号的功能片段,或至少一个酶的功能片段,或至少一个激素的功能片段,或至少一个抗体的功能片段,或至少一个抗原,或至少一个毒素,或至少一个受体,或至少一个定位或靶向或转运信号,或至少一个酶,或至少一个激素,或至少一个抗体,或这些的任何组合,优选至少一个抗原的功能片段,更优选至少一个抗原。
[0182]
因此,根据本发明的衣壳是功能化的空衣壳。
[0183]
根据一个有利的实施方案,衣壳的特征在于装饰蛋白pb10的片段选自:
[0184]
i)与蛋白pb10的n末端结构域的部分具有至少80%的同一性的肽或蛋白片段,优选至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;所述部分包含(或基本上由或由以下组成),优选来自蛋白pb10的n末端结构域的至少76个连续氨基酸,更优选来自蛋白pb10的n末端结构域的至少77个连续氨基酸,更优选来自蛋白pb10的n末端结构域的至少80个连续氨基酸;
[0185]
ii)与蛋白pb10的n末端结构域具有至少80%的同一性的肽或蛋白片段,优选至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;所述蛋白pb10的n末端结构域优选包含(或基本上由或由以下组成)包含在蛋白pb10的位置1至80之间的连续氨基酸,或介于包含在蛋白pb10的位置1至77之间的连续氨基酸,或介于包含在蛋白pb10的位置2至77之间的连续氨基酸;
[0186]
iii)包含与序列seq id no:1具有至少80%的同一性的氨基酸序列的蛋白的片段或肽,优选与序列seq id no:1具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;所述片段或肽优选包含所述蛋白的至少前80个连续氨基酸;
[0187]
iv)蛋白的片段或肽,其由(或基本上由)与序列seq id no:1具有至少80%同一性的氨基酸序列组成,优选与序列seq id no:1具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少
86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;所述片段或肽优选包含所述蛋白的至少前80个连续氨基酸;
[0188]
v)包含与序列seq id no:3具有至少80%的同一性的氨基酸序列的肽,优选与序列seq id no:3具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;
[0189]
vi)肽,其由(或基本上由)与序列seq id no:3具有至少80%的同一性的氨基酸序列组成,优选与序列seq id no:3具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;以及
[0190]
vii)蛋白的片段或肽,其由(或基本上由)与序列seq id no:16具有至少80%同一性的氨基酸序列组成,优选与序列seq id no:16具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;所述片段或肽优选包含所述蛋白的至少前77个连续氨基酸;更优选至少包含在位置2至76之间的连续氨基酸。
[0191]
因此,装饰蛋白pb10的片段可以选自包含(或基本上由或由以下组成)蛋白pb10的n末端结构域的片段和完整的蛋白pb10(其可以是天然的或改变的,特别是根据克隆需求改变的)。
[0192]
根据一个具体的实施方案,装饰蛋白pb10选自包含(或基本上由或由以下组成)与序列seq id no:1或与seq id no:16具有至少80%的同一性的氨基酸序列的蛋白,优选与序列seqid no:1或与序列seq id no:16具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;在该
实施方案中,装饰蛋白pb10的片段优选为完整的蛋白pb10。
[0193]
根据一个优选的实施方案,装饰蛋白pb10的片段选自如上文段落中的点iii)、iv)、v)、vi)和vii)所定义的肽或蛋白片段和肽,以及更优选地,装饰蛋白pb10的片段选自如上文段落中的点iii)和v)中所定义的肽或蛋白片段和肽。
[0194]
根据一个优选的实施方案,衣壳特征在于装饰蛋白pb10选自如上文段落中的点i)、ii)、v)和vi)所定义的肽或蛋白片段和肽,以及更优选地,装饰蛋白pb10的片段选自如上文段落中的点v)和vi)中所定义的肽或蛋白片段和肽。实际上,发明人已经证明,当蛋白pb10的片段包含蛋白pb10的n末端结构域或由该n末端结构域组成时,功能化(在衣壳表面上暴露融合蛋白)特别有效。
[0195]
根据一个优选的实施方案,抗原的功能片段,毒素的功能片段,受体片段,定位或靶向或转运信号的功能片段,酶的功能片段,激素的功能片段,抗体、抗原、毒素、受体、定位或靶向或转运信号、酶、激素、抗体或这些的任何组合的功能片段是肽、多肽或蛋白,其包含至少10个连续氨基酸,更优选至少12个连续氨基酸,更优选至少15个连续氨基酸,更优选至少20个连续氨基酸,更优选至少30个连续氨基酸。
[0196]
优选地,抗原的功能片段,毒素的功能片段,受体片段,定位或靶向或转运信号的功能片段,酶的功能片段,激素的功能片段,抗体、抗原、毒素、受体、定位或靶向或转运信号、酶、激素、抗体或这些的任何组合的功能片段具有三维结构。
[0197]
根据具体实施方案,抗原的功能片段,毒素的功能片段,受体片段,定位或靶向或转运信号的功能片段,酶的功能片段,激素的功能片段,抗体、抗原、毒素、受体、定位或靶向或转运信号、酶、激素、抗体或这些的任何组合的功能片段,不是通常用于亲和纯化分子的标签,更优选其不是组氨酸标签(由6至10个组氨酸氨基酸的链组成)。
[0198]
有利地,抗原选自包含(或基本上由或由以下组成)至少一种肽、蛋白、糖蛋白、糖、糖苷、脂质、核酸或这些的任何组合的抗原。抗原优选为微生物、植物、藻、微藻、细菌、病毒、寄生生物、酵母、真菌、昆虫、动物或肿瘤抗原;优选为真核或原核病原体的抗原或癌的抗原;优选为细菌、病毒、寄生生物、酵母、真菌或肿瘤的蛋白、脂质或糖抗原。
[0199]
有利地,毒素选自至少包含(或基本上由或由以下组成):化学分子、肽、蛋白、糖蛋白、糖、糖苷、脂质、核酸或这些的任何组合的抗原。毒素优选为微生物、植物、藻、微藻、细菌、病毒、寄生生物、酵母、真菌、昆虫、动物或肿瘤抗原;优选为真核或原核病原体的毒素或癌的毒素。
[0200]
有利地,受体选自至少包含(或基本上由或由以下组成):肽、蛋白、糖蛋白、糖、糖苷、脂质、核酸或这些的任何组合的受体。受体优选为微生物、植物、藻、微藻、细菌、病毒、寄生生物、酵母、真菌、昆虫、动物或肿瘤受体;优选为真核或原核病原体的受体、或癌的受体;优选为细菌、病毒、寄生生物、酵母、真菌或肿瘤的蛋白或糖蛋白受体。
[0201]
有利地,定位或靶向或转运信号选自至少包含(或基本上由或由以下组成):肽、蛋白、糖蛋白、糖、糖苷、脂质、核酸或这些的任何组合的定位或靶向或转运信号。优选地,定位或靶向或转运信号包含(或基本上由或由以下组成)至少一种肽、蛋白、糖蛋白或核酸。信号优选是原核生物、真核生物或病毒信号,优选动物、植物、藻、微藻、微生物、细菌、寄生生物、酵母、真菌、昆虫、病毒或癌信号;更优选哺乳动物信号,例如人信号。
[0202]
有利地,定位或靶向或转运信号可以是用于定位或靶向或转运至/朝向细胞核的
信号;用于定位或靶向或转运至/朝向细胞质的信号;用于定位或靶向或转运至/朝向细胞液的信号;用于定位或靶向或转运至/朝向细胞膜的信号;用于定位或靶向或转运至/朝向线粒体的信号;用于定位或靶向或转运至/朝向过氧化物酶体的信号;用于定位或靶向或转运至/朝向溶酶体的信号;用于定位或靶向或转运至/去往内质网的信号;来自分泌通路的用于定位或靶向或转运的信号;以及受体的配体,优选膜或跨膜受体,优选选自细胞膜、细胞外膜、细胞质膜或核膜的膜的膜或跨膜受体。
[0203]
有利地,酶的功能片段至少包含酶催化结构域,或至少基本上由或至少由酶催化结构域组成,优选酶活性位点。酶优选是原核生物、真核生物或病毒的酶,优选动物、植物、藻、微藻、昆虫、微生物、细菌、寄生生物、酵母、真菌或病毒的酶;更优选是哺乳动物的酶,例如人的酶。
[0204]
有利地,酶选自前药转化酶、作用于核酸的酶、代谢酶、免疫系统酶和消化酶。
[0205]
有利地,激素优选选自肽或蛋白激素、胺衍生的激素、类固醇激素和脂质激素。激素优选是动物或植物激素,优选是哺乳动物激素,优选是人激素。
[0206]
有利地,抗体的功能片段可以选自抗体的fc片段、抗体的fv片段、抗体的fab片段和抗体的f(ab')片段。抗体优选是动物抗体,优选哺乳动物抗体,优选人或人源化抗体。
[0207]
与装饰蛋白pb10的片段和/或融合蛋白具有至少80%的同一性的肽或蛋白片段可以通过用于生产/获得肽或蛋白片段和/或融合蛋白的常规方法获得。这些方法包括,例如通过在表达细胞中插入的表达系统(例如,载体)的方式进行表达的方法,例如通过克隆然后进行纯化。本领域技术人员将知道如何限定适当的步骤以实施这些方法。融合蛋白有利地由任何合适的(本领域技术人员将知道如何定义其特性的)表达系统生产。融合蛋白尤其可以产生自植物或植物细胞、动物(非人)或动物细胞(不包括人胚胎干细胞)、昆虫或昆虫细胞、藻或微藻或藻细胞或微藻细胞、真菌或真菌细胞、酵母、寄生生物或寄生生物细胞、微生物或微生物细胞、或细菌。融合蛋白优选由真核生物或真核细胞生产。
[0208]
当抗原、毒素、受体、定位或靶向或转运信号、酶、激素、抗体的功能片段,抗原,毒素,受体,靶向或转运信号,酶,激素,抗体或这些的任何组合包含,基本上由或由非蛋白物质或分子(不包含蛋白或肽片段或部分)组成,可以通过使用本领域技术人员已知的方法,将所述非蛋白物质或分子融合到与pb10装饰蛋白的片段具有至少80%的同一性的肽或蛋白片段上,本领域技术人员将知道如何选择最合适的方法。这些方法包括,例如,通过与胺反应的融合方法(共价键融合;例如在尤其描述在robertson等人,2011(doi:dx.doi.org/10.1021/bc100365j)的文章中)以及与链霉亲和素反应的融合方法(通过非共价键融合;例如,尤其描述在edgar等人,2009(doi:10.1073/pnas.0601211103)的文章中)。
[0209]
根据一个实施方案,衣壳还包括:
[0210]
(i)至少一个拷贝的与衣壳蛋白pb8具有至少80%的同一性的蛋白,优选与衣壳蛋白pb8具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性(例如,具有序列seq id no:8);或
[0211]
(ii)至少一个拷贝的与门户蛋白pb7具有至少80%的同一性的蛋白,优选与门户蛋白pb7具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性(例如,具有序列seq id no:7);或
[0212]
(iii)至少一个拷贝的与蛋白酶pb11具有至少80%的同一性的蛋白,优选与蛋白酶pb11具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性(例如,具有序列seq id no:9);或者
[0213]
(iv)从(i)至(iii)的任何组合。
[0214]
有利地,衣壳蛋白pb8包含或基本上由或由具有序列seq id no:8的氨基酸序列组成。
[0215]
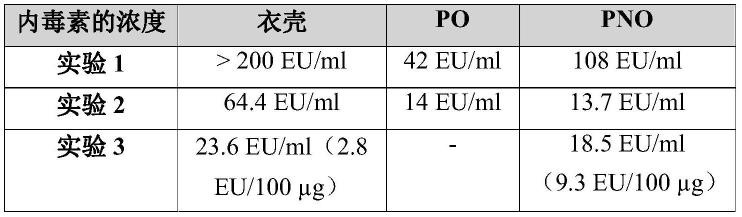
有利地,门户蛋白pb7包含或基本上由或由具有序列seq id no:7的氨基酸序列组成。
[0216]
有利地,蛋白酶pb11包含或基本上由或由具有序列seq id no:9的氨基酸序列组成。
[0217]
有利地,装饰蛋白pb10、衣壳蛋白pb8、门户蛋白pb7和/或蛋白酶pb11是噬菌体t5蛋白。
[0218]
pb7、pb8、pb10、pb11以及这些的任何组合的活性和/或表达可以是可诱导的(例如,通过将编码相应蛋白的基因置于诱导型启动子的控制下)。根据一个特别有利的实施方案,蛋白酶的活性和/或表达是可诱导的(例如,通过将编码蛋白酶的基因置于诱导型启动子的控制下)。
[0219]
有利地,衣壳是扩增的成熟形式。
[0220]
衣壳优选是分离和/或纯化的。衣壳优选是重组的。
[0221]
衣壳生产方法
[0222]
发明人还开发了用于生产根据本发明的衣壳的特别有效的方法。
[0223]
因此,本发明还涉及一种生产衣壳的方法,包括以下步骤:
[0224]
a)生产没有基因组dna并且没有蛋白pb10的噬菌体t5衣壳;
[0225]
b)使步骤a)的衣壳接触如上文定义的融合蛋白,以获得经修饰的衣壳;和
[0226]
c)任选地,使用中性去污剂纯化步骤b)中装饰的衣壳,所述中性去污剂优选选自正辛基-β-d-吡喃葡萄糖苷(β-og)和十二烷基二甲基氨基氧化物(ldao)。
[0227]
步骤a)中不存在装饰蛋白pb10(或其片段)确保在生产衣壳期间以及在添加融合蛋白之前完全不存在装饰。这提供能够以定制方式与任何类型的物质或分子(甚至非蛋白)融合的优势。
[0228]
有利地,融合蛋白通过上述方法生产。
[0229]
发明人还完全出人意料地表明,在衣壳纯化步骤期间使用正辛基-β-d-吡喃葡萄糖苷(β-og)和/或十二烷基二甲基氨基氧化物(ldao)去污剂可以获得纯衣壳。特别是,这些去污剂的使用可以消除大部分污染性内毒素(尤其是源自细菌表达的或生产的),并符合(不超过)动物受试者,尤其是人的施用耐受的内毒素水平。
[0230]
根据一个实施方案,步骤a)的衣壳通过包括以下步骤的方法获得:
[0231]
1.使用突变噬菌体t5感染细菌,优选肠杆菌科的细菌,更优选埃希氏杆菌属的细菌,更优选大肠杆菌细菌,所述突变噬菌体t5缺乏编码t5 dna衣壳化的启动子、终止酶的基因,并缺乏编码装饰蛋白pb10的基因(优选没有编码装饰蛋白pb10的基因);
[0232]
2.步骤1的细菌裂解,对由此产生的细菌裂解物进行沉淀或超速离心,并将沉淀重悬于盐水缓冲液中。
[0233]
3.在甘油梯度上快速沉降,在存在β-og(优选1%)的情况下孵育含有衣壳的级分,然后在ldao(优选0.1%)存在下通过几级离子交换色谱进行纯化,优选在第一步中。
[0234]
根据一个实施方案,步骤b)的装饰的衣壳通过包括以下步骤的方法获得:
[0235]
1.使步骤a)的衣壳与如上定义的融合蛋白接触确定的时间(优选至少10分钟,优选10至60分钟),温度范围为2至20℃(优选温度介于3至5℃)
[0236]
2.相应的衣壳浓度(根据vernhes等人2017描述的操作方案计算)和装饰蛋白优选相应的摩尔比120
×
[衣壳]/[pb10]=1+/-0.1。
[0237]
根据一个特别有利的实施方案,步骤a)的衣壳通过包括以下步骤的方法获得:
[0238]
a-1)获得载体,其包含:
[0239]
(i)至少一个编码与衣壳蛋白pb8具有至少80%的同一性的蛋白的基因,优选与衣壳蛋白pb8具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;
[0240]
(ii)至少一个编码与门户蛋白pb7具有至少80%的同一性的蛋白的基因,优选与门户蛋白pb7具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;
[0241]
(iii)至少一个编码与蛋白酶pb11具有至少80%的同一性的蛋白的基因,优选与蛋白酶pb11具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,
优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;和
[0242]
其中基因(i)至(iii)置于诱导型启动子的控制下;优选地,其中基因(i)至(iii)安置在单个操纵子内;
[0243]
优选地,其中基因(i)至(iii)是根据噬菌体t5基因组进行排序的;和
[0244]
a-2)通过细菌,优选肠杆菌科的细菌,更优选埃希氏杆菌属的细菌,更优选大肠杆菌细菌表达步骤a-1)的载体;以获得没有基因组dna并且没有蛋白pb10的噬菌体t5衣壳;和
[0245]
a-3)任选地,步骤a-2)中的衣壳使用中性去污剂进行纯化,所述中性去污剂优选选自正辛基-β-d-吡喃葡萄糖苷(β-og)和十二烷基二甲基氨基氧化物(ldao)。
[0246]
事实上,发明人以完全出人意料的方式表明,有可能不通过生产突变噬菌体就能生产这些功能化的空衣壳。这可以取消用突变噬菌体感染细菌培养物的步骤,因此避免了在衣壳生产的上游生产大量的噬菌体。该方法还具有防止噬菌体恢复为野生型的优势,从而提高了安全性并提高了空衣壳的产量。因此,发明人开发的这种生产和装饰方法完全独立于细菌噬菌体t5。该系统基于携带编码细菌噬菌体t5衣壳蛋白的基因的载体(特别地,重组质粒)的构建。由于该系统,可以直接生产空的装饰的并且功能性的衣壳(在这种情况下,载体包含编码装饰蛋白和/或其片段的序列),或未装饰的衣壳,然后可以在第二步中通过将未装饰的衣壳与目的融合蛋白的简单接触得到装饰。数据完全出人意料地表明,这些质粒在细菌中的表达导致衣壳的装配,所述衣壳的形态与使用完整噬菌体(突变体或其他)通过常规方法生产的衣壳相似,并且所述衣壳的装饰特性与由完整噬菌体生产的衣壳相当。事实上,数据表明由衣壳基因的异位表达(噬菌体t5的病毒周期之外)所得的衣壳的自装配特性是保守的。因此,本发明人开发了一种用于大规模生产没有基因组dna的重组衣壳的简化的方法,所述衣壳可以通过两种不同的方式进行装饰:i)通过体外添加纯化的装饰蛋白;ii)通过原位共同生产装饰蛋白。
[0247]
在所使用的载体中不存在编码装饰蛋白pb10(或其片段)的基因,确保在衣壳纯化期间以及在添加纯化的嵌合蛋白之前完全不存在装饰。这提供能够以定制方式与任何类型的物质或分子(甚至非蛋白)融合的优势。
[0248]
在这种情况下,使用的(插入)到步骤a-1)的载体中的操纵子包含(或基本上由或由以下组成)优选地与序列seq id no:11具有至少80%的同一性的核酸序列,优选与序列seq id no:11具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;
[0249]
有利地,衣壳蛋白pb8包含或基本上由或由具有序列seq id no:8的氨基酸序列组成。
[0250]
有利地,门户蛋白pb7包含或基本上由或由具有序列seq id no:7的氨基酸序列组成。
[0251]
有利地,蛋白酶pb11包含或基本上由或由具有序列seq id no:9的氨基酸序列组
成。
[0252]
有利地,装饰蛋白pb10、衣壳蛋白pb8、门户蛋白pb7和/或蛋白酶pb11是噬菌体t5蛋白。
[0253]
pb7、pb8、pb10、pb11以及这些的任何组合的活性和/或表达可以是可诱导的(例如,通过将编码相应蛋白的基因置于诱导型启动子的控制下)。根据一个特别有利的实施方案,蛋白酶的活性和/或表达是可诱导的(例如,通过将编码蛋白酶的基因置于诱导型启动子的控制下)。
[0254]
发明人还表明,通过使用编码衣壳蛋白并蛋白pb10的载体,可以直接生产装饰的空衣壳。使用这种方法,产率和效率特别高。
[0255]
因此,本发明涉及一种生产衣壳的方法,包括以下步骤:
[0256]
a)获得载体,其包含:
[0257]
(i)至少一个编码与衣壳蛋白pb8具有至少80%的同一性的蛋白的基因,优选与衣壳蛋白pb8具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;
[0258]
(ii)至少一个编码与门户蛋白pb7具有至少80%的同一性的蛋白的基因,优选与门户蛋白pb7具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;
[0259]
(iii)至少一个编码与蛋白酶pb11具有至少80%的同一性的蛋白的基因,优选与蛋白酶pb11具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;和
[0260]
(iv)至少一个编码如上定义的融合蛋白的基因;
[0261]
其中基因(i)至(iv)置于诱导型启动子的控制下;优选地,其中基因(i)至(iv)安置在单个操纵子内;
[0262]
优选地,其中基因(i)至(iii)根据噬菌体t5基因组排列,以及编码融合蛋白的基因(iv)占据所述基因组中编码蛋白pb10的基因的基因座;
[0263]
b)通过细菌,优选肠杆菌科的细菌,更优选埃希氏杆菌属的细菌,更优选大肠杆菌细菌表达步骤a)的载体;以获得没有基因组dna并且在其表面暴露至少一个拷贝的融合蛋
白的噬菌体t5衣壳;和
[0264]
c)任选地,使用中性去污剂纯化步骤b)中装饰的衣壳,所述中性去污剂优选选自正辛基-β-d-吡喃葡萄糖苷(β-og)和十二烷基二甲基氨基氧化物(ldao)。
[0265]
根据一个实施方案,使用的(插入)到步骤a)的载体中的操纵子包含(或基本上由或由以下组成)优选地与序列seq id no:10具有至少80%的同一性的核酸序列,优选与序列seq id no:10具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性。
[0266]
有利地,衣壳蛋白pb8包含或基本上由或由具有序列seq id no:8的氨基酸序列组成。
[0267]
有利地,门户蛋白pb7包含或基本上由或由具有序列seq id no:7的氨基酸序列组成。
[0268]
有利地,蛋白酶pb11包含或基本上由或由具有序列seq id no:9的氨基酸序列组成。
[0269]
有利地,装饰蛋白pb10、衣壳蛋白pb8、门户蛋白pb7和/或蛋白酶pb11是噬菌体t5蛋白。
[0270]
本发明还涉及通过上述生产方法可获得的衣壳、通过上述生产方法获得的衣壳以及通过上述生产方法直接获得的衣壳。
[0271]
融合蛋白-核酸-载体-宿主细胞-纳米颗粒
[0272]
发明人已经表明,能够以完全独立于细菌噬菌体t5的方式生产这些功能化的空衣壳,从而避免噬菌体恢复为野生型并提高空衣壳的安全性和产量。该生产和装饰方法基于携带编码细菌噬菌体t5衣壳蛋白的基因的载体(特别地,重组质粒)的构建。
[0273]
因此,本发明涉及载体,其包含:
[0274]
(i)至少一个编码与衣壳蛋白pb8具有至少80%的同一性的蛋白的基因,优选与衣壳蛋白pb8具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;
[0275]
(ii)至少一个编码与门户蛋白pb7具有至少80%的同一性的蛋白的基因,优选与门户蛋白pb7具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的
同一性,优选至少99%的同一性,优选100%的同一性;
[0276]
(iii)至少一个编码与蛋白酶pb11具有至少80%的同一性的蛋白的基因,优选与蛋白酶pb11具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;和
[0277]
其中基因(i)至(iii)置于诱导型启动子的控制下;优选地,其中基因(i)至(iii)安置在单个操纵子内;
[0278]
优选地,其中基因(i)至(iii)是根据噬菌体t5基因组进行排序的。
[0279]
本发明还涉及载体,其包含:
[0280]
(i)至少一个编码与衣壳蛋白pb8具有至少80%的同一性的蛋白的基因,优选与衣壳蛋白pb8具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;
[0281]
(ii)至少一个编码与门户蛋白pb7具有至少80%的同一性的蛋白的基因,优选与门户蛋白pb7具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;
[0282]
(iii)至少一个编码与蛋白酶pb11具有至少80%的同一性的蛋白的基因,优选与蛋白酶pb11具有至少81%的同一性,优选至少82%的同一性,优选至少83%的同一性,优选至少84%的同一性,优选至少85%的同一性,优选至少86%的同一性,优选至少87%的同一性,优选至少88%的同一性,优选至少89%的同一性,优选至少90%的同一性,优选至少91%的同一性,优选至少92%的同一性,优选至少93%的同一性,优选至少94%的同一性,优选至少95%的同一性,优选至少96%的同一性,优选至少97%的同一性,优选至少98%的同一性,优选至少99%的同一性,优选100%的同一性;和
[0283]
(iv)至少一个编码如上定义的融合蛋白的基因;
[0284]
其中基因(i)至(iv)置于诱导型启动子的控制下;优选地,其中基因(i)至(iv)安置在单个操纵子内;
[0285]
优选地,其中基因(i)至(iii)根据噬菌体t5基因组排序,以及编码融合蛋白的基因(iv)占据所述基因组中编码蛋白pb10的基因的基因座;
[0286]
有利地,衣壳蛋白pb8包含或基本上由或由具有序列seq id no:8的氨基酸序列组
成。
[0287]
有利地,门户蛋白pb7包含或基本上由或由具有序列seq id no:7的氨基酸序列组成。
[0288]
有利地,蛋白酶pb11包含或基本上由或由具有序列seq id no:9的氨基酸序列组成。
[0289]
有利地,衣壳蛋白pb8、门户蛋白pb7和/或蛋白酶pb11是噬菌体t5蛋白并且融合蛋白包含至少一个噬菌体t5的蛋白pb10的片段(优选地,如上所定义的噬菌体t5装饰蛋白pb10的n末端结构域)。
[0290]
启动子优选为t7启动子;优选载体是表达载体,优选细菌表达载体,优选细菌表达质粒,优选t7 rna聚合酶表达质粒。
[0291]
本发明还涉及宿主细胞,其包含至少一个如上定义的衣壳,或至少一个可以通过任何一种上文定义的生产方法获得(或可获得,或直接获得)的衣壳,或至少一个如上定义的载体,或这些中任何的混合物。
[0292]
宿主细胞可以是真核细胞或原核细胞。宿主细胞优选是细菌,优选肠杆菌科的细菌,更优选是埃希氏杆菌属的细菌,更优选大肠杆菌细菌。宿主细胞优选是分离的。宿主细胞优选是重组的。
[0293]
本发明还涉及如上定义的融合蛋白。融合蛋白优选是分离和/或纯化的。融合蛋白细胞优选是重组的。
[0294]
本发明还涉及编码如上定义的融合蛋白的核酸。核酸优选是分离和/或纯化的。核酸优选是重组的。
[0295]
本发明还涉及纳米颗粒,其包含至少一个如上定义的衣壳,或至少一个能够通过上述生产方法获得的衣壳,或至少一个通过上述生产方法获得的衣壳,或至少一个通过上述生产方法直接获得的衣壳,或至少一个如上定义的载体,或至少一个如上定义的宿主细胞或这些的任何混合物。
[0296]
本发明还涉及如上定义的衣壳,或能够通过上述生产方法获得的衣壳,或通过上述生产方法获得的衣壳,或通过上述生产方法直接获得的衣壳,特征在于是如上定义的纳米颗粒和/或载体,特征在于是纳米颗粒。
[0297]
本发明涉及以下作为纳米颗粒的用途:至少一个如上定义的衣壳,或至少一个能够通过上述生产方法获得的衣壳,或至少一个通过上述生产方法获得的衣壳,或至少一个通过上述生产方法直接获得的衣壳,或至少一个如上定义的载体或这些的任何混合物。有利地,用途是非医疗的生物技术用途。根据一个优选的实施方案,用途是体外用途。
[0298]
组合物-药物组合物
[0299]
本发明还涉及组合物,其包含至少一个如上定义的衣壳,或至少一个能够通过上述生产方法获得的衣壳,或至少一个通过上述生产方法获得的衣壳,或至少一个通过上述生产方法直接获得的衣壳,或至少一个如上定义的载体,或至少一个如上定义的宿主细胞,或至少一个如上所述的纳米颗粒或这些的任何混合物。
[0300]
组合物还可以包含至少一种美容上可接受的赋形剂(在这种情况下,该组合物是美容组合物)和/或至少一种合适的载剂,其可以是本领域技术人员已知的任何赋形剂和/或任何载剂以获得如上定义的组合物。
[0301]
发明人以完全出人意料的方式表明,根据本发明的衣壳暴露的融合蛋白保留了其所有特性和功能,尤其是在体内施用后。特别地,在小鼠模型中施用这些由抗原功能化的衣壳诱导有效的免疫,并显著诱导体液反应(抗体)和细胞反应。这种免疫的结果是有效接种这些小鼠。
[0302]
本发明还涉及药物和/或疫苗组合物,其包含至少一个如上定义的衣壳,或至少一个能够通过上述生产方法获得的衣壳,或至少一个通过上述生产方法获得的衣壳,或至少一个通过上述生产方法直接获得的衣壳,或至少一个如上定义的载体,或至少一个如上定义的宿主细胞,或至少一个如上所述的纳米颗粒或这些的任何混合物。
[0303]
根据一个实施方案,药物和/或疫苗组合物还可以包含至少一个药学上可接受的赋形剂和/或至少一个药学上可接受的佐剂和/或至少一个药学上可接受的载剂,其可以是本领域技术人员已知那些中的任何合适的赋形剂和/或任何合适的佐剂和/或任何合适的载剂以获得如上定义的药物和/或疫苗组合物。
[0304]
根据一个有利的实施方案,组合物(药物或其他、疫苗或其他)是适合局部或口服施用或通过注射施用的形式。
[0305]
制备这些组合物的操作条件是本领域技术人员常识的一部分。
[0306]
有利地,该组合物没有额外的佐剂。实际上,发明人已经表明,根据本发明的衣壳提供了佐剂作用,其佐剂作用至少与模型佐剂(弗氏完全佐剂)一样有效。
[0307]
治疗用途-治疗方法
[0308]
发明人以完全出人意料的方式表明,根据本发明的衣壳暴露的融合蛋白保留了其所有特性和功能,尤其是在体内施用后。特别地,在小鼠模型中施用这些由抗原功能化的衣壳诱导有效的免疫,并显著诱导体液反应(抗体)和细胞反应。这种免疫的结果是有效接种这些小鼠。
[0309]
因此,本发明涉及如上定义的衣壳,或能够通过上述生产方法获得的衣壳,或通过上述生产方法获得的衣壳,或通过上述生产方法直接获得的衣壳,或如上定义的载体,或如上定义的宿主细胞,或如上所述的纳米颗粒,或如上定义的药物和/或疫苗组合物或这些中的任何的混合物作为药物和/或疫苗的用途。
[0310]
本发明还涉及药物和/或疫苗组合物用作药物和/或疫苗的用途,所述药物和/或疫苗组合物包含至少一个如上定义的衣壳,或至少一个能够通过上述生产方法获得的衣壳,或至少一个通过上述生产方法获得的衣壳,或至少一个通过上述生产方法直接获得的衣壳,或至少一个如上定义的载体,或至少一个如上定义的宿主细胞,或至少一个如上所述的纳米颗粒或这些的任何混合物。
[0311]
因此,本发明涉及如上定义的衣壳,或能够通过上述生产方法获得的衣壳,或通过上述生产方法获得的衣壳,或通过上述生产方法直接获得的衣壳,或如上定义的载体,或如上定义的宿主细胞,或如上所述的纳米颗粒,或如上定义的药物和/或疫苗组合物或这些中的任何混合物在制备药物和/或疫苗中的用途。
[0312]
本发明还涉及预防或治疗性的治疗方法,其包括施用如上定义的衣壳,或能够通过上述生产方法获得的衣壳,或通过上述生产方法获得的衣壳,或通过上述生产方法直接获得的衣壳,或如上定义的载体,或如上定义的宿主细胞,或如上所述的纳米颗粒,或如上定义的药物和/或疫苗组合物或这些的任何混合物。
[0313]
本发明还涉及如上定义的衣壳、或能够通过上述生产方法获得的衣壳、或通过上述生产方法获得的衣壳、或通过上述生产方法直接获得的衣壳、或如上定义的载体、或如上定义的宿主细胞、或如上所述的纳米颗粒,或如上定义的药物和/或疫苗组合物或这些的任何混合物用于预防和/或治疗以下的用途:感染(例如,病毒或细菌感染);自身免疫性疾病;代谢疾病;皮肤病、心血管疾病;呼吸系统疾病;神经退行性疾病;遗传病;内分泌疾病;精神疾病;癌症;与感染和/或毒素有关的疾病,例如与病毒或细菌感染有关和/或与毒素暴露有关的疾病。
[0314]
本发明还涉及药物和/或疫苗组合物用于预防和/或治疗以下的用途:感染(例如,病毒或细菌感染);自身免疫性疾病;代谢疾病;皮肤病、心血管疾病;呼吸系统疾病;神经退行性疾病;遗传病;内分泌疾病;精神疾病;癌症;与感染和/或毒素有关的疾病(例如与病毒或细菌感染有关和/或与毒素暴露有关的疾病);所述药物和/或疫苗组合物包含至少一个如上定义的衣壳,或至少一个能够通过上述生产方法获得的衣壳,或至少一个通过上述生产方法获得的衣壳,或至少一个通过上述生产方法直接获得的衣壳,或至少一个如上定义的载体,或至少一个如上定义的宿主细胞,或至少一个如上所述的纳米颗粒或这些的任何混合物。
[0315]
以下实施例旨在说明本发明。
[0316]
实施例
[0317]
实施例1:与卵清蛋白融合的噬菌体t5的pb10蛋白的构建及证明其对空噬菌体t5衣壳的装饰特性
[0318]
1.1.生产“嵌合”蛋白:与目的蛋白融合的完整蛋白pb10、或与目的蛋白融合的pb10的n末端结构域:卵清蛋白抗原
[0319]
此处显示的示例是与在疫苗接种检测中用作模型抗原的卵清蛋白(ova;mm=42.8kda)融合的pb10蛋白。描述了嵌合抗原的生产,所述嵌合抗原由完整的蛋白pb10(seq id no:1)与目的蛋白融合组成,或仅由pb10的n末端结构域(pb10n-ter,对应seq id no:3)与替换c末端结构域的目的蛋白融合组成。
[0320]
嵌合蛋白如下生产:
[0321]-将pb10-ovah6(po)和pb10n-ter-ovah6(pno)基因克隆进pet28b中,在大肠杆菌菌株bl21(de3)中表达。
[0322]-在补充有卡那霉素(50μg/ml)的luria broth(lb)培养基中培养转化的细菌,至od600为0.8。
[0323]-通过添加异丙基-β-d-硫代吡喃半乳糖苷(0.4mm iptg)来诱导po和pno基因的表达,并继续培养2小时。
[0324]-破碎细菌沉淀,以100,000g超速离心,收集上清液。
[0325]-分三个步骤从细胞质级分(上清液)中纯化po和pno蛋白:
[0326]
1)在0.1%ldao(十二烷基二甲基氨基氧化物)存在下进行镍柱纯化。
[0327]
2)阴离子交换柱纯化。
[0328]
3)尺寸排阻色谱法纯化
[0329]
通过sds-page分析嵌合蛋白po和pno的纯度(在superdex75 hr10/300柱(ge healthcare)上进行尺寸排阻色谱后洗脱的级分)。获得的结果如图2所示。
[0330]
注意:在这三个步骤结束时,内毒素水平符合疫苗接种要求(《100eu/ml)。
[0331]
1.2.证实嵌合蛋白的“装饰”特性
[0332]
1.2.1.材料和方法
[0333]
根据以上实施例1.1生产的嵌合蛋白用于装饰空的噬菌体t5衣壳。根据preux等人2013年和vernhes等人2017年的文章中的方法,通过将纯化的po和pno蛋白与生产的衣壳在4℃下孵育10分钟来完成装饰检测,修饰和优化如下:
[0334]
i)构建了用于生产空衣壳的新噬菌体t5突变体t5stamn5-δdec,其是从噬菌体t5stamn5中删除编码装饰蛋白pb10的基因所得,如preux等人2013和zivanovic 2014的出版物中所述。该突变体可以确保在衣壳生产过程中和在添加纯化的嵌合蛋白之前完全没有装饰蛋白(数据未显示)。
[0335]
ii)在衣壳纯化步骤中连续使用两种去污剂。正辛基-β-d-吡喃葡萄糖苷(β-og)和十二烷基二甲基氨基氧化物(ldao)。简而言之,在由突变噬菌体t5amn5-δdec感染大肠杆菌菌株f的细菌培养物生产的细菌裂解物中收集到的衣壳,在0.5mnacl和8%的peg 6000存在下沉淀,离心,重悬在含有200至400mm nacl的ph 7.6的50mm tris缓冲溶液中。在通过甘油梯度快速沉降进行纯化的第一步之后,将含有衣壳的级分在1%β-og存在下孵育6至12小时,然后注射进阴离子交换柱。在该柱上进行连续两个纯化步骤。在第一个步骤中,平衡缓冲液和洗脱缓冲液含有0.2至0.05%的ldao。在没有去污剂的情况下,通过阴离子交换对含有衣壳的级分进行新的纯化。该操作可以消除很大一部分污染内毒素,并遵守(不超过)小鼠体内对于注射衣壳所能耐受的内毒素水平。
[0336]
两种方法可以显示蛋白po和pno在纯衣壳上的结合特性:1)通过天然琼脂糖凝胶电泳的生化方法,这种方法可以通过凝胶上的延迟效应用于可视化衣壳的完整装饰(图3)。2)表面等离子共振(spr),一种可以确定空衣壳上嵌合蛋白结合和解离的动力学常数并计算出亲和常数的方法(图4)。这两种技术描述见于vernhe等人(scientific reports 2017)的文章中。
[0337]
1.2.2.通过天然琼脂糖凝胶电泳分析装饰
[0338]
图3显示了用pb10、po和pno蛋白装饰纯的空衣壳的测试结果。已调整不同装饰蛋白和衣壳的相应浓度以获得[蛋白]/[衣壳上的结合位点]的浓度比=1+/-0.1。
[0339]
与未装饰的衣壳[0]相比,装饰的衣壳[1]的迁移延迟。图3显示衣壳用相同浓度的pb10、po和pno蛋白进行完全的装饰。第一个测试表明po和pno蛋白对衣壳的亲和力与天然蛋白pb10的亲和力相当。
[0340]
1.2.3.通过spr测量装饰蛋白的亲和力
[0341]
图4显示嵌合po和pno蛋白与装饰蛋白pb10对空噬菌体t5衣壳具有相同的亲和力。完整的卵清蛋白抗原与完整的蛋白pb10的c末端融合、甚至完整的卵清蛋白抗原与单结构域pb10n-ter的c末端融合不影响装饰蛋白对衣壳的高亲和力。
[0342]
1.2.4.结论
[0343]
因此,t5衣壳构成了生物来源的纳米颗粒,其能够在其表面上暴露120个拷贝的蛋白,其功能可以根据与装饰蛋白融合的肽或蛋白的性质而变化。
[0344]
1.3.“嵌合”蛋白的生产:与目的蛋白融合的完整的蛋白pb10、或与目的蛋白融合的pb10的n末端结构域:mcherry荧光蛋白
[0345]
研究装饰蛋白修饰的又一示例。构建与mcherry荧光蛋白(28.9kda)融合的嵌合蛋白pb10-mcherryh6(seq id no:14)和pb10n-ter-mcherryh6(seq id no:15),并测试其装饰特性。图5所示的结果证明,可以在pb10或其nter结构域的c末端融合又一个、大的蛋白而不影响衣壳结合特性。这种装饰蛋白可用于装饰整个噬菌体衣壳。这尤其使荧光成像应用成为可能。
[0346]
1.4.开发独立于噬菌体t5的衣壳生产系统
[0347]
该研究开始时使用的用于生产空衣壳的方法依赖于使用突变噬菌体t5感染细菌培养物,这需要在衣壳生产的上游生产大量的该噬菌体。此外,在感染过程中,观察到逆转到野生型的高频率发生,这降低了空衣壳的产量。为了克服这些限制,从增加衣壳生产规模的角度出发,发明人开发了完全独立于噬菌体t5的衣壳生产和装饰的系统。
[0348]
将编码门户蛋白pb7、装饰蛋白pb10、成熟的蛋白酶pb11和主要衣壳蛋白pb8的4种衣壳基因,如同它们在t5基因组中的组织结构一样,克隆到载体pet28b中(petcapt5;图6)。它们的表达在t7启动子的控制下,在葡萄糖存在时受到抑制,但可被iptg诱导,这使得可能控制蛋白酶(其对大肠杆菌表达菌株有毒)的基础表达。还构建了该质粒的第二个版本(petcapt5δdec;图7),其中已删除蛋白pb10的基因。例如插入这些质粒的操纵子序列,以及得到的质粒的序列如下:
[0349]
操纵子(插入)capt5:seq id no:10;操纵子(插入)capt5δdec:seq id no:11;petcapt5:seq id no:12;petcapt5δdec:seq id no:13。
[0350]
根据已经描述的用于从突变噬菌体生产衣壳的操作方案(有一些变化),纯化从质粒生产的衣壳。特别是,在第一步在甘油梯度上纯化后收获的衣壳在60,000g离心20至30分钟。这种超速离心步骤可以在阴离子交换色谱步骤之前浓缩衣壳,并消除大部分可溶性蛋白和dna污染物。
[0351]
结果表明,在这种大肠杆菌细菌中,来自这些质粒的衣壳基因的表达导致衣壳的自装配,所述衣壳的形态与噬菌体生产的衣壳形态相似,然后在体外扩增(图8a)。通过使用天然琼脂糖凝胶的生化方法评估这些重组衣壳结合装饰蛋白的能力,从而估计pb10对其结合位点的亲和力(图8b)。用纯化的蛋白pb10对两种衣壳群体进行结合测试。在没有pb10的情况下装配的衣壳显示出与由噬菌体生产的衣壳相当的装饰特性。在装饰蛋白pb10存在下生产的衣壳具有与完全装饰衣壳相当的电泳迁移率,并且它们在凝胶上的迁移不会因添加pb10而改变。该结果表明,衣壳在其装配过程中是原位装饰的,如果在衣壳纯化后添加装饰蛋白,则衣壳不能结合装饰蛋白,以及在装配过程中所有结合位点都已饱和(最佳效率)。使用针对pb10的多克隆抗体,通过蛋白印迹验证了这些衣壳上pb10的存在(图9)。
[0352]
1.5.观察结果
[0353]
这些数据表明来自衣壳基因的异位表达(噬菌体t5的病毒周期之外)所得空衣壳的自装配特性。这些数据与之前发表的结果尤其不同(huet等人,2016),至少是因为:
[0354]
i)在用iptg诱导之前,可以通过在0.2%至0.5%葡萄糖存在下抑制衣壳基因的基础表达来控制蛋白酶的毒性,这显著增加衣壳产量。
[0355]
ii)使用质粒petcapt5δpb10生产的衣壳在其扩增构象中获得,而由质粒petcapt5生产的衣壳在其扩增的和完全装饰的构象中获得。
[0356]
因此,这些重组的t5衣壳能够以两种不同的方式装饰:i)通过体外添加纯化的装
饰蛋白;ii)通过在体内共同生产装饰蛋白与形成衣壳的蛋白。相对于使用噬菌体t5的生产而言,这两种方法能够简化功能化纳米颗粒的生产,并使其可以更大规模地生产。
[0357]
实施例2:在小鼠中的疫苗接种实验(体内)
[0358]
通过使用由pascale boulanger(pb)组生产的噬菌体衣壳和重组蛋白的制剂来生成在体内实验中获得的结果。由karim benihoud(kb)组测试在制剂中的内毒素污染。
[0359]
2.1.实验1:
[0360]
目标:根据其是否与纯化的噬菌体t5衣壳(c)结合,比较重组蛋白pb10-ovah6(po)和pb10nterm-ovah6(pno)诱导的免疫反应。
[0361]
表1:实验1实验计划
[0362]
组蛋白衣壳完全弗氏佐剂(acf)popo
‑‑
po+cpo+-pnopno
‑‑
pno+cpno+-po+acfpo-+
[0363]
关键词:pb10-ovah6=po;pb10nterm-ovah6=pno;纯化的噬菌体t5衣壳=c
[0364]
2.2.实验2:
[0365]
目标:根据其是否与纯化的噬菌体t5衣壳结合,比较重组蛋白pb10-ova(po)和pb10nterm-ova(pno)诱导的免疫反应。
[0366]
表2:实验2实验计划
[0367]
组蛋白衣壳完全弗氏佐剂(acf)popo
‑‑
po+cpo+-pnopno
‑‑
pno+cpno+-po+acfpo-+
[0368]
在该实验中,测试纯化的衣壳制剂和重组蛋白中的内毒素污染。
[0369]
2.3.实验3:
[0370]
目标:根据其是否与纯化的噬菌体t5衣壳结合,比较重组蛋白pb10nterm-ovah6(pno)诱导的免疫反应。
[0371]
表3:实验3实验计划
[0372]
组蛋白衣壳完全弗氏佐剂(acf)pnopno
‑‑
pno+cpno+-po+acfpno-+
[0373]
在该实验中,检测了纯化的衣壳制剂和重组蛋白中的内毒素污染。
[0374]
2.4.材料和方法
[0375]
2.4.1.内毒素含量的测定
[0376]
根据制造商的说明(thermo fisher scientific),使用lal显色内毒素定量试剂盒(pierce lal)定量用于体内实验的蛋白和衣壳制剂中的内毒素水平。
[0377]
2.4.2.小鼠的免疫
[0378]
由janvier(le genest saint isle,法国)提供6周龄的雌性c57bl/6小鼠。在实验开始之前,所有的小鼠都在我们的动物设施中进行至少一周的适应。所有的动物实验都得到第26号伦理委员会(由法国研究部官方授权(minist
è
rede la recherche))的批准(授权号为19055-2019021108472030),符合欧洲指令2010/63号及其在法国法律中的转换。
[0379]
含有或不含衣壳(32nm)的重组pb10融合蛋白(3.6μm)在50μl体积的pbs缓冲液中通过皮下注射。在一些实验中,对照组接受与完全弗氏佐剂(acf,sigma)混合的pb10-ova(3.6μm)的注射。在重新施用(第二次注射)期间除了对照组都使用类似的条件,在对照组中用不完全弗氏佐剂(ifa,sigma)代替完全弗氏佐剂。在施用疫苗制剂后在不同时间在下颌下静脉中抽取血样。制备和分析血清用于通过如下所述的elisa测定特异性抗体的存在。在第二次注射后10天采集脾脏用于测量细胞免疫反应。
[0380]
2.4.3.抗体反应的测量
[0381]
将卵清蛋白(1μg,sigma)固定在96孔板(nunc)上。在tbst缓冲液中洗涤并用含有5%牛奶的tbs-tween饱和后,加入血清在含有5%的牛奶的tbst中的系列稀释液。用与过氧化物酶(southern biotechnology associates,birmingham,al)偶联的特异于小鼠igg或同种型(igg1、igg2b、igg2c、igg3或igm)的山羊抗体检测结合的抗体。通过与底物临苯二胺二盐酸盐(sigma-aldrich)一起孵育30分钟显示过氧化物酶活性。通过添加3n的hcl终止反应,并在490nm处获取分光光度读数。滴度定义为稀释度的倒数,最高的od490是背景值的两倍。类似的操作方案用于测量衣壳或pb10特异性抗体。
[0382]
2.4.4.细胞免疫反应的测量。
[0383]
脾脏在补充有10%胎牛血清和10-5
mβ-巯基乙醇的rpmi培养基中破碎,然后通过100μm筛子过滤。在用ack裂解缓冲液(invitrogen,cergy pontoise,法国)去除红细胞后,将细胞重新悬浮并将浓度调至2.5
×
106细胞/ml。然后在不同条件下(仅培养基、200μl体积的肽ova
257-264
(5μg/ml)一天(elispot)或三天(elisa)重新刺激脾细胞。对于elispot,根据供应商的说明(diaclone)显示板的情况。通过s6 fluorospot(ctl,cleveland,ohio)对产生ifnγ的细胞点数进行计数。对于elisa,测试,通过使用ifnγ测定试剂盒(ebioscience)测定上清液中的ifnγ浓度。使用离子霉素(1μm)和醋酸佛波酯(0.1μm)进行再刺激来控制脾细胞制剂的质量。
[0384]
2.5.结果
[0385]
结果列于下表4,其显示内毒素浓度测量数据;在图10中(pb10融合蛋白诱导的抗ova抗体反应的动力学);在图11中(pb10融合蛋白诱导的抗体性质的表征);在图12中(pb10与ova的融合蛋白诱导的细胞反应分析);和图13(蛋白pno诱导的细胞反应分析)。
[0386]
表4:实验1至3的内毒素浓度[表4]
[0387][0388]
实验2的结果
[0389]
图10的数据表明:
[0390]-单独注射的po和pno蛋白可诱导少量抗ova抗体(igg)的产生
[0391]-与纯化噬菌体t5衣壳一起注射po和pno蛋白诱导强烈的ab反应,在疫苗制剂施用后第28天达到平台期。这种反应是持久的,因为在施用与纯化的衣壳结合的po或pno后192天仍可检测到高水平的抗ova抗体。
[0392]-在注射po或pno加衣壳的组中的抗ova ab的反应动力学(总igg)与在共注射po+acf(反应阳性对照)的小鼠中获得的反应动力学相当。
[0393]-pb10融合蛋白与纯化的噬菌体t5衣壳的共同施用诱导了与使用标准佐剂(完全弗氏佐剂(acf))获得的持久抗ova ab反应相当。
[0394]
图11的数据表明:
[0395]-注射po+c或pno+c的小鼠组与只注射po或pno的组相比产生非常大量的igg1、igg2b、igg2c和igg3型抗ova的ab。
[0396]-po+c和pno+c组之间产生的同种型没有区别,这表明仅有pb10的n末端部分就足够了,并且完整蛋白pb10的存在对于产生抗ova的ab不是必需的。
[0397]-与po+acf组相比,po+c和pno+c组产生较少的igg1型的抗ova的抗体,但产生更多的igg3型的ab。同种型igg2b和igg2c的抗ova的ab没有显著差异(对于igg2c有增加的趋势)。
[0398]-po或pno蛋白与纯化衣壳一起施用导致具有广泛同种型谱的抗ova的ab反应。然而,与acf相比,观察到有利于igg3(补体激活同种型)的显著偏差和igg1的显著减少。
[0399]
图12的数据表明:
[0400]-免疫显性肽ova
257-264
对脾细胞再刺激的测试表明,与单独注射po或pno的小鼠相比,注射po+c或pno+c的小鼠有更多产生ifnγ的脾细胞。这些结果表明用融合蛋白+衣壳接种的小鼠具有更强的抗ova的t反应。由于用能够与主要组织相容性复合体的i类分子结合的t表位进行再刺激,这表明在这些小鼠中,特异于卵清蛋白的cd8+t细胞的产量更高,并且它们是有功能的(产生干扰素γ)。
[0401]-po+c和pno+c组之间产生ifnγ的脾细胞数量没有显著差异,表明pb10融合蛋白不一定需要包含整个pb10序列。
[0402]-pb10融合蛋白与纯化的噬菌体衣壳共同施用可在小鼠中诱导强烈的细胞反应。
[0403]
实验3的结果
[0404]
图13的数据表明:
[0405]-免疫显性肽ova
257-264
对脾细胞再刺激的测试表明,与单独注射pno的小鼠相比,注射或pno+c的小鼠有更多产生ifnγ的脾细胞。
[0406]-同样,再刺激测试显示,在来自注射pno+c的小鼠的脾细胞上清液中产生更高的ifnγ(图13b)。
[0407]-产生ifnγ的脾细胞数量或上清液中产生的ifnγ量大于注射pno+acf的小鼠中的脾细胞中发现的。
[0408]
结果表明,当蛋白pno与纯化的衣壳结合时,会诱导显著更高的抗ova细胞反应。这种反应也高于当该蛋白与acf共同施用时获得的反应。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1