固化性组合物、固化物、光学部件及透镜的制作方法
1.本发明涉及一种固化性组合物、固化物、光学部件及透镜。
背景技术:
2.以往,在相机、摄像机或带相机的移动电话、可视电话或带相机的对讲机等摄像模块的光学部件中使用了玻璃材料。玻璃材料具备各种光学特性,且耐环境性优异,因此适宜地进行了使用,但另一方面,不容易轻量化或小型化,具有加工性或生产率较差的缺点。相对于此,树脂固化物能够进行大规模生产,且加工性也优异,因此近年来逐渐用于各种光学部件中。
3.近年来,伴随摄像模块的小型化,要求使用于摄像模块的光学部件小型化。然而,若使光学部件小型化,则产生色差的问题。因此,研究了如下内容,即在使用了树脂固化物的光学部件中,通过固化性组合物的单体或添加物调整阿贝数来进行色差的校正。
4.例如,专利文献1中公开如下:通过使用具有类似于二苯基芴骨架的含杂原子(氧原子、硫原子或氮原子)骨架的单体,能够获得能够成型作为折射率的分散特性的阿贝数(νd)低且部分色散比(θg,f值)高的固化物的固化性组合物。
5.以往技术文献
6.专利文献
7.专利文献1:国际公开第2017/115649号
技术实现要素:
8.发明要解决的技术课题
9.由于摄影模块的光学部件在户外等光照射环境下使用,因此要求耐光性。
10.本发明人等进行研究的结果,如上述专利文献1中记载的含有具有特定结构的含氮稠合芳香环的单体的固化性组合物中,使用酰基氧化膦光聚合引发剂固化时的固化物的初期着色本身少,充分满足了摄影模块的光学部件所需要的透过性。然而,从抑制(以下,还简称为“耐光性”。)在户外等照射光的环境下长期使用、保管固化物时产生的固化物的着色(即,透射率的下降)的观点出发,明显需要改善。
11.本发明的课题在于,提供一种固化性组合物,其含有具有含氮稠合芳香环的单体和酰基氧化膦光聚合引发剂,且能够获得耐光性优异的固化物。并且,本发明的课题还在于,提供一种由该固化性组合物获得的固化物、以及含有该固化物的光学部件及透镜。
12.用于解决技术课题的手段
13.即,本发明的上述课题通过下述方法得到解决。
14.<1>
15.一种固化性组合物,其含有下述成分a、成分b及成分c。
16.成分a:由下述通式(a)表示的聚合性化合物
17.成分b:酰基氧化膦光聚合引发剂
18.成分c:胺化合物
19.[化学式1]
[0020][0021]
上述式中,ar表示包含满足下述(i)~(iii)全部的含氮稠合芳香环作为部分结构的n价基团。
[0022]
(i)具有由2个以上的六元环稠合而成的稠环结构。
[0023]
(ii)具有至少一个氮原子作为成环原子。
[0024]
(iii)所有的成环原子具有p轨道,且这些p轨道全部有助于芳香性。
[0025]
l表示单键、-o-、-s-、-c(=o)-、-oc(=o)-、-c(=o)o-、-oc(=o)o-、-nr
101
c(=o)-、-c(=o)nr
102-、-oc(=o)nr
103-、-nr
104
c(=o)o-、-sc(=o)-或-c(=o)s-。
[0026]r101
、r
102
、r
103
及r
104
分别独立地表示-sp
a-pol3或卤原子。
[0027]
sp及spa分别独立地表示单键或2价连接基团,pol及pol3分别独立地表示氢原子或聚合性基团。
[0028]
n为1或2。
[0029]
当n为2时,2个以上l可以相同或不同,2个以上sp可以相同或不同,2个以上pol可以相同或不同。
[0030]
其中,由通式(a)表示的聚合性化合物具有至少一个聚合性基团。
[0031]
<2>
[0032]
根据<1>所述的固化性组合物,其中,上述(ii)中的氮原子数为2个或3个。
[0033]
<3>
[0034]
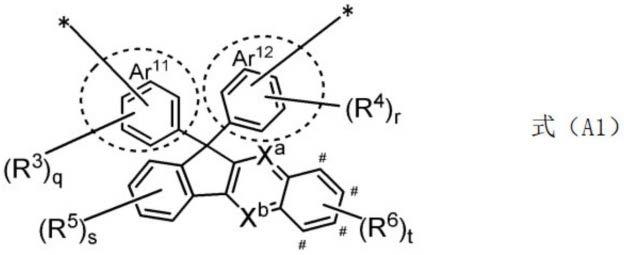
根据<1>或<2>所述的固化性组合物,其中,上述ar是由下述通式(a1)及下述通式(a2-1)~通式(a2-5)中的任一式表示的基团。
[0035]
[化学式2]
[0036][0037]
上述式中,ar
11
及ar
12
分别独立地表示包含被虚线包围的苯环的芳香族烃基,或者表示包含被虚线包围的苯环作为构成稠环的环之一的芳香族杂环基。
[0038]
xa及xb表示氮原子或ch,#位置的ch可以被氮原子取代。
[0039]
其中,xa、xb及#位置的ch之中,2个或3个是氮原子。
[0040]
r3~r6分别独立地表示取代基,q、r、s及t分别独立地为0~4的整数。
[0041]
并且,*表示与pol-sp-l-的键合位置。
[0042]
[化学式3]
[0043][0044]
上述式中,z1、z2、z3及z4分别独立地表示氢原子、可以具有取代基的碳原子数1~20的脂肪族烃基、可以具有取代基的碳原子数1~20的烷氧基、可以具有取代基的碳原子数1~20的烷氧基羰基、可以具有取代基的碳原子数3~20的脂环式烃基、可以具有取代基的碳原子数6~20的芳香族烃基、卤原子、氰基、硝基、-nr
12r13
、-sr
12
、或者可以具有取代基的成环原子数5~20的芳香族杂环基。
[0045]
z1及z2可以彼此键合而形成可以具有取代基的芳香族烃环或者形成可以具有取代基的芳香族杂环。
[0046]r12
及r
13
分别独立地表示氢原子,或表示可以具有取代基的碳原子数1~6的烷基。
[0047]
t1、t2、t5及t6分别独立地表示卤原子、氰基、硝基、-l
6-sp
b-pol6、可以具有取代基的碳原子数3~20的脂环式烃基、可以具有取代基的碳原子数6~20的芳香族烃基、可以具有取代基的成环原子数5~20的芳香族杂环基、-nr
12r13
或-sr
12
。
[0048]
t1及t2可以彼此键合而形成可以具有取代基的芳香族烃环或者形成可以具有取代基的芳香族杂环。
[0049]
l6的含义与上述l的含义相同。
[0050]
spb表示单键、可以具有取代基的碳原子数1~30的直链亚烷基、或在可以具有取代基的碳原子数2~30的直链亚烷基中一个或者不相邻的2个以上的-ch
2-分别独立地被选自-o-、-s-、-c(=o)-、-oc(=o)-、-c(=o)o-、-oc(=o)o-、-nr
201
c(=o)-、-c(=o)nr
202-、-oc(=o)nr
203-、-nr
204
c(=o)o-、-sc(=o)-及-c(=o)s-中的基团替换后的基团。
[0051]r201
、r
202
、r
203
及r
204
分别独立地表示-sp
c-pol4或卤原子。
[0052]
spc表示单键、可以具有取代基的碳原子数1~30的直链亚烷基、或在可以具有取代基的碳原子数2~30的直链亚烷基中一个或者不相邻的2个以上的-ch
2-分别独立地被选自-o-、-s-、-c(=o)-、-oc(=o)-、-c(=o)o-、-oc(=o)o-、-nhc(=o)-、-c(=o)nh-、-oc(=o)nh-、-nhc(=o)o-、-sc(=o)-及-c(=o)s-中的基团替换后的基团。
[0053]
pol4及pol6的含义分别独立地与上述pol的含义相同。
[0054]
t3及t4分别独立地表示可以具有取代基的碳原子数6~12的2价芳香族烃基、或可以具有取代基的2价芳香族杂环基。
[0055]
并且,*表示与pol-sp-l-的键合位置。
[0056]
<4>
[0057]
根据<3>所述的固化性组合物,其中,上述ar是由上述通式(a1)表示的基团,xa及xb均为氮原子,#位置的ch均未被氮原子替换。
[0058]
<5>
[0059]
根据<1>至<4>中任一项所述的固化性组合物,其含有成分d:由下述通式(d)
表示的化合物。
[0060]
[化学式4]
[0061][0062]
上述式中,r
d1
、r
d2
及r
d3
分别独立地表示氢原子或取代基,w表示氢原子或取代基。r
d1
及r
d2
、或r
d2
及r
d3
也可以彼此键合而形成可以具有取代基的环。
[0063]
<6>
[0064]
一种固化物,其是<1>至<5>中任一项所述的固化性组合物的固化物。
[0065]
<7>
[0066]
一种光学部件,其含有<6>所述的固化物。
[0067]
<8>
[0068]
一种透镜,其含有<6>所述的固化物。
[0069]
在本发明中,在存在多个由特定的符号或式表示的取代基或者连接基团等(以下,称为取代基等)时,或同时规定多个取代基等时,只要没有特别说明,各个取代基等可以彼此相同或不同。这对于取代基等的数量的规定也同样适用。并且,在多个取代基等靠近时(尤其,相邻时),只要没有特别说明,它们可以彼此连结而形成环。并且,只要没有特别说明,环、例如脂环、芳香族环及杂环可以进一步稠合而形成稠环。
[0070]
在本发明中,只要没有特别说明,关于双键,在分子内存在e型及z型的情况下,可以是其中的任一种,并且也可以是它们的混合物。
[0071]
并且,是指包含在不损害本发明的效果的范围内改变了结构的一部分的化合物。而且,关于未明确记载取代或未取代的化合物,是指在不损害本发明的效果的范围内可以具有任意的取代基。这对于取代基及连接基团也同样适用。
[0072]
在本发明中,由“~”表示的数值范围是指将记载于“~”前后的数值作为下限值以及上限值而包含的范围。
[0073]
在本发明中,各成分可以分别使用一种,也可以将两种以上混合使用。
[0074]
在本发明的固化性组合物中的各成分的含量的记载中,本发明的固化性组合物中的固体成分是指,除了成分a~成分c以外,残留在由本发明的固化性组合物获得的固化物中的成分。通常,除了溶剂以外的剩余部分是“固体成分”。
[0075]
在本发明中,“(甲基)丙烯酸酯”表示丙烯酸酯及甲基丙烯酸酯中的任一者或这两者,“(甲基)丙烯酰基”表示丙烯酰基及甲基丙烯酰基中的任一者或这两者。本发明中的单体与低聚物及聚合物有区分,是指重均分子量为1000以下的化合物。
[0076]
在本发明中,在称为脂肪族烃基时,表示从直链或者支链的烷烃、直链或者支链的烯烃或直链或者支链的炔烃中去除一个任意的氢原子而获得的基团。在本说明书中,脂肪族烃基优选为从直链或者支链的烷烃中去除一个任意的氢原子而获得的烷基。作为烷基,可举出甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、1-甲基丁基、3-甲基丁基、己基、1-甲基戊基、4-甲基戊基、庚基、1-甲基己基、5-甲基己基、2-乙基己基、辛基、1-甲基庚基、壬基、1-甲基辛基、癸基、十一烷基、十二烷基、十三烷基、十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基等。
[0077]
并且,在本发明中,脂肪族烃基(未取代)优选为碳原子数1~12的烷基,尤其优选为甲基、乙基。
[0078]
在本发明中,在称为烷基时表示直链或者支链的烷基。作为烷基,可举出上述例子。对于含有烷基的基团(烷氧基、烷氧基羰基等)中的烷基也同样适用。
[0079]
并且,在本发明中,作为直链亚烷基的例子,可举出从上述烷基中的直链烷基中去除一个与末端的碳键合的氢原子而获得的基团。
[0080]
在本发明中,脂环式烃环是指饱和烃环(环烷烃)。作为脂环式烃环的例子,可举出环丙烷、环丁烷、环戊烷、环己烷、环庚烷、环辛烷、环壬烷、环癸烷等。
[0081]
在本发明中,不饱和烃环是指在具有碳-碳不饱和双键的烃环中不是芳香族环的烃环。作为不饱和烃环的例子,可举出茚、茚满、芴。
[0082]
在本发明中,在称为脂环式烃基时是指从环烷烃中去除一个任意的氢原子而获得的环烷基。作为脂环式烃基的例子,可举出环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基、环癸基等,优选为碳原子数3~12的环烷基。
[0083]
在本发明中,亚环烷基表示从环烷烃中去除2个任意的氢原子而获得的2价基团。作为亚环烷基的例子,可举出亚环己基。
[0084]
在本发明中,在称为芳香环时是指芳香族烃环及芳香族杂环中的任一者或这两者。
[0085]
在本发明中,芳香族烃环是指仅由碳原子形成环的芳香环。芳香族烃环可以是单环或稠环。优选为碳原子数6~14的芳香族烃环。作为芳香族烃环的例子,可举出苯环、萘环、蒽环、菲环等。在本说明书中,在称为芳香族烃环与其他环键合时,芳香族烃环只要作为1价或2价芳香族烃基取代在其他环上即可。
[0086]
在本发明中,在将1价基团称为芳香族烃基时,表示从芳香族烃环中去除一个任意的氢原子而获得的1价基团。作为1价芳香族烃基,优选为碳原子数6~14的芳香族烃基,作为例子,可举出苯基、联苯基、1-萘基、2-萘基、1-蒽基、2-蒽基、3-蒽基、4-蒽基、9-蒽基、1-菲基、2-菲基、3-菲基、4-菲基、9-菲基等。这些中,优选为苯基。
[0087]
在本发明中,在将2价基团称为芳香族烃基时,表示从上述1价芳香族烃基中去除一个任意的氢原子而获得的2价基团。作为2价芳香族烃基的例子,可举出亚苯基、亚联苯基、亚萘基、亚菲基等,优选为亚苯基,更优选为1,4-亚苯基。
[0088]
在本发明中,芳香族杂环是指由碳原子及杂原子形成环的芳香环。作为杂原子,可举出氧原子、氮原子及硫原子等。芳香族杂环可以是单环或稠环,构成环的原子的数量优选为5~20,更优选为5~14。构成环的原子中的杂原子的数量没有特别限定,优选为1~3个,更优选为1~2个。作为芳香族杂环的例子,可举出呋喃环、噻吩环、吡咯环、咪唑环、异噻唑环、异噁唑环、吡啶环、吡嗪环、喹啉环、苯并呋喃环、苯并噻唑环、苯并噁唑环及后述的含氮稠合芳香环的例子等。在本说明书中,在称为芳香族杂环与其他环键合时,芳香族杂环只要作为1价或2价芳香族杂环基取代在其他环上即可。
[0089]
在本发明中,在将1价基团称为芳香族杂环基时,表示从芳香族杂环中去除一个任意的氢原子而获得的1价基团。作为1价芳香族杂环基的例子,可举出呋喃基、噻吩基、吡咯基、咪唑基、异噻唑基、异噁唑基、吡啶基、吡嗪基、喹啉基、苯并呋喃基(优选为2-苯并呋喃基)、苯并噻唑基(优选为2-苯并噻唑基)、苯并噁唑基(优选为2-苯并噁唑基)等。这些中,优
选为呋喃基、噻吩基、苯并呋喃基、苯并噻唑基、苯并噁唑基,更优选为2-呋喃基、2-噻吩基。
[0090]
在本发明中,在称为2价芳香族杂环基时,表示从芳香族杂环中去除2个任意的氢原子而获得的2价基团,作为例子,可举出从上述(1价)芳香族杂环基中去除一个任意的氢原子而获得的2价基团。
[0091]
在本发明中,作为卤原子,可举出氟原子、氯原子、溴原子、碘原子。
[0092]
发明效果
[0093]
在本发明的固化性组合物中,通过固化反应而获得的固化物具有优异的耐光性。本发明的固化物具有优异的耐光性。因此,即使长期在户外等光照射环境下使用含有该固化物作为构成部件的本发明的光学部件及透镜,也能够抑制着色。
具体实施方式
[0094]
以下,对本发明详细地进行说明。以下记载的构成要件的说明有时根据代表性的实施方式或具体例等完成,但本发明并不限定于这种实施方式。
[0095]
<固化性组合物>
[0096]
本发明的固化性组合物含有下述成分a、成分b及成分c。
[0097]
成分a:由后述通式(a)表示的聚合性化合物
[0098]
成分b:酰基氧化膦光聚合引发剂
[0099]
成分c:胺化合物
[0100]
本发明的固化性组合物除了上述成分a、成分b及成分c以外,还可以适当含有其他成分。作为其他成分,具体而言,例如可以含有由通式(d)表示的化合物、(甲基)丙烯酸酯单体(除了成分a以外且由通式(d)表示的化合物以外的单体)、热自由基聚合引发剂、光自由基聚合引发剂(除了成分b以外的光自由基聚合引发剂)、除了上述成分以外的聚合物或单体、分散剂、增塑剂、热稳定剂、脱模剂等添加剂。
[0101]
本发明的固化性组合物中所含有的成分a:由通式(a)表示的聚合性化合物包含满足后述(i)~(iii)全部的含氮稠合芳香环作为部分结构。该成分a的聚合物(固化物)在大致波长300~400nm的紫外区域中具有极大吸收波长,因此认为作为折射率的分散特性,阿贝数(νd)低且部分色散比(θg,f值)高,显示优异的光学特性。然而,成分a的聚合物作为部分结构起因于含氮稠合芳香环,容易发生着色。
[0102]
本发明人等进行了研究,结果发现,作为光聚合引发剂使用成分b:酰基氧化膦光聚合引发剂进行聚合固化时,能够抑制本发明的固化性组合物的固化过程中的着色。然而,通过本发明人等的进一步的研究,还发现在将固化物在户外等光照射环境下长期保管、使用的情况下,固化物经时产生着色,固化物的透射率下降。针对该经时透射率下降的问题,本发明人等尝试适用了各种添加剂等。其结果,发现通过同时使用成分c:胺化合物,耐光性大幅提高。该理由尚不确定,但推测如下。
[0103]
成分a的聚合物作为部分结构包含的含氮稠合芳香环显示弱碱性,因此通过由酰基氧化膦光聚合引发剂的光分解(产生亚磷酸系的分解物)产生的酸的作用在含氮稠合芳香环上的氮原子上加成氢离子,认为这是固化物的透射率下降的主要原因。推测通过在其中并存胺化合物,能够抑制透射率的下降。
[0104]
[成分a:由通式(a)表示的聚合性化合物]
[0105]
本发明的固化性组合物含有由下述通式(a)表示的聚合性化合物作为成分a。
[0106]
由通式(a)表示的聚合性化合物在其结构中包含特定的含氮稠合芳香环及聚合性基团。由通式(a)表示的聚合性化合物能够降低由含有该化合物的固化性组合物形成的固化物的阿贝数(νd),且提高部分色散比(θg,f)。具有满足后述(i)~(iii)全部的含氮稠合芳香环的上述化合物在近紫外区域具有吸收,因此显示折射率的异常分散性,由此在用作复合透镜的情况下,能够提高色差校正功能。
[0107]
[化学式5]
[0108][0109]
上述式中,ar表示包含满足下述(i)~(iii)全部的含氮稠合芳香环作为部分结构的n价基团。
[0110]
(i)具有由2个以上的六元环稠合而成的稠环结构。
[0111]
(ii)具有至少一个氮原子作为成环原子。
[0112]
(iii)所有的成环原子具有p轨道,且这些p轨道全部有助于芳香性。
[0113]
l表示单键、-o-、-s-、-c(=o)-、-oc(=o)-、-c(=o)o-、-oc(=o)o-、-nr
101
c(=o)-、-c(=o)nr
102-、-oc(=o)nr
103-、-nr
104
c(=o)o-、-sc(=o)-或-c(=o)s-。
[0114]r101
、r
102
、r
103
及r
104
分别独立地表示-sp
a-pol3或卤原子。
[0115]
sp及spa分别独立地表示单键或2价连接基团,pol及pol3分别独立地表示氢原子或聚合性基团。
[0116]
n为1或2。
[0117]
当n为2时,2个以上l可以相同或不同,2个以上sp可以相同或不同,2个以上pol可以相同或不同。
[0118]
其中,由通式(a)表示的聚合性化合物具有至少一个聚合性基团。
[0119]
以下,对ar、l、sp及spa、以及pol及pol3的各取代基进行说明。
[0120]
(1)ar
[0121]
在上述通式(a)中,ar是包含满足下述(i)~(iii)全部的含氮稠合芳香环作为部分结构的n价基团。
[0122]
(i)具有由2个以上的六元环稠合而成的稠环结构。
[0123]
(ii)具有至少一个氮原子(n)作为成环原子。
[0124]
(iii)所有的成环原子具有p轨道,且这些p轨道全部有助于芳香性。
[0125]
即,满足上述(i)~(iii)全部的含氮稠合芳香环(以下,还简称为“含氮稠合芳香环”。)是2个以上的六元环稠合而形成的芳香族杂环,是含有氮原子作为构成该芳香族杂环的原子的芳香环。
[0126]
上述(i)的规定优选具有2个~5个六元环稠合而成的稠环结构,更优选具有2个六元环稠合而成的稠环结构。
[0127]
从进一步提高耐光性的观点出发,上述(ii)的规定优选含有2个以上的氮原子作为成环原子,更优选含有2个或3个,进一步优选含有2个。
[0128]
含氮稠合芳香环可以含有氧原子(o)或硫原子(s)等除了氮原子(n)以外的杂原子,优选不含有这种杂原子。
[0129]
上述(iii)的规定是指构成含氮稠合芳香环的所有的环(单环)显示芳香性。
[0130]
例如,在由后述通式(a1)表示的基团中,上述含氮稠合芳香环是位于结构式中的右下侧的2个六元环稠合而成的稠环结构。即,可以具有r5的苯环和位于该苯环的右侧的五元环不包含在上述含氮稠合芳香环中。这是因为构成位于可以具有r5的苯环的右侧的五元环的一个碳原子具有无助于芳香性的p轨道,因此不满足上述(iii)的规定。
[0131]
并且,由后述通式(a2-1)~通式(a2-3)表示的基团作为上述含氮稠合芳香环,至少具有喹喔啉环结构,由后述通式(a2-4)或通式(a2-5)表示的基团作为上述含氮稠合芳香环,至少具有喹唑啉环结构。另外,在t1及t2或z1及z2彼此键合而与喹喔啉环或喹唑啉环一起形成满足上述(i)~(iii)全部的含氮稠合芳香环的情况下,包含t1及t2或z1及z2彼此键合而形成的芳香环,构成上述含氮稠合芳香环。
[0132]
作为上述含氮稠合芳香环的例子,可举出异喹啉环、喹啉环、酞嗪环、萘啶环、喹喔啉环、喹唑啉环、噌啉环、吡啶并[3,4-b]吡嗪环、吡啶并[2、3-b]吡嗪环或蝶啶环等。
[0133]
这些中,从进一步提高耐光性的观点出发,优选为喹喔啉环或喹唑啉环。
[0134]
包含由ar表示的上述含氮稠合芳香环作为部分结构的n价基团(以下,还简称为“n价基团”。)可以在含氮稠合芳香环上具有取代基,也可以未取代。
[0135]
作为n价基团,例如可举出由可以具有取代基的含氮稠合芳香环构成的n价基团。
[0136]
作为n价基团的连接键的位置没有特别限定,可举出去除构成含氮稠合芳香环的环的任一个碳原子所具有的一个氢原子而成的连接键(以下,还简称为“含氮稠合芳香环上的连接键”。)及去除含氮稠合芳香环所具有的取代基中的任一个原子(优选为碳原子)所具有的一个氢原子而成的连接键(以下,还简称为“含氮稠合芳香环所具有的取代基上的连接键”。)。
[0137]
在n为1的情况下,连接键可以是含氮稠合芳香环上的连接键,也可以是含氮稠合芳香环所具有的取代基上的连接键。
[0138]
在n为2的情况下,2个连接键能够选自含氮稠合芳香环上的连接键及含氮稠合芳香环所具有的取代基上的连接键。作为n为2时的连接键,优选含氮稠合芳香环上的连接键为2个,或含氮稠合芳香环所具有的取代基上的连接键为2个。
[0139]
n优选为2。
[0140]
例如,在含氮稠合芳香环是喹喔啉环或喹唑啉环的情况下,喹喔啉环或喹唑啉环上的连接键的位置没有特别限定,优选为选自5~8位中的2个,更优选为5位及8位的组合、或6位及7位的组合。
[0141]
并且,在连接键是喹喔啉环或喹唑啉环所具有的取代基上的连接键的情况下,具有连接键的取代基及连接键的位置没有特别限定。作为具有该连接键的取代基,优选为可以具有取代基的芳香族烃基或可以具有取代基的芳香族杂环基,更优选为可以具有取代基的碳原子数6~12的芳香族烃基,进一步优选为可以具有取代基的苯基(作为具有连接键的状态,为可以具有取代基的亚苯基),尤其优选为苯基(作为具有连接键的状态,为亚苯基)。在苯基具有连接键的情况下,其位置优选在4位(将与喹喔啉环或喹唑啉环的键合位置设为1位)(即,1,4-亚苯基)。
[0142]
在由可以具有取代基的含氮稠合芳香环构成的n价基团中,与在含氮稠合芳香环中相邻的碳原子键合的取代基可以彼此键合而形成可以具有取代基的环。作为这种结构,
可举出由下述通式(a1)表示的结构。
[0143]
ar优选包含可以具有取代基的芳香族烃环基及可以具有取代基的芳香族杂环基中的1个或2个与含氮稠合芳香环直接键合的结构,更优选包含可以具有取代基的碳原子数6~12的芳香族烃环基的1个或2个与含氮稠合芳香环直接键合的结构,进一步优选包含苯环的1个或2个与含氮稠合芳香环直接键合的结构。
[0144]
上述与含氮稠合芳香环直接键合的结构是指不经由连接基团而通过单键键合的结构。
[0145]
包含由ar表示的含氮稠合芳香环作为部分结构的n价基团中,作为2价基团的例子,可分别优选举出由下述通式(a1)表示的基团及由下述通式(a2-1)~通式(a2-5)中的任一式表示的基团。
[0146]
(由通式(a1)表示的基团)
[0147]
[化学式6]
[0148][0149]
上述式中,ar
11
及ar
12
分别独立地表示包含被虚线包围的苯环的芳香族烃基,或者表示包含被虚线包围的苯环作为构成稠环的环之一的芳香族杂环基。
[0150]
xa及xb表示氮原子或ch,#位置的ch可以被氮原子取代。
[0151]
其中,xa、xb及#位置的ch之中,2个或3个是氮原子。
[0152]
r3~r6分别独立地表示取代基,q、r、s及t分别独立地为0~4的整数。
[0153]
并且,*表示与pol-sp-l-的键合位置。
[0154]
在采用包含被虚线包围的苯环的芳香族烃基作为ar
11
或ar
12
的情况下,该芳香族烃基优选为碳原子数6~18的芳香族烃基,更优选为碳原子数6~14的芳香族烃基,进一步优选为碳原子数6~10的芳香族烃基,尤其优选为仅由被虚线包围的苯环构成的亚苯基。
[0155]
并且,作为ar
11
或ar
12
,在采用包含被虚线包围的苯环作为构成稠环的环之一的芳香族杂环基(杂亚芳基)的情况下,该芳香族杂环基优选为成环原子数9~14的芳香族杂环基,更优选为成环原子数9~10的芳香族杂环基。作为构成该芳香族杂环基的环的杂原子,能够举出氮原子、氧原子及硫原子等。
[0156]
ar
11
及ar
12
优选分别独立地为包含被虚线包围的苯环的芳香族烃基(亚芳基),更优选为仅由被虚线包围的苯环构成的亚苯基。
[0157]
作为r3~r6所表示的取代基,没有特别限制,例如能够举出卤原子、卤化烷基、烷基、烯基、酰基、羟基、羟基烷基、烷氧基、芳香族烃基、芳香族杂环基、脂肪族环基及氰基等。
[0158]
r3~r6所表示的取代基优选为卤原子、烷基、烷氧基、芳香族烃基或氰基,更优选为卤原子、碳原子数1~5的烷基、碳原子数1~5的烷氧基、苯基或氰基,进一步优选为卤原子、甲基、甲氧基、苯基或氰基。
[0159]
其中,r3及r4优选分别独立地为甲基或甲氧基,r5优选为卤原子、甲基或甲氧基,更优选为甲基。r6优选为卤原子、甲基或甲氧基,更优选为甲基。
[0160]
q及r优选分别独立地为0或1,更优选均为0。s及t优选分别独立地为0~2的整数,更优选s为0,且t为0~2的整数。
[0161]
对于t为1时的r6的取代位置及t为2时的r6的取代位置,能够分别将下述通式(a1-2)中的喹喔啉环中的r6的取代位置的记载替换为氮原子在由ra及rb表示的稠环中的取代位置而适用。
[0162]
xa及xb优选任一个为氮原子且另一个为ch或均为氮原子,更优选均为氮原子。
[0163]
并且,#位置的ch优选均未被氮原子取代。
[0164]
即,由通式(a1)表示的基团优选为由下述通式(a1-2)表示的基团。
[0165]
[化学式7]
[0166][0167]
上述式中,ar
11
、ar
12
、r3~r6、q、r、s、t及*的含义与式(a1)中的ar
11
、ar
12
、r3~r6、q、r、s、t及*的含义相同。
[0168]
在t为1的情况下,r6的取代位置优选为所形成的喹喔啉环的6位或7位,在t为2的情况下,r6的取代位置优选为所形成的喹喔啉环的6位及7位。
[0169]
(由通式(a2-1)~(a2-5)中的任一式表示的基团)
[0170]
[化学式8]
[0171][0172]
上述式中,z1、z2、z3及z4表示1价基团,分别独立地表示氢原子、可以具有取代基的碳原子数1~20的脂肪族烃基、可以具有取代基的碳原子数1~20的烷氧基、可以具有取代基的碳原子数1~20的烷氧基羰基、可以具有取代基的碳原子数3~20的脂环式烃基、可以具有取代基的碳原子数6~20的芳香族烃基、卤原子、氰基、硝基、-nr
12r13-sr
12
或可以具有取代基的成环原子数5~20的芳香族杂环基。
[0173]
z1及z2可以彼此键合而形成可以具有取代基的芳香族烃环或可以具有取代基的芳香族杂环。
[0174]r12
及r
13
分别独立地表示可以具有氢原子或取代基的碳原子数1~6的烷基。
[0175]
并且,*表示与pol-sp-l-的键合位置。
[0176]
在通式(a2-1)~(a2-5)中的各取代基的说明中,作为称为“可以具有取代基”时的
取代基,只要不是酰氯(-cocl)或-otf(-o-so2cf3)等消除性过高的基团(容易分解的基团),则没有特别限定,例如可举出卤原子、羟基、氨基、氰基、硝基、亚硝基、羧基、碳原子数1~6的烷基、碳原子数1~6的烷氧基、碳原子数1~6的烷氧基羰基、碳原子数1~6的烷基羰氧基、碳原子数1~6的烷基羰基、碳原子数1~6的烷基亚磺酰基、碳原子数1~6的烷基磺酰基、碳原子数1~6的氟烷基、碳原子数1~6的烷基硫烷基、碳原子数1~6的n-烷基氨基、碳原子数2~12的n,n-二烷基氨基、碳原子数1~6的n-烷基氨磺酰基及碳原子数2~12的n,n-二烷基氨磺酰基等。
[0177]
这些取代基中,优选为卤原子、羟基、碳原子数1~6的烷基、碳原子数1~6的烷氧基或碳原子数1~6的氟烷基,更优选为氟原子、氯原子、溴原子、羟基、甲基、甲氧基或氟甲基。
[0178]
z1及z2优选分别独立地为氢原子或者可以具有取代基的碳原子数1~20的脂肪族烃基,或z1及z2彼此键合而形成可以具有取代基的芳香族烃环,更优选分别独立地为氢原子或者甲基,或z1及z2彼此键合而形成苯环。
[0179]
z2及z4优选分别独立地为氢原子或者可以具有取代基的碳原子数1~20的脂肪族烃基,更优选分别独立地为氢原子或者甲基。
[0180]
通式(a2-1)及(a2-2)中的t1及t2、以及通式(a2-4)及(a2-5)中的t5及t6表示1价基团,分别独立地表示卤原子、氰基、硝基、-l
6-sp
b-pol6、可以具有取代基的碳原子数3~20的脂环式烃基、可以具有取代基的碳原子数6~20的芳香族烃基、可以具有取代基的成环原子数5~20的芳香族杂环基、-nr
12r13
或-sr
12
。
[0181]
l6的含义与上述l的含义相同。其中,在作为l例示的连接基团的记载中,左侧与喹喔啉环或喹唑啉环键合,右侧与spb键合。
[0182]
l6优选为单键或-o-、-oc(=o)-或-c(=o)o-,更优选为单键。
[0183]
spb表示单键、可以具有取代基的碳原子数1~30的直链亚烷基、或在可以具有取代基的碳原子数2~30的直链亚烷基中一个或者不相邻的2个以上的-ch
2-分别独立地被选自-o-、-s-、-c(=o)-、-oc(=o)-、-c(=o)o-、-oc(=o)o-、-nr
201
c(=o)-、-c(=o)nr
202-、-oc(=o)nr
203-、-nr
204
c(=o)o-、-sc(=o)-及-c(=o)s-中的基团替换后的基团。
[0184]r201
、r
202
、r
203
及r
204
分别独立地表示-sp
c-pol4或卤原子。
[0185]
spc表示单键、可以具有取代基的碳原子数1~30的直链亚烷基、或在可以具有取代基的碳原子数2~30的直链亚烷基中一个或者不相邻的2个以上的-ch
2-分别独立地被选自-o-、-s-、-c(=o)-、-oc(=o)-、-c(=o)o-、-oc(=o)o-、-nhc(=o)-、-c(=o)nh-、-oc(=o)nh-、-nhc(=o)o-、-sc(=o)-及-c(=o)s-中的基团替换后的基团。
[0186]
pol4及pol6的含义分别独立地与后述pol的含义相同。
[0187]
作为spb及spc,优选分别独立地为可以具有取代基的碳原子数1~10的直链亚烷基、或在可以具有取代基的碳原子数2~10的直链亚烷基中一个或者不相邻的2个以上的-ch
2-分别独立地被选自-o-、-c(=o)-、-oc(=o)-、-c(=o)o-及-oc(=o)o-中的基团替换后的基团。
[0188]
作为pol4及pol6,优选为氢原子。
[0189]
作为-l
6-sp
b-pol6,例如可举出氢原子、作为由-l-sp-pol表示的基团举出的后述的例子以及选自由可以具有取代基的碳原子数1~20的脂肪族烃基及可以具有取代基的碳
原子数1~20的烷氧基组成的组中的基团、或在这些基团的末端具有聚合性基团的基团。
[0190]
作为-sp
c-pol4,优选为氢原子或可以具有取代基的碳原子数1~4的烷基,更优选为氢原子或未取代的碳原子数1~4的烷基。
[0191]r201
、r
202
、r
203
及r
204
优选分别独立地为氢原子、未取代的碳原子数1~4的烷基或卤原子。
[0192]
作为t1及t2,优选分别独立地为可以具有取代基的碳原子数6~20的芳香族烃基、可以具有取代基的成环原子数5~20的芳香族杂环基、可以具有取代基的碳原子数1~20的脂肪族烃基、或作为由-l-sp-pol表示的基团举出的后述的例子,更优选为可以具有取代基的苯基、联苯基、萘基、碳原子数1~6的烷基、呋喃基或噻吩基,进一步优选为苯基、4-联苯基、1-萘基、2-萘基、碳原子数1~6的烷基、2-呋喃基或2-噻吩基,尤其优选为苯基。
[0193]
t1及t2可以相同或不同,优选相同。其中,还优选t1及t2中的一个为可以具有取代基的苯基,且另一个为氢原子或碳原子数1~4的烷基。
[0194]
优选t1及t2中的至少一个不是氢原子。并且,优选t1及t2中的至少一个为可以具有取代基的碳原子数6~20的芳香族烃基或可以具有取代基的成环原子数5~20的芳香族杂环基。
[0195]
t1及t2可以彼此键合而形成可以具有取代基的芳香族烃环或可以具有取代基的芳香族杂环。在该情况下,t1及t2优选彼此键合而形成可以具有取代基的芳香族烃环,更优选形成可以具有取代基的苯、可以具有取代基的萘、可以具有取代基的蒽或可以具有取代基的菲,进一步优选形成苯或菲。
[0196]
t5及t6优选分别独立地为可以具有取代基的碳原子数6~20的芳香族烃基、可以具有取代基的成环原子数5~20的芳香族杂环基、可以具有取代基的碳原子数1~20的脂肪族烃基、或作为由-l-sp-pol表示的基团举出的后述的例子,更优选为氢原子、可以具有取代基的苯基、联苯基、萘基、碳原子数1~6的烷基、呋喃基或噻吩基,进一步优选为氢原子、苯基、4-联苯基、1-萘基、2-萘基、碳原子数1~6的烷基、2-呋喃基或2-噻吩基,尤其优选为氢原子或苯基。
[0197]
t5及t6可以相同或不同。还优选t6为上述优选的取代基中的任一个,且t5为氢原子。
[0198]
优选t5及t6中的至少一个不是氢原子。并且,优选t6及t6中的至少一个为可以具有取代基的碳原子数6~20的芳香族烃基或可以具有取代基的芳香族杂环基。
[0199]
通式(a2-3)中,t3及t4表示2价连接基团,分别独立地表示可以具有取代基的碳原子数6~12的2价芳香族烃基、或可以具有取代基的2价芳香族杂环基。
[0200]
作为t3及t4,优选为可以具有取代基的碳原子数6~12的2价芳香族烃基,更优选为碳原子数6~10的2价芳香族烃基,进一步优选为亚苯基,尤其优选为1,4-亚苯基。
[0201]
t3及t4可以相同或不同,优选相同。
[0202]
在由上述通式(a2-1)~(a2-5)中的任一式表示的基团中,更优选为由通式(a2-1)~(a2-3)中的任一式表示的基团。这是因为其合成容易且能够廉价获取原料。
[0203]
作为包含由ar表示的含氮稠合芳香环作为部分结构的n价基团的例子,从进一步提高耐光性的观点出发,更优选为由上述通式(a1)表示的基团,进一步优选为由上述通式(a1-2)表示的基团。
[0204]
以下,只要没有特别说明,l、sp及spa、以及pol及pol3所涉及的记载能够与上述任意的ar(包含含氮稠合芳香环作为部分结构的n价基团)优选组合,构成由通式(a)表示的聚合性化合物。
[0205]
即使在ar为由上述通式(a1)表示的基团、由上述通式(a1-2)表示的基团及由上述通式(a2-1)~(a2-5)中的任一式表示的基团中的任一个的情况下,也能够分别优选适用l、sp及spa、以及pol及pol3所涉及的记载。
[0206]
(2)l
[0207]
通式(a)中,l表示单键、-o-、-s-、-c(=o)-、-oc(=o)-、-c(=o)o-、-oc(=o)o-、-nr
101
c(=o)-、-c(=o)nr
102-、-oc(=o)nr
103-、-nr
104
c(=o)o-、-sc(=o)-或-c(=o)s-。另外,在上述连接基团的记载中,左侧与ar键合,右侧与sp键合。
[0208]r101
、r
102
、r
103
及r
104
分别独立地表示-sp
a-pol3或卤原子。
[0209]
l优选分别独立地为-o-、-oc(=o)-、-c(=o)o-、-oc(=o)o-、-nr
101
c(=o)-、-c(=o)nr
102-、-oc(=o)nr
103-或-nr
104
c(=o)o-,更优选为-o-、-oc(=o)-、-oc(=o)o-或-oc(=o)nr
103-,进一步优选为-o-或-oc(=o)-。
[0210]
在n为2的情况下,多个l可以相同或不同,优选相同。
[0211]
(3)sp及spa[0212]
sp及spa分别独立地表示单键或2价连接基团。
[0213]
作为2价连接基团的sp及spa的例子,可举出可以具有取代基的直链亚烷基、可以具有取代基的亚环烷基、可以具有取代基的2价芳香族烃基及可以具有取代基的2价芳香族杂环基。并且,还可举出选自可以具有取代基的直链亚烷基、可以具有取代基的亚环烷基、可以具有取代基的2价芳香环基及可以具有取代基的2价芳香族杂环基中的两个以上的连接基团经由单键、选自-o-、-s-、-c(=o)-、-oc(=o)-、-c(=o)o-、-oc(=o)o-、-nr
201
c(=o)-、-c(=o)nr
202-、-oc(=o)nr
203-、-nr
204
c(=o)o-、-sc(=o)-及-c(=o)s-中的连接基团键合而成的连接基团。
[0214]
另外,在上述连接基团的记载中,左侧与l或n(spa的情况)键合,右侧与pol或pol3(spa的情况)键合。
[0215]r201
、r
202
、r
203
及r
204
的含义分别与前述r
201
、r
202
、r
203
及r
204
的含义相同。
[0216]
在将sp及spa中的取代基称为“可以具有取代基”时的取代基只要不是酰氯(-cocl)或-otf(-o-so2cf3)等消除性过高的基团(容易分解的基团),则没有特别限定,例如可举出烷基、环烷基、烷氧基、酰基、酰氧基、烷氧基羰基、酰胺基、氨基、卤原子、硝基及氰基以及组合2个以上的上述取代基而成的取代基。
[0217]
取代基可以是由-sp
5-pol5表示的基团。sp5及pol5的含义分别独立地与sp及pol的含义相同,优选的范围也相同。取代基的数量没有特别限定,可以具有1~4个取代基。在具有2个以上的取代基时,2个以上的取代基可以彼此相同或不同。
[0218]
作为由sp表示的2价连接基团,优选为可以具有取代基的碳原子数1~30的直链亚烷基、可以具有取代基的碳原子数1~30的直链亚烷基与可以具有取代基的碳原子数3~10的亚环烷基经由单键、-o-、-c(=o)-、-oc(=o)-、-c(=o)o-、-oc(=o)o-、-nr
201
c(=o)-或-c(=o)nr
202-键合而成的连接基团、或在可以具有取代基的碳原子数2~30的直链亚烷基中一个或不相邻的2个以上的-ch
2-分别独立地被选自-o-、-s-、-c(=o)-、-oc(=o)-、-c
(=o)o-、-oc(=o)o-、-nr
201
c(=o)-、-c(=o)nr
202-、-oc(=o)nr
203-、-nr
204
c(=o)o-、-sc(=o)-及-c(=o)s-中的基团替换后的基团。
[0219]
在上述的在碳原子数2~30的直链亚烷基中-ch
2-被选自-o-、-s-、-c(=o)-、-oc(=o)-、-c(=o)o-、-oc(=o)o-、-nr
201
c(=o)-、-c(=o)nr
202-、-oc(=o)nr
203-、-nr
204
c(=o)o-、-sc(=o)-及-c(=o)s-中的基团(以下,在本段中简称为“其他2价基团”。)取代的基团中,上述其他2价基团优选不与l直接键合。即,优选被上述其他2价基团取代的部位不是sp中的l侧末端。
[0220]
作为由sp表示的2价连接基团,更优选为可以具有取代基的碳原子数1~20的直链亚烷基、可以具有取代基的碳原子数1~20的直链亚烷基与可以具有取代基的碳原子数3~6的亚环烷基经由-o-、-c(=o)-、-oc(=o)-、-c(=o)o-或者-oc(=o)o-键合而成的连接基团、或在可以具有取代基的碳原子数2~20的直链亚烷基中一个或不相邻的2个以上的-ch
2-分别独立地被选自-o-、-c(=o)-、-oc(=o)-、-c(=o)o-、-oc(=o)o-、-nr
201
c(=o)-、-c(=o)nr
202-、-oc(=o)nr
203-及-nr
204
c(=o)o-中的基团替换后的基团,进一步优选为可以具有取代基的碳原子数1~10的直链亚烷基、可以具有取代基的碳原子数1~10的直链亚烷基与可以具有取代基的碳原子数3~6的亚环烷基经由-o-、-c(=o)-、-oc(=o)-或者-c(=o)o-键合而成的连接基团、或在可以具有取代基的碳原子数2~10的直链亚烷基中一个或不相邻的2个以上的-ch
2-分别独立地被选自-o-、-c(=o)-、-oc(=o)-及-c(=o)o-中的基团替换后的基团,尤其优选为不具有取代基或具有甲基作为取代基的碳原子数1~10的直链亚烷基、不具有取代基或具有甲基作为取代基的碳原子数1~10的直链亚烷基与未取代的碳原子数3~6的亚环烷基经由-o-、-c(=o)-、-oc(=o)-或者-c(=o)o-键合而成的连接基团、或在不具有取代基或具有甲基作为取代基的碳原子数2~10的直链亚烷基中一个或不相邻的2个以上的-ch
2-分别独立地被选自-o-、-c(=o)-、-oc(=o)-及-c(=o)o-中的基团替换后的基团。
[0221]
在n为2的情况下,多个sp可以相同或不同,优选相同。
[0222]
在pol-sp-l-中,优选sp及l不同时是单键,更优选均不是单键。
[0223]
通式(a)中,-l-sp-优选为-oc(=o)-c2h
4-或-oc(=o)-c2h
4-重复2~10次而成的结构,更优选为-oc(=o)-c2h
4-重复2~5次而成的结构,进一步优选为-oc(=o)-c2h
4-oc(=o)-c2h
4-。
[0224]
作为由spa表示的2价连接基团,优选单键或可以具有取代基的碳原子数1至10的直链亚烷基,更优选可以具有取代基的碳原子数1至5的直链亚烷基,进一步优选可以具有取代基的碳原子数1至3的直链亚烷基,尤其优选未取代的碳原子数1至3的直链亚烷基。
[0225]
(4)pol及pol3[0226]
pol、pol3分别独立地表示氢原子或聚合性基团。
[0227]
作为聚合性基团,例如可举出由下述式(pol-1)~式(pol-6)中的任一式表示的聚合性基团。
[0228]
[化学式9]
[0229][0230]
*表示键合位置。
[0231]
这些中,优选为由上述式(pol-1)或式(pol-2)表示的(甲基)丙烯酰氧基,更优选为由上述式(pol-2)表示的甲基丙烯酰氧基。
[0232]
pol优选为聚合性基团,更优选为(甲基)丙烯酰氧基。尤其,从提高由本发明的固化性组合物形成的透镜的湿热耐久性的观点出发,pol尤其优选为甲基丙烯酰氧基。
[0233]
在有多个pol时,2个以上pol可以相同或不同,优选相同。
[0234]
由通式(a)表示的聚合性化合物具有至少一个聚合性基团。由通式(a)表示的聚合性化合物优选具有至少两个聚合性基团。由通式(a)表示的聚合性化合物所具有的聚合性基团的数量的上限值没有特别限制,例如优选为4个以下。
[0235]
由通式(a)表示的聚合性化合物优选至少具有聚合性基团作为pol,更优选仅作为pol具有聚合性基团。
[0236]
pol3优选为氢原子。
[0237]
作为-sp
a-pol3,优选为氢原子或可以具有取代基的碳原子数1~4的烷基,更优选为氢原子或未取代的碳原子数1~4的烷基。
[0238]
另外,在由通式(a)表示的聚合性化合物中,在具有多个pol-sp-l-时,2个以上pol-sp-l-可以相同或不同,优选相同。
[0239]
作为pol-sp-l-的具体结构的例子,可举出以下结构。
[0240]
r表示氢原子或甲基。并且,*表示与ar的键合位置。
[0241]
[化学式10]
[0242][0243]
另外,在本说明书中,由以下表述表示的结构表示异丙烯结构。该异丙烯结构可以是在构成乙烯基的任意一个碳原子上键合有甲基的2个结构异构体中的任意一种,这些结构异构体也可以混合存在。
[0244]
[化学式11]
[0245][0246]
如此,在由通式(a)表示的聚合性化合物中,在具有取代基在直链亚烷基上取代的结构的情况下,可能存在该取代基的取代位置不同的结构异构体。由通式(a)表示的聚合性化合物可以是这种结构异构体的混合物。
[0247]
由通式(a)表示的聚合性化合物优选为非液晶性的化合物。
[0248]
以下,列举本发明的固化性组合物中优选使用的由通式(a)表示的聚合性化合物的具体例,但并不限定于以下化合物。另外,以下结构式中的me表示甲基,et表示乙基,ipr表示异丙基,npr表示正丙基,nbu表示正丁基,tbu表示叔丁基。
[0249]
[化学式12]
[0250][0251]
[化学式13]
[0252][0253]
[化学式14]
[0254][0255]
[化学式15]
[0256][0257]
[化学式16]
[0258][0259]
[化学式17]
[0260][0261]
[化学式18]
[0262][0263]
[化学式19]
[0264][0265]
[化学式20]
[0266][0267]
由通式(a)表示的聚合性化合物有时具有1个或2个以上的不对称碳,对于这种不对称碳的立体化学,能够分别独立地采用(r)体或(s)体中的任一个。并且,由通式(a)表示的聚合性化合物可以是光学异构体或非对映异构体等立体异构体的混合物。即,由通式(a)表示的聚合性化合物可以是任意一种立体异构体,也可以是立体异构体的任意的混合物,还可以是外消旋体。
[0268]
对于由上述通式(a)表示的化合物的获得方法没有特别限制,可以使用市售品,也可以使用通过合成获得的化合物。在通过合成获得的情况下,作为由通式(a)表示的化合物
的制造方法没有特别限制,能够参考后述实施例中记载的方法等,按照常规方法制造。
[0269]
本发明的固化性组合物中的由通式(a)表示的化合物的含量在固化性组合物的总固体成分中优选为30~99质量%,更优选为35质量%~99质量%,进一步优选为40~99质量%。通过使由通式(a)表示的聚合性化合物的含量在上述范围内,在具有规定的阿贝数的固化物中,容易实现高于预测的部分色散比(θg,f)的部分色散比(θg,f)。
[0270]
固化性组合物中可以含有两种以上由通式(a)表示的聚合性化合物。在含有两种以上由通式(a)表示的聚合性化合物的情况下,优选合计含量在上述范围内。
[0271]
[成分b:酰基氧化膦光聚合引发剂]
[0272]
本发明的固化性组合物含有酰基氧化膦光聚合引发剂作为成分b。
[0273]
在本发明的固化性组合物中,作为成分b的酰基氧化膦光聚合引发剂通过光照射产生自由基活性种,作用于作为成分a的由通式(a)表示的聚合性化合物进行聚合(固化)反应,由此获得固化物。
[0274]
作为酰基氧化膦光聚合引发剂,能够没有特别限制地使用通常作为光聚合引发剂使用的酰基氧化膦化合物。
[0275]
作为上述酰基氧化膦光聚合引发剂(以下,还简称为“酰基氧化膦化合物”。),优选为具有由下述式(b-1)表示的结构的单酰基氧化膦化合物或具有由下述式(b-2)表示的结构的双酰基氧化膦化合物。
[0276]
[化学式21]
[0277][0278]
作为酰基氧化膦化合物,更优选为由下述式(b-3)表示的单酰基氧化膦化合物或由式(b-4)表示的双酰基氧化膦化合物,从获得更优异的光固化灵敏度的观点出发,进一步优选为由下述式(b-4)表示的双酰基氧化膦化合物。
[0279]
(由式(b-3)表示的单酰基氧化膦化合物)
[0280]
[化学式22]
[0281][0282]
上述式中,r
b1
、r
b2
及r
b3
分别独立地表示可以具有选自甲基及乙基中的基团作为取代基的芳基(芳香族烃基)。
[0283]
构成能够作为r
b1
~r
b3
采用的芳基的芳香环的碳原子数没有特别限制,例如优选为6~14,更优选为6~10。
[0284]
在能够作为r
b1
~r
b3
采用的芳基具有取代基的情况下,所具有的取代基的数量没有特别限制,优选为1~5个,更优选为1~3个。
[0285]
在能够作为r
b1
~r
b3
采用的芳基具有多个取代基的情况下,取代基的种类可以是单独的甲基,可以是单独的乙基,也可以是甲基和乙基这两者。其中,优选为单独的甲基。
[0286]
作为能够作为r
b1
~r
b3
采用的未取代的芳基,优选为苯基。
[0287]
作为具有能够作为r
b1
~r
b3
采用的取代基的芳基,优选为具有甲基作为取代基的苯基,更优选为具有1~3个甲基作为取代基的苯基,进一步优选为2,4,6-三甲基苯基。
[0288]
作为由式(b-3)表示的单酰基氧化膦化合物,优选为r
b1
~r
b3
分别独立地可以具有甲基作为取代基的苯基的化合物,更优选为r
b2
及r
b3
为苯基且r
b1
为具有1~3个甲基的苯基的化合物。
[0289]
其中,作为由式(b-3)表示的单酰基氧化膦化合物,优选为2,4,6-三甲基苯甲酰基二苯基氧化膦。
[0290]
(由式(b-4)表示的双酰基氧化膦化合物)
[0291]
[化学式23]
[0292][0293]
上述式中,r
b4
、r
b5
及r
b6
分别独立地表示可以具有选自甲基及乙基中的基团作为取代基的芳基(芳香族烃基)。
[0294]rb4
及r
b5
的含义与上述r
b1
的含义相同,r
b6
的含义与上述r
b2
的含义相同。
[0295]
作为由式(b-4)表示的双酰基氧化膦化合物,优选为r
b4
~r
b6
分别独立地可以具有甲基作为取代基的苯基的化合物,更优选为r
b6
为苯基且r
b4
及r
b5
分别独立地为具有1~3个甲基的苯基的化合物。
[0296]
其中,作为由式(b-4)表示的双酰基氧化膦化合物,优选为双(2,4,6-三甲基苯甲酰基)苯基氧化膦。
[0297]
本发明的固化性组合物中的成分b的含量在固化性组合物的总固体成分中优选为0.01~1质量%,从进一步提高耐光性的观点、并且从进一步提高透射率的观点出发,更优选为0.01~0.5质量%,进一步优选为0.01~0.3质量%。
[0298]
[成分c:胺化合物]
[0299]
本发明的固化性组合物含有胺化合物(以下,还简称为“胺化合物”。)作为成分c。另外,具有胺结构的由通式(a)表示的聚合性化合物分类为成分a。并且,胺化合物可以是具有胺结构的光自由基聚合引发剂,但在除了成分b以外的光自由基聚合引发剂残留在固化物中的情况下,有时由于光分解而使固化物的品质发生变化,因此优选不是具有胺结构的光自由基聚合引发剂。
[0300]
胺化合物能够提高由本发明的固化性组合物获得的固化物的耐光性。推测这是因为,由于存在胺化合物,抑制了氢离子对由通式(a)表示的聚合性化合物所具有的含氮稠合芳香环中的氮原子的加成,抑制了透射率的下降。
[0301]
上述胺化合物也可以是伯胺化合物、仲胺化合物及叔胺化合物中的任一种。
[0302]
在此,伯、仲及叔根据是否具有用脂肪族基团或芳香族基团取代了几个氨(nh3)的氢原子的结构来分类。取代数为一个时称为伯胺结构,取代数为2个时称为仲胺结构,取代数为3个时称为叔胺结构。
[0303]
上述脂肪族基团可以为链状,也可以为脂环式,只要与氮原子键合的原子为碳原子,则可以具有杂原子(氮原子、氧原子、硫原子等)作为脂环的成环原子。具体而言,是指烷基(包括环烷基。以下,在作为成分c的说明中含义相同。)、烯基(包括环烯基。以下,在作为
成分c的说明中含义相同。)、炔基(包括环炔基。以下,在作为成分c的说明中含义相同。)及胺结构中的与氮原子键合的原子为碳原子的杂环基(以下,在作为成分c的胺化合物的说明中简称为“杂环基”。)。
[0304]
除了芳香族烃基以外,上述芳香族基团还包括与氮原子键合的原子为碳原子的芳香族杂环基。
[0305]
上述脂肪族基团及芳香族基团可以未取代,也可以进一步具有取代基。
[0306]
在胺化合物为仲胺化合物或叔胺化合物的情况下,胺结构中的氮原子上的取代基可以彼此键合而形成环,也可以不形成环,但优选不形成环。其中,彼此键合而形成的环不是芳香族杂环。在使用了芳香族杂环的情况下,认为抑制固化物的透射率下降的效果小。
[0307]
从抑制与由通式(a)表示的聚合性化合物等聚合性化合物的副反应,进一步提高透射率的观点出发,上述胺化合物优选为叔胺化合物。
[0308]
胺化合物只要是分子内具有至少1个胺结构的化合物即可,胺结构的数量没有特别限制。在分子内具有2个以上的胺结构的化合物的情况下,伯胺~叔胺结构的分类取决于化合物所具有的最小级数的胺结构。例如,在分子内具有叔胺结构和仲胺结构这两者的化合物的情况下,作为仲胺化合物。
[0309]
胺结构中的氮原子所具有的取代基中,作为脂肪族基团,可举出烷基、烯基、炔基、及与氮原子键合的原子为碳原子的杂环基,作为芳香族基团,可举出芳基及杂芳基。
[0310]
胺结构中的氮原子所具有的取代基中,作为脂肪族基团或芳香族基团以外的基团,可举出卤原子(氟原子、溴原子、氯原子或碘原子)、羟基、烷氧基、芳氧基、烷硫基、芳硫基、酰基、酰氧基、烷氧基羰基及芳氧基羰基。
[0311]
上述胺结构中的氮原子所具有的取代基中,烷基、烯基、炔基、杂环基、芳基、杂芳基、烷氧基、芳氧基、烷硫基、芳硫基、酰基、酰氧基、烷氧基羰基及芳氧基羰基均可以未取代,也可以进一步具有取代基。
[0312]
上述杂环基及杂芳基中,作为成环原子而具有的杂原子,可优选举出氮原子、氧原子及硫原子,成环原子中所包含的杂原子的数量例如优选为一个~3个。环元数只要能够采用,则没有特别限制,例如,杂环基的环元数优选为3~6,杂芳基的环元数优选为5或6。并且,可以是单环,也可以是稠环。
[0313]
作为上述胺结构中的氮原子所具有的取代基可以进一步具有的取代基,只要能够获得本发明的效果,则没有特别限制,例如可举出选自卤原子(氟原子、溴原子、氯原子或碘原子)、羟基、烷基、烯基、炔基、杂环基(其中,连接键的位置并不限定于碳原子。)、芳基、杂芳基(其中,连接键的位置并不限定于碳原子。)、烷氧基、芳氧基、烷硫基、芳硫基、酰基、酰氧基、烷氧基羰基及芳氧基羰基中的基团、将这些基团组合2个以上而成的基团、以及聚合性基团。
[0314]
作为聚合性基团,能够适用上述通式(a)中的pol中的聚合性基团的记载,能够优选举出(甲基)丙烯酰氧基、(甲基)丙烯酰基氨基及乙烯基等。
[0315]
上述胺结构中的氮原子所具有的取代基在化合物中存在多个的情况下,可以分别相同,也可以不同。
[0316]
上述胺化合物可以是脂肪族胺化合物,也可以是芳香族胺化合物,但从氢离子等酸的捕捉能力的观点出发,优选为脂肪族胺化合物。
[0317]
在此,脂肪族胺化合物是指具有至少一个脂肪族基团作为胺结构中的氮原子所具有的取代基,且不具有芳香族基的化合物。并且,芳香族胺化合物是指具有至少一个芳香族基团作为胺结构中的氮原子所具有的取代基的化合物。
[0318]
从进一步提高耐光性的观点出发,上述胺化合物优选为脂肪族叔胺化合物。
[0319]
如上所述,从氢离子等酸的捕捉能力的观点出发,上述胺化合物的共轭酸的pka优选超过作为成分a的由通式(a)表示的聚合性化合物的共轭酸的pka(以下,还简称为“成分a的共轭酸的pka”。),更优选为成分a的共轭酸的pka+1以上,进一步优选为成分a的共轭酸的pka+2以上。
[0320]
上述胺化合物的分子量(mw)优选为90~5000,更优选为100~5000,进一步优选为120~3000,尤其优选为150~1000。
[0321]
从使用本发明的固化性组合物制作固化物等时,即使在加热工序后也存在于固化物中,发挥本发明的效果的观点出发,上述胺化合物的大气压(1013.25hpa)下的沸点(bp)优选为100℃以上,更优选为150℃以上,进一步优选为200℃以上。
[0322]
(伯胺化合物)
[0323]
作为伯胺化合物,例如作为胺结构中的氮原子所具有的取代基,可举出具有碳原子数6以上的烷基(优选为碳原子数6~30的烷基,更优选为碳原子数6~20的烷基。)、碳原子数6以上的烯基(优选为碳原子数6~30的烯基,更优选为碳原子数6~20的烯基。)、碳原子数6以上的炔基(优选为碳原子数6~30的炔基,更优选为碳原子数6~20的炔基。)、碳原子数6以上的脂环式烃基(优选为碳原子数6~20的环烷基,更优选为碳原子数6~16的环烷基)或碳原子数6以上的芳基(优选为碳原子数6~20的芳基,更优选为碳原子数6~16的芳基。)的胺化合物。
[0324]
胺结构中的氮原子所具有的上述各取代基可以未取代,也可以具有取代基。
[0325]
在胺化合物中,各取代基中的碳原子数是指作为未取代基团的碳原子数。
[0326]
作为胺结构中的氮原子所具有的上述各取代基可以具有的取代基,可举出碳原子数1以上的烷基、碳原子数2以上的烯基、碳原子数2以上的炔基、碳原子数6以上的芳基、卤原子(氟原子、溴原子、氯原子或碘原子)、羟基、碳原子数1以上的烷氧基、碳原子数6以上的芳氧基、碳原子数1以上的烷硫基、碳原子数6以上的芳硫基、碳原子数1以上的酰基、碳原子数2以上的酰氧基、碳原子数2以上的烷氧基羰基及碳原子数7以上的芳氧基羰基。这些基团的数量没有特别限制,可以是一个,也可以是2个以上。
[0327]
作为上述胺结构中的氮原子所具有的各取代基可以具有的各取代基的碳原子数如下。
[0328]
烷基的碳原子数优选为1~15,更优选为1~10,烯基的碳原子数优选为2~15,更优选为2~10,炔基的碳原子数优选为2~15,更优选为2~10,芳基的碳原子数优选为6~20,更优选为6~16。对于烷氧基、烷硫基、酰基、酰氧基及烷氧基羰基中的烷基部分的碳原子数,能够优选适用上述烷基的碳原子数的记载。并且,对于芳氧基、芳硫基及芳氧基羰基中的芳基部分的碳原子数,能够优选适用上述芳基的碳原子数的记载。
[0329]
(仲胺化合物)
[0330]
作为仲胺化合物,例如作为胺结构中的氮原子所具有的取代基,可举出具有合计2个选自碳原子数3以上的烷基(优选为碳原子数3~20的烷基,更优选为碳原子数3~20的烷
基。)、碳原子数3以上的烯基(优选为碳原子数3~30的烯基,更优选为碳原子数3~20的烯基。)、碳原子数3以上的炔基(优选为碳原子数3~30的炔基,更优选为碳原子数3~20的炔基。)、碳原子数3以上的脂环式烃基(优选为碳原子数3~20的环烷基,更优选为碳原子数6~16的环烷基)及碳原子数6以上的芳基(优选为碳原子数6~20的芳基,更优选为碳原子数6~16的芳基。)中的基团的胺化合物。
[0331]
胺结构中的氮原子所具有的上述各取代基可以未取代,也可以具有取代基。
[0332]
作为胺结构中的氮原子所具有的上述各取代基可以具有的取代基,能够适用前述伯胺化合物中的胺结构中的氮原子所具有的取代基可以具有的取代基。
[0333]
上述胺结构中的氮原子所具有的2个取代基可以分别相同,也可以不同。
[0334]
(叔胺化合物)
[0335]
作为叔胺化合物,例如作为胺上的氮原子所具有的3个取代基,可举出具有合计3个选自烷基、烯基、炔基、芳基、杂环基(可以是脂肪族及芳香族中的任一种)及脂环式烃基(可以是饱和及不饱和中的任一种)中的基团的胺化合物。
[0336]
3个取代基的碳原子数的合计优选为4~30,更优选为6~25,进一步优选为8~20。
[0337]
作为杂环基,能够优选适用上述胺结构中的氮原子所具有的取代基中的杂环基及杂芳基的记载,以使构成环的碳原子数成为4以上。构成环的碳原子数优选为4~15,更优选为4~9。构成环的原子数优选为5~16,更优选为5~10。
[0338]
作为脂环式烃基,优选为环烷基,碳原子数优选为3~20,更优选为6~16。
[0339]
对于烷基、烯基、炔基及芳基的碳原子数,能够优选适用前述伯胺化合物中的,上述胺结构中的氮原子所具有的各取代基可以具有的各取代基的碳原子数的记载。
[0340]
胺结构中的氮原子所具有的上述各取代基可以未取代,也可以具有取代基。
[0341]
作为胺结构中的氮原子所具有的上述各取代基可以具有的取代基,能够适用前述伯胺化合物中的胺结构中的氮原子所具有的取代基可以具有的取代基。
[0342]
上述胺结构中的氮原子所具有的3个取代基可以分别相同,也可以不同。
[0343]
本发明的固化性组合物中的作为成分c的胺化合物的含量在固化性组合物的总固体成分中优选为0.01~2质量%,从进一步提高耐光性的观点出发,更优选为0.01~1.0质量%,进一步优选为0.01~0.7质量%。
[0344]
并且,在本发明的固化性组合物中,相对于1质量份的成分b,成分c的配合量优选为0.1~20质量份,更优选为0.3~15质量份,进一步优选为0.5~10质量份。
[0345]
作为具体的胺化合物,优选为由下述通式(c)表示的化合物。
[0346]
[化学式24]
[0347][0348]
上述式中,r
c1
表示选自碳原子数4以上的未取代的烷基(可以是链状及环式中的任一种,碳原子数优选为4~30,更优选为4~20。)、碳原子数6以上的芳基(碳原子数优选为6~20,更优选为6~16。)、构成环的碳原子数为4以上的杂环基(可以是脂肪族及芳香族中的任一种。能够优选适用上述中的杂环基及杂芳基的记载。)、碳原子数2以上的羟基烷基(碳原子数优选为2~6,更优选为2~4。)及具有(甲基)丙烯酰氧基作为取代基的碳原子数2以
上的烷基(碳原子数不包括(甲基)丙烯酰氧基中的碳原子数。碳原子数优选为2~6,更优选为2~4。)中的基团,或将这些取代基组合2个以上而成的基团。
[0349]rc2
及r
c3
分别独立地表示氢原子、碳原子数1以上的非环状烷基(碳原子数优选为1~10,更优选为1~6。)、碳原子数6以上的芳基(碳原子数优选为6~20,更优选为6~16。)或碳原子数2以上的羟基烷基(碳原子数优选为2~6,更优选为2~4。)。
[0350]
其中,在r
c1
的碳原子数小于6的情况下,r
c2
与r
c3
不会同时成为氢原子。
[0351]
并且,由上述式(c)表示的胺化合物以从r
c1
~r
c3
中的任一个取代基去除氢原子的形式彼此连接,也优选成为2以上的多聚体的化合物。
[0352]
作为由上述式(c)表示的化合物,优选r
c1
是选自碳原子数4以上的未取代的烷基、碳原子数6以上的芳基、构成环的碳原子数为4以上的杂环基、碳原子数2以上的羟基烷基及具有(甲基)丙烯酰氧基作为取代基的碳原子数2以上的烷基中的基团,或将这些取代基组合2个以上而成的基团,且r
c2
及r
c3
分别独立地为碳原子数1以上的非环状烷基、碳原子数6以上的芳基或碳原子数2以上的羟基烷基,从进一步提高耐光性的观点出发,更优选r
c1
是选自碳原子数4以上的未取代的烷基、构成环的碳原子数为4以上的杂环基(但是,不是杂芳基。)、碳原子数2以上的羟基烷基及具有(甲基)丙烯酰氧基作为取代基的碳原子数2以上的烷基中的基团,或将这些取代基组合2个以上而成的基团,且r
c2
及r
c3
分别独立地为碳原子数1以上的非环状烷基或碳原子数2以上的羟基烷基。
[0353]
更具体而言,由上述式(c)表示的化合物可举出以下胺化合物。下述表中的表述“氢”是指氢原子。
[0354]
[化学式25]
[0355][0356] r
c1rc2rc3
(c-1)正丁基正丁基氢(c-2)正丁基正丁基正丁基(c-3)正丁基正丁基2-羟基乙基(c-4)异丁基异丁基异丁基(c-5)苯基苯基氢(c-6)苯基苯基甲基(c-7)苯基甲基甲基(c-8)4-吡啶基甲基甲基(c-9)1-萘基甲基甲基(c-10)2-萘基甲基甲基(c-11)苄基甲基甲基(c-12)正十二烷基氢氢(c-13)苄基2-羟基乙基2-羟基乙基(c-14)环己基甲基甲基
(c-15)(2-羟基乙氧基)乙基甲基甲基
[0357]
[化学式26]
[0358][0359]
[成分d:由通式(d)表示的化合物]
[0360]
本发明的固化性组合物还优选含有由下述通式(d)表示的化合物。
[0361]
本发明的固化性组合物通过含有成分a的具有由通式(a)表示的含氮稠合芳香环作为部分结构的聚合性化合物、成分b的酰基氧化膦光聚合引发剂及成分c的胺化合物、以及由通式(d)表示的化合物而获得的固化物还具有优异的耐光性。
[0362]
并不受任何特定理论的限制,但在通过本发明的固化性组合物进一步含有由通式(d)表示的化合物而获得的固化物中,发生从吸收光而被激励的由通式(a)表示的聚合性化合物向由通式(d)表示的化合物的能量转移,由通式(a)表示的化合物返回到基底状态,因此认为这是因为抑制了由通式(a)表示的化合物的光反应(光劣化)。
[0363]
即,推测由通式(d)表示的化合物作为淬灭剂(quencher)发挥作用。
[0364]
(由通式(d)表示的化合物)
[0365]
由下述通式(d)表示的化合物为不饱和羰基化合物,具有二烯结构或与芳香环直接键合的双键。
[0366]
[化学式27]
[0367][0368]
上述式中,r
d1
、r
d2
及r
d3
分别独立地表示氢原子或取代基,w表示氢原子或取代基。r
d1
及r
d2
、或r
d2
及r
d3
也可以彼此键合而形成可以具有取代基的环。
[0369]
波浪线是指可以具有顺式结构或反式结构。
[0370]
作为能够作为r
d1
~r
d3
采用的取代基,能够举出可以具有取代基的烷基、可以具有取代基的烯基、可以具有取代基的芳香族烃基、可以具有取代基的芳香族杂环基、可以具有取代基的环烷基、可以具有取代基的环烯基、可以具有取代基的烷氧基、可以具有取代基的烯氧基。
[0371]
以下,对能够作为r
d1
~r
d3
采用的上述取代基的碳原子数等进行详细说明。在由通式(d)表示的化合物中,以下,取代基的碳原子数是指未取代的取代基时的碳原子数,在是具有取代基的取代基的情况下,是指不具有取代基的状态(即未取代的状态)下的碳原子数。
[0372]
能够作为r
d1
~r
d3
采用的烷基的碳原子数优选为1~6,更优选为1~4,进一步优选为1~2。
[0373]
能够作为r
d1
~r
d3
采用的烯基的碳原子数优选为2~6,更优选为2~4,进一步优选为2。
[0374]
能够作为r
d1
~r
d3
采用的芳香族烃基的碳原子数优选为6~14,更优选为6~10,进一步优选为6。
[0375]
能够作为r
d1
~r
d3
采用的环烷基的碳原子数优选为3~15,更优选为5~12,进一步优选为6~10。
[0376]
能够作为r
d1
~r
d3
采用的环烯基的碳原子数优选为4~15,更优选为5~12,进一步优选为6~10。
[0377]
对于能够作为r
d1
~r
d3
采用的芳香族杂环基,能够优选适用开头的芳香族杂环基的记载。
[0378]
对于能够作为r
d1
~r
d3
采用的烷氧基及烯氧基的碳原子数,其含义分别与能够作为上述r
d1
~r
d3
采用的烷基及烯基的碳原子数的记载的含义相同。
[0379]
在能够作为r
d1
~r
d3
采用的取代基的上述例中,作为各取代基可以具有的取代基的例子,能够举出碳原子数1~6的烷氧基、卤原子(氟原子、氯原子、溴原子等)、羟基、氰基、硝基、亚硝基、羧基、碳原子数2~6的烷氧基羰基、碳原子数2~6的烷基羰氧基、碳原子数2~6的烷基羰基及交联性基团等。其中,优选为卤原子、氰基、烷基羰氧基、羟基、烷氧基或交联性基团。
[0380]
作为上述交联性基团的例子,能够适用上述通式(a)中的pol中的聚合性基团的记载,能够优选举出(甲基)丙烯酰氧基、(甲基)丙烯酰基氨基及乙烯基等。
[0381]
以下,对于由通式(d)、(d1)或(d2)表示的化合物中的交联性基团也与上述的含义相同。
[0382]rd1
与r
d2
、或r
d2
与r
d3
也可以彼此键合而形成环。尤其,优选r
d1
与r
d2
彼此键合而形成环。
[0383]
在r
d1
与r
d2
、及r
d2
与r
d3
均不彼此键合而形成环的情况下,r
d1
及r
d3
优选为氢原子,r
d2
优选为烷基或芳基。
[0384]
作为r
d1
与r
d2
通过彼此键合而形成的环,可举出芳香族烃环、芳香族杂环、不饱和烃环,例如可举出苯环、环己烯环、四氢呋喃环,优选为苯环。
[0385]
作为r
d2
与r
d3
通过彼此键合而形成的环,可举出饱和烃环、不饱和烃环,例如可举出环己烷环、环己烯环。
[0386]rd1
与r
d2
、或r
d2
与r
d3
彼此键合而形成的环可以未取代,也可以具有取代基。
[0387]
作为r
d1
与r
d2
、或r
d2
与r
d3
彼此键合而形成的环可以具有的取代基的例子,能够举出烷基、烯基、脂肪族环基、烷氧基、烯氧基、烷基羰氧基、羟基、卤原子(氟原子、氯原子、溴原子等)、氰基及交联性基团等。
[0388]
作为上述环可以具有的各取代基,能够优选适用能够作为上述r
d1
~r
d3
采用的各取代基的记载中的对应的取代基的记载。
[0389]
作为r
d1
与r
d2
、或r
d2
与r
d3
彼此键合而形成的环所具有的取代基,优选为碳原子数1~6的烷氧基、卤原子、羟基、氰基、碳原子数2~6的烷基羰氧基及交联性基团。
[0390]
作为能够作为w采用的取代基,能够举出可以具有取代基的烷基、可以具有取代基的烷氧基、可以具有取代基的芳氧基、可以具有取代基的烯氧基、羟基及交联性基团等。
[0391]
对于能够作为w采用的各取代基,能够优选适用能够作为上述r
d1
~r
d3
采用的各取代基的记载中的对应的取代基的记载。
[0392]
在能够作为w采用的上述取代基的例子中,作为上述各取代基可以具有的取代基的例子,能够举出碳原子数1~6的烷氧基、卤原子(氟原子、氯原子、溴原子等)、羟基、芳香族烃基及交联性基团等。
[0393]
作为能够作为上述w采用的取代基可以具有的碳原子数1~6的烷氧基及芳香族烃基,能够分别优选适用能够优选作为上述r
d1
~r
d3
采用的碳原子数1~6的烷氧基及芳香族烃基的记载。
[0394]
w优选为氢原子、可以具有取代基的烷基、可以具有取代基的烷氧基、可以具有取代基的芳氧基、可以具有取代基的烯氧基、羟基或交联性基团,更优选为可以具有取代基的烷基、可以具有取代基的烷氧基、可以具有取代基的芳氧基、可以具有取代基的烯氧基、羟基或交联性基团。
[0395]
由通式(d)表示的化合物中,式中的波浪线部分可以具有顺式结构或反式结构,优选为反式结构。
[0396]
即,由通式(d)表示的化合物优选为由通式(d1)表示的化合物。下述式中的r
d1
~r
d3
及w的含义与上述式(d)中的r
d1
~r
d3
及w的含义相同。
[0397]
[化学式28]
[0398][0399]
从进一步提高耐光性的观点出发,由通式(d)表示的化合物更优选为由通式(d2)表示的化合物。
[0400]
[化学式29]
[0401][0402]
上述式中,r
d11
表示取代基,r
d12
表示氢原子或取代基,z为0~5的整数。
[0403]
作为r
d11
中的取代基的例子,能够举出烷基、烯基、烷氧基、烯氧基、烷基羰氧基、氰基、卤原子及羟基等。并且,这些基团可以进一步被交联性基团取代。
[0404]
对于能够作为r
d11
采用的烷基、烯基、烷氧基、烯氧基、烷基羰氧基及卤原子,能够优选适用作为上述r
d1
与r
d2
、或r
d2
与r
d3
彼此键合而形成的环可以具有的取代基记载的烷基、烯基、烷氧基、烯氧基、烷基羰氧基及卤原子的记载。
[0405]
在z为2以上的情况下,多个r
d11
可以相同或不同。
[0406]
作为能够作为r
d12
采用的取代基,能够举出烷基、烯基及芳香族烃基等。这些基团可以进一步被交联性基团取代。
[0407]
对于能够作为r
d12
采用的烷基、烯基及芳香族烃基,能够优选适用作为上述能够作为w采用的取代基记载的烷氧基中的烷基、烯氧基中的烯基、芳氧基中的芳香族烃基(芳基)
的记载。
[0408]
z为0~5的整数,优选为0~2的整数,更优选为0或1。
[0409]
由通式(d)表示的化合物也可以是经由r
d1
~r
d3
中的任一个所包含的交联性基团聚合而成的聚合物。
[0410]
上述聚合物可以是由单一单体形成的聚合物,也可以是由两种以上的单体形成的共聚物。
[0411]
作为构成共聚物的两种以上的单体,只要是由通式(d)表示的化合物且含有具有交联性基团的化合物,则可以使用其他单体。例如,能够举出苯乙烯、α-甲基苯乙烯、乙烯基甲苯、叔丁基苯乙烯等苯乙烯系单体;(甲基)丙烯酸甲酯、(甲基)丙烯酸乙酯、(甲基)丙烯酸正丁酯、(甲基)丙烯酸异丁酯、(甲基)丙烯酸异戊酯、(甲基)丙烯酸正己酯、(甲基)丙烯酸异辛酯、(甲基)丙烯酸2-乙基己酯、(甲基)丙烯酸正辛酯、(甲基)丙烯酸异壬酯、(甲基)丙烯酸正癸酯、(甲基)丙烯酸异癸酯、(甲基)丙烯酸异冰片酯等(甲基)丙烯酸酯;(甲基)丙烯酸、衣康酸、巴豆酸、异巴豆酸、马来酸等不饱和羧酸;乙烯、丙烯、1-丁烯、2-甲基-1-丁烯、1-戊烯、4-甲基-1-戊烯、1-己烯、1-辛烯、1-癸烯、1-十八碳烯等α-烯烃;降冰片烯等。
[0412]
以下,列举本发明的固化性组合物中优选使用的由通式(d)表示的化合物的具体例,但并不限定于以下化合物。
[0413]
[化学式30]
[0414][0415]
[化学式31]
[0416][0417]
在本发明的固化性组合物含有由通式(d)表示的化合物的情况下,本发明的固化性组合物中的由通式(d)表示的化合物的含量在固化性组合物的总固体成分中优选为1~30质量%,更优选为2~25质量%,进一步优选为3~20质量%,尤其优选为3~10质量%。通过使由通式(d)表示的化合物的含量在上述优选的范围内,由本发明的固化性组合物获得的固化物能够兼具耐光性及光学特性(低阿贝数和高部分色散比)。
[0418]
并且,在本发明的固化性组合物中,相对于100质量份的成分a,由通式(d)表示的化合物的含量优选为1~40质量份,更优选为2~30质量份,进一步优选为3~25质量份。
[0419]
[(甲基)丙烯酸酯单体]
[0420]
本发明的固化性组合物可以包含(甲基)丙烯酸酯单体。(甲基)丙烯酸酯单体可以是分子中具有2个以上的(甲基)丙烯酰基的多官能(甲基)丙烯酸酯单体,也可以是分子中具有一个(甲基)丙烯酰基的单官能(甲基)丙烯酸酯单体。
[0421]
作为在本发明中使用的(甲基)丙烯酸酯单体的例子,能够举出以下的单体1(苯氧乙基丙烯酸酯)、单体2(甲基丙烯酸苄酯)、单体3(三环癸烷二甲醇二丙烯酸酯)、单体4(丙烯酸二环戊酯)、单体5(1,6-己二醇二丙烯酸酯)、单体6(1,6-己二醇二甲基丙烯酸酯)、单体7(丙烯酸苄酯)、单体8(甲基丙烯酸异冰片酯)、单体9(甲基丙烯酸二环戊酯)或单体10(甲基丙烯酸十二烷基酯)等。并且,作为(甲基)丙烯酸酯单体的具体例,还能够举出日本特开2012-107191号公报的0037~0046段中记载的(甲基)丙烯酸酯单体。
[0422]
(甲基)丙烯酸酯单体的分子量优选为100~500。
[0423]
以下,列举本发明的固化性组合物中优选使用的(甲基)丙烯酸酯单体的具体例,但并不限定于以下化合物。
[0424]
[化学式32]
[0425][0426]
对于(甲基)丙烯酸酯单体的获得方法没有特别限制,可以通过商业手段获得,也可以通过合成来制造。在通过商业手段获得的情况下,例如能够优选使用viscort#192pea(单体1)(osaka organic chemical ind.ltd.制造)、light ester bz(单体2)(kyoeishachemical co.,ltd.制造)、a-dcp(单体3)(shin-nakamura chemical co.,ltd.制造)、fa-513as(单体4)(hitachi chemical co.,ltd.制造)、a-hd-n(单体5)(shin-nakamura chemical co.,ltd.制造)、hd-n(单体6)(shin-nakamura chemical co.,ltd.制造)、fa-bza(单体7)(hitachi chemical co.,ltd.制造)、light ester ib-x(单体8)(kyoeishachemical co.,ltd.制造)、fa-513m(单体9)(hitachi chemical co.,ltd.制造)、light ester l(单体10)(kyoeishachemical co.,ltd.制造)。
[0427]
在固化性组合物含有(甲基)丙烯酸酯单体的情况下,(甲基)丙烯酸酯单体的含量在固化性组合物的总固体成分中优选为1~80质量%,更优选为2~50质量%,进一步优选为3~40质量%。通过调整固化性组合物中的(甲基)丙烯酸酯单体量能够调整缓和固化物热变化时的应力的功能。
[0428]
[侧链上具有自由基聚合性基团的聚合物]
[0429]
除上述化合物以外,本发明的固化性组合物还可以包含侧链上具有自由基聚合性基团的聚合物。由于侧链上具有自由基聚合性基团的聚合物发挥提高固化性组合物的粘度的作用,因此也能够称为增稠剂或者增稠聚合物。为了调整固化性组合物的粘度而能够添加侧链上具有自由基聚合性基团的聚合物。
[0430]
侧链上具有自由基聚合性基团的聚合物可以是均聚物,也可以是共聚物。其中,侧链上具有自由基聚合性基团的聚合物优选为共聚物。在侧链上具有自由基聚合性基团的聚合物是共聚物的情况下,只要至少一个共聚成分具有自由基聚合性基团即可。并且,在侧链上具有自由基聚合性基团的聚合物是共聚物的情况下,更优选为包含侧链上具有自由基聚合性基团的单体单元和侧链上具有芳香族烃基的单体单元的共聚物。
[0431]
上述共聚物也可以是无规及嵌段等任意方式的共聚物。
[0432]
作为自由基聚合性基团,能够举出(甲基)丙烯酸酯基、乙烯基、苯乙烯基、烯丙基等。侧链上具有自由基聚合性基团的聚合物中,优选包含5~100质量%的具有自由基聚合性基团的结构单元,更优选包含10~90质量%,进一步优选包含20~80质量%。
[0433]
以下,列举侧链上具有本发明中优选使用的自由基聚合性基团的聚合物的具体例,但侧链上具有自由基聚合性基团的聚合物并不限定于以下结构。以下所示的具体例均为共聚物,分别包含2个或三个相邻记载的结构单元。例如,在最上层左端记载的具体例为甲基丙烯酸烯丙酯-甲基丙烯酸苄酯的共聚物。
[0434]
在以下结构式中,ra及rb分别独立地表示氢或甲基。另外,一个聚合物中的多个ra可以相同,也可以不同。并且,n表示0~10的整数,优选为0~2的整数,更优选为0或1。共聚物中的各结构单元的量比没有特别限制,作为共聚物中的具有自由基聚合性基团的结构单元的含有率,能够优选适用上述记载。
[0435]
[化学式33]
[0436][0437]
[化学式34]
[0438][0439]
侧链上具有自由基聚合性基团的聚合物的分子量(重均分子量)优选为1,000~10,000,000,更优选为5,000~300,000,进一步优选为10,000~200,000。并且,侧链上具有
自由基聚合性基团的聚合物的玻璃化转变温度优选为50~400℃,更优选为70~350℃,进一步优选为100~300℃。
[0440]
侧链上具有自由基聚合性基团的聚合物的含量在固化性组合物的总固体成分中优选为40质量%以下,更优选为30质量%以下,进一步优选为25质量%以下。另外,侧链上具有自由基聚合性基团的聚合物的含量可以是0质量%,还优选不添加侧链上具有自由基聚合性基团的聚合物的方式。
[0441]
[聚合引发剂]
[0442]
除了上述成分b的酰基氧化膦光聚合引发剂以外,本发明的固化性组合物还可以含有热自由基聚合引发剂,还可以含有上述成分b的酰基氧化膦光聚合引发剂以外的光自由基聚合引发剂。
[0443]
(热自由基聚合引发剂)
[0444]
本发明的固化性组合物优选含有热自由基聚合引发剂。通过该热聚合引发剂的作用,对本发明的固化性组合物进行热聚合,由此能够成型显示高耐热性的固化物。
[0445]
作为热自由基聚合引发剂,能够根据后述的热聚合工序的条件适当使用通常用作热自由基聚合引发剂的化合物。例如,可举出有机过氧化物等,具体而言,能够使用以下化合物。
[0446]
例如能够举出1,1-二(叔己基过氧)环己烷、1,1-二(叔丁基过氧)环己烷、2,2-二(4,4-二-(叔丁基过氧)环己基)丙烷、叔己基过氧化异丙基单碳酸酯、叔丁基过氧-3,5,5-三甲基己酸酯、叔丁基过氧化月桂酸酯、过氧化二异丙苯、过氧化二叔丁基、叔丁基过氧-2-己酸乙酯、过氧化二叔己酯、叔己基过氧-2-己酸乙酯、氢过氧化异丙苯、叔丁基过氧化氢、叔丁基过氧-2-乙基己基、2,3-二甲基-2,3-二苯基丁烷等。
[0447]
热自由基聚合引发剂的含量在本发明的固化性组合物的总固体成分中优选为0.01~5质量%,更优选为0.02~3质量%,进一步优选为0.03~2质量%,尤其优选为0.05~1质量%。
[0448]
(光自由基聚合引发剂)
[0449]
除了上述作为成分b的酰基氧化膦光聚合引发剂以外,本发明的固化性组合物还可以含有除了该成分b以外的光自由基聚合引发剂(以下,还简称为“其他光自由基聚合引发剂”。)。
[0450]
作为其他光自由基聚合引发剂,只要能够获得本发明的效果,满足作为所获得的固化物所需要的性能,则能够没有特别限制地使用通常作为光自由基聚合引发剂使用的化合物。具体而言,能够使用以下化合物。
[0451]
例如,能够举出1-苯基-2-羟基-2-甲基丙烷-1-酮、1-羟基环己基苯基酮、1-(4-异丙基苯基)-2-羟基-2-甲基丙烷-1-酮、1,2-二苯基乙烷二酮、甲基苯基乙醛酸酯、1-[4-(2-羟基乙氧基)-苯基]-2-羟基-2-甲基-1-丙烷-1-酮、2-羟基-1-{4-[4-(2-羟基-2-甲基-丙酰基)-苄基]苯基}-2-甲基-丙烷-1-酮、2,2-二甲氧基-1,2-二苯基乙烷-1-酮、2-甲基-1-(4-甲硫基苯基)-2-吗啉基丙烷-1-酮等。
[0452]
其他光自由基聚合引发剂的含量只要能够获得本发明的效果,满足作为所获得的固化物所需要的性能,则没有特别限制,能够适当调整而确定。
[0453]
本发明的固化性组合物优选含有光自由基聚合引发剂和热自由基聚合引发剂这
两者。在该情况下,光自由基聚合引发剂和热自由基聚合引发剂的合计含量在本发明的固化性组合物的总固体成分中优选为0.02~5质量%,更优选为0.03~3质量%,进一步优选为0.04~2质量%。
[0454]
上述合计含量的计算中的光自由基聚合引发剂的含量是指,作为成分b的酰基氧化膦光聚合引发剂的含量、或作为成分b的酰基氧化膦光聚合引发剂及可以含有的其他光自由基聚合引发剂的合计含量。
[0455]
[其他添加剂等]
[0456]
只要不违背本发明的主旨,则本发明的固化性组合物可以含有除了上述成分以外的聚合物或单体、分散剂、增塑剂、热稳定剂、脱模剂等添加剂。
[0457]
本发明的固化性组合物的粘度优选为20,000mpa
·
s以下,更优选为15,000mpa
·
s以下,进一步优选为13,000mpa
·
s以下,尤其优选为10,000mpa
·
s以下。通过使固化性组合物的粘度在上述范围内,能够提高将固化物成型时的操作性,并形成高品质的固化物。另外,固化性组合物的粘度优选为2,000mpa
·
s以上,更优选为3,000mpa
·
s以上,进一步优选为4,000mpa
·
s以上,尤其优选为5,000mpa
·
s以上。
[0458]
<固化物>
[0459]
通过本发明的固化性组合物的固化,能够获得阿贝数低且部分色散比高,显示优异的耐光性的固化物。
[0460]
固化物的阿贝数(νd)及部分色散比(θg,f)是使用kalnew精密折射计kpr-2000(shimadzu device corporation制造)测定的值。具体而言,将固化性组合物注入直径20mm、厚度2mm的透明玻璃模具中,在氧浓度1%以下的气氛下,从透明玻璃模具的上方照射1000mj/cm2的紫外线,由此成型固化物(紫外线照射工序),对该固化物测定阿贝数(νd)及部分色散比(θg,f)。固化物的阿贝数(νd)及部分色散比(θg,f)通过下述式计算。另外,在将固化物成型时,除了上述紫外线照射工序以外,还可以采用加热工序。在该情况下,作为加热工序,可举出在氧浓度1%以下的气氛下,在200℃下加热30分钟。
[0461]
νd=(nd-1)/(nf-nc)
[0462]
θg,f=(ng-nf)/(nf-nc)
[0463]
在此,nd表示波长587.56nm下的折射率,nf表示波长486.13nm下的折射率,nc表示波长656.27nm下的折射率,ng表示波长435.83nm下的折射率。
[0464]
本发明的固化物的阿贝数没有特别限定,优选为35以下,更优选为30以下,进一步优选为29以下,尤其优选为28以下。并且,本发明的固化物的阿贝数没有特别限定,优选为1以上,更优选为3以上,进一步优选为5以上,尤其优选为7以上。
[0465]
本发明的固化物的部分色散比θg,f没有特别限定,优选为0.65以上,更优选为0.70以上,进一步优选为0.75以上。并且,本发明的固化物的部分色散比θg,f没有特别限定,优选为2以下,更优选为1.8以下,进一步优选为1.7以下。
[0466]
由本发明的固化性组合物获得的固化物在用作透镜时,作为性能要求在可见光区域不具有吸收,即透明。
[0467]
由本发明的固化性组合物获得的固化物在可见光区域中的长波长区域实质上不具有吸收,随着变为短波长侧,可见透射率的下降。因此,通过测定波长430nm下的透射率,能够评价由本发明的固化性组合物获得的固化物的透明性。
[0468]
本发明的固化物在波长430nm下的透射率是使用紫外可见分光光度计(例如,uv-2600(商品名,shimadzu corporation制造))测定的值。具体而言,对除了使用直径20mm、厚度1mm的透明玻璃模具以外,以与上述固化物的阿贝数(νd)及部分色散比(θg,f)的测定样品相同的方式制作的厚度大致1mm的固化物测定波长430nm下的透射率。
[0469]
并且,用于评价固化物的耐光性的光照射试验根据后述实施例中记载的氙光照射试验进行。
[0470]
以下,对于固化物在波长430nm下的透射率,记载优选的值。
[0471]
本发明的固化物的刚制作后的透射率,即光照射试验前的透射率没有特别限定,优选为80%以上,更优选为82%以上,进一步优选为83%以上,尤其优选为85%以上。
[0472]
并且,本发明的固化物的光照射试验后的透射率没有特别限定,优选为65%以上,更优选为68%以上,进一步优选为70%以上,尤其优选为75%以上,最优选为80%以上。
[0473]
本发明的固化物的光照射试验前后的透射率的下降幅度没有特别限定,优选为15%以下,更优选为12%以下,进一步优选为10%以下,尤其优选为6%以下,最优选为3%以下。
[0474]
通过从上述光照射试验前的透射率的值减去上述光照射试验后的透射率的值来计算上述光照射试验前后的透射率的下降幅度。
[0475]
[固化物的制造方法]
[0476]
能够通过包括对本发明的固化性组合物进行光固化的工序的方法制造固化物,优选还包括热固化的工序。固化物的制造方法优选设置有通过对固化性组合物进行光照射或加热固化性组合物而形成半固化物的工序及通过对所获得的半固化物进行光照射或加热半固化物而形成固化物的工序。其中,一定包括通过光照射固化的工序。
[0477]
[形成半固化物的工序]
[0478]
形成半固化物的工序优选包括转印工序。转印工序为将模具按压到上述固化性组合物的工序。在转印工序中,在注入到一对模具的一个中的固化性组合物上按压另一个模具而使固化性组合物展开。
[0479]
优选固化物的制造方法中所使用的模具已实施氮化铬处理。由此,在后工序中进行的脱模工序中,能够获得良好的模具脱模性,且能够提高光学部件的制造效率。
[0480]
作为氮化铬处理,例如能够举出在模具表面形成氮化铬膜的方法。作为在模具表面形成氮化铬膜的方法,例如有cvd(化学气相沉积(chemical vapor deposition))法和pvd(物理气相沉积(physical vapor deposition))法。cvd法为使含有铬的原料气体和含有氮的原料气体在高温下反应而在基体表面形成氮化铬膜的方法。并且,pvd法为利用电弧放电在基体表面形成氮化铬膜的方法(电弧式真空蒸镀法)。在该电弧式真空蒸镀法中,在真空容器内配置例如由铬制成的阴极(蒸发源),在阴极与真空容器的壁面之间通过触发器产生电弧放电,蒸发阴极的同时,通过电弧等离子体实现金属的离子化,对基体施加负电压,并且在真空容器中装入几十mtorr(1.33pa)左右的反应气体(例如氮气),由此使离子化的金属与反应气体在基体的表面进行反应来制作化合物的膜。本发明中的模具表面的氮化铬处理通过上述cvd法或pvd法实施。
[0481]
在此,关于模具,通常能够组合2个模具一边对内容物进行加压一边进行加热,当将低粘度的组合物注入模具中时,成为向成型模间隙泄露的原因。因此,注入到模具的固化
性组合物优选具有一定以上的粘度。为了调整固化性组合物的粘度,可以在固化性组合物中添加上述侧链上具有自由基聚合性基团的聚合物。
[0482]
在按压模具的工序之后设置有形成半固化物的工序。半固化物通过对注入到模具内的固化性组合物进行半固化而获得。在形成半固化物的工序中,进行光照射或加热。本说明书中,也能够将这种工序称为半固化工序。
[0483]
在半固化工序中,对本发明的固化性组合物进行光照射及加热中的至少一个。在半固化中,无论是在进行光照射的情况下还是进行加热的情况下,最终获得的固化物的阿贝数及部分色散比(θg,f)通常无差异。在半固化工序中,优选形成在25℃且频率10hz下的复数粘度为105~108mpa
·
s的半固化物。
[0484]
在此,本说明书中,“半固化物”为聚合固化性组合物而成的固化物,是指没有完全成为固体而某种程度上具有流动性的状态的物质。在固化性组合物的聚合物在25℃且频率10hz下的复数粘度为105~108mpa
·
s的情况下,其聚合物是半固化物。即,作为在25℃且频率10hz下的复数粘度的上限值,将小于1.0
×
109mpa
·
s的物质为止视为半固化物。另一方面,“固化物”为通过聚合使固化性组合物固化而成的固化物,是指完全成为固体的状态的物质。
[0485]
光照射中所使用的光优选为紫外线或可见光线,更优选为紫外线。例如优选使用金属卤化物灯、低压汞灯、高压汞灯、超高压汞灯、杀菌灯、氙气灯、led(发光二极管,light emitting diode)光源灯等。在进行光照射时,也可以使用短波长截止滤光片(例如,asahi spectra co.,ltd.制造的lu0422(商品名))等。光照射时的气氛优选为空气气氛或用不活泼气体置换的气氛,更优选为用氮气置换空气直至氧浓度成为1%以下的气氛。
[0486]
半固化工序中,在设置加热半固化工序的情况下,优选以加热后的半固化物在25℃且频率10hz时的复数粘度成为105~108mpa
·
s的方式进行加热半固化。
[0487]
本发明也可以涉及通过上述方法制造的半固化物。这种半固化物能够优选用于后述的固化物的制造方法中。在此,半固化物的复数粘度的优选范围与形成上述半固化物的工序中的半固化物的复数粘度的优选的范围相同。
[0488]
在光照射工序之后,在半固化物中,含有上述成分b的光自由基聚合引发剂可以被完全消耗而不存在,也可以残留含有上述成分b的光自由基聚合引发剂。
[0489]
并且,半固化物的玻璃化转变温度优选为-150~0℃,更优选为-50~0℃,进一步优选为-20~0℃。
[0490]
[形成固化物的工序]
[0491]
形成固化物的工序优选包括聚合工序,该聚合工序中将半固化物装入成型模中进行加压变形,并进行加热而使其热聚合或者通过进行光照射使其光聚合,由此获得固化物。本说明书中,也能够将这种工序称为固化工序。另外,形成固化物的工序中的光照射的条件和加热条件与上述半固化工序中的条件相同。
[0492]
在固化工序是热聚合工序的情况下,还将在聚合工序中所使用的成型模称为热成型用成型模。通常,热成型用成型模优选成为能够组合2个成型模并一边对内容物进行加压一边进行加热的结构。并且,在固化物的制造方法中,获得固化物的热聚合工序中,优选使用模具作为成型模。作为这种热成型用成型模,例如能够使用日本特开2009-126011号公报中所记载的成型模。并且,模具优选为已实施氮化铬处理的模具。
[0493]
在热聚合工序中,对装入成型模的半固化物进行加压变形,并进行加热而使其热聚合来获得固化物。在此,加压变形与加热可以同时进行,也可以在加压变形之后进行加热,还可以在进行加热之后加压变形,其中,优选同时进行加压变形与加热。并且,优选在同时进行加压变形与加热,且加压稳定之后,进一步加热至高温。
[0494]
在热聚合工序中,将半固化物在150℃以上的温度下加热并使其固化而获得固化物。
[0495]
加热温度为150℃以上,优选为160~270℃,更优选为165~250℃,进一步优选为170~230℃。
[0496]
在该固化工序中,优选进行加热的同时进行加压变形。由此,能够将模具内表面的倒置形状精确地转印至固化物上。
[0497]
加压变形时的压力优选为0.098mpa~9.8mpa,更优选为0.294mpa~4.9mpa,进一步优选为0.294mpa~2.94mpa。
[0498]
热聚合的时间优选为30~1000秒钟,更优选为30~500秒钟,进一步优选为60~300秒钟。热聚合时的气氛优选为空气气氛或用不活泼气体置换的气氛,更优选为用氮气置换直至氧浓度成为1%以下的气氛。
[0499]
在固化工序之后设置有脱模工序。在固化工序中进行了热聚合的情况下,在脱模工序中,优选在150~250℃的温度范围内从固化物分离模具。通过使脱模工序中的温度在上述范围内,能够容易从固化物分离模具,且能够提高制造效率。
[0500]
以上,对本发明的固化物的制造方法的一例进行了说明,但本发明的结构并不限定于此,在不脱离本发明的范围内能够适当变更。例如,可以将在转印工序及半固化工序中使用的模具直接用于固化工序,也可以在进行半固化工序之后,从半固化物分离模具,并将该半固化物移动至其他模具(热成型用成型模)而进行固化工序。在该情况下,优选在半固化工序及固化工序中所使用的模具上实施有上述铬处理。
[0501]
并且,在半固化工序中,可以对模具内的固化性组合物进行光照射的同时进行加热。由此,能够可靠地获得具有所希望的固化度的半固化物。
[0502]
[半固化物]
[0503]
能够通过对固化性组合物进行半固化来形成半固化物。半固化物优选通过上述半固化物的制造方法制造而成。并且,半固化物在25℃且频率10hz下的复数粘度优选为105~108mpa
·
s。
[0504]
本发明的固化物也可以通过使上述半固化物固化来形成。
[0505]
<光学部件>
[0506]
本发明的固化物能够优选用于光学部件。
[0507]
光学部件的种类没有特别限制,尤其作为透射光的光学部件(所谓的无源光学部件)能够优选地利用。具备这种光学部件的光学功能装置,例如可例示出各种显示装置(液晶显示器或等离子体显示器等)、各种投影装置(ohp(overhead projector)、液晶投影机等)、光纤通信装置(光波导、光放大器等)、相机或摄像机等摄影装置等。
[0508]
作为无源光学部件,例如可例示出透镜、棱镜、棱镜片、面板(板状成型体)、薄膜、光波导(薄膜状或光纤状等)、光盘、led的密封剂等。在无源光学部件中可以根据需要设置有任意的包覆层或任意的附加功能层。例如,在无源光学部件中可以设置有防止由于摩擦
或磨损引起的涂布面的机械损伤的保护层、吸收成为无机粒子或基材等的劣化原因的不期望的波长的光线的光线吸收层、抑制或防止水分或氧气等反应性低分子透过的透过屏蔽层、防眩层、防反射层、低折射率层等。作为包覆层的具体例,可举出由无机氧化物或无机氮化物涂层形成的透明导电膜或阻气膜、由有机物涂层形成的阻气膜或硬涂层膜等。作为用于形成涂层的涂布法,能够使用真空蒸镀法、cvd法、溅射法、浸涂法、旋涂法等公知的涂布法。
[0509]
[透镜基材]
[0510]
光学部件可以是透镜基材。即,使用本发明的固化性组合物能够制造透镜基材。本说明书中“透镜基材”是指能够发挥透镜功能的单一部件。使用本发明的固化性组合物制造的透镜基材显示低阿贝数且高部分色散比,显示优异的耐光性。优选制成,能够通过适当调整构成固化性组合物的单体的种类而任意调节透镜基材的折射率,并能够进一步兼备高折射性、光线透射性及轻量性的透镜基材。
[0511]
根据透镜的使用环境或用途,在透镜基材的表面或周围能够设置膜或部件。例如,在透镜基材的表面能够形成保护膜、防反射膜、硬涂膜等。并且,能够制成使用本发明的固化物制造而成的透镜基材与选自玻璃透镜基材及塑料透镜基材等中的其他一个以上的透镜基材(以下,称为“其他透镜基材”。)层叠而成的复合透镜。
[0512]
例如通过在其他透镜基材上将本发明的固化性组合物光固化而形成半固化物,通过对所获得的半固化物进行加热来形成固化物,由此能够制造这种复合透镜。对于半固化工序及形成固化物的工序,分别能够优选适用上述记载。本发明的固化性组合物的耐光性优异,并且光固化灵敏度也优异,因此能够获得优异的品质的复合透镜。在本发明中,光固化灵敏度优异是指能够通过光固化反应由液态的固化性组合物获得凝胶状或橡胶状的半固化物。
[0513]
透镜基材的周围可以嵌入并固定于基材保持框等中。但是,这些膜或框架等为附加于透镜基材的部件,与在本说明书中所指的透镜基材本身有区分。
[0514]
在利用透镜基材作为透镜时,可以将透镜基材本身单独用作透镜,也可以附加上述膜或框架、其它透镜基材等来用作透镜。使用了透镜基材的透镜的种类或形状没有特别限制,最大厚度优选为0.1~10mm。最大厚度更优选为0.1~5mm,进一步优选为0.15~3mm。并且,透镜基材的最大直径优选为1~1000mm的圆形状。最大直径更优选为2~200mm,进一步优选为2.5~100mm。
[0515]
透镜基材优选用于移动电话或数码相机等摄像用透镜或电视机、摄像机等摄影透镜以及车载透镜、内窥镜透镜。
[0516]
<接合透镜>
[0517]
通过将使用本发明的固化性组合物制造而成的透镜基材或透镜使用其他透镜和透镜用粘接剂进行粘接,能够制造接合透镜。
[0518]
[其他透镜]
[0519]
其他透镜的种类没有特别限定,例如可举出圆盘状的凸透镜、凹透镜、弯月形透镜、非球面透镜、具有圆筒面状的透镜面的柱面透镜、球形透镜、棒状透镜等。并且,其他透镜的材料没有特别限定,只要是玻璃透镜、树脂透镜或复合透镜即可。
[0520]
(玻璃透镜)
[0521]
作为玻璃透镜,能够不受限制地使用公知的透镜。作为市售的玻璃透镜,例如可举出ohara inc.制造的bk7(商品名)。
[0522]
在复合透镜包括玻璃透镜时也能够使用相同的玻璃透镜。
[0523]
(树脂透镜、复合透镜)
[0524]
树脂透镜是指由树脂固化物构成的透镜。
[0525]
在本说明书中,复合透镜是指包含由玻璃构成的层和树脂层的透镜。树脂层是由树脂固化物构成的层。复合透镜中所包含的各层可以是透镜(单透镜),在该情况下,优选各单透镜的光轴(连接两个球面的曲率中心的线)一致。复合透镜可以在表面具有树脂层,也可以在内部具有树脂层。
[0526]
[透镜用粘接剂]
[0527]
作为透镜用粘接剂,能够不受限制地使用公知的粘接剂。
[0528]
作为透镜用粘接剂,尤其优选使用含有由通式(1)表示的化合物的透镜用粘接剂。含有由通式(1)表示的化合物的透镜用粘接剂吸收紫外光,另一方面对紫外线照射的坚牢性优异,因此通过使用该透镜用粘接剂,能够获得作为接合透镜光稳定性高的固化物。并且,由含有由通式(1)表示的化合物的透镜用粘接剂形成的粘接层的耐热冲击性高。
[0529]
(由通式(1)表示的化合物)
[0530]
[化学式35]
[0531]
pol1sp
e-l
1-ar
21-l
2-sp
f-po12ꢀꢀ
通式(1)
[0532]
上述式中,ar
21
是由下述通式(21-1)~通式(21-4)中的任一式表示的芳香环基。
[0533]
[化学式36]
[0534][0535]
上述式中,q1表示-s-、-o-或nr
11-,r
11
表示氢原子或碳原子数1~6的烷基。
[0536]
y1表示可以具有取代基的碳原子数1~6的烷基、可以具有取代基的碳原子数6~12的芳香族烃基或可以具有取代基的碳原子数3~12的芳香族杂环基。
[0537]
z1、z2及z3分别独立地表示氢原子、可以具有取代基的碳原子数1~20的脂肪族烃基、可以具有取代基的碳原子数1~20的烷氧基、可以具有取代基的碳原子数3~20的脂环式烃基、可以具有取代基的1价碳原子数6~20的芳香族烃基、卤原子、氰基、硝基、-nr
12r13
或sr
12
,z1及z2可以彼此键合而形成可以具有取代基的芳香族烃环或可以具有取代基的芳香族杂环,r
12
及r
13
分别独立地表示氢原子或碳原子数1~6的烷基。
[0538]
a1及a2分别独立地表示选自由-o-、-nr
21-(r
21
表示氢原子或取代基。)、-s-及-c(=o)-组成的组中的基团,x表示o(氧原子)、s(硫原子)、键合有氢原子或者取代基的c(碳原
子)、或键合有氢原子或者取代基的n(氮原子)。
[0539]
ax表示具有选自由芳香族烃环及芳香族杂环组成的组中的至少一个芳香环的碳原子数1~30的有机基团,ay表示氢原子、可以具有取代基的碳原子数1~6的烷基或具有选自由芳香族烃环及芳香族杂环组成的组中的至少一个芳香环的碳原子数1~30的有机基团,ax及ay所具有的芳香环可以具有取代基,ax与ay可以彼此键合而形成可以具有取代基的环。
[0540]
q2表示氢原子或可以具有取代基的碳原子数1~6的烷基。
[0541]
另外,*表示与l1或l2的键合位置。
[0542]
关于通式(21-1)~(21-4)中的各取代基的定义及优选的范围,关于y1、z1、z2能够参考日本特开2012-21068号公报中记载的关于化合物(a)的与y1、q1及q2有关的记载,关于a1、a2及x能够参考日本特开2008-107767号公报中记载的关于由通式(i)表示的化合物的与a1、a2及x有关的记载,关于通式(21-3)的ax、ay及q2能够参考wo2013/018526中记载的关于由通式(i)表示的化合物的与a
x
、ay及q1有关的记载,关于通式(21-4)的ax、ay及q2能够参考wo2013/018526中记载的关于由通式(ii)表示的化合物的与aa、ab及q
11
有关的记载。关于z2能够参考日本特开2012-21068号公报中记载的关于化合物(a)的与q1有关的记载。
[0543]
通式(21-2)中的x优选为键合有2个取代基的c,a1、a2优选均为-s-。在通式(21-3)中作为ax及ay彼此键合而形成可以具有取代基的环时的环,优选为脂环式烃环、芳香族烃环或芳香族杂环,更优选为芳香族杂环。在通式(21-4)中作为ax及ay彼此键合而形成可以具有取代基的环时的环,优选为不饱和烃环。
[0544]
通式(1)中的ar
21
优选为由通式(21-2)表示的芳香环基。
[0545]
作为由通式(21-2)表示的芳香环基,尤其优选为由下述通式(21-2-1)表示的芳香环基。
[0546]
[化学式37]
[0547][0548]
式中,rz表示取代基。作为rz所表示的取代基的例子,可举出后述的作为spd的取代基例示的取代基等。2个rz可以相同或不同。并且,2个rz也可以键合而形成环。此时所形成的环优选为5元环或6元环,更优选为包含氮或氧作为构成环的原子的5元环或6元环。尤其优选为由以下任一个式表示的环。
[0549]
[化学式38]
[0550][0551]
在上述式中,*分别表示在通式(21-2-1)中2个rz所键合的碳原子的位置。并且,由上述式表示的环可以在氮原子或碳原子中具有取代基。作为此时的取代基,优选为碳原子数1~6的烷基,更优选为直链的碳原子数1~4的烷基。
[0552]
作为由通式(21-2-1)表示的芳香环基,优选为至少任一个rz为氰基的芳香环基或2个rz键合而形成环的芳香环基,更优选为2个rz均为氰基的芳香环基。
[0553]
这是因为在含有这种具有芳香环基的由通式(1)表示的化合物的透镜用粘接剂中,能够更显著地获得保持可见光区域中的高透射性,并且提高紫外线区域的吸收的效果。
[0554]
通式(1)中,l1及l2的含义分别独立地与上述l的含义相同,优选的范围也相同。
[0555]
通式(1)中,spe及spf的含义分别独立地与上述sp的含义相同,优选的范围也相同。
[0556]
通式(1)中,pol1及pol2的含义分别独立地与上述pol的含义相同,优选的范围也相同。
[0557]
作为pol
1-sp
e-l
1-或pol
2-sp
f-l
2-的具体的结构的例子,可举出与对上述pol-sp-l-所举出的例子相同的例子。
[0558]
以下,列举本发明的透镜用粘接剂中优选使用的由通式(1)表示的化合物的具体例,但并不限定于以下化合物。另外,以下结构式中的me表示甲基,et表示乙基,npr表示正丙基,ipr表示异丙基,nbu表示正丁基,tbu表示叔丁基。
[0559]
[化学式39]
[0560][0561]
[化学式40]
[0562][0563]
[化学式41]
[0564]
[0565]
[化学式42]
[0566][0567]
[化学式43]
[0568][0569]
[化学式44]
[0570][0571]
[化学式45]
[0572][0573]
由通式(1)表示的化合物有时具有1个或2个以上的不对称碳,对于这种不对称碳的立体化学,能够分别独立地采用(r)体或(s)体中的任一个。并且,由式(a)表示的化合物可以是光学异构体或非对映异构体等立体异构体的混合物。即,由式(a)表示的化合物可以是任意一种立体异构体,也可以是立体异构体的任意的混合物,还可以是外消旋体。
[0574]
相对于透镜用粘接剂的总质量,透镜用粘接剂中的由通式(1)表示的化合物的含量优选为10质量%~90质量%,更优选为15质量%~85质量%,进一步优选为20质量%~80质量%。通过设为90质量%以下,能够使粘度在优选的范围内。
[0575]
透镜用粘接剂中可以含有两种以上由通式(1)表示的化合物。在含有两种以上由通式(1)表示的化合物的情况下,优选合计含量在上述范围内。
[0576]
(聚合物)
[0577]
透镜用粘接剂可以以调整粘度或固化物的杨氏系数的目的,含有聚合物或低聚物(以下还称为“聚合物”)。作为聚合物,没有特别限制,优选为具有烯属不饱和基团的聚合物。烯属不饱和基团可以包含在聚合物的主链内部、主链末端及侧链中的任一者中。作为烯属不饱和基团,没有特别限制,优选为源自丁二烯或异戊二烯的烯属不饱和键或(甲基)丙烯酰基。
[0578]
作为透镜用粘接剂中所含有的聚合物,优选为选自由共轭二烯系聚合物及具有烯属不饱和基团的聚氨酯树脂组成的组中的聚合物,更优选为选自由具有聚丁二烯结构的聚合物、具有聚异戊二烯结构的聚合物及氨基甲酸酯(甲基)丙烯酸酯组成的组中的聚合物。
[0579]
作为具有聚丁二烯结构的聚合物,作为市售品,例如能够获得nipol br系列(zeon corporation制造)、ubepol br系列(ube industries,ltd.制造)、nisso-pb系列(nippon soda co.,ltd.制造)、claprene lbr系列、claprene l-sbr系列(kuraray co.,ltd制造)等。
[0580]
作为具有聚异戊二烯结构的聚合物,作为市售品,例如能够获得nipol ir系列(zeon corporation制造)、claprene lir系列、claprene uc系列(kuraray co.,ltd制造)等。
[0581]
作为氨基甲酸酯(甲基)丙烯酸酯,作为市售品,例如能够获得紫光(注册商标)系列的uv-3200、uv-3000b、uv-3700b、uv-3210ea、uv-2000b、uv-3630(以上,nippon synthetic chemical industry co.,ltd.制造)、ebecryl230、ebecryl9227ea(以上,daicel scitech co.,ltd.)、hi-corp au(注册商标)系列的au-3040、au-3050、au-3090、au-3110、au-3120(以上,tokushiki co.,ltd.制造)等。
[0582]
聚合物的分子量以重均分子量(gpc、聚苯乙烯换算)计,优选为1,000以上,更优选为3,000以上,进一步优选为5,000以上。并且,聚合物的分子量以重均分子量(gpc、聚苯乙烯换算)计,优选为500,000以下,更优选为300,000以下,进一步优选为100,000以下。
[0583]
相对于透镜用粘接剂的总质量,聚合物的含量优选为50质量%以下,更优选为40质量%以下,进一步优选为30质量%以下。
[0584]
((甲基)丙烯酸酯单体)
[0585]
透镜用粘接剂也可以含有(甲基)丙烯酸酯单体。作为(甲基)丙烯酸酯单体,能够使用与关于上述固化性组合物举出的单体相同的单体。
[0586]
作为透镜用粘接剂中所含有的作为(甲基)丙烯酸酯单体优选的例子,能够举出苯氧乙基丙烯酸酯(上述单体1)或丙烯酸苄酯等具有芳香环的单官能(甲基)丙烯酸酯单体、单体a(丙烯酸2-乙基己酯)、单体b(1,6-己二醇二丙烯酸酯)、单体c(1,6-己二醇二甲基丙烯酸酯)等具有脂肪族基团的(甲基)丙烯酸酯单体、单体d(丙烯酸2-羟基乙酯)、单体e(丙烯酸羟丙酯)或单体f(丙烯酸4-羟基丁酯)等具有羟基的(甲基)丙烯酸酯单体。
[0587]
[化学式46]
[0588][0589]
对于(甲基)丙烯酸酯单体的获得方法没有特别限制,可以通过商业手段获得,也可以通过合成来制造。在通过商业手段获得的情况下,例如能够优选使用viscort#192pea(苯氧乙基丙烯酸酯)(osaka organic chemical ind.ltd.制造)、viscort#160bza(丙烯酸苄酯)(osaka organic chemical ind.ltd.制造)、2eha(单体a)(toagosei co.,ltd.制造)、a-hd-n(单体b)(shin-nakamura chemical co.,ltd.制造)、hd-n(单体c)(shin-nakamura chemical co.,ltd.制造)、hea(单体d)(osaka organic chemical ind.ltd.制造)、light ester hop-a(n)(单体e)(kyoeishachemical co.,ltd.制造)、4-hba(单体f)(osaka organic chemical ind.ltd.制造)。
[0590]
在透镜用粘接剂含有(甲基)丙烯酸酯单体的情况下,相对于透镜用粘接剂的总质量,(甲基)丙烯酸酯单体的含量优选为5~90质量%,更优选为10~85质量%,进一步优选为20~80质量%。通过调整透镜用粘接剂中的(甲基)丙烯酸酯单体量,能够调整缓和固化
物因热而变形时的应力的功能。
[0591]
(聚合引发剂)
[0592]
透镜用粘接剂优选含有光自由基聚合引发剂。作为光自由基聚合引发剂,能够适用在上述固化性组合物中记载的成分b及其他光自由基聚合引发剂所涉及的记载。
[0593]
并且,除了光自由基聚合引发剂以外,透镜用粘接剂还可以含有热自由基聚合引发剂。通过进一步含有热自由基聚合引发剂,能够促进光无法到达的区域的固化。作为热自由基聚合引发剂,能够以相同的量使用与关于上述固化性组合物举出的引发剂相同的引发剂。
[0594]
[接合透镜的制造]
[0595]
接合透镜能够通过以下方式获得,即经由透镜用粘接剂叠加2个透镜之后,使粘接剂固化而如后述那样形成粘接层。优选在上述叠加之后,去除混入到粘接剂中的气泡之后进行固化。
[0596]
粘接剂的固化能够通过光照射或加热来实施。优选至少通过实施光照射来进行固化。并且,可以在进行光照射之后进一步实施加热的工序。
[0597]
粘接层的厚度优选为10~50μm,更优选为20~30μm。通过设为10μm以上的厚度,能够充分获得紫外线吸收的效果。并且,通过设为50μm以下的厚度,能够在表现出高粘接性的同时,提高可见光的短波长区域(400~430nm)中的透射率。
[0598]
粘接层的波长587nm下的折射率优选为1.51以上,更优选为1.53以上,进一步优选为1.55以上。这是因为与所接合的透镜的折射率的差异变小。
[0599]
并且,在膜厚30μm的粘接层中,截止波长优选为380nm以下,更优选为385nm以下,进一步优选为390nm以下。另外,在此,将粘接层的透射率成为0.5%以下的波长定义为截止波长。粘接层的透射率能够使用分光光度计(例如shimadzu corporation制造的uv-2550)来进行测定。
[0600]
通过透镜用粘接剂中的由通式(1)表示的化合物的量能够将粘接层的折射率和截止波长调整为上述范围。
[0601]
实施例
[0602]
以下,根据实施例对本发明进一步详细地进行说明。以下的实施例中所示的材料、使用量、比例、处理内容、处理步骤等在不脱离本发明的主旨的范围内能够进行适当的变更。因此,本发明的范围不应被以下所示的具体例进行限定性解释。
[0603]
另外,在使用黄色灯作为照明的环境下进行了固化性组合物的制备工序及使用制备后的固化性组合物直至用于固化物的制作的保管工序。
[0604]
(合成例)
[0605]
如下合成了由通式(a)表示的化合物。
[0606]
<合成例1:化合物(vi-2)的合成>
[0607]
[化学式47]
[0608][0609]
[化合物(vi-2db)的合成]
[0610]
将2,4-二氯-6,7-二甲氧基喹唑啉(vi-2da)5.0g(19.3mmol)、苯基硼酸7.1g(57.9mmol)、二氯双[二叔丁基(对二甲基氨基苯基)膦基]钯(ii)1.1g、1,4-二噁烷100ml、饱和碳酸氢钠水溶液100ml在氮气氛下进行了混合。在内温85℃下搅拌2小时之后,冷却至25℃并添加乙酸乙酯300ml、水200ml,进行了清洗、分液。然后,进行浓缩,通过柱色谱法进行提纯,获得了化合物(vi-2db)。(产率77%)
[0611]
[化合物(vi-2d)的合成]
[0612]
在将化合物(vi-2db)5.0g、吡啶盐酸盐50g进行混合之后,在氮气氛下,在190℃下搅拌了4小时。然后,在80℃下滴加水300ml,析出固体之后,冷却至25℃。过滤固体后,用容积比3:1的水-甲醇混合溶剂进行清洗,获得了化合物(vi-2d)。(产率95%)
[0613]
[化合物(vi-1a)的合成]
[0614]
按照日本特开2016-053149号公报的0113段中记载的方法,合成了化合物(vi-1a)。
[0615]
[化合物(vi-2)的合成]
[0616]
将羧酸化合物(vi-1a)20.1g(67.4mmol)、乙酸乙酯185ml、n,n-二甲基乙酰胺46ml及2,6-二叔丁基-4-甲基苯酚60mg进行混合,并将内温冷却至0℃。在内温0~5℃下,向混合物中滴加了亚硫酰氯7.75g(65.1mmol)。在5℃下搅拌60分钟之后,在内温0~8℃下滴加了化合物(vi-2d)8.7g(27.6mmol)及thf52ml的溶液。
[0617]
然后,在内温0~10℃下滴加了n,n-二异丙基乙胺16.8g。在内温20~25℃下搅拌1小时之后,添加乙酸乙酯40ml、水165ml及浓盐酸14ml,进行了清洗。将有机层用饱和食盐水140ml进行清洗、分液,接着,用饱和食盐水100ml、7.5wt%碳酸氢钠水溶液10ml进行了清洗、分液。然后,进行浓缩,获得油状的组合物之后,通过柱色谱法提纯,获得了化合物(vi-2)。(产率38%)
[0618]1h-nmr(300mhz,cdcl3):δ(ppm)1.40-1.60(m,8h),1.60-1.80(m,8h),2.00-2.20(m,8h),2.20-2.40(m,4h),4.15(t4h),4.24(t4h),5.84(dd,2h),6.05-6.15(m,2h),6.40(dd,2h)、7.35(s,2h)、7.45-7.55(m,6h)、7.60-7.70(m,4h)
[0619]
<合成例2:化合物(i-1)的合成>
[0620]
[化学式48]
[0621][0622]
[化合物(i-1db)的合成]
[0623]
将1,2-苯二胺(i-1da)5.0g(46.2mmol)、对茴香基12.5g(46.2mmol)、乙酸80ml进行混合之后,添加了2-碘氧基苯甲酸125mg。在25℃下搅拌2小时之后,过滤析出的化合物(i-db),用甲醇50ml进行了清洗。(产率65%)
[0624]
[化合物(i-1d)的合成]
[0625]
将合成例1的化合物(vi-2d)的合成中的化合物(vi-2db)变更为化合物(i-db),除此以外,以相同的方法获得了化合物(i-1d)。(产率93%)
[0626]
[化合物(i-1)的合成]
[0627]
使用化合物(i-1a)和化合物(i-1d),按照上述方案获得了化合物(i-1)。(产率75%)
[0628]1h-nmr(300mhz,cdcl3):δ(ppm)2.80(t4h)、2.92(t4h)、4.30-4.40(m,8h)、5.85(d,2h)、6.05-6.15(m,2h)、6.43(d,2h)、7.10(d,4h)、7.70(d、4h)、7.70-7.80(m,2h)、8.10-8.20(m,2h)
[0629]
<合成例3:化合物(a-28)的合成>
[0630]
按照wo2017/115649的0139段的记载,合成了化合物(a-28)。
[0631]
<合成例4:化合物(a-1)的合成>
[0632]
[中间体4的合成]
[0633]
按照wo2017/115649的0133段的记载,合成了中间体4。
[0634]
[化学式49]
[0635][0636]
[化合物(a-1)的合成]
[0637]
向200ml的三口烧瓶中添加4.8g中间体4、单(2-丙烯酰氧基乙基)琥珀酸酯6.5g、
8.14ppm(d,1h)、9.40ppm(bs,2h)
[0651]
[化合物(a-35)的合成]
[0652]
在合成例4的化合物(a-1)的合成中,将中间体4变更为中间体2,且将单(2-丙烯酰氧基乙基)琥珀酸酯变更为单(2-甲基丙烯酰氧基乙基)琥珀酸酯,除此以外,以相同的方法获得了化合物(a-35)。
[0653]1h-nmr(300mhz,dmso-d6):δ1.80ppm(s、6h)、2.47ppm(s、3h)、2.49ppm(s、3h)、2.62-2.72ppm(m,4h)、2.80-2.90ppm(m,4h)、4.25-4.35ppm(m,8h)、5.58ppm(s、2h)、5.97ppm(s、2h)、7.00-7.10ppm(d,4h)、7.20-7.30ppm(d,4h)、7.55-7.70ppm(m,3h)、7.84ppm(s,1h)、7.93ppm(s,1h)、8.16-8.22ppm(d,1h)
[0654]
<实施例1:固化性组合物及其固化物>
[0655]
(1)固化性组合物的制备
[0656]
以成为下述表中记载的组成的方式混合各成分,进行搅拌使其均匀,由此制备了固化性组合物。
[0657]
(2)光固化样品的制作
[0658]
将所制备的固化性组合物注入到直径20mm的圆形透明玻璃模具(用二氯二甲基硅烷对表面进行疏水处理的硼硅酸盐玻璃制)中,使固化物的厚度成为1mm。使用execure3000(商品名,hoya corporation制造)作为光源,在光源与透明玻璃模具之间配置短波长截止滤光片lu0422(商品名,asahi spectra co.,ltd.制造)之后,在进行氮取代以使氧浓度成为1%以下的气氛下,从透明玻璃模具的上方照射1000mj/cm2的紫外线,制作了光固化样品。
[0659]
[评价1:光固化灵敏度]
[0660]
对于上述中获得的光固化样品,进行与玻璃型内的样品表面(相对于紫外线照射装置最近侧的面)接触时的官能评价,按照以下基准评价了光固化灵敏度。在本发明中,“b”以上为合格。
[0661]-评价基准-[0662]
a:硬橡胶状(无粘性)
[0663]
b:软凝胶状(有粘性)
[0664]
c:固化不良(液态)
[0665]
(3)固化物的制作
[0666]
将上述中获得的光固化样品在氧浓度1%以下的气氛下,在200℃下加热30分钟,由此制作了固化物。
[0667]
通过经过该加热工序完成固化反应,任何固化物均以完全固化的固化物获得。
[0668]
[评价2:照射试验前的透射率]
[0669]
使用紫外可见分光光度计uv-2600(商品名,shimadzu corporation制造),对所获得的固化物进行中心部(直径5mm)的紫外-可见透射率测定,求出波长430nm下的透射率(照射试验前)。
[0670]
[评价3:照射试验后的透射率]
[0671]
在以下条件下对所制作的固化物实施了氙光照射试验。该照射试验相当于太阳光环境下的耐光性加速试验。
[0672]
对于进行上述氙光照射试验后的固化物,通过上述评价2:照射试验前的透射率中
记载的方法,求出了波长430nm下的透射率(照射试验后)。
[0673]
(氙光照射条件)
[0674]
装置:氙促进耐候性试验机q-sun xe-1(商品名,q-lab corporation制造)
[0675]
光源:氙弧灯
[0676]
滤光器:extended uv q/b(商品名,q-lab corporation制造)
[0677]
照度:0.43w/m2(340nm照度计)
[0678]
黑色面板温度:63℃
[0679]
试验时间:8小时
[0680]
<光学特性测定>
[0681]
关于“折射率(nd)”、“阿贝数(νd)”及“部分色散比(θg,f)”,注入了以固化物的厚度成为2mm的方式制备的固化性组合物,除此以外,以与上述相同的方式制作固化物,加工成v字嵌段状之后,使用kalnew精密折射计kpr-2000(shimadzu device corporation制造)进行了测定。在25℃下对各样品进行3次测定,将平均值作为测定结果。
[0682]“折射率(nd)”是波长587.56nm下的折射率。并且,“阿贝数(νd)”及“部分色散比(θg,f)”是根据不同的波长下的折射率测定值通过下述式计算的值。
[0683]
νd=(nd-1)/(nf-nc)
[0684]
θg,f=(ng-nf)/(nf-nc)
[0685]
在此,nd表示波长587.56nm下的折射率,nf表示波长486.13nm下的折射率,nc表示波长656.27nm下的折射率,ng表示波长435.83nm下的折射率。
[0686]
由固化性组合物no.101~117获得的固化物的阿贝数均低至26~20,部分色散比高至0.72~0.86,满足色差校正透镜所需要的折射率的异常分散性。
[0687]
[0688]
[0689][0690]
<表注>
[0691]
表中的各成分如下所述。另外,各成分的配合量比是质量基准。
[0692]
(成分a)
[0693]
[化学式51]
[0694][0695]
(成分b)
[0696]
irg819:irgacure 819(商品名,basf japan公司制造)
[0697]
[化学式52]
[0698][0699]
irgtpo:irgacure tpo(商品名,basf japan公司制造)
[0700]
[化学式53]
[0701][0702]
(成分c)
[0703]
[化学式54]
[0704][0705]
(成分d)
[0706]
[化学式55]
[0707][0708]
(其他成分)
[0709]
[化学式56]
[0710][0711]
(热聚合引发剂)
[0712]
perbutyl d:商品名,nof corporation制造,二叔己基过氧化物
[0713]
(比较用光聚合引发剂)
[0714]
irg907:irgacure 907(商品名,basf japan公司制造)
[0715]
[化学式57]
[0716][0717]
(紫外线吸收剂)
[0718]
tinuvin 99-2:商品名,basf japan公司制造
[0719]
tinuvin 405:商品名,basf japan公司制造
[0720]
tinuvin 120:商品名,basf japan公司制造
[0721]
[化学式58]
[0722][0723]
由表1的结果可知以下内容。
[0724]
从不含有作为成分c的胺化合物的方面考虑,比较固化性组合物no.c01不是本发明中规定的固化性组合物。可知,由该比较固化性组合物no.c01获得的固化物的光照射试验前的透射率优异,但通过光照射试验,透射率下降。并且,从使用作为光稳定剂已知的化合物来代替作为成分c的胺化合物的方面考虑,比较固化性组合物no.c02~c04不是本发明
中规定的固化性组合物。可知,由这些比较固化性组合物no.c02~c04获得的固化物与由比较固化性组合物no.c01获得的固化物相比,光照射试验前后的透射率均没有差异,没有获得通过光照射抑制透射率的下降的效果。
[0725]
并且,参考例的固化性组合物no.r01含有与酰基氧化膦光聚合引发剂不同的光聚合引发剂。由该参考例的固化性组合物no.r01获得的固化物与由比较固化性组合物no.c01获得的固化物相比,光照射试验的透射率的下降幅度小。由该对比可知,通过作为成分a的由通式(a)表示的聚合性化合物和作为成分b的酰基氧化膦光聚合引发剂的组合,会产生因光照射引起的透射率的下降的问题。并且,从光固化灵敏度的方面考虑,参考例的固化性组合物no.r01本来就差。若光固化灵敏度差,则在用于复合透镜的制作时会成为模具转印性不充分或混入气泡等的原因,因此从用于复合透镜的制作的观点出发,不优选。
[0726]
与此相对,可知由本发明的固化性组合物no.101~117获得的固化物的光照射试验前的透射率均优异,而且在光照射试验后也显示优异的透射率,可知能够抑制透射率的下降。
[0727]
如此,由于由本发明的固化性组合物获得的固化物具有优异的耐光性,因此即使长期在户外等光照射环境下使用含有该固化物作为构成部件的光学部件及透镜,也能够抑制着色。而且,本发明的固化性组合物的光固化灵敏度也优异,因此能够优选用于复合透镜的制作。
[0728]
<实施例2:复合透镜l-1的制作>
[0729]
参考国际公开第2017/115649号的记载如下进行了制作。
[0730]
在表面被进行氮化铬处理的成型模具中注入200mg固化性组合物no.104,以覆盖不与固化性组合物的成型模具接触的一侧的所有表面的方式覆盖透明的玻璃透镜(玻璃材料=bk7,直径33mm,中心厚度3mm,与固化性组合物接触的面的曲率半径=44.3mm,不与固化性组合物接触的面的曲率半径=330.9mm的凸透镜),并以固化性组合物的直径成为30mm的方式将其展开。设为该状态之后,使用execure3000(hoya corporation制造)作为光源,从玻璃透镜的上方照射了300mj/cm2的紫外线。此时,在光源与玻璃透镜之间配置了短波长截止滤光片lu0422(asahi spectra co.,ltd.制造)。
[0731]
接着,在保持被成型模具及玻璃透镜夹住的状态下,一边对固化性组合物施加0.196mpa(2kgf/cm2)的压力,一边升温至200℃。然后,以0.05mm/sec的速度分离固化性组合物的固化物和成型模具,由此制作了复合透镜l-1。
[0732]
[评价4:复合透镜l-1的耐光性评价]
[0733]
与实施例1同样地,进行所获得的透镜l-1的中心部(直径5mm)的紫外-可见透射率测定,求出波长430nm下的透射率,结果为84%。并且,在与实施例1相同的条件下实施氙光照射试验之后,求出波长430nm下的透射率,结果为82%。这表示使用本发明的固化性组合物no.104制作的复合透镜具有不逊色于在实施例1中使用本发明的固化性组合物no.104制作的圆形固化物的优异的耐光性。并且,表示使用本发明的固化性组合物no.101~103、105~117制作的复合透镜也具有不逊色于在实施例1中使用对应的固化性组合物制作的圆形固化物的优异的耐光性。
[0734]
如此,使用本发明的固化性组合物制作的复合透镜具有不逊色于使用本发明的固化性组合物制作的固化物的优异的耐光性。
[0735]
对本发明及其实施方式进行了说明,但我们认为,只要不特别指定,则我们的发明并不限定于说明的任何细节上,应该在不违背所附权利要求书中所示的发明的精神和范围的情况下广泛地进行解释。
[0736]
本技术主张基于2019年12月24日在日本技术专利的日本特愿2019-232629的优先权,在此参考这些并将其内容作为本说明书中记载的一部分而引用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1