1.本说明书主张于2019年12月20日在韩国知识产权局提出申请的韩国专利申请案第10-2019-0171467号的优先权及权利,所述韩国专利申请案的全部内容并入本案供参考。
2.本说明书涉及一种杂环化合物以及一种包括其的有机发光元件。
背景技术:
3.电致发光元件为一种自发光显示元件,且具有视角宽、及响应速度快以及对比度优异的优点。
4.有机发光元件具有在两个电极之间设置有机薄膜的结构。当向具有此种结构的有机发光元件施加电压时,自所述两个电极注入的电子及空穴在有机薄膜中结合成对,且当该些电子及空穴湮灭时发光。有机薄膜可根据需要形成为单层或多层。
5.有机薄膜的材料可根据需要具有发光功能。举例而言,作为有机薄膜的材料,可使用能够自身单独形成发光层的化合物,或者亦可使用能够发挥基于主体-掺杂剂的发光层的主体或掺杂剂的作用的化合物。除此之外,能够发挥空穴注入、空穴传输、电子阻挡、空穴阻挡、电子传输、电子注入等作用的化合物亦可用作有机薄膜的材料。
6.为增强有机发光元件的效能、寿命或效率,一直需要开发有机薄膜材料。
7.先前技术文献
8.(专利文献1)美国专利第4,356,429号
技术实现要素:
9.技术问题
10.本说明书涉及提供一种杂环化合物以及一种包括其的有机发光元件。
11.技术解决方案
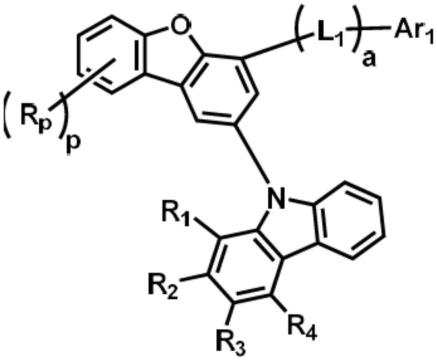
12.本技术案的一个实施例提供一种由以下化学式1表示的杂环化合物。
13.[化学式1]
[0014][0015]
在化学式1中,
[0016]
l1为直接键;具有6至60个碳原子的经取代或未经取代的亚芳基;或者具有2至60个碳原子的经取代或未经取代的亚杂芳基,
[0017]
x1为o;或s,
[0018]rp
为氢;氘;卤素基;氰基;具有1至30个碳原子的经取代或未经取代的烷基;或具有3至30个碳原子的经取代或未经取代的环烷基,
[0019]
r1至r8彼此相同或不同,且各自独立地选自由氢;氘;具有6至60个碳原子的经取代或未经取代的芳基;及具有2至60个碳原子的经取代或未经取代的杂芳基组成的群组,或者彼此相邻的二或更多个基团彼此键结以形成具有6至60个碳原子的经取代或未经取代的芳族烃环、或具有2至60个碳原子的经取代或未经取代的杂环,
[0020]
ar1为具有6至60个碳原子的经取代或未经取代的芳基;具有2至60个碳原子的经取代或未经取代的杂芳基;或者未经取代的胺基或经选自由具有6至40个碳原子的经取代或未经取代的芳基及具有2至40个碳原子的经取代或未经取代的杂芳基组成的群组中的一者或多者取代的胺基,
[0021]
a为0至2的整数,且当a为2时,括弧中的取代基彼此相同或不同,且
[0022]
p为0至4的整数,且当p为2或大于2时,括弧中的取代基彼此相同或不同。
[0023]
本技术案的另一实施例提供一种有机发光元件,所述有机发光元件包括:第一电极;第二电极;以及一或多个有机材料层,设置于所述第一电极与所述第二电极之间,其中所述有机材料层中的一或多个层包含由化学式1表示的所述杂环化合物。
[0024]
有益效果
[0025]
本说明书中所述的杂环化合物可用作有机发光元件的有机材料层的材料。在有机发光元件中,所述杂环化合物能够发挥空穴注入材料、空穴传输材料、发光材料、电子传输材料、电子注入材料等的作用。
[0026]
具体而言,当在有机发光元件的有机材料层中使用由化学式1表示的杂环化合物时,可降低元件的驱动电压,可提高光效率,且可增强元件的寿命性质。
附图说明
[0027]
图1至图3是各自示出根据本技术案的一个实施例的有机发光元件的层叠结构的图。
[0028]
《符号说明》
[0029]
100:基板
[0030]
200:阳极
[0031]
300:有机材料层
[0032]
301:空穴注入层
[0033]
302:空穴传输层
[0034]
303:发光层
[0035]
304:空穴阻挡层
[0036]
305:电子传输层
[0037]
306:电子注入层
[0038]
400:阴极
具体实施方式
[0039]
以下,将更详细地阐述本说明书。
[0040]
在本说明书中,除非特别进行与此相反的陈述,否则某一部分“包含(including)”某些构成部分意指能够还包括其他构成部分,且不排除其他构成部分。
[0041]
在本说明书中,用语“取代(substitution)”意指键结至化合物的碳原子的氢原子变为另一取代基,且取代的位置不受限制,只要其为氢原子被取代的位置(亦即,取代基可进行取代)的位置即可,且当二或更多个取代基进行取代时,所述二或更多个取代基可彼此相同或不同。
[0042]
在本说明书中,“经取代或未经取代的”意指未经取代或经一个或多个由下列所构成的族群中选出的取代基取代:具有1至60个碳原子的直链或支链烷基;具有2至60个碳原子的直链或支链烯基;具有2至60个碳原子的直链或支链炔基;具有3至60个碳原子的单环或多环环烷基;具有2至60个碳原子的单环或多环杂环烷基;具有6至60个碳原子的单环或多环芳基;具有2至60个碳原子的单环或多环杂芳基;硅烷基;氧化膦基;及胺基,或者经连接两个或大于两个由上文族群中示出的取代基中选出的取代基的取代基取代。
[0043]
更具体而言,在本说明书中“经取代或未经取代的”意指被选自由具有6至60个碳原子的单环或多环芳基;或者具有2至60个碳原子的单环或多环杂芳基组成的群组中的一或多个取代基取代。
[0044]
在本说明书中,卤素可为氟、氯、溴或碘。
[0045]
在本说明书中,烷基包括具有1至60个碳原子的直链或支链烷基,且可进一步经其他取代基取代。烷基的碳原子数可为1至60、具体而言为1至40且更具体而言为1至20。其具体实例可包括甲基、乙基、丙基、正丙基、异丙基、丁基、正丁基、异丁基、第三丁基、第二丁基、1-甲基-丁基、1-乙基-丁基、戊基、正戊基、异戊基、新戊基、第三戊基、己基、正己基、1-甲基戊基、2-甲基戊基、4-甲基-2-戊基、3,3-二甲基丁基、2-乙基丁基、庚基、正庚基、1-甲基己基、环戊基甲基、环己基甲基、辛基、正辛基、第三辛基、1-甲基庚基、2-乙基己基、2-丙基戊基、正壬基、2,2-二甲基庚基、1-乙基-丙基、1,1-二甲基-丙基、异己基、2-甲基戊基、4-甲基己基、5-甲基己基等,但不限于此。
[0046]
在本说明书中,烯基包括具有2至60个碳原子的直链或支链烯基,且可进一步经其他取代基取代。烯基的碳原子数可为2至60、具体而言为2至40且更具体而言为2至20。其具体实例可包括乙烯基、1-丙烯基、异丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、1-戊烯基、2-戊烯基、3-戊烯基、3-甲基-1-丁烯基、1,3-丁二烯基、烯丙基、1-苯基乙烯基-1-基、2-苯基乙烯基-1-基、2,2-二苯基乙烯基-1-基、2-苯基-2-(萘基-1-基)乙烯基-1-基、2,2-双(二苯基-1-基)乙烯基-1-基等,但不限于此。
[0047]
在本说明书中,炔基包括具有2至60个碳原子的直链或支链炔基,且可进一步经其他取代基取代。炔基的碳原子数可为2至60、具体而言为2至40且更具体而言为2至20。
[0048]
在本说明书中,烷氧基可为直链的、支链的或环状的。所述烷氧基的碳原子的数目不受特别限制,但较佳地为1至20。其具体实例可包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、第三丁氧基、第二丁氧基、正戊基氧基、新戊基氧基、异戊基氧基、正己基氧基、3,3-二甲基丁基氧基、2-乙基丁基氧基、正辛基氧基、正壬基氧基、正癸基氧基、苄氧基、对甲基苄氧基等,但不限于此。
[0049]
在本说明书中,环烷基包括具有3至60个碳原子的单环或多环环烷基,且可进一步经其他取代基取代。在本文中,多环意指环烷基与其他环状基直接连接或稠合的基团。在本文中,其他环状基可为环烷基,但亦可为不同类型的环状基,例如杂环烷基、芳基及杂芳基。环烷基的碳基团的数目可为3至60、具体而言为3至40且更具体而言为5至20。其具体实例可包括环丙基、环丁基、环戊基、3-甲基环戊基、2,3-二甲基环戊基、环己基、3-甲基环己基、4-甲基环己基、2,3-二甲基环己基、3,4,5-三甲基环己基、4-第三丁基环己基、环庚基、环辛基等,但不限于此。
[0050]
在本说明书中,杂环烷基包括o、s、se、n或si作为杂原子,包括具有2至60个碳原子的单环或多环杂环烷基,且可进一步经其他取代基取代。在本文中,多环意指其中杂环烷基与其他环状基直接连接或稠合的基团。在本文中,其他环状基可为杂环烷基,但亦可为不同类型的环状基,例如环烷基、芳基及杂芳基。杂环烷基的碳原子数可为2至60、具体而言为2至40且更具体而言为3至20。
[0051]
在本说明书中,芳基包括具有6至60个碳原子的单环或多环芳基,且可进一步经其他取代基取代。在本文中,多环意指其中芳基与其他环状基直接连接或稠合的基团。在本文中,其他环状基可为芳基,但亦可为不同类型的环状基,例如环烷基、杂环烷基及杂芳基。芳基包括螺环基。芳基的碳原子数可为6至60、具体而言为6至40且更具体而言为6至25。芳基的具体实例可包括苯基、联苯基、三联苯基、萘基、蒽基、基、菲基、苝基、萤蒽基、联三亚苯基、萉基、芘基、稠四苯基、稠五苯基、芴基、茚基、苊基、苯并芴基、螺二芴基、2,3-二氢-1h-茚基、其稠环等,但不限于此。
[0052]
在本说明书中,氧化膦基由-p(=o)r101r102表示,且r101与r102彼此相同或不同,并且可各自独立地为由氢;氘;卤素基;烷基;烯基;烷氧基;环烷基;芳基;及杂环基中的至少一者形成的取代基。氧化膦的具体实例可包括二苯基氧化膦基、二萘基氧化膦基等,但不限于此。
[0053]
在本说明书中,硅烷基是包含si、直接连接有si原子作为自由基的取代基,并且由-sir104r105r106表示。r104至r106彼此相同或不同,并且可各自独立地为由氢;氘;卤素基;烷基;烯基;烷氧基;环烷基;芳基;及杂环基中的至少一者形成的取代基。硅烷基的具体实例可包括三甲基硅烷基、三乙基硅烷基、第三丁基二甲基硅烷基、乙烯基二甲基硅烷基、丙基二甲基硅烷基、三苯基硅烷基、二苯基硅烷基、苯基硅烷基等,但不限于此。
[0054]
在本说明书中,芴基可被取代,且相邻的取代基可彼此键结以形成环。
[0055]
在本说明书中,螺环基为包括螺环结构的基团,且可具有15至60个碳原子。举例而言,螺环基可包括其中2,3-二氢-1h-茚基或环己烷基螺环键结至芴基的结构。具体而言,以下螺环基可包括以下结构式的基团中的任一者。
[0056][0057]
在本说明书中,杂芳基包括s、o、se、n或si作为杂原子,包括具有2至60个碳原子的单环或多环杂芳基,且可进一步经其他取代基取代。在本文中,多环意指其中杂芳基与其他环状基直接连接或稠合的基团。在本文中,其他环状基可为杂芳基,但亦可为不同类型的环状基,例如环烷基、杂环烷基及芳基。杂芳基的碳原子数可为2至60、具体而言为2至40且更具体而言为3至25。杂芳基的具体实例可包括吡啶基、吡咯基、嘧啶基、哒嗪基、呋喃基、噻吩基、咪唑基、吡唑基、恶唑基、异恶唑基、噻唑基、异噻唑基、三唑基、呋呫基、恶二唑基、噻二唑基、二噻唑基、四唑基、吡喃基、噻喃基、二嗪基、恶嗪基、噻嗪基、二恶英基(dioxynyl group)、三嗪基、四嗪基、喹啉基、异喹啉基、喹唑啉基、异喹唑啉基、喹嗪啉基(qninozolinyl group)、萘啶基、吖啶基、菲啶基、咪唑并吡啶基、二氮杂萘基、三氮杂茚基、吲哚基、中氮茚基、苯并噻唑基、苯并恶唑基、苯并咪唑基、苯并噻吩基、苯并呋喃基、二苯并噻吩基、二苯并呋喃基、咔唑基、苯并咔唑基、二苯并咔唑基、啡嗪基、二苯并硅杂环戊二烯基(dibenzosilole group)、螺环二(二苯并硅杂环戊二烯基)、二氢啡嗪基、啡恶嗪基、菲啶基、咪唑并吡啶基、噻吩基、吲哚并[2,3-a]咔唑基、吲哚并[2,3-b]咔唑基、吲哚啉基、10,11-二氢-二苯并[b,f]氮环庚烯基、9,10-二氢吖啶基、酚嗪基、啡噻嗪基、酞嗪基、萘啶基、啡啉基、苯并[c][1,2,5]噻二唑基、5,10-二氢苯并[b,e][1,4]氮杂硅啉基、吡唑并[1,5-c]喹唑啉基、吡啶并[1,2-b]吲唑基、吡啶并[1,2-a]咪唑并[1,2-e]二氢吲哚基、5,11-二氢茚并[1,2-b]咔唑基等,但不限于此。
[0058]
在本说明书中,胺基可选自由单烷基胺基;单芳基胺基;单杂芳基胺基;-nh2;二烷基胺基;二芳基胺基;二杂芳基胺基;烷基芳基胺基;烷基杂芳基胺基;及芳基杂芳基胺基组成的群组,且尽管并非特别受限于此,但碳原子数较佳为1至30。胺基的具体实例可包括甲基胺基、二甲基胺基、乙基胺基、二乙基胺基、苯基胺基、萘基胺基、联苯基胺基、二联苯基胺基、蒽基胺基、9-甲基-蒽基胺基、二苯基胺基、苯基萘基胺基、二甲苯基胺基、苯基甲苯基胺基、三苯基胺基、联苯基萘基胺基、苯基联苯基胺基、联苯基芴基胺基、苯基联三亚苯基胺基、联苯基联三亚苯基胺基等,但不限于此。
[0059]
在本说明书中,亚芳基意指具有两个键结位点的芳基,即二价基。除各自为二价基者以外,可对其应用以上提供的对芳基的说明。此外,亚杂芳基意指具有两个键结位点的杂芳基,即二价基。除各自为二价基者以外,可对其应用以上提供的对杂芳基的说明。
[0060]
在本说明书中,“相邻的”基团可意指取代与由对应的取代基取代的原子直接连接的原子的取代基、在空间上最靠近地定位至对应的取代基的取代基或取代由对应的取代基取代的原子的另一取代基。举例而言,可将在苯环中取代邻位的两个取代基、及在脂族环中取代同一个碳的两个取代基理解为彼此“相邻的”基团。
[0061]
在本说明书中,“化学式或化合物结构中未指明取代基的情况”意指氢原子键结至碳原子。然而,由于氘(2h)是氢的同位素,因此一些氢原子可能是氘。
[0062]
在本技术案的一个实施例中,“在化学式或化合物结构中未指明取代基的情况”可意指可作为取代基的位置可全部是氢或氘。换言之,由于氘是氢的同位素,因此一些氢原子可为作为同位素的氘,且在本文中,氘的含量可为0%至100%。
[0063]
在本技术案的一个实施例中,在“化学式或化合物结构中未指明取代基的情况”下,当氘未被明确排除时,氢及氘可在化合物中混合,例如氘含量为0%,氢含量为100%,或取代基全部为氢。
[0064]
在本技术案的一个实施例中,氘是氢的同位素中的一者,是具有由一个质子及一个中子形成的氘作为核的元素,且可被表达为氢-2,并且元素符号亦可写成d或2h。
[0065]
在本技术案的一个实施例中,同位素意指具有相同原子序数(z)但具有不同质量数(a)的原子,且亦可被解释为具有相同质子数但具有不同中子数的元素。
[0066]
在本技术案的一个实施例中,当基础化合物可具有的取代基的总数被定义为t1、且其中特定取代基的数目被定义为t2时,特定取代基的含量t%的含义可被定义为t2/t1
×
100=t%。
[0067]
换言之,在一个实例中,在由表示的苯基中具有20%的氘含量意指苯基可具有的取代基的总数是5(式中的t1),且其中氘的数目是1(式中的t2)。换言之,苯基中具有20%的氘含量可由以下结构式表示。
[0068][0069]
此外,在本技术案的一个实施例中,“氘含量为0%的苯基”可意指不包含氘原子的苯基,即具有5个氢原子的苯基。
[0070]
本技术案的一个实施例提供一种由以下化学式1表示的杂环化合物。
[0071]
[化学式1]
[0072][0073]
在化学式1中,
[0074]
l1为直接键;具有6至60个碳原子的经取代或未经取代的亚芳基;或者具有2至60个碳原子的经取代或未经取代的亚杂芳基,
[0075]
x1为o;或s,
[0076]rp
为氢;氘;卤素基;氰基;具有1至30个碳原子的经取代或未经取代的烷基;或具有3至30个碳原子的经取代或未经取代的环烷基,
[0077]
r1至r8彼此相同或不同,且各自独立地选自由氢;氘;具有6至60个碳原子的经取代或未经取代的芳基;及具有2至60个碳原子的经取代或未经取代的杂芳基组成的群组,或者彼此相邻的二或更多个基团彼此键结以形成具有6至60个碳原子的经取代或未经取代的芳族烃环、或具有2至60个碳原子的经取代或未经取代的杂环,
[0078]
ar1为具有6至60个碳原子的经取代或未经取代的芳基;具有2至60个碳原子的经取代或未经取代的杂芳基;或者未经取代的胺基或经选自由具有6至40个碳原子的经取代或未经取代的芳基及具有2至40个碳原子的经取代或未经取代的杂芳基组成的群组中的一者或多者取代的胺基,
[0079]
a为0至2的整数,且当a为2时,括弧中的取代基彼此相同或不同,且
[0080]
p为0至4的整数,且当p为2或大于2时,括弧中的取代基彼此相同或不同。
[0081]
由化学式1表示的杂环化合物通过在特定位置固定取代基而具有空间布置,并且在空间上将最高占用分子轨域(highest occupied molecular orbital,homo)与最低未占用分子轨域(lowest unoccupied molecular orbital,lumo)分开,从而允许强的电荷传输。因此,当用作有机发光元件中的有机材料时,在有机发光元件中可预期高效率及寿命的增加。
[0082]
在本技术案的一个实施例中,化学式1的l1可为直接键;经取代或未经取代的亚芳基;或者经取代或未经取代的亚杂芳基。
[0083]
在另一实施例中,l1可为直接键;具有6至60个碳原子的经取代或未经取代的亚芳基;或者具有2至60个碳原子的经取代或未经取代的亚杂芳基。
[0084]
在另一实施例中,l1可为直接键;具有6至40个碳原子的经取代或未经取代的亚芳基;或者具有2至40个碳原子的经取代或未经取代的亚杂芳基。
[0085]
在另一实施例中,l1可为直接键;具有6至20个碳原子的经取代或未经取代的亚芳基;或者具有2至20个碳原子的经取代或未经取代的亚杂芳基。
[0086]
在另一实施例中,l1可为直接键;或经取代或未经取代的亚苯基。
[0087]
在另一实施例中,l1可为直接键;或亚苯基。
[0088]
在另一实施例中,l1为直接键。
[0089]
在另一实施例中,l1为亚苯基。
[0090]
在本技术案的一个实施例中,化学式1的a为0至2的整数,且当a为2时,括弧中的取代基彼此相同或不同。
[0091]
在本技术案的一个实施例中,a为2。
[0092]
在本技术案的一个实施例中,a为1。
[0093]
在本技术案的一个实施例中,a为0。
[0094]
当在有机发光元件中使用由化学式1表示的其中l1不为直接键或a不为0的杂环化合物作为有机材料时,相较于当l1为直接键或a为0时,有机发光元件的效率及寿命更优异。此被认为是由于当l1具有取代基时homo与lumo在空间上更分离此一事实,此允许更强的电荷传输。
[0095]
在本技术案的一个实施例中,化学式1的x1可为o;或s。
[0096]
在本技术案的一个实施例中,x1为o。
[0097]
在本技术案的一个实施例中,x1为s。
[0098]
在本技术案的一个实施例中,化学式1的r
p
可为氢;氘;卤素基;氰基;具有1至30个碳原子的经取代或未经取代的烷基;或具有3至30个碳原子的经取代或未经取代的环烷基。
[0099]
在本技术案的一个实施例中,化学式1的r
p
为氢。
[0100]
在本技术案的一个实施例中,化学式1可由以下化学式1-1表示。
[0101]
[化学式1-1]
[0102][0103]
在化学式1-1中,
[0104]
每一取代基具有与化学式1中相同的定义。
[0105]
在本技术案的一个实施例中,化学式1的r1至r8彼此相同或不同,且各自独立地选自由氢;氘;具有6至60个碳原子的经取代或未经取代的芳基;及具有2至60个碳原子的经取代或未经取代的杂芳基组成的群组,或者彼此相邻的二或更多个基团可彼此键结以形成具有6至60个碳原子的经取代或未经取代的芳族烃环、或具有2至60个碳原子的经取代或未经取代的杂环。
[0106]
在本技术案的一个实施例中,r1至r8彼此相同或不同,且各自独立地选自由氢;氘;
具有6至40个碳原子的经取代或未经取代的芳基;及具有2至40个碳原子的经取代或未经取代的杂芳基组成的群组,或者彼此相邻的二或更多个基团可彼此键结以形成具有6至40个碳原子的经取代或未经取代的芳族烃环、或具有2至40个碳原子的经取代或未经取代的杂环。
[0107]
在本技术案的一个实施例中,r1至r8彼此相同或不同,且各自独立地选自由氢;氘;具有6至20个碳原子的经取代或未经取代的芳基;及具有2至20个碳原子的经取代或未经取代的杂芳基组成的群组,或者彼此相邻的二或更多个基团可彼此键结以形成具有6至20个碳原子的经取代或未经取代的芳族烃环、或具有2至20个碳原子的经取代或未经取代的杂环。
[0108]
在本技术案的一个实施例中,r1至r8彼此相同或不同,且各自独立地选自由氢;氘;具有6至10个碳原子的经取代或未经取代的芳基;及具有2至10个碳原子的经取代或未经取代的杂芳基组成的群组,或者彼此相邻的二或更多个基团可彼此键结以形成具有6至10个碳原子的经取代或未经取代的芳族烃环、或具有2至10个碳原子的经取代或未经取代的杂环。
[0109]
在本技术案的一个实施例中,r1至r8彼此相同或不同,且各自独立地选自由氢;氘;及具有6至40个碳原子的经取代或未经取代的芳基组成的群组,或者彼此相邻的二或更多个基团可彼此键结以形成具有6至40个碳原子的经取代或未经取代的芳族烃环。
[0110]
在本技术案的一个实施例中,r1至r8彼此相同或不同,且各自独立地选自由氢;氘;及具有6至20个碳原子的经取代或未经取代的芳基组成的群组,或者彼此相邻的二或更多个基团可彼此键结以形成具有6至20个碳原子的经取代或未经取代的芳族烃环。
[0111]
在本技术案的一个实施例中,r1至r8彼此相同或不同,且各自独立地选自由氢;氘;及具有6至10个碳原子的经取代或未经取代的芳基组成的群组,或者彼此相邻的二或更多个基团可彼此键结以形成具有6至10个碳原子的经取代或未经取代的芳族烃环。
[0112]
在本技术案的一个实施例中,r1至r8彼此相同或不同,且各自独立地选自由氢;氘;及经取代或未经取代的苯基组成的群组,或者彼此相邻的二或更多个基团可彼此键结以形成经取代或未经取代的苯环。
[0113]
在本技术案的一个实施例中,r1及r8各自独立地为氢;或氘,且r2至r7彼此相同或不同,且各自独立地选自由氢;氘;具有6至60个碳原子的经取代或未经取代的芳基;及具有2至60个碳原子的经取代或未经取代的杂芳基组成的群组,并且r2至r7的彼此相邻的二或更多个基团可彼此键结以形成具有6至60个碳原子的经取代或未经取代的芳族烃环、或具有2至60个碳原子的经取代或未经取代的杂环。
[0114]
在本技术案的一个实施例中,r1及r8各自独立地为氢;或氘,且r2至r7彼此相同或不同,且各自独立地选自由氢;氘;具有6至40个碳原子的经取代或未经取代的芳基;及具有2至40个碳原子的经取代或未经取代的杂芳基组成的群组,并且r2至r7的彼此相邻的二或更多个基团可彼此键结以形成具有6至40个碳原子的经取代或未经取代的芳族烃环、或具有2至40个碳原子的经取代或未经取代的杂环。
[0115]
在本技术案的一个实施例中,r1及r8各自独立地为氢;或氘,且r2至r7彼此相同或不同,且各自独立地选自由氢;氘;具有6至20个碳原子的经取代或未经取代的芳基;及具有2至20个碳原子的经取代或未经取代的杂芳基组成的群组,并且r2至r7的彼此相邻的二或更
多个基团可彼此键结以形成具有6至20个碳原子的经取代或未经取代的芳族烃环、或具有2至20个碳原子的经取代或未经取代的杂环。
[0116]
在本技术案的一个实施例中,r1及r8各自独立地为氢;或氘,且r2至r7彼此相同或不同,且各自独立地选自由氢;氘;及具有6至60个碳原子的经取代或未经取代的芳基组成的群组,并且r2至r7的彼此相邻的二或更多个基团可彼此键结以形成具有6至60个碳原子的经取代或未经取代的芳族环。
[0117]
在本技术案的一个实施例中,r1及r8各自独立地为氢;或氘,且r2至r7彼此相同或不同,且各自独立地选自由氢;氘;及具有6至40个碳原子的经取代或未经取代的芳基组成的群组,并且r2至r7的彼此相邻的二或更多个基团可彼此键结以形成具有6至40个碳原子的经取代或未经取代的芳族环。
[0118]
在本技术案的一个实施例中,r1及r8各自独立地为氢;或氘,且r2至r7彼此相同或不同,且各自独立地选自由氢;氘;及具有6至20个碳原子的经取代或未经取代的芳基组成的群组,并且r2至r7的彼此相邻的二或更多个基团可彼此键结以形成具有6至20个碳原子的经取代或未经取代的芳族环。
[0119]
在本技术案的一个实施例中,r1及r8各自独立地为氢;或氘,且r2至r7彼此相同或不同,且各自独立地选自由氢;氘;及具有6至10个碳原子的经取代或未经取代的芳基组成的群组,并且r2至r7的彼此相邻的二或更多个基团可彼此键结以形成具有6至10个碳原子的经取代或未经取代的芳族环。
[0120]
在本技术案的一个实施例中,r1及r8各自独立地为氢;或氘,且r2至r7彼此相同或不同,且各自独立地选自由氢;氘;及经取代或未经取代的苯基组成的群组,并且r2至r7的彼此相邻的二或更多个基团可彼此键结以形成经取代或未经取代的苯环。
[0121]
在本技术案的一个实施例中,化学式1的ar1可为具有6至60个碳原子的经取代或未经取代的芳基;具有2至60个碳原子的经取代或未经取代的杂芳基;或者未经取代的胺基或经选自由具有6至40个碳原子的经取代或未经取代的芳基及具有2至40个碳原子的经取代或未经取代的杂芳基组成的群组中的一者或多者取代的胺基。
[0122]
在本技术案的一个实施例中,ar1可为具有6至40个碳原子的经取代或未经取代的芳基;具有2至40个碳原子的经取代或未经取代的杂芳基;或者未经取代的胺基或经选自由具有6至40个碳原子的经取代或未经取代的芳基及具有2至40个碳原子的经取代或未经取代的杂芳基组成的群组中的一者或多者取代的胺基。
[0123]
在本技术案的一个实施例中,ar1可为未经取代的胺基或经选自由具有6至40个碳原子的经取代或未经取代的芳基及具有2至40个碳原子的经取代或未经取代的杂芳基组成的群组中的一者或多者取代的胺基。
[0124]
在本技术案的一个实施例中,化学式1的p为0至4的整数,且当p为2或大于2时,括弧中的取代基彼此相同或不同。
[0125]
在本技术案的一个实施例中,化学式1可由以下化学式2或化学式3表示。
[0126]
[化学式2]
[0127][0128]
[化学式3]
[0129][0130]
在化学式2及化学式3中,
[0131]
每一取代基具有与化学式1中相同的定义。
[0132]
在本技术案的一个实施例中,化学式1可由以下化学式4至化学式6中的任一者表示。
[0133]
[化学式4]
[0134][0135]
[化学式5]
[0136][0137]
[化学式6]
[0138][0139]
在化学式4至化学式6中,
[0140]
每一取代基具有与化学式1中相同的定义。
[0141]
在本技术案的一个实施例中,化学式1的ar1可为具有6至60个碳原子的经取代或未经取代的芳基;具有2至60个碳原子的经取代或未经取代的杂芳基;或由以下化学式a表示的基团。
[0142]
[化学式a]
[0143][0144]
在化学式a中,
[0145]
l
11
及l
12
彼此相同或不同,且各自独立地为直接键;具有6至40个碳原子的经取代或未经取代的亚芳基;或者具有2至40个碳原子的经取代或未经取代的亚杂芳基,
[0146]
ar
11
与ar
12
彼此相同或不同,且各自独立地为具有6至40个碳原子的经取代或未经取代的芳基;或者具有2至40个碳原子的经取代或未经取代的杂芳基,
[0147]
a及b为0或1,且
[0148]
意指键结至化学式1的l1的位置。
[0149]
在本技术案的一个实施例中,化学式1的l
11
与l
12
彼此相同或不同,且可各自独立地为直接键;具有6至40个碳原子的经取代或未经取代的亚芳基;或具有2至40个碳原子的经取代或未经取代的亚杂芳基。
[0150]
在本技术案的一个实施例中,l
11
与l
12
彼此相同或不同,且可各自独立地为直接键;或者具有6至40个碳原子的经取代或未经取代的亚芳基。
[0151]
在本技术案的一个实施例中,l
11
与l
12
彼此相同或不同,且可各自独立地为直接键;或者具有6至20个碳原子的经取代或未经取代的亚芳基。
[0152]
在本技术案的一个实施例中,l
11
与l
12
彼此相同或不同,且可各自独立地为直接键;或者经取代或未经取代的亚苯基。
[0153]
在本技术案的一个实施例中,l
11
与l
12
彼此相同或不同,且可各自独立地为直接键;或者亚苯基。
[0154]
在本技术案的一个实施例中,l
11
为直接键。
[0155]
在本技术案的一个实施例中,l
11
为亚苯基。
[0156]
在本技术案的一个实施例中,l
12
为直接键。
[0157]
在本技术案的一个实施例中,l
12
为亚苯基。
[0158]
在本技术案的一个实施例中,化学式1的ar
11
及ar
12
彼此相同或不同,且可各自独立地为具有6至40个碳原子的经取代或未经取代的芳基;或具有2至40个碳原子的经取代或未经取代的杂芳基。
[0159]
在本技术案的一个实施例中,ar
11
与ar
12
彼此相同或不同,并且可各自独立地为经取代或未经取代的苯基;经取代或未经取代的联苯基;经取代或未经取代的萘基;未经取代或经选自由具有1至10个碳原子的烷基及具有6至10个碳原子的芳基组成的群组中的一个或多者取代的芴基;经取代或未经取代的二苯并呋喃基;或者经取代或未经取代的二苯并噻吩基。
[0160]
在本技术案的一个实施例中,ar
11
与ar
12
彼此相同或不同,并且可各自独立地为苯基;联苯基;萘基;未经取代或经选自由甲基;二苯并呋喃基;或二苯并噻吩基组成的群组中的一或多者取代的芴基。
[0161]
在本技术案的一个实施例中,ar
11
与ar
12
可彼此相同。
[0162]
在本技术案的一个实施例中,ar
11
与ar
12
可皆为具有6至40个碳原子的经取代或未经取代的芳基。
[0163]
在本技术案的一个实施例中,ar
11
与ar
12
可皆为具有2至40个碳原子的经取代或未经取代的杂芳基。
[0164]
在本技术案的一个实施例中,ar
11
与ar
12
可彼此不同。
[0165]
在本技术案的一个实施例中,ar
11
可为具有6至40个碳原子的经取代或未经取代的芳基,且ar
12
可为具有2至40个碳原子的经取代或未经取代的杂芳基。
[0166]
在本技术案的一个实施例中,ar
11
可为具有2至40个碳原子的经取代或未经取代的杂芳基,且ar
12
可为具有6至40个碳原子的经取代或未经取代的芳基。
[0167]
当在有机发光元件中使用其中可由化学式1的ar1表示的化学式a的ar
11
及ar
12
中的
一者为芳基而另一者为杂芳基的杂环化合物作为有机材料时,相较于当ar
11
及ar
12
皆为芳基时,有机发光元件的效率及寿命更优异。此被认为是由于当ar
11
及ar
12
中的一者为芳基而另一者为杂芳基时homo与lumo在空间上更分离此一事实,此允许更强的电荷传输。
[0168]
在本技术案的一个实施例中提供的杂环化合物中,化学式1由以下化合物中的任一者表示。
[0169]
[0170]
[0171][0172]
[0173]
[0174]
[0175]
[0176]
[0177]
[0178]
[0179]
[0180][0181]
此外,通过将各种取代基引入至化学式1的结构,可合成具有所引入取代基的独特性质的化合物。举例而言,通过将通常用作用于制造有机发光元件的空穴注入层材料、空穴传输层材料、发光层材料、电子传输层材料及电荷产生层材料的取代基引入至核心结构,可合成满足每一有机材料层所需要的条件的材料。
[0182]
此外,通过将各种取代基引入化学式1的结构,可精密地控制能带间隙,且同时增强有机材料之间的介面处的性质,且材料应用可变得多样化。
[0183]
同时,所述杂环化合物具有高玻璃转变温度(tg),且因此具有优异的热稳定性。热稳定性的此种增加变为为元件提供驱动稳定性的重要因素。
[0184]
根据本技术案的一个实施例的杂环化合物可使用多步式化学反应来制备。首先制备一些中间化合物,且可由所述中间化合物来制备化学式1的化合物。更具体而言,根据本技术案的一个实施例的杂环化合物可基于稍后阐述的制备例来制备。
[0185]
本技术案的另一实施例提供一种包含由化学式1表示的杂环化合物的有机发光元件。“有机发光元件”可用例如“有机发光二极管(organic light emitting diode)”、“oled”、“oled元件”及“有机电致发光元件”等用语来表达。
[0186]
本技术案的一个实施例提供一种有机发光元件,所述有机发光元件包括:第一电极;第二电极;以及一或多个有机材料层,设置于所述第一电极与所述第二电极之间,其中所述有机材料层中的一或多个层包含由化学式1表示的所述杂环化合物。
[0187]
在本技术案的一个实施例中,第一电极可为阳极,而第二电极可为阴极。
[0188]
在本技术案的另一实施例中,第一电极可为阴极,而第二电极可为阳极。
[0189]
在本技术案的一个实施例中,有机发光元件可为蓝色有机发光元件,且根据化学式1的杂环化合物可用作蓝色有机发光元件的材料。
[0190]
在本技术案的另一实施例中,有机发光元件可为绿色有机发光元件,且根据化学式1的杂环化合物可用作绿色有机发光元件的材料。
[0191]
在本技术案的另一实施例中,有机发光元件可为红色有机发光元件,且根据化学式1的杂环化合物可用作红色有机发光元件的材料。
[0192]
关于由化学式1表示的杂环化合物的具体说明与以上提供的说明相同。
[0193]
除使用上述杂环化合物形成一或多个有机材料层以外,本技术案的有机发光元件可使用常见有机发光元件制造方法及材料来制造。
[0194]
当制造有机发光元件时,所述杂环化合物可通过溶液涂布方法以及真空沉积方法而被形成为有机材料层。在本文中,所述溶液涂布方法意指旋转涂布(spin coating)、浸涂(dip coating)、喷墨印刷(inkjet printing)、网版印刷(screen printing)、喷雾(spray)方法、辊涂(roll coating)等,但不限于此。
[0195]
本技术案的所述有机发光元件的有机材料层可被形成为单层结构,但亦可形成为其中层叠有二或更多个有机材料层的多层式结构。举例而言,本公开的有机发光元件可具有包括空穴注入层、空穴传输层、空穴辅助层、发光层、电子传输层、电子注入层等作为有机材料层的结构。然而,有机发光元件的结构不限于此,而是可包括更小数目的有机材料层。
[0196]
在本技术案的有机发光元件中,有机材料层包括发光层,且所述发光层可包含所述杂环化合物。在发光层中使用杂环化合物在空间上将最高占用分子轨域(homo)与最低未占用分子轨域(lumo)分开,从而允许强的电荷传输,且因此,可在有机发光元件中获得优异的驱动、效率及寿命。
[0197]
本公开的有机发光元件可还包括选自由发光层、空穴注入层、空穴传输层、电子注入层、电子传输层、电子阻挡层、空穴辅助层及空穴阻挡层组成的群组中的一、二或更多个层。
[0198]
图1至图3示出根据本技术案的一个实施例的有机发光元件的电极及有机材料层的层叠顺序。然而,本技术案的范围不限于该些附图,且此项技术中已知的有机发光元件的结构亦可用于本技术案中。
[0199]
图1示出其中阳极(200)、有机材料层(300)及阴极(400)连续层叠在基板(100)上的有机发光元件。然而,所述结构不限于此种结构,且如图2所示,亦可获得其中阴极、有机材料层及阳极连续层叠在基板上的有机发光元件。
[0200]
图3示出有机材料层为多层的情况。根据图3的有机发光元件包括空穴注入层(301)、空穴传输层(302)、发光层(303)、空穴阻挡层(304)、电子传输层(305)及电子注入层(306)。然而,本技术案的范围不限于此种层叠结构,且根据需要,可不包括除发光层之外的层,并且可进一步添加其他需要的功能层。
[0201]
根据需要,包含由化学式1表示的杂环化合物的有机材料层可还包含其他材料。
[0202]
在根据本技术案的一个实施例的有机发光元件中,以下示出除了化学式1的杂环化合物之外的材料,然而,该些仅用于说明的目的,而非限制本技术案的范围,且可由此项技术中已知的材料代替。
[0203]
作为阳极材料,可使用具有相对大的功函数的材料,且可使用透明导电氧化物、金属、导电聚合物等。阳极材料的具体实例包括:金属,例如钒、铬、铜、锌、及金,或其合金;金属氧化物,例如氧化锌、氧化铟、氧化铟锡(indium tin oxide,ito)、及氧化铟锌(indium zinc oxide,izo);金属与氧化物的组合,例如zno:al或sno2:sb;导电聚合物,例如聚(3-甲基噻吩)、聚[3,4-(乙烯-1,2-二氧)噻吩](poly[3,4-(ethylene-1,2-dioxy)thiophene],pedot)、聚吡咯、及聚苯胺等,但不限于此。
[0204]
作为阴极材料,可使用具有相对小的功函数的材料,且可使用金属、金属氧化物、导电聚合物等。阴极材料的具体实例包括:金属,例如镁、钙、钠、钾、钛、铟、钇、锂、钆、铝、银、锡、及铅,或其合金;多层结构材料,例如lif/al或lio2/al等,但不限于此。
[0205]
作为空穴注入材料,可使用已知的空穴注入材料,且举例而言,可使用酞菁化合物,例如在美国专利第4,356,429号中公开的铜酞菁;或星形猝发型胺衍生物,例如在文献[高级材料,6,第677页(1994)]中阐述的三(4-咔唑基-9-基苯基)胺(tcta)、4,4',4
”‑
三[苯基(间甲苯基)胺基]三苯基胺(m-mtdata)或1,3,5-三[4-(3-甲基苯基苯胺基)苯基]苯(m-mtdapb)、作为具有溶解度的导电聚合物的聚苯胺/十二烷基苯磺酸、聚(3,4-乙烯二氧噻吩)/聚(4-苯乙烯磺酸酯)、聚苯胺/樟脑磺酸或聚苯胺/聚(4-苯乙烯-磺酸酯)等。
[0206]
作为空穴传输材料,可使用吡唑啉衍生物、芳基胺系衍生物、二苯乙烯衍生物、三苯基二胺衍生物等,且亦可使用低分子或高分子材料。
[0207]
作为电子传输材料,可使用恶二唑衍生物、蒽醌二甲烷及其衍生物、苯醌及其衍生物、萘醌及其衍生物、蒽醌及其衍生物、四氰基蒽醌二甲烷及其衍生物、芴酮衍生物、二苯基二氰基乙烯及其衍生物、二苯醌衍生物、8-羟基喹啉及其衍生物等的金属错合物,且亦可使用高分子材料以及低分子材料。
[0208]
作为电子注入材料的实例,此项技术中通常使用lif,然而,本技术案不限于此。
[0209]
作为发光材料,可使用红色、绿色或蓝色发光材料,且根据需要,可混合并使用二或更多种发光材料。在本文中,可通过沉积为个别供应源或者通过预混合并沉积为一个供应源来使用二或更多种发光材料。此外,萤光材料亦可用作发光材料,然而,亦可使用磷光材料。作为发光材料,可单独使用通过结合分别自阳极及阴极注入的电子及空穴来发光的材料,然而,亦可使用具有一起参与发光的主体材料及掺杂剂材料的材料。
[0210]
当混合发光材料主体时,可混合相同系列的主体,或者可混合不同系列的主体。举例而言,可选择n型主体材料或p型主体材料中的任何二或更多种材料,并将其用作发光层的主体材料。
[0211]
在本技术案的有机发光元件中,有机材料层包括发光层,并且发光层可包含所述杂环化合物作为发光材料的主体材料。
[0212]
在本技术案的有机发光元件中,发光层可包括二或更多种主体材料,并且所述主体材料中的至少一者可包括所述杂环化合物作为发光材料的主体材料。
[0213]
在本技术案的有机发光元件中,发光层可在预混合之后使用二或更多种主体材料,并且所述二或更多种主体材料中的至少一者可包含所述杂环化合物作为发光材料的主体材料。
[0214]
预混合意指在沉积在有机材料层上之前,在一个供应源中预先混合发光层的两或更多种主体材料。
[0215]
在本技术案的有机发光元件中,发光层可包括二或更多种主体材料,所述二或更多种主体材料各自包括一或多种p型主体材料及n型主体材料,并且所述主体材料中的至少一者可包含所述杂环化合物作为发光材料的主体材料。在此种情况下,有机发光元件可具有优异的驱动、效率及寿命。
[0216]
依据所使用的材料,根据本技术案的一个实施例的有机发光元件可为顶部发射型(top-emission type)、底部发射型(bottom-emission type)、或双发射型(dual-emission type)。
[0217]
根据本技术案一个实施例的杂环化合物亦可在有机发光元件中使用的相似原理之下用于包括有机太阳电池(solar cell)、有机光导体、有机晶体管等在内的有机电子元件中。
[0218]
实施本发明的方式
[0219]
在下文中,将参照实例更详细地阐述本说明书,然而该些仅用于说明目的,且本技术案的范围不限于此。
[0220]
《制备例》
[0221]
《制备例1》制备化合物1、14、28、198及201
[0222]
1)制备化合物e1
[0223][0224]
在将2-溴-4-氯二苯并[b,d]噻吩(20克,67.2毫摩尔)、9h-咔唑(11.2克,67.2毫摩尔)、cui(15.8克,80.6毫摩尔)、环己烷-1,2-二胺(9.2克,80.6毫摩尔)及k3po4(28.4克,134.4毫摩尔)引入500毫升圆底烧瓶后,向其中引入1,4-二恶烷(200毫升),且在140℃下对混合物进行了搅拌。在反应完成后,将温度降至室温,并对所得物进行了硅藻土过滤,且然后进行了浓缩。使用甲醇:己烷=1:3(v/v)的管柱对浓缩的反应材料进行了纯化,以获得化合物e1(23.7克,61.7毫摩尔,产率:91.8%)。在本文中,mc意指二氯甲烷(在下文中被称为mc)。
[0225]
2)制备化合物e2
[0226]
除了使用下表1的a2代替2-溴-4-氯二苯并[b,d]噻吩(a1)之外,以与制备化合物e1相同的方式合成了化合物e2(产率:85.1%)。
[0227]
[表1]
[0228][0229]
3)制备化合物1
[0230][0231]
在将下表2的e1(10.0克,26.0毫摩尔)、h1(6.4克,26.0毫摩尔)、pd2dba3(1.2克,1.3毫摩尔)、xphos(1.2克,2.6毫摩尔)及nao
t
bu(7.5克,78.0毫摩尔)引入500毫升圆底烧瓶后,向其中引入了二甲苯(110毫升),并在160℃下对混合物进行了搅拌。在反应完成后,将温度降至室温,并对所得物进行了硅藻土过滤,且然后进行了浓缩。使用甲醇:己烷=1:1的管柱对浓缩的反应材料进行了纯化,以获得化合物1(14.0克,23.6毫摩尔,产率:90.8%)。
[0232]
4)制备化合物14、28、198及201
[0233]
除了使用下表2的e代替e1、且使用下表2的h代替h1之外,以与制备化合物1相同的方式合成了化合物14、28、198及201。
[0234]
[表2]
[0235][0236]
《制备例2》制备化合物55至57、65、71至73、77、79、91、94至96、98、111至113、122至124、129、131、133、137、144、146、153及160
[0237]
1)制备化合物c3
[0238][0239]
在将2-溴二苯并[b,d]噻吩(20克,76.0毫摩尔)、9h-咔唑(12.7克,76.0毫摩尔)、cui(17.8克,91.2毫摩尔)、环己烷-1,2-二胺(10.4克,91.2毫摩尔)及k3po4(32.2克,152.0
毫摩尔)引入500毫升圆底烧瓶后,向其中引入了1,4-二恶烷(200毫升),并在140℃下对混合物进行了搅拌。在反应完成后,将温度降至室温,并对所得物进行了硅藻土过滤,且然后进行了浓缩。使用甲醇:己烷=1:3(v/v)的管柱对浓缩的反应材料进行了纯化,以获得化合物c3(24.2克,69.3毫摩尔,产率:91.2%)。
[0240]
2)制备化合物c4至c8
[0241]
除了使用下表3的a代替2-溴二苯并[b,d]噻吩(a3)、且使用下表3的b代替9h-咔唑(b1)之外,以与制备化合物c3相同的方式合成了化合物c4至c8。
[0242]
[表3]
[0243][0244]
3)制备化合物e3
[0245]
在氮气气氛下将c3(20克,57.2毫摩尔)引入500毫升圆底烧瓶后,向其中引入了四氢呋喃(在下文中称为thf)(200毫升),并在-78℃下对混合物进行了搅拌。此后,向其中缓慢滴加了2.5摩尔/升(m)的正丁基锂溶液(23毫升,57.2毫摩尔),并将所得物搅拌了30分钟。此后,向其中缓慢滴加了硼酸三甲酯(9.6毫升,85.8毫摩尔),并对结果进行了搅拌。在反应完成后,用ea/h2o对所得物进行了萃取,且然后进行了浓缩。用mgso4对浓缩的反应材料进行了处理,且然后再次进行了浓缩以获得化合物e3(19.1克,48.6毫摩尔,产率:85.0%)。
[0246]
4)制备化合物e4至e8
[0247]
除了使用下表4的c代替c3之外,以与制备化合物e3相同的方式合成了化合物e4至e8。
[0248]
[表4]
[0249][0250]
5)制备化合物57
[0251][0252]
在将e3(15克,38.1毫摩尔)、h94(18.1克,38.1毫摩尔)、pd(pph3)4(2.2克,1.9毫摩
尔)及k2co3(13.1克,95.3毫摩尔)引入500毫升圆底烧瓶后,向其中引入了1,4-二恶烷/h2o(200毫升/40毫升),并在160℃对混合物进行了搅拌。在反应完成后,将温度降至室温,并用mc/h2o对所得物进行了萃取,且然后进行了浓缩。使用甲醇:己烷=1:1(v/v)的管柱对浓缩的反应材料进行了纯化,以获得化合物57(26.3克,35.3毫摩尔,产率:92.7%)。
[0253]
6)制备化合物55、56、65、71至73、77、79、91、94至96、98、111至113、122至124、129、131、133、137、144、146、153及160
[0254]
除了使用下表5的e代替e3、且使用下表5的h代替h94之外,以与制备化合物57相同的方式合成了化合物55、56、64、71至73、77、79、91、94至96、98、111至113、122至124、129、131、133、137、144、146、153及160。
[0255]
[表5]
[0256]
[0257]
[0258]
[0259]
[0260]
[0261]
[0262]
[0263][0264]
以与制备例相同的方式制备了在本说明书中描述的化合物,且所制备的化合物的合成识别结果示于下表6及表7中。下表6示出1h nmr(cdcl3,400mz)的测量值,且下表7示出fd-质谱(fd-ms:场解吸质谱(field desorption mass spectrometry))的测量值。
[0265]
[表6]
[0266]
[0267][0268]
[表7]
[0269]
[0270]
[0271][0272]
[实验例]
[0273]
1)制造有机发光元件(红色主体)
[0274]
用蒸馏水超音波对上面氧化铟锡(ito)被涂布至1,500埃厚度的薄膜的玻璃基板进行了清洗。用蒸馏水清洗完成后,用例如丙酮、甲醇及异丙醇等溶剂对基板进行了超音波清洗,然后干燥,并在紫外线(ultra violet,uv)清洁器中使用紫外线将紫外线臭氧(ultraviolet ozone,uvo)处理进行了5分钟。之后,将基板传输至电浆清洁器(plasma cleaner,pt),且在真空下进行电浆处理以达成ito功函数并移除残留膜之后,将基板传输至热沉积设备以进行有机沉积。
[0275]
在透明ito电极(阳极)上,形成了作为共用层的空穴注入层2-tnata(4,4',4
”‑
三[2-萘基(苯基)胺基]三苯胺)及空穴传输层npb(n,n'-二(1-萘基)-n,n'-二苯基-(1,1'-联苯基)-4,4'-二胺)。
[0276]
如下在其上热真空沉积了发光层。通过将(piq)2(ir)(acac)以3重量%掺杂至主体中,使用在下表8中描述的化合物作为主体且使用(piq)2(ir)(acac)作为红色磷光掺杂剂而将发光层沉积至500埃。此后,将bcp沉积至60埃作为空穴阻挡层,且将alq3在其上沉积至200埃作为电子传输层。最后,通过将氟化锂(lif)沉积至10埃的厚度在电子传输层上形成了电子注入层,且然后通过将铝(al)阴极沉积至1,200埃的厚度在电子注入层上形成了阴极,且结果,制造了有机电致发光元件。
[0277]
同时,对于将在有机发光二极管(organic light emitting diode,oled)制造中使用的每种材料而言,制造有机发光二极管所需的全部有机化合物在10-8
托至10-6
托下进行真空升华纯化。
[0278]
2)有机电致发光元件的驱动电压及发光效率
[0279]
对于如上制造的有机电致发光元件中的每一者,使用麦克赛恩斯公司(mcscience inc.)制造的m7000测量了电致发光(electroluminescent,el)性质,且利用测量结果,当标准亮度为6,000坎德拉/平方米时,通过麦克赛恩斯公司制造的寿命测量系统(m6000)测量了t
90
。本公开的有机电致发光元件的性质如下表8所示。
[0280]
[表8]
[0281] 化合物驱动电压(v)效率(cd/a)彩色坐标(x,y)寿命(t
90
)比较例1a5.3620.8(0.681,0.319)30比较例2b5.4319.9(0.682,0.316)25比较例3c5.2918.1(0.683,0.315)36比较例4d5.1022.0(0.681,0.318)40比较例5e5.1126.9(0.680,0.319)60比较例6f5.2522.5(0.679,0.321)35实例114.8431.2(0.688,0.311)75实例2144.8730.2(0.687,0.312)78实例3284.8733.5(0.686,0.312)73实例4554.7934.8(0.686,0.312)130实例5564.8032.8(0.686,0.313)129实例6574.8033.1(0.680,0.319)133实例7654.7932.1(0.679,0.321)128实例8714.2927.0(0.688,0.311)81实例9724.7732.2(0.687,0.312)131实例10734.8132.9(0.686,0.312)155实例11774.8134.9(0.686,0.312)190实例12794.7135.1(0.686,0.313)200实例13914.9836.5(0.680,0.319)230实例14944.8936.6(0.679,0.321)250实例15954.7834.1(0.688,0.311)159实例16964.9936.2(0.687,0.312)235实例17984.8736.5(0.686,0.312)254实例181114.8035.5(0.686,0.312)150实例191124.7534.0(0.686,0.313)135实例201134.8533.9(0.686,0.312)120实例211224.2527.8(0.686,0.313)85实例221234.8033.1(0.688,0.311)142实例231244.8333.5(0.687,0.312)160实例241294.8938.3(0.686,0.312)278实例251314.9539.7(0.686,0.312)290实例261334.8134.5(0.686,0.313)130实例271374.8833.2(0.688,0.311)120实例281444.2227.3(0.679,0.321)80实例291464.8533.5(0.688,0.311)125实例301534.9437.9(0.687,0.312)243实例311604.8133.9(0.688,0.311)123实例321984.9029.8(0.687,0.312)90
实例332014.3025.9(0.685,0.313)65实例342144.7231.5(0.684,0.313)115实例352284.2127.1(0.685,0.313)73实例362314.7030.2(0.687,0.313)110实例372344.7130.5(0.687,0.311)115实例382444.8035.3(0.686,0.312)180实例392464.7932.5(0.686,0.311)155实例402574.7532.0(0.687,0.311)125
[0282][0283]
自实验例识别出,当在有机发光元件的有机材料层中使用化学式1的杂环化合物具体而言作为发光层的主体时,改善了驱动电压及效率。具体而言,识别出相较于比较例1至比较例6,使用化学式1的杂环化合物的实例1至实例40通过固定取代基而具有空间布置,并且在空间上分离的最高占用分子轨域(homo)与最低未占用分子轨域(lumo)允许强的电荷传输,且藉此适合作为红色主体,并且当用作有机发光元件中的有机材料时,预期具有高效率。
[0284]
此被认为是由于本技术案的化合物具有的c-n键增强了驱动及效率此一事实,并且通过在特定位置固定取代基,获得了空间布置,并且最高占用分子轨域(homo)与最低未占用分子轨域(lumo)在空间上分离,从而产生强的电荷传输。
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:李涌熙 牟晙兑 金东骏
- 技术所有人:LT素材株式会社
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
精彩留言,会给你点赞!
专利分类正在加载中....