新颖抗FGFR2B抗体的制作方法
94,2010)、食道鳞状细胞癌(ishizuka等人,《生物化学与生物物理学研究通讯(biochem biophys res commun.)》9;296(1):152-5,2002)、卵巢癌(gorringe等人,《临床癌症研究(clin cancer res.)》15;13(16):4731-9,2007)、膀胱癌(simon等人,《癌症研究》1;61(11):4514-9,2001)、前列腺癌(edwards等人,《临床癌症研究》1;9(14):5271-81 2003)以及肺癌,特别是鳞状亚型(dutt等人,《公共科学图书馆
·
综合(plos one.)》6(6):e20351,2011;weir等人,《自然(nature.)》6;450(7171):893-8,2007;weiss等人,《科学
·
转化医学(sci transl med.)》15;2(62):62ra93,2010)。
5.迫切需要新颖抗fgfr2b抗体。确切地说,相信尚未报导能够同时结合至fgfr2b和fgfr1b的抗体。
技术实现要素:
6.在本公开通篇,冠词“一个(种)(a/an)”和“所述”在本文中用于指一个(种)或多个(种)(即,至少一个(种))该冠词的语法对象。举例来说,“一种抗体”意味着一种或多种抗体。
7.本公开提供新颖单克隆抗fgfr2b抗体、其氨基酸和核苷酸序列,以及其用途。
8.在一方面,本公开提供一种分离的抗fgfr2b抗体,该抗体包含:1、2或3个重链互补决定区(cdr)序列,所述重链cdr序列选自由seq id no:1、3、5和7组成的组;和/或1、2或3个轻链cdr序列,所述轻链cdr序列选自由seq id no:2、4和6组成的组,其中所述抗体能够特异性结合至fgfr2b和fgfr1b。在一些实施例中,本文所提供的抗体与fgfr2c不具有可检测的结合亲和力。
9.在一些实施例中,本文所提供的抗体包含:seq id no:5的重链cdr3和/或seq id no:6的轻链cdr3。在一些实施例中,本文所提供的抗体包含:具有1、2或3个重链cdr序列的重链可变区(vh),所述重链cdr选自由seq id no:1、3、5和7组成的组,和/或具有1、2或3个轻链cdr序列的轻链可变区(v
l
),所述轻链cdr选自由seq id no:2、4和6组成的组。在一些实施例中,本文所提供的抗体包含:含seq id no:1、3和5的重链可变区(vh),和/或含有seq id no:2、4和6的轻链可变区(v
l
)。在一些实施例中,本文所提供的抗体包含:含有seq id no:1、7和5的重链可变区(vh),和/或含有seq id no:2、4和6的轻链可变区(v
l
)。
10.在一些实施例中,本文所提供的抗体包含重链可变区,该重链可变区包含seq id no:8、12或16,或其同源序列,所述同源序列与seq id no:8、12或16具有至少80%序列同一性。在一些实施例中,本文所提供的抗体包含轻链可变区,该轻链可变区包含seq id no:10或14,或其同源序列,所述同源序列与seq id no:10或14具有至少80%序列同一性。在一些实施例中,本文所提供的抗体包含:含有seq id no:8的重链可变区和含有seq id no:10的轻链可变区。在一些实施例中,本文所提供的抗体包含:含有seq id no:12的重链可变区和含有seq id no:14的轻链可变区。在一些实施例中,本文所提供的抗体包含:含有seq id no:16的重链可变区和含有seq id no:10的轻链可变区。
11.在一些实施例中,本文所提供的抗体还包含一个或多个氨基酸残基取代或修饰,仍然保持与fgfr2b和/或与fgfr1b的特异性结合亲和力。在一些实施例中,所述取代或修饰中的至少一个是在所述cdr序列的一个或多个中,和/或在所述vh或v
l
序列的一个或多个中,或在所述vh或v
l
序列的一个或多个中,但在所述任何cdr序列的外部。
12.在一些实施例中,本文所提供的抗体还包含免疫球蛋白恒定区,任选地人免疫球蛋白的恒定区,优选地人igg的恒定区,更优选地人igg1的恒定区。
13.在一些实施例中,本文所提供的抗体在其恒定区内还包含一个或多个修饰,所述修饰:a)引入或移除糖基化位点、b)引入游离半胱氨酸残基、c)增强与活化fc受体的结合、和/或d)增强抗体依赖性细胞介导的细胞毒性(adcc)。
14.在一些实施例中,本文所提供的抗体经历糖基化工程改造。在一些实施例中,本文所提供的抗体是无岩藻糖基化的。在一些实施例中,本文所提供的无岩藻糖基化抗体在asn297处缺乏岩藻糖。在一些具体实施例中,经历糖基化工程改造的抗体相较于其未工程改造的对应物展现增强的adcc活性。在一些实施例中,所述增强的adcc是以表达fgfr2b的细胞的裂解提高至少10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、65%、70%或75%为特征。
15.在一些实施例中,本文所提供的抗体是嵌合抗体。在一些其它实施例中,本文所提供的抗体是人源化抗体。
16.在一些实施例中,本文所提供的抗体连接至一个或多个缀合物部分。在某些实施例中,所述缀合物部分包含治疗剂、放射性同位素、可检测标记、药物动力学调节部分或纯化部分。在一些实施例中,所述缀合物部分是直接或通过连接子共价连接。
17.在另一方面,本公开还提供了分离的抗体或其抗原结合片段,其与以上描述的抗体竞争结合至fgfr2b和/或fgfr 1b。
18.在一方面,本公开提供一种分离的多核苷酸,该分离的多核苷酸编码本文所提供的抗体。在一些实施例中,所述分离的多核苷酸包含选自下组的核苷酸序列:seq id no:9、11、13、15或17,以及其同源序列,所述同源序列与seq id no:9、11、13、15或17具有至少80%序列同一性。在一些实施例中,所述同源序列编码如seq id no:9、11、13、15或17编码的相同的蛋白质。
19.在另一方面,本公开提供一种表达载体,该表达载体包含本文所提供的分离的多核苷酸。在又另一方面,本公开提供一种宿主细胞,该宿主细胞包含本公开的表达载体。
20.在又另一方面,本公开提供一种产生本文所提供的抗体的方法。在一些实施例中,所述方法包括在使本公开的表达载体表达的条件下,培养本公开的宿主细胞。在一些实施例中,所述方法还包括纯化由所述宿主细胞产生的抗体。
21.在又另一方面,本公开提供一种药物组合物,该药物组合物包括本文所提供的抗体,和药学上可接受的运载体。
22.在另一方面,本公开提供一种治疗受试者的fgfr2b和/或fgfr1b相关疾病或病况的方法,该方法包括施用治疗有效量的本公开的抗体或药物组合物。
23.在一些实施例中,所述疾病或病况是癌症,并且任选地,所述癌症以fgfr2b和/或fgfr1b的表达或过度表达为特征。
24.在一些实施例中,所述施用是经口、鼻、静脉内、皮下、舌下或肌肉内施用。在一些实施例中,受试者是人。
25.在另一方面,本公开提供一种检测样品中fgfr2b和/或fgfr1b的存在或量的方法,该方法包括使所述样品与本公开的抗体接触,以及确定所述样品中fgfr2b和/或fgfr1b的存在或量。
26.在另一方面,本公开提供一种诊断受试者的fgfr2b和/或fgfr1b相关疾病或病况的方法,该方法包括:a)使从所述受试者获得的样品与本公开的抗体接触;b)确定所述样品中fgfr2b和/或fgfr1b的存在或量;c)将所述fgfr2b和/或fgfr1b的存在或量与所述受试者的fgfr2b和/或fgfr1b相关疾病或病况的存在或状态相关联。
27.在另一方面,本公开提供了对受试者的fgfr2b和/或fgfr1b相关疾病或病况预后的方法,所述方法包括:a)使从所述受试者获得的样品与本公开的抗体接触;b)确定所述样品中fgfr2b和/或fgfr1b的存在或量;c)将所述fgfr2b和/或fgfr1b的存在或量与所述受试者对fgfr2b和/或fgfr1b拮抗剂的潜在反应性相关联。
28.在另一方面,本公开提供了本公开的抗体在制造用于治疗受试者的疾病或病况的药物中的用途,所述疾病或病况将受益于对fgfr2b和/或fgfr1b表达调节。
29.在另一方面,本公开提供了本公开的抗体在制造用于检测fgfr2b和/或fgfr1b相关疾病或病况的诊断试剂中的用途。
30.在又另一方面,本公开提供了用于检测fgfr2b和/或fgfr1b的试剂盒,所述试剂盒包含本公开的抗体。
附图说明
31.图1.完整ab hu21-26(图中表示为“hu21-26”)轻链(a)和重链(b)的氨基酸序列,其中cdr加下划线。
32.图2.ab 21c、ab hu21-21和afhu21-26(图中分别表示为“21c”、“hu21-21”和“afhu21-26”)与人fgfr2b或人fgfr1b的biacore结合ka、koff和亲和力kd,其中使用fpa144作为对照抗体用于参照比较。
33.图3.嵌合ab 21c与katoiii细胞上fgfr2b的剂量依赖性结合的流式细胞术分析。
34.图4.ab 21c与人、食蟹猕猴和大鼠/小鼠fgfr2b的交叉物种结合。
35.图5.小鼠ab 21(图中表示为“21”)与人fgfr的各种家族成员的结合选择性。
36.图6.ab 21c对fgf7诱导的被人fgfr2b稳定转染的ba/f3细胞的细胞增殖的抑制作用,其中同种型人igg1作为阴性对照。
37.图7.ab 21c剂量依赖性下调fgfr2b磷酸化和其下游靶erk磷酸化。
38.图8.由小鼠ab 21在与katoiii细胞一起在37℃下培育2小时和4小时之后细胞内分布的共聚焦图像指示的抗体内化情况。小鼠ab 21在与katoiii细胞一起在4℃下培育2小时和4小时之后细胞内分布的共聚焦图像用作阴性基线对照。
39.图9.无岩藻糖基化ab hu21-26(图中表示为“afhu21-26”)和岩藻糖基化抗体ab 21c针对katoiii细胞的adcc活性。
40.图10.一周两次腹腔内(i.p.)给与10mg/kg ab afhu21-26在snu16胃癌异种移植模型(a)和lc038患者源性异种移植肺癌模型(b)中的体内抗肿瘤功效。使用fpa144作为比较。
41.图11.使用hic-hplc进行的未缀合的afhu21-26(底部曲线)和adc缀合物afhu21-26-mmae(顶部曲线)的药物/抗体比分析。
42.图12.(a)afhu21-26-mmae在lc038患者源性异种移植肺癌模型中、和(b)ab21c-mmae、ab 21c-mmaf在snu16胃癌异种移植模型中的体内抗肿瘤功效。每周向动物静脉内给
药。
具体实施方式
43.以下对本公开的描述仅旨在说明本公开的各种实施例。因此,所论述的具体改造不应被解释为对本公开范围的限制。所属领域的技术人员将显而易见的是,可以在不脱离本公开的范围的情况下实行各种等效、变化和修改,并且应理解,此类等效实施例将包含在本文中。本文引用的所有参考文献,包含出版物、专利和专利申请,均以全文引用的方式并入本文中。
44.定义
45.如本文所使用,术语“抗体”包含任何免疫球蛋白、单克隆抗体、多克隆抗体、多价抗体、二价抗体、单价抗体、多特异性抗体、双特异性抗体以及其结合至特定抗原的抗原结合片段。天然完整抗体包括两条重(h)链和两条轻(l)链。哺乳动物重链分类为α、δ、ε、γ和μ,每条重链由一个可变区(vh)以及第一、第二和第三恒定区(分别为c
h1
、c
h2
、c
h3
)组成;哺乳动物轻链分类为λ或κ,而每条轻链由一个可变区(v
l
)和一个恒定区组成。抗体呈“y”形,并且y的茎部由通过二硫键结合在一起的两条重链的第二和第三恒定区组成。y的每个臂包含结合至单一轻链的可变区和恒定区的单一重链的可变区和第一恒定区。轻链和重链的可变区负责抗原结合。两条链的可变区一般含有三个高变环,称为互补决定区(cdr)(轻链cdr包含lcdr1、lcdr2和lcdr3,重链cdr包含hcdr1、hcdr2、hcdr3)。本文公开的抗体的cdr边界可根据kabat、imgt、chothia或al-lazikani的惯例界定或标识(al-lazikani,b.,chothia,c.,lesk,a.m.,《分子生物学杂志(j.mol.biol.)》,273(4),927(1997);chothia,c.等人,《分子生物学杂志》,12月5日;186(3):651-63(1985);chothia,c.和lesk,a.m.,《分子生物学杂志》,196,901(1987);chothia,c.等人,《自然》,12月21-28日;342(6252):877-83(1989);kabat e.a.等人,《美国国家卫生研究院(national institutes of health)》,马里兰州贝塞斯达(bethesda,md.)(1991);marie-paule lefranc等人,《发育与比较免疫学(developmental and comparative immunology)》,27:55-77(2003);marie-paule lefranc等人,《免疫组研究(immunome research)》,1(3),(2005);marie-paule lefranc,《b细胞分子生物学(molecular biology of b cells)》(第二版),第26章,481-514,(2015))。这三个cdr间杂有称为构架区(fr)的侧接链段,fr的保守性要高于cdr的保守性,并形成了支撑高变环的支架。重链和轻链的恒定区不参与抗原结合,但展现出各种效应功能。抗体是根据其重链恒定区的氨基酸序列分类。抗体的五个主要类别或同种型是iga、igd、ige、igg和igm,分别以α、δ、ε、γ和μ重链的存在为特征。一些主要抗体类别分为亚类,如igg1(γ1重链)、igg2(γ2重链)、igg3(γ3重链)、igg4(γ4重链)、iga1(α1重链)或iga2(α2重链)。
46.如本文所使用,术语“抗原结合片段”是指由完整抗体的一部分形成的包含一个或多个cdr的抗体片段,或其他任何可以结合抗原但不包含完整原生抗体结构的任何其它抗体片段。抗原结合片段的实例包含但不限于双抗体、fab、fab'、f(ab')2、fv片段、二硫键稳定的fv片段(dsfv)、(dsfv)2、双特异性dsfv(dsfv-dsfv')、二硫键稳定的双抗体(ds双抗体)、单链抗体分子(scfv)、单链fv-fc抗体(scfv-fc)、scfv二聚体(二价双抗体)、双特异性抗体、多特异性抗体、骆驼化单域抗体、纳米抗体、域抗体及二价域抗体。抗原结合片段能够
结合至与亲本抗体所结合相同的抗原。
47.与抗体有关的“fab”是指抗体的由通过二硫键结合至单一重链的可变区和第一恒定区的单一轻链(可变区和恒定区)组成的部分。
[0048]“fab'”是指包含一部分铰链区的fab片段。
[0049]“f(ab')
2”是指fab'的二聚体。与抗体有关的“fv”是指带有完整抗原结合位点的抗体的最小片段。fv片段由与单一重链的可变区结合的单一轻链的可变区组成。
[0050]“dsfv”是指二硫键稳定的fv片段,其中在单一轻链的可变区与单一重链的可变区之间的键联是二硫键。在一些实施例中,“(dsfv)
2”或“(dsfv-dsfv')”包括三条肽链:通过肽连接子(例较长柔性连接子)连接的两个vh部分,所述两个vh部分并分别通过二硫桥键结合至两个v
l
部分的。在一些实施例中,dsfv-dsfv'具有双特异性,其中各二硫键配对的重链和轻链具有不同抗原特异性。
[0051]“单链fv”或“scfv”是指由轻链可变区和重链可变区直接或通过肽连接子序列彼此连接组成的工程改造的抗体(huston js等人《美国国家科学院院刊》,85:5879(1988))。
[0052]
与抗体有关的“fc”是指抗体的由通过二硫键与第二重链的第二和第三恒定区结合的第一重链的第二和第三恒定区组成的部分。抗体的fc部分引起各种效应功能,如抗体依赖性细胞介导的细胞毒性(adcc)和补体依赖性细胞毒性(cdc),但不在抗原结合中起作用。
[0053]“单链fv-fc抗体”或“scfv-fc”是指由连接至抗体fc区的scfv组成的工程改造的抗体。
[0054]“骆驼化单域抗体”、“重链抗体”或“hcab”是指含有两个vh域且不含轻链的抗体(riechmann l.和muyldermans s.,《免疫学方法杂志(j immunol methods.)》12月10日;231(1-2):25-38(1999);muyldermans s.,《生物技术杂志(j biotechnol.)》6月;74(4):277-302(2001);wo94/04678;wo94/25591;美国专利第6,005,079号)。重链抗体最初来源于骆驼科(骆驼、单峰骆驼和羊驼)。尽管不含轻链,但骆驼化抗体具有真实(authentic)的抗原结合库(hamers-casterman c.等人,《自然》6月3日;363(6428):446-8(1993);nguyen vk.等人,“骆驼科重链抗体:进化创新案例(heavy-chain antibodies in camelidae;a case of evolutionary innovation),”《免疫遗传学(immunogenetics.)》4月;54(1):39-47(2002);nguyen vk.等人,《免疫学(immunology.》5月;109(1):93-101(2003))。重链抗体的可变域(“vhh域”)代表由适应性免疫反应产生的已知的最小抗原结合单元(koch-nolte f.等人,《美国实验生物学学会联合会杂志(faseb j.)》11月;21(13):3490-8.epub 2007年6月15日(2007))。
[0055]“纳米抗体”是指由来自常规igg的重链抗体的一个vh域以及两个重链恒定域,例如ch2和ch3组成的抗体片段。
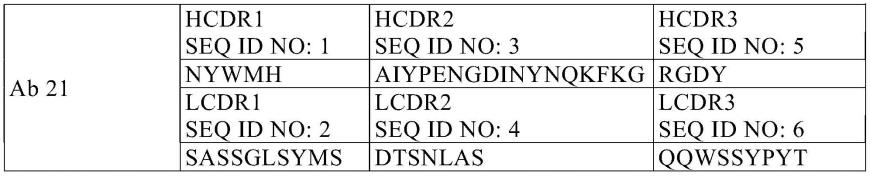
[0056]“双抗体”或“dab”包含具有两个抗原结合位点的小抗体片段,其中所述片段包括连接至同一多肽链中的v
l
域的vh域(v
h-v
l
或v
l-vh)(参见例如holligerp.等人,《美国国家科学院院刊》7月15日;90(14):6444-8(1993);ep404097;wo93/11161)。通过使用过短而使得同一链上的两个域之间不能配对的连接子,迫使域与另一条链的互补域配对,由此产生两个抗原结合位点。所述抗原结合位点可靶向相同或不同的抗原(或表位)。在某些实施例中,“双特异性二硫键稳定的双抗体”是靶向两个不同抗原(或表位)的双抗体。
[0057]
在某些实施例中,“scfv二聚体”是一种二价双抗体或二价scfv(bsfv),其包含v
h-v
l
(通过肽连接子连接)与另一个v
h-v
l
部分二聚化,使得一个部分的vh与另一个部分的v
l
配位并形成可靶向相同抗原(或表位)或不同抗原(或表位)的两个结合位点。在其它实施例中,“scfv二聚体”是一种双特异性双抗体,其包含v
h1-v
l2
(通过肽连接子连接)与v
l1-v
h2
(也通过肽连接子连接)缔合,使得v
h1
与v
l1
配位且v
h2
与v
l2
配位并且每个配位对具有不同抗原特异性。
[0058]“域抗体”是指仅含重链可变区或轻链可变区的抗体片段。在某些情况下,两个或更多个vh域用肽连接子共价接合,产生二价或多价域抗体。二价域抗体的两个vh域可靶向相同或不同的抗原。
[0059]
如本文所使用,术语“嵌合”意思指重链和/或轻链的一部分来源于一个物种且其余重链和/或轻链来源于不同物种的抗体或抗原结合片段。在一个示意性实例中,嵌合抗体可包括来源于人类的恒定区和来源于如小鼠之类非人类动物的可变区。在一些实施例中,非人类动物是哺乳动物,例如小鼠、大鼠、兔、山羊、绵羊、豚鼠或仓鼠。
[0060]
如本文所使用,术语“人源化”意思指抗体或抗原结合片段包括来源于非人类动物的cdr、来源于人类的fr区,并且在适用时,恒定区是来源于人类。
[0061]
如本文所使用,术语“二价”是指具有两个抗原结合位点的抗体或抗原结合片段;术语“单价”是指仅具有单一抗原结合位点的抗体或抗原结合片段;并且术语“多价”是指具有多个抗原结合位点的抗体或抗原结合片段。
[0062]
如本文所使用,“双特异性”抗体是指具有来源于两种不同单克隆抗体并且能够结合至两个不同表位的人工抗体或抗原结合片段。两个表位可存在于同一抗原上,或其可存在于两种不同抗原上。
[0063]
除非另外说明,否则如本文所使用,术语“fgfr”涵盖任何和所有成纤维细胞生长因子受体家族成员(fgfr1-fgfr4),并且意图涵盖任何形式的fgfr,例如1)原生未加工的fgfr分子、“全长”fgfr链或fgfr的天然存在的变体,包含例如等位基因变体;2)由在细胞中加工产生的任何形式的fgfr,例如不同剪接形式,例如fgfr1b、fgfr1c、fgfr2a、fgfr2b、fgfr2c等;或3)通过重组方法产生的fgfr亚基的片段(例如截短形式、细胞外/跨膜域)或修饰的形式(例如突变形式、糖基化/聚乙二醇化、his标记/免疫荧光融合形式)。如本文所使用,“fgfr”可来源于任何脊椎动物来源,包含哺乳动物,如灵长类动物(例如人类、猴)和啮齿动物(例如小鼠和大鼠)。
[0064]
术语“fgfr2iiib”和“fgfr2b”可互换使用,意思指fgfr2的亚型iiib剪接形式。例示性fgfr2b序列包含智人(人类)fgfr2b蛋白质(例如带信号肽的前体序列,genbank获取编号:np_075259.4);褐家鼠(rattus norvegicus)(大鼠)fgfr2b蛋白质(例如全序列,genbank获取编号:np_001103363.1);小家鼠(mus musculus)(小鼠)fgfr2b蛋白质(例如全序列,genbank获取编号:np_963895.2)。
[0065]“fgfr2iiic”或“fgfr2c”可互换使用,意思指fgfr2的亚型iiic剪接形式。例示性fgfr2c序列包含人fgfr2c蛋白质(例如前体序列,genbank获取编号:np_000132.3);褐家鼠(大鼠)fgfr2c蛋白质(全序列,genbank获取编号:np_001103362.1);小家鼠(小鼠)fgfr2c蛋白质(全序列,genbank获取编号:np_034337.2)。
[0066]
术语“fgfr1iiib”和“fgfr1b”可互换使用,意思指fgfr1的亚型iiib剪接形式。例
示性fgfr1b序列包含智人(人类)fgfr1b蛋白质(例如带信号肽的前体序列,uniprotkb获取编号:p11362-19);小家鼠(小鼠)fgfr1b蛋白质(例如带信号肽的前体序列,uniprotkb获取编号:p16092-5)。
[0067]
术语“抗fgfr2b抗体”是指能够特异性结合至fgfr2b的抗体。在一些实施例中,本文所提供的抗fgfr2b抗体能够特异性结合至fgfr2b和fgfr1b两者,但不结合至fgfr2c和fgfr1c,或与fgfr2c和fgfr1c的结合不太强(例如与fgfr2c或fgfr1c的结合亲和力比与fgfr2b或fgfr1b的结合亲和力要低至少10倍、或要低至少50倍、或要低至少100倍、或要低至少200倍)。在一些实施例中,本文所提供的抗fgfr2b抗体与fgfr2c不具有可检测的结合亲和力。
[0068]
如本文所使用,术语“特异性结合(specific binding/specifically binds)”是指两个分子之间,如抗体与抗原之间的非随机结合反应。本文所提供的抗体和抗原结合片段的结合亲和力可由kd值表示,kd表示当抗原和抗原结合分子(例如抗体和抗原结合片段)之间的结合达到平衡时解离速率与缔合速率的比率(k
off
/k
on
)。抗原结合亲和力(例如kd)可使用本领域中已知的适合方法,包含例如biacore技术(该技术是基于表面等离子体共振技术,参见例如murphy,m.等人,《最新蛋白质科学实验指南(current protocols in protein science)》,第19章,第19.14单元,2006)、kinexa技术(参见例如darling,r.j.等人,《测定与药物开发技术(assay drug dev.technol.)》,2(6):647-657(2004))和流式细胞术适当地确定。
[0069]
如本文所使用,“竞争结合”能力是指抗体或抗原结合片段抑制两个分子(例如人fgfr2b和抗fgfr2b抗体)之间的结合相互作用达到任何可检测程度(例如抑制至少85%、或至少90%、或至少95%)的能力。本领域的普通技术人员应认识到,无需过度实验即可确定给定抗体是否与本公开的抗体(例如ab 21、ab 21c、ab hu21-21或ab hu21-26,如下文所定义)竞争结合至fgfr 2b和/或fgfr1b。
[0070]
如本文所使用,术语“表位”是指在抗体所结合的抗原上的原子或氨基酸的特定的组。
[0071]
与氨基酸序列有关的“保守取代”是指氨基酸残基被含具有类似物理化学特性的侧链的不同氨基酸残基置换。例如,可在具有疏水性侧链的氨基酸残基(例如met、ala、val、leu和ile)间、具有中性亲水性侧链的残基(例如cys、ser、thr、asn和gln)间、具有酸性侧链的残基(例如asp、glu)间、具有碱性侧链的氨基酸(例如his、lys和arg)间、或具有芳香族侧链的残基(例如trp、tyr和phe)间进行保守取代。如本领域中所知,保守取代通常不会引起蛋白质构形结构的显著变化,并因此可保持蛋白质的生物活性。
[0072]
如本文所使用,术语“同源物”和“同源”是可互换的并且是指当最佳地对准时与另一序列具有至少80%(例如至少85%、88%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%)序列同一性的核酸序列(或其互补链)或氨基酸序列。
[0073]
与氨基酸序列(或核酸序列)有关的“序列同一性百分比(%)”定义为在对准候选序列与参照序列并在必要时,引入空位以使一致氨基酸(或核酸)达到最大数量之后,该候选序列中与该参照序列中的氨基酸(或核酸)残基一致的氨基酸(或核酸)残基的百分比。氨基酸残基的保守取代可视为或可不视为一致残基。出于确定氨基酸(或核酸)序列同一性百分比的目的进行的比对可例如使用可公开获得的工具,如blastn、blastp(可见于美国国家
生物技术信息中心(u.s.national center for biotechnology information,ncbi)的网站,另参见altschul s.f.等人,《分子生物学杂志(j.mol.biol.)》,215:403-410(1990);stephen f.等人,《核酸研究(nucleic acids res.)》,25:3389-3402(1997))、clustalw2(可见于欧洲生物信息研究所(european bioinformatics institute)网站,另参见higgins d.g.等人,《酶学方法(methods in enzymology)》,266:383-402(1996);larkin m.a。等人,《生物信息学(bioinformatics)》(英格兰牛津(oxford,england)),23(21):2947-8(2007)))和align或megalign(dnastar)软件实现。本领域的普通技术人员可使用所述工具提供的默认参数,或可定制适于比对的参数,如通过选择适合算法进行。
[0074]“分离的”物质已通过人工方式自天然状态改变。如果“分离的”组合物或物质存在于自然界中,则该组合物或物质已经从其原始环境改变或从其原始环境移出,或这两种情况都有。例如,天然地存在于活动物体内的多核苷酸或多肽不是“分离”的,但如果该多核苷酸或多肽与其天然状态的共存材料充分地分离,由此以大体上纯的状态存在,则该多核苷酸或多肽是“分离的”。“分离的多核苷酸序列”是指分离的多核苷酸分子的序列。在某些实施例中,“分离的抗体”是指具有至少60%、70%、75%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的纯度的抗体,所述纯度是通过电泳法(如sds-page、等电聚焦、毛细电泳法)或色谱法(如离子交换色谱或反相hplc)确定。
[0075]
如本文所使用,“效应功能”是指由抗体fc区与其效应物,如c1复合物与fc受体结合引起的生物活性。例示性效应功能包含:由抗体与c1复合物上的c1q的相互作用诱导的补体依赖性细胞毒性(cdc);由抗体fc区与效应细胞上的fc受体结合所诱导的抗体依赖性细胞介导的细胞毒性(adcc);以及吞噬作用。
[0076]“抗体依赖性细胞介导的细胞毒性”和“adcc”是指一种细胞介导的反应,在该反应中,表达fc受体(fcr)的效应细胞识别结合于靶细胞上的抗体或抗原结合片段且随后引起靶细胞溶解。“adcc活性”是指如上文所描述,结合于靶细胞上的抗体或抗原结合片段引起adcc反应的能力。
[0077]“靶细胞”是包含fc区的抗体所特异性结合的细胞,该结合一般通过在fc区c末端的蛋白质部分实现。“效应细胞”是表达一种或多种fc受体并执行效应功能的白细胞。优选地,所述细胞至少表达fcγriii并执行adcc效应功能。介导adcc的人白细胞的实例包括外周血单核细胞(pbmc)、自然杀伤(nk)细胞、单核细胞、细胞毒性t细胞以及嗜中性粒细胞;其中优选pbmc和nk细胞。效应细胞可从其原生来源,例如,如本领域中所知从血液或pbmc分离。
[0078]
如本文所使用,“载体”是指当引入适当细胞宿主中时能够复制/克隆其中所包含的所需核酸片段,或能够表达由此类所需核酸片段所编码的蛋白质的多核苷酸分子。载体的实例包含克隆载体和表达载体两种。如本文所使用,术语“表达载体”是指编码蛋白质的多核苷酸可以被可操作地插入以引起该蛋白质表达的媒介物。表达载体可以含有多种用于控制表达的元件,包含启动子序列、转录起始序列、增强子序列、选择性元件和报导基因。此外,所述载体可以含有复制起点。
[0079]
如本文所使用,短语“宿主细胞”是指引入了外源多核苷酸和/或表达载体的细胞。
[0080]
如本文所使用,病况的“治疗(treating/treatment)”包含预防或减轻病况、减缓
病况的发作或发展速率、降低发展病况的风险、预防或延迟与病况有关的症状的发展、减少或消除与病况有关的症状、产生病况的完全或部分消退、治愈病况或其某种组合。
[0081]
如本文所使用,“fgfr 2b和/或fgfr 1b相关”疾病或病况是指易于用fgfr2b调节剂和/或fgfr1b调节剂治疗,或与fgfr2b和/或fgfr1b表达或过度表达相关的任何疾病或病况。在一些实施例中,fgfr 2b和/或fgfr 1b相关疾病或病况是癌症,以及任选地fgfr2b和/或fgfr1b表达呈阳性或表达增加的癌症。
[0082]
如本文所使用,“癌症”是指以恶性细胞生长或赘瘤、异常增殖、浸润或转移为特征的任何医学病况,并且包含实体肿瘤和非实体癌两种。如本文所使用,“实体肿瘤”是指赘生性和/或恶性细胞的固体块。“非实体癌”是指恶性血液病,如白血病、淋巴瘤、骨髓瘤和其它恶性血液病。癌症或肿瘤的实例包含恶性血液病(例如淋巴瘤、霍奇金氏淋巴瘤(hodgkin's lymphoma)、非霍奇金淋巴瘤和b细胞淋巴瘤)、口腔癌(例如唇、舌或咽的癌瘤)、消化器官(例如食道、胃、小肠、结肠、大肠或直肠)、腹膜、肝脏和胆道、胰腺、呼吸系统如喉或肺(小细胞和非小细胞)、骨、结缔组织、皮肤(例如黑素瘤)、乳房、生殖器官(输卵管、子宫、子宫颈、睾丸、卵巢或前列腺)、泌尿道(例如膀胱或肾)、脑和内分泌腺如甲状腺的肿瘤。在某些实施例中,癌症选自卵巢癌、子宫内膜癌、乳癌、肺癌(小细胞或非小细胞肺癌)、膀胱癌、结肠癌、前列腺癌、子宫颈癌、结肠直肠癌、胰腺癌、胃癌、食道癌、肝细胞癌(肝癌)、肾细胞癌(肾癌)、头颈癌、间皮瘤、黑素瘤、肉瘤和脑肿瘤(例如神经胶质瘤,如胶质母细胞瘤)。
[0083]
术语“药学上可接受的”指示,指定载体、媒剂、稀释剂、赋形剂和/或盐一般在化学上和/或物理上与构成配制物的其它成分相容,并且在生理上与其接受者相容。
[0084]
抗fgfr2b抗体
[0085]
本公开提供了包括ab 21的一个或多个(例如1、2、3、4、5或6个)cdr序列的抗fgfr2b抗体。表1显示ab 21的cdr序列。如本文所使用,术语“ab 21”是指具有seq id no:12的重链可变区和seq id no:14的轻链可变区的小鼠单克隆抗体。ab 21特异性结合至fgfr2b和fgfr1b两者。
[0086]
表1.ab 21的cdr氨基酸序列
[0087][0088]
已知cdr引起抗原结合,但已发现,并非全部6个cdr都是必不可少的或不可改变的。换句话说,可更换或改变或修饰ab 21中的一个或多个cdr,但大体上保持与fgfr,特别是fgfr2b和fgfr1b的特异性结合亲和力。
[0089]
在某些实施例中,本文所提供的抗fgfr2b抗体可在表1中所提供的一个或多个cdr区中包括一个或多个修饰或取代。此类变体保持其亲本抗体与fgfr2b和/或fgfr1b的特异性结合亲和力,但其特性可具有一种或多种改良,如较高抗原结合亲和力或降低的糖基化可能性。
[0090]
在某些实施例中,本文所提供的抗fgfr2b抗体可被修饰成移除cdr区内(或可变区内)的一个或多个asn或asp热点。此类asn和asp热点可导致抗体降解并因此降低抗体的稳
定性。cdr区内的例示性推定的热点基元(motif)包含asn-gly、asn-thr、asn-ser、asn-asn、asp-gly、asp-thr、asp-ser、asp-asp以及asp-his。在某些实施例中,ab 21的hcdr2被修饰成移除asn-gly(ng)热点。在某些实施例中,修饰的hcdr2包含seq id no:7(aiypenrdinynqkfkg)。
[0091]
在一些实施例中,本文所提供的抗fgfr2b抗体包含seq id no:5的重链cdr3序列,和任选地seq id no:6的轻链cdr3。重链cdr3区位于抗原结合位点的中心,并因此认为该区域最易与抗原接触并向抗体对抗原的亲和力提供最大自由能。另外,根据多种多样化机制(multiple diversification mechanisms),相信就长度、氨基酸组成和构形来说,重链cdr3是迄今为止抗原结合位点最多样化的cdr(tonegawa s.,《自然》302:575-81.(1983))。重链cdr3的多样性足以产生大部分抗体特异性(xu jl,davis mm.《免疫》13:37-45(2000))以及所需的抗原结合亲和力(schier r等《分子生物学杂志》263:551-67(1996))。
[0092]
在某些实施例中,本文所提供的抗fgfr2b抗体还包括适合构架区(fr)序列,只要所述抗体能特异性结合至fgfr2b和/或fgfr1b。表1中所提供的cdr序列是从小鼠抗体获得,但这些序列可使用本领域中已知的适合方法,如重组技术移植至任何适合物种,如小鼠、人类、大鼠、兔等的任何适合fr序列上。
[0093]
在某些实施例中,本文所提供的抗fgfr2b抗体是人源化的。本文所提供的例示性人源化抗体包含ab hu21-21和ab hu21-26。
[0094]
如本文所使用,“ab hu21-21”是指基于ab 21的人源化抗体,该抗体具有seq id no:16的重链可变区和seq id no:10的轻链可变区。
[0095]
如本文所使用,“ab hu21-26”是指基于ab 21的人源化抗体,该抗体具有seq id no:8的重链可变区和seq id no:10的轻链可变区。ab hu21-26的重链可变区序列(seq id no:8)除存在g56r突变外,在其它方面与ab hu21-21的重链可变区序列(seq id no:16)一致,该突变移除了hcdr2中的ng热点。
[0096]
在某些实施例中,本文所提供的抗fgfr2b抗体还包括免疫球蛋白恒定区,任选地人免疫球蛋白,任选地人igg。在一些实施例中,免疫球蛋白恒定区包含重链和/或轻链恒定区。重链恒定区包括ch1、铰链和/或ch2-ch3区。在某些实施例中,重链恒定区包含fc区。在某些实施例中,轻链恒定区包含cκ或cλ。
[0097]
在某些实施例中,本文所提供的抗fgfr2b抗体是包含小鼠可变区和人恒定区的嵌合抗体。如本文所使用,“ab 21c”是指基于ab 21的嵌合抗体,该抗体包括分别与人重链恒定区和人轻链恒定区融合的seq id no:12的小鼠重链可变区和seq id no:14的小鼠轻链可变区。
[0098]
表2和表3显示例示性抗体的可变区序列。
[0099]
表2.例示性抗体的可变区的氨基酸序列
[0100]
[0101][0102]
表3.例示性抗体的可变区的核苷酸序列
[0103]
[0104][0105]
在某些实施例中,本文所提供的抗fgfr2b抗体可在本文所提供的一个或多个可变区序列中含有一个或多个修饰或取代,仍保持与fgfr2b和/或fgfr 1b的特异性结合亲和力。在某些实施例中,cdr序列、fr序列或可变区序列中的取代中的至少一个(或全部)包括保守取代。
[0106]
本领域中已知的各种方法均可用于达成此目的。例如,可使用噬菌体展示技术产生并表达抗体变体(如fab或scfv变体)的文库,接着,针对与人fgfr2b和/或fgfr1b的结合亲和力进行筛选。又,例如可使用计算机软件虚拟地模拟抗体与fgfr2b和/或fgfr1b的结合,并鉴别抗体上形成结合界面的氨基酸残基。此类残基可避免进行取代,以便防止结合亲和力的降低,或作为取代的目标以实现较强结合。
[0107]
在某些实施例中,本文所提供的抗fgfr2b抗体在seq id no:1-7内的一个或多个cdr序列、和/或一个或多个fr序列中包含一个或多个氨基酸残基取代。在某些实施例中,cdr序列和/或fr序列中总计进行不超过10、9、8、7、6、5、4、3、2或1个取代。
[0108]
在某些实施例中,抗fgfr2b抗体包含与seq id no:1-7中所列的cdr序列具有至少80%(例如至少85%、88%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%)序列同一性的1、2、3、4、5或6个cdr序列,并且同时保持与其亲本抗体类似或甚至更高水平的与fgfr2b和/或fgfr1b的结合亲和力。
[0109]
在某些实施例中,抗fgfr2b抗体包含与表2中所列的可变区序列具有至少80%(例如至少85%、88%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%)序列同一性的一个或多个可变区序列,并且同时保持与其亲本抗体类似或甚至更高水平的与fgfr2b和/或fgfr1b的结合亲和力。在一些实施例中,表2中所列的可变区序列中总计有1至10个氨基酸被取代、插入或缺失。在某些实施例中,取代、插入或缺失发生于cdr外部的区域中(例如fr中)。
[0110]
在某些实施例中,本文所提供的抗fgfr2b抗体包含能够诱导效应功能,如adcc或cdc的恒定区。效应功能,如adcc和cdc可引起对表达fgfr的细胞的细胞毒性,并且可使用各种测定法,如fc受体结合测定法、c1q结合测定法和细胞裂解测定法评价。在某些实施例中,恒定区属于igg1同种型,已知其诱导adcc。
[0111]
在某些实施例中,抗fgfr2b抗体在恒定区中包括使adcc增强的一个或多个修饰。如本文所使用,术语“增强的adcc”定义为在包围靶细胞的培养基中给定浓度的抗体存在下,由以上所定义的adcc机制引起的在给定时间中裂解的靶细胞的数量增加,和/或在包围靶细胞的培养基中,由adcc机制引起的给定时间中给定数量靶细胞裂解所需的抗体浓度减小。
[0112]
为了评估所关注分子的adcc活性,可执行体外adcc测定法,如美国专利第5,500,362号;hellstrom等人《美国国家科学院院刊》83,7059-7063(1986);和hellstrom等人,《美国国家科学院院刊》82,1499-1502(1985);美国专利第5,821,337号;或bruggemann等人,《实验医学杂志(j exp med)》166,1351-1361(1987)中所述的adcc测定法。或者,可采用非放射性测定法(参见例如用于流式细胞术的acti
tm
非放射性细胞毒性测定法(加利福尼亚州山景城(mountain view,ca)的cell technology inc.);以及cytotox非放射性细胞毒性测定法(威斯康星州麦迪逊(madison,wi)的promega))。另外,所关注分子的adcc活性可以在体内,例如在如clynes等人,《美国国家科学院院刊》,95:652-656(1998)中所公开的动物模型中评估。
[0113]
增强adcc的各种方法在现有技术中已有描述。例如,已证明fc区中的氨基酸残基的子集涉及与fcγr的结合,如fc区中的以下氨基酸残基(残基按eu编号)涉及与人fcγriiia的结合:(1)lys274-arg301和tyr407-arg416(sarmay等人(1984)《分子免疫学(mol.immunol.)》,21:43-51和gergely等人(1984)《生物化学学会学报(biochem.soc.tans.)》,12:739-743);(2)leu234-ser239、asp265-glu269、asn297-thr299和ala327-ile332(sondermann等人(2000)《自然》,406:267-273);和(3)t256、k290、s298、e333、k334、a339(shields等人(2001)《生物化学杂志》,276:6591-6604;以及美国专利申请第2004/0228856号)。以上所列的氨基酸残基可突变以增强adcc活性,例如在shields等人(2001),《生物化学杂志》9(2),6591-6604中,经证实,相较于原生序列,fc变体t256a、k290a、s298a、e333a、k334a和a339t可增强adcc活性。
[0114]
或者,可通过对抗体的糖基化形式进行工程改造,获得增强的adcc活性。据报导,
多种糖基化形式可通过增强其与效应细胞的fc受体的结合来增强抗体的adcc活性。不同糖基化形式包含连接至抗体的聚糖的若干形式中的任何,具有不同糖(例如缺乏一种类型的糖,如岩藻糖,或具有较高水平的一种类型的糖,如甘露糖),或具有不同结构(例如各种分支结构,如双触角(两个分支)、三触角(三个分支)或四触角(四个分支)结构)。
[0115]
在某些实施例中,本文所提供的抗fgfr2b抗体经历糖基工程改造。“糖基工程改造的”抗体或抗原结合片段可具有相较于其未经历糖基工程改造的对应物增加或降低的糖基化水平、糖基化形式变化或两者。在某些实施例中,糖基工程改造的抗体展现相较于其未经历工程改造的对应物增强的adcc活性。在一些实施例中,增强的adcc活性以表达fgfr2b的细胞的裂解提高至少10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、65%、70%或75%为特征。
[0116]
所述抗体可通过本领域中已知的方法进行糖基工程改造,包含针对肽主链的任何操作(例如修饰氨基酸序列和/或个体氨基酸的侧链基团)和/或通过宿主细胞系对翻译后修饰的操作(例如修饰糖基化模式)。通过对抗体进行糖基化工程改造来改变adcc活性的方法在本领域中也已有描述,参见例如weikert等人(1999)《自然-生物技术(nature biotech.)》,17:116-121;shields r.l.等人(2002),《生物化学杂志》,277:26733-26740;shinkawa等人(2003),《生物化学杂志》,278,3466-3473;ferrara等人(2006),《生物技术与生物工程(biotech.bioeng.)》,93,851-861;yamane-ohnuki等人(2004),《生物技术与生物工程》,87,614-622;niwa等人(2006),《免疫学方法杂志》306,151-160;shinkawa t.等人,《生物化学杂志》,(2003),278:3466-3473。
[0117]
在一些实施例中,本文所提供的糖基工程改造的抗体是无岩藻糖基化的(即,不含岩藻糖)。若干研究显示,无岩藻糖基化(即,缺乏岩藻糖或未岩藻糖基化)的抗体展现与fcγriii的结合增加并因此引起较高的adcc活性(shields等人(2002)《生物化学杂志》,277:26733-26740;shinkawa等人(2003)《生物化学杂志》,278:3466-3473;以及欧洲专利申请公开第1176195号)。在一些实施例中,本文所提供的无岩藻糖基化抗体在重链的天冬酰胺297(asn297)(基于kabat编号)处没有岩藻糖。asn297是在抗体igg1同种型的fc区的每个ch2域中存在的保守n-连接糖基化位点(arnold等人,《糖生物学与医学(glycobiology and medicine)》,564:27-43,2005)。
[0118]
在一些实施例中,本文所提供的糖基工程改造的抗体以高甘露糖糖基化形式(例如甘露糖e5、甘露糖7、8、9聚糖)为特征。经证实,高甘露糖糖基化形式可增强adcc活性(yu等人(2012),兰德斯生物医学(landes bioscience),mabs 4:4,475-487)。
[0119]
在一些实施例中,本文所提供的抗体在其恒定区内还包括一个或多个修饰,所述修饰:a)引入或移除糖基化位点、b)引入游离半胱氨酸残基、c)增强与活化fc受体的结合、和/或d)增强adcc。
[0120]
抗fgfr2b抗体或其抗原结合片段可包含具有可连接碳水化合物部分(例如寡糖结构)的侧链的一个或多个氨基酸残基。抗体的糖基化典型地是n-连接或o-连接的。n-连接是指碳水化合物部分与天冬酰胺残基,例如三肽序列如天冬酰胺-x-丝氨酸和天冬酰胺-x-苏氨酸中的天冬酰胺残基的侧链连接,其中x是除脯氨酸外的任何氨基酸。o-连接糖基化是指糖n-乙酰基半乳糖胺、半乳糖或木糖中的一种与羟基氨基酸,最常见地与丝氨酸或苏氨酸的连接。天然糖基化位点的移除可便利地实现,例如通过改变氨基酸序列以使得抗体序列
中存在的上述三肽序列(对于n-连接糖基化位点)中的一个或丝氨酸或苏氨酸残基(对于o-连接糖基化位点)被取代来实现。可按类似方式,通过引入此类三肽序列或者丝氨酸或苏氨酸残基来产生新的糖基化位点。
[0121]
本文所提供的抗fgfr2b抗体也涵盖半胱氨酸工程改造的变体,该变体包括一个或多个引入的游离半胱氨酸氨基酸残基。游离半胱氨酸残基是不作为二硫桥键一部分的半胱氨酸残基。半胱氨酸工程改造的变体可用于在工程改造的半胱氨酸位点处,通过例如顺丁烯二酰亚胺或卤代乙酰基与例如细胞毒性和/或成像化合物、标记、或放射性同位素等缀合。对抗体工程改造以引入游离半胱氨酸残基的方法是本领域中已知的,参见例如wo2006/034488。
[0122]
本文所提供的抗fgfr2b抗体还涵盖fc变体,该变体在其fc区和/或铰链区包括一个或多个氨基酸残基修饰或取代。在某些实施例中,抗fgfr2b抗体包括一个或多个改善与新生儿fc受体(fcrn)的ph依赖性结合的氨基酸取代。此类变体可具有延长的药物动力学半衰期,因为该变体在酸性ph值下结合至fcrn,使其避免在转运溶酶体中降解,然后转位并从细胞释放出来。对抗体和其抗原结合片段工程改造以改善与fcrn的结合亲和力的方法是本领域中众所周知的,参见例如vaughn,d.等人,《结构(structure)》,6(1):63-73(1998);kontermann,r.等人,《抗体工程(antibody engineering)》,第1卷,第27章:改善pk的fc区工程改造(engineering of the fc region for improved pk),springer出版,2010;yeung,y.等人,《癌症研究(cancer research)》,70:3269-3277(2010);以及hinton,p.等人,《免疫学杂志(j.immunology)》,176:346-356(2006)。
[0123]
结合特性
[0124]
本文所提供的抗fgfr2b抗体能够特异性结合至fgfr2b和fgfr1b。在某些实施例中,本文所提供的抗体特异性结合至人fgfr2b和/或fgfr1b且其结合亲和力(kd)≤10-6
m(例如≤5
×
10-7
m、≤2
×
10-7
m、≤10-7
m、≤5
×
10-8
m、≤2
×
10-8
m、≤10-8
m、≤5
×
10-9
m、≤4
×
10-9
m、≤3
×
10-9
m、≤2
×
10-9
m、≤10-9
m、≤9
×
10-10
m、≤8
×
10-10
m、≤7
×
10-10
m、≤6
×
10-10
m、≤5
×
10-10
m、≤4
×
10-10
m、≤3
×
10-10
m、≤2.5
×
10-10
m、≤2
×
10-10
m、≤1.5
×
10-10
m、≤10-10
m、≤9
×
10-11
m、≤5
×
10-11
m、≤4
×
10-11
m、≤3
×
10-11
m、≤2
×
10-11
m、或≤10-11
m)。
[0125]
在某些实施例中,本文所提供的抗fgfr2b抗体能够特异性结合至人fgfr2b且其结合亲和力(kd)不超过5
×
10-9
m、不超过4
×
10-9
m、不超过3
×
10-9
m、不超过2
×
10-9
m、不超过10-9
m、不超过5
×
10-10
m、不超过4
×
10-10
m、不超过3
×
10-10
m、不超过2
×
10-10
m、不超过10-10
m、不超过5
×
10-11
m、或不超过4
×
10-11
m、不超过3
×
10-11
m、不超过2
×
10-11
m,该kd是通过biacore测量。
[0126]
在一些实施例中,本文所提供的抗fgfr2b抗体能够特异性结合至人fgfr1b且其结合亲和力(kd)不超过5
×
10-9
m、不超过4
×
10-9
m、不超过3
×
10-9
m、不超过2
×
10-9
m、不超过10-9
m、不超过5
×
10-10
m、不超过4
×
10-10
m、不超过3
×
10-10
m、不超过2
×
10-10
m、不超过10-10
m、不超过5
×
10-11
m、或不超过4
×
10-11
m、不超过3
×
10-11
m、不超过2
×
10-11
m,该kd是通过biacore测量。
[0127]
在某些实施例中,本文所提供的抗fgfr2b抗体与食蟹猕猴fgfr对应物、大鼠fgfr对应物和小鼠fgfr对应物交叉反应。
[0128]
抗体与人fgfr2b和/或fgfr1b的结合也可由“半数最大有效浓度”(ec
50
)值表示,
biophysical methods)》24:107-117(1992);以及brennan等人,《科学(science)》,229:81(1985))、由宿主细胞如大肠杆菌重组表达(例如对于fab、fv和scfv抗体片段)、自如上文所论述的噬菌体展示文库筛选(例如对于scfv)以及两个fab'-sh片段化学偶合形成f(ab')2片段(carter等人,《生物技术(bio/technology)》10:163-167(1992))。用于制造抗体片段的其它技术对于熟练技术人员是显而易见的。
[0137]
在某些实施例中,抗原结合片段是scfv。scfv的产生描述于例如wo 93/16185;美国专利第5,571 894号和第5,587,458号中。scfv可在氨基或羧基末端处与效应蛋白融合以提供融合蛋白(参见例如《抗体工程》,borrebaeck编)。
[0138]
缀合物
[0139]
在一些实施例中,抗fgfr2b抗体进一步包括缀合物部分。所述缀合物部分可连接至本文所提供的抗体。缀合物部分是可连接至抗体的非蛋白质或肽部分。考虑多种缀合物部分可连接至本文所提供的抗体(参见例如“缀合型疫苗(conjugate vaccines)”,对微生物学与免疫学的贡献(contributions to microbiology and immunology),j.m.cruse和r.e.lewis,jr.(编),carger press,纽约(1989))。缀合物部分可通过共价结合、亲和力结合、嵌入、配位结合、复合、缔合、共混合或添加等方法连接至所述抗体。
[0140]
在某些实施例中,抗fgfr2b抗体通过连接子连接至一个或多个缀合物。在某些实施例中,连接子是肼连接子、二硫化物连接子、双官能连接子、二肽连接子、葡萄糖苷酸连接子或硫醚连接子。在某些实施例中,连接子是溶酶体可切割的二肽,例如缬氨酸-瓜氨酸(vc)。
[0141]
缀合物部分可以是治疗剂(例如细胞毒性剂)、放射性同位素、可检测标记(例如镧系元素、发光标记、荧光标记或酶-底物标记)、药物动力学调节部分或纯化部分(如磁珠或纳米粒子)。
[0142]
可检测标记的实例可包含用于检测的荧光标记(例如荧光素、罗丹明(rhodamine)、丹磺酰基、藻红蛋白或德克萨斯红(texas red))、酶-底物标记(例如辣根过氧化酶、碱性磷酸酶、荧光素酶、葡糖淀粉酶、溶菌酶、糖氧化酶或β-d-半乳糖苷酶)、放射性同位素、发光标记、发色部分、地高辛(digoxigenin)、生物素/抗生物素蛋白、dna分子或金。
[0143]
放射性同位素的实例可包含
123
i、
124
i、
125
i、
131
i、
35
s、3h、
111
in、
112
in、
14
c、
64
cu、
67
cu、
86
y、
88
y、
90
y、
177
lu、
211
at、
186
re、
188
re、
153
sm、
212
bi、
32
p和其它镧系元素。放射性同位素标记的抗体可用于受体靶向成像实验。
[0144]
在某些实施例中,药物动力学调节部分可以是有助于增加抗体半衰期的清除调节剂。示例性实例包含水溶性聚合物,如peg、羧甲基纤维素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮、乙二醇/丙二醇共聚物等。所述聚合物可具有任何分子量,并且可以是分支或未分支的。与抗体连接的聚合物的数量可以变化,并且如果连接多个聚合物,它们可以是相同或不同的分子。
[0145]
在某些实施例中,缀合物部分可以是纯化部分,如磁珠或纳米粒子。
[0146]
抗体-药物缀合物
[0147]
在某些实施例中,本文所提供的缀合物是抗体-药物缀合物(adc),其包含与细胞毒性剂缀合的任何以上抗fgfr2b抗体中。换句话说,缀合物部分包含细胞毒性剂。
[0148]
adc可用于局部递送细胞毒性剂,例如以治疗癌症。这允许将细胞毒性剂靶向递送
至肿瘤和其中的细胞内积累,它特别适用于全身施用这些未缀合的细胞毒性剂可能对正常细胞以及欲消除的肿瘤细胞引起不可接受水平的毒性的情形(baldwin等人(1986),《柳叶刀(lancet)》,603-05;thorpe,(1985),《单克隆抗体(monoclonal antibodies)》,84;pinchera等人(编),《生物与临床应用(biological and clinical applications)》,475-506;syrigos和epenetos(1999),《抗癌研究(anticancer research)》19:605-614;niculescu-duvaz和springer(1997)《先进药物递送评论(adv.drg del.rev.)》26:151-172;以及美国专利第4,975,278号)。
[0149]“细胞毒性剂”可以是对癌细胞有害或可损伤或杀灭癌细胞的任何药剂。在某些实施例中,细胞毒性剂任选地是化学治疗剂(如生长抑制剂、dna烷基化剂、拓扑异构酶抑制剂、微管蛋白结合物或其它抗癌药)、毒素或高反应性放射性同位素。
[0150]
细胞毒性剂的实例包含大分子细菌毒素和植物毒素,如白喉毒素、外毒素a链(来自绿脓杆菌(pseudomonas aeruginosa))、蓖麻毒素、相思子毒素、莫迪素(modeccin)、α-八叠球菌素(alpha-sarcin)、油桐蛋白质、康乃馨蛋白质、洋商陆蛋白质(pari、papii和pap-s)、苦瓜抑制剂、麻疯树毒蛋白、巴豆毒素、肥阜草抑制剂、白树素、局限曲菌素、酚霉素(phenomycin)、伊诺霉素(enomycin)和单端孢霉烯(参见例如wo 93/21232)。此类大分子毒素可使用本领域中已知的方法,例如vitetta等人(1987)《科学》,238:1098中所描述的方法与本文所提供的抗体缀合。
[0151]
细胞毒性剂也可以是小分子毒素和化学治疗药物,如格尔德霉素(geldanamycin)(mandler等人(2000)《国家癌症研究所杂志(jour.of the nat.cancer inst.)》92(19):1573-1581;mandler等人(2002)《生物缀合化学(bioconjugate chem.)》13:786-791)、类美登素(maytansinoids)(ep 1391213;liu等人(1996)《美国国家科学院院刊》93:8618-8623)、卡奇霉素(calicheamicin)(lode等人(1998)《癌症研究》58:2928;hinman等人(1993)《癌症研究》53:3336-3342)、紫杉醇(taxol)、细胞松弛素b(cytochalasin b)、短杆菌肽d(gramicidin d)、溴化乙锭(ethidium bromide)、吐根素(emetine)、丝裂霉素(mitomycin)、依托泊苷(etoposide)、替尼泊苷(tenoposide)、长春新碱(vincristine)、长春碱(vinblastine)、长春地辛(vindesine)、秋水仙碱(colchicin)、小红莓(doxorubicin)、柔红霉素(daunorubicin)、二羟基炭疽菌素二酮(dihydroxy anthracin dione)、米托蒽醌(mitoxantrone)、光神霉素(mithramycin)、放线菌素d(actinomycin d)、1-去氢睪固酮、糖皮质激素、普鲁卡因(procaine)、丁卡因(tetracaine)、利多卡因(lidocaine)、普萘洛尔(propranolol)、嘌呤霉素(puromycin)和其类似物、抗代谢物(例如甲氨蝶呤(methotrexate)、6-巯基嘌呤、6-硫鸟嘌呤、阿糖胞苷(cytarabine)、5-氟尿嘧啶、达卡巴嗪(decarbazine))、烷基化剂(例如甲氮芥(mechlorethamine)、塞替哌(thioepa)苯丁酸氮芥(chlorambucil)、美法仑(melphalan)、卡莫司汀(carmustine)(bsnu)和洛莫司汀(lomustine)(ccnu)、环硫磷酰胺、白消安(busulfan)、二溴甘露醇(dibromomannitol)、链佐霉素(streptozotocin)、丝裂霉素c(mitomycin c)和顺-二氯二胺铂(ii)(ddp)(顺铂(cisplatin))、蒽环霉素(anthracyclines)(例如柔红霉素(先前称为道诺霉素(daunomycin))和多柔比星(doxorubicin))、抗生素(例如放线菌素d(dactinomycin)(先前称为放线菌素)、博莱霉素(bleomycin)、光神霉素和安曲霉素(anthramycin)(amc))、以及抗有丝分裂剂(例如长春新碱和长春碱)、卡奇霉素、类美登素、海兔毒素(dolastatins)、奥
瑞他汀(auristatins)(如单甲基奥瑞他汀e(mmae)和单甲基奥瑞他汀f(mmaf))、单端孢霉烯和cc1065,以及其具有细胞毒性活性的衍生物。此类毒素可使用本领域中已知的方法,例如us7,964,566;kline,t.等人,《药物研究(pharmaceutical research)》32(11):3480-3493中所描述的方法与本文所提供的抗体缀合。
[0152]
细胞毒性剂还可以是高放射性同位素。实例包含at
211
、i
131
、i
125
、y
90
、re
186
、sm
153
、bi
212
、p
32
、pb
212
和lu的放射性同位素。将放射性同位素与抗体缀合的方法是本领域中已知的,例如通过适合配体试剂缀合(参见例如wo94/11026;《免疫学实验室指南(current protocols in immunology)》,第1和2章,coligen等人编,wiley-interscience,new york,n.y.,pubs.(1991))。配体试剂具有能与放射性同位素金属结合、螯合或以其它方式络合的螯合配体,并且还具有与抗体或抗原结合片段中半胱氨酸的硫醇基具有反应性的官能团。例示性螯合配体包含dota、dotp、dotma、dtpa和teta(德克萨斯州达拉斯(dallas,tex.)的macrocyclics)。
[0153]
在某些实施例中,抗体通过连接子,例如肼连接子、二硫化物连接子、双官能连接子、二肽连接子、葡萄糖苷酸连接子或硫醚连接子连接至缀合物部分。
[0154]
例示性双官能连接子包含例如n-琥珀酰亚胺基-3-(2-吡啶基二硫基)丙酸酯(spdp)、琥珀酰亚胺基-4-(n-顺丁烯二酰亚胺基甲基)环己烷-1-甲酸酯(smcc)、亚氨基硫杂环戊烷(it)、亚氨基酯的双官能衍生物(如二亚胺代己二酸二甲酯盐酸盐)、活性酯(如辛二酸二琥珀酰亚胺酯)、醛(如戊二醛)、双叠氮基化合物(如双(对叠氮基苯甲酰基)己二胺)、双重氮衍生物(如双-(对重氮苯甲酰基)-乙二胺)、二异氰酸酯(如2,6-二异氰酸甲苯酯)以及双活性氟化合物(如1,5-二氟-2,4-二硝基苯)。
[0155]
在某些实施例中,连接子在特定生理环境下是可切割的,由此促进细胞毒性剂在细胞中释放。例如,连接子可以是酸不稳定性连接子、肽酶敏感性连接子、光不稳定性连接子、二甲基连接子或含二硫基的连接子(chari等人,《癌症研究》52:127-131(1992);美国专利第5,208,020号)。在一些实施例中,连接子可包括氨基酸残基,如二肽、三肽、四肽或五肽。连接子中的氨基酸残基可以是天然或非天然存在的氨基酸残基。此类连接子的实例包含:缬氨酸-瓜氨酸(vc或val-cit)、丙氨酸-苯丙氨酸(af或ala-phe)、甘氨酸-缬氨酸-瓜氨酸(gly-yal-cit)、甘氨酸-甘氨酸-甘氨酸(gly-gly-gly)、缬氨酸-瓜氨酸-对氨基苯甲氧基羰基(“vc-pab”))。可设计和优化氨基酸连接子组分被特定酶,例如肿瘤相关蛋白酶、组织蛋白酶b、c和d、或纤维蛋白溶酶蛋白酶进行酶裂解的选择性。
[0156]
在某些实施例中,在本文所提供的adc中,抗体(或抗原结合片段)与一种或多种细胞毒性剂以约1比约20、约1比约6、约1比约3、约1比约2、约1比约1、约2比约5或约3比约4的抗体:药剂比率缀合。
[0157]
本文所提供的adc可通过本领域中已知的任何适合方法制备。在某些实施例中,抗体的亲核性基团先与双官能连接子试剂反应,接着连接至细胞毒性剂,或反之亦然,即,细胞毒性剂的亲核性基团先与双官能连接子反应,接着连接至抗体。
[0158]
在某些实施例中,细胞毒性剂可以含有(或被修饰成含有)硫醇基反应性官能团,该官能团可与本文所提供的抗体中游离半胱氨酸的半胱氨酸硫醇基反应。例示性硫醇基反应性官能团包含例如顺丁烯二酰亚胺、碘乙酰胺、吡啶基二硫化物、卤代乙酰基、琥珀酰亚胺基酯(例如nhs、n-羟基琥珀酰亚胺)、异硫氰酸酯、磺酰氯、2,6-二氯三嗪基、五氟苯基酯
或氨基磷酸酯(haugland,2003,《molecular probes荧光探针与研究化合物手册(molecular probes handbook of fluorescent probes and research chemicals)》,molecular probes,inc.;brinkley,1992,《生物缀合化学》3:2;garman,1997,《非放射性标记实践方法(non-radioactive labelling:a practical approach)》,academic press,london;means(1990)《生物缀合化学》1:2;hermanson,g.,《生物缀合技术(bioconjugate techniques)》(1996)academic press,san diego,第40-55页,643-671)。
[0159]
细胞毒性剂或抗体可与连接试剂反应,随后缀合形成adc。例如,可形成、分离、纯化和/或表征细胞毒性剂的n-羟基琥珀酰亚胺基酯(nhs),或其可原位形成并与抗体的亲核性基团反应。
[0160]
在一些实施例中,细胞毒性剂和抗体可在一个步骤中通过原位活化和反应连接以形成adc。在另一个实例中,抗体可与生物素缀合,接着与第二缀合物间接地缀合,该第二缀合物与抗生物素蛋白缀合。
[0161]
在某些实施例中,缀合物部分随机地连接至抗体中表面暴露的特定类型的氨基酸残基,例如半胱氨酸残基或赖氨酸残基。
[0162]
在某些实施例中,缀合物部分连接至明确地确定的位点以提供在药物/抗体比(dar)和连接位点方面具有高度均一性和批次间一致性的adc群体。在某些实施例中,缀合物部分通过天然氨基酸、非天然氨基酸、短肽标签或asn297聚糖连接至抗体分子中明确地确定的位点。例如,缀合可以在表位结合部分外部的特定位点发生。
[0163]
位点特异性连接可通过用氨基酸取代抗体特定位点处的原生氨基酸,或在抗体特定位点之前/之后引入氨基酸来实现,所述氨基酸为药物部分可缀合的氨基酸如半胱氨酸(参见stimmel等人(2000),jbc,275(39):30445-30450;junutula等人(2008),《自然
·
生物技术(nature biotechnology)》,26(8):925-932;以及wo2006/065533)。或者,位点特异性缀合可如axup等人((2012),《美国国家科学院院刊》109(40):16101-16116)所描述,通过将抗体工程改造成在其重链和/或轻链中的特定位点处含有非天然氨基酸(例如对乙酰基苯丙氨酸(pacf)、n6-((2-叠氮基乙氧基)羰基)-l-赖氨酸、对叠氮基甲基-l-苯丙氨酸(pamf)和硒半胱氨酸(sec))实现,其中所述非天然氨基酸提供额外优势,即可设计正交化学以连接该连接子试剂和药物。可用于两种上述位点特异性缀合方法中的例示性特定位点(例如轻链v205、重链a114、s239、h274、q295、s396等)在许多现有技术中有描述,例如strop等人(2013),《化学与生物学(chemistry&biology)》,20,161-167;qun zhou(2017),《生物医学(biomedicines)》,5,64;dimasi等人(2017),《分子制药学(mol.pharm.)》,14,1501-1516;wo2013/093809和wo2011/005481。另一种位点特异性adc缀合方法是聚糖介导的缀合,其中药物-连接子可与位于ch2域中的asn297聚糖(如岩藻糖、半乳糖、n-乙酰基半乳糖胺、n-乙酰氨基葡萄糖、唾液酸)缀合,而非将疏水性相对较强的细胞毒性剂偶合至抗体的氨基酸主链中。也曾尝试通过特定位点(例如n末端或c末端区域中的位点)将独特短肽标签(如llqg、lpetg、lcxpxr)引入抗体中,接着使肽标签中的特定氨基酸官能化并与药物-连接子偶合(strop等人(2013),《化学与生物学》,20,161-167;beerli等人(2015),《公共科学图书馆
·
综合(plos one)》,10,e0131177;wu等人2009),《美国国家科学院院刊》106,3000-3005;rabuka(2012),《自然
·
实验手册(nat.protoc.)》7,1052-1067)。
[0164]
多核苷酸和重组方法
[0165]
本公开提供了分离的多核苷酸,其编码本文所提供的抗fgfr2b抗体。
[0166]
如本文所使用,术语“多核苷酸”是指呈单链或双链形式的脱氧核糖核酸(dna)或核糖核酸(rna)和其聚合物。除非明确限制,否则该术语涵盖含有天然核苷酸的已知类似物的多核苷酸,所述天然核苷酸的已知类似物具有与参照核酸类似的结合特性并且以与天然存在的核苷酸类似的方式代谢。除非另外指示,否则特定多核苷酸序列还隐含地涵盖其保守修饰变体(例如简并密码子取代)、等位基因、直系同源物、snp和互补序列,以及明确指示的序列。确切地说,简并密码子取代可以通过产生以下序列来实现,在所述序列中,一个或多个选定(或全部)密码子的第三位被混合碱基和/或脱氧肌苷残基取代(batzer等人,《核酸研究》,19:5081(1991);ohtsuka等人,《生物化学杂志(j.biol.chem.)》,260:2605-2608(1985);以及rossolini等人,《分子与细胞探针(mol.cell.probes)》8:91-98(1994))。
[0167]
在某些实施例中,分离的多核苷酸包括如seq id no:9、11、13、15、17中所示的一个或多个核苷酸序列和/或其同源序列,和/或其仅具有简并取代的变体,所述同源序列具有至少80%(例如至少85%、88%、90%、92%、93%、94%、95%、96%、97%、98%或99%)序列同一性,并且所述多核苷酸编码本文所提供的例示性抗体的可变区。编码单克隆抗体的dna易于使用常规程序分离和测序(例如通过使用能够与编码抗体重链和轻链的基因特异性结合的寡核苷酸探针)。编码dna也可通过合成方法获得。
[0168]
编码抗fgfr2b抗体的分离的多核苷酸(例如包含如表3中所示的序列)可使用本领域中已知的重组技术插入载体中以便进一步克隆(dna扩增)或表达。有很多载体可供使用。载体组分一般包含但不限于以下一种或多种:信号序列、复制起点、一个或多个标记物基因、增强子元件、启动子(例如sv40、cmv、ef-1α)和转录终止序列。载体还可以包含有助于其进入细胞的材料,包含但不限于病毒颗粒、脂质体或蛋白质包膜。
[0169]
本公开提供了载体(例如克隆载体或表达载体),其含有编码所述抗体的本文所提供的核酸序列、可操作地连接至所述核酸序列的至少一个启动子(例如sv40、cmv、ef-1α)及至少一个选择标记物。载体的其实例包含但不限于质粒;噬菌粒;柯斯质粒(cosmid);和人工染色体,如酵母人工染色体(yac)、细菌人工染色体(bac)或p1源性人工染色体(pac);噬菌体,如λ噬菌体或m13噬菌体;以及动物病毒。用作表达载体的动物病毒的种类包含逆转录病毒(包含慢病毒)、腺病毒、腺相关病毒、疱疹病毒(例如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒和乳多空病毒(例如sv40)。例示性质粒包含pcdna3.3、pmd18-t、poptivec、pcmv、pegfp、pires、pqd-hyg-gseu、palter、pbad、pcdna、pcal、pl、pet、pgemex、pgex、pci、pegft、psv2、pfuse、pvitro、pvivo、pmal、pmono、pselect、puno、pduo、psg5l、pbabe、pwpxl、pbi、p15tv-l、ppro18、ptd、prs10、plexa、pact2.2、pcmv-script.rtm.、pcdm8、pcdna1.1/amp、pcdna3.1、prc/rsv、pcr 2.1、pef-1、pfb、psg5、pxt1、pcdef3、psvsport、pef-bos等。
[0170]
包含编码抗体或抗原结合片段的多核苷酸序列的载体可被引入宿主细胞中进行克隆或基因表达。适合克隆或表达本文所提供的载体的dna的宿主细胞是上述原核生物、酵母或高等真核细胞。用于此目的的适合原核生物包含真细菌,如革兰氏阴性(gram-negative)或革兰氏阳性(gram-positive)生物体,例如肠内菌科(enterobacteriaceae),如埃希氏菌属(escherichia),例如大肠杆菌;肠杆菌属(enterobacter);欧文氏菌属(erwinia);克雷伯氏菌属(klebsiella);变形杆菌属(proteus);沙门氏菌属(salmonella),例如鼠伤寒沙门氏菌(salmonella typhimurium);沙雷氏菌属(serratia),
例如粘质沙雷氏菌(serratia marcescans);和志贺杆菌属(shigella),以及芽孢杆菌属(bacilli),如枯草芽孢杆菌(b.subtilis)和地衣芽孢杆菌(b.licheniformis);假单胞菌属(pseudomonas),如绿脓杆菌;和链霉菌属(streptomyces)。
[0171]
除原核生物外,真核微生物,如丝状真菌或酵母也是编码抗fgfr2b抗体的载体的适合克隆或表达宿主。酿酒酵母(saccharomyces cerevisiae)或常见的烘焙酵母是低级真核宿主微生物中最常用的。然而,多种其它属、种和菌株通常可得到并且适用于本文中,如粟酒裂殖酵母(schizosaccharomyces pombe);克鲁维酵母属(kluyveromyces)宿主,例如乳酸克鲁维酵母(k.lactis)、脆壁克鲁维酵母(k.fragilis)(atcc 12,424)、保加利亚克鲁维酵母(k.bulgaricus)(atcc 16,045)、威克克鲁维酵母(k.wickeramii)(atcc 24,178)、克鲁维雄酵母(k.waltii)(atcc 56,500)、果蝇克鲁维酵母(k.drosophilarum)(atcc36,906)、耐热克鲁维酵母(k.thermotolerans)和马克斯克鲁维酵母(k.marxianus);耶氏酵母属(yarrowia)(ep 402,226);巴斯德毕赤酵母(pichia pastoris)(ep 183,070);假丝酵母属(candida);瑞氏木霉(trichoderma reesia)(ep 244,234);粗糙脉孢菌(neurospora crassa);许旺氏酵母属(schwanniomyces),例如西方许旺酵母(schwanniomyces occidentalis);以及丝状真菌,如脉孢菌属(neurospora)、青霉菌属(penicillium)、弯颈霉属(tolypocladium)和曲霉属(aspergillus)宿主,如构巢曲霉(a.nidulans)和黑曲霉(a.niger)。
[0172]
适合表达此处所提供的抗体或抗原片段的宿主细胞来源于多细胞生物体。无脊椎动物细胞的实例包含植物和昆虫细胞。已经鉴别出多种杆状病毒株和变体以及来自如下宿主的相应容许的昆虫宿主细胞:草地贪夜蛾(spodoptera frugiperda)(毛虫)、埃及伊蚊(aedes aegypti)(蚊子)、白纹伊蚊(aedes albopictus)(蚊子)、黑腹果蝇(drosophila melanogaster)(果蝇)和家蚕(bombyx mori)。多种用于转染的病毒株是公开可得的,例如苜蓿银纹夜蛾(autographa californica)npv的l-1变种和家蚕(bombyx mori)npv的bm-5病毒株,并且根据本发明,这些病毒可以用作本文中的病毒,特别是用于转染草地贪夜蛾细胞。棉、玉米、马铃薯、大豆、矮牵牛、番茄和烟草的植物细胞培养物也可以用作宿主。
[0173]
不过,脊椎动物细胞也已引起极大关注,并且在培养物(组织培养物)中繁殖脊椎动物细胞已变成常规程序。有用哺乳动物宿主细胞系的实例是sv40转化的猴肾cv1细胞系(cos-7,atcc crl 1651);人胚肾细胞系(亚克隆成用于在悬浮培养物中生长的293或293细胞,graham等人,《普通病毒学杂志(j.gen virol.)》36:59,1977);幼仓鼠肾细胞(bhk,atcc ccl 10);小鼠骨髓瘤细胞系(ns0,galfr
è
和milstein(1981),《酶学方法(methods in enzymology)》73:3-46;sp2/0-ag14,atcc crl-1581);中国仓鼠卵巢细胞/-dhfr(cho,urlaub等人,《美国国家科学院院刊》77:4216(1980));小鼠塞特利氏细胞(tm4,mather,《生殖生物学(biol.reprod.)》23:243-251,1980);猴肾细胞(cv1atcc ccl 70);非洲绿猴肾细胞(vero-76,atcc crl-1587);人子宫颈癌细胞(hela,atcc ccl 2);犬肾细胞(mdck,atcc ccl 34);布法罗大鼠肝细胞(brl 3a,atcc crl 1442);人肺细胞(w138,atcc ccl 75);人肝细胞(hep g2,hb 8065);小鼠乳腺肿瘤(mmt 060562,atcc ccl51);tri细胞(mather等人,《纽约科学院年鉴(annals n.y acad.sci.)》383:44-68(1982));mrc 5细胞;fs4细胞;以及人肝肿瘤系(hep g2)。在一些优选的实施例中,宿主细胞是培养的哺乳动物细胞,如cho细胞、bhk细胞或ns0细胞。
[0174]
在一些实施例中,宿主细胞能够产生糖基工程改造的抗体。例如,宿主细胞系可在翻译后修饰期间提供所需的糖基化机制。此类宿主细胞系的实例包含但不限于糖基化相关酶的活性改变(增加或减小)的细胞系,所述糖基化相关酶如氨基葡萄糖转移酶(例如β(1,4)-n-乙酰氨基葡萄糖转移酶iii(gntiii))、糖基转移酶(例如β(1,4)-半乳糖基转移酶(gt))、唾液酸转移酶(例如α(2,3)
‑‑
唾液酸转移酶(st))、甘露糖苷酶(例如α-甘露糖苷酶ii(manii)、岩藻糖基转移酶(例如α-1,6-岩藻糖基转移酶基因(fut8)、(l,3)岩藻糖基转移酶)、原核gdp-6-脱氧-d-来苏-4-己酮糖还原酶(rmd)、gdp-岩藻糖转运蛋白(gft),这些酶可以是天然的或是通过基因工程改造得到的。
[0175]
在一些实施例中,宿主细胞是以缺乏功能性fut8、过度表达异源gntiii、表达原核gdp-6-脱氧-d-来苏-4-己酮糖还原酶(rmd)或缺乏功能性gft为特征。fut8基因敲除的宿主细胞系是岩藻糖基化缺陷型的并产生无岩藻糖基化的抗体。宿主细胞系中gntiii的过度表达(参见例如roche的glycart technology)使得形成等分、非岩藻糖基化糖基化形式的抗体。rmd的表达(例如,如在来自probiogen ag的系统中)抑制岩藻糖从头生物合成,并因此,由此类宿主细胞系产生的抗体也展现减少的岩藻糖基化。cho细胞系中gft基因敲除(参见例如beijing mabworks biotech的技术)阻断岩藻糖从头合成和岩藻糖挽救生物合成路径并使得岩藻糖基化减少。
[0176]
用上述表达或克隆载体转化宿主细胞以产生抗fgfr2b抗体,并在适于诱导启动子、选择转化体或扩增编码所需序列的基因的改良型常规营养培养基中培养。在另一个实施例中,抗体可通过本领域中已知的同源重组方法制备。
[0177]
用于产生本文所提供的抗体的宿主细胞可以在多种培养基中培养。市售培养基,如ham's f10(sigma)、最小必需培养基(mem)(sigma)、rpmi-1640(sigma)以及杜尔贝科氏改良型伊格尔氏培养基(dulbecco's modified eagle's medium,dmem,sigma)适于培养宿主细胞。另外,ham等人,《酶学方法》58:44(1979);barnes等人,《分析生物化学(anal.biochem.)》102:255(1980);美国专利第4,767,704号、第4,657,866号、第4,927,762号、第4,560,655号或第5,122,469号;wo90/03430;wo 87/00195;或美国再颁专利第30,985号中所述的任何培养基都可以用作宿主细胞的培养基。任何这些培养基中的都可以视需要补充激素和/或其它生长因子(如胰岛素、转铁蛋白或表皮生长因子)、盐(如氯化钠、钙盐、镁盐和磷酸盐)、缓冲剂(如hepes)、核苷酸(如腺苷和胸苷)、抗生素(如gentamycin
tm
药物)、痕量元素(定义为通常以在微摩尔浓度范围内的最终浓度存在的无机化合物)以及葡萄糖或等效能源。还可以包含本领域普通技术人员已知的适当浓度的任何其它必需补充剂。培养条件,如温度、ph等,是先前用于选定用于表达的宿主细胞的培养条件,并且是本领域普通技术人员显而易见的。
[0178]
当使用重组技术时,抗体可以在细胞内、周质空间中产生,或直接分泌至培养基中。如果在细胞内产生抗体,则作为第一步,通过例如离心或超滤移除宿主细胞或溶解片段的颗粒状碎片。carter等人,《生物技术》10:163-167(1992)描述了用于分离抗体的程序,所述抗体被分泌至大肠杆菌的周质空间中。简单点说,在乙酸钠(ph 3.5)、edta和苯甲基磺酰氟(pmsf)存在下,经约30分钟将细胞糊浆解冻。可以通过离心移除细胞碎片。在抗体被分泌至培养基中的情况下,一般先使用市售的蛋白质浓缩过滤器,例如amicon或millipore pellicon超滤单元浓缩来自此类表达系统的上清液。可在上述任何步骤中包含蛋白酶抑制
剂,如pmsf,以抑制蛋白水解,并且可以包含抗生素以防止外来污染物生长。
[0179]
由细胞制备的抗fgfr2b抗体可使用例如羟基磷灰石色谱法、凝胶电泳、透析、deae-纤维素离子交换色谱法、硫酸铵沉淀、盐析以及亲和色谱法纯化,其中亲和色谱法是优选的纯化技术。
[0180]
在某些实施例中,使用固定于固相上的蛋白质a对抗体和其抗原结合片段进行免疫亲和纯化。蛋白质a作为亲和配体的适合性取决于抗体中存在的任何免疫球蛋白fc域的种类和同种型。蛋白质a可用于纯化基于人γ1、γ2或γ4重链的抗体(lindmark等人,《免疫学方法杂志》62:1-13(1983)。推荐对所有小鼠同种型和人γ3使用蛋白质g(guss等人,《欧洲分子生物学杂志(embo j.)》5:1567 1575(1986))。亲和配体所连接的基质通常是琼脂糖,但也可以使用其它基质。机械稳定的基质,如受控微孔玻璃或聚(苯乙烯二乙烯基)苯,实现比用琼脂糖所能实现更快的流动速率和更短的处理时间。当抗体包括ch3域时,bakerbond abx
tm
树脂(新泽西州菲利普斯堡(phillipsburg,n.j.)的jt baker)可用于纯化。取决于待回收的抗体,用于蛋白质纯化的其它技术,如离子交换柱上进行的分级分离、乙醇沉淀、反相hplc、二氧化硅色谱、肝素sepharose
tm
上进行的色谱、阴离子或阳离子交换树脂(如聚天冬氨酸柱)上进行的色谱、色谱焦聚、sds-page以及硫酸铵沉淀也是可用的。
[0181]
在任何初步纯化步骤之后,包括所关注抗体和污染物的混合物可使用ph值在约2.5-4.5之间的洗脱缓冲液,优选地以低盐浓度(例如约0-0.25m盐)进行的低ph疏水相互作用色谱。
[0182]
药物组合物
[0183]
本公开另外提供药物组合物,所述药物组合物包含本文所提供的抗fgfr2b抗体和一种或多种药学上可接受的载体。
[0184]
用于本文所公开的药物组合物的药学上可接受的载体可包含例如药学上可接受的液体、凝胶或固体载体、水性媒剂、非水性媒剂、抗微生物剂、等渗剂、缓冲剂、抗氧化剂、麻醉剂、悬浮/分散剂、钳合剂或螯合剂、稀释剂、佐剂、赋形剂或无毒辅助物质、本领域中已知的其它组分或其各种组合。
[0185]
适合组分可包含例如抗氧化剂、填充剂、粘合剂、崩解剂、缓冲剂、防腐剂、润滑剂、调味剂、增稠剂、着色剂、乳化剂或稳定剂,如糖和环糊精。适合抗氧化剂可包含例如甲硫氨酸、抗坏血酸、edta、硫代硫酸钠、铂、过氧化氢酶、柠檬酸、半胱氨酸、硫代甘油、硫代乙醇酸、硫代山梨糖醇、丁基化羟基苯甲醚、丁基化羟基甲苯和/或没食子酸丙酯。如本文所公开,在如本文所提供的包括抗体或抗原结合片段和缀合物的组合物中包含一种或多种抗氧化剂,如甲硫氨酸,将减少抗体或抗原结合片段的氧化。此氧化的减少将防止或减少结合亲和力损失,由此改善抗体稳定性并使保存期最长。因此,在某些实施例中,提供了包含一种或多种本文所公开的抗体以及一种或多种抗氧化剂如甲硫氨酸的组合物。还提供了通过将如本文所提供的抗体或抗原结合片段与一种或多种抗氧化剂,如甲硫氨酸混合,防止所述抗体或抗原结合片段氧化、延长其保存期和/或改善其功效的方法。
[0186]
作为进一步说明,药学上可接受的载体可包含例如水性媒剂,如氯化钠注射液、林格氏注射液、等渗右旋糖注射液、无菌水注射液、或右旋糖和乳酸林格氏注射液;非水性媒剂,如植物来源的非挥发性油、棉籽油、玉米油、芝麻油或花生油;抑制细菌或抑制真菌浓度的抗微生物剂;等渗剂,如氯化钠或右旋糖;缓冲剂,如磷酸盐或柠檬酸盐缓冲剂;抗氧化
剂,如硫酸氢钠;局部麻醉剂,如盐酸普鲁卡因;悬浮剂和分散剂,如羧甲基纤维素钠、羟丙基甲基纤维素或聚乙烯吡咯烷酮;乳化剂,如聚山梨醇酯80(tween-80);钳合剂或螯合剂,如乙二胺四乙酸(edta)或乙二醇四乙酸(egta)、乙醇、聚乙二醇、丙二醇、氢氧化钠、盐酸、柠檬酸或乳酸。用作载体的抗微生物剂可以添加至在多剂量容器中的药物组合物中,所述抗微生物剂包括苯酚或甲酚、汞剂、苯甲醇、氯丁醇、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯、硫柳汞、苯扎氯铵(benzalkonium chloride)以及苄索氯铵(benzethonium chloride)。适合的赋形剂可包含例如水、生理盐水、右旋糖、甘油或乙醇。适合的无毒辅助物质可包含例如润湿剂或乳化剂、ph缓冲剂、稳定剂、溶解性增强剂或如乙酸钠、脱水山梨糖醇单月桂酸酯、三乙醇胺油酸酯或环糊精之类试剂。
[0187]
药物组合物可以是液体溶液、悬浮液、乳液、丸剂、胶囊、片剂、持续释放配制物或散剂。口服配制物可包含标准载体,如药物级甘露糖醇、乳糖、淀粉、硬脂酸镁、聚乙烯吡咯烷酮、糖精钠、纤维素、碳酸镁等。
[0188]
在某些实施例中,药物组合物被配制成可注射组合物。可注射药物组合物可被制备成任何常规形式,如液体溶液、悬浮液、乳液或适于产生液体溶液、悬浮液或乳液的固体形式。注射用制剂可包含可立即用于注射的无菌和/或无热原质溶液;仅在临使用之前与溶剂组合的无菌干燥可溶性产品,如冻干粉,包含皮下注射片剂;可立即用于注射的无菌悬浮液;仅在临使用之前与媒剂组合的无菌干燥不溶性产品;以及无菌和/或无热原质乳液。溶液可以是水性或非水性的。
[0189]
在某些实施例中,单位剂量的肠胃外制剂被包装在安瓿、小瓶或带针注射器中。供肠胃外施用的所有制剂都应当是无菌且无热原质的,正如本领域中所知和实践的那样。
[0190]
在某些实施例中,无菌冻干粉是通过将如本文中所公开的抗体或抗原结合片段溶解于适合溶剂中制备。溶剂可以含有赋形剂,所述赋形剂将改善粉末或其它药理学成分或由粉末制备的复原溶液的稳定性。可以使用的赋形剂包含但不限于水、右旋糖、山梨糖醇、果糖、玉米糖浆、木糖醇、甘油、葡萄糖、蔗糖或其它适合的试剂。溶剂可以含有缓冲剂,如柠檬酸盐、磷酸钠或磷酸钾、或本领域的技术人员已知的其它此类缓冲剂,在一个实施例中,缓冲剂大致呈中性ph值。随后无菌过滤溶液,随后在本领域技术人员已知的标准条件下冻干,得到所需配制物。在一个实施例中,所得溶液将被分配到小瓶中进行冻干。每个小瓶可以含有单次剂量或多次剂量的抗fgfr2b抗体或其组合物。小瓶过填充超出一次剂量或一组剂量所需量较少量(例如约10%)是可接受的,以便于抽取精确的样品并精确地给药。冻干粉可以在适当的条件下储存,如在约4℃至室温下储存。
[0191]
用注射用水复原冻干粉,得到供肠胃外施用的配制物。在一个实施例中,为进行复原,将无菌和/或无热原质水或其它液态适合载体添加至冻干粉中。精确量取决于所给出的选定疗法,并且可以凭经验确定。
[0192]
使用方法
[0193]
本公开还提供治疗方法,所述治疗方法包括:向有需要的受试者施用治疗有效量的如本文所提供的抗体或抗原结合片段,由此治疗或预防fgfr2b和/或fgfr1b相关病况或病症。在一些实施例中,fgfr2b和/或fgfr1b相关病况或病症是癌症,任选地,所述癌症以fgfr2b和/或fgfr1b的表达或过度表达为特征。
[0194]
癌症的实例包含但不限于卵巢癌、子宫内膜癌、乳癌、肺癌(小细胞或非小细胞肺
癌)、结肠癌、前列腺癌、子宫颈癌、结肠直肠癌、胰腺癌、胃癌、食道癌、肝细胞癌(肝癌)、肾细胞癌(肾癌)、头颈癌、间皮瘤、黑素瘤、肉瘤、脑肿瘤(例如神经胶质瘤,如胶质母细胞瘤)以及恶性血液病。
[0195]
在一些实施例中,fgfr2b和/或fgfr1b相关病况或病症是以fgfr2b和/或fgfr1b的表达或过度表达为特征的癌症。
[0196]
fgfr2b和/或fgfr1b表达或过度表达可在诊断或预后测定法中,通过评价来自受试者的生物样品(如来源于癌细胞或组织的样品,或肿瘤浸润免疫细胞)中fgfr的含量增加来确定。可使用各种方法。例如,可使用诊断或预后测定法评价细胞表面上存在的fgfr2b和/或fgfr1b的表达量(例如通过免疫组织化学测定法;ihc确定)。替代地或另外,可以例如通过荧光原位杂交(fish;参见1998年10月公开的wo98/45479)、dna印迹或聚合酶链反应(pcr)技术,如实时定量pcr(rt-pcr)《方法(methods)》132:73-80(1990))测量细胞中编码fgfr的核酸的水平。除上述测定法之外,本领域技术人员可以使用各种体内测定法。例如,可使患者体内的细胞暴露于抗体,所述抗体任选地用可检测标记,例如用放射性同位素标记,并且可评价抗体与患者体内细胞的结合,例如通过外部扫描放射性或通过分析从先前暴露于抗体的患者取得的活组织检查样品进行评价。
[0197]
本文所提供的抗体或抗原结合片段的治疗有效量将取决于本领域中已知的各种因素,如受试者的体重、年龄、既往病史、当前药物治疗、健康状态以及发生交叉反应的可能性、过敏、敏感性和不良副作用,以及施用途径和疾病发展程度。如这些和其它情况或要求所示,本领域普通技术人员(例如医生或兽医)可以按比例减少或增加剂量。
[0198]
在某些实施例中,本文所提供的抗体或抗原结合片段可按约0.01mg/kg至约100mg/kg的治疗有效剂量施用。在这些实施例中的某些实施例中,抗体或抗原结合片段是以约50mg/kg或更低的剂量施用,并且在这些实施例中的某些实施例中,剂量是10mg/kg或更低、5mg/kg或更低、3mg/kg或更低、1mg/kg或更低、0.5mg/kg或更低、或0.1mg/kg或更低。在某些实施例中,施用剂量可以在治疗过程中改变。例如,在某些实施例中,初始施用剂量可以高于后续施用剂量。在某些实施例中,取决于受试者的反应,可以在治疗过程中改变施用剂量。
[0199]
可以调整剂量方案以提供最佳的期望反应(例如治疗反应)。例如,可施用单次剂量,或可随时间施用若干分次剂量。
[0200]
本文所公开的抗体可通过本领域已知的任何途径施用,如肠胃外(例如皮下、腹膜内、静脉内(包括静脉内输注)、肌肉内或皮内注射)或非肠胃外(例如口服、鼻内、眼内、舌下、直肠或局部)途径。
[0201]
在一些实施例中,本文所公开的抗体可单独施用或与一种或多种额外治疗手段或药剂组合施用。例如,本文所公开的抗体可与另一种治疗剂,例如化学治疗剂或抗癌药物组合施用。
[0202]
在这些实施例中的某些实施例中,与一种或多种额外治疗剂组合施用的本文所公开的抗体或抗原结合片段可以与所述一种或多种额外治疗剂同时施用,并且在这些实施例中的某些实施例中,所述抗体或抗原结合片段和所述额外治疗剂可以作为同一药物组合物的一部分施用。然而,与另一种治疗剂“组合”施用的抗体或其抗原结合片段不必与所述药剂同时施用或以同一组合物施用。如本文所使用的短语,在另一种药剂之前或之后施用的
抗体或其抗原结合片段被认为与所述药剂“组合”施用,即使抗体或抗原结合片段和另一种药剂是通过不同途径施用的。在可能的情况下,与本文所公开的抗体组合施用的额外治疗剂是根据额外治疗剂的产品信息表单中所列的时程、或根据《医师案头参考2003(physicians'desk reference 2003)》(《医师案头参考》,第57版;medical economics company;isbn:1563634457;第57版(2002年11月))或本领域中众所周知的方案施用。
[0203]
本公开还提供了使用抗fgfr2b抗体的方法。
[0204]
在一些实施例中,本公开提供了一种检测样品中fgfr2b和/或fgfr1b的存在或量的方法,所述方法包括使所述样品与抗体接触,以及确定所述样品中fgfr2b和/或fgfr1b的存在或量。
[0205]
在一些实施例中,本公开提供了诊断受试者的fgfr2b和/或fgfr1b相关疾病或病况的方法,所述方法包括:a)使从所述受试者获得的样品与本文所提供的抗体接触;b)确定所述样品中fgfr2b和/或fgfr1b的存在或量;c)将所述fgfr2b和/或fgfr1b的存在或量与所述受试者的fgfr2b和/或fgfr1b相关疾病或病况的存在或状态相关联。
[0206]
在一些实施例中,本公开提供了对受试者的fgfr2b和/或fgfr1b相关疾病或病况预后的方法,所述方法包括:a)使从所述受试者获得的样品与本文所提供的抗体接触;b)确定所述样品中fgfr2b和/或fgfr1b的存在或量;c)将所述fgfr2b和/或fgfr1b的存在或量与所述受试者对fgfr2b和/或fgfr1b拮抗剂的潜在反应性相关联。
[0207]
在一些实施例中,本公开提供了试剂盒,所述试剂盒包括本文所提供的抗体,该抗体任选地与可检测部分缀合。所述试剂盒可用于检测fgfr2b和/或fgfr1b或诊断fgfr2b和/或fgfr1b相关疾病。
[0208]
在一些实施例中,本公开还提供了本文所提供的抗体在制造用于治疗将获益于受试者体内fgfr2b和/或fgfr1b表达调节的疾病或病况的药物中、在制造用于对gfr2b和/或fgfr1b相关疾病或病况进行诊断/预后的的诊断/预后试剂中的用途。
[0209]
提供以下实例是为了更好地说明所要求的发明,而不应理解为限制本发明的范围。以下描述的所有特定组合物、材料和方法(包括整体或部分)在本发明的范围内。这些特定组合物、材料和方法不意在限制本发明,而仅说明在本发明的范围内的特定实施例。在不脱离本发明范围的情况下,本领域的技术人员无需履行发明能力即可开发出等效组合物、材料和方法。应理解,可对本文所描述的程序作出许多变化,但仍在本发明的界限内。本发明人意在将此类变化形式包含在本发明的范围内。
[0210]
实例
[0211]
实例1.细胞和试剂
[0212]
具有fgfr2b表达的人胃癌细胞系kato iii和snu16,以及ba/f3细胞(前b淋巴细胞)是购自美国典型培养物保藏中心(atcc)。人食道癌细胞系kyse180是来自北京大学(peking university)的馈赠。上述人细胞系是根据供应商的建议培养。人肿瘤组织是从中山医院(zhongshan hospital)(中国)获得,经患者同意并符合法规,并且被用于开发人肺癌患者源性异种移植模型lc038。
[0213]
为了建立基于细胞的测定以在抗体产生期间进行抗体筛选,将ba/f3细胞工程改造成表达fgfr2b或fgfr2c。用编码人fgfr2的2b或2c同功异型物的质粒转染ba/f3细胞。在用g418选择之后,分离出具有较高fgfr2b或fgfr2c表达的单个克隆。
[0214]
通过将fgfr2b(genbank获取编号np_001138391)的胞外域(“ecd域”)残基65-267与人fc区(残基100-330)在dna质粒中融合,以免疫粘附分子形式表达人fgfr2b的β-同功异型物(igd2和igd3域)。通过转染人293f细胞(invitrogen)表达所述蛋白质,并使用蛋白质a/g柱自培养基纯化出该蛋白质。
[0215]
通过标准技术,自食蟹猕猴(cyno)皮肤mrna克隆食蟹猕猴fgfr2b ecd域的cdna,并将氨基酸1-253与鼠类fc融合以产生食蟹猕猴fgfr2b-fc进行表达。也表达出人(hu)fgfr2b(np_001138391的65-267)或大鼠fgfr2b(np_001103363.1的56-308)的ecd域残基与鼠类fc的融合物。大鼠和小鼠fgfr2b ecd是相同的。
[0216]
其他人fgfr家族成员的人fc融合蛋白都是购自r&d systems,包含重组fgfr1b-fc、fgfr1c-fc、fgfr2c、fgfr1c-fc、fgfr3b-fc、fgfr3c-fc和fgfr4-fc蛋白质。fgfr2b-fc的α-同功异型物、fgf也是购自r&d systems。肝素是从sigma-aldrich获得(sigma,#h3149-500ku-9)。pbmc是购自allcell(#lp180322)。
[0217]
临床阶段抗人fgfr2b特异性抗体fpa144是根据相关专利申请wo 2015/017600 a1表达。
[0218]
实例2.产生抗fgfr单克隆抗体
[0219]
用每只小鼠50μg初始剂量且接着每只小鼠25μg剂量,或用每只小鼠10μg初始剂量且接着每只小鼠5μg剂量的含人fgfr2b(β)-fc的cfa/ifa对balb/c小鼠或sjl小鼠进行腹膜内免疫接种。通过elisa确定针对人fgfr2b-fc或人fgfr2c-fc的血清效价。最后一次注射之后四天,提取出腘窝淋巴细胞并与小鼠骨髓瘤细胞融合。融合之后十天,先通过elisa,针对fgfr2b(β)-fc相对于nc-fc(fc片段作为阴性对照)结合筛选杂交瘤培养上清液。选出具有结合至fgfr2b(β)-fc但不结合至nc-fc的抗体的杂交瘤。通过初步筛选的杂交瘤经历二次筛选研究,包含通过facs测定与baf3/fgfr-2b细胞和baf3/fgfr-2c的结合、阻断fgf配体结合、以及细胞杀灭。通过这种方式,选出若干阳性克隆,包含名为ab 21的克隆。使用同种型特异性抗体确定由选择的这些克隆产生的单克隆抗体的同种型。
[0220]
实例3.ab 21的人源化
[0221]
使用标准race技术确定ab 21的重链和轻链可变(vh、vl)区序列。从选出的杂交瘤细胞系提取总rna。接着,使用smart race cdna扩增试剂盒(加利福尼亚州帕洛阿尔托(palo alto,ca)的clontech)或generacer试剂盒(invitrogen),根据制造商的说明书产生含有5'端的全长第一链cdna,并通过pcr扩增。分离并纯化产物,接着进行ta克隆和测序。
[0222]
接着,通过将小鼠ab 21的vh和v
l
移植至人fc中,产生嵌合抗体ab 21c。并且使用标准分子生物学方法设计、构建并表达人源化ab 21。简单地说,将小鼠ab 21的cdr移植至人受体构架中。接着,在计算机模型表明与cdr明显接触的构架位置处,将来自小鼠抗体的氨基酸残基取代成人构架氨基酸残基,包含重链的m69l、a93t和r94s,但在轻链中无取代,其中使用kabat编号。由此提供ab 21的人源化抗体,称为ab hu21-21。ab hu21-21重链cdr2中的氨基酸asn-gly(ng)进一步被氨基酸asn-arg(nr)取代,得到称为ab hu21-26的变体。ab21、ab 21c、ab hu21-21和ab hu21-26的重链或和轻链cdr区序列和可变区序列显示于上述表1-3中。
[0223]
具有人igg1的完整成熟ab hu21-26轻链和重链的氨基酸序列显示于图1中。
[0224]
实例4.ab hu21-26的无岩藻糖基化和聚糖分析
[0225]
为了产生ab hu21-26的无岩藻糖基化形式(称为“afhu21-26”,其中前缀“af”是“无岩藻糖基化”的简写),使用1,6-岩藻糖基转移酶基因敲除(fut8-/-)的chok1细胞(中国上海的wuxi biologics)作为宿主细胞系,产生不含岩藻糖的抗体(即,无岩藻糖基化抗体)。将表达载体短暂转染至fut8-/-chok1中以产生无岩藻糖基化抗体,该表达载体包含编码具有人igg1恒定fc的ab hu21-26单克隆抗体的重链(hc)和轻链(lc)的核苷酸序列。
[0226]
通过蛋白质a和sec-hplc纯化afhu21-26并进行透析以交换成配制物缓冲液,并在-80℃储存。
[0227]
使用lc-ms对所产生的afhu21-26执行聚糖分析。简单地说,在37℃下,用1μl的12个单位/微升ides酶(genovis ab)消化10μl的10μg抗体1小时,随后依序添加37.5μl的8m盐酸胍、2.5μl的1m tris-hcl和1μl的1m dtt,接着在10-30℃下混合并培育30分钟。通过反相hplc方法分离完全还原的抗体。然后,使用ls-ms分析聚糖特征。确定每个峰的质量并将其用于鉴别每种聚糖,且结果显示于下表4中。
[0228]
表4.聚糖峰的质量
[0229]
聚糖理论质量(da)测量的质量(da)g0-gn24854.9124856.57man52497624977.37g025058.1125059.43g125220.2525221.32
[0230]
结果展示,g0f、g1f、g2f是无法检测的并且如表5中所示的抗体接近100%无岩藻糖基化。
[0231]
表5.afhu21-26的聚糖特征
[0232][0233]
实例5.抗体的结合特征
[0234]
通过表面等离子体共振(biacore)确定抗体与人fgfr2b或人fgfr1b抗原的结合。简单地说,先通过经4分钟注射50mm n-羟基琥珀酰胺(nhs):200mm ecd域的1:1新鲜混合物,使cm5传感器芯片(ge healthcare life sciences)活化。接着,使用胺偶合试剂盒(ge healthcare life sciences)并使用1m乙醇胺作为封闭试剂,将hfgfr2b-fc或hfgfr1b-fc固定于活化的cm5传感器芯片上。获得约20-30个反应单位(ru,1ru表示每平方毫米结合1pg蛋白质)的抗原蛋白质。
[0235]
在hbs-ep+操作缓冲液(ge healthcare life sciences)(10mm hepes、150mm nacl、3mm edta、0.05%表面活性剂p20,ph 7.4)中稀释抗体,并将其以连续浓度(0、6.25、12.5、25、50、100、150、200nm)注射,并在每个操作循环中包含cm5传感器芯片的表面再生。用biacore t200评价软件(1.0版)计算缔合常数和解离常数。如图2中所示,ab 21c(嵌合)以及其人源化变体ab hu21-21和ab hu21-26展现出与人fgfr2b的较强结合亲和力,其kd值在220-489pm的范围内,优于用作阳性对照的抗体fpa144。此外,ab 21c在fgfr1b结合方面也不同于抗体fpa144。ab 21c以3.69nm的kd值强效结合至人fgfr1b,与抗体fpa144以225nm
的kd值极弱地结合至人fgfr1b形成对比。与ab 21c类似,ab hu21-21和ab hu21-26也展现与人fgfr1b的特异性结合(数据未示出)。
[0236]
为了证实选定的抗体可以结合至细胞膜上内源性形式的fgfr2b,使用表达fgfr2b的katoiii细胞执行流式细胞术。所有抗体都在含10%驴血清(jackson immunogen#017-000-121)的pbs缓冲液中制备。将500,000个katoiii细胞与100μl不同浓度的抗fgfr2b抗体一起在4℃下培育60分钟。将细胞洗涤两次,并在暗处,在4℃下于在100μl的10μg/ml二次igg-alexa488抗体(jackson immunogen#709546149)中培育30分钟。用洗涤缓冲液将细胞洗涤三次并使其再悬浮,并且在流式细胞仪上进行分析。如图3中所示,facs数据明确地显示,ab 21c强效地结合至katoiii细胞且其ec
50
值是约8nm。与ab21c类似,ab hu21-21和ab hu21-26也展现与katoiii细胞的特异性结合(数据未示出)。
[0237]
用elisa分析ab 21c与重组食蟹猕猴、大鼠/小鼠和人fgfr2b-fc融合蛋白的交叉物种结合。简单地说,用在pbs中的约100微升/孔0.1μg/ml重组人fgfr2b-fc、重组大鼠/小鼠fgfr2b-fc、或重组食蟹猕猴fgfr2b-fc蛋白质涂布96孔elisa板过夜。接着,用含0.05%tween20和2%bsa的pbs封闭该板,并将其与抗体样品一起在室温下培育60分钟,然后在1
×
tbst(cell signaling technology,#9997)中洗涤两次,随后与抗人lgg hrp(辣根过氧化酶)缀合物一起在室温下培育60分钟。用四甲基联苯胺底物(cell signaling technology,#7004)检测hrp活性并用终止溶液(cell signaling technology,#7002)停止反应。在450nm下读取该板。如图4中所示,ab 21c与不同物种的fgfr2b的结合ec
50
不存在显著差异。ab 21c对大鼠/小鼠fgfr2b的结合亲和力最高,其次是人fgfr2b,接着是食蟹猕猴fgfr2b。与ab 21c类似,ab hu21-21和hu21-26也展现与不同物种的fgfr2b的特异性结合(数据未示出)。
[0238]
类似地,用elisa测定法表征ab 21与各种fgfr家族成员,即fgfr1b、fgfr3c、fgfr3b、fgfr4的结合特异性。数据示于图5中。根据elisa分析结果,ab 21特异性结合至fgfr2b和fgfr1b,这与图2中所示的数据相符,并且该抗体不结合至任何其它fgfr家族成员。与ab 21c类似,在elisa分析中,ab hu21-21和ab hu21-26也展现与fgfr2b和fgfr1b的特异性结合,但不结合至任何其它fgfr家族成员(数据未示出)。
[0239]
实例6.体外抑制活性
[0240]
在fgfr2b工程改造的ba/f3细胞克隆(ba/f3-fgfr2b)中分析抗体对配体诱导的细胞增殖的抑制活性。在肝素(10μg/ml)存在下,将细胞以30,000个细胞/孔接种于96孔板中含有10%胎牛血清和重组人fgf7蛋白质(10ng/ml)的rpmi1640培养基中。在培育过夜后,将不同浓度的抗fgfr2b抗体添加至测定板中并且再培育72小时。在培育72小时之后,将20μl celltiter aqueous one solution试剂添加至各孔中并室温下培育各板2小时。为了测量吸光度,将25μl的10%sds添加至各孔中以停止反应。在tecan spark 20m上,在490nm和650nm(参照波长)下测量吸光度。ab 21c可强效地抑制fgf7诱导的baf3细胞增殖且gi50是约10nm。使用prism处理ab 21c的抑制活性数据并且图式示于图6中。与ab 21c类似,ab hu21-21和ab hu21-26也展现出对fgf7诱导的baf3细胞增殖的强效抑制(数据未示出)。
[0241]
研究抗体对fgfr2信号传导路径的抑制作用。使snu16细胞在含10%fbs的rpmi培养基中生长,接着以30,000个/孔接种并在无血清rpmi/0.1%bsa中保持过夜。接着,通过刮擦收集细胞并在冷pbs中洗涤一次,然后在2
×
sds溶解缓冲液(100mm tris ph 6.8、4%
sds、20%甘油和1
×
蛋白酶和磷酸酶抑制剂(pierce))中溶解。接着,在100℃下将溶解产物煮沸,保持10分钟。通过bca蛋白质测定试剂盒(pierce)检测蛋白质浓度并将等量的蛋白质装载至sds-page凝胶中,接着使用ibolt(invitrogen)将蛋白质转印至硝化纤维素膜上,然后针对fgfr2和其下游基因erk的磷酸化进行蛋白质印迹分析。如图7中所示,ab 21c处理以剂量依赖性方式引起snu16细胞上磷酸化fgfr2和磷酸化erk的下调。与ab 21c类似,ab hu21-21和ab hu21-26也展现出磷酸化fgfr2和磷酸化erk的下调(数据未示出)。
[0242]
通过共聚焦显微镜检查检测抗体的内化。简单地说,在共聚焦显微镜检查的当天,使用无酶解离溶液收集细胞,并制备成5
×
105个细胞的密度用于各管。用100μl阻断缓冲液(10%驴血清)洗涤细胞并使细胞再悬浮,在4℃下保持30分钟。接着,将细胞洗涤两次并与100μl的10μg/ml ab 21一起在4℃下培育60分钟。洗涤细胞,并将其分成多个等分试样放入小瓶中,其中一些保持在4℃,而另一些保持在37℃。在指定时间点,从4℃取出一个小瓶并从37℃取出一个小瓶。在洗涤和再悬浮之后,将细胞固定,接着用100μl的10%驴血清阻断,随后洗涤并与10μg/ml驴抗人igg-alexa488一起在4℃下于暗处培育30分钟。洗涤细胞并使其再悬浮,并将5μl细胞悬浮液散布于玻璃载片上(旨在得到单层细胞),在55℃热表面上干燥并用5μl的1
×
dapi处理,随后用玻璃盖片密封。接着,获取共聚焦图像。如图8中所示,在4℃下,不能发生内化,仅在细胞表面上观察到ab 21。在经历37℃条件2小时或4小时以允许内化之后,在细胞内发现抗体(以箭头标出),表明抗体内化的发生。与ab 21类似,ab 21c、ab hu21-21和ab hu21-26也全部诱导细胞中抗体的内化(数据未示出)。
[0243]
执行体外测定以确定抗体的adcc活性。使用通过easysep
tm
人nk细胞分离试剂盒(stemcell,#17955)从人pbmc(allcells,cat#pb0004f)分离的初代nk细胞作为效应细胞,以8:1的效应细胞比靶细胞(e/t)比率执行adcc测定。在执行facs测定前一天,在含有10%fbs+hepes 10mm+丙酮酸钠1mm的rpmi1640中解冻人pbmc。用细胞标记物cfse-fitc(invitrogen,#c34554)对靶细胞katoiii染色,保持30分钟,接着在效应物和抗体存在下,在37℃下培育5小时。接着,细胞用活力标记物viability stain-apc-cy7(bd,#565388)染色。利用facs,通过对cfse染色和活力标记物染色呈阳性的细胞选通来确定细胞毒性裂解。数据在图9中示出。afhu21-26显示出明显优于ab 21c的adcc活性,指示就最大裂解百分比和ec
50
而言,无岩藻糖基化改善ab 21c的adcc活性。afhu21-21也获得类似结果。
[0244]
实例7.抗体在肿瘤小鼠模型中的体内抗肿瘤活性
[0245]
免疫缺陷裸小鼠是购自vitariver。所有动物研究都获得iacuc批准,并且遵守内部和当地法规要求进行。
[0246]
通过先在体外培养细胞,接着将细胞以每只小鼠1
×
107个细胞/200μl(混有50%matrigel)皮下接种至小鼠的背侧,当异种移植肿瘤达到300-500mm3大小时,将其切除,切成相同大小的片段并皮下(s.c.)植入一组新的裸小鼠体内,由此建立snu16人胃癌细胞系源性异种移植(cdx)小鼠模型。以类似方式建立lc038人肺癌患者源性异种移植(pdx)小鼠模型。简单地说,将以手术方式从患者取出的组织(f0)切成相同大小的片段,并在手术之后2小时内,皮下植入免疫功能不全的裸小鼠(f1小鼠)体内。当异种移植肿瘤达到400-600mm3大小时,将其切除,切成片段并植入裸小鼠体内进行传代,这些小鼠是f2,以此类推。
[0247]
用测径器从两个维度测量肿瘤结节并使用下式计算肿瘤体积:肿瘤体积=(长度
×
宽度2)
×
0.52。当肿瘤体积达到150-250mm3时,将荷瘤小鼠随机分入治疗组中。接着,从随
机分组后一天开始,一周一次/两次用同种型对照(即,igg1)或测试抗体(即,fpa144、afhu21-26)治疗小鼠。每周两次测量小鼠的肿瘤体积和体重并记录原始数据。通过比较对照组与治疗组之间肿瘤体积的平均变化,评估从治疗开始的肿瘤生长抑制情况。计算是基于每组中相对肿瘤体积(rtv)的几何或算术平均值。通过用初始肿瘤体积除以治疗当天的肿瘤体积来计算rtv。
[0248]
用afhu21-26或抗体fpa144治疗的snu16细胞和lc038 pdx细胞的体内肿瘤生长曲线分别显示于图10a和10b中。在两个模型中,afhu21-26显示出优于抗体fpa144的抗肿瘤活性。afhu21-21也获得类似结果。
[0249]
实例8.抗体药物缀合物(adc)的制备和其特性
[0250]
向3ml含10mg/ml ab 21c的pbs中以2.2的tcep/ab摩尔比添加新鲜tcep。在37℃水浴中培育120分钟之后,将1/10(v/v)的n,n-二甲基乙酰胺(dma)添加至抗体溶液中。接着,将dma中10mm的mc-vc-mmae(mc=顺丁烯二酰亚胺基己酰基;vc=缬氨酸-瓜氨酸连接子)以6的mmae比抗体摩尔比添加至ab溶液中。将溶液室温下保持过夜,接着用25ml 1
×
pbs平衡pd-10柱。接着,将缀合混合物装载至pd-10柱上以纯化adc。在nanodrop中测量adc的浓度。分别使用sec-hplc和hic-hplc进行adc聚集和药物/抗体比(dar)的质量控制分析。根据标准方法计算平均dar。以类似方式产生adc缀合物21c-mmaf和afhu21-26-mmae。afhu21-26-mmae的hic-hplc直方图显示于图11中。dar计算值是3.76,类似于批准的adc药物本妥昔单抗维多汀(brentuximab vedotin)的dar。
[0251]
对各种肿瘤异种移植模型,如lc038 pdx模型和snu16异种移植模型中adc的抗肿瘤活性进行评价。用afhu21-26 mmae、21c-mmaf和21c-mmae治疗都在两种肿瘤模型中诱导肿瘤消退(图12a和12b)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1