抗CD79嵌合抗原受体、CAR-T细胞及其用途的制作方法
抗cd79嵌合抗原受体、car-t细胞及其用途
1.序列表
2.本技术包含已经以ascii格式电子递交的序列表,并且据此全文以引用方式并入。所述ascii副本创建于2020年11月9日,命名为jbi6171wopct1_sl.txt,并且大小为488,479字节。
技术领域
3.本发明涉及包含靶向cd79b的单链可变片段的靶向cd79b的嵌合抗原受体(car)和表达car的工程化靶向cd79b的免疫细胞。还提供了编码car的核酸和表达载体、包含载体的重组细胞,以及包含表达靶向cd79b的car的工程化免疫细胞的组合物。还提供了制备car和工程化免疫细胞的方法,以及使用工程化免疫细胞治疗包括癌症在内的病症的方法。
背景技术:
4.t细胞疗法利用了分离的t细胞,这些t细胞已经被基因修饰以增强它们对特定肿瘤相关抗原的特异性。基因修饰可以涉及嵌合抗原受体(car)或外源性t细胞受体的表达,以将新的抗原特异性提供到t细胞上。表达嵌合抗原受体的t细胞(car-t细胞)可以诱导肿瘤免疫反应性。需要利用car-t细胞的更好的癌症疗法。
5.非霍奇金淋巴瘤(nhl)占所有癌症的约4%。尽管可用疗法有改进,但复发性/难治性(r/r)nhl的特征在于一致预后不良。使用经基因工程化以表达嵌合抗原受体(car)的t细胞的过继性免疫疗法对于治疗cd19阳性b细胞恶性肿瘤已经显示出有前景的结果,但是即使具有大约60-80%的初始总应答率,也只有40%的患者实现长期完全缓解[1,2]。现在浮现出报告急性成淋巴细胞性白血病(all)和弥漫性大b细胞淋巴瘤(dlbcl)患者中由于cd19抗原损失而引起的疾病复发的临床数据,突出了对靶向新型表面抗原的未得到满足的临床需要[2,4]。
[0006]
b细胞(b淋巴细胞)是适应性免疫的中心组分,通过产生抗体对几种不同病原体做出应答,进行抗原呈递细胞的作用,分泌细胞因子并且在活化后发育成记忆b细胞[5]。b细胞在血液和淋巴系统中循环。在淋巴器官中,它们遇到其同源抗原,并且与来自t辅助细胞的另外的信号一起可以分化成效应浆细胞。这些细胞分泌特异性抗体,这些特异性抗体将在血液中循环以靶向和消除抗原或病原体[6]。
[0007]
为了检测抗原或病原体,b细胞在细胞表面上具有b细胞受体(bcr),所述b细胞受体是由跨膜免疫球蛋白分子(mig)及二硫键连接的cd79a(igα)和cd79b(igβ)的异二聚体组成的多组分受体。cd79b在多种多样的b细胞淋巴瘤中高度表达。已经证实其表达对大多数dlbcl肿瘤模型的癌细胞活力至关重要。因此,通过抗原损失发展对cd79b靶向剂的抗性可能是不太可能的,从而使其成为开发新型免疫治疗方法有吸引力的靶标。在临床上,泊洛妥珠单抗(polatuzumab)(polivy
tm
),一种靶向cd79b的抗体-药物缀合物(adc)分子,最近已被批准用于治疗r/r dlbcl[7]。泊洛妥珠单抗治疗在与标准护理治疗(苯达莫司汀(bendamustine)和利妥昔单抗(rituximab))组合时引起完全应答(cr)和应答持续(dor)率
的增加,从而验证cd79b是有价值的临床靶标[8]。
[0008]
因此,需要开发靶向cd79b的car-t疗法。
技术实现要素:
[0009]
本文公开了嵌合抗原受体(car)(例如,靶向分化簇79b蛋白(cd79b)的car)、包含car的细胞、编码car的载体(例如,重组表达载体),以及编码car的核酸分子,制备car、组合物、多肽、蛋白质、核酸、宿主细胞、细胞群体的方法,以及使用所公开的car治疗病症(例如,癌症)的方法。
[0010]
在一个方面,提供了一种嵌合抗原受体(car),该car包含:
[0011]
(a)细胞外结构域,该细胞外结构域包含与分化簇79b蛋白(cd79b)抗原特异性结合的scfv,
[0012]
(b)跨膜结构域,和
[0013]
(c)细胞内信号传导结构域,所述细胞内信号传导结构域任选地包括至少一个共刺激结构域。
[0014]
在一些实施方案中,car还包含
[0015]
(d)cd8a铰链区,
[0016]
其中所述跨膜结构域包含cd8a跨膜区(cd8a-tm)多肽;并且
[0017]
其中所述细胞内信号传导结构域包括共刺激结构域和初级信号传导结构域,所述共刺激结构域包含tnf受体超家族成员9(cd137)组分,所述初级信号传导结构域包含t细胞表面糖蛋白cd3ζ链(cd3z)组分。
[0018]
在一些实施方案中,所述cd8a铰链区包含与seq id no:38具有至少90%同一性的氨基酸序列;
[0019]
所述跨膜结构域包含与seq id no:39具有至少90%同一性的氨基酸序列;并且/或者
[0020]
所述细胞内信号传导结构域包括共刺激结构域和初级信号传导结构域,所述共刺激结构域具有与seq id no:40具有至少90%同一性的氨基酸序列,所述初级信号传导结构域具有与seq id no:41具有至少90%同一性的氨基酸序列。
[0021]
在另一方面,提供了一种嵌合抗原受体(car),该car包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中细胞外抗原结合结构域包含:
[0022]
具有seq id no:208的氨基酸序列的重链互补决定区1(cdr1)、具有seq id no:209的氨基酸序列的重链cdr2和具有seq id no:210的氨基酸序列的重链cdr3;
[0023]
具有seq id no:216的氨基酸序列的重链cdr1、具有seq id no:217的氨基酸序列的重链cdr2和具有seq id no:218的氨基酸序列的重链cdr3;
[0024]
具有seq id no:222的氨基酸序列的重链cdr1、具有seq id no:223的氨基酸序列的重链cdr2和具有seq id no:224的氨基酸序列的重链cdr3;
[0025]
具有seq id no:228的氨基酸序列的重链cdr1、具有seq id no:217的氨基酸序列的重链cdr2和具有seq id no:229的氨基酸序列的重链cdr3;
[0026]
具有seq id no:232的氨基酸序列的重链cdr1、具有seq id no:233的氨基酸序列的重链cdr2和具有seq id no:234的氨基酸序列的重链cdr3;
[0027]
具有seq id no:238的氨基酸序列的重链cdr1、具有seq id no:239的氨基酸序列的重链cdr2和具有seq id no:240的氨基酸序列的重链cdr3;
[0028]
具有seq id no:242的氨基酸序列的重链cdr1、具有seq id no:243的氨基酸序列的重链cdr2和具有seq id no:244的氨基酸序列的重链cdr3;
[0029]
具有seq id no:248的氨基酸序列的重链cdr1、具有seq id no:249的氨基酸序列的重链cdr2和具有seq id no:250的氨基酸序列的重链cdr3;
[0030]
具有seq id no:253的氨基酸序列的重链cdr1、具有seq id no:254的氨基酸序列的重链cdr2和具有seq id no:255的氨基酸序列的重链cdr3;
[0031]
具有seq id no:257的氨基酸序列的重链cdr1、具有seq id no:258的氨基酸序列的重链cdr2和具有seq id no:259的氨基酸序列的重链cdr3;
[0032]
具有seq id no:263的氨基酸序列的重链cdr1、具有seq id no:243的氨基酸序列的重链cdr2和具有seq id no:264的氨基酸序列的重链cdr3;
[0033]
具有seq id no:268的氨基酸序列的重链cdr1、具有seq id no:269的氨基酸序列的重链cdr2和具有seq id no:270的氨基酸序列的重链cdr3;或者
[0034]
具有seq id no:274的氨基酸序列的重链cdr1、具有seq id no:275的氨基酸序列的重链cdr2和具有seq id no:276的氨基酸序列的重链cdr3;
[0035]
其中细胞外抗原结合结构域结合cd79b抗原。
[0036]
在另一方面,提供了一种嵌合抗原受体(car),该car包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中细胞外抗原结合结构域包含:
[0037]
具有seq id no:211的氨基酸序列的轻链cdr1、具有seq id no:212的氨基酸序列的轻链cdr2和具有seq id no:213的氨基酸序列的轻链cdr3;
[0038]
具有seq id no:214的氨基酸序列的轻链cdr1、具有seq id no:212的氨基酸序列的轻链cdr2和具有seq id no:213的氨基酸序列的轻链cdr3;
[0039]
具有seq id no:215的氨基酸序列的轻链cdr1、具有seq id no:212的氨基酸序列的轻链cdr2和具有seq id no:213的氨基酸序列的轻链cdr3;
[0040]
具有seq id no:219的氨基酸序列的轻链cdr1、具有seq id no:220的氨基酸序列的轻链cdr2和具有seq id no:221的氨基酸序列的轻链cdr3;
[0041]
具有seq id no:225的氨基酸序列的轻链cdr1、具有seq id no:226的氨基酸序列的轻链cdr2和具有seq id no:227的氨基酸序列的轻链cdr3;
[0042]
具有seq id no:230的氨基酸序列的轻链cdr1、具有seq id no:231的氨基酸序列的轻链cdr2和具有seq id no:221的氨基酸序列的轻链cdr3;
[0043]
具有seq id no:235的氨基酸序列的轻链cdr1、具有seq id no:236的氨基酸序列的轻链cdr2和具有seq id no:237的氨基酸序列的轻链cdr3;
[0044]
具有seq id no:241的氨基酸序列的轻链cdr1、具有seq id no:226的氨基酸序列的轻链cdr2和具有seq id no:227的氨基酸序列的轻链cdr3;
[0045]
具有seq id no:245的氨基酸序列的轻链cdr1、具有seq id no:246的氨基酸序列的轻链cdr2和具有seq id no:247的氨基酸序列的轻链cdr3;
[0046]
具有seq id no:251的氨基酸序列的轻链cdr1、具有seq id no:236的氨基酸序列的轻链cdr2和具有seq id no:252的氨基酸序列的轻链cdr3;
[0047]
具有seq id no:251的氨基酸序列的轻链cdr1、具有seq id no:236的氨基酸序列的轻链cdr2和具有seq id no:256的氨基酸序列的轻链cdr3;
[0048]
具有seq id no:260的氨基酸序列的轻链cdr1、具有seq id no:261的氨基酸序列的轻链cdr2和具有seq id no:262的氨基酸序列的轻链cdr3;
[0049]
具有seq id no:265的氨基酸序列的轻链cdr1、具有seq id no:266的氨基酸序列的轻链cdr2和具有seq id no:267的氨基酸序列的轻链cdr3;
[0050]
具有seq id no:271的氨基酸序列的轻链cdr1、具有seq id no:272的氨基酸序列的轻链cdr2和具有seq id no:273的氨基酸序列的轻链cdr3;或者
[0051]
具有seq id no:277的氨基酸序列的轻链cdr1、具有seq id no:266的氨基酸序列的轻链cdr2和具有seq id no:278的氨基酸序列的轻链cdr3;
[0052]
其中细胞外抗原结合结构域结合cd79b抗原。
[0053]
在一些实施方案中,细胞外抗原结合结构域还包含:
[0054]
具有seq id no:211的氨基酸序列的轻链cdr1、具有seq id no:212的氨基酸序列的轻链cdr2和具有seq id no:213的氨基酸序列的轻链cdr3;
[0055]
具有seq id no:214的氨基酸序列的轻链cdr1、具有seq id no:212的氨基酸序列的轻链cdr2和具有seq id no:213的氨基酸序列的轻链cdr3;
[0056]
具有seq id no:215的氨基酸序列的轻链cdr1、具有seq id no:212的氨基酸序列的轻链cdr2和具有seq id no:213的氨基酸序列的轻链cdr3;
[0057]
具有seq id no:219的氨基酸序列的轻链cdr1、具有seq id no:220的氨基酸序列的轻链cdr2和具有seq id no:221的氨基酸序列的轻链cdr3;
[0058]
具有seq id no:225的氨基酸序列的轻链cdr1、具有seq id no:226的氨基酸序列的轻链cdr2和具有seq id no:227的氨基酸序列的轻链cdr3;
[0059]
具有seq id no:230的氨基酸序列的轻链cdr1、具有seq id no:231的氨基酸序列的轻链cdr2和具有seq id no:221的氨基酸序列的轻链cdr3;
[0060]
具有seq id no:235的氨基酸序列的轻链cdr1、具有seq id no:236的氨基酸序列的轻链cdr2和具有seq id no:237的氨基酸序列的轻链cdr3;
[0061]
具有seq id no:241的氨基酸序列的轻链cdr1、具有seq id no:226的氨基酸序列的轻链cdr2和具有seq id no:227的氨基酸序列的轻链cdr3;
[0062]
具有seq id no:245的氨基酸序列的轻链cdr1、具有seq id no:246的氨基酸序列的轻链cdr2和具有seq id no:247的氨基酸序列的轻链cdr3;
[0063]
具有seq id no:251的氨基酸序列的轻链cdr1、具有seq id no:236的氨基酸序列的轻链cdr2和具有seq id no:252的氨基酸序列的轻链cdr3;
[0064]
具有seq id no:251的氨基酸序列的轻链cdr1、具有seq id no:236的氨基酸序列的轻链cdr2和具有seq id no:256的氨基酸序列的轻链cdr3;
[0065]
具有seq id no:260的氨基酸序列的轻链cdr1、具有seq id no:261的氨基酸序列的轻链cdr2和具有seq id no:262的氨基酸序列的轻链cdr3;
[0066]
具有seq id no:265的氨基酸序列的轻链cdr1、具有seq id no:266的氨基酸序列的轻链cdr2和具有seq id no:267的氨基酸序列的轻链cdr3;
[0067]
具有seq id no:271的氨基酸序列的轻链cdr1、具有seq id no:272的氨基酸序列
的轻链cdr2和具有seq id no:273的氨基酸序列的轻链cdr3;或者
[0068]
具有seq id no:277的氨基酸序列的轻链cdr1、具有seq id no:266的氨基酸序列的轻链cdr2和具有seq id no:278的氨基酸序列的轻链cdr3。在另一方面,提供了一种嵌合抗原受体(car),该car包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中所述细胞外抗原结合结构域包含具有seq id no:208、216、222、228、232、238、242、248、253、257、263、268或274的氨基酸序列的重链cdr1,具有seq id no:209、217、223、233、239、243、249、254、258、269或275的氨基酸序列的重链cdr2,具有seq id no:210、218、224、229、234、240、244、250、255、259、264、270或276的氨基酸序列的重链cdr3,具有seq id no:211、214、215、219、225、230、235、241、245、251、260、265、271或277的氨基酸序列的轻链cdr1,具有seq id no:212、220、226、231、236、246、261、266或272的氨基酸序列的轻链cdr2,以及具有seq id no:213、221、227、237、247、252、256、262、267、273或278的氨基酸序列的轻链cdr3。
[0069]
在一些实施方案中,所述细胞外抗原结合结构域包含具有以下的氨基酸序列的所述重链cdr1、所述重链cdr2、所述重链cdr3、所述轻链cdr1、所述轻链cdr2和所述轻链cdr3:
[0070]
a)分别为seq id no:208、209、210、211、212和213;
[0071]
b)分别为seq id no:208、209、210、214、212和213;
[0072]
c)分别为seq id no:208、209、210、215、212和213;
[0073]
d)分别为seq id no:216、217、218、219、220和221;
[0074]
e)分别为seq id no:222、223、224、225、226和227;
[0075]
f)分别为seq id no:228、217、229、230、231和221;
[0076]
g)分别为seq id no:232、233、234、235、236和237;
[0077]
h)分别为seq id no:238、239、240、241、226和227;
[0078]
i)分别为seq id no:242、243、244、245、246和247;
[0079]
j)分别为seq id no:248、249、250、251、236和252;
[0080]
k)分别为seq id no:253、254、255、251、236和256;
[0081]
l)分别为seq id no:257、258、259、260、261和262;
[0082]
m)分别为seq id no:263、243、264、265、266和267;
[0083]
n)分别为seq id no:268、269、270、271、272和273;或者
[0084]
o)分别为seq id no:274、275、276、277、266和278。
[0085]
在一些实施方案中,细胞外抗原结合结构域包含:
[0086]
包含与seq id no:1具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:19具有至少90%同一性的氨基酸序列的轻链可变区;
[0087]
包含与seq id no:1具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:20具有至少90%同一性的氨基酸序列的轻链可变区;
[0088]
包含与seq id no:2具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:19具有至少90%同一性的氨基酸序列的轻链可变区;
[0089]
包含与seq id no:2具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:20具有至少90%同一性的氨基酸序列的轻链可变区;
[0090]
包含与seq id no:3具有至少90%同一性的氨基酸序列的重链可变区以及包含与
seq id no:20具有至少90%同一性的氨基酸序列的轻链可变区;
[0091]
包含与seq id no:4具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:19具有至少90%同一性的氨基酸序列的轻链可变区;
[0092]
包含与seq id no:5具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:22具有至少90%同一性的氨基酸序列的轻链可变区;
[0093]
包含与seq id no:5具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:23具有至少90%同一性的氨基酸序列的轻链可变区;
[0094]
包含与seq id no:6具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:24具有至少90%同一性的氨基酸序列的轻链可变区;
[0095]
包含与seq id no:7具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:26具有至少90%同一性的氨基酸序列的轻链可变区;
[0096]
包含与seq id no:8具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:25具有至少90%同一性的氨基酸序列的轻链可变区;
[0097]
包含与seq id no:9具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:27具有至少90%同一性的氨基酸序列的轻链可变区;
[0098]
包含与seq id no:10具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:28具有至少90%同一性的氨基酸序列的轻链可变区;
[0099]
包含与seq id no:11具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:29具有至少90%同一性的氨基酸序列的轻链可变区;
[0100]
包含与seq id no:12具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:30具有至少90%同一性的氨基酸序列的轻链可变区;
[0101]
包含与seq id no:13具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:31具有至少90%同一性的氨基酸序列的轻链可变区;
[0102]
包含与seq id no:14具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:32具有至少90%同一性的氨基酸序列的轻链可变区;
[0103]
包含与seq id no:15具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:33具有至少90%同一性的氨基酸序列的轻链可变区;
[0104]
包含与seq id no:16具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:34具有至少90%同一性的氨基酸序列的轻链可变区;
[0105]
包含与seq id no:16具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:35具有至少90%同一性的氨基酸序列的轻链可变区;
[0106]
包含与seq id no:17具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:33具有至少90%同一性的氨基酸序列的轻链可变区;或者
[0107]
包含与seq id no:18具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:36具有至少90%同一性的氨基酸序列的轻链可变区。
[0108]
在一些实施方案中,细胞外抗原结合结构域包含:
[0109]
包含seq id no:1的氨基酸序列的重链可变区和包含seq id no:19的氨基酸序列的轻链可变区;
[0110]
包含seq id no:1的氨基酸序列的重链可变区和包含seq id no:20的氨基酸序列
的轻链可变区;
[0111]
包含seq id no:2的氨基酸序列的重链可变区和包含seq id no:19的氨基酸的轻链可变区;
[0112]
包含seq id no:2的氨基酸序列的重链可变区和包含seq id no:20的氨基酸序列的轻链可变区;
[0113]
包含seq id no:3的氨基酸序列的重链可变区和包含seq id no:20的氨基酸序列的轻链可变区;
[0114]
包含seq id no:4的氨基酸序列的重链可变区和包含seq id no:19的氨基酸序列的轻链可变区;
[0115]
包含seq id no:5的氨基酸序列的重链可变区和包含seq id no:22的氨基酸序列的轻链可变区;
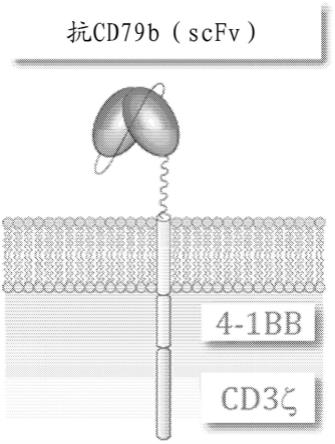
[0116]
包含seq id no:5的氨基酸序列的重链可变区和包含seq id no:23的氨基酸序列的轻链可变区;
[0117]
包含seq id no:6的氨基酸序列的重链可变区和包含seq id no:24的氨基酸序列的轻链可变区;
[0118]
包含seq id no:7的氨基酸序列的重链可变区和包含seq id no:26的氨基酸序列的轻链可变区;
[0119]
包含seq id no:8的氨基酸序列的重链可变区和包含seq id no:25的氨基酸序列的轻链可变区;
[0120]
包含seq id no:9的氨基酸序列的重链可变区和包含seq id no:27的氨基酸序列的轻链可变区;
[0121]
包含seq id no:10的氨基酸序列的重链可变区和包含seq id no:28的氨基酸序列的轻链可变区;
[0122]
包含seq id no:11的氨基酸序列的重链可变区和包含seq id no:29的氨基酸序列的轻链可变区;
[0123]
包含seq id no:12的氨基酸序列的重链可变区和包含seq id no:30的氨基酸序列的轻链可变区;
[0124]
包含seq id no:13的氨基酸序列的重链可变区和包含seq id no:31的氨基酸序列的轻链可变区;
[0125]
包含seq id no:14的氨基酸序列的重链可变区和包含seq id no:32的氨基酸序列的轻链可变区;
[0126]
包含seq id no:15的氨基酸序列的重链可变区和包含seq id no:33的氨基酸序列的轻链可变区;
[0127]
包含seq id no:16的氨基酸序列的重链可变区和包含seq id no:34的氨基酸序列的轻链可变区;
[0128]
包含seq id no:16的氨基酸序列的重链可变区和包含seq id no:35的氨基酸序列的轻链可变区;
[0129]
包含seq id no:17的氨基酸序列的重链可变区和包含seq id no:33的氨基酸序列的轻链可变区;或者
[0130]
包含seq id no:18的氨基酸序列的重链可变区和包含seq id no:36的氨基酸序列的轻链可变区。
[0131]
在一些实施方案中,细胞外抗原结合结构域包含:
[0132]
包含与seq id no:14具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:32具有至少90%同一性的氨基酸序列的轻链可变区。
[0133]
在一些实施方案中,细胞外抗原结合结构域包含:
[0134]
包含seq id no:14的氨基酸序列的重链可变区和包含seq id no:32的氨基酸序列的轻链可变区。
[0135]
在一些实施方案中,细胞外抗原结合结构域包含单链可变片段(scfv)。在一些实施方案中,scfv包含位于轻链可变区(vl)与重链可变区(vh)之间的接头多肽。在一些实施方案中,所述接头多肽包含与seq id no:42具有至少90%同一性的氨基酸序列。在一些实施方案中,所述接头多肽包含seq id no:42的氨基酸序列。在一些实施方案中,所述scfv包含与选自由seq id no:75-118组成的组的序列具有至少90%同一性的氨基酸序列。在一些实施方案中,所述scfv包含选自由seq id no:75-118组成的组的氨基酸序列。在一些实施方案中,细胞外抗原结合结构域包含信号多肽。在一些实施方案中,该信号多肽包含与seq id no:37具有至少90%同一性的氨基酸序列。在一些实施方案中,该信号多肽包含seq id no:37的氨基酸序列。
[0136]
在一些实施方案中,细胞内信号传导结构域包含多肽组分,该多肽组分选自:tnf受体超家族成员9(cd137)组分、t细胞表面糖蛋白cd3ζ链(cd3z)组分、分化簇(cd27)组分、分化簇超家族成员组分,以及它们的组合。在一些实施方案中,该cd137组分包含与seq id no:40具有至少90%同一性的氨基酸序列。在一些实施方案中,该cd137组分包含seq id no:40的氨基酸序列。在一些实施方案中,该cd3z组分包含与seq id no:41具有至少90%同一性的氨基酸序列。在一些实施方案中,该cd3z组分包含seq id no:41的氨基酸序列。在一些实施方案中,该细胞内信号传导结构域包含与seq id no:163具有至少90%同一性的氨基酸序列。在一些实施方案中,该细胞内信号传导结构域包含seq id no:163的氨基酸序列。在一些实施方案中,跨膜结构域包含cd8a跨膜区(cd8a-tm)多肽。在一些实施方案中,该cd8a-tm多肽包含与seq id no:39具有至少90%同一性的氨基酸序列。在一些实施方案中,该cd8a-tm多肽包含seq id no:39的氨基酸序列。
[0137]
在各种实施方案中,car还包含将跨膜结构域连接至细胞外抗原结合结构域的铰链区。在一些实施方案中,铰链区为cd8a铰链区。在一些实施方案中,所述cd8a铰链区包含与seq id no:38具有至少90%同一性的氨基酸序列。在一些实施方案中,所述cd8a铰链区包含seq id no:38的氨基酸序列。
[0138]
在一些实施方案中,所述细胞外抗原结合结构域包含与选自由seq id no:119-162组成的组的序列具有至少90%同一性的氨基酸序列。在一些实施方案中,所述细胞外抗原结合结构域包含选自由seq id no:119-162组成的组的氨基酸序列。
[0139]
在一些实施方案中,所述car与选自由seq id no:164-207组成的组的序列具有至少90%同一性的氨基酸序列。在一些实施方案中,所述car包含选自由seq id no:164-207组成的组的氨基酸序列。
[0140]
在另一方面,提供了一种嵌合抗原受体(car),该car包含细胞外抗原结合结构域、
id no:163的氨基酸序列。
[0154]
在一些实施方案中,所述跨膜结构域可包含cd8a跨膜区(cd8a-tm)多肽。在此类实施方案中,所述cd8a-tm多肽可包含与seq id no:39具有至少90%同一性的氨基酸序列。在此类实施方案中,所述cd8a-tm多肽可包含seq id no:39的氨基酸序列。
[0155]
在一些实施方案中,本文所公开的car还可包含将跨膜结构域连接至细胞外抗原结合结构域的铰链区。在某些实施方案中,该铰链区为cd8a铰链区。在此类实施方案中,所述cd8a铰链区可包含与seq id no:38具有至少90%同一性的氨基酸序列。在此类实施方案中,所述cd8a铰链区可包含seq id no:38的氨基酸序列。
[0156]
在一些实施方案中,所述细胞外抗原结合结构域包含与seq id no:157具有至少90%同一性的氨基酸序列。在一些实施方案中,该细胞外抗原结合结构域包含seq id no:157的氨基酸序列。
[0157]
在一些实施方案中,本文所公开的car可包含与seq id no:202具有至少90%同一性的氨基酸序列。在一些实施方案中,本文所公开的car可包含seq id no:202的氨基酸序列。在另一方面,提供了一种表达上述car中的任一种的分离的淋巴细胞。在一些实施方案中,淋巴细胞为t淋巴细胞。在一些实施方案中,淋巴细胞为自然杀伤(nk)细胞。
[0158]
还提供了编码上述car中的任一种car的分离的核酸分子。还提供了包含核酸分子的载体。此外,还提供了表达核酸分子的细胞。
[0159]
还提供了药物组合物,该药物组合物包含有效量的以上淋巴细胞中的任一种淋巴细胞和药学上可接受的赋形剂。
[0160]
在另一方面,提供了一种治疗患有癌症的受试者的方法。该方法包括将治疗有效量的以上淋巴细胞或以上药物组合物中的任一种施用于有需要的受试者,由此淋巴细胞诱导对受试者中的癌细胞的杀伤。在一些实施方案中,该癌症为b细胞淋巴瘤。在一些实施方案中,该癌症为非霍奇金淋巴瘤。在一些实施方案中,该癌症是弥漫性大b细胞淋巴瘤(dlbcl)、套细胞淋巴瘤(mcl)、滤泡性淋巴瘤(fl)、边缘区淋巴瘤(mz)、急性成淋巴细胞性白血病(all)、慢性淋巴细胞白血病(cll)、多发性骨髓瘤(mm)、粘膜相关淋巴组织(malt)淋巴瘤、霍奇金淋巴瘤、伯基特淋巴瘤、毛细胞白血病或浆细胞瘤。
[0161]
在另一方面,提供了一种对癌细胞进行靶向杀伤的方法,该方法包括使癌细胞与以上淋巴细胞中的任一种淋巴细胞接触,由此淋巴细胞诱导对癌细胞的杀伤。在一些实施方案中,该癌细胞是恶性b细胞。在一些实施方案中,该癌细胞是非霍奇金淋巴瘤细胞。在一些实施方案中,该癌细胞是弥漫性大b细胞淋巴瘤(dlbcl)、套细胞淋巴瘤(mcl)、滤泡性淋巴瘤(fl)、边缘区淋巴瘤(mz)、急性成淋巴细胞性白血病(all)、慢性淋巴细胞白血病(cll)、多发性骨髓瘤(mm)、粘膜相关淋巴组织(malt)淋巴瘤、霍奇金淋巴瘤、伯基特淋巴瘤、毛细胞白血病或浆细胞瘤的细胞。
[0162]
在另一方面,提供了一种检测受试者中癌症的存在的方法,该方法包括:
[0163]
(a)使从所述受试者获得的细胞样品与以上car中的任一种car接触,从而形成car-细胞复合物,以及
[0164]
(b)检测所述复合物,其中检测到所述复合物指示所述受试者中存在癌症。
(nsg)小鼠中皮下植入5x105个carnaval细胞。当组均肿瘤体积达到约50mm
3-100mm3/只小鼠时,静脉注射car-t细胞(图7a)。每周两次监测肿瘤(图7b)和体重(图7c)。
[0174]
图8a-图8c展示在不存在抗原或细胞因子刺激的情况下,acd79b car-t转导细胞中的基础细胞因子水平不会升高。将先前生成的acd79b car-t细胞以每孔50,000个car+细胞一式三份地平板接种。经由添加未转导的(utd)细胞,跨条件对每个孔的t细胞总数进行归一化。在过夜培养后收集培养上清液并且使用msd(v plex proinflammation panel 1[人]试剂盒)定量细胞因子水平。在441-hl car-t、cd19 car-t和utd细胞上清液中检测到的infγ、il-2和tnfα水平绘制为每个供体的平均值(pg/ml)
±
sem。
[0175]
图9a-图9b展示在不存在抗原或细胞因子刺激的情况下,441-hl car-t细胞不存在异常的基础增殖或活化。在441-hl car-t细胞中进行五天增殖测定以筛选异常的基础增殖或活化。用cell trace
tm
violet(ctv)染料(5mm)标记后,将car-t细胞稀释到5
×
105个活car+t细胞/ml。然后将细胞(100μl)添加到96孔圆底板中,其中它们在不存在靶细胞或细胞因子刺激的情况下生长五天。将靶阳性细胞(carnaval)和靶阴性细胞(k562)类似地平板接种以得到1:1的car+效应子:靶标(e:t)比率,并且在相同条件下培养。在第五天,经由对cd3的流式细胞术门控,接着通过car分析细胞。使用ctv染料稀释(pacific blue channel)和cd71标志物表达来分别确定五个供体中的增殖(图9a)和活化(图9b)car-t细胞的百分比。
[0176]
图10a-图10r展示在测试的所有供体中,在cd79b/cd19+细胞的存在下441-hl car-t细胞的抗原特异性癌细胞杀伤。使用流式细胞术测试在五个cd79b/cd19+细胞系(hbl-1、oci-ly-10、carnaval、will-2和jeko-1)和五个cd79b/cd19
–
细胞系(k562、hly-1、su-dhl-1、hl-60和jurkat e6.1)的小组中441-hl car-t细胞的作用。包括经工程化以表达cd79b的k562作为附加对照。解冻和静置过夜后,对细胞进行计数,并且经由添加未转导的细胞归一化每个供体的car+细胞百分比。然后对归一化的car-t细胞进行计数并以5x105个car+细胞/ml的浓度重悬以获得2.5:1的起始car+e:t比率。制备总共八份2倍稀释液,并将效应细胞接种在96孔板中(每孔100μl)。收获靶细胞系,计数并以4百万个细胞/ml重悬。然后将它们用cell trace
tm
violet(ctv)进行标记,稀释到2
×
105个活细胞/ml,并且将100μl经标记的细胞添加到含有car-t细胞的96孔板中。在24小时温育期后,用可固定活力染料efluor
tm
660对细胞进行染色。经由流式细胞术通过以下方式评估肿瘤细胞死亡:通过前向散射和侧向散射门控以鉴定细胞群体;然后进行live/dead门控以鉴定活细胞;并且,最后进行ctv+肿瘤事件门控以评估每个孔中活癌细胞的数目。癌细胞杀伤的百分比(%)计算为每个e:t比率下活癌细胞的绝对数目除以0:1e:t比率的孔中活癌细胞的平均绝对数目,然后乘以100。数据绘制为平均值+/-sem(3个单独实验)。在图10a-图10c和图10d-图10f中分别针对cd79b/cd19+细胞和cd79b/cd19
–
细胞示出了五个供体的合并图。在图10g-图10l和图10m-图10r中分别针对cd79b/cd19+细胞和cd79b/cd19
–
细胞示出了显示五个供体中的每个供体的单独杀伤曲线的曲线图。
[0177]
图11a-图11f示出了使用技术确定的441-hl car-t细胞对抗原阳性细胞系的特异性杀伤。利用技术,在两个cd79b/cd19+(hbl-1、oci-ly-10)和两个cd79b/cd19
–
(hly-1、su-dhl-1)mkate2表达细胞系的小组中评估441-hl car-t的杀伤动力学。解冻和静置过夜后,对细胞进行计数,并且经由添加未转导的细胞归一化每个供体的
car+细胞百分比。然后对归一化的car-t细胞进行计数并以5x105个car+细胞/ml的浓度重悬以获得2.5:1的起始car+e:t比率。制备总共八份2倍稀释液,并将效应细胞接种在96孔板中(每孔100μl)。收获靶细胞系,计数,以1x105个细胞/ml重悬,并且根据平板布局接种(96孔板;每孔100μl)。在混合car-t细胞和靶细胞之后,在384孔板中一式两份地分配来自每个孔的80μl。然后将共培养物放置在zoom活内涵成像系统中,并且用4x物镜(单个图像)每4小时在两相和荧光通道中自动获取图像,持续4天至6天。基于mkate2红色荧光蛋白表达定量靶细胞的水平。为了随时间推移定量癌细胞杀伤,将每个重复的平均面积导出到graphpad prism并针对每种条件导出曲线下面积(auc)。在归一化到未处理的对照之后,将e:t比率相对于auc值绘制为剂量反应。生成五个供体(两个独立实验)的合并值(平均值
±
sem)或单独值的剂量反应图。在图11a和图11b中分别针对cd79b/cd19+细胞和cd79b/cd19
–
细胞示出了合并图。在图11c-图11d和图11e-图11f中分别针对cd79b/cd19+细胞和cd79b/cd19
–
细胞示出了显示每个供体的单独杀伤曲线的曲线图。
[0178]
图12a-图12j示出了441-hl car-t细胞的促炎性细胞因子的抗原特异性产生。在基于流式细胞术的杀伤测定期间收集来自四个cd79b/cd19+细胞系(hbl-1、oci-ly-10、carnaval、will-2)和两个cd79b/cd19
–
细胞系(hly-1和su-dhl-1)的上清液,并且通过meso scale discovery(msd)进行测试。进行数据分析并将每种细胞因子的结果绘制为五个供体中的每个供体(两个独立实验)的单独值,以及每个处理组的平均值。图12a-图12d中示出了对于每个供体而言收集到的441-hl car-t、cd19 car-t和utd细胞上清液中检测到的infγ、il-2、tnfα、il-6水平(pg/ml)的曲线图,以及跨供体的合并图(平均值
±
sem)。图12e-图12h中示出了对于每个供体而言收集到的441-hl car-t、cd19 car-t和utd细胞上清液中检测到的il-4、il-1β、il10和il12p70(pg/ml)的曲线图,以及跨供体的合并图(平均值
±
sem)。图12i-图12j中示出了对于每个供体而言收集到的441-hl car-t、cd19car-t和utd细胞上清液中检测到的il-13和il-8(pg/ml)的曲线图,以及跨供体的合并图(平均值
±
sem)。
[0179]
图13a-图13c示出了carnaval异种移植模型中cd79b car-t细胞对肿瘤生长的剂量依赖性抑制。图13a示出了用于研究cd79b car-t细胞在carnaval异种移植模型中的体内功效的实验范例的示意图。在第0天在nod/scid/il-2rg-/-(nsg)小鼠中皮下植入处于对数生长期的carnaval细胞(5x105个)。当组均肿瘤体积达到大约50mm
3-100mm3/只小鼠时(植入后14天),静脉注射多剂如本文所述的car+t细胞。记录肿瘤体积和体重,并定期收集血样。图13b中示出了在肿瘤植入后的天数中的平均肿瘤体积(mm2±
sem)。图13c中示出了在肿瘤植入后的天数中的平均体重变化百分比(%
±
sem)。
具体实施方式
[0180]
对示例性实施方案的描述如下:
[0181]
本公开提供了嵌合抗原受体(car)(其靶向分化簇79b蛋白(cd79b))、包含此类car的细胞,以及使用本文所述的car治疗癌症(例如,b细胞淋巴瘤)的方法。
[0182]
本发明的car对cd79b具有抗原特异性。如本文所用,短语“具有抗原特异性”和“引发抗原特异性应答”意味着car可以特异性地结合并且免疫识别抗原,使得car与cd79b抗原的结合引发免疫应答。测试car的抗原特异性和识别靶细胞的能力的方法是本领域已知的。
[0183]
本公开还提供了相关的核酸、重组表达载体、宿主细胞、细胞群体、抗体或其抗原
结合部分,以及与本发明的car相关的药物组合物。
[0184]
下文仅出于说明性目的参考实施例描述本发明的若干方面。应当理解,阐述了许多具体的细节、关系和方法来提供对本发明的全面理解。然而,相关领域的普通技术人员将容易认识到,本发明可以在没有一种或多种具体细节的情况下实施,或者可以用其他方法、方案、试剂、细胞系和动物实施。本发明不受动作或事件的所展示次序的限制,因为一些动作可以以不同的次序发生和/或与其他动作或事件同时发生。此外,并非所有展示的动作、步骤或事件都是实施根据本发明的方法所必需的。本文所述或引用的许多技术和规程是本领域的技术人员熟知的,并且通常由本领域的技术人员使用常规方法加以采用。
[0185]
除非另外限定,否则本文所用的所有专门术语、符号和其他科学术语或专门用语均旨在具有本发明所属领域的技术人员通常理解的含义。在一些情况下,为了清楚起见和/或为了易于参考,本文定义了具有通常理解的含义的术语,并且本文包含的这些定义不应必须被解释为表示与本领域通常理解的含义存在显著性的差别。还应当理解,术语(诸如常用词典中定义的那些)应当被解释为具有与其在相关领域的语境中的含义一致的含义和/或如本文另外所定义的含义。
[0186]
定义
[0187]
当提供一个列表时,除非另行指出,否则应当理解,该列表中的每个单独元素和该列表的每种组合都是单独的实施方案。例如,作为“a、b或c”呈现的实施方案的列表将被理解为包括实施方案“a”、“b”、“c”、“a或b”、“a或c”、“b或c”或者“a、b或c”。
[0188]
应当了解,本文所用的术语只是为了描述具体实施方案的目的,并非旨在进行限制。如本文所用,除非上下文另外明确地指出,否则不定冠词“一个”、“一种”和“该”应当被理解为包括复数指代。
[0189]
过渡术语“包括”、“基本上由
……
组成”和“由
……
组成”旨在暗示它们在专利用语中的公认含义;即,(i)“包括”与“包含”、“含有”或“其特征在于”同义,并且是包括端值在内或末端开放的,并且不排除附加的、未列出的要素或方法步骤;(ii)“由
……
组成”排除权利要求书未指定的任何要素、步骤或成分;以及(iii)“基本上由
……
组成”将权利要求的范围限制于指定的材料或步骤“以及本质上不影响受权利要求书保护的发明的基本及新颖特征的材料或步骤”。还提供了以短语“包括”(或其等同形式)描述的实施方案,如以“由
……
组成”和“基本上由
……
组成”独立描述的那些实施方案。
[0190]
术语“约”或“大约”包括在统计学上有意义的值范围内。此类范围可以在给定值或范围的数量级内,优选地在50%以内,更优选地在20%以内,仍更优选地在10%以内,并且甚至更优选地在5%以内。术语“约”或“大约”涵盖的可允许的变化取决于所研究的具体系统,并且可以由本领域普通技术人员容易地理解。
[0191]“活化”或“刺激”意指诱导细胞的生物状态变化,通过该变化,细胞(例如,t细胞和nk细胞)表达活化标志物,产生细胞因子、增殖和/或变得对靶细胞具有细胞毒性。所有这些变化都可由初级刺激信号产生。共刺激信号可以放大初级信号的幅度并阻抑初始刺激后的细胞死亡,从而产生更持久的活化状态并因此产生更高的细胞毒性能力。“共刺激信号”是指与初级信号(诸如tcr/cd3连接)组合的信号导致t细胞和/或nk细胞增殖和/或关键分子的上调或下调。
[0192]“双特异性”是指特异性结合两个不同抗原或同一抗原内的两个不同表位的分子
细胞、cd8+细胞和cd8-细胞。nkt细胞上的tcr的独特之处在于它识别由mhc i样分子cd id递呈的糖脂抗原。由于nkt细胞能够产生促进炎症或免疫耐受的细胞因子,因此它们可具有保护作用或有害作用。还包括“γ-δt细胞(γδt细胞)”,是指特化的群体,即在其表面上具有独特tcr的t细胞的小子集,并且与其中tcr由被命名为α-tcr链和β-tcr链的两种糖蛋白链组成的大多数t细胞不同,γδt细胞中的tcr由γ-链和δ-链组成。γδt细胞可以在免疫监视和免疫调节中起作用,并且被发现是il-17的重要来源且诱导强烈的cd8+细胞毒性t细胞应答。还包括“调节性t细胞”或“treg”,其是指抑制异常或过度免疫应答并在免疫耐受中起作用的t细胞。treg细胞通常是转录因子foxp3阳性cd4+t细胞,并且还可以包括为产生il-10的cd4+t细胞的转录因子foxp3阴性调节性t细胞。
[0202]
术语“自然杀伤细胞”和“nk细胞”是可互换的并且在本文中同义使用。如本文所用,nk细胞是指具有cd 16+cd56+和/或cd57+tcr-表型的分化淋巴细胞。nk的特征在于其能够给通过活化特异性溶细胞酶来结合并杀死不能表达“自身”mhc/hla抗原的细胞,能够杀死表达nk活化受体的配体的肿瘤细胞或其他患病细胞,并且能够释放称为刺激或抑制免疫应答的细胞因子的蛋白质分子。
[0203]
如本文所用,术语“抗原”是指能够被t细胞受体结合的任何试剂(例如,蛋白质、肽、多糖、糖蛋白、糖脂、核酸、它们的部分或它们的组合)分子。抗原也能够引起免疫应答。免疫应答的示例可涉及但不限于抗体产生,或特异性免疫活性细胞的活化,或这两者。技术人员将理解,抗原根本不需要由“基因”编码。显而易见的是,抗原可通过合成方式生成或者可来源于生物样品,或者可以是除了多肽之外的大分子。此类生物样品可包括但不限于组织样品、肿瘤样品、细胞或具有其他生物组分的流体、生物体、蛋白质/抗原的亚基、杀死或灭活的全细胞或溶解物。
[0204]“抗原结合片段”或“抗原结合结构域”是指蛋白质的结合抗原的部分。抗原结合结构域可以是合成的、可酶促获得的或经遗传工程化的多肽,并且包括免疫球蛋白质的结合抗原的部分,诸如vh、vl、vh和vl、fab、fab’、f(ab')2、fd和fv片段,由一个vh结构域或一个vl结构域组成的结构域抗体(dab),鲨鱼可变ignar结构域,驼峰化vh结构域,vhh结构域,由模拟抗体的cdr诸如fr3-cdr3-fr4部分、hcdr1、hcdr2和/或hcdr3以及lcdr1、lcdr2和/或lcdr3的氨基酸残基组成的最小识别单元,结合抗原的替代性支架,及包含抗原结合片段的多特异性蛋白质。抗原结合片段(诸如vh和vl)可经由合成接头连接在一起以形成各种类型的单抗体设计,其中在vh和vl结构域由单独的单链表达的那些情况下,vh/vl结构域可在分子内或分子间配对,以形成单价抗原结合位点,诸如单链fv(scfv)或双链抗体。抗原结合片段也可以缀合至其它抗体、蛋白质、抗原结合片段或替代性支架缀合,所述支架可以是单特异性或多特异性的以工程化双特异性和多特异性蛋白质。
[0205]
术语“抗体”是指单克隆抗体、多特异性抗体、人抗体、人源化抗体、嵌合抗体、单链fv(scfv)、单链抗体、fab片段、f(ab')片段、二硫键连接的fv(sdfv)、细胞内抗体、微抗体、双抗体和抗独特型(抗id)抗体(包括例如抗原特异性tcr的抗id抗体)和上述抗体中任一者的表位结合片段。术语“抗体”也指共价双抗体,诸如美国专利申请公布2007/0004909中公开的那些和ig-darts,诸如美国专利申请公布2009/0060910中公开的那些。可用作tcr结合分子的抗体包括免疫球蛋白分子和免疫球蛋白分子的免疫活性片段,即含有抗原结合位点的分子。免疫球蛋白分子可以是任何类型(例如,igg、ige、igm、igd、iga和igy)、类别(例如,
igg1、igg2、igg3、igg4、igm1、igm2、iga1和iga2)或亚类。
[0206]“人抗体”是指当施用于人受试者时被优化以具有最小限度的免疫应答的抗体。人抗体的可变区源自人免疫球蛋白序列。如果人抗体包含恒定区或恒定区的一部分,则该恒定区也源自人免疫球蛋白序列。如果人抗体的可变区由使用人种系免疫球蛋白或重排免疫球蛋白基因的系统获得,则该人抗体包含“源自”人起源序列的重链可变区和轻链可变区。此类示例性系统为在噬菌体上展示的人免疫球蛋白基因文库,以及转基因非人动物,诸如携带人免疫球蛋白基因座的小鼠或大鼠。由于用于获得人抗体和人免疫球蛋白基因座的系统之间的差异,体细胞突变的引入或有意将取代引入框架或cdr中或两者,因此“人抗体”与在人中表达的免疫球蛋白相比通常包含氨基酸差异。通常,“人抗体”的氨基酸序列与由人种系免疫球蛋白基因或重排免疫球蛋白基因编码的氨基酸序列具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。在一些情况下,“人抗体”可以包含由人框架序列分析得出的共有框架序列(例如,如knappik等人,(2000)j mol biol 296:57-86中所述),或结合到展示在噬菌体上的人免疫球蛋白基因文库中的合成hcdr3(例如,如shi等人,(2010)j mol biol 397:385-96和国际专利公开wo2009/085462中所述的)。“人抗体”的定义中不包括至少一个cdr源自非人物种的抗体。
[0207]“人源化抗体”是指其中至少一个cdr来源于非人物种并且至少一个框架来源于人免疫球蛋白序列的抗体。人源化抗体在框架中可包含取代,使得该框架可能不是表达的人免疫球蛋白或人免疫球蛋白种系基因序列的精确拷贝。
[0208]“特异性结合”或“结合”是指蛋白质类分子以比对其他抗原更大的亲和力与抗原或抗原内的表位结合。通常,蛋白质分子与抗原或抗原内的表位结合,平衡解离常数(kd)为约1x10-7
m或更低,例如约5x10-8
m或更低、约1x10-8
m或更低、约1x10-9
m或更低、约1x10-10
m或更低、约1x10-11
m或更低或约1x10-12
m或更低,通常kd比它与非特异性抗原(例如bsa、酪蛋白)结合的kd低至少一百倍。在本文所述的cd79b抗原的上下文中,“特异性结合”是指蛋白质分子与cd79b抗原的结合,而没有与新抗原为其变体的野生型蛋白质的可检测结合。
[0209]
术语“宿主细胞”意指含有异源核酸的任何细胞。异源核酸可以是载体(例如,表达载体)。例如,宿主细胞可以是来自以任何方式选择、修饰、转化、生长、使用或操纵的任何生物体的细胞,用于通过细胞产生物质,例如通过细胞表达基因、dna或rna序列、蛋白质或酶。可以确定适当的宿主。例如,可以基于载体主链和期望的结果来选择宿主细胞。举例来说,可以将质粒或粘粒引入原核生物宿主细胞中以复制几种类型的载体。细菌细胞诸如但不限于dh5α、jm109和kcb、感受态细胞以及solopack黄金细胞可以用作载体复制和/或表达的宿主细胞。另外,细菌细胞诸如大肠杆菌le392可以用作噬菌体病毒的宿主细胞。可以用作宿主细胞的真核细胞包括但不限于酵母(例如,yph499、yph500和yph501)、昆虫和哺乳动物。用于载体的复制和/或表达的哺乳动物真核宿主细胞的示例包括但不限于hela、nih3t3、jurkat、293、cos、cho、saos和pc12。
[0210]
本公开的宿主细胞包括t细胞和自然杀伤细胞,这些细胞含有编码car的dna或rna序列并在细胞表面上表达car。宿主细胞可用于增强t细胞活性、自然杀伤细胞活性、癌症的治疗和自身免疫疾病的治疗。
[0211]
术语“增殖”是指细胞分裂(细胞的对称或不对称分裂)增加。术语“扩增”是指细胞
artiodactyla),包括牛科动物(奶牛)和猪科动物(猪),或者奇蹄目(order perssodactyla),包括马科动物(马)。哺乳动物可以是灵长目(order primate)、四足猴目(order ceboid)或猴目(order simoid)(猴),或者类人猿目(order anthropoid)(人和猿)。在一个实施方案中,哺乳动物是人。
[0220]
所谓“增强”或“促进”或“增加”或“扩大”或“改进”通常是指与由媒介物或对照分子/组合物引起的响应相比,本文预期的组合物产生、引发或导致更大生理响应(即,下游作用)的能力。可测量的生理应答可包括t细胞扩增、活化、效应功能、持久性的增加,和/或癌细胞死亡杀伤能力的增加,以及从本领域的理解和本文的描述中显而易见的应答等。在某些实施方案中,“增加的”或“增强的”量可以是“统计意义上显著的”量,并且可包括比由媒介物或对照组合物产生的应答增加1.1倍、1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍或更多倍(例如,500倍、1000倍)(包括其间和高于1的所有整数和小数点,例如1.5倍、1.6倍、1.7倍、1.8倍等)。
[0221]“降低”或“下降”或“减少”或“减小”或“减弱”通常是指与由媒介物或对照分子/组合物引起的应答相比,本文设想的组合物产生、引发或引起更小生理应答(即,下游效应)的能力。在某些实施方案中,“降低的”或“减少的”量可以是“统计意义上显著的”量,并且可包括比由媒介物、对照组合物产生的应答(参考应答)或特定细胞谱系中的应答降低1.1倍、1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍或更多倍(例如,500倍、1000倍)(包括其间和高于1的所有整数和小数点,例如1.5倍、1.6倍、1.7倍、1.8等)。
[0222]“癌症”是指广泛的各种疾病,其特征在于身体中异常细胞的不受控制的生长。未受控制的细胞分裂和生长导致形成侵入相邻组织的恶性肿瘤,并且还可通过淋巴系统或血流转移到身体的远侧部分。“癌症”或“癌症组织”可包括肿瘤。
[0223]“复发”是指在先前用治疗剂治疗之后改善一段时间之后疾病或疾病的迹象和症状的再现。
[0224]“难治性”是指对治疗无应答的疾病。难治性疾病可在治疗之前或开始时对治疗具有抗性,或者难治性疾病可在治疗期间变得具有抗性。
[0225]“肿瘤细胞”或“癌细胞”是指在体内、离体或组织培养物中的癌性、癌前或转化的细胞,其具有自发或诱导的表型变化。这些变化未必涉及新遗传物质的摄取。然而转化可由感染转化病毒以及结合新基因组核酸、摄取外源核酸而发生,或者其也可自发地发生或在暴露于致癌物之后发生,从而使内源基因突变。转化/癌症示例为合适的动物宿主(诸如裸小鼠等)中体外、体内和离体的形态变化、细胞永生、异常生长控制、病灶形成、增殖、恶性肿瘤、肿瘤特异性标志物水平调节、侵入、肿瘤生长。
[0226]
应用于剂量或量的术语“有效”是指足以在向有需要的受试者施用时产生期望活性的化合物或药物组合物的量。注意,当施用活性成分的组合时,所述组合的有效量可以包括或可以不包括如果单独施用将有效的每种成分的量。所需的确切量将随受试者而变化,取决于受试者的物种、年龄和一般病状、所治疗的病状的严重程度、所采用的一种或多种特定药物、施用模式等。
[0227]
术语“预防(prevent)”、“预防(preventing)”、“预防(prevention)”或“防预(prophylaxis)”疾病或病症意指预防病症在受试者中发生。
[0228]“治疗有效量”或“有效量”在本文中互换使用,是指在所需剂量和时间段有效实现
期望的治疗结果的量。治疗有效量可根据以下因素变化:诸如个体的疾病状态、年龄、性别和重量,以及治疗剂或治疗剂组合在个体中引发期望的应答的能力。有效治疗剂或治疗剂组合的示例性指标包括,例如:患者健康状况的改善、肿瘤负荷的减少、肿瘤生长的遏止或减慢和/或癌细胞没有向身体其他部位转移的情况。
[0229]
与本文所述的组合物结合使用的短语“药学上可接受的”是指此类组合物的分子实体和其他成分,是生理学上耐受的并且当施用于哺乳动物(例如人)时通常不会产生不良反应。优选地,术语“药学上可接受的”意味着由联邦或州政府的监管机构批准的或者在美国药典或其他公认的药典中列出的用于在哺乳动物并且更具体地人类中使用的物质。
[0230]
本文使用的术语“蛋白质”涵盖所有种类的天然存在的和合成的蛋白质,包括所有长度的蛋白质片段、融合蛋白和修饰的蛋白质,包括但不限于糖蛋白类以及所有其他类型的修饰蛋白质(例如由磷酸化、乙酰化、肉豆蔻酰化、棕榈酰化、糖基化、氧化、甲酰化、酰胺化、聚谷氨酰化、adp核糖基化、聚乙二醇化、生物素酰化等)。
[0231]
除非另有说明,否则术语“核酸”、“核苷酸”和“多核苷酸”涵盖dna和rna两者。“核酸序列”或“核苷酸序列”意指编码氨基酸的核酸序列;这些术语还可以指包括编码作为克隆制品的任何氨基酸的部分的核酸序列,包括由接头编码的任何氨基酸。
[0232]“分离的”是指已从产生分子的系统(诸如重组细胞)的其他组分中基本上分离和/或纯化出来的分子(诸如合成多核苷酸或多肽)的同质群体,以及已经受至少一个纯化或分离步骤的蛋白质。“分离的”是指基本上不含其他细胞材料和/或化学物质的分子,并且涵盖分离至更高纯度(诸如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%纯度)的分子。
[0233]
术语“载剂”是指与化合物一起施用的稀释剂、辅助剂、赋形剂或介质。此类药物载剂可以是无菌液体,诸如水和油,包括来源于石油、动物、植物的油或合成的那些油,诸如花生油、大豆油、矿物油、芝麻油等。水或水溶液盐水溶液和葡萄糖水溶液和甘油溶液优选用作载剂,特别是用于可注射溶液。另选地,载剂可以是固体剂型载剂,包括但不限于粘结剂(用于压缩丸剂)、助流剂、包封剂、调味剂和着色剂中的一种或多种。合适的药物载剂描述于e.w.martin的“pharmaceutical sciences”中。
[0234]“分化簇79b蛋白”或“cd79b”是指已知蛋白质,也称为b细胞特异性糖蛋白b29、ig-β或agm6。b淋巴细胞抗原受体是多聚体复合物,该多聚体复合物包括与ig-α和ig-β非共价缔合的抗原特异性组分,表面免疫球蛋白(ig)。cd79b是b细胞抗原组分的ig-β蛋白。所有cd79b同种型和变体均涵盖在“cd79b”中。可从genbank登录号aah32651.1、eaw94232.1、aah02975.2、np_000617.1和np_001035022.1中检索各种同种型的氨基酸序列。全长cd79b序列的氨基酸序列如下所示。该序列包括细胞外结构域(残基29-159)和细胞质结构域(残基181-229)。
[0235]
marlalspvpshwmvalllllsaepvpaarsedryrnpkgsacsriwqsprfiarkrgftvkmhcymnsasgnvswlwkqemdenpqqlklekgrmeesqneslatltiqgirfedngiyfcqqkcnntsevyqgcgtelrvmgfstlaqlkqrntlkdgiimiqtlliilfiivpifllldkddskagmeedhtyegldidqtatyedivtlrtgevkwsvgehpgqe(seq id no:282)
[0236]
嵌合抗原受体
[0237]
本发明整体涉及经基因修饰以稳定表达所需的嵌合抗原受体的t细胞的用途。嵌
合抗原受体(car)是人工构建的杂合蛋白或多肽,其含有与t细胞信号传导结构域连接的抗体(scfv)的抗原结合结构域。car的特性可以包括它们能够以非mhc限制性方式将t细胞特异性和反应性重定向至所选靶标,从而利用单克隆抗体的抗原结合性质。非mhc限制性抗原识别赋予表达car的t细胞不依赖于抗原加工而识别抗原的能力,因此绕过了肿瘤逃逸的主要机制。此外,当在t细胞中表达时,car有利地不与内源性t细胞受体(tcr)的α链和β链二聚化。
[0238]
本文所述的car提供重组多肽构建体,所述重组多肽构建体至少包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域(在本文中也称为“细胞质信号传导结构域”),该细胞内信号传导结构域包括来源于如下定义的刺激分子的功能性信号传导结构域。表达car的t细胞在本文中称为car t细胞、car-t细胞或经car修饰的t细胞,并且这些术语在本文中可互换使用。该细胞可以经基因修饰以在其表面上稳定地表达抗体结合结构域,从而赋予不依赖mhc的新型抗原特异性。
[0239]
在一些情况下,t细胞经基因修饰以稳定地表达car,该car将特异性抗体的抗原识别结构域与cd3-ζ链或fcγri蛋白的细胞内结构域组合成单个嵌合蛋白。在一个实施方案中,刺激分子是与t细胞受体复合物缔合的ζ链。
[0240]
如本文所用的术语“细胞内信号传导结构域”是指分子的细胞内部分。该蛋白质的功能性部分通过在细胞内传递信息起作用,以通过产生第二信使经由限定的信号传导通路调节细胞活性,或者通过响应于此类信使而起到效应子的作用。细胞内信号传导结构域产生促进含有car的细胞(例如,car-t细胞)的免疫效应子功能的信号。免疫效应子功能的示例(例如,在car-t细胞中)包括细胞溶解活性和辅助活性,包括分泌细胞因子。
[0241]
在一个实施方案中,细胞内信号传导结构域可以包括初级细胞内信号传导结构域。示例的初级细胞内信号传导结构域包括来源于负责初级刺激或抗原依赖性刺激的分子的那些。在一个实施方案中,细胞内信号传导结构域可以包括共刺激细胞内结构域。示例的共刺激细胞内信号传导结构域包括来源于负责共刺激信号或抗原非依赖性刺激的分子的那些。例如,就car-t而言,初级细胞内信号传导结构域可以包含t细胞受体的细胞质序列,并且共刺激细胞内信号传导结构域可以包含来自共受体或共刺激分子的细胞质序列。
[0242]
初级细胞内信号传导结构域可以包含信号传导基序,其被称为基于免疫受体酪氨酸的活化基序或itam。包含itam的初级细胞质信号传导序列的示例包括但不限于来源于cd3-ζ、fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b和cd66d dap10以及dap12的那些。
[0243]
术语“ζ”或者替代性地“ζ链”、“cd3-ζ”或“tcr-ζ”被定义为以genbank登录号bag36664.1提供的蛋白质,或者来自非人物种(例如,鼠、兔、灵长类、小鼠、啮齿类、猴、猿等)的等同残基,并且“ζ刺激结构域”或者替代性地“cd3-ζ刺激结构域”或“tcr-ζ刺激结构域”被定义为来自ζ链的细胞质结构域的足以在功能上传递t细胞活化所必需的初始信号的氨基酸残基。在一个方面,ζ的细胞质结构域包含genbank登录号bag36664.1的残基52至164,或者来自非人物种(例如小鼠、啮齿类、猴、猿等)的为其功能直系同源物的等同残基。在一个方面,“ζ刺激结构域”或“cd3-ζ刺激结构域”是作为seq id no:28提供的序列,或与seq id no:41具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一
性的序列。
[0244]
术语“共刺激分子”是指t细胞上的同源结合配偶体,其与共刺激配体特异性地结合,从而介导t细胞的共刺激应答,诸如但不限于增殖。共刺激分子是有效免疫应答所需的除抗原受体或其配体之外的细胞表面分子。共刺激分子包括但不限于mhc 1类分子、btla和toll配体受体,以及ox40、cd2、cd27、cd28、cds、icam-1、lfa-1(cd11a/cd18)和4-1bb(cd137)。
[0245]
共刺激细胞内信号传导结构域可以是共刺激分子的细胞内部分。共刺激分子可以表示在下列蛋白质家族中:tnf受体蛋白、免疫球蛋白样蛋白、细胞因子受体、整联蛋白、信号传导淋巴细胞性活化分子(slam蛋白)和活化nk细胞受体。此类分子的示例包括cd27、cd28、4-1bb(cd137)、ox40、gitr、cd30、myd88、cd40、icos、baffr、hvem、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c、slamf7、nkp80、cd160、b7-h3,以及与cd83特异性结合的配体,等等。
[0246]
细胞内信号传导结构域可以包含其来源分子的整个细胞内部分或整个天然细胞内信号传导结构域,或其功能片段。
[0247]
术语“4-1bb”或另选地“cd137”是指tnfr超家族的成员,其具有作为genbank登录号aaa62478.2提供的氨基酸序列,或者来自非人物种(例如,小鼠、啮齿类、猴、猿等)的等同残基;并且“4-1bb共刺激结构域”被定义为genbank登录号aaa62478.2的氨基酸残基214至255,或者来自非人物种(例如,小鼠、啮齿类、猴、猿等)的等效残基。在一个方面,“4-1bb共刺激结构域”或“cd137共刺激结构域”是作为seq id no:27提供的序列,或者来自非人物种(例如,小鼠、啮齿类、猴、猿等)的等同残基,或者与seq id no:40具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的序列。
[0248]
在一个实施方案中,使用与car中的一个结构域天然缔合的跨膜结构域。在另一个实施方案中,跨膜结构域可以通过氨基酸取代来选择或修饰,以避免此类结构域与相同或不同的表面膜蛋白的跨膜结构域结合,从而使与受体复合物的其他成员的相互作用最小化。在一个示例的实施方案中,跨膜结构域包括cd8α铰链结构域。
[0249]
在一些实施方案中,细胞质信号传导结构域还包含一个或多个源自至少一个如本文所定义的共刺激分子的功能性信号传导结构域。在一个实施方案中,共刺激分子选自4-1bb(即cd137)、cd27、cd3-ζ和/或cd28。cd28是在t细胞共刺激中很重要的t细胞标记物。cd27是肿瘤坏死因子受体超家族的成员并且充当共刺激免疫检查点分子。4-1bb将强效共刺激信号传递给t细胞,从而促进t淋巴细胞分化并且增强t淋巴细胞的长期存活。cd3-ζ与tcr缔合以产生信号,并且包含基于免疫受体酪氨酸的活化基序(itam)。在另一个实施方案中,共刺激分子是myd88或cd40。
[0250]
在一个实施方案中,car包含细胞内铰链结构域和细胞内t细胞受体信号传导结构域,其中细胞内铰链结构域包含cd8,细胞内t细胞受体信号传导结构域包含cd28、4-1bb和cd3-ζ。在另一个实施方案中,car包含细胞内铰链结构域和细胞内t细胞受体信号传导结构域,细胞内t细胞受体信号传导结构域包含cd28、4-1bb和cd3-ζ,其中铰链结构域包含cd8、cd4或cd28的整个或部分细胞外区域;整个或部分抗体恒定区;fcyriiia受体、igg铰链、igm铰链、iga铰链、igd铰链、ige铰链或ig铰链的全部或部分。igg铰链可以来自igg1、igg2、
igg3、igg4、igm1、igm2、iga1、iga2、igd、ige或它们的嵌合体。
[0251]
本文所述的car提供重组多肽构建体,所述重组多肽构建体至少包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域(在本文中也称为“细胞质信号传导结构域”),该细胞内信号传导结构域包括例如来源于如下定义的刺激分子的功能性信号传导结构域。
[0252]
在一个实施方案中,car包含嵌合融合蛋白,该嵌合融合蛋白包含细胞外抗原识别结构域、跨膜结构域和细胞内信号传导结构域,所述细胞内信号传导结构域包括源自刺激分子的功能性信号传导结构域。在一个实施方案中,car包含嵌合融合蛋白,该嵌合融合蛋白包含细胞外抗原识别结构域、跨膜结构域和细胞内信号传导结构域,所述细胞内信号传导结构域包括来源于共刺激分子的功能性信号传导结构域和来源于刺激分子的功能性信号传导结构域。在一个实施方案中,car包含嵌合融合蛋白,该嵌合融合蛋白包含细胞外抗原识别结构域、跨膜结构域和细胞内信号传导结构域,所述细胞内信号传导结构域包括源自一个或多个共刺激分子的至少两个功能性信号传导结构域以及源自刺激分子的功能性信号传导结构域。
[0253]
本发明的car可以被设计成自身包含cd28信号传导结构域和/或4-1bb信号传导结构域,或者与可用于本发明的car的语境中的任何其他期望的细胞质结构域组合。在一个实施方案中,car的细胞质结构域可以还包含信号传导结构域cd3-ζ。例如,car的细胞质结构域可以包括但不限于cd3-ζ、4-1bb和cd28信号传导模块,以及它们的组合。因此,本发明提供了car t细胞及其用于过继疗法的方法。
[0254]
本公开还提供了本文所述的car、核酸、多肽和蛋白质的变体,例如功能性变体。“变体”是指因一处或多处修饰(例如,置换、插入或缺失)而不同于参考多肽或参考多核苷酸的多肽或多核苷酸。如本文所用,术语“功能性变体”是指与亲本car、多肽或蛋白质具有实质或显著的序列同一性或相似性的car、多肽或蛋白质,该功能性变体保留了它为其变体的car、多肽或蛋白质的生物活性。功能性变体涵盖例如本文所述的car、多肽或蛋白质(亲本car、多肽或蛋白质)的那些变体,所述变体保留了以与亲本car、多肽或蛋白质相似的程度、相同的程度或更高的程度识别靶细胞的能力。关于亲本car、多肽或蛋白质,该功能性变体可以例如与亲本car、多肽或蛋白质的氨基酸序列具有至少约30%、约40%、约50%、约60%、约75%、约80%、约85%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或更高的同一性。
[0255]
功能性变体可以例如包含具有至少一个保守氨基酸取代的亲本car、多肽或蛋白质的氨基酸序列。在另一个实施方案中,功能性变体可以包含具有至少一个非保守氨基酸取代的亲本car、多肽或蛋白质的氨基酸序列。在这种情况下,非保守氨基酸取代可以不干扰或抑制功能性变体的生物活性。非保守氨基酸取代可以增强功能性变体的生物活性,使得功能性变体的生物活性相比于亲本car、多肽或蛋白质增加。
[0256]
本发明的car的氨基酸取代可以是保守氨基酸取代。保守氨基酸取代是本领域已知的,并且包括其中具有特定的物理性质和/或化学性质的一种氨基酸被替换为具有相同或相似的化学性质或物理性质的另一种氨基酸的氨基酸取代。例如,保守氨基酸取代可以是酸性氨基酸被另一种酸性氨基酸(例如,asp或glu)取代、具有非极性侧链的氨基酸被另一种具有非极性侧链的氨基酸(例如,ala、gly、val、ile、leu、met、phe、pro、trp、val等)取
代、碱性氨基酸被另一种碱性氨基酸(lys、arg等)取代、具有极性侧链的氨基酸被另一种具有极性侧链的氨基酸(asn、cys、gln、ser、thr、tyr等)取代,等等。
[0257]
该car、多肽或蛋白质可以基本上由本文所述的一种或多种指定氨基酸序列组成,使得其他组分(例如其他氨基酸)不会实质上改变功能性变体的生物活性。
[0258]
本公开的实施方案的car、多肽和蛋白质(包括功能性部分和功能性变体)可以具有任何长度,即,可以包含任何数量的氨基酸,前提条件是该car、多肽或蛋白质(或其功能性部分或功能性变体)保持其生物活性,例如特异性地结合抗原、检测宿主中的患病细胞(例如癌细胞)或者治疗或预防宿主中的疾病等的能力。例如,该多肽的长度可以为约50个至约5000个氨基酸,诸如约50个、约70个、约75个、约100个、约125个、约150个、约175个、约200个、约225个、约250个、约275个、约300个、约325个、约350个、约375个、约400个、约425个、约450个、约475个、约500个、约525个、约550个、约575个、约600个、约625个、约650个、约675个、约700个、约725个、约750个、约775个、约800个、约825个、约850个、约875个、约900个、约925个、约950个、约975个、约1000个或更多个氨基酸。本发明的多肽还包括低聚肽。
[0259]
本发明的实施方案的car、多肽和蛋白质(包括本发明的功能性部分和功能性变体)可以包含替代一种或多种天然存在的氨基酸的合成氨基酸。此类合成氨基酸是本领域已知的,并且包括例如氨基环己烷羧酸、正亮氨酸、α-氨基正癸酸、高丝氨酸、s-乙酰氨基甲基-半胱氨酸、反式-3-羟脯氨酸和反式-4-羟脯氨酸、4-氨基苯丙氨酸、4-硝基苯丙氨酸、α-(2-氨基-2-降冰片烷)-羧酸、α,γ-二氨基丁酸、α,β-二氨基丙酸、高苯丙氨酸、4-氯苯丙氨酸、4-羧基苯丙氨酸、β-苯基丝氨酸、β-羟基苯丙氨酸、苯基甘氨酸、α-萘基丙氨酸、环己基丙氨酸、环己基甘氨酸、n'-苄基-n'-甲基-赖氨酸、n',n'-二苄基-赖氨酸、6-羟基赖氨酸、鸟氨酸、α-氨基环戊烷羧酸、α-氨基环己烷羧酸、α-氨基环庚烷羧酸、二氢吲哚-2-羧酸、1,2,3,4-四氢异喹啉-3-羧酸、氨基丙二酸、氨基丙二酸单酰胺和α-叔丁基甘氨酸。
[0260]
本发明的实施方案的car、多肽和蛋白质(包括功能性部分和功能性变体)可以经受翻译后修饰。它们可以被糖基化、酯化、n-酰化、酰胺化、羧化、磷酸化、酯化、经由例如二硫桥环化,或者转化成酸加成盐。在一些实施方案中,它们是二聚的或聚合的,或者缀合的。
[0261]
本发明的实施方案的car、多肽和/或蛋白质(包括其功能性部分和功能性变体)可以通过本领域已知的方法获得。从头合成多肽和蛋白质的合适方法在诸如下列的参考文献中有所描述:chan等人,fmoc solid phase peptide synthesis,oxford university press,oxford,united kingdom,2000;peptide and protein drug analysis,reid,r.编辑,marcel dekker,inc.,2000;和epitope mapping,westwood等人编辑,oxford university press,oxford,united kingdom,2001。另外,可以使用标准重组方法,使用本文所述的核酸来重组产生多肽和蛋白质。参见例如sambrook等人,molecular cloning:a laboratory manual,第3版,cold spring harbor press,cold spring harbor,n.y.2001;以及ausubel等人,current protocols in molecular biology,greene publishing associates and john wiley&sons,ny,1994。另外,本发明的car、多肽和蛋白质中的一些(包括其功能性部分和功能性变体)可以从诸如植物、细菌、昆虫、哺乳动物等来源分离和/或纯化。分离和纯化的方法是本领域已知的。替代性地,本文所述的car、多肽和/或蛋白质(包括其功能性部分和功能性变体)可以商业合成。在这方面,所述car、多肽和蛋白质可以是合成的、重组的、分离的和/或纯化的。
[0262]
可以用于生成用于产生本文所述的多肽的重组核酸的经修饰核苷酸的示例包括但不限于5-氟尿嘧啶、5-溴尿嘧啶、5-氯尿嘧啶、5-碘尿嘧啶、次黄嘌呤、黄嘌呤、4-乙酰基胞嘧啶、5-(羧羟甲基)尿嘧啶、羧甲基氨甲基-2-硫代尿苷、5-羧甲基氨甲基尿嘧啶、二氢尿嘧啶、n
6-取代的腺嘌呤、7-甲基鸟嘌呤、5-甲基氨甲基尿嘧啶、5-甲氧基氨甲基-2-硫尿嘧啶、β-d-甘露糖基喹啉、5
″‑
甲氧基羧甲基尿嘧啶、5-甲氧基尿嘧啶、2-甲硫基-n
6-异戊烯基腺嘌呤、尿嘧啶-5-氧基乙酸(v)、怀丁氧苷(wybutoxosine)、假尿嘧啶、辫苷、β-d-半乳糖基辫苷、肌苷、n
6-异戊烯基腺嘌呤、1-甲基鸟嘌呤、1-甲基肌苷、2,2-二甲基鸟嘌呤、2-甲基腺嘌呤、2-甲基鸟嘌呤、3-甲基胞嘧啶、5-甲基胞嘧啶、2-硫代胞嘧啶、5-甲基-2-硫尿嘧啶、2-硫尿嘧啶、4-硫尿嘧啶、5-甲基尿嘧啶、尿嘧啶-5-氧基乙酸甲酯、3-(3-氨基-3-n-2-羧丙基)尿嘧啶和2,6-二氨基嘌呤。
[0263]
该核酸可以包含任何分离的或纯化的核苷酸序列,所述核苷酸序列编码car、多肽或蛋白质或者其功能性部分或功能性变体中的任一者。替代性地,该核苷酸序列可以包括与所述序列中的任一者简并的核苷酸序列或者简并序列的组合。
[0264]
本发明的一些实施方案还提供了分离的或纯化的核酸,其包含与本文所述的任何核酸的核苷酸序列互补的核苷酸序列或者在严格条件下与本文所述的任何核酸的核苷酸序列杂交的核苷酸序列。
[0265]
在严格条件下杂交的核苷酸序列可以在高严格条件下杂交。所谓“高严格条件”,意味着核苷酸序列以可检测到的比非特异性杂交更强的量与靶序列(本文所述的任何核酸的核苷酸序列)特异性杂交。高严格条件包括将具有精确互补序列的多核苷酸,或仅含有少量分散错配的多核苷酸与恰好具有与该核苷酸序列匹配的少量小区域(例如3个至12个碱基)的随机序列区分开的条件。这种小的互补区域比14个至17个或更多个碱基的全长互补序列更容易解链,并且高严格杂交使得它们能够容易区分。相对高严格条件将包括例如低盐条件和/或高温条件,诸如在约50℃至70℃的温度下由约0.02m nacl至0.1m nacl或等同物提供的。此类高严格条件容许核苷酸序列与模板或靶链之间的极少(如果有的话)错配,并且特别适用于检测本文所述的任何car的表达。一般认为,通过添加增量的甲酰胺可以使条件更严格。
[0266]
在一个实施方案中,可以将本发明的核酸掺入到重组表达载体中。本公开提供了包含本发明的任何核酸的重组表达载体。如本文所用,术语“重组表达载体”意味着下述经基因修饰的寡核苷酸或多核苷酸构建体:当该构建体包含编码mrna、蛋白质、多肽或肽的核苷酸序列,并且载体在足以使所述mrna、蛋白质、多肽或肽在细胞内表达的条件下与宿主细胞接触时,其允许宿主细胞表达所述mrna、蛋白质、多肽或肽。本文所述的载体整体上不是天然存在的;然而,这些载体的部分可以是天然存在的。所述重组表达载体可以包含任何类型的核苷酸,包括但不限于dna和rna,其可以是单链或双链的、合成的或部分地从天然来源获得的,并且其可以包含天然的、非天然的或改变的核苷酸。所述重组表达载体可以包含天然存在的或非天然存在的核苷酸间键,或这两种类型的键。非天然存在的或改变的核苷酸或核苷酸间键不妨碍载体的转录或复制。
[0267]
在一个实施方案中,本发明的重组表达载体可以是任何合适的重组表达载体,并且可以用于转化或转染任何合适的宿主。合适的载体包括被设计用于增殖和扩增或用于表达或这两者的那些,诸如质粒和病毒。载体可以选自由以下项组成的组:puc系列
(fermentas life sciences,glen burnie,md.)、pbluescript系列(stratagene,lajolla,calif.)、pet系列(novagen,madison,wis.)、pgex系列(pharmacia biotech,uppsala,sweden)和pex系列(clontech,palo alto,calif.)。可以使用噬菌体载体,诸如λgt10、λgt11、λembl4和λnm1149、λzapii(stratagene)。植物表达载体的示例包括pbi01、pbi01.2、pbi121、pbi101.3和pbin19(clontech)。动物表达载体的示例包括peuk-cl、pmam和pmamneo(clontech)。重组表达载体可以是病毒载体,例如逆转录病毒载体,例如γ逆转录病毒载体。
[0268]
在一个实施方案中,使用例如sambrook等人(出处同上)和ausubel等人(出处同上)中所述的标准重组dna技术来制备本发明的重组表达载体。可以制备环状或线性的表达载体构建体,以包含在原核或真核宿主细胞中有功能的复制系统。复制系统可来源于例如cole1、sv40、2μ质粒、λ、牛乳头状瘤病毒等。
[0269]
重组表达载体可以包含调控序列,诸如转录和翻译起始密码子和终止密码子,所述调控序列对于载体将被适当地引入其中的宿主类型(例如,细菌、植物、真菌或动物)具有特异性,并且考虑该载体是基于dna的还是基于rna的。
[0270]
重组表达载体可以包含一种或多种标记基因,其允许选择转化的或转染的宿主。标记基因包括杀生物剂抗性(例如对抗生素、重金属等的抗性)、营养缺陷型宿主中提供原养型的互补作用等等。用于所述表达载体的合适标记基因包括例如新霉素/g418抗性基因、组氨醇x抗性基因、组氨醇抗性基因、四环素抗性基因和氨苄青霉素抗性基因。
[0271]
该重组表达载体可以包含可操作地连接至编码所述car、多肽或蛋白质(包括其功能性部分和功能性变体)的核苷酸序列,或者可操作地连接至与编码所述car、多肽或蛋白质的核苷酸序列互补或杂交的核苷酸序列的天然或标准启动子。启动子(例如强启动子、弱启动子、组织特异性启动子、诱导型启动子和发育特异性启动子)的选择在普通技术人员的技能范围内。类似地,将核苷酸序列与启动子组合也在技术人员的技能范围内。启动子可以是非病毒启动子或病毒启动子,例如细胞巨化病毒(cmv)启动子、rsv启动子、sv40启动子,或在鼠干细胞病毒的长末端重复序列中发现的启动子。
[0272]
该重组表达载体可以包含可操作地连接至编码所述car、多肽或蛋白质(包括其功能性部分和功能性变体)的核苷酸序列,或者可操作地连接至与编码所述car、多肽或蛋白质的核苷酸序列互补或杂交的核苷酸序列的一个或多个附加调控元件,诸如增强子元件、5'和3'utr或终止子序列。
[0273]
可将重组表达载体设计用于瞬时表达、用于稳定表达或用于两者。而且,可将重组表达载体制备用于组成型表达或用于诱导型表达。
[0274]
另外,可以将重组表达载体制备成包括自杀基因。如本文所用,术语“自杀基因”是指导致表达自杀基因的细胞死亡的基因。自杀基因可以是赋予表达该基因的细胞对试剂例如药物敏感并且在细胞与试剂接触或暴露于试剂时导致细胞死亡的基因。自杀基因是本领域已知的,包括例如单纯疱疹病毒(hsv)胸苷激酶(tk)基因、胞嘧啶脱氨酶、嘌呤核苷磷酸化酶和硝基还原酶。
[0275]
包括在本发明范围内的是包含下述各项中的任一者的缀合物(例如生物缀合物):car、多肽或蛋白质(包括其功能性部分或功能性变体中的任一者)、宿主细胞、核酸、重组表达载体、宿主细胞群体,或者抗体或其抗原结合部分。一般来讲,缀合物以及合成缀合物的
方法是本领域已知的(例如参见hudecz,f.,methods mol.biol.298:209-223(2005)和kirin等人,norg chem.44(15):5405-5415(2005))。
[0276]
本发明的一个实施方案还提供了抗体或其抗原结合部分,其结合(例如,特异性结合)至本发明的car的表位。
[0277]
该抗体可以是本领域已知的任何类型的免疫球蛋白。免疫球蛋白可以被分为五大类:iga、igd、ige、igg和igm。iga和igg被进一步分为同种型iga1、iga2、igg1、igg2、igg3和igg4。脊椎动物物种的抗体轻链可以基于其恒定结构域的氨基酸序列而被指定为两种类型即κ和λ中的一种。抗体可以是任何类型或同种型。
[0278]
抗体包括免疫球蛋白分子,具体包括单克隆抗体(包括鼠单克隆抗体、人单克隆抗体、人源化单克隆抗体和嵌合单克隆抗体)、多克隆抗体、抗原结合片段、双特异性或多特异性抗体,单体抗体、二聚抗体、四聚抗体或多聚抗体,单链抗体、结构域抗体,以及包含具有所需特异性的抗原结合位点的免疫球蛋白分子的任何其他经修饰构型。抗体可以是天然存在的抗体,例如从哺乳动物(例如鼠、灵长类、小鼠、兔、山羊、马、鸡、仓鼠、人等)分离和/或纯化的抗体。替代性地,抗体可以是工程化(例如,基因工程化)的抗体。
[0279]
人源化抗体具有来源于非人物种的抗原结合位点并且可变区框架来源于人免疫球蛋白序列。人抗体具有重链可变区和轻链可变区,其中框架和抗原结合位点均来源于人起源的序列。
[0280]
另外,该抗体可以对car的功能性部分具有任何水平的亲和力或亲合力。在一些实施方案中,抗体可以以一系列亲和力(kd)结合cd79b抗原。在根据本发明的一个实施方案中,并且在下文列出的带有编号的实施方案的每一者中的一些实施方案中,该抗体以高亲和力结合cd79b抗原,例如,由表面等离子体共振或kinexa方法确定,kd等于或小于约10-7
m,诸如但不限于1-9.9(或者其中的任何范围或值,诸如1、2、3、4、5、6、7、8或9)
×
10-8
m、10-9
m、10-10
m、10-11
m、10-12
m、10-13
m、10-14
m、10-15
m或者其中的任何范围或值,如本领域的技术人员所实践。一种示例的亲和力等于或小于1
×
10-8
m。另一种示例的亲和力等于或小于1
×
10-9
m。
[0281]
测试抗体结合car的任何功能性部分的能力的方法是本领域已知的,并且包括任何抗体-抗原结合测定,诸如放射性免疫测定(ria)、蛋白质印迹、酶联免疫吸附测定(elisa)、免疫沉淀和竞争性抑制测定。
[0282]
制备抗体的合适方法是本领域已知的。例如,标准杂交瘤方法在以下文献中有所描述:例如和milstein,eur.j.immunol.,5,511-519(1976),harlow和lane(编辑),antibodies:a laboratory manual,csh press(1988),以及c.a.janeway等人(编辑),immunobiology,第5版,garland publishing,new york,n.y.(2001))。替代性地,其他方法诸如ebv杂交瘤方法(haskard和archer,j.immunol.methods,74(2),361-67(1984)以及roder等人,methods enzymol.,121,140-67(1986))以及噬菌体载体表达系统(参见例如huse等人,science,246,1275-81(1989))是本领域已知的。另外,在非人动物中产生抗体的方法在例如美国专利号5,545,806、5,569,825和5,714,352以及美国专利申请公布号2002/0197266a1中有所描述。
[0283]
噬菌体展示也可以用于产生抗体。就这一点而言,编码抗体的抗原结合可变(v)结构域的噬菌体文库可以使用标准分子生物学技术和重组dna技术产生(参见例如sambrook
等人(出处同上)和ausubel等人(出处同上))。选择编码具有期望的特异性的可变区的噬菌体,用于与期望的抗原(即,cd79b)特异性结合,并且重建包含所选可变结构域的完整或部分抗体。将编码重建抗体的核酸序列引入合适的细胞系(诸如用于产生杂交瘤的骨髓瘤细胞)中,使得具有单克隆抗体特性的抗体由该细胞分泌(参见例如,janeway等人(出处同上)、huse等人(出处同上)和美国专利号6,265,150)。
[0284]
抗体可以由转基因小鼠产生,所述转基因小鼠对于特定的重链免疫球蛋白基因和轻链免疫球蛋白基因是转基因的。此类方法是本领域已知的,并且描述于例如美国专利5,545,806和5,569,825以及janeway等人(出处同上)中。
[0285]
用于产生人源化抗体的方法是本领域已知的,并且描述于例如janeway等人(出处同上),美国专利5,225,539、5,585,089和5,693,761,欧洲专利0239400b1,以及英国专利2188638中。人源化抗体也可以使用描述于美国专利5,639,641和pedersen等人,j.mol.biol.,235,959-973(1994)中的抗体表面重建技术产生。
[0286]
如本文所用,抗体可以是多链或单链的,或完整的免疫球蛋白,并且可以来源于天然来源或重组来源。抗体可以是免疫球蛋白分子的四聚体。
[0287]
在一些实施方案中,该抗体是双特异性抗体。可以将现有抗体的vl区和/或vh区或者如本文所述从头鉴定的vl区和vh区工程化为双特异性全长抗体。可以使用诸如以下专利中所述的那些技术的技术,通过调节抗体fc中的ch3相互作用以形成双特异性抗体,从而制备此类双特异性抗体:美国专利号7,695,936;国际专利公布号wo04/111233;美国专利公布号2010/0015133;美国专利公布号2007/0287170;国际专利公布号wo2008/119353;美国专利公布号2009/0182127;美国专利公布号2010/0286374;美国专利公布号2011/0123532;国际专利公布号wo2011/131746;国际专利公布号wo2011/143545;或美国专利公布号2012/0149876。例如,本发明的双特异性抗体可以通过如下方式在无细胞环境中在体外生成:根据国际专利公布号wo2011/131746所述的方法,在两个单特异性同源二聚抗体的ch3区域中引入非对称突变,并且在允许二硫键异构化的还原条件下由两个亲本单特异性同源二聚抗体形成双特异性异源二聚抗体。在所述方法中,将第一单特异性二价抗体和第二单特异性二价抗体工程化为在ch3结构域处具有促进异源二聚体稳定性的某些取代;将这些抗体在足以使铰链区中的半胱氨酸发生二硫键异构化的还原条件下一起温育;从而通过fab臂交换产生双特异性抗体。温育条件最理想地可恢复到非还原条件。可以使用的示例的还原剂为2-巯基乙胺(2-mea)、二硫苏糖醇(dtt)、二硫赤藓糖醇(dte)、谷胱甘肽、三(2-羧乙基)膦(tcep)、l-半胱氨酸和β-巯基乙醇,优选地为选自由以下项组成的组的还原剂:2-巯基乙胺、二硫苏糖醇和三(2-羧乙基)膦。例如,可以使用如下条件:在至少25mm 2-mea的存在下或在至少0.5mm二硫苏糖醇的存在下,在5至8的ph(例如ph 7.0或ph 7.4)和至少20℃的温度下,温育至少90分钟。
[0288]
术语“抗体片段”是指保留亲本全长抗体的抗原结合性质的完整抗体或其重组变体的至少一部分。它是指例如抗原结合结构域,例如,完整抗体的抗原决定可变区,其足以赋予识别和结合,例如抗体片段与靶标(诸如抗原)的特异性结合。“抗原结合片段”是指免疫球蛋白分子的一部分。抗体片段的示例包括但不限于fab、fab’、f(ab’)2和fv片段,单链抗体(scfv)、线性抗体、单结构域抗体诸如sdab(vl或vh)、骆驼科vhh结构域,以及由抗体片段形成的多特异性抗体。
[0289]
术语“scfv”是指包含至少一个包含轻链可变区的抗体片段和至少一个包含重链可变区的抗体片段的蛋白质。在一些实施方案中,轻链可变区和重链可变区经由短的柔性多肽接头连续连接,并且能够表达为单链多肽,并且其中scfv保留了其来源完整抗体的特异性。除非另外指明,否则如本文所用,scfv可以具有任一顺序的vl可变区和vh可变区,例如,相对于多肽的n末端和c末端,该scfv可以包含vl-接头-vh或可以包含vh-接头-vl。
[0290]
本文鉴定的vh结构域和vl结构域可以并入到scfv格式中,并且可以使用已知方法评估所得scfv与cd79b的结合和热稳定性。可以使用本领域技术人员已知的proteon xpr36、biacore 3000或kinexa仪器、elisa或竞争结合测定法评估结合。可以使用纯化的scfv或含有表达的scfv的大肠杆菌上清液或溶解细胞来评价结合。如果在不同的条件(例如,同渗容摩、ph)下测量,则测量的测试scfv对cd79b的亲和力可变化。因此,亲和力和其他结合参数(例如kd、k
on
和k
off
)的测量通常用标准化条件和标准化缓冲液进行。可以通过在高温诸如50℃、55℃或60℃下加热测试scfv一段时间,诸如5分钟(min)、10min、15min、20min、25min或30min,并且测量测试scfv与cd79b的结合来评价热稳定性。当与未加热的scfv样品相比时,scfv保持与cd79b同等结合称为热稳定的。
[0291]
cd79b抗原结合结构域可以包含编码变体的序列,所述变体展示出与亲本抗体sn8相比改善的热稳定性。可赋予改善的热稳定性的工程化位置包括vh中的残基m12、i20、r40和a79(残基编号是根据seq id no:283的sn8_vh)以及vl中的残基l4、d32、f51、v82和a87(残基编号是根据seq id no:284的sn8_vl)。
[0292]
在重组表达系统中,接头是肽接头并且可以包含任何天然存在的氨基酸。可以被包含到接头中的示例性氨基酸为gly、ser、pro、thr、glu、lys、arg、ile、leu、his和the。该接头的长度应当足以使vh和vl以相对于彼此形成正确构象,从而使得它们保持期望的活性(诸如与cd79b结合)的方式连接。
[0293]
接头的长度可以为约5个至50个氨基酸。在一些实施方案中,接头的长度为约10个至40个氨基酸。在一些实施方案中,接头的长度为约10个至35个氨基酸。在一些实施方案中,接头的长度为约10个至30个氨基酸。在一些实施方案中,接头的长度为约10个至25个氨基酸。在一些实施方案中,接头的长度为约10个至20个氨基酸。在一些实施方案中,接头的长度为约15个至20个氨基酸。在一些实施方案中,接头的长度为6个氨基酸。在一些实施方案中,接头的长度为7个氨基酸。在一些实施方案中,接头的长度为8个氨基酸。在一些实施方案中,接头的长度为9个氨基酸。在一些实施方案中,接头的长度为10个氨基酸。在一些实施方案中,接头的长度为11个氨基酸。在一些实施方案中,接头的长度为12个氨基酸。在一些实施方案中,接头的长度为13个氨基酸。在一些实施方案中,接头的长度为14个氨基酸。在一些实施方案中,接头的长度为15个氨基酸。在一些实施方案中,接头的长度为16个氨基酸。在一些实施方案中,接头的长度为17个氨基酸。在一些实施方案中,接头的长度为18个氨基酸。在一些实施方案中,接头的长度为19个氨基酸。在一些实施方案中,接头的长度为20个氨基酸。在一些实施方案中,接头的长度为21个氨基酸。在一些实施方案中,接头的长度为22个氨基酸。在一些实施方案中,接头的长度为23个氨基酸。在一些实施方案中,接头的长度为24个氨基酸。在一些实施方案中,接头的长度为25个氨基酸。在一些实施方案中,接头的长度为26个氨基酸。在一些实施方案中,接头的长度为27个氨基酸。在一些实施方案中,接头的长度为28个氨基酸。在一些实施方案中,接头的长度为29个氨基酸。在一些实施
方案中,接头的长度为30个氨基酸。在一些实施方案中,接头的长度为31个氨基酸。在一些实施方案中,接头的长度为32个氨基酸。在一些实施方案中,接头的长度为33个氨基酸。在一些实施方案中,接头的长度为34个氨基酸。在一些实施方案中,接头的长度为35个氨基酸。在一些实施方案中,接头的长度为36个氨基酸。在一些实施方案中,接头的长度为37个氨基酸。在一些实施方案中,接头的长度为38个氨基酸。在一些实施方案中,接头的长度为39个氨基酸。在一些实施方案中,接头的长度为40个氨基酸。可以使用的示例性接头为富含gly的接头、含有gly和ser的接头、含有gly和ala的接头、含有ala和ser的接头,以及其他柔性接头。
[0294]
其他接头序列可以包括源自任何免疫球蛋白重链或轻链同种型的免疫球蛋白铰链区、cl或ch1的部分。可以使用的示例性接头在表1中示出。附加的接头在例如国际专利公布号wo2019/060695中有描述。
[0295]
在一些实施方案中,scfv从n末端到c末端包含vh、接头和vl(vh-接头-vl)。
[0296]
在一些实施方案中,scfv从n末端到c末端包含vl、接头和vh(vl-接头-vh)。
[0297]
在一些实施方案中,该接头包含seq id no:42的氨基酸序列。
[0298]
在一些实施方案中,该接头包含seq id no:43的氨基酸序列。
[0299]
在一些实施方案中,该接头包含seq id no:44的氨基酸序列。
[0300]
在一些实施方案中,该接头包含seq id no:45的氨基酸序列。
[0301]
在一些实施方案中,该接头包含seq id no:46的氨基酸序列。
[0302]
在一些实施方案中,该接头包含seq id no:47的氨基酸序列。
[0303]
在一些实施方案中,该接头包含seq id no:48的氨基酸序列。
[0304]
在一些实施方案中,该接头包含seq id no:49的氨基酸序列。
[0305]
在一些实施方案中,该接头包含seq id no:50的氨基酸序列。
[0306]
在一些实施方案中,该接头包含seq id no:51的氨基酸序列。
[0307]
在一些实施方案中,该接头包含seq id no:52的氨基酸序列。
[0308]
在一些实施方案中,该接头包含seq id no:53的氨基酸序列。
[0309]
在一些实施方案中,该接头包含seq id no:54的氨基酸序列。
[0310]
在一些实施方案中,该接头包含seq id no:55的氨基酸序列。
[0311]
在一些实施方案中,该接头包含seq id no:56的氨基酸序列。
[0312]
在一些实施方案中,该接头包含seq id no:57的氨基酸序列。
[0313]
在一些实施方案中,该接头包含seq id no:58的氨基酸序列。
[0314]
在一些实施方案中,该接头包含seq id no:59的氨基酸序列。
[0315]
在一些实施方案中,该接头包含seq id no:60的氨基酸序列。
[0316]
在一些实施方案中,该接头包含seq id no:61的氨基酸序列。
[0317]
在一些实施方案中,该接头包含seq id no:62的氨基酸序列。
[0318]
在一些实施方案中,该接头包含seq id no:63的氨基酸序列。
[0319]
在一些实施方案中,该接头包含seq id no:64的氨基酸序列。
[0320]
在一些实施方案中,该接头包含seq id no:65的氨基酸序列。
[0321]
在一些实施方案中,该接头包含seq id no:66的氨基酸序列。
[0322]
在一些实施方案中,该接头包含seq id no:67的氨基酸序列。
[0323]
在一些实施方案中,该接头包含seq id no:68的氨基酸序列。
[0324]
在一些实施方案中,该接头包含seq id no:69的氨基酸序列。
[0325]
在一些实施方案中,该接头包含seq id no:70的氨基酸序列。
[0326]
在一些实施方案中,该接头包含seq id no:71的氨基酸序列。
[0327]
在一些实施方案中,该接头包含seq id no:72的氨基酸序列。
[0328]
在一些实施方案中,该接头包含seq id no:73的氨基酸序列。
[0329]
在一些实施方案中,该接头包含seq id no:74的氨基酸序列。
[0330]
表1.
[0331][0332]
本发明的一个实施方案还提供了本文所述抗体中的任一者的抗原结合部分。该抗原结合部分可以是具有至少一个抗原结合位点的任何部分,诸如fab、f(ab’)2、dsfv、sfv、
双抗体和三抗体。
[0333]
在一些实施方案中,抗原结合片段为重链互补决定区(hcdr)1、2和/或3,轻链互补决定区(lcdr)1、2和/或3,重链可变区(vh)或轻链可变区(vl),fab、f(ab’)2、fd和fv片段,以及包含(例如,由下列中的任一者组成)一个vh结构域或一个vl结构域的结构域抗体(dab)。vh结构域和vl结构域可以经由接头(例如合成接头)连接在一起。
[0334]“互补决定区(cdr)”是抗体中的抗原结合位点。cdr可以使用各种术语来定义:(i)三个在vh中(hcdr1、hcdr2、hcdr3)且三个在vl中(lcdr1、lcdr2、lcdr3)的互补决定区(cdr)基于序列变异性(wu和kabat,j exp med 132:211-50,1970;kabat等人,sequences of proteins of immunological interest,第5版public health service,national institutes of health,bethesda,md.,1991)。(ii)三个在vh中(h1、h2、h3)且三个在vl中(l1、l2、l3)的“高变区”、“hvr”或“hv”是指抗体可变结构域的在结构上高变的区域,如chothia和lesk所定义(chothia和lesk,mol biol 196:901-17,1987)。国际免疫遗传学(imgt)数据库(http://imgt_org)提供了抗原结合位点的标准化编号和定义。cdr、hv和imgt描述之间的对应性在lefranc等,dev comparat immunol 27:55-77,2003中有所描述。除非另有明确地说明,本文所用的术语“cdr”、“hcdr1”、“hcdr2”、“hcdr3”、“lcdr1”、“lcdr2”和“lcdr3”包括由任何上述方法(kabat、chothia或imgt)定义的cdr。
[0335]
另外,抗体或其抗原结合部分可以经修饰以包含可检测标签,诸如放射性同位素、荧光团(例如异硫氰酸荧光素(fitc)、藻红蛋白(pe))、酶(例如碱性磷酸酶、辣根过氧化物酶)和元素颗粒(例如金颗粒)。
[0336]
示例性的可检测标签包括放射性同位素、磁珠、金属珠、胶体粒子、荧光染料、电子高密度试剂、酶(例如,如elisa中常用的)、生物素、地高辛、半抗原、发光分子、化学发光分子、荧光染料、荧光团、荧光淬灭剂、有色分子、放射性同位素、闪烁体、抗生物素蛋白、链霉抗生物素蛋白、蛋白质a、蛋白质g、抗体或其片段、多组氨酸、ni2+、flag标签、myc标签、重金属、酶、碱性磷酸酶、过氧化物酶、荧光素酶、电子供体/受体、吖啶酯和比色底物。
[0337]
可检测标签可自发地发出信号,例如当可检测标签为放射性同位素时。在其他情况下,可检测标签由于受到外场的刺激而发出信号。合适的染料包括任何可商购染料,诸如例如5(6)-羧基荧光素、irdye 680rd马来酰亚胺或irdye 800cw、钌多吡啶染料等。合适的荧光团是异硫氰酸荧光素(fitc)、氨基硫脲荧光素、罗丹明、德克萨斯红、cydyes(例如cy3、cy5、cy5.5)、alexa fluors(例如alexa488、alexa555、alexa594;alexa647)、近红外(nir)(700-900nm)荧光染料、以及碳菁和氨基苯乙烯基染料。
[0338]
本公开还提供了包含编码本文所述的car、多肽或蛋白质(包括其功能性部分和功能性变体)中的任一者的核苷酸序列的核酸。
[0339]
该car的包含抗体或其抗体片段的部分可以以多种形式存在,其中抗原结合结构域被表示为连续多肽链的一部分,包括例如单结构域抗体片段(sdab)、scfv和人嵌合抗体或人源化抗体(harlow等人,1999,载于:in:using antibodies:a laboratory manual,cold spring harbor laboratory press,n.y.;harlow等人,1989,载于:antibodies:a laboratory manual,cold spring harbor,n.y.;ashkenazi等人,1988,proc.natl.acad.sci.usa85:5879-5883;bird等人,1988,science 242:423-426)。在一个方面,本发明的car组合物的抗原结合结构域包含抗体片段。在一个方面,该car包含具有
scfv的抗体片段。
[0340]
术语“重组抗体”是指使用重组dna技术产生的抗体,诸如由噬菌体或酵母表达系统表达的抗体。该术语还应当被理解为意味着已通过合成编码该抗体并且表达抗体蛋白质的dna分子或者指定该抗体的氨基酸序列而产生的抗体,其中该dna或氨基酸序列已使用本领域可用且已知的重组dna或氨基酸序列技术获得。
[0341]
术语“抗原”是指引发免疫应答的分子。该免疫应答可以涉及抗体产生,或特异性免疫活性细胞的活化,或这两者。技术人员将理解,任何大分子(包括几乎所有蛋白质或肽)均可以用作抗原。此外,抗原可以来源于重组dna或基因组dna。技术人员将理解,包含编码引起免疫应答的蛋白质的核苷酸序列或部分核苷酸序列的任何dna因此编码如本文所用的术语“抗原”。此外,本领域的技术人员将理解,抗原不必仅由基因的全长核苷酸序列编码。显而易见的是,本公开包括但不限于使用不止一种基因的部分核苷酸序列,并且这些核苷酸序列以各种组合排列以编码引起期望的免疫应答的多肽。
[0342]
在一个方面,本公开提供了car,其包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中细胞外抗原结合结构域结合cd79b抗原。
[0343]
在一个方面,本公开提供了car,其包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中该细胞外抗原结合结构域包含:
[0344]
在一个实施方案中,该细胞外抗原结合结构域包含:
[0345]
a)seq id no:1的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:19的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0346]
b)seq id no:1的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:20的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0347]
c)seq id no:2的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:19的轻链可变区(vl)的轻链互补决定区(cdr)2、cdr2和cdr3;
[0348]
d)seq id no:2的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:20的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0349]
e)seq id no:3的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:20的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0350]
f)seq id no:4的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:19的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0351]
g)seq id no:5的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:22的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0352]
h)seq id no:5的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:23的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0353]
i)seq id no:6的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:24的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0354]
j)seq id no:7的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:26的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0355]
k)seq id no:8的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:25的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0356]
l)seq id no:9的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:27的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0357]
m)seq id no:10的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:28的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0358]
n)seq id no:11的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:29的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0359]
o)seq id no:12的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:30的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0360]
p)seq id no:13的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:31的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0361]
q)seq id no:14的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:32的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0362]
r)seq id no:15的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:33的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0363]
s)seq id no:16的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:34的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0364]
t)seq id no:16的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:35的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;
[0365]
u)seq id no:17的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:33的轻链可变区(vl)的轻链cdr1、cdr2和cdr3;或者
[0366]
v)seq id no:18的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:36的轻链可变区(vl)的轻链cdr1、cdr2和cdr3。
[0367]
在一个实施方案中,该细胞外抗原结合结构域包含:
[0368]
seq id no:14的重链可变区(vh)的重链cdr1、cdr2和cdr3及seq id no:32的轻链可变区(vl)的轻链cdr1、cdr2和cdr3。
[0369]
在一个方面,本公开提供了car,其包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中该细胞外抗原结合结构域包含:
[0370]
重链cdr1,其具有选自由seq id no:208、216、222、228、232、238、242、248、253、257、263、268和274以及它们的保守性修饰组成的组的氨基酸序列,其中该细胞外抗原结合结构域结合cd79b抗原。
[0371]
在一个方面,本公开提供了car,其包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中该细胞外抗原结合结构域包含:
[0372]
重链cdr2,其具有选自由seq id no:209、217、223、233、239、243、249、254、258、269和275以及它们的保守性修饰组成的组的氨基酸序列,其中该细胞外抗原结合结构域结合cd79b抗原。
[0373]
在一个方面,本公开提供了car,其包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中该细胞外抗原结合结构域包含:
[0374]
重链cdr3,其具有选自由seq id no:210、218、224、229、234、240、244、250、255、259、264、270和276以及它们的保守性修饰组成的组的氨基酸序列,其中该细胞外抗原结合
结构域结合cd79b抗原。
[0375]
在一个方面,本公开提供了car,其包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中该细胞外抗原结合结构域包含:
[0376]
具有seq id no:208的氨基酸序列的重链互补决定区1(cdr1)、具有seq id no:209的氨基酸序列的重链cdr2和具有seq id no:210的氨基酸序列的重链cdr3;
[0377]
具有seq id no:216的氨基酸序列的重链cdr1、具有seq id no:217的氨基酸序列的重链cdr2和具有seq id no:218的氨基酸序列的重链cdr3;
[0378]
具有seq id no:222的氨基酸序列的重链cdr1、具有seq id no:223的氨基酸序列的重链cdr2和具有seq id no:224的氨基酸序列的重链cdr3;
[0379]
具有seq id no:228的氨基酸序列的重链cdr1、具有seq id no:217的氨基酸序列的重链cdr2和具有seq id no:229的氨基酸序列的重链cdr3;
[0380]
具有seq id no:232的氨基酸序列的重链cdr1、具有seq id no:233的氨基酸序列的重链cdr2和具有seq id no:234的氨基酸序列的重链cdr3;
[0381]
具有seq id no:238的氨基酸序列的重链cdr1、具有seq id no:239的氨基酸序列的重链cdr2和具有seq id no:240的氨基酸序列的重链cdr3;
[0382]
具有seq id no:242的氨基酸序列的重链cdr1、具有seq id no:243的氨基酸序列的重链cdr2和具有seq id no:244的氨基酸序列的重链cdr3;
[0383]
具有seq id no:248的氨基酸序列的重链cdr1、具有seq id no:249的氨基酸序列的重链cdr2和具有seq id no:250的氨基酸序列的重链cdr3;
[0384]
具有seq id no:253的氨基酸序列的重链cdr1、具有seq id no:254的氨基酸序列的重链cdr2和具有seq id no:255的氨基酸序列的重链cdr3;
[0385]
具有seq id no:257的氨基酸序列的重链cdr1、具有seq id no:258的氨基酸序列的重链cdr2和具有seq id no:259的氨基酸序列的重链cdr3;
[0386]
具有seq id no:263的氨基酸序列的重链cdr1、具有seq id no:243的氨基酸序列的重链cdr2和具有seq id no:264的氨基酸序列的重链cdr3;
[0387]
具有seq id no:268的氨基酸序列的重链cdr1、具有seq id no:269的氨基酸序列的重链cdr2和具有seq id no:270的氨基酸序列的重链cdr3;或者
[0388]
具有seq id no:274的氨基酸序列的重链cdr1、具有seq id no:275的氨基酸序列的重链cdr2和具有seq id no:276的氨基酸序列的重链cdr3;
[0389]
其中所述细胞外抗原结合结构域结合所述cd79b抗原。
[0390]
在一个实施方案中,本公开的car包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中该细胞外抗原结合结构域包含:
[0391]
具有seq id no:257的氨基酸序列的重链cdr1、具有seq id no:258的氨基酸序列的重链cdr2和具有seq id no:259的氨基酸序列的重链cdr3。
[0392]
在一个方面,本公开提供了car,其包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中该细胞外抗原结合结构域包含:
[0393]
轻链cdr1,其具有选自由seq id no:211、214、215、219、225、230、235、241、245、251、260、265、271和277以及它们的保守性修饰组成的组的氨基酸序列,其中该细胞外抗原结合结构域结合cd79b抗原。
[0394]
在一个方面,本公开提供了car,其包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中该细胞外抗原结合结构域包含:
[0395]
轻链cdr2,其具有选自由seq id no:212、220、226、231、236、246、261、266和272以及它们的保守性修饰组成的组的氨基酸序列,其中该细胞外抗原结合结构域结合cd79b抗原。
[0396]
在一个方面,本公开提供了car,其包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中该细胞外抗原结合结构域包含:
[0397]
轻链cdr3,其具有选自由seq id no:213、221、227、237、247、252、256、262、267、273或278以及它们的保守性修饰组成的组的氨基酸序列,其中该细胞外抗原结合结构域结合cd79b抗原。
[0398]
在一个方面,本公开提供了car,其包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中该细胞外抗原结合结构域包含:
[0399]
具有seq id no:211的氨基酸序列的轻链cdr1、具有seq id no:212的氨基酸序列的轻链cdr2和具有seq id no:213的氨基酸序列的轻链cdr3;
[0400]
具有seq id no:214的氨基酸序列的轻链cdr1、具有seq id no:212的氨基酸序列的轻链cdr2和具有seq id no:213的氨基酸序列的轻链cdr3;
[0401]
具有seq id no:215的氨基酸序列的轻链cdr1、具有seq id no:212的氨基酸序列的轻链cdr2和具有seq id no:213的氨基酸序列的轻链cdr3;
[0402]
具有seq id no:219的氨基酸序列的轻链cdr1、具有seq id no:220的氨基酸序列的轻链cdr2和具有seq id no:221的氨基酸序列的轻链cdr3;
[0403]
具有seq id no:225的氨基酸序列的轻链cdr1、具有seq id no:226的氨基酸序列的轻链cdr2和具有seq id no:227的氨基酸序列的轻链cdr3;
[0404]
具有seq id no:230的氨基酸序列的轻链cdr1、具有seq id no:231的氨基酸序列的轻链cdr2和具有seq id no:221的氨基酸序列的轻链cdr3;
[0405]
具有seq id no:235的氨基酸序列的轻链cdr1、具有seq id no:236的氨基酸序列的轻链cdr2和具有seq id no:237的氨基酸序列的轻链cdr3;
[0406]
具有seq id no:241的氨基酸序列的轻链cdr1、具有seq id no:226的氨基酸序列的轻链cdr2和具有seq id no:227的氨基酸序列的轻链cdr3;
[0407]
具有seq id no:245的氨基酸序列的轻链cdr1、具有seq id no:246的氨基酸序列的轻链cdr2和具有seq id no:247的氨基酸序列的轻链cdr3;
[0408]
具有seq id no:251的氨基酸序列的轻链cdr1、具有seq id no:236的氨基酸序列的轻链cdr2和具有seq id no:252的氨基酸序列的轻链cdr3;
[0409]
具有seq id no:251的氨基酸序列的轻链cdr1、具有seq id no:236的氨基酸序列的轻链cdr2和具有seq id no:256的氨基酸序列的轻链cdr3;
[0410]
具有seq id no:260的氨基酸序列的轻链cdr1、具有seq id no:261的氨基酸序列的轻链cdr2和具有seq id no:262的氨基酸序列的轻链cdr3;
[0411]
具有seq id no:265的氨基酸序列的轻链cdr1、具有seq id no:266的氨基酸序列的轻链cdr2和具有seq id no:267的氨基酸序列的轻链cdr3;
[0412]
具有seq id no:271的氨基酸序列的轻链cdr1、具有seq id no:272的氨基酸序列
的轻链cdr2和具有seq id no:273的氨基酸序列的轻链cdr3;或者
[0413]
具有seq id no:277的氨基酸序列的轻链cdr1、具有seq id no:266的氨基酸序列的轻链cdr2和具有seq id no:278的氨基酸序列的轻链cdr3;
[0414]
其中所述细胞外抗原结合结构域结合所述cd79b抗原。
[0415]
在一个实施方案中,本公开的car包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中该细胞外抗原结合结构域包含:
[0416]
具有seq id no:260的氨基酸序列的轻链cdr1、具有seq id no:261的氨基酸序列的轻链cdr2和具有seq id no:262的氨基酸序列的轻链cdr3。
[0417]
在一个实施方案中,所述细胞外抗原结合结构域包含具有以下的氨基酸序列的所述重链cdr1、所述重链cdr2、所述重链cdr3、所述轻链cdr1、所述轻链cdr2和所述轻链cdr3:
[0418]
a)分别为seq id no:208、209、210、211、212和213;
[0419]
b)分别为seq id no:208、209、210、214、212和213;
[0420]
c)分别为seq id no:208、209、210、215、212和213;
[0421]
d)分别为seq id no:216、217、218、219、220和221;
[0422]
e)分别为seq id no:222、223、224、225、226和227;
[0423]
f)分别为seq id no:228、217、229、230、231和221;
[0424]
g)分别为seq id no:232、233、234、235、236和237;
[0425]
h)分别为seq id no:238、239、240、241、226和227;
[0426]
i)分别为seq id no:242、243、244、245、246和247;
[0427]
j)分别为seq id no:248、249、250、251、236和252;
[0428]
k)分别为seq id no:253、254、255、251、236和256;
[0429]
l)分别为seq id no:257、258、259、260、261和262;
[0430]
m)分别为seq id no:263、243、264、265、266和267;
[0431]
n)分别为seq id no:268、269、270、271、272和273;或者
[0432]
o)分别为seq id no:274、275、276、277、266和278。
[0433]
在一个实施方案中,所述细胞外抗原结合结构域包含具有以下的氨基酸序列的所述重链cdr1、所述重链cdr2、所述重链cdr3、所述轻链cdr1、所述轻链cdr2和所述轻链cdr3:分别为seq id no:257、258、259、260、261和262。
[0434]
在一个实施方案中,该细胞外抗原结合结构域包含
[0435]
包含选自seq id no:1-18的氨基酸序列的重链可变结构域(hcvh);包含选自seq id no:19-36的氨基酸序列的轻链可变结构域(lcvl),或包含选自由seq id no:1-18组成的组的氨基酸序列的hcvh和包含选自由seq id no:19-36组成的组的氨基酸序列的lcvl的组合。
[0436]
在一个实施方案中,该细胞外抗原结合结构域包含:
[0437]
包含seq id no:1的氨基酸序列的重链可变区和包含seq id no:19的氨基酸序列的轻链可变区;
[0438]
包含seq id no:1的氨基酸序列的重链可变区和包含seq id no:20的氨基酸序列的轻链可变区;
[0439]
包含seq id no:2的氨基酸序列的重链可变区和包含seq id no:19的氨基酸序列
的轻链可变区;
[0440]
包含seq id no:2的氨基酸序列的重链可变区和包含seq id no:20的氨基酸序列的轻链可变区;
[0441]
包含seq id no:3的氨基酸序列的重链可变区和包含seq id no:20的氨基酸序列的轻链可变区;
[0442]
包含seq id no:4的氨基酸序列的重链可变区和包含seq id no:19的氨基酸序列的轻链可变区;
[0443]
包含seq id no:5的氨基酸序列的重链可变区和包含seq id no:22的氨基酸序列的轻链可变区;
[0444]
包含seq id no:5的氨基酸序列的重链可变区和包含seq id no:23的氨基酸序列的轻链可变区;
[0445]
包含seq id no:6的氨基酸序列的重链可变区和包含seq id no:24的氨基酸序列的轻链可变区;
[0446]
包含seq id no:7的氨基酸序列的重链可变区和包含seq id no:26的氨基酸序列的轻链可变区;
[0447]
包含seq id no:8的氨基酸序列的重链可变区和包含seq id no:25的氨基酸序列的轻链可变区;
[0448]
包含seq id no:9的氨基酸序列的重链可变区和包含seq id no:27的氨基酸序列的轻链可变区;
[0449]
包含seq id no:10的氨基酸序列的重链可变区和包含seq id no:28的氨基酸序列的轻链可变区;
[0450]
包含seq id no:11的氨基酸序列的重链可变区和包含seq id no:29的氨基酸序列的轻链可变区;
[0451]
包含seq id no:12的氨基酸序列的重链可变区和包含seq id no:30的氨基酸序列的轻链可变区;
[0452]
包含seq id no:13的氨基酸序列的重链可变区和包含seq id no:31的氨基酸序列的轻链可变区;
[0453]
包含seq id no:14的氨基酸序列的重链可变区和包含seq id no:32的氨基酸序列的轻链可变区;
[0454]
包含seq id no:15的氨基酸序列的重链可变区和包含seq id no:33的氨基酸序列的轻链可变区;
[0455]
包含seq id no:16的氨基酸序列的重链可变区和包含seq id no:34的氨基酸序列的轻链可变区;
[0456]
包含seq id no:16的氨基酸序列的重链可变区和包含seq id no:35的氨基酸序列的轻链可变区;
[0457]
包含seq id no:17的氨基酸序列的重链可变区和包含seq id no:33的氨基酸序列的轻链可变区;或者
[0458]
包含seq id no:18的氨基酸序列的重链可变区和包含seq id no:36的氨基酸序列的轻链可变区。
[0459]
在一个实施方案中,该细胞外抗原结合结构域包含:
[0460]
包含seq id no:14的氨基酸序列的重链可变区和包含seq id no:32的氨基酸序列的轻链可变区。
[0461]
在一个实施方案中,该细胞外抗原结合结构域包含:
[0462]
重链可变区,该重链可变区包含与seq id no:1具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:19具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;
[0463]
重链可变区,该重链可变区包含与seq id no:1具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:20具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;
[0464]
重链可变区,该重链可变区包含与seq id no:2具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:19具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;
[0465]
重链可变区,该重链可变区包含与seq id no:2具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:20具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;
[0466]
重链可变区,该重链可变区包含与seq id no:3具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:20具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;
[0467]
重链可变区,该重链可变区包含与seq id no:4具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:19具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同
一性的氨基酸序列;
[0468]
重链可变区,该重链可变区包含与seq id no:5具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:22具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;
[0469]
重链可变区,该重链可变区包含与seq id no:5具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:23具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;
[0470]
重链可变区,该重链可变区包含与seq id no:6具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:24具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;
[0471]
重链可变区,该重链可变区包含与seq id no:7具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:26具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;
[0472]
重链可变区,该重链可变区包含与seq id no:8具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:25具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;
[0473]
重链可变区,该重链可变区包含与seq id no:9具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:27具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;
[0474]
重链可变区,该重链可变区包含与seq id no:10具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、
至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:28具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;
[0475]
重链可变区,该重链可变区包含与seq id no:11具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:29具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;
[0476]
重链可变区,该重链可变区包含与seq id no:12具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:30具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;
[0477]
重链可变区,该重链可变区包含与seq id no:13具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:31具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;
[0478]
重链可变区,该重链可变区包含与seq id no:14具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:32具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;
[0479]
重链可变区,该重链可变区包含与seq id no:15具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:33具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;
[0480]
重链可变区,该重链可变区包含与seq id no:16具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:34具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同
一性的氨基酸序列;
[0481]
重链可变区,该重链可变区包含与seq id no:16具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:35具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;
[0482]
重链可变区,该重链可变区包含与seq id no:17具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:33具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;或者
[0483]
重链可变区,该重链可变区包含与seq id no:18具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:36具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列。
[0484]
在一个实施方案中,该细胞外抗原结合结构域包含:
[0485]
重链可变区,该重链可变区包含与seq id no:14具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列;和轻链可变区,该轻链可变区包含与seq id no:32具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列。
[0486]
在一个实施方案中,该细胞外抗原结合结构域包含scfv。在一些实施方案中,该scfv包含位于轻链可变区与重链可变区之间的接头多肽。在某些实施方案中,该细胞外抗原结合结构域是包含选自由seq id no:75-118组成的组的氨基酸序列,并且与cd79b多肽(例如,具有本文所述的氨基酸序列的人cd79b多肽或其片段)的scfv。在一些实施方案中,该接头多肽包含选自由seq id no:42-74组成的组的氨基酸序列。
[0487]
在一个实施方案中,该接头多肽包含seq id no:42的氨基酸序列。在一个实施方案中,该接头多肽包含与seq id no:42具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。
[0488]
在一个实施方案中,该scfv包含选自由seq id no:75-118组成的组的氨基酸序列。在一个实施方案中,该scfv包含seq id no:75的氨基酸序列。在一个实施方案中,该scfv包含seq id no:76的氨基酸序列。在一个实施方案中,该scfv包含seq id no:77的氨基酸序列。在一个实施方案中,该scfv包含seq id no:78的氨基酸序列。在一个实施方案
中,该scfv包含seq id no:79的氨基酸序列。在一个实施方案中,该scfv包含seq id no:80的氨基酸序列。在一个实施方案中,该scfv包含seq id no:81的氨基酸序列。在一个实施方案中,该scfv包含seq id no:82的氨基酸序列。在一个实施方案中,该scfv包含seq id no:83的氨基酸序列。在一个实施方案中,该scfv包含seq id no:84的氨基酸序列。在一个实施方案中,该scfv包含seq id no:85的氨基酸序列。在一个实施方案中,该scfv包含seq id no:86的氨基酸序列。在一个实施方案中,该scfv包含seq id no:87的氨基酸序列。在一个实施方案中,该scfv包含seq id no:88的氨基酸序列。在一个实施方案中,该scfv包含seq id no:89的氨基酸序列。在一个实施方案中,该scfv包含seq id no:90的氨基酸序列。在一个实施方案中,该scfv包含seq id no:91的氨基酸序列。在一个实施方案中,该scfv包含seq id no:92的氨基酸序列。在一个实施方案中,该scfv包含seq id no:93的氨基酸序列。在一个实施方案中,该scfv包含seq id no:94的氨基酸序列。在一个实施方案中,该scfv包含seq id no:95的氨基酸序列。在一个实施方案中,该scfv包含seq id no:96的氨基酸序列。在一个实施方案中,该scfv包含seq id no:97的氨基酸序列。在一个实施方案中,该scfv包含seq id no:98的氨基酸序列。在一个实施方案中,该scfv包含seq id no:99的氨基酸序列。在一个实施方案中,该scfv包含seq id no:100的氨基酸序列。在一个实施方案中,该scfv包含seq id no:101的氨基酸序列。在一个实施方案中,该scfv包含seq id no:102的氨基酸序列。在一个实施方案中,该scfv包含seq id no:103的氨基酸序列。在一个实施方案中,该scfv包含seq id no:104的氨基酸序列。在一个实施方案中,该scfv包含seq id no:105的氨基酸序列。在一个实施方案中,该scfv包含seq id no:106的氨基酸序列。在一个实施方案中,该scfv包含seq id no:107的氨基酸序列。在一个实施方案中,该scfv包含seq id no:108的氨基酸序列。在一个实施方案中,该scfv包含seq id no:109的氨基酸序列。在一个实施方案中,该scfv包含seq id no:110的氨基酸序列。在一个实施方案中,该scfv包含seq id no:111的氨基酸序列。在一个实施方案中,该scfv包含seq id no:112的氨基酸序列。在一个实施方案中,该scfv包含seq id no:113的氨基酸序列。在一个实施方案中,该scfv包含seq id no:114的氨基酸序列。在一个实施方案中,该scfv包含seq id no:115的氨基酸序列。在一个实施方案中,该scfv包含seq id no:116的氨基酸序列。在一个实施方案中,该scfv包含seq id no:117的氨基酸序列。在一个实施方案中,该scfv包含seq id no:118的氨基酸序列。
[0489]
在一个实施方案中,该scfv包含与选自由seq id no:75-118组成的组的序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:75具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:76具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:77具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包
含与seq id no:78具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:79具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:80具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:81具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:82具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:83具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:84具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:85具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:86具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:87具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:88具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:89具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:90具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:91具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:92具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:93具有至少50%、至少
55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:94具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:95具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:96具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:97具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:98具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:99具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:100具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:101具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:102具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:103具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:104具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:105具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:106具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:107具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:108具有至少50%、至少55%、至少60%、至少
65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:109具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:110具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:111具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:112具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:113具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:114具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:115具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:116具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:117具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该scfv包含与seq id no:118具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。
[0490]
在一个实施方案中,细胞外抗原结合结构域是包含seq id no:113的氨基酸序列,或与seq id no:113具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列的scfv。
[0491]
在一个实施方案中,该细胞外抗原结合结构域包含信号多肽。在一些实施方案中,该信号多肽包含seq id no:37的氨基酸序列。在一个实施方案中,该信号多肽包含与seq id no:37具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。
[0492]
在一个方面,本公开提供了car,其包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中细胞外抗原结合结构域包含选自由seq id no:119-162组成的
组的氨基酸序列。具有包含选自由seq id no:119-162的氨基酸序列的细胞外抗原结合结构域的car的另一个特征是该细胞外抗原结合结构域结合cd79b抗原。
[0493]
在一个实施方案中,该细胞内信号传导结构域包含多肽组分,其选自由以下项组成的组:tnf受体超家族成员9(cd137)组分、t细胞表面糖蛋白cd3ζ链(cd3z)组分、分化簇(cd27)组分、分化簇超家族成员(诸如,cd28或诱导型t细胞共刺激剂(icos))组分,以及它们的组合。
[0494]
在一个实施方案中,该cd137组分包含seq id no:40的氨基酸序列。在一个实施方案中,该cd137组分包含与seq id no:40具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。
[0495]
在一个实施方案中,该cd3z组分包含seq id no:41的氨基酸序列。在一个实施方案中,该cd3z组分包含与seq id no:41具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。
[0496]
在一个实施方案中,该细胞内信号传导结构域包含seq id no:163的氨基酸序列。在一个实施方案中,该细胞内信号传导结构域包含与seq id no:163具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。
[0497]
在一个实施方案中,跨膜结构域包含cd8a跨膜区(cd8a-tm)多肽。在一些实施方案中,该cd8a-tm多肽包含seq id no:39的氨基酸序列。在一些实施方案中,该cd8a-tm多肽包含与seq id no:39具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。
[0498]
在一个实施方案中,该跨膜结构域至少包含以下项的跨膜区:t-细胞受体的α链、β链或ζ链,cd28、cd3ε、cd45、cd4、cd5、cd8、cd8α、cd9、cd16、cd22、cd33、cd37、cd40、cd64、cd80、cd86、cd134、cd137、cd154。在另一个实施方案中,该跨膜结构域至少包含具有以下项的跨膜结构域:ζ、η或fcεr1γ和-β、mb1(igα.)、b29或cd3-γ、ζ或η。在另一个实施方案中,该跨膜结构域是合成的,例如,主要包含疏水性残基,诸如亮氨酸和缬氨酸、苯丙氨酸三联体或色氨酸。
[0499]
在一个实施方案中,该car还包含将跨膜结构域连接至细胞外抗原结合结构域的铰链区。在一些实施方案中,铰链区为cd8a铰链区。在一些实施方案中,cd8a铰链区包含seq id no:38的氨基酸序列。在一些实施方案中,cd8a铰链区包含与seq id no:38具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一些实施方案中,铰链区包含序列epkscdkthtcppcp(seq id no:285),或者包含与epkscdkthtcppcp(seq id no:285)具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一些实施方案中,铰链区包含序列erkccvecppcp(seq id no:286),或者包含与erkccvecppcp(seq id no:286)具有至少
50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一些实施方案中,铰链区包含序列elktplgdtthtcprcp(epkscdtpppcprcp)3(seq id no:287),或者包含与elktplgdtthtcprcp(epkscdtpppcprcp)3(seq id no:287)具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一些实施方案中,铰链区包含序列eskygppcpscp(seq id no:288),或者包含与eskygppcpscp(seq id no:288)具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。
[0500]
在一个实施方案中,该细胞外抗原结合结构域包含选自由seq id no:119-162组成的组的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:119的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:120的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:121的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:122的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:123的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:124的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:125的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:126的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:127的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:128的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:129的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:130的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:131的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:132的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:133的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:134的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:135的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:136的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:137的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:138的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:139的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:140的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:141的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:142的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:143的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:144的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:145的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:146的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:147的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:148的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:149的
氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:150的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:151的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:152的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:153的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:154的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:155的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:156的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:157的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:158的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:159的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:160的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:161的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含seq id no:162的氨基酸序列。
[0501]
在一个实施方案中,该细胞外抗原结合结构域包含与选自由seq id no:119-162组成的组的序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:119具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:120具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:121具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:122具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:123具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:124具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:125具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:126具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:127具有至少50%、至少55%、至少60%、至少65%、至少
70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:128具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:129具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:130具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:131具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:132具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:133具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:134具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:135具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:136具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:137具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:138具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:139具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:140具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:141具有至少50%、至少55%、至少
60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:142具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:143具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:144具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:145具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:146具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:147具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:148具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:149具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:150具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:151具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:152具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:153具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:154具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:155具有至少50%、至
少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:156具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:157具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:158具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:159具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:160具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:161具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。在一个实施方案中,该细胞外抗原结合结构域包含与seq id no:162具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。
[0502]
在一个实施方案中,该细胞外抗原结合结构域包含seq id no:157的氨基酸序列,或与seq id no:157具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。
[0503]
car构建体和表达car的免疫应答细胞
[0504]
在一个实施方案中,本公开提供了表达编码car的核酸分子的细胞。在一个实施方案中,本公开的car包含选自由seq id nos:164-207组成的组的氨基酸序列。在一些实施方案中,本公开的car包含与seq id no:164具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:164的序列。在一些实施方案中,本公开的car包含与seq id no:165具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:165的序列。在一些实施方案中,本公开的car包含与seq id no:166具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:166的序列。在一些实施方案中,本公开的car包含与seq id no:167具有至少50%、至少55%、至少60%、至少65%、至少
70%、至少75%、至少80%、至少85%、至少90%、少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:167的序列。在一些实施方案中,本公开的car包含与seq id no:168具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:168的序列。在一些实施方案中,本公开的car包含与seq id no:169具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:169的序列。在一些实施方案中,本公开的car包含与seq id no:170具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:170的序列。在一些实施方案中,本公开的car包含与seq id no:171具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:171的序列。在一些实施方案中,本公开的car包含与seq id no:172具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:172的序列。在一些实施方案中,本公开的car包含与seq id no:173具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:173的序列。在一些实施方案中,本公开的car包含与seq id no:174具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:174的序列。在一些实施方案中,本公开的car包含与seq id no:175具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:175的序列。在一些实施方案中,本公开的car包含与seq id no:176具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:176的序列。在一些实施方案中,本公开的car包含与seq id no:177具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:177的序列。在一些实施方案中,本公开的car包含与seq id no:178具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:178的序列。在一些实施方案中,本公开的car包含与seq id no:179具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:179的序列。在一些实施方案中,本公开的car包含与seq id no:180具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少
80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:180的序列。在一些实施方案中,本公开的car包含与seq id no:181具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:181的序列。在一些实施方案中,本公开的car包含与seq id no:182具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:182的序列。在一些实施方案中,本公开的car包含与seq id no:183具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:183的序列。在一些实施方案中,本公开的car包含与seq id no:184具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:184的序列。在一些实施方案中,本公开的car包含与seq id no:185具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:185的序列。在一些实施方案中,本公开的car包含与seq id no:186具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:186的序列。在一些实施方案中,本公开的car包含与seq id no:187具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:187的序列。在一些实施方案中,本公开的car包含与seq id no:188具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:188的序列。在一些实施方案中,本公开的car包含与seq id no:189具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:189的序列。在一些实施方案中,本公开的car包含与seq id no:190具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:190的序列。在一些实施方案中,本公开的car包含与seq id no:191具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:191的序列。在一些实施方案中,本公开的car包含与seq id no:192具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:192的序列。在一些实施方案中,本公开的car包含与seq id no:193具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少
80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:193的序列。在一些实施方案中,本公开的car包含与seq id no:194具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:194的序列。在一些实施方案中,本公开的car包含与seq id no:195具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:195的序列。在一些实施方案中,本公开的car包含与seq id no:196具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:196的序列。在一些实施方案中,本公开的car包含与seq id no:197具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:197的序列。在一些实施方案中,本公开的car包含与seq id no:198具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:198的序列。在一些实施方案中,本公开的car包含与seq id no:199具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:199的序列。在一些实施方案中,本公开的car包含与seq id no:200具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:200的序列。在一些实施方案中,本公开的car包含与seq id no:201具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:201的序列。在一些实施方案中,本公开的car包含与seq id no:202具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:202的序列。在一些实施方案中,本公开的car包含与seq id no:203具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:203的序列。在一些实施方案中,本公开的car包含与seq id no:204具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:204的序列。在一些实施方案中,本公开的car包含与seq id no:205具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:205的序列。在一些实施方案中,本公开的car包含与seq id no:206具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少
80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:206的序列。在一些实施方案中,本公开的car包含与seq id no:207具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:207的序列。
[0505]
在一些实施方案中,本公开的car包含seq id no:202的氨基酸序列。
[0506]
在一个方面,本公开提供了包含本文所述car的分离的免疫应答细胞。在一些实施方案中,该分离的免疫应答细胞用car转导,例如,car在该免疫应答细胞的表面上组成型表达。在某些实施方案中,该分离的免疫应答细胞用至少一种共刺激配体进一步转导,使得该免疫应答细胞表达所述至少一种共刺激配体。在某些实施方案中,所述至少一种共刺激配体选自由以下项组成的组:4-1bbl、cd48、cd70、cd80、cd86、ox40l、tnfrsf14,以及它们的组合。在某些实施方案中,该分离的免疫应答细胞用至少一种细胞因子进一步转导,使得该免疫应答细胞分泌所述至少一种细胞因子。在某些实施方案中,所述至少一种细胞因子选自由以下项组成的组:il-2、il-3、il-6、il-7、il-11、il-12、il-15、il-17、il-21,以及它们的组合。在一些实施方案中,该分离的免疫应答细胞选自由以下项组成的组:t淋巴细胞(t细胞)、天然杀伤(nk)细胞、细胞毒性t淋巴细胞(ctl)、调节性t细胞、人胚胎干细胞、淋巴祖细胞、t细胞前体细胞,以及可以从其分化淋巴样细胞的多能干细胞。
[0507]
在一个实施方案中,本公开的car t细胞可以通过将包含期望的car(例如,包含抗cd79b结构域、cd8α铰链和跨膜结构域,以及人4-1bb和cd3ζ信号传导结构域的car)的慢病毒载体引入细胞中来生成。本发明的car t细胞能够在体内复制,从而导致可以引起持续肿瘤控制的长期持久性。
[0508]
本发明的实施方案还提供了包含本文所述的任何重组表达载体的宿主细胞。如本文所用,术语“宿主细胞”是指可以含有重组表达载体的任何类型的细胞。宿主细胞可以是真核细胞(例如,植物、动物或藻类、真菌),或者可以是原核细胞(例如,细菌或原生动物)。宿主细胞可以是培养的细胞或原代细胞(即,直接从生物体(例如,人)分离的)。宿主细胞可以是贴壁细胞或悬浮细胞,即在悬浮液中生长的细胞。合适的宿主细胞是本领域已知的,并且包括例如dh5α大肠杆菌(e.coli)细胞、中国仓鼠卵巢细胞、猴vero细胞、cos细胞、hek293细胞,等等。为了扩增或复制重组表达载体,宿主细胞可以是原核细胞,例如dh5α细胞。为了产生重组car、多肽或蛋白质,宿主细胞可以是哺乳动物细胞。宿主细胞可以是人细胞。虽然宿主细胞可以是任何细胞类型,可以源自任何类型的组织,并且可以处于任何发育阶段,但是宿主细胞可以是外周血淋巴细胞(pbl)。宿主细胞可以是t细胞。
[0509]
出于本文的目的,t细胞可以是任何t细胞,诸如培养的t细胞(例如原代t细胞),或者来自培养的t细胞系的t细胞(例如jurkat、supt1等),或者从哺乳动物获得的t细胞。如果是从哺乳动物获得的,则t细胞可以从多种来源获得,包括但不限于骨髓、血液、淋巴结、胸腺或者其他组织或流体。t细胞也可以富集或纯化。t细胞可以是人t细胞。t细胞可以是从人分离的t细胞。t细胞可以是任何类型的t细胞并且可以处于任何发育阶段,包括但不限于cd4
+
/cd8
+
双阳性t细胞、cd8
+
t细胞(例如,细胞毒性t细胞)、cd4
+
辅助t细胞(例如,th1细胞和th2细胞)、外周血单核细胞(pbmc)、外周血白细胞(pbl)、肿瘤浸润细胞、记忆t细胞、初始t细胞,等等。t细胞可以是cd8
+
t细胞或cd4
+
t细胞。
[0510]
还提供了包含至少一种本文所述宿主细胞的细胞群体。细胞群体可以是异质群体,其包含具有所述重组表达载体中的任一者的宿主细胞,此外还包含至少一种其他细胞,例如不具有所述重组表达载体中的任一者的宿主细胞(例如t细胞),或者除t细胞之外的细胞,例如b细胞、巨噬细胞、红细胞、嗜中性粒细胞、肝细胞、内皮细胞、上皮细胞、肌细胞、脑细胞等。替代性地,细胞群体可以是基本上同质的群体,其中该群体主要包含具有重组表达载体的宿主细胞(例如,基本上由其组成)。该群体还可以是细胞的克隆群体,其中该群体的所有细胞是包含重组表达载体的单个宿主细胞的克隆,使得该群体的所有细胞包含重组表达载体。在一个实施方案中,细胞群体是包含具有如本文所述的重组表达载体的宿主细胞的克隆群体。
[0511]
药物组合物/施用
[0512]
在本公开的实施方案中,表达car的细胞可以在组合物中提供,例如,包含表达car的细胞和药学上可接受的载剂的合适的药物组合物。在一个方面,本公开提供了药物组合物,其包含有效量的表达所述car中的一者或多者的淋巴细胞和药学上可接受的赋形剂。本公开的药物组合物可以包含表达car的细胞(例如,如本文所述的多个表达car的细胞)与一种或多种药学上或生理学上可接受的载剂、赋形剂或稀释剂的组合。药学上可接受的载剂可以是药物组合物中除活性成分之外的成分,其对受试者无毒。
[0513]
药学上可接受的载剂可以包括但不限于缓冲剂、赋形剂、稳定剂或防腐剂。药学上可接受的载剂的示例是生理上相容的溶剂、分散介质、包衣剂、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等,诸如盐、缓冲剂、抗氧化剂、糖类、水性或非水性载剂、防腐剂、润湿剂、表面活性剂或乳化剂,或者它们的组合。药物组合物中的药学上可接受的载剂的量可基于载剂活性和所需制剂特征(例如稳定性和/或最低氧化)来通过实验确定。
[0514]
此类组合物可以包含缓冲剂,诸如乙酸、柠檬酸、甲酸、琥珀酸、磷酸、碳酸、苹果酸、天冬氨酸、组氨酸、硼酸、tris缓冲剂、heppso、hepes、中性缓冲盐水、磷酸盐缓冲盐水等;碳水化合物,诸如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露糖醇;蛋白质;多肽或氨基酸,诸如甘氨酸;抗氧化剂;螯合剂,诸如edta或谷胱甘肽;辅助剂(例如氢氧化铝);抗细菌剂和抗真菌剂;以及防腐剂。
[0515]
本公开的组合物可以被配制用于肠胃外施用或非肠胃外施用的多种方式。在一个实施方案中,所述组合物可以被配制用于输注或静脉内施用。本文所公开的组合物可以例如作为无菌液体制剂(例如等渗水溶液剂、乳剂、混悬剂、分散体或粘稠组合物)提供,其可以被缓冲至期望的ph。适用于口服施用的制剂可以包括液体溶液剂、胶囊剂、小药囊、片剂、锭剂和糖锭、散剂,以及在适当的液体和乳剂中的液体混悬剂。
[0516]
如本文关于药物组合物所用的术语“药学上可接受的”,意味着由联邦或州政府的监管机构批准的或者在美国药典或其他公认的药典中列出的用于在动物和/或人类中使用的物质。
[0517]
在一个方面,本公开涉及使用淋巴细胞输注来施用表达car的经基因修饰的t细胞,以治疗患有癌症或有患上癌症的风险的受试者。在至少一个实施方案中,在治疗中使用了自体淋巴细胞输注。从需要治疗的受试者收集自体pbmc,并且使用本文所述和本领域已知的方法将t细胞活化和扩增,然后输注回受试者中。
[0518]
在一个方面,本公开整体涉及对有患上癌症的风险的受试者的治疗。本发明还包
括治疗以下恶性肿瘤或自身免疫疾病:其中受试者的化学疗法和/或免疫疗法导致显著的免疫抑制,从而增加了受试者患上癌症的风险。在一个方面,本公开提供了预防癌症的方法,所述方法包括将一定量的表达所述car中的一者或多者的淋巴细胞施用于有需要的受试者。
[0519]
在一个方面,本公开提供了治疗患有癌症的受试者的方法,所述方法包括将治疗有效量的表达所述car中的一者或多者的淋巴细胞施用于有需要的受试者,由此所述淋巴细胞诱导或调节杀伤受试者中的癌细胞。
[0520]
在另一方面,本公开提供了减少患有癌症的受试者中的肿瘤负荷的方法,所述方法包括将治疗有效量的表达本文所述car中的一者或多者的淋巴细胞施用于有需要的受试者,由此所述淋巴细胞诱导对受试者中的癌细胞的杀伤。在另一方面,本公开提供了延长患有癌症的受试者的存活期的方法,所述方法包括将治疗有效量的表达所述car中的一者或多者的淋巴细胞施用于有需要的受试者,由此延长受试者的存活期。一般来讲,表达所述car的淋巴细胞诱导对受试者中的癌细胞的杀伤,并且导致受试者中的肿瘤细胞/癌细胞减少或根除。癌症(包括可以靶向的转移性病灶)的非限制性列表包括b细胞淋巴瘤和b细胞来源的癌症。在一个实施方案中,在受试者中所治疗的癌症是b细胞淋巴瘤。在一些实施方案中,该癌症为非霍奇金淋巴瘤。在一些实施方案中,该癌症是造血来源的癌症,诸如弥漫性大b细胞淋巴瘤(dlbcl)、套细胞淋巴瘤(mcl)、滤泡性淋巴瘤(fl)、边缘区淋巴瘤(mz)、急性成淋巴细胞性白血病(all)、慢性淋巴细胞白血病(cll)、多发性骨髓瘤(mm)、粘膜相关淋巴组织(malt)淋巴瘤、霍奇金淋巴瘤、伯基特淋巴瘤、毛细胞白血病或浆细胞瘤。
[0521]
在一个方面,提供了治疗患有癌症的受试者的方法,包括向有需要的受试者施用治疗有效量的表达car(该car具有结合cd79b抗原的细胞外抗原结合结构域)的淋巴细胞,由此所述淋巴细胞诱导对受试者中的癌细胞的杀伤。在一些实施方案中,所述car中的至少一者包含选自由seq id no:164-207组成的组的氨基酸序列。在一些实施方案中,car包含与seq id no:164具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:164的序列。在一些实施方案中,car包含与seq id no:165具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:165的序列。在一些实施方案中,car包含与seq id no:166具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:166的序列。在一些实施方案中,car包含与seq id no:167具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:167的序列。在一些实施方案中,car包含与seq id no:168具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:168的序列。在一些实施方案中,car包含与seq id no:169具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、
至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:169的序列。在一些实施方案中,car包含与seq id no:170具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:170的序列。在一些实施方案中,car包含与seq id no:171具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:171的序列。在一些实施方案中,car包含与seq id no:172具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:172的序列。在一些实施方案中,car包含与seq id no:173具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:173的序列。在一些实施方案中,car包含与seq id no:174具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:174的序列。在一些实施方案中,car包含与seq id no:175具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:175的序列。在一些实施方案中,car包含与seq id no:176具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:176的序列。在一些实施方案中,car包含与seq id no:177具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:177的序列。在一些实施方案中,car包含与seq id no:178具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:178的序列。在一些实施方案中,car包含与seq id no:179具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:179的序列。在一些实施方案中,car包含与seq id no:180具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:180的序列。在一些实施方案中,car包含与seq id no:181具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:181的序列。在一些实施方案中,car包含与seq id no:182具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:182的序列。在一些实施方案中,car包含与seq id no:183具有至少50%、至
少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:183的序列。在一些实施方案中,car包含与seq id no:184具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:184的序列。在一些实施方案中,car包含与seq id no:185具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:185的序列。在一些实施方案中,car包含与seq id no:186具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:186的序列。在一些实施方案中,car包含与seq id no:187具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:187的序列。在一些实施方案中,car包含与seq id no:188具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:188的序列。在一些实施方案中,car包含与seq id no:189具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:189的序列。在一些实施方案中,car包含与seq id no:190具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:190的序列。在一些实施方案中,car包含与seq id no:191具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:191的序列。在一些实施方案中,car包含与seq id no:192具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:192的序列。在一些实施方案中,car包含与seq id no:193具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:193的序列。在一些实施方案中,car包含与seq id no:194具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:194的序列。在一些实施方案中,car包含与seq id no:195具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:195的序列。在一些实施方案中,car包含与seq id no:196具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一
性的氨基酸序列,或包含seq id no:196的序列。在一些实施方案中,car包含与seq id no:197具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:197的序列。在一些实施方案中,car包含与seq id no:198具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:198的序列。在一些实施方案中,car包含与seq id no:199具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:199的序列。在一些实施方案中,car包含与seq id no:200具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:200的序列。在一些实施方案中,car包含与seq id no:201具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:201的序列。在一些实施方案中,car包含与seq id no:202具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:202的序列。在一些实施方案中,car包含与seq id no:203具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:203的序列。在一些实施方案中,car包含与seq id no:204具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:204的序列。在一些实施方案中,car包含与seq id no:205具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:205的序列。在一些实施方案中,car包含与seq id no:206具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:206的序列。在一些实施方案中,car包含与seq id no:207具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列,或包含seq id no:207的序列。
[0522]
在一个方面,公开了对癌细胞进行靶向杀伤的方法,该方法包括使癌细胞与表达所述car中的一者或多者的淋巴细胞接触,由此所述淋巴细胞诱导对癌细胞的杀伤。可以靶向的癌细胞(包括转移性癌细胞)的非限制性列表包括b细胞淋巴瘤、非霍奇金淋巴瘤及它们的组合。在一个实施方案中,癌细胞是恶性b细胞。
[0523]
本公开的药物组合物可以以适于待治疗(或预防)的疾病的方式施用。施用的量和频率将由诸如受试者的病症以及受试者疾病的类型和严重性之类的因素确定,但适当的剂
量可以通过临床试验来确定。
[0524]
当指示治疗有效量时,待施用的本公开的组合物的精确量可以由医师考虑受试者的年龄、体重、肿瘤大小、感染或转移程度和状况的个体差异来确定。通常可以说,包含本文所述的t细胞的药物组合物可以以约104个细胞/kg体重至约10
10
个细胞/kg体重,在一些情况下约105个细胞/kg体重至约106个细胞/kg体重(包括在那些范围内的所有整数值)的剂量施用。在一些实施方案中,包含本文所述的t细胞的药物组合物可以以约106个细胞/kg体重的剂量施用。t细胞组合物也可以以这些剂量施用多次。这些细胞可以通过使用免疫疗法中通常已知的输注技术来施用(参见例如,rosenberg等人,new eng.j.of med.319:1676,1988)。
[0525]
可用于本发明实施方案的语境中的递送体系可以包括定时释放递送体系、延迟释放递送体系和持续释放递送体系,使得t细胞组合物的递送在待治疗部位致敏之前发生,并且具有足够的时间以引起待治疗部位致敏。组合物可与其他治疗剂或疗法联合使用。此类体系可以避免组合物的重复施用,从而增加对受试者和医师的便利性,并且可以特别适用于本发明的某些组合物实施方案。
[0526]
许多类型的释放递送体系是可用的,并且是本领域普通技术人员已知的。这些释放递送体系包括聚合物基础体系,诸如聚(丙交酯-乙交酯)、共聚草酸酯、聚酯酰胺、聚原酸酯、聚己内酯、聚羟基丁酸和聚酸酐。前述含有药物的聚合物的微胶囊描述于例如美国专利5,075,109中。递送体系还包括为脂质的非聚合物体系,这些脂质包括甾醇(诸如胆固醇、胆固醇酯和脂肪酸或中性脂肪(诸如甘油一酯、甘油二酯和甘油三酯));硅橡胶体系;基于肽的体系;水凝胶释放体系;蜡涂层;使用常规粘合剂和赋形剂的压片;部分熔融的植入物;等。具体示例包括但不限于:(a)侵蚀体系,其中活性组合物以一定形式包含在基质内,诸如美国专利号4,452,775;4,667,014;4,748,034;和5,239,660中所述的那些;以及(b)扩散体系,其中活性组分以受控速率从聚合物中渗透,诸如美国专利号3,854,480和3,832,253中所述。此外,可使用基于泵的硬件递送体系,其中一些体系适于植入。
[0527]
在某些方面,可能有利的是将活化的t细胞施用于受试者,然后重新抽取血液(或进行单采血液成分术),根据本公开活化t细胞,并且向受试者重新输注这些经活化和扩增的t细胞。该过程可以每几周进行多次。在某些方面,可以活化10cc至400cc的抽血中的t细胞。在某些方面,可以活化20cc、30cc、40cc、50cc、60cc、70cc、80cc、90cc或100cc的抽血中的t细胞。
[0528]
car-t细胞和组合物的施用可以以任何方式进行,例如,通过肠胃外或非肠胃外施用,包括通过气溶胶吸入、注射、输注、摄取、输血、植入或移植。例如,本文所述的car-t细胞和组合物可以经动脉、皮内、皮下、肿瘤内、髓内、结节内、肌内、通过静脉内(i.v.)注射、或腹膜内施用于患者。在一个方面,本公开的组合物通过i.v.注射施用。在一个方面,本公开的组合物通过皮内注射或皮下注射施用于受试者。t细胞的组合物可以被直接注射到例如肿瘤、淋巴结、组织、器官或感染部位中。
[0529]
施用可以是自体施用或非自体施用。例如,表达分化簇79b蛋白(例如,cd79b)特异性car的免疫应答细胞可以从一名受试者获得,并且施用于相同的受试者或不同的相容受试者。本公开的外周血来源的t细胞,或扩增的t细胞(例如,体内、离体或体外来源的)可以经由例如静脉内注射、局部注射、全身注射、导管施用或肠胃外施用来施用。
[0530]
在特定实施方案中,受试者可以经受白细胞去除术,其中离体收集、富集或去除白细胞,以选择和/或分离感兴趣的细胞(例如t细胞)。这些t细胞分离物可以通过本领域已知的方法扩增,并且进行处理,使得可以引入本公开的一种或多种car构建体,从而形成car-t细胞。随后,有需要的受试者可以经受用高剂量化学疗法进行的标准治疗,之后进行外周血干细胞移植。在某些方面,在移植之后或与移植同时,受试者接受扩增的car-t细胞的输注。在一个方面,扩增细胞在手术之前或之后施用。
[0531]
向患有恶性肿瘤的患者施用的剂量足以缓解或至少部分地遏止所治疗的疾病(“治疗有效量”)。待施用于受试者的上述治疗的剂量将随所治疗病症的确切性质和治疗接受者而变化。用于人类施用的剂量的缩放可以根据本领域通常接受的实践来进行。
[0532]
本发明的car t细胞可以经受体内t细胞扩增并且可以建立在血液和骨髓中以高水平存留延长的时间量的cd79b特异性记忆细胞。在一些情况下,输注到受试者中的本发明的car t细胞可以消除患有晚期化学疗法抗性癌症的受试者体内的癌细胞,例如恶性b细胞。
[0533]
在一个实施方案中,本公开的car例如使用体外转录被引入t细胞中,并且受试者(例如,人)接受本公开的car-t细胞的初始施用,以及car-t细胞的一次或多次后续施用,其中所述一次或多次后续施用在前一次施用之后不到15天(例如,14天、13天、12天、11天、10天、9天、8天、7天、6天、5天、4天、3天或2天)施用。在一个实施方案中,每周向受试者(例如,人)施用car-t细胞的多于一次施用,例如,每周施用car-t细胞的2次、3次或4次施用。在一个实施方案中,受试者每周接受多于一次的car-t细胞施用(例如,每周2次、3次或4次施用)(在本文中也称为周期),之后一周不接受car-t细胞施用,然后向该受试者施用一次或多次car-t细胞的附加施用(例如,每周多于一次的car-t细胞施用)。在另一个实施方案中,受试者接受多于一个car-t细胞周期,并且每个周期之间的时间少于10天、9天、8天、7天、6天、5天、4天或3天。在一个实施方案中,每隔一天施用car-t细胞,每周施用3次。在一个实施方案中,将car-t细胞施用至少两周、三周、四周、五周、六周、七周、八周或更多周。
[0534]
在一个实施方案中,可在一天、两天、三天、四天、五天、六天、一周、两周、三周、一个月、五周、六周、七周、两个月、三个月、四个月、五个月、六个月或更长时间之后重复施用。也可以重复治疗过程,按照慢性施用一样。重复施用可为相同剂量或不同剂量。
[0535]
car-t细胞在本发明的方法中可以通过维持疗法施用,诸如每周一次,持续6个月或更长的时期。
[0536]
在一个实施方案中,使用慢病毒载体(诸如慢病毒属(lentivirus))来产生car-t细胞。用此类病毒载体产生的car-t细胞通常将具有稳定的car表达。
[0537]
在一个实施方案中,car-t细胞在转导后瞬时表达car载体4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天。car的瞬时表达可以受到rna car载体递送的影响。在一个实施方案中,car rna通过电穿孔被转导到t细胞中。
[0538]
如果患者在瞬时car疗法的过程期间处于产生抗car抗体应答(诸如由rna转导产生的那些)的高风险下,则car-t输注间歇不应持续超过十天至十四天。
[0539]
本文所述的表达car的细胞可以与其他已知的作用剂和疗法组合使用。如本文所用,“组合”施用意味着在受试者的治疗过程期间将两种(或更多种)不同的治疗递送给受试者,例如,两种或更多种治疗在受试者已被诊断患有癌症之后并且在癌症已被治愈或消除
之前或者出于其他原因已停止治疗之前递送。在一些实施方案中,一种治疗的递送在第二种治疗的递送开始时仍在进行,使得在施用方面存在重叠。这在本文中有时称为“同时”或“同时递送”。在其他实施方案中,一种治疗的递送在另一种治疗的递送开始之前结束。在任一种情况的一些实施方案中,由于组合施用,治疗更有效。例如,与在不存在第一种治疗的情况下施用第二种治疗时、或者在使用第一种治疗时观察到的类似情况相比,第二治疗更有效,例如,在使用较少的第二种治疗时观察到等同的效果,或者第二种治疗更大程度地减轻了症状。在一些实施方案中,递送使得症状减轻或与疾病相关的其他参数减小的程度大于在递送一种治疗而不存在另一种治疗的情况下将观察到的减轻或减小的程度。两种治疗的效果可以是部分相加的、完全相加的,或比相加的结果大。所述递送可以使得递送的第一种治疗的效果在递送第二种治疗时仍然是可检测的。
[0540]
在一个实施方案中,其他治疗剂(诸如因子)可以在car-t细胞之前、之后或同时(与之同时)施用,包括但不限于白介素以及集落刺激因子(诸如g-csf、m-csf和gm-csf)和干扰素。
[0541]
本文所述的表达car的细胞和至少一种附加的治疗剂可以同时施用、在相同或分开的组合物中施用,或相继施用。对于相继施用,可以首先施用本文所述的表达car的细胞,并且可以其次施用附加的作用剂,或者可以颠倒施用次序。
[0542]
在另外的实施方案中,本文所述的表达car的细胞可用于与外科手术、放射、化学疗法、免疫抑制剂、抗体或其它免疫消融剂组合的治疗方案中。在另一个实施方案中,本文所述的表达car的细胞可以与抗雄激素治疗组合使用。在一个实施方案中,可以向受试者施用增强表达car的细胞的活性的作用剂。例如,在一个实施方案中,该作用剂可以是抑制抑制性分子的作用剂。
[0543]
试剂盒
[0544]
本发明还提供了包含以下任一者的试剂盒:本文所述的嵌合抗原受体(car),和/或编码所述car的核酸、包含所述核酸的载体和包含所述载体的宿主细胞。
[0545]
试剂盒可用于治疗用途并用作诊断试剂盒。
[0546]
试剂盒可用于检测样品中cd79b或表达cd79b的细胞的存在。
[0547]
试剂盒可包含一个或多个其它元件,包含:使用说明;其它试剂,例如标记、治疗剂、或者可用于使抗体与标记或治疗剂螯合或以其它方式偶联的药剂、或辐射防护组合物;用于准备施用抗体的装置或其它材料;药学上可接受的载剂;以及向受试者施用的装置或其它材料。
[0548]
在一些实施方案中,试剂盒还包含容器中的以上car、核酸、载体和/或宿主细胞中的任一者以及试剂盒的使用说明。
[0549]
在一些实施方案中,car包含结合cd79b的抗原结合结构域,所述抗原结合结构域包含:
[0550]
seq id no:1的vh和seq id no:19的vl;
[0551]
seq id no:1的vh和seq id no:20的vl;
[0552]
seq id no:2的vh和seq id no:19的vl;
[0553]
seq id no:2的vh和seq id no:20的vl;
[0554]
seq id no:3的vh和seq id no:20的vl;
[0555]
seq id no:4的vh和seq id no:19的vl;
[0556]
seq id no:5的vh和seq id no:22的vl;
[0557]
seq id no:5的vh和seq id no:23的vl;
[0558]
seq id no:6的vh和seq id no:24的vl;
[0559]
seq id no:7的vh和seq id no:26的vl;
[0560]
seq id no:8的vh和seq id no:25的vl;
[0561]
seq id no:9的vh和seq id no:27的vl;
[0562]
seq id no:10的vh和seq id no:28的vl;
[0563]
seq id no:11的vh和seq id no:29的vl;
[0564]
seq id no:12的vh和seq id no:30的vl;
[0565]
seq id no:13的vh和seq id no:31的vl;
[0566]
seq id no:14的vh和seq id no:32的vl;
[0567]
seq id no:15的vh和seq id no:33的vl;
[0568]
seq id no:16的vh和seq id no:34的vl;
[0569]
seq id no:16的vh和seq id no:35的vl;
[0570]
seq id no:17的vh和seq id no:33的vl;或者
[0571]
seq id no:18的vh和seq id no:36的vl。
[0572]
在一些实施方案中,试剂盒包含含有seq id no:75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117或118的car。
[0573]
治疗方法和用途
[0574]
本公开还提供了一种治疗受试者的表达cd79b的癌症的方法,该方法包括向有需要的受试者施用治疗有效量的表达本文所述的car中的任一种的分离的淋巴细胞中的任一种,持续足以治疗表达cd79b的癌症的时间。
[0575]
本公开还提供了一种治疗受试者的表达cd79b的癌症的方法,该方法包括向受试者施用治疗有效量的包含表达本文所述的car中的任一种的分离的淋巴细胞中的任一种的药物组合物,持续足以治疗表达cd79b的癌症的时间。
[0576]
在一个方面,本公开整体涉及对有患上癌症的风险的受试者的治疗。本发明还包括治疗以下恶性肿瘤或自身免疫疾病:其中化学疗法和/或免疫疗法在受试者中导致显著的免疫抑制,从而增加了受试者发展癌症的风险。
[0577]
本公开还提供了一种治疗处于发展癌性病状风险中的受试者中的非癌性病状的方法,该方法包括向受试者施用表达本文所述的car中的任一种的分离的淋巴细胞中的任一种以治疗非癌性病状。
[0578]
本公开还提供了一种治疗处于发展癌性病状风险中的受试者中的非癌性病状的方法,该方法包括向受试者施用包含本文所述的car的药物组合物以治疗非癌性病状。
[0579]
本公开还提供了一种预防受试者的表达cd79b的癌症的方法,该方法包括向受试者施用治疗有效量的本公开的结合cd79b的抗原结合结构域,持续足以预防表达cd79b的癌症的时间。表达cd79b的癌症的示例包括但不限于:b细胞淋巴瘤、非霍奇金淋巴瘤、弥漫性大b细胞淋巴瘤(dlbcl)、套细胞淋巴瘤(mcl)、滤泡性淋巴瘤(fl)、边缘区淋巴瘤(mz)、急性
成淋巴细胞性白血病(all)、慢性淋巴细胞白血病(cll)、多发性骨髓瘤(mm)、粘膜相关淋巴组织(malt)淋巴瘤、霍奇金淋巴瘤、伯基特淋巴瘤、毛细胞白血病和浆细胞瘤。
[0580]
本公开还提供了一种预防受试者的表达cd79b的癌症的方法,该方法包括受试者施用治疗有效量的包含本公开的结合cd79b的抗原结合结构域的蛋白质,持续足以预防表达cd79b的癌症的时间。表达cd79b的癌症的示例包括但不限于:b细胞淋巴瘤、非霍奇金淋巴瘤、dlbcl、mcl、fl、mz、all、cll、mm、malt淋巴瘤、霍奇金淋巴瘤、伯基特淋巴瘤、毛细胞白血病和浆细胞瘤。
[0581]
本公开还提供了一种预防受试者的表达cd79b的癌症的方法,该方法包括受试者施用治疗有效量的包含本公开的结合cd79b的抗原结合结构域的多特异性蛋白质,持续足以预防表达cd79b的癌症的时间。表达cd79b的癌症的示例包括但不限于:b细胞淋巴瘤、非霍奇金淋巴瘤、dlbcl、mcl、fl、mz、all、cll、mm、malt淋巴瘤、霍奇金淋巴瘤、伯基特淋巴瘤、毛细胞白血病和浆细胞瘤。
[0582]
本公开还提供了一种预防受试者的表达cd79b的癌症的方法,该方法包括向受试者施用治疗有效量的结合本公开的cd79b的本文所述的car-t细胞中的任一种,持续足以预防表达cd79b的癌症的时间。表达cd79b的癌症的示例包括但不限于:b细胞淋巴瘤、非霍奇金淋巴瘤、dlbcl、mcl、fl、mz、all、cll、mm、malt淋巴瘤、霍奇金淋巴瘤、伯基特淋巴瘤、毛细胞白血病和浆细胞瘤。
[0583]
本公开还提供了一种预防受试者的表达cd79b的癌症的方法,该方法包括向受试者施用治疗有效量的表达本文所述的car中的任一种的分离的淋巴细胞中的任一种,持续足以预防表达cd79b的癌症的时间。表达cd79b的癌症的示例包括但不限于:b细胞淋巴瘤、非霍奇金淋巴瘤、dlbcl、mcl、fl、mz、all、cll、mm、malt淋巴瘤、霍奇金淋巴瘤、伯基特淋巴瘤、毛细胞白血病和浆细胞瘤。
[0584]
在一些实施方案中,表达cd79b的癌症是b细胞淋巴瘤。
[0585]
在一些实施方案中,表达cd79b的癌症是非霍奇金淋巴瘤。
[0586]
在一些实施方案中,表达cd79b的癌症已经转移。
[0587]
在一些实施方案中,表达cd79b的癌症是弥漫性大b细胞淋巴瘤(dlbcl)、套细胞淋巴瘤(mcl)、滤泡性淋巴瘤(fl)、边缘区淋巴瘤(mz)、急性成淋巴细胞性白血病(all)、慢性淋巴细胞白血病(cll)、多发性骨髓瘤(mm)、粘膜相关淋巴组织(malt)淋巴瘤、霍奇金淋巴瘤、伯基特淋巴瘤、毛细胞白血病和浆细胞瘤。
[0588]
在一个方面,本公开提供了治疗患有癌症的受试者的方法,所述方法包括施用表达本文所述的car中的任一种的分离的淋巴细胞中的任一种,由此所述淋巴细胞诱导或调节对受试者中的癌细胞的杀伤。
[0589]
表达本文所述的car中的任一种的分离的淋巴细胞中的任一种都可以连同其他治疗剂或疗法使用。此类体系可以避免组合物的重复施用,从而增加对受试者和医师的便利性,并且可以特别适用于本发明的某些组合物实施方案。
[0590]
表达本文所述的car中的任一种的分离的淋巴细胞中的任一种的施用可以任何方式进行,例如,通过肠胃外或非肠胃外施用,包括通过气溶胶吸入、注射、输注、摄取、输液、植入或移植。例如,本文所述的cd79结合蛋白和组合物可以经动脉、皮内、皮下、肿瘤内、髓内、结节内、肌内、通过静脉内(i.v.)注射、或腹膜内施用于患者。在一个方面,本公开的组
合物通过i.v.注射施用。在一个方面,本公开的组合物通过皮内注射或皮下注射施用于受试者。cd79结合蛋白的组合物可以例如直接注射到肿瘤、淋巴结、组织、器官或感染部位中。
[0591]
在一个实施方案中,可在一天、两天、三天、四天、五天、六天、一周、两周、三周、一个月、五周、六周、七周、两个月、三个月、四个月、五个月、六个月或更长时间之后重复施用。也可以重复治疗过程,按照慢性施用一样。重复施用可为相同剂量或不同剂量。
[0592]
联合疗法
[0593]
可以将表达本文所述的car中的任一种的分离的淋巴细胞中的任一种与至少一种附加治疗剂组合施用。
[0594]
在一些实施方案中,所述至少一种附加治疗剂为外科手术、化学疗法、雄激素阻断疗法或放射疗法、或它们的任何组合。
[0595]
在一些实施方案中,一种治疗的递送在第二种治疗的递送开始时仍在进行,使得在施用方面存在重叠。这在本文中有时称为“同时”或“同时递送”。在其他实施方案中,一种治疗的递送在另一种治疗的递送开始之前结束。在任一种情况的一些实施方案中,由于组合施用,治疗更有效。例如,与在不存在第一种治疗的情况下施用第二种治疗时、或者在使用第一种治疗时观察到的类似情况相比,第二治疗更有效,例如,在使用较少的第二种治疗时观察到等同的效果,或者第二种治疗更大程度地减轻了症状。在一些实施方案中,递送使得症状减轻或与疾病相关的其他参数减小的程度大于在递送一种治疗而不存在另一种治疗的情况下将观察到的减轻或减小的程度。两种治疗的效果可以是部分相加的、完全相加的,或比相加的结果大。所述递送可以使得递送的第一种治疗的效果在递送第二种治疗时仍然是可检测的。
[0596]
在一个实施方案中,其他治疗剂(诸如因子)可以在表达本文所述的car中的任一种的分离的淋巴细胞中的任一种之前、之后或同时(与之同时)施用,包括但不限于白介素以及集落刺激因子(诸如g-csf、m-csf和gm-csf)和干扰素。
[0597]
表达本文所述的car中的任一种的分离的淋巴细胞中的任一种可包含至少一种附加治疗剂,可以同时施用、在相同或分开的组合物中施用,或相继施用。对于相继施用,本文所述的淋巴细胞可以首先施用,而附加作用剂可以第二施用,或者可以颠倒施用次序。
[0598]
在另外的实施方案中,本文所述的淋巴细胞可用于与外科手术、放射、化学疗法、免疫抑制剂、抗体或其它免疫消融剂组合的治疗方案中。在另一个实施方案中,本文所述的淋巴细胞可以与抗雄激素治疗组合使用。在一个实施方案中,可以向受试者施用增强淋巴细胞的活性的作用剂。例如,在一个实施方案中,该作用剂可以是抑制抑制性分子的作用剂。
[0599]
提供以下实施例以进一步描述本文所公开的实施方案中的一些。这些实施例旨在说明而非限制本发明所公开的实施方案。
[0600]
对示例性实施方案的描述如下:
[0601]
1.一种嵌合抗原受体(car),所述car包含:
[0602]
(a)细胞外结构域,所述细胞外结构域特异性地结合cd79b抗原,
[0603]
(b)跨膜结构域,和
[0604]
(c)细胞内信号传导结构域,所述细胞内信号传导结构域任选地包括至少一个共刺激结构域。
[0605]
2.根据实施方案1所述的car,所述car还包含
[0606]
(d)cd8a铰链区,
[0607]
其中所述跨膜结构域包含cd8a跨膜区(cd8a-tm)多肽;并且
[0608]
其中所述细胞内信号传导结构域包括共刺激结构域和初级信号传导结构域,所述共刺激结构域包含tnf受体超家族成员9(cd137)组分,所述初级信号传导结构域包含t细胞表面糖蛋白cd3ζ链(cd3z)组分。
[0609]
3.根据实施方案2所述的car,其中
[0610]
所述cd8a铰链区包含与seq id no:38具有至少90%同一性的氨基酸序列;
[0611]
所述跨膜结构域包含与seq id no:39具有至少90%同一性的氨基酸序列;并且/或者
[0612]
所述细胞内信号传导结构域包括共刺激结构域和初级信号传导结构域,所述共刺激结构域具有与seq id no:40具有至少90%同一性的氨基酸序列,所述初级信号传导结构域具有与seq id no:41具有至少90%同一性的氨基酸序列。
[0613]
4.一种嵌合抗原受体(car),所述car包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中所述细胞外抗原结合结构域包含:
[0614]
具有seq id no:208的氨基酸序列的重链互补决定区1(cdr1)、具有seq id no:209的氨基酸序列的重链cdr2和具有seq id no:210的氨基酸序列的重链cdr3;
[0615]
具有seq id no:216的氨基酸序列的重链cdr1、具有seq id no:217的氨基酸序列的重链cdr2和具有seq id no:218的氨基酸序列的重链cdr3;
[0616]
具有seq id no:222的氨基酸序列的重链cdr1、具有seq id no:223的氨基酸序列的重链cdr2和具有seq id no:224的氨基酸序列的重链cdr3;
[0617]
具有seq id no:228的氨基酸序列的重链cdr1、具有seq id no:217的氨基酸序列的重链cdr2和具有seq id no:229的氨基酸序列的重链cdr3;
[0618]
具有seq id no:232的氨基酸序列的重链cdr1、具有seq id no:233的氨基酸序列的重链cdr2和具有seq id no:234的氨基酸序列的重链cdr3;
[0619]
具有seq id no:238的氨基酸序列的重链cdr1、具有seq id no:239的氨基酸序列的重链cdr2和具有seq id no:240的氨基酸序列的重链cdr3;
[0620]
具有seq id no:242的氨基酸序列的重链cdr1、具有seq id no:243的氨基酸序列的重链cdr2和具有seq id no:244的氨基酸序列的重链cdr3;
[0621]
具有seq id no:248的氨基酸序列的重链cdr1、具有seq id no:249的氨基酸序列的重链cdr2和具有seq id no:250的氨基酸序列的重链cdr3;
[0622]
具有seq id no:253的氨基酸序列的重链cdr1、具有seq id no:254的氨基酸序列的重链cdr2和具有seq id no:255的氨基酸序列的重链cdr3;
[0623]
具有seq id no:257的氨基酸序列的重链cdr1、具有seq id no:258的氨基酸序列的重链cdr2和具有seq id no:259的氨基酸序列的重链cdr3;
[0624]
具有seq id no:263的氨基酸序列的重链cdr1、具有seq id no:243的氨基酸序列的重链cdr2和具有seq id no:264的氨基酸序列的重链cdr3;
[0625]
具有seq id no:268的氨基酸序列的重链cdr1、具有seq id no:269的氨基酸序列的重链cdr2和具有seq id no:270的氨基酸序列的重链cdr3;或者
[0626]
具有seq id no:274的氨基酸序列的重链cdr1、具有seq id no:275的氨基酸序列的重链cdr2和具有seq id no:276的氨基酸序列的重链cdr3;
[0627]
其中所述细胞外抗原结合结构域结合所述cd79b抗原。
[0628]
5.根据实施方案4所述的car,其中所述细胞外抗原结合结构域包含具有seq id no:257的氨基酸序列的重链cdr1、具有seq id no:258的氨基酸序列的重链cdr2和具有seq id no:259的氨基酸序列的重链cdr3。
[0629]
6.一种嵌合抗原受体(car),所述car包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中所述细胞外抗原结合结构域包含:
[0630]
具有seq id no:211的氨基酸序列的轻链cdr1、具有seq id no:212的氨基酸序列的轻链cdr2和具有seq id no:213的氨基酸序列的轻链cdr3;
[0631]
具有seq id no:214的氨基酸序列的轻链cdr1、具有seq id no:212的氨基酸序列的轻链cdr2和具有seq id no:213的氨基酸序列的轻链cdr3;
[0632]
具有seq id no:215的氨基酸序列的轻链cdr1、具有seq id no:212的氨基酸序列的轻链cdr2和具有seq id no:213的氨基酸序列的轻链cdr3;
[0633]
具有seq id no:219的氨基酸序列的轻链cdr1、具有seq id no:220的氨基酸序列的轻链cdr2和具有seq id no:221的氨基酸序列的轻链cdr3;
[0634]
具有seq id no:225的氨基酸序列的轻链cdr1、具有seq id no:226的氨基酸序列的轻链cdr2和具有seq id no:227的氨基酸序列的轻链cdr3;
[0635]
具有seq id no:230的氨基酸序列的轻链cdr1、具有seq id no:231的氨基酸序列的轻链cdr2和具有seq id no:221的氨基酸序列的轻链cdr3;
[0636]
具有seq id no:235的氨基酸序列的轻链cdr1、具有seq id no:236的氨基酸序列的轻链cdr2和具有seq id no:237的氨基酸序列的轻链cdr3;
[0637]
具有seq id no:241的氨基酸序列的轻链cdr1、具有seq id no:226的氨基酸序列的轻链cdr2和具有seq id no:227的氨基酸序列的轻链cdr3;
[0638]
具有seq id no:245的氨基酸序列的轻链cdr1、具有seq id no:246的氨基酸序列的轻链cdr2和具有seq id no:247的氨基酸序列的轻链cdr3;
[0639]
具有seq id no:251的氨基酸序列的轻链cdr1、具有seq id no:236的氨基酸序列的轻链cdr2和具有seq id no:252的氨基酸序列的轻链cdr3;
[0640]
具有seq id no:251的氨基酸序列的轻链cdr1、具有seq id no:236的氨基酸序列的轻链cdr2和具有seq id no:256的氨基酸序列的轻链cdr3;
[0641]
具有seq id no:260的氨基酸序列的轻链cdr1、具有seq id no:261的氨基酸序列的轻链cdr2和具有seq id no:262的氨基酸序列的轻链cdr3;
[0642]
具有seq id no:265的氨基酸序列的轻链cdr1、具有seq id no:266的氨基酸序列的轻链cdr2和具有seq id no:267的氨基酸序列的轻链cdr3;
[0643]
具有seq id no:271的氨基酸序列的轻链cdr1、具有seq id no:272的氨基酸序列的轻链cdr2和具有seq id no:273的氨基酸序列的轻链cdr3;或者
[0644]
具有seq id no:277的氨基酸序列的轻链cdr1、具有seq id no:266的氨基酸序列的轻链cdr2和具有seq id no:278的氨基酸序列的轻链cdr3;
[0645]
其中所述细胞外抗原结合结构域结合所述cd79b抗原。
[0646]
7.根据实施方案6所述的car,其中所述细胞外抗原结合结构域包含具有seq id no:260的氨基酸序列的轻链cdr1、具有seq id no:261的氨基酸序列的轻链cdr2和具有seq id no:262的氨基酸序列的轻链cdr3。
[0647]
8.根据实施方案4或实施方案5所述的car,其中所述细胞外抗原结合结构域还包含:
[0648]
具有seq id no:211的氨基酸序列的轻链cdr1、具有seq id no:212的氨基酸序列的轻链cdr2和具有seq id no:213的氨基酸序列的轻链cdr3;
[0649]
具有seq id no:214的氨基酸序列的轻链cdr1、具有seq id no:212的氨基酸序列的轻链cdr2和具有seq id no:213的氨基酸序列的轻链cdr3;
[0650]
具有seq id no:215的氨基酸序列的轻链cdr1、具有seq id no:212的氨基酸序列的轻链cdr2和具有seq id no:213的氨基酸序列的轻链cdr3;
[0651]
具有seq id no:219的氨基酸序列的轻链cdr1、具有seq id no:220的氨基酸序列的轻链cdr2和具有seq id no:221的氨基酸序列的轻链cdr3;
[0652]
具有seq id no:225的氨基酸序列的轻链cdr1、具有seq id no:226的氨基酸序列的轻链cdr2和具有seq id no:227的氨基酸序列的轻链cdr3;
[0653]
具有seq id no:230的氨基酸序列的轻链cdr1、具有seq id no:231的氨基酸序列的轻链cdr2和具有seq id no:221的氨基酸序列的轻链cdr3;
[0654]
具有seq id no:235的氨基酸序列的轻链cdr1、具有seq id no:236的氨基酸序列的轻链cdr2和具有seq id no:237的氨基酸序列的轻链cdr3;
[0655]
具有seq id no:241的氨基酸序列的轻链cdr1、具有seq id no:226的氨基酸序列的轻链cdr2和具有seq id no:227的氨基酸序列的轻链cdr3;
[0656]
具有seq id no:245的氨基酸序列的轻链cdr1、具有seq id no:246的氨基酸序列的轻链cdr2和具有seq id no:247的氨基酸序列的轻链cdr3;
[0657]
具有seq id no:251的氨基酸序列的轻链cdr1、具有seq id no:236的氨基酸序列的轻链cdr2和具有seq id no:252的氨基酸序列的轻链cdr3;
[0658]
具有seq id no:251的氨基酸序列的轻链cdr1、具有seq id no:236的氨基酸序列的轻链cdr2和具有seq id no:256的氨基酸序列的轻链cdr3;
[0659]
具有seq id no:260的氨基酸序列的轻链cdr1、具有seq id no:261的氨基酸序列的轻链cdr2和具有seq id no:262的氨基酸序列的轻链cdr3;
[0660]
具有seq id no:265的氨基酸序列的轻链cdr1、具有seq id no:266的氨基酸序列的轻链cdr2和具有seq id no:267的氨基酸序列的轻链cdr3;
[0661]
具有seq id no:271的氨基酸序列的轻链cdr1、具有seq id no:272的氨基酸序列的轻链cdr2和具有seq id no:273的氨基酸序列的轻链cdr3;或者
[0662]
具有seq id no:277的氨基酸序列的轻链cdr1、具有seq id no:266的氨基酸序列的轻链cdr2和具有seq id no:278的氨基酸序列的轻链cdr3。
[0663]
9.根据实施方案8所述的car,其中所述细胞外抗原结合结构域包含具有seq id no:260的氨基酸序列的轻链cdr1、具有seq id no:261的氨基酸序列的轻链cdr2和具有seq id no:262的氨基酸序列的轻链cdr3。
[0664]
10.一种嵌合抗原受体(car),所述car包含细胞外抗原结合结构域、跨膜结构域和
细胞内信号传导结构域,其中所述细胞外抗原结合结构域包含具有seq id no:208、216、222、228、232、238、242、248、253、257、263、268或274的氨基酸序列的重链cdr1,具有seq id no:209、217、223、233、239、243、249、254、258、269或275的氨基酸序列的重链cdr2,具有seq id no:210、218、224、229、234、240、244、250、255、259、264、270或276的氨基酸序列的重链cdr3,具有seq id no:211、214、215、219、225、230、235、241、245、251、260、265、271或277的氨基酸序列的轻链cdr1,具有seq id no:212、220、226、231、236、246、261、266或272的氨基酸序列的轻链cdr2,以及具有seq id no:213、221、227、237、247、252、256、262、267、273或278的氨基酸序列的轻链cdr3。
[0665]
11.根据实施方案1-10中任一项所述的car,其中所述细胞外抗原结合结构域包含具有以下的氨基酸序列的所述重链cdr1、所述重链cdr2、所述重链cdr3、所述轻链cdr1、所述轻链cdr2和所述轻链cdr3:
[0666]
a)分别为seq id no:208、209、210、211、212和213;
[0667]
b)分别为seq id no:208、209、210、214、212和213;
[0668]
c)分别为seq id no:208、209、210、215、212和213;
[0669]
d)分别为seq id no:216、217、218、219、220和221;
[0670]
e)分别为seq id no:222、223、224、225、226和227;
[0671]
f)分别为seq id no:228、217、229、230、231和221;
[0672]
g)分别为seq id no:232、233、234、235、236和237;
[0673]
h)分别为seq id no:238、239、240、241、226和227;
[0674]
i)分别为seq id no:242、243、244、245、246和247;
[0675]
j)分别为seq id no:248、249、250、251、236和252;
[0676]
k)分别为seq id no:253、254、255、251、236和256;
[0677]
l)分别为seq id no:257、258、259、260、261和262;
[0678]
m)分别为seq id no:263、243、264、265、266和267;
[0679]
n)分别为seq id no:268、269、270、271、272和273;或者
[0680]
o)分别为seq id no:274、275、276、277、266和278。
[0681]
12.根据实施方案1-11中任一项所述的car,其中所述细胞外抗原结合结构域包含具有以下的氨基酸序列的所述重链cdr1、所述重链cdr2、所述重链cdr3、所述轻链cdr1、所述轻链cdr2和所述轻链cdr3:分别为seq id no:257、258、259、260、261和262。
[0682]
13.一种嵌合抗原受体(car),所述car包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,其中所述细胞外抗原结合结构域包含:
[0683]
包含与选自seq id no:1-18的序列具有至少90%同一性的氨基酸序列的重链可变结构域(vh);以及/或者
[0684]
包含与选自seq id no:19-36的序列具有至少90%同一性的氨基酸序列的轻链可变结构域(vl);
[0685]
其中所述细胞外抗原结合结构域结合所述cd79b抗原。
[0686]
14.根据实施方案13所述的car,其中所述细胞外抗原结合结构域包含:
[0687]
包含选自seq id no:1-18的氨基酸序列的重链可变结构域(vh);以及/或者
[0688]
包含选自seq id no:19-36的氨基酸序列的轻链可变结构域(vl);
[0689]
其中所述细胞外抗原结合结构域结合所述cd79b抗原。
[0690]
15.根据实施方案13所述的car,其中所述细胞外抗原结合结构域包含:
[0691]
包含与seq id no:1具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:19具有至少90%同一性的氨基酸序列的轻链可变区;
[0692]
包含与seq id no:1具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:20具有至少90%同一性的氨基酸序列的轻链可变区;
[0693]
包含与seq id no:2具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:19具有至少90%同一性的氨基酸序列的轻链可变区;
[0694]
包含与seq id no:2具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:20具有至少90%同一性的氨基酸序列的轻链可变区;
[0695]
包含与seq id no:3具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:20具有至少90%同一性的氨基酸序列的轻链可变区;
[0696]
包含与seq id no:4具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:19具有至少90%同一性的氨基酸序列的轻链可变区;
[0697]
包含与seq id no:5具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:22具有至少90%同一性的氨基酸序列的轻链可变区;
[0698]
包含与seq id no:5具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:23具有至少90%同一性的氨基酸序列的轻链可变区;
[0699]
包含与seq id no:6具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:24具有至少90%同一性的氨基酸序列的轻链可变区;
[0700]
包含与seq id no:7具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:26具有至少90%同一性的氨基酸序列的轻链可变区;
[0701]
包含与seq id no:8具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:25具有至少90%同一性的氨基酸序列的轻链可变区;
[0702]
包含与seq id no:9具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:27具有至少90%同一性的氨基酸序列的轻链可变区;
[0703]
包含与seq id no:10具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:28具有至少90%同一性的氨基酸序列的轻链可变区;
[0704]
包含与seq id no:11具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:29具有至少90%同一性的氨基酸序列的轻链可变区;
[0705]
包含与seq id no:12具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:30具有至少90%同一性的氨基酸序列的轻链可变区;
[0706]
包含与seq id no:13具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:31具有至少90%同一性的氨基酸序列的轻链可变区;
[0707]
包含与seq id no:14具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:32具有至少90%同一性的氨基酸序列的轻链可变区;
[0708]
包含与seq id no:15具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:33具有至少90%同一性的氨基酸序列的轻链可变区;
[0709]
包含与seq id no:16具有至少90%同一性的氨基酸序列的重链可变区以及包含
与seq id no:34具有至少90%同一性的氨基酸序列的轻链可变区;
[0710]
包含与seq id no:16具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:35具有至少90%同一性的氨基酸序列的轻链可变区;
[0711]
包含与seq id no:17具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:33具有至少90%同一性的氨基酸序列的轻链可变区;或者
[0712]
包含与seq id no:18具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:36具有至少90%同一性的氨基酸序列的轻链可变区。
[0713]
16.根据实施方案13-15中任一项所述的car,其中所述细胞外抗原结合结构域包含:
[0714]
包含seq id no:1的氨基酸序列的重链可变区和包含seq id no:19的氨基酸序列的轻链可变区;
[0715]
包含seq id no:1的氨基酸序列的重链可变区和包含seq id no:20的氨基酸序列的轻链可变区;
[0716]
包含seq id no:2的氨基酸序列的重链可变区和包含seq id no:19的氨基酸的轻链可变区;
[0717]
包含seq id no:2的氨基酸序列的重链可变区和包含seq id no:20的氨基酸序列的轻链可变区;
[0718]
包含seq id no:3的氨基酸序列的重链可变区和包含seq id no:20的氨基酸序列的轻链可变区;
[0719]
包含seq id no:4的氨基酸序列的重链可变区和包含seq id no:19的氨基酸序列的轻链可变区;
[0720]
包含seq id no:5的氨基酸序列的重链可变区和包含seq id no:22的氨基酸序列的轻链可变区;
[0721]
包含seq id no:5的氨基酸序列的重链可变区和包含seq id no:23的氨基酸序列的轻链可变区;
[0722]
包含seq id no:6的氨基酸序列的重链可变区和包含seq id no:24的氨基酸序列的轻链可变区;
[0723]
包含seq id no:7的氨基酸序列的重链可变区和包含seq id no:26的氨基酸序列的轻链可变区;
[0724]
包含seq id no:8的氨基酸序列的重链可变区和包含seq id no:25的氨基酸序列的轻链可变区;
[0725]
包含seq id no:9的氨基酸序列的重链可变区和包含seq id no:27的氨基酸序列的轻链可变区;
[0726]
包含seq id no:10的氨基酸序列的重链可变区和包含seq id no:28的氨基酸序列的轻链可变区;
[0727]
包含seq id no:11的氨基酸序列的重链可变区和包含seq id no:29的氨基酸序列的轻链可变区;
[0728]
包含seq id no:12的氨基酸序列的重链可变区和包含seq id no:30的氨基酸序列的轻链可变区;
[0729]
包含seq id no:13的氨基酸序列的重链可变区和包含seq id no:31的氨基酸序列的轻链可变区;
[0730]
包含seq id no:14的氨基酸序列的重链可变区和包含seq id no:32的氨基酸序列的轻链可变区;
[0731]
包含seq id no:15的氨基酸序列的重链可变区和包含seq id no:33的氨基酸序列的轻链可变区;
[0732]
包含seq id no:16的氨基酸序列的重链可变区和包含seq id no:34的氨基酸序列的轻链可变区;
[0733]
包含seq id no:16的氨基酸序列的重链可变区和包含seq id no:35的氨基酸序列的轻链可变区;
[0734]
包含seq id no:17的氨基酸序列的重链可变区和包含seq id no:33的氨基酸序列的轻链可变区;或者
[0735]
包含seq id no:18的氨基酸序列的重链可变区和包含seq id no:36的氨基酸序列的轻链可变区。
[0736]
17.根据实施方案13或15所述的car,其中所述细胞外抗原结合结构域包含:
[0737]
包含与seq id no:14具有至少90%同一性的氨基酸序列的重链可变区以及包含与seq id no:32具有至少90%同一性的氨基酸序列的轻链可变区。
[0738]
18.根据实施方案13-17中任一项所述的car,其中所述细胞外抗原结合结构域包含:
[0739]
包含seq id no:14的氨基酸序列的重链可变区和包含seq id no:32的氨基酸序列的轻链可变区。
[0740]
19.根据实施方案1-18中任一项所述的car,其中所述细胞外抗原结合结构域包含单链可变片段(scfv),所述scfv包含重链可变区(vh)和轻链可变区(vl)。
[0741]
20.根据实施方案19所述的car,其中所述scfv包含位于所述重链可变区(vh)与所述轻链可变区(vl)之间的接头多肽。
[0742]
21.根据实施方案20所述的car,其中所述接头多肽包含与seq id no:42具有至少90%同一性的氨基酸序列。
[0743]
22.根据实施方案20或21所述的car,其中所述接头多肽包含seq id no:42的氨基酸序列。
[0744]
23.根据实施方案19-22中任一项所述的car,其中所述scfv包含与选自由seq id no:75-118组成的组的序列具有至少90%同一性的氨基酸序列。
[0745]
24.根据实施方案19-23中任一项所述的car,其中所述scfv包含选自由seq id no:75-118组成的组的氨基酸序列。
[0746]
25.根据实施方案19-23中任一项所述的car,其中所述scfv包含与seq id no:113具有至少90%同一性的氨基酸序列。
[0747]
26.根据实施方案19-25中任一项所述的car,其中所述scfv包含seq id no:113的氨基酸序列。
[0748]
27.根据实施方案1-26中任一项所述的car,其中所述细胞外抗原结合结构域包含信号多肽。
[0749]
28.根据实施方案27所述的car,其中所述信号多肽包含与seq id no:37具有至少90%同一性的氨基酸序列。
[0750]
29.根据实施方案27或28所述的car,其中所述信号多肽包含seq id no:37的氨基酸序列。
[0751]
30.根据实施方案4-29中任一项所述的car,其中所述细胞内信号传导结构域包含多肽组分,所述多肽组分选自由以下项组成的组:tnf受体超家族成员9(cd137)组分、t细胞表面糖蛋白cd3ζ链(cd3z)组分、分化簇(cd27)组分、分化簇超家族成员组分,以及它们的组合。
[0752]
31.根据实施方案30所述的car,其中所述cd137组分包含与seq id no:40具有至少90%同一性的氨基酸序列。
[0753]
32.根据实施方案30或31所述的car,其中所述cd137组分包含seq id no:40的氨基酸序列。
[0754]
33.根据实施方案30-32中任一项所述的car,其中所述cd3z组分包含与seq id no:41具有至少90%同一性的氨基酸序列。
[0755]
34.根据实施方案30-33中任一项所述的car,其中所述cd3z组分包含seq id no:41的氨基酸序列。
[0756]
35.根据实施方案30-34中任一项所述的car,其中所述细胞内信号传导结构域包含与seq id no:163具有至少90%同一性的氨基酸序列。
[0757]
36.根据实施方案30-35中任一项所述的car,其中所述细胞内信号传导结构域包含seq id no:163的氨基酸序列。
[0758]
37.根据实施方案4-36中任一项所述的car,其中所述跨膜结构域包含cd8a跨膜区(cd8a-tm)多肽。
[0759]
38.根据实施方案37所述的car,其中所述cd8a-tm多肽包含与seq id no:39具有至少90%同一性的氨基酸序列。
[0760]
39.根据实施方案37或38所述的car,其中所述cd8a-tm多肽包含seq id no:39的氨基酸序列。
[0761]
40.根据实施方案4-39中任一项所述的car,所述car还包含将所述跨膜结构域连接至所述细胞外抗原结合结构域的铰链区。
[0762]
41.根据实施方案40所述的car,其中所述铰链区为cd8a铰链区。
[0763]
42.根据实施方案41所述的car,其中所述cd8a铰链区包含与seq id no:38具有至少90%同一性的氨基酸序列。
[0764]
43.根据实施方案41或42所述的car,其中所述cd8a铰链区包含seq id no:38的氨基酸序列。
[0765]
44.根据实施方案1-43中任一项所述的car,其中所述细胞外抗原结合结构域包含选自由seq id no:119-162组成的组的氨基酸序列或与之具有90%同一性的序列。
[0766]
45.根据实施方案1-44中任一项所述的car,其中所述细胞外抗原结合结构域包含与seq id no:157具有至少90%同一性的氨基酸序列。
[0767]
46.根据实施方案1-45中任一项所述的car,其中所述细胞外抗原结合结构域包含seq id no:157的氨基酸序列。
[0768]
47.根据实施方案1-46中任一项所述的car,其中所述car包含选自由seq id no:164-207组成的组的氨基酸序列或与之具有90%同一性的序列。
[0769]
48.根据实施方案1-47中任一项所述的car,其中所述car包含与seq id no:202具有至少90%同一性的氨基酸序列。
[0770]
49.根据实施方案1-48中任一项所述的car,其中所述car包含seq id no:202的氨基酸序列。
[0771]
50.一种分离的淋巴细胞,所述分离的淋巴细胞表达根据实施方案1-49中任一项所述的car。
[0772]
51.根据实施方案50所述的分离的淋巴细胞,其中所述淋巴细胞为t淋巴细胞。
[0773]
52.根据实施方案51所述的分离的淋巴细胞,其中所述淋巴细胞为自然杀伤(nk)细胞。
[0774]
53.一种分离的核酸分子,所述分离的核酸分子编码根据实施方案1-49中任一项所述的car。
[0775]
54.一种载体,所述载体包含根据实施方案53所述的核酸分子。
[0776]
55.一种细胞,所述细胞表达根据实施方案53所述的核酸分子。
[0777]
56.一种药物组合物,所述药物组合物包含有效量的根据实施方案50-52中任一项所述的淋巴细胞和药学上可接受的赋形剂。
[0778]
57.一种治疗患有癌症的受试者的方法,所述方法包括:
[0779]
将治疗有效量的根据实施方案50-52中任一项所述的淋巴细胞或根据实施方案56所述的药物组合物施用于所述受试者,由此所述淋巴细胞诱导对所述受试者中的癌细胞的杀伤。
[0780]
58.根据实施方案57所述的方法,其中所述癌症是b细胞淋巴瘤。
[0781]
59.根据实施方案57或实施方案58所述的方法,其中所述癌症是非霍奇金淋巴瘤。
[0782]
60.根据实施方案57-59中任一项所述的方法,其中所述癌症是弥漫性大b细胞淋巴瘤(dlbcl)、套细胞淋巴瘤(mcl)、滤泡性淋巴瘤(fl)、边缘区淋巴瘤(mz)、急性成淋巴细胞性白血病(all)、慢性淋巴细胞白血病(cll)、多发性骨髓瘤(mm)、粘膜相关淋巴组织(malt)淋巴瘤、霍奇金淋巴瘤、伯基特淋巴瘤、毛细胞白血病或浆细胞瘤。
[0783]
61.一种对癌细胞进行靶向杀伤的方法,所述方法包括:
[0784]
使所述癌细胞与根据实施方案50-52中任一项所述的淋巴细胞接触,由此所述淋巴细胞诱导对所述癌细胞的杀伤。
[0785]
62.根据实施方案61所述的方法,其中所述癌细胞是恶性b细胞。
[0786]
63.根据实施方案61或实施方案62所述的方法,其中所述癌细胞是非霍奇金淋巴瘤的细胞。
[0787]
64.根据实施方案61-63中任一项所述的方法,其中所述癌细胞是弥漫性大b细胞淋巴瘤(dlbcl)、套细胞淋巴瘤(mcl)、滤泡性淋巴瘤(fl)、边缘区淋巴瘤(mz)、急性成淋巴细胞性白血病(all)、慢性淋巴细胞白血病(cll)、多发性骨髓瘤(mm)、粘膜相关淋巴组织(malt)淋巴瘤、霍奇金淋巴瘤、伯基特淋巴瘤、毛细胞白血病或浆细胞瘤的细胞。
[0788]
65.一种检测受试者中癌症的存在的方法,所述方法包括:
[0789]
使从所述受试者获得的细胞样品与根据实施方案1-49中任一项所述的car接触,
从而形成car-细胞复合物,以及
[0790]
检测所述复合物,其中检测到所述复合物指示所述受试者中存在癌症。
[0791]
实施例
[0792]
提供以下实施例以进一步描述本文所公开的实施方案中的一些。这些实施例旨在说明而非限制本发明所公开的实施方案。
[0793]
实施例1:cd79b car的构建和慢病毒转导
[0794]
如图1所示构建cd79b特异性car。经由infusion(clontech)将编码scfv序列的gblocks(idt)克隆到具有串联的ef1a启动子和cd8a铰链/跨膜结构域,接着是4-1bb(cd137)和cd3z细胞内结构域的第三代自灭活慢病毒载体骨架中。如下生成car-t细胞:使用pan-t细胞分离试剂盒(stemcell technologies inc.)经由阴性选择分离出原代人t细胞。根据制造商的说明,在补充有100u/ml重组人il-2的texmacs培养基中用transact(miltenyi)(图2a-图2c、图2g-图2i),或在补充有100u/ml il-2(miltenyi)的optimizer培养基中用抗cd3/抗cd28珠粒(dynabeads,invitrogen)(图2d-图2f)刺激1
×
106个细胞。在刺激后24小时用编码car构建体的慢病毒载体转导细胞。在培养的第5天将细胞去珠粒化并且转移至grex(wilson wolf)。将t细胞总共培养12天-14天,之后收获并在cryostor cs10培养基中冷冻。培养期间,每2天-4天更新培养基和细胞因子。使用融合到af647蛋白的重组人cd79b细胞外结构域经由流式细胞术定量cd79b car表达。car+细胞的频率示于图2a-图2i中。
[0795]
实施例2:cd79b car-t细胞介导的肿瘤溶解
[0796]
将冷冻的car-t细胞解冻到texmacs培养基或optimizer培养基中并且用100u/ml重组人il-2(miltenyi)静置过夜。通过将acd79b car-t细胞与指示的靶细胞系以指示的效应子:靶标(e:t)比率(基于car+频率)一起温育16小时-20小时来进行共培养。共培养物一式三份设置。对于图3a,肿瘤细胞在共培养之前用10μm celltraceviolet(ctv)标记。将肿瘤细胞用live/dead可固定近红外(thermo)活力染料在4℃下染色30分钟,并且经由流式细胞术对总的活肿瘤细胞进行定量。对于图3b-图3f,板在设置16-20小时后以400g离心4分钟,并且收获1/2培养物体积获得上清液。按照制造商的说明添加一个体积的promega brightglo荧光素酶底物,并且经由perkin elmer envision对发光进行定量。在每种情况下,溶解%(或杀伤%)如下计算:
[0797]
溶解%=[1-(测试孔中的信号/单独肿瘤孔的信号)]*100
[0798]
结果示于图3a-图3f中。示出了平均溶解%
±
sd。
[0799]
实施例3:cd79b car-t细胞的抗原诱导的细胞因子产生
[0800]
car驱动的细胞因子产生,尤其是il-2,可以促进car-t细胞的持久性并最终促进抗肿瘤功能。为了定量cd79b car-t细胞的细胞因子产生,使用v-plex msd 4-plex(ifng、il-2、tnfa、il-10)(meso scale diagnostics)按照制造商的方案测定依据图3b-图3f收获的上清液。acd79b car-t细胞展现出抗原依赖性细胞因子产生。结果示于图4a-图4d中。示出了平均细胞因子浓度
±
sd(pg/ml)。
[0801]
实施例4:热稳定的scfv car构建体的生成和表征
[0802]
抗cd79b抗体克隆sn8由astsaturov等人鉴定[9]。鼠来源的克隆sn8的人源化通过singh等人,mabs.2015;7(4):778-91中描述的方法进行。以scfv的形式进行人源化,并且将
来自人源化变体的大肠杆菌表达的上清液在60℃下温育15分钟,接着使用elisa针对与重组cd79b的结合进行筛选。
[0803]
表2中提供了含有热稳定的sn8 scfv的示例性car构建体的描述和seq id no。
[0804]
表2.具有sn8热稳定的scfv的car构建体
[0805]
构建体编号描述seq id no1cd9w23-lh752cd9w24-lh763cd9w32-lh774cd9w33-lh785cd9w51-lh796cd9w59-lh807cd9w83-lh818cd9w88-lh829cd9w23-hl9710cd9w24-hl9811cd9w32-hl9912cd9w33-hl10013cd9w51-hl10114cd9w59-hl10215cd9w83-hl10316cd9w88-hl104
[0806]
实施例5:cd79b car的抗原依赖性增殖
[0807]
将acd79b car-t细胞用1μm celltraceviolet(ctv)以1
×
106个细胞/ml,按照制造商的说明(invitrogen)进行标记。将标记的car-t细胞与指示的靶标以1:2的e:t比率共培养4天-5天。e:t比率是基于car+计算的并且通过添加未转导的t细胞,将总t细胞在构建体间归一化。第4天-第5天,收获细胞并用car检测试剂(重组cd79b-af647)和可固定live/dead(invitrogen)进行染色。然后经由流式细胞术分析car+细胞的增殖。在图5a-图5c中,曲线图示出car+细胞的ctv稀释。acd79b car-t细胞在用cd79b+肿瘤系刺激后特异性地表现出ctv稀释,而未针对抗原阴性靶标系表现出ctv稀释,表明抗原依赖性增殖。
[0808]
实施例6:长期细胞毒性测定中肿瘤的cd79b特异性溶解
[0809]
将acd79b car-t细胞与指示的表达红色荧光蛋白(rfp)的靶细胞系并且以指示的效应子:靶标(e:t)比率(基于car+频率)共培养4天-7天。细胞增殖后随时间推移每4小时对每个孔进行成像并且使用incucyte技术计算每孔的总rfp+面积。针对测试的构建体中的每个构建体计算生长抑制(图6)
[0810]
实施例7:carnaval异种移植模型中cd79b car的抗肿瘤活性
[0811]
将carnaval细胞保持在补充有10%胎牛血清(fbs)的rpmi1640中。在第0天在nod/scid/il-2rg-/-(nsg)小鼠中皮下植入5x105个处于对数生长期的carnaval细胞。如先前所述(实施例1)生成car-t细胞(husn8克隆23或cd19 4-1bbz参考car)。
[0812]
当植入后约14天组均肿瘤体积达到约50mm
3-100mm3/只小鼠时,静脉注射指示剂量
的car+t细胞(图7a);添加未转导的car-t细胞以归一化对于每种car施用的car+和总t细胞的数目。每周两次经由卡尺(图7b)测量肿瘤体积,并测量体重(图7c)。husn8克隆23(cd9w23-lh)car在5
×
106个car+细胞的剂量下介导肿瘤完全消退,没有观察到伴随性的体重减轻。
[0813]
实施例8:重组scfv-fc蛋白的生物物理表征
[0814]
将生成的各种scfv与fc融合以生成重组scfv-fc蛋白。进行重组scfv-fc蛋白的生物物理表征,并将结果呈现于下面的表3中。通过分析尺寸排阻色谱技术测量重组scfv-fc蛋白的纯度。
[0815]
通过表面等离子体共振对scfv-fc融合蛋白与人cd79b的结合研究
[0816]
使用biacore 8k仪器通过表面等离子体共振(spr)确定scfv-fc融合蛋白与重组人cd79b同种型-1(长)和同种型-2(短)的结合亲和力。使用山羊抗人fc igg抗体以30-60反应单位(ru)的密度将scfv-fc分子捕获在c1传感器芯片的表面。然后将重组人cd79b抗原在芯片表面上以3.70nm-300nm的浓度注入3倍稀释液,其中缔合时间为3分钟且解离时间为30分钟。通过从空白表面减去分析物结合信号来引用原始结合传感图,并且使用1:1langmuir结合模型,使用iacore insight评价软件分析经处理的传感图,以获得结合动力学和亲和力。
[0817]
差示扫描荧光法(dsf)
[0818]
使用自动化prometheus仪器,通过纳米差示扫描荧光(nanodsf)方法确定重组scfv-fc融合蛋白样品的热稳定性。通过将样品从384孔样品板装载到24孔毛细管中来进行测量。对每个样品执行重复运行。使用prometheus nanodsf用户界面(熔融扫描选项卡)建立运行的实验参数。典型igg样品的热扫描范围为20℃至95℃,速率为1℃/分钟。双uv技术监测在330nm和350nm发射波长下的固有色氨酸和酪氨酸荧光,并且将该比率(f350nm/f330nm)相对于温度进行绘图以生成拆解曲线。使用背向反射技术,仪器测量聚集的起始温度,将起始温度相对于温度按mau(毫衰减单位)进行绘图。nanodsf用于测量在ph 7.4的磷酸盐缓冲盐水(pbs)中0.5mg/ml浓度的scfv-fc样品的热去折叠参数(tm和t
agg
)。
[0819]
通过自相互作用纳米颗粒光谱法测量的scfv-fc融合蛋白的自缔合
[0820]
亲和力捕获自相互作用纳米颗粒光谱法(ac-sins)用于测量scfv-fc候选物自相互作用的倾向。对自相互作用的倾向可能是car-t表达和在细胞表面上的稳定性的预测标志。在该测定法中,金纳米颗粒(aunp)涂覆有山羊抗人igg(h+l)捕获抗体,并且随后在多克隆山羊igg的存在下与候选scfv-fc一起温育。自缔合的任何候选scfv-fc继而使aunp靠近,导致纳米颗粒等离子波长(λ
p
),也称为最大吸光度下的波长(λ
max
)的偏移。每种候选scfv-fc的偏移大小(δλ
max
)指示其自缔合的强度。
[0821]
通过表面等离子体共振进行非特异性结合评估
[0822]
通过生物传感器技术确定抗体与无关带电蛋白质和多克隆igg的非特异性结合。scfv-fc通过涂覆有无关蛋白质(诸如,大豆胰蛋白酶抑制剂、溶菌酶、β防御素、汇集的人igg、整合素a4b7、plbl2)的表面等离子体共振(spr)表面。如果抗体显示出与这些表面的显著非特异性结合,则这种结合可能转为不良药代动力学(pk)和生物分布,以及car-t细胞表面上scfv的次优表达。表3中提供了重组scfv-fc融合蛋白的生物物理特性的描述。
[0823]
表3.重组scfv-fc蛋白的生物物理表征
[0824][0825][0826]
实施例9:不存在抗原的情况下的基础细胞因子产生
[0827]
在不存在抗原的情况下,基础细胞因子的分泌可以指示car的潜在强直信号传导。为了针对这种特性进行筛选,将如先前所述生成的car-t细胞解冻并在完全培养基(37℃、5%co2)中静置过夜。次日,对细胞进行计数,以每孔50,000个car+细胞的密度一式三份地平板接种并且在不存在抗原的情况下温育过夜。经由添加未转导的细胞,跨条件对每个孔的t细胞总数进行归一化。在过夜培养后收集培养上清液,并且经由meso scale discovery(msd;v plex proinflammation panel 1[人]试剂盒)根据制造商的说明对细胞因子进行定量。使用msd工作台程序执行数据分析,并且使用graphpad prism将每个供体的结果绘制为平均值
±
sem(两个独立实验,技术一式三份)。结果示于图8a-图8c中。在不存在抗原或细
胞因子刺激的情况下没有检测到car转导的培养物中基础细胞因子表达升高的证据,与缺乏强直信号传导一致。
[0828]
实施例10:在不存在抗原的情况下的增殖
[0829]
来自car的强直信号传导可以在不存在抗原的情况下驱动基础增殖。为此,通过执行五天增殖测定,针对基础增殖来筛选441-hl car-t细胞。将car-t细胞解冻并在完全培养基(37℃、5%co2)中静置过夜。次日,对细胞进行计数,并且经由添加未转导的细胞对每个供体进行car+百分比归一化。根据制造商的说明,用5mm的cell trace
tm
violet(ctv)染料标记细胞。标记后,将car-t细胞稀释到5
×
105个活car+t细胞/ml。将细胞添加到96孔圆底板中(每孔100μl)并且使其在不存在靶细胞和细胞因子刺激的情况下生长。作为对照,收获靶阳性细胞(carnaval)和靶阴性细胞(k562),计数,并在完全培养基中稀释到5
×
105个活细胞/ml,并将其添加到相应孔中(每孔100μl)以得到1:1的car+效应子:靶标(e:t)。将板在37℃、5%co2下温育五天。在第五天,通过流式细胞术,对cd3的门控,接着通过car分析细胞。使用ctv染料稀释(pacific blue channel)和cd71标志物表达来分别确定增殖(图9a)和活化(图9b)car-t细胞的百分比。在五个供体中,在不存在抗原或细胞因子刺激的情况下,没有441-hl car-t进行异常增殖或活化的证据。
[0830]
实施例11:基于流式细胞术的细胞毒性
[0831]
在五个cd79b/cd19+细胞系(hbl-1、oci-ly-10、carnaval、will-2和jeko-1)和五个cd79b/cd19
–
细胞系(k562、hly-1、su-dhl-1、hl-60和jurkat e6.1)的小组中使用基于流式细胞术的测定法测试441-hl car-t细胞的作用。该小组中包括工程化为表达cd79b的k562细胞作为抗原特异性杀伤的附加对照。
[0832]
将441-hl car-t、cd19 car-t或utd细胞解冻并在完全培养基(37℃、5%co2)中静置过夜。次日,对细胞进行计数并且经由添加未转导的细胞对每个供体进行car+细胞百分比的归一化。对于2.5:1的起始car效应子:靶标(e:t)比率(最高稀释度下2.5
×
104个car+细胞),将car-t细胞以5x105个car+细胞/ml的浓度重悬。制备总共八份两倍稀释液(比率为2.5:1,2.5
×
104个car+细胞;比率为1.25:1,1.25
×
104个car+细胞;比率为1:1.6,6.25
×
103个car+细胞;比率为1:3.2,3.13
×
103个car+细胞;比率为1:6.4,1.56
×
103个car+细胞;比率为1:13,7.81
×
102个car+细胞;比率为1:26,3.91
×
102个car+细胞;以及,比率为1:51,1.95
×
102个car+细胞)并且根据平板布局将100μl效应细胞接种在96孔圆底板中。
[0833]
接下来,收获靶细胞系,计数并以400万个细胞/ml重悬于杜尔贝科磷酸盐缓冲盐水(dpbs)中。按照制造商的说明,用1mm的cell trace
tm
violet(ctv)标记肿瘤靶标。将标记的靶细胞在完全培养基中稀释至2
×
105个活细胞/ml,并且将100μl标记的细胞添加到含有car-t细胞的96孔板中(每孔2x104个活细胞)。将板温育(37℃、5%co2)大约24小时。
[0834]
24小时后,用可固定活力染料efluor
tm
660(thermo fisher scientific,65-0864-14)按照制造商的说明对细胞进行染色。经由流式细胞术通过以下方式评估肿瘤细胞死亡:通过前向散射和侧向散射门控以鉴定细胞群体;然后进行live/dead门控以鉴定活细胞;并且,最后进行ctv+肿瘤事件门控以评估每个孔中活癌细胞的数目。使用下式计算癌细胞杀伤的百分比(基于绝对计数):
[0835]
[0836]
对于每个car+e:t比率,将数据绘制为平均杀伤%+/-sem(3个单独实验)。生成五个供体的合并图(cd79b/cd19+细胞的图10a-图10c和cd79b/cd19
–
细胞的图10d-图10f),以及示出每个供体的单独杀伤曲线的曲线图(cd79b/cd19+细胞的图10g-图10l和cd79b/cd19
–
细胞的图10m-图10r)。在cd79b/cd19+靶细胞系的存在下,可以在测试的所有供体中实现抗原特异性癌细胞杀伤。在任何靶阴性细胞系的存在下均未能观察到特异性杀伤。
[0837]
实施例12:基于的细胞毒性
[0838]
利用技术,在两个cd79b/cd19+(hbl-1、oci-ly-10)和两个cd79b/cd19
–
(hly-1、su-dhl-1)mkate2表达细胞系的小组中评估441-hl car-t的杀伤动力学。
[0839]
将441-hl car-t、cd19 car-t或utd细胞解冻并在完全培养基(37℃、5%co2)中静置过夜。次日,对细胞进行计数并且经由添加未转导的细胞对每个供体进行car+细胞百分比的归一化。然后将归一化的car-t细胞以2.5
×
105个car+细胞/ml的浓度重悬于无酚红的培养基中以获得2.5:1的起始car+e:t比率。制备总共八份2倍稀释液(比率为2.5:1,2.5
×
105个car+细胞;比率为1.25:1,1.25
×
105个car+细胞;比率为1:1.6,6.25
×
104个car+细胞;比率为1:3.2,3.13
×
104个car+细胞;比率为1:6.4,1.56
×
104个car+细胞;比率为1:13,7.81
×
103个car+细胞;比率为1:26,3.91
×
103个car+细胞;以及,比率为1:51,1.95
×
103个car+细胞)并且根据平板布局将效应细胞接种在96孔板中(每孔100μl)。
[0840]
接下来,收获靶细胞系,计数,以1x105个细胞/ml重悬于无酚红的培养基中,并且根据平板布局接种(每孔100μl)。
[0841]
在混合靶细胞和car-t细胞之后,在384孔板中分配来自每个孔的80μl,一式两份。接种后,将共培养物放置在zoom活内涵成像系统中,并且用4x物镜(单个图像)每四小时在两相和荧光通道中自动获取图像,持续四天至六天。使用zoom软件基于mkate2红色荧光蛋白表达,使用优化的过程定义参数检测靶细胞。为了测量每孔靶细胞的水平,定量总红色面积,并将原始值导出到excel。为了随时间推移定量癌细胞杀伤,将每个重复的平均值导出到graphpad prism并针对每种条件导出曲线下面积(auc)。在将数据归一化到未处理的对照之后(单独的靶标),将e:t比率相对于auc值绘制为剂量反应。生成五个供体(两个独立实验)的合并值(平均值
±
sem)或单独值的图。在图11a中示出了cd79b/cd19+细胞的合并结果并且在图11b中示出了cd79b/cd19
–
细胞的合并结果。在图11c-图11d中示出了cd79b/cd19+细胞的显示每个供体的单独杀伤曲线的曲线图并且在图11e-图11f中示出了cd79b/cd19
–
细胞的该曲线图。
[0842]
在抗原阳性细胞系的存在下检测到特异性杀伤,而在抗原阴性模型中没有观察到杀伤。
[0843]
实施例13:细胞因子释放测定
[0844]
为了评估car-t细胞杀伤后的细胞因子释放水平,在上述基于流式细胞术的杀伤测定期间收集来自四个cd79b/cd19+细胞系(hbl-1、oci-ly-10、carnaval、will-2)和两个cd79b/cd19
–
细胞系(hly-1和su-dhl-1)的上清液,并且通过meso scale discovery(msd)进行测试。将上清液解冻并且使用msd板(v plex proinflammation panel 1[人]试剂盒)经由制造商的说明进行分析。使用msd discovery workbench程序执行数据分析,并且使用
treatment of non-hodgkin lymphoma.blood 110,616-623(2007).
[0856]
8.palanca-wessels,m.c.a.et al.safety and activity of the anti-cd79b antibody
–
drug conjugate polatuzumab vedotin in relapsed or refractory b-cell non-hodgkin lymphoma and chronic lymphocytic leukaemia:a phase 1study.the lancet oncology 16,704-715(2015).
[0857]
9.astsaturov,i.a.et al.differential expression of b29(cd79b)and mb-1(cd79a)proteins in acute lymphoblastic leukaemia.leukemia 10,769-773(1996).
[0858]
本文引用的所有专利、已公布的专利申请和参考文献的教导内容全文以引用方式并入。
[0859]
虽然已经具体示出和描述了示例的实施方案,但是本领域的技术人员应当理解,在不脱离所附权利要求书所涵盖的实施方案的范围的前提下,可以在其中进行形式和细节上的各种改变。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1