微工程组织屏障系统的制作方法
本发明涉及一种用于模拟生物体内组织屏障及功能的微流体装置。具体而言,涉及一种模拟二维-三维结缔组织屏障或三维组织屏障的结构及功能,从而可替代动物模型用作用于新药开发及毒性评价等的模型的微流体装置、微流体装置内细胞培养方法及利用微流体装置的器官或脏器的模拟方法。
背景技术:
1、为解决因使用用于检查药物的功效及副作用的实验动物模型导致的伦理问题及不同种类之间的差异引起的问题,开发出将脏器组织集成为芯片形式的器官芯片(organ-on-a-chip)。器官芯片为在小芯片上培养构成脏器的细胞,以模拟该脏器的形状及生理特性,从而实现所需功能的技术。利用器官芯片可详细研究特定脏器的细胞活动及微环境中物理化学反应的机制,可用作用于新药开发及毒性评价等的模型。
2、在器官芯片的开发中,利用现有的二维(two-dimensional(2d))细胞培养的细胞培养模型,因利用培养皿(petri dish)在器皿底部二维培养细胞,存在无法说明许多细胞类型的组织特异分化功能(tissue-specific differentiated functions)或无法准确预测生物体内(in vivo)的组织功能和药物活性度的问题。
3、尤其是,在具备于生物体内进行三维接触的神经(neuron)、星形细胞(astrocyte)等的脑组织的情况下,因受到上述二维细胞培养模型的限制,对能够很好地模拟活体组织的空间结构和生物化学复杂性的三维细胞培养模型的需求很高。
4、三维细胞培养模型因很好地模拟生物体内状态(situation),在体外实验中能够实现定向生长和细胞间连接的复杂性,在研究分子基础(molecular basis)的组织功能方面,较之二维细胞培养模型有利于更好地捕捉各种疾病状态的信号通路(signalingpathway)和药物反应(drug responsiveness)。
5、另外,与半导体工程技术一同发展的微流体工程技术,能够以高准确度大量生产具备微单位的规格的结构体。尤其是,光刻及软光刻技术可通过利用半永久模具的冲压(stamping)容易生产微通道结构,从而尝试通过上述技术在体外模拟人体的血管或脏器的细胞层等微结构。
6、现有的研究利用光刻及软光刻技术制作由聚二甲基硅氧烷(pdms)微通道和多孔膜构成的芯片,并通过在芯片内部的细胞培养实现脏器的细胞层结构。但是,利用由pdms材质制作的微流体装置的器官芯片,经常发生药物或蛋白质被pdms表面吸收消失的情况,存在难以用在实际制药产业的限制。
7、因此,本发明人开发出改善利用现有的微流体装置的器官芯片的问题,更相似地模拟生物体内二维-三维结蹄组织屏障或三维组织屏障的结构及功能微流体装置,由此完成本发明。
8、【现有技术文献】
9、【非专利文献】
10、(非专利文献1)cho,h.et al.three-dimensional blood-brain barrier modelfor in vitro studies of neurovascular pathology.sci.rep.5,15222(2015).
11、(非专利文献2)booth,r.&kim,h.characterization of a microfluidic invitro model of the blood-brain barrier(mu bbb).lab chip 12,1784–1792(2012).
技术实现思路
1、要解决的课题
2、本发明的目的在于克服使用实验动物模型导致的伦理问题及不同种类之间的差异引起的问题,提供一种形成二维-三维结蹄组织屏障或三维组织屏障,从而较之现有的器官芯片(organ-on-a-chip),表现出与生物体内组织屏障更相似的结构及功能的微流体装置。
3、课题解决方案
4、本发明提供一种微流体装置,包括:嵌件,包括第一中心通道;底座,包括第二中心通道、第三侧面通道、第四侧面通道、连接第二中心通道和第三侧面通道的第五通路通道,及连接第二中心通道和第四侧面通道的第六通路通道;及多孔膜,位于所述嵌件和所述底座之间。
5、本发明提供一种微流体装置内细胞培养方法,包括:组装微流体装置的步骤;将第二细胞注入第二中心通道之后,翻转微流体装置进行培养的步骤;将包含第三细胞的水凝胶注入第二中心通道之后,进行培养的步骤;及翻转微流体装置之后,将第一细胞注入所述第一中心通道进行培养的步骤。
6、另外,本发明提供器官或脏器的模拟方法,作为利用所述微流体装置模拟器官或脏器的结构及功能的方法,包括:将第一流体灌流至第一中心通道的步骤;及将第二流体灌流至第三侧面通道、第二中心通道及第四侧面通道的步骤。
7、发明效果
8、本发明的微流体装置通过模拟包括血脑屏障在内的生物体内各种组织屏障的主要结构及物质移动现象,用于药物功效评价。
9、本发明的微流体装置可实现对组织屏障周边的纳米粒子分布的精确量化,嵌件可从底座拆装,从而可无损选择性分离包含于微流体装置内的细胞用于分析。另外,在将嵌件从底座分离,进行药物涂布等必要处理之后,重新组装观察细胞反应。
10、本发明的微流体装置可三维培养细胞,实现生物体内细胞的空间结构和生物化学复杂性,从而能够更好地模拟组织屏障的结构及功能。
11、附图概述
12、在所有附图中,以下标记用于标识特定特征。
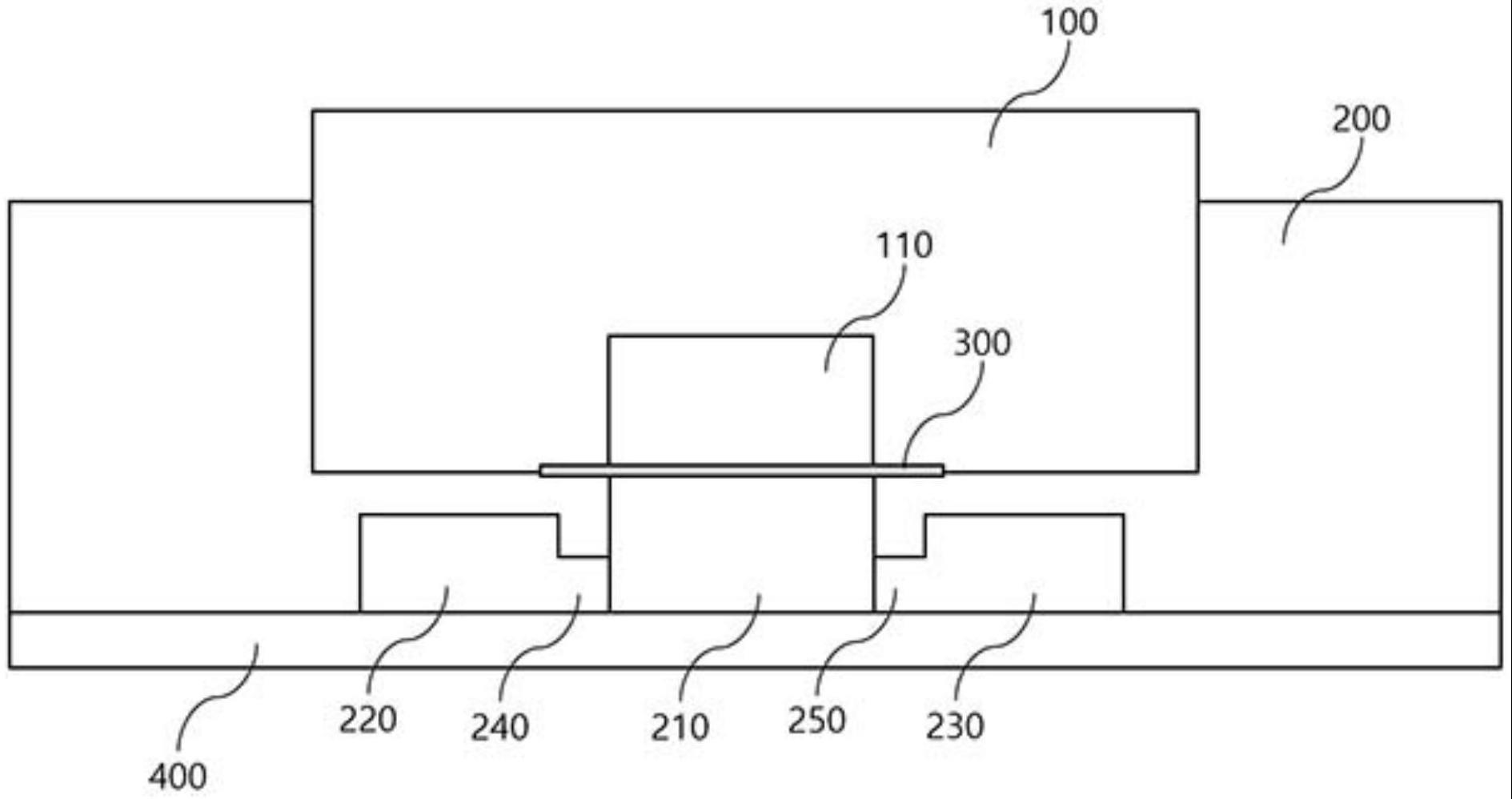
13、100:嵌件
14、101:第一结合头
15、110:第一中心通道
16、111:第一细胞
17、112:第一中心通道入口
18、113:第一中心通道出口
19、200:底座
20、201:嵌件插入槽
21、202:第二结合头
22、210:第二中心通道
23、211:第二细胞
24、212:第三细胞
25、213:水凝胶
26、214:第二中心通道入口
27、215:第二中心通道出口
28、220:第三侧面通道
29、221:第三侧面通道入口
30、222:第三侧面通道出口
31、230:第四侧面通道
32、231:第四侧面通道入口
33、232:第四侧面通道出口
34、240:第五通路通道
35、250:第六通路通道
36、260:第七通路通道
37、270:第八通路通道
38、280:第一流体储藏室
39、290:第二流体储藏室
40、300:多孔膜
41、400:底部
42、500:盖子
43、501:盖子内第一中心通道入口
44、502:盖内第一中心通道出口
45、图1为微流体装置的截面图。
46、图2为微流体装置的截面图。
47、图3为微流体装置的透视图。
48、图4为微流体装置的分解图。
49、图5为微流体装置的结合图。
50、图6为包含细胞及水凝胶的微流体装置的截面图。
51、图7为包含细胞及水凝胶的微流体装置的截面图。
52、图8为表示嵌件和底座的拆装结构的截面图。
53、图9为表示嵌件和底座的拆装结构及拆装方法的截面图。
54、图10为表示嵌件和底座的拆装结构及拆装方法的截面图。
55、图11为表示微流体装置的底座内流体流动的截面图。
56、图12为嵌件的斜视图。
57、图13为嵌件的斜视图。
58、图14为底座的斜视图。
59、图15为底座的平面图。
60、图16为底座的底面图及放大底面图。
61、图17为盖子的斜视图。
62、图18为表示嵌件和底座的拆装结构及拆装方法的斜视图及截面图。
63、图19为嵌件和底座附着的形式的微流体装置的平面图。
64、图20为图19的嵌件和底座附着的形式的微流体装置的a-a’截面图及放大截面图。
65、图21为嵌件和底座附着的形式的微流体装置的正面图。
66、图22为嵌件和底座附着的形式的微流体装置的底面图及放大底面图。
67、图23为包含盖子的微流体装置的斜视图。
68、图24为表示包含于嵌件的微通道内的流体流动的斜视图。
69、图25为表示包含于底座的微通道内的流体流动的截面图。
70、图26为表示将人脑微血管内皮细胞(hbmec)、人脑血管周皮细胞(hbvp)或人星形细胞(ha)培养于作为各自的培养基的内皮培养基(e)、周皮细胞培养基(p)或星形细胞培养基(a)中的情况和培养于作为混合培养基的e+g(e+a+m)培养基中的情况下的细胞形态的示意图。
71、图27为表示将人脑微血管内皮细胞(hbmec)、人脑血管周皮细胞(hbvp)或人星形细胞(ha)各培养于内皮培养基(e)、星形细胞培养基(a)、周皮细胞培养基(p)、小胶质培养基(m)、e+g+p(e+a+m+p)培养基或e+g(e+a+m)培养基中的情况下的细胞活性度的曲线图。
72、图28为表示将人脑微血管内皮细胞(hbmec)、人脑血管周皮细胞(hbvp)或人星形细胞(ha)各培养于作为混合培养基的e+g(e+a+m)培养基或e+g+p(e+a+m+p)培养基或中的情况下的细胞活性度的曲线图。
73、图29为表示微流体装置内细胞培养方法的模式图。
74、图30为表示在人脑微血管内皮细胞(hbmec)单一培养和血脑屏障(bbb)模拟微流体装置中的血脑屏障特异蛋白的表达水平的rt-qpcr结果的热图(heat map)(n=3)。
75、图31为表示在人脑微血管内皮细胞(hbmec)单一培养和血脑屏障(bbb)模拟微流体装置中的血脑屏障特异连接蛋白(junctional proteins)的基因表达水平的曲线图(n=3,*p<0.05by student t-test)。
76、图32为表示在人脑微血管内皮细胞(hbmec)单一培养和血脑屏障(bbb)模拟微流体装置中的血脑屏障特异受体蛋白(receptor proteins)的基因表达水平的曲线图(n=3,*p<0.05by student t-test)。
77、图33为表示在人脑微血管内皮细胞(hbmec)单一培养和血脑屏障(bbb)模拟微流体装置中测量的跨内皮电阻(teer)值的曲线图(n=11(ec),n=12(bbb),**p<0.01bystudent t-test)。
78、图34为表示在血脑屏障(bbb)模拟微流体装置中测量的根据血液模拟流动的剪应力差异的跨内皮电阻(teer)值的曲线图(n=5(无剪切),n=4(0.4dyne cm2),n=12(4dynecm2),*p<0.05by student t-test)。
79、图35为表示在无细胞(no cell)、人脑微血管内皮细胞(hbmec)单一培养及血脑屏障(bbb)模拟微流体装置中测量的渗透系数(p)的曲线图(n=4,*p<0.05,****p<0.001vs.no cell,#p<0.05,##p<0.01vs.ec,student t-test)。
80、图36为表示在2d基质凝胶(matrigel)涂层表面上培养的人星形细胞(ha)的形态及在3d基质凝胶内部培养的人星形细胞(ha)的形态的示意图。
81、图37为比较在2d基质凝胶(matrigel)涂层表面及3d基质凝胶内部培养的人星形细胞(ha)的细胞体大小的曲线图。
82、图38为比较在2d基质凝胶(matrigel)涂层表面及3d基质凝胶内部培养的人星形细胞(ha)的突起长度的曲线图。
83、图39为比较在2d基质凝胶(matrigel)涂层表面及3d基质凝胶内部培养的人星形细胞(ha)中的gfap、vim及lcn2的表达水平的曲线图(n=4,***p<0.005,****p<0.001bystudent t-test)。
84、图40为比较根据对在2d基质凝胶(matrigel)涂层表面培养的人星形细胞(ha)进行处理的il-1β浓度的lcn2表达水平的曲线图。
85、图41为比较根据对在3d基质凝胶内部培养的人星形细胞(ha)进行处理的il-1β浓度的lcn2表达水平的曲线图。
86、图42为表示将星形细胞培养于2d基质凝胶(matrigel)涂层表面的情况下的aqp-4及α-syn表达的示意图(scale bars=50μm(2d),20μm(3d))。
87、图43为表示将星形细胞培养于3d基质凝胶内部的情况下的aqp-4及α-syn表达的示意图(scale bars=50μm(2d),20μm(3d))。
88、图44为表示只培养人星形细胞(ha)的情况(a)、一同培养人心性细胞(ha)和人脑微血管内皮细胞(hbmec)的情况(e+a)及一同培养人脑微血管内皮细胞(hbmec)、人脑血管周皮细胞(hbvp)及人星形细胞(ha)的情况(e+p+a)下的aqp-4极化水平的曲线图(n=4,*p<0.05by student t-test)。
89、图45为表示合成的ehnp-a1的大小分布的曲线图。
90、图46为定量表示生物体内各器官中相对ehnp-a1分布的曲线图(mean±s.e.m,n=4)。
91、图47为表示脑中的ehnp-a1分布的示意图。
92、图48为表示包含各从第一中心通道(vascular channel)抽样的ehnp-a1的培养基的相对荧光强度的曲线图(n=12;**p<0.01by student t-test,mean±s.e.m.)。
93、图49为表示包含各从中心通道(perivascular channel)抽样的ehnp-a1的培养基的相对荧光强度的曲线图(n=5,)。
94、图50为表示第一中心通道(vascular)、人脑微血管内皮细胞(hbmec)及第二中心通道(perivascular)的ehnp-a1分布的曲线图。
95、图51为对显示阳性的人脑微血管内皮细胞(hbmec)、人星形细胞(ha)及人脑血管周皮细胞(hbvp)的数量的facs(fluorescence-activated cell sorting)图。
96、图52对图51中观察到的细胞部分进行量化的图。
- 还没有人留言评论。精彩留言会获得点赞!