检测SARS-COV-2的方法和设备与流程
检测sars-cov-2的方法和设备
技术领域
1.本发明涉及检测靶核酸序列是否存在的方法。
背景技术:
2.聚合酶链式反应可以用于增加特定dna片段的拷贝数以检测该片段的存在,和/或可以用于量化该片段或用于进一步的例如增加dna量的最终用途。
3.为此,其使用对应于正向引物和反向引物的两个寡核苷酸序列,这两个寡聚核苷酸序列被寻址到一个靶序列的开始位置和结束位置。正向引物和反向引物与双链dna的互补链结合。聚合酶链式反应利用温度在互补链和引物寡核苷酸之间产生杂交和变性循环,以及激活和抑制聚合酶活性的循环。
4.在pcr中,存在特定温度水平序列的重复循环(也称为热循环)。典型的pcr反应经过30-40个循环。在pcr过程中,会产生许多由反向引物和正向引物限定的起始模板dna序列的拷贝。如果引物与模板序列结合,它们会扩增(制造许多拷贝)引物边界的核酸片段。对双链dna敏感的dna结合染料用于识别成功的扩增;或者初始淬灭的探针(例如taqman)在dna上存在特定序列的情况下发出荧光(fluoresce)。pcr的产物通过凝胶电泳或嵌入荧光染料进行确认,在这种情况下,荧光强度与扩增序列的量相关。
5.对于大多数pcr应用,实际上不需要以将dna片段的扩展许多拷贝而结束。仅针对片段的初始拷贝数的存在或量化进行pcr,如在定量pcr(qpcr)中。然而,这种pcr扩增会导致额外的限制。例如,在大多数情况下无法实现高特异性的扩增。在qpcr中,使用dna嵌入染料只能检测双链dna的存在。此外,在许多情况下,引物对充当了彼此放大不需要的副产物的模板。为了防止这些非特异性伪影,已经开发了诸如taqman探针之类的方法。该方法需要设计与生成序列的特定区域互补的附加探针,其中荧光团连接到一侧,淬灭剂连接到另一侧,从而为整个反应增加了另一个级别的复杂性。taqman或类似方法特定于所生成的序列,但在实际靶序列和序列长度方面有不同的要求,从而增加了复杂性。
6.大多数病毒感染(例如冠状病毒)目前没有治愈方法或疫苗。早期有效的检测对于对抗这些病毒流行至关重要。世界卫生组织建议采取多种措施的组合:快速诊断并立即隔离病例,对密切接触者进行严格跟踪和预防性自我隔离。详尽的筛查允许早期诊断可用于有效隔离受感染的个体并帮助防止病毒传播。由于具有高度传染性的病毒感染,缺乏足够的检测会导致病毒迅速传播并导致出现症状的人住院,从而导致重大的人员和经济损失。
7.因此,需要用于在被测试个体的护理点检测核酸的改进方法。
技术实现要素:
8.本文提供了用于检测和/或量化样品中存在核酸序列的方法,该方法包括:
9.提供一种延伸混合物,该延伸混合物包含:(i)聚合酶,(ii)atp再生酶,(iii)发光酶(例如,萤火虫荧光素酶),(iv)来自样品的模板核酸,(v)与特定靶核酸序列杂交(例如互补)的引物-探针,以及(vi)聚合酶-atp再生酶-发光试剂溶液,所述试剂溶液具有用于对生
长中的核酸链进行模板定向延伸合成的组分。其中,所述试剂溶液包括:atp再生酶底物(例如,通过atp硫化酶的aps;通过agppase的adp-葡萄糖;通过ppdk的amp+pep等);发光底物;以及多种类型的dntp或核苷酸类似物,其中每种类型的核苷酸类似物具有能够被聚合酶切割的离去基团,其中在各核苷酸类似物聚合酶依赖性地结合模板链时离去基团被切割;
10.进行核酸延伸合成,使得如果引物-探针与靶核酸序列杂交,则一个或多个核苷酸类似物被顺序添加到模板中,由此:a)核苷酸类似物与聚合酶结合,b)当核苷酸类似物上的离去基团被聚合酶切割时,核苷酸类似物被聚合酶掺入模板链上,其中通过atp再生酶(例如,通过atp硫化酶的aps;通过agppase的adp-葡萄糖;通过ppdk的amp+pep等)产生atp将离去基团与atp再生酶底物结合,然后c)将atp与发光酶结合,其中在再生各离去基团时发光底物被发光酶催化产生发光(luminescence);以及
11.在发生核酸合成时检测来自发光的光,由此检测到的光指示存在特定靶核酸序列。发射的发光可以由适当的光学传感器和/或检测设备检测。
12.靶核酸检测是依靠于查询引物-探针的结合和链延伸反应的启动,通过检测每次将核苷酸添加到互补链时产生的发光(揭示了存在靶)来实现的。如果靶核酸不存在,则引物-探针将不会结合,不会引发链延伸,也不会检测到发光。因此,如果存在靶核酸,它将被引物-探针引发链延伸所结合。在本文称为通过dna链连续延伸的发光扩增(laces)方法的实施方式中,每个特定的核苷酸连接物将产生可以被光学传感器/检测器检测到的发光(例如,可检测的光)信号。因此,可轻松快速地产生可检测的光信号,可以在合适的护理点(poc)设备中检测到(图1)。
13.本文提供的本发明laces方法用于检测靶核酸片段的存在和拷贝数的定量。它在反应混合物中使用询问引物(例如,引物-探针)寡核苷酸。当引物-探针序列与模板序列杂交时,聚合酶结合在双链末端。随着发生通过聚合酶的互补链的延伸,焦磷酸盐(ppi)作为离去基团被释放。使用根据本发明的酶系统(atp硫化酶、ppdk、agppase等),ppi被转化为atp。该生成的atp与荧光素一起被荧光素酶利用,产生发光,从而再次释放焦磷酸离去基团(ppi)。这种释放的焦磷酸盐可以被atp生成酶再循环以形成atp,以供荧光素酶再次使用以产生另一个发光事件,从而产生以焦磷酸盐运行多次的酶循环。随着聚合酶通过链延伸将更多的核苷酸连接到模板核酸上,更多的这些产生发光的酶循环被合并到总发光中,这有效地放大了由于互补链的延伸而产生的可检测光;从而检测和/或定量被询问的靶核酸序列的存在。
14.在另一个实施方式中(如图11所示),荧光标记连接到核苷酸的末端磷酸(或焦磷酸离去基团上的另一个区域;ppi)。这种荧光标记的激发光谱至少部分与荧光素氧化产生的发光相匹配。该标记的核苷酸还可以任选地包括淬灭剂分子(可移除或不可移除地连接到核苷酸的碱基或糖上),其吸收光谱与荧光标记(连接到核苷酸的末端磷酸)的发射光谱重叠。用荧光标记和淬灭剂修饰的核苷酸在本文中称为淬灭核苷酸。因此,在核苷酸类似物与聚合酶相互作用时,聚合酶释放带有荧光团的焦磷酸盐(标记的焦磷酸盐),从而将荧光标记与淬灭剂分离。当分离时,淬灭剂将不能吸收荧光标记的发射光。然后标记的焦磷酸盐与生成atp酶发生反应并转化为现在被相同荧光标记标记的atp(标记的atp)。然后,这种标记的atp将与荧光素酶相互作用,产生发光并释放标记的焦磷酸盐。产生的发光激发标记焦磷酸盐上的荧光标记,激发的荧光团在其特定发射范围内发光。产生的淬灭核苷酸对聚合
酶具有提高的特异性,使得在荧光标记发射光谱范围内产生的光增加了生成的信号的特异性;因为已经掺入的核苷酸与背景中未与聚合酶反应的其他核苷酸不同。对于该实施方式,每个核苷酸可以用相同的标记或不同的标记进行标记。
15.在另一实施方式中,本文称为通过链的连续延伸(faces)进行的荧光激活,淬灭的核苷酸用于仅包括聚合酶的系统中(图12)。在这种情况下,使用外部光源来激发荧光团。当淬灭的核苷酸与阳性样品靶模板核酸链上的聚合酶反应时,标记的焦磷酸盐被释放,产生与模板链上连接的核苷酸数量成比例的荧光信号。也即是,荧光信号与链延伸长度成正比。由于荧光标记与淬灭剂分子非常接近,未掺入延伸链中的淬灭核苷酸即使在激发下也不显示任何发射光。这些未掺入的核苷酸的荧光发射将被淬灭,从而实现低量至0量的背景。
16.本发明的信号扩增核酸序列检测和/或量化方法的优点是检测特定序列而不需要温度循环或dna拷贝数的显著增加。使用本发明的方法,在某些实施方式中,dna杂交产生的光被酶循环进一步放大,将每个信号转化为导致链延伸发光的许多酶促事件,而不是拷贝数的指数增加。
17.本文提供的本发明光信号检测方法的另一优点是它们在提供可检测的、可操作的信号方面比pcr快得多。例如,典型的pcr通常有多达30-40个循环,其中每个循环需要几分钟才能完成,导致总运行持续时间至少为一到几个小时。可以做更短的运行的pcr,但放弃特异性;那些较短的运行案例在引物、探针和模板配置方面非常有限。相比之下,本发明的用于检测和/或定量靶核酸序列(例如,laces和faces)的光信号检测方法开始于一旦延伸(例如在放大环被接合的laces反应中)开始就产生可检测信号。相对于稍后的信号,非常早(例如,在几分钟内等)产生的初始信号是最高和最特定的信号。因此,laces产生的信号的演变可以是用一个快速的初始上升,然后是一个长的衰减来描述的;而对于定量pcr,定量pcr是在许多循环和更长的时间范围后变得可检测到,最终达到平台期的指数增长。更具体地说,与qpcr相比,laces在初始快速上升期提供了非常特定的信号,而不会放弃特异性。
18.例如,在本发明的特定实施方案中,单个聚合酶或多个聚合酶被限制在核酸链延伸反应混合物中(例如,在大体积反应中或在单个液滴中),其中聚合酶不受外部光激发,以产生待检测的dntp掺入信号。
19.在特定实施方式中,所公开的发明是一种基于将特异性询问(interrogating)引物-探针与靶序列杂交并监测由各个聚合酶依次掺入dntp引起的可检测光信号(例如,发光、荧光等)来检测特定靶核酸的技术。例如,在一个具体实施方式中,本发明包括这样的过程:其中每次聚合酶掺入与模板互补的dntp或核苷酸类似物时,焦磷酸离去基团(ppi)引起在掺入过程中产生的可检测的光(例如,发光和/或荧光等)信号,其中这种可检测的光(例如,发光和/或荧光等)信号是通过如本文所述的由酶基于发光引起的。也即是,在这些实施方式中,ppi(或ppi+fl)离去基团引起发光,从而针对该特定dntp在有限的时间内发射可检测的光信号。在下一次dntp掺入中该过程重复(图1)。
20.更具体地,每次聚合酶将脱氧核糖核苷三磷酸(dntp)核苷酸类似物掺入与模板dna互补的链时,产生可检测的光(例如,发光和/或荧光)信号。dntp有五种类型,即脱氧腺苷三磷酸(datp)、脱氧鸟苷三磷酸(dgtp)、脱氧胞苷三磷酸(dctp)、脱氧胸苷三磷酸(dttp)和脱氧尿苷三磷酸(dutp)。在核苷酸类似物与先前连接的核苷酸类似物的3’部分完成连接后,可以通过适合的光学传感器和/或检测设备检测如本文所述的由进入“聚合酶-atp再生
酶-荧光素酶”3-酶反应的离去基团产生的可检测光信号(例如,发光和/或荧光)。也即是,每个掺入模板链的dntp都会产生可检测的光脉冲。
21.在其他实施方式中,在本发明的核酸延伸合成反应中,通过离去基团产生的可检测的光信号(例如,发光和/或荧光)被放大,或者通过以有效地增加atp再生酶/荧光素酶放大环的信号强度的辅酶a与荧光素酶的比例将辅酶a添加到链延伸混合物中,atp再生酶/荧光素酶放大环的信号强度被增加。
22.本文还提供了通过电调制富集的目标富集方法,本文称为teem方法。本发明的用于从含核酸的样品中富集或分离靶核酸的teem方法,包括:
23.a.在具有第一电极和第二电极的流体室中容纳包含离子和含核酸样品的电解液,其中至少一个电极附接有与靶核酸互补的多个捕获-探针,其中捕获-探针位于电极-溶液界面;
24.b.向靠近电极-溶液界面的电解液施加退火-电压以通过该界面产生退火-ph水平,其中退火-ph水平导致含核酸样品内的核酸与捕获-探针之间的任意数量的互补碱基对退火;
25.c.向靠近电极-溶液界面的电解液施加变性-电压以通过界面产生变性-ph水平,其中变性-ph水平导致双链核酸变性,双链核酸包括捕获-探针对和靶核酸的杂交对,该杂交对比双链捕获-探针的全长短特定数量的碱基对或短特定范围的碱基对;以及
26.d.在退火-电压和变性-电压之间调制电压,其中在最终应用相应的ph水平(例如退火或变性)之后,通过维持捕获-探针结合到电极上,从含核酸样品中富集或分离靶核酸。
27.在特定的实施方式中,一旦靶核酸被富集或分离,就对其进行检测。检测可以通过选自由以下组成的组的方法进行:laces、直接检测、pcr、滚环扩增、连接和pcr的组合,以及扩增后的检测步骤、标记探针、嵌入荧光染料。在一个实施方式中,在检测之前,从含核酸样品中洗去未结合到捕获-探针的材料。在一个具体实施方式中,通过本文提供的本发明laces方法检测靶核酸。
28.在特定实施方式中,ph水平是通过离子在溶液中的迁移产生的。在某些实施方式中,退火-电压和变性-电压之间的调制电压处于0.1-1000khz范围内的调制频率(例如,每秒100-1,000,000个周期)。在特定实施方式中,电极上的捕获-探针的密度为每平方厘米100至1,000,000个寡核苷酸探针。在某些实施方式中,在调制步骤中变性的互补碱基对的数目选自1-20、1-15、1-10或1-5个双链碱基对。在具体实施方式中,含核酸样品选自细胞、唾液、尿液、血液、毛发、精液、唾液、骨、组织、牙齿、细胞裂解物、病毒、细胞核酸或基因组核酸。
29.本文还提供了结合本发明的teem和laces方法用于检测靶核酸存在的方法。例如,本文提供的用于检测含核酸的样品中是否存在靶核酸序列的方法,包括:
30.a.在具有第一电极和第二电极的流体室中容纳包含离子和含核酸样品的电解液,其中至少一个电极附接有与靶核酸互补的多个捕获/引物-探针,其中捕获/引物-探针位于电极-溶液界面;
31.b.向靠近电极-溶液界面的电解液施加退火-电压以通过该界面产生退火-ph水平,其中退火-ph水平导致含核酸样品内的核酸与捕获/引物-探针之间的任意数量的互补碱基对退火;
32.c.向靠近电极-溶液界面的电解液施加变性-电压以通过界面产生变性-ph水平,其中变性-ph水平导致双链核酸变性,双链核酸包括捕获-探针对和靶核酸的杂交对,该杂交对比双链捕获-探针的全长短特定数量的碱基对或短特定范围的碱基对;以及
33.d.在退火-电压和变性-电压之间调制,其中在最终应用相应的ph水平(例如退火或变性)之后,通过维持捕获/引物-探针结合到电极上,从含核酸样品中富集或分离靶核酸,其中结合的靶核酸是用于模板定向延伸合成的模板链;
34.e.提供一种延伸混合物,该延伸混合物包含:(i)聚合酶,(ii)atp再生酶,(iii)发光酶(例如,萤火虫荧光素酶),以及(iv)聚合酶-atp再生酶-发光试剂溶液,该溶液具有用于对生长中的核酸链进行模板定向延伸合成的组分,其中所述试剂溶液包括atp再生酶底物、发光底物、以及多种类型的dntp或核苷酸类似物,其中每种类型的核苷酸类似物具有可被聚合酶切割的离去基团,其中在各核苷酸类似物聚合酶依赖性地结合模板链时离去基团被切割;
35.f.进行核酸延伸合成,使得如果捕获/引物-探针与靶核酸序列杂交,则一个或多个核苷酸类似物被顺序添加到模板链中,由此:a)核苷酸类似物与聚合酶结合,b)当核苷酸类似物上的离去基团被聚合酶切割时,核苷酸类似物被聚合酶掺入模板链上,其中通过atp再生酶产生atp将离去基团与atp再生酶底物结合,然后c)将atp与发光酶结合,其中在再生各离去基团时发光底物被发光酶催化产生荧光;以及
36.g.在发生核酸合成时检测来自发光的光,由此检测到的光指示存在特定靶核酸序列。在一个实施方式中,在提供步骤(e)的延伸反应混合物之前,从含核酸样品中洗去未结合捕获/引物-探针的材料。
37.本文还提供了从哺乳动物细胞样品开始富集或分离靶核酸的本发明的teem方法,包括介电泳以促进制备样品。例如,本文提供了一种用于从哺乳动物细胞样品中富集或分离靶核酸的方法,所述方法包括:
38.a.在具有第一电极和第二电极的流体室中容纳包括离子和哺乳动物细胞样品的电解液;
39.b.裂解细胞以形成细胞裂解物;
40.c.向含有细胞裂解物的溶液施加不对称介电电场,其中来自细胞裂解物样品的总核酸被至少一个电极捕获;
41.d.从流体室中洗去未被捕获的细胞裂解物;
42.e.将总核酸重悬到流体室中的包括离子的电解液溶液中,其中至少一个电极附接有与靶核酸互补的多个捕获-探针,其中捕获-探针位于电极-溶液界面;
43.f.向靠近电极-溶液界面的电解液施加退火-电压以通过该电极-溶液界面产生退火-ph水平,其中退火-ph水平导致总核酸与捕获-探针之间的任意数量的互补碱基对退火;
44.g.向靠近电极-溶液界面的电解液施加变性-电压以通过界面产生变性-ph水平,其中变性-ph水平导致双链核酸变性,双链核酸包括捕获-探针对和靶核酸的杂交对,该杂交对比双链捕获-探针的全长短特定数量的碱基对或短特定范围的碱基对;以及
45.h.调制退火-电压和变性-电压,其中在最终应用相应的ph水平(例如退火或变性)之后,通过维持捕获/引物-探针结合到电极上,从总核酸中富集或分离靶核酸。
46.本文还提供了从细胞裂解物样品开始富集或分离靶核酸的本发明的teem方法,包
括介电泳以促进制备样品。例如,本文提供了一种用于从细胞裂解物样品中富集或分离靶核酸的方法,所述方法包括:
47.a.在具有第一电极和第二电极的流体室中容纳解包括离子和细胞裂解物样品的电解液溶液;
48.b.向含有细胞裂解物样品的溶液施加不对称介电电场,其中来自细胞裂解物样品的总核酸被至少一个电极(例如,第一电极)捕获;
49.c.从流体室中洗去未被捕获的细胞裂解物;
50.d.将总核酸重悬到流体室中的包括离子的电解液溶液中,其中至少一个电极(例如,第一电极)附接有与靶核酸互补的多个捕获-探针,其中捕获-探针位于电极-溶液界面;
51.e.向靠近电极-溶液界面的电解液施加退火-电压以通过该电极-溶液界面产生退火-ph水平,其中退火-ph水平导致总核酸与捕获-探针之间的任意数量的互补碱基对退火;
52.f.向靠近电极-溶液界面的电解液施加变性-电压以通过界面产生变性-ph水平,其中变性-ph水平导致双链核酸变性,双链核酸包括捕获-探针对和靶核酸的杂交对,该杂交对比双链捕获-探针的全长短特定数量的碱基对或短特定范围的碱基对;以及
53.g.调制退火-电压和变性-电压,其中在最终应用相应的ph水平(例如退火或变性)之后,通过维持捕获/引物-探针结合到电极上,富集或分离靶核酸。
54.在特定实施方式中,通过终止不对称介电电场将总核酸重新悬浮到流体室中。在某些实施方式中,通过在流体室内裂解哺乳动物细胞样品来获得细胞裂解物。在特定实施方式中,通过选自由以下组成的组的方法检测靶核酸:laces、直接检测、pcr、滚环扩增、连接和pcr的组合,以及扩增后的检测步骤、标记探针、嵌入荧光染料。在特定实施方式中,在检测之前,从含核酸样品中洗去未结合捕获/引物-探针的材料。在一个具体实施方式中,通过laces方法检测靶核酸。从以下中获得哺乳动物细胞样品:细胞、唾液、尿液、血液、毛发、精液、唾液、骨、组织、牙齿、细胞裂解物、病毒、细胞核酸或基因组核酸。
55.本文还提供了用于富集靶核酸(通过本发明的teem方法)和用于检测和/或量化富集的核酸的存在(通过本发明的laces方法)的方法。例如,本文提供了一种用于从哺乳动物细胞样品中富集或分离靶核酸的方法,所述方法包括:
56.a.在具有第一电极和第二电极的流体室中容纳包括离子和哺乳动物细胞样品的电解液;
57.b.裂解细胞以形成细胞裂解物;
58.c.向含有细胞裂解物的溶液施加不对称介电电场,其中来自细胞裂解物样品的总核酸被至少一个电极(例如,第一电极)捕获;
59.d.从流体室中洗去未被捕获的细胞裂解物;
60.e.将总核酸重悬到流体室中的包括离子的电解液溶液中,其中至少一个电极附接有与靶核酸互补的多个捕获-探针,其中捕获-探针位于电极-溶液界面;
61.f.向靠近电极-溶液界面的电解液施加退火-电压以通过该电极-溶液界面产生退火-ph水平,其中退火-ph水平导致总核酸与捕获-探针之间的任意数量的互补碱基对退火;
62.g.向靠近电极-溶液界面的电解液施加变性-电压以通过界面产生变性-ph水平,其中变性-ph水平导致双链核酸变性,双链核酸包括捕获-探针对和靶核酸的杂交对,该杂交对比双链捕获-探针的全长短特定数量的碱基对或短特定范围的碱基对;以及
63.h.在退火-电压和变性-电压之间调制,其中在最终应用相应的ph水平(例如退火或变性)之后,通过维持捕获/引物-探针结合到电极上,从总核酸中富集或分离靶核酸,其中结合的靶核酸是用于模板定向延伸合成的模板链;
64.i.提供一种延伸混合物,该延伸混合物包含:(i)聚合酶,(ii)atp再生酶,(iii)发光酶(例如,萤火虫荧光素酶),以及(iv)聚合酶-atp再生酶-发光试剂溶液,该溶液具有用于对生长中的核酸链进行模板定向延伸合成的组分,其中所述试剂溶液包括atp再生酶底物、发光底物、以及多种类型的dntp或核苷酸类似物,其中每种类型的核苷酸类似物具有可被聚合酶切割的离去基团,其中在各核苷酸类似物聚合酶依赖性地结合模板链时离去基团被切割;
65.j.进行核酸延伸合成,使得如果捕获/引物-探针与靶核酸序列杂交,则一个或多个核苷酸类似物被顺序添加到模板链中,由此:a)核苷酸类似物与聚合酶结合,b)当核苷酸类似物上的离去基团被聚合酶切割时,核苷酸类似物被聚合酶掺入模板链上,其中通过atp再生酶产生atp将离去基团与atp再生酶底物结合,然后c)将atp与发光酶结合,其中在再生各离去基团时发光底物被发光酶催化产生发光;以及
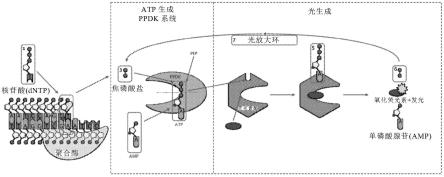
66.k.在发生核酸合成时检测来自发光的光,由此检测到的光指示存在特定靶核酸序列。在一个具体实施方式中,来自总核酸的捕获/引物-探针在提供步骤(1)的延伸反应混合物之前被洗去。
67.本文还提供了本发明的用于从含核酸的样品中富集或分离靶核酸的teem方法,所述方法包括:
68.a.在具有第一电极和第二电极的流体室中容纳包含离子和含核酸样品的电解液,其中至少一个电极附接有与靶核酸互补的多个捕获-探针,其中捕获-探针位于电极-溶液界面;以及
69.b.通过交替退火-电压和变性-电压来调制在电极-溶液界面附近形成的电场,以在电解液的电极-溶液界面附近处产生相应退火-ph水平和变性-ph水平,其中退火-ph水平引起任意数量的互补碱基对的退火;并且变性-ph水平导致具有对应于选自以下范围的多个互补碱基对的双链核酸变性:1到x-5个互补碱基对;1到x-10个互补碱基对;1到x-15个互补碱基对;1到x-20个互补碱基对;1至x-25个互补碱基对,其中x是各个捕获-探针的核苷酸长度,其中在最终应用退火-ph水平后,通过被维持与电极上的引物-探针结合,从含核酸的样品中富集或分离靶核酸。
附图说明
70.本专利或申请文件包含至少一幅以彩色绘制的图。专利局将根据请求和支付必要的费用提供本专利或专利申请出版物的彩色附图副本。
71.图1a示出了本发明的一个实施方式的laces靶核酸检测方法的一般说明:dna聚合酶使dnt或dntp类似物作为构建单元。在与聚合酶结合后,焦磷酸盐被切割下来以供后续反应。
72.图1b示出了切割的焦磷酸盐通过与atp硫化酶相互作用与aps结合,atp硫化酶将相应的焦磷酸盐与腺苷5
’‑
磷酸硫酸盐(aps)结合,从而形成atp(atp)。
73.图1c示出了用于本文所述的发光反应的试剂、atp(atp)、荧光素和萤火虫荧光素
酶;以及由此产生可检测的发光的发光反应中试剂的相互作用。
74.图2示出了使用amp+pep和ppdk酶的本发明laces靶核酸检测方法的另一实施方式的一般说明。切割的焦磷酸盐通过与ppdk酶的相互作用与amp+pep结合,ppdk酶将相应的焦磷酸盐与amp结合,从而形成atp(atp)。
75.图3示出了使用adp-葡萄糖和agppase酶的本发明laces靶核酸检测的另一实施方式的一般说明。切割的焦磷酸盐通过与agppase酶的相互作用与adp-葡萄糖结合,agppase酶将相应的焦磷酸盐与adp-葡萄糖结合,从而形成atp(atp)。
76.图4示出了作为本发明laces与不同atp硫化酶反应的结果的发光产生。
77.图5示出了作为本发明laces与不同萤火虫荧光素酶反应的结果的发光产生。
78.图6示出了作为本发明laces与不同dgtp-香豆素反应的结果的发光产生。
79.图7示出了将atp和aps添加到具有不同量的无机焦磷酸酶的荧光素酶反应中的结果。
80.图8示出了向atp硫化酶/荧光素酶信号放大环反应添加辅酶a对发光信号的影响。
81.图9a示出了在本发明laces核酸检测方法中在每个相应的靶核酸模板上使用多个聚合酶/单个引物-探针进行链延伸的实施方式。
82.图9b示出了一个实施方式,其中由于起始合成互补链的聚合酶穿过其典型的核酸链延伸长度并然后从模板上脱离或解离,反应混合物中的多个其他聚合酶中的一个聚合酶立即结合模板并且继续仅互补链延伸合成,所以靶核酸模板的链延伸基本上是连续的。
83.图10示出了使用amp+pep和ppdk酶的本发明laces靶核酸检测方法的实施方式的另一一般说明。切割的焦磷酸盐通过与ppdk酶的相互作用与amp+pep结合,ppdk酶将相应的焦磷酸盐与amp结合,从而形成atp(atp)用于随后荧光素酶反应以产生可检测的发光,该发光通过本文中描述的酶促环被放大。
84.图11示出了本发明靶核酸检测方法的另一实施方式的一般说明,该方法使用在其上具有荧光标记或其他可检测标记的淬灭核苷酸、以及amp+pep和ppdk酶系统。切割的标记焦磷酸盐(即ppi+fl)通过与ppdk酶的相互作用与amp+pep结合,ppdk酶将相应的焦磷酸盐与amp结合,形成atp(atp)随后用于荧光素酶反应以产生被本文中描述的酶促环放大的可检测的发光和/或荧光。
85.图12示出了本发明faces靶核酸检测方法的一个实施方式的一般说明,该方法使用在其上具有荧光标记或其他可检测标记的淬灭核苷酸、以及聚合酶系统。切割的标记焦磷酸盐(即ppi+fl)通过与ppdk酶的相互作用与amp+pep结合,ppdk酶将相应的焦磷酸盐与amp结合,从而形成atp(atp)用于随后荧光素酶反应以产生可检测的发光和/或荧光。
86.图13示出了本发明的实施方式的一般说明,该实施方式使用双功能,来捕获/引物-探针来捕获rna靶核酸;在利用聚合酶来从与rna靶核酸和双功能捕获/引物-探针的引物区域结合的中间dna模板链开始延伸的本发明laces链延伸反应中,使用3路连接dna中间核酸,来检测rna靶核酸(例如,sars-cov2)。最后一个部分中描述的lace反应产生的信号在几分钟内达到峰值并缓慢衰减。检测发生在信号快速上升期间的第一分钟内。
87.图14示出了本发明的实施方式的一般说明,该实施方式使用引捕获/引物-探针,来利用在本文中提供的teem方法捕获rna靶核酸;以及使用rna捕获/引物-探针作为利用聚合酶的本发明laces链延伸反应的引物(dna/rna),来从模板rna链延伸以检测rna靶核酸
(例如,sars-cov2)。最后一个部分中描述的laces反应产生的信号在几分钟内达到峰值并缓慢衰减。检测发生在信号快速上升期间的第一分钟内。
88.图15示出了本发明的实施方式的一般说明,该实施方式使用引捕获/引物-探针,来捕获rna靶核酸;以及使用rna捕获/引物-探针作为利用逆转录酶的本发明laces链延伸反应的引物(dna/rna),来从模板rna链延伸以检测rna靶核酸(例如,sars-cov2)。最后一个部分中描述的lace反应产生的信号在几分钟内达到峰值并缓慢衰减。检测发生在信号快速上升期间的第一分钟内。
89.图16示出了本发明的实施方式的一般说明,该实施方式使用引捕获/引物-探针,来捕获dna靶核酸;以及使用rna捕获/引物-探针作为利用聚合酶的本发明laces链延伸反应的引物(dna/dna),来从模板dna链延伸以检测dna靶核酸。最后一个部分中描述的lace反应产生的信号在几分钟内达到峰值并缓慢衰减。检测发生在信号快速上升期间的第一分钟内。
90.图17示出了在用于从裂解物中介电分离核酸(本文称为dial过程)的示例性微流体芯片上的各个位置处发生的介电力。
91.图18示出了双电层的操作。当电极与固体或液体离子导体(电解质)接触并在电极上施加电势时,反荷离子向电极移动,而共离子从表面排斥,从而产生在电极-溶液界面的离子分布,即ph。
92.图19示出了本发明的通过电调制的靶富集(teem)方法的总体描述,该方法使用表面附着的捕获-探针,该探针位于活性区域的界面中,其中ph分布由电压调制和电场调制所控制。
93.图20示出了用于检测病原体的本发明便携式基于仪器的诊断系统,该系统具有包括执行本发明teem和laces方法以检测靶核酸存在或不存在所必需的所有试剂和组分的示例性一次性使用盒。
94.图21示出了有源电极阵列设计的一个实施方式,其描绘了驻留在耗材内的有源区域内的电极几何形状。
95.图22示出了溶解温度带曲线,该曲线描绘了通过施加电场来改变可变和可调ph条件从ph4到ph8以改变ph对恒定42℃下12bp核酸杂交、以及可变和可调温度条件的影响。结果表明,在ph 8时,所有大于、等于和小于预选的12bp结合亲和力阈值的寡核苷酸都与其靶标杂交。然而,将ph降低到ph 4会导致大于预选12bp阈值的寡核苷酸发生杂交,而那些小于预选12bp阈值的寡核苷酸会变性。
96.图23示出了teem方法的性能估计和优化。
97.图24示出了信号负载数据集。
98.图25示出了时间敏感性数据集。
99.图26示出了本发明设备外壳的另一个实施方式,该设备外壳具有其中带有拭子插件的消耗性芯片以及适配器,适配器内部具有耗材芯片和柱塞帽。
具体实施方式
100.本文提供了用于检测样品中核酸序列存在的方法,该方法包括:
101.提供一种核酸延伸混合物,该延伸混合物包含:(i)聚合酶,(ii)atp再生酶,(iii)
发光酶(例如,萤火虫荧光素酶),(iv)来自样品的模板核酸,(v)与特定靶核酸序列杂交(例如互补)的引物-探针,以及(vi)聚合酶-atp再生酶-发光试剂溶液,该溶液具有用于对生长中的核酸链进行模板定向延伸合成的组分。其中,所述试剂溶液包括:atp再生酶底物(例如,通过atp硫化酶的aps;通过agppase的adp-葡萄糖;通过ppdk的amp+pep等);发光底物;以及多种类型的dntp或核苷酸类似物,其中每种类型的核苷酸类似物具有可被聚合酶切割的离去基团,其中在各核苷酸类似物聚合酶依赖性地结合模板链时离去基团被切割;
102.进行核酸延伸合成,使得如果引物-探针与靶核酸序列杂交,则一个或多个核苷酸类似物被顺序添加到模板中,由此:a)核苷酸类似物与聚合酶结合,b)当核苷酸类似物上的离去基团被聚合酶切割时,核苷酸类似物被聚合酶掺入模板链上,其中通过atp再生酶(例如,通过atp硫化酶的aps;通过agppase的adp-葡萄糖;通过ppdk的amp+pep等)产生atp将离去基团与atp再生酶底物结合,然后c)将atp与发光酶结合,其中发光底物被发光酶催化产生发光,其中焦磷酸离去基团被再生成;以及
103.在发生核酸合成时检测来自发光的光,由此检测到的光指示存在特定靶核酸序列。
104.在本发明方法的特定实施方式中,所述方法包括:
105.提供一种核酸延伸混合物,该延伸混合物包含:(i)聚合酶,(ii)atp硫化酶,(iii)发光酶(例如,萤火虫荧光素酶),(iv)来自样品的模板核酸,(v)与特定靶核酸序列杂交(例如互补)的引物-探针,以及(vi)聚合酶-atp再生酶-发光试剂溶液,该溶液具有用于对生长中的核酸链进行模板定向合成的组分。其中,所述试剂溶液包括:atp;发光底物(例如,荧光素);以及多种类型的核苷酸类似物,其中每种类型的核苷酸类似物具有可被聚合酶切割的焦磷酸酶离去基团,其中在各核苷酸类似物聚合酶依赖性地结合模板链时焦磷酸离去基团被切割;或者
106.提供一种核酸延伸混合物,该延伸混合物包含:(i)聚合酶,(ii)adpglc焦磷酸化酶(agppase),(iii)发光酶(例如,萤火虫荧光素酶),(iv)来自样品的模板核酸,(v)与特定靶核酸序列杂交(例如互补)的引物-探针,以及(vi)聚合酶-agppase-发光试剂溶液,该溶液具有用于对生长中的核酸链进行模板定向延伸合成的组分。其中,所述试剂溶液包括:atp再生酶底物(例如,通过atp硫化酶的adp-葡萄糖;通过agppase的adp-葡萄糖;通过ppdk的amp+pep等);发光底物(例如,荧光素);以及多种类型的dntp或核苷酸类似物,其中每种类型的核苷酸类似物具有可被聚合酶切割的焦磷酸酶离去基团,其中在各核苷酸类似物与模板链聚合酶依赖性地结合时焦磷酸酶离去基团被切割;或者
107.提供一种核酸延伸混合物,该延伸混合物包含:(i)聚合酶,(ii)丙酮酸正磷酸二激酶(ppdk),(iii)发光酶(例如,萤火虫荧光素酶),(iv)来自样品的模板核酸,(v)与特定靶核酸序列杂交(例如互补)的引物-探针,以及(vi)聚合酶-ppdk-发光试剂溶液,该溶液具有用于对生长中的核酸链进行模板定向合成的组分。其中,所述试剂溶液包括:amp和磷酸烯醛丙酮酸(pep);发光底物(例如,荧光素);以及多种类型的核苷酸类似物,其中每种类型的核苷酸类似物具有可被聚合酶切割的焦磷酸酶离去基团,其中在各核苷酸类似物与模板链聚合酶依赖性地结合时焦磷酸酶离去基团被切割;以及
108.进行核酸合成,从而将多个核苷酸类似物顺序添加到模板中,由此:a)核苷酸类似物与聚合酶结合;b)当该核苷酸类似物上的焦磷酸酶离去基团被聚合酶切割时核苷酸类似
物被聚合酶掺入在模板链上,其中,焦磷酸酶离去基团与以下任一者结合来产生atp:通过atp硫化酶的aps,通过aggpase的adp-葡萄糖,和/或通过ppdk的amp;然后c)将atp结合到发光酶(萤火虫荧光素酶),其中发光底物(荧光素)被发光酶(荧光素酶)催化产生有限(瞬时/离散)时间段的发光,并且其中焦磷酸离去基团被再生;以及
109.在发生核酸合成时检测来自发光的光,由此检测到的光指示存在特定靶核酸序列。
110.如本文所用,“聚合酶-atp再生酶-荧光素酶”或其语法变体,是指本领域已知的任何串联的3酶系统,其可用于本发明方法中以利用由聚合酶链延伸反应产生的焦磷酸离去基团,并将焦磷酸离去基团(ppi;图1b)转化为atp。例如,串联的3酶聚合酶-atp再生酶-荧光素酶系统可以选自由以下组成的组:聚合酶-atp硫化酶-发光酶系统;聚合酶-agppase-发光酶系统(如lee等,analytical biochemistry,399(2010)168-173中所公开的;出于所有目的通过引用整体并入本文);聚合酶-ppdk-发光酶系统(如zhou等,anal.chem.2006,78,4482-4489中所公开的;出于所有目的以引用的方式整体并入本文)等。
111.如本文所用,短语“atp再生酶底物”是指用于本文所用的相应atp再生酶的天然底物。例如,本文用于atp硫化酶的天然底物是aps;aggpase的底物是adp-葡萄糖;ppdk的底物是amp+pep,等等。
112.如本文所用,术语“atp再生酶/荧光素酶环”或“atp再生酶/荧光素酶信号放大环”的语法变体(例如,atp硫化酶/荧光素酶环、agppase/荧光素酶环、ppdk/荧光素酶环等),一般指如本文实施方式3和图1b-图1g中所述的atp再生酶和荧光素酶之间的酶环,由此在荧光素酶催化的发光反应之后释放新的焦磷酸盐分子(ppi)(图1f)。这种新释放的ppi-fl可以再次成为atp再生酶(例如,atp硫化酶、agppase、ppdk等)的底物,从而在atp再生酶(例如,atp硫化酶、agppase、ppdk等)和荧光素酶之间形成酶环(图1g的上部)。如图1b-图1g所示,在这个环中,ppi被atp硫化酶回收并转化为atp(atp),然后可以被荧光素酶催化释放ppi。这将从焦磷酸离去基团产生连续的发光信号,从而充当每个相应核苷酸的检测信号的放大机制。
113.如本文所用,短语“核酸链延伸混合物”或“链延伸混合物”或其语法变体是指用于执行本发明laces核酸链延伸反应的组分。在一个实施方式中,链延伸混合物包括:(i)聚合酶;(ii)atp再生酶(例如,atp硫化酶、agppase、ppdk等);(iii)发光酶(例如,萤火虫荧光素酶);(iv)来自样品的模板核酸;(v)与正在被询问的特定靶核酸序列杂交(例如互补)的引物-探针;以及(vi)具有用于执行生长的核酸链的模板定向合成的组分的聚合酶-atp再生酶-发光试剂溶液,其中所述试剂溶液包括aps、adp-葡萄糖或amp+pep中一者,发光底物(例如,荧光素),以及其中多种类型的核苷酸类似物。根据本发明,所使用的链延伸混合物在本发明的靶核酸检测方法中提供了以下优于先前方法的优点:所使用的聚合酶在其理想状态下起作用;无需修饰聚合酶;使用高浓度的核苷酸(例如,dntp)可获得最佳效率;不需要复杂的光学或纳米结构的芯片涉及,从而降低了成本;提供了高特异性;并且提供长的核酸链延伸长度(例如,约50kb至1个基因/小室(cell)),其快速且强烈地将表示被询问的靶核酸存在的发光信号进行放大。
114.如本文所用,短语“模板核酸样品”或“靶模板核酸样品”、“靶核酸”或其语法变体是指任何合适的多核苷酸,包括双链dna、单链dna、单链dna发夹、dna/rna杂合体、单链rna、
具有用于结合引物-探针的识别位点的rna、捕获-探针、捕获/引物-探针、聚合试剂、和/和rna发夹。此外,适合用作本发明核酸靶检测方法的模板核酸或靶核酸的靶多核苷酸可以是来自任何细胞的基因组的特定部分,例如内含子、调节区、等位基因、变体或突变、全基因组、或其任何部分。在其他实施方式中,靶多核苷酸可以是mrna、trna、rrna、核酶、反义rna或rnai。在其他实施方案中,靶多核苷酸样品可以具有任何长度,例如在约10个碱基至约100,000个碱基之间、约10,000个碱基至约90,000个碱基之间、约20,000个碱基至约80,000个碱基之间、约30,000个碱基最多约70,000个碱基之间、约40,000个碱基到约60,000个碱基或更长,典型范围为约10,000-50,000个碱基。本文还考虑了长度在约100个碱基和10,000个碱基之间的靶模板核酸。
115.适用于本文的模板核酸样品(本文也称为靶核酸)可以从本领域熟知的多种来源获得。例如,来自细胞dna、病毒dna/rna、循环游离dna、循环肿瘤dna、来自唾液的dna/rna、来自血液的dna/rna、以及来自农业样品、动物生物体液、环境样品(淡水源、海水/海洋样品)等的dna/rna的核酸样品。
116.如本文所用,术语“引物-探针”是指可以引发链延伸的引物,其还用作鉴定特定靶核酸序列的探针,优选来自被询问的未知核酸样品。由于不存在温度循环和变性,并且由于不存在杂交循环(例如pcr),因此在可用于本发明方法的长度和序列方面,探针设计具有很大的灵活性。使用本文提供的本发明方法,设计一种寡核苷酸探针(例如,引物-探针)就足够了,而不是pcr所需的2种引物。引物-探针的长度可以是任何大小,只要它准确地结合到模板核酸样品中的其各自的靶核酸序列即可。例如,适用于本文的引物-探针长度的多种范围可以选自由以下组成的组:20-100、20-90、20-80、20-70、20-60、20-50、20-40、20-30、5-100、10-100、30-100、40-100、50-100、60-100、70-100、80-100、90-100、15-150、10-200、5-300、20-200、20-300、20-400、20-500、20-600、20-700、20-800、20-900、20-1000、至少5、至少10、至少15、至少20、至少30、至少40、至少50、至少60、至少70、至少80、至少90、至少100、至少150、至少200、至少300、至少400、至少500、至少600、至少700、至少800、至少900、至少1000个核苷酸碱基。
117.适用于本文的引物-探针长度的其他合适范围可选自由以下组成的组:5-1000个碱基、10-950、15-900、20-800、25-700、30-600、35-500、40-400、50-300、25-250、25-200、25-150、25-100、25-90、25-80、25-70、25-60、25-50碱基长度。在其他实施方式中,引物-探针在20-100个碱基的范围内。在其他实施方式中,本领域技术人员可以针对引物-探针长度选择更长的核苷酸序列,引物-探针长度可以选自由以下组成的组:25、30、40、45、50、55、60、65、70、80、85、90、95、100、110、120、130、140、150、160、170、180、190和200个碱基或更多以增加特异性。在其他实施方式中,与pcr一样,也考虑使用约20个碱基的探针长度。
118.如本文所用,短语“聚合酶-atp再生酶-发光试剂溶液”及其使用atp硫化酶、agppase、ppdk等作为atp再生酶的语法变体、或者“试剂溶液”,是指执行生长核酸的模板定向合成所必需的组分的混合物。在使用atp硫化酶的一个实施方式中,用于与聚合酶(例如,dna聚合酶i)、atp硫化酶以及发光酶(例如,荧光素酶等)一起使用的聚合酶试剂溶液包括aps(腺苷5’磷酸硫酸盐)、荧光素、以及合适浓度的dntp(例如,本文中描述的核苷酸类似物)。在使用agppase的另一个实施方式中,用于与聚合酶(例如,dna聚合酶i)、agppase以及发光酶(例如,荧光素酶等)一起使用的聚合酶试剂溶液包括adp-葡萄糖、荧光素以及合适
浓度的dntp(例如,本文中描述的核苷酸类似物)。在使用ppdk的另一个实施方式中,用于与聚合酶(例如,dna聚合酶i)、ppdk以及发光酶(例如,荧光素酶等)一起使用的聚合酶试剂溶液包括amp+pep、荧光素以及合适浓度的dntp(例如,本文中描述的核苷酸类似物)。在一个具体的实施方式中,采用的dntps的浓度远高于迄今为止可能的浓度,部分原因是由于在本发明方法中有利地使用的离去基团(例如,荧光焦磷酸;ppi)产生的低荧光背景。由于atp形成酶(例如,atp硫化酶、agppase、ppdk等)和聚合酶速率可根据酶的类型和来源而显著变化,因此可以通过调整反应条件(例如,如本文中描述的atp再生酶浓度等)来单独地调节由本文中采用的atp再生酶(例如,atp硫化酶、agppase、ppdk等)反应实现的atp形成速率。
119.如本文所用,短语“atp反应”是指可以将焦磷酸盐(例如,离去基团;ppi)与atp再生底物(例如,腺苷5'磷酸硫酸盐(aps)、adp-葡萄糖、amp+pep等)结合形成atp(atp),如图1b和图1c所示。在用于本文的一个实施方式中,焦磷酸离去基团可以使用atp硫化酶等与aps结合。在用于本文的另一个实施方式中,焦磷酸离去基团可以使用agppase酶等与adp-葡萄糖结合。在用于本文的另一个实施方式中,焦磷酸离去基团可以使用ppdk酶等与amp+pep结合。
120.如本文所用的,短语“发光反应”是指可以产生光发射的任何反应,该光发射根本不来源于或仅来源于发射体的温度的能量(即,除了白炽光之外的光的发射)。“发光”包括但不限于荧光、磷光、热致发光、化学发光、电致发光和生物发光。“发光的”是指表现出发光的物体。在优选实施方式中,光在可见光谱中。然而,本发明不限于可见光,而是包括任何频率的电磁辐射。在一个实施方式中,本文所用的发光反应是由发光酶、荧光素酶(例如萤火虫荧光素酶)使用atp(atp)作为辅助因子催化发光底物、荧光素引起的,以产生发光、氧化荧光素、amp,并且还再生用于循环产生另一atp的焦磷酸盐(ppi)(见图1d-图1f)。
121.例如,在一个实施方式中,本文考虑的迭代链延伸循环涉及由atp硫化酶催化的ppi与aps的第一atp反应,这导致atp和无机硫酸盐的产生。在第二反应中,发光反应、荧光素和荧光素酶消耗atp作为能源来产生光、amp和氧化荧光素,并且再生焦磷酸盐(ppi)(图1c)。因此,在掺入每个相应的dntp类似物后,通过第二发光反应为溶液中的每个焦磷酸盐(ppi)分子产生光量子。在本文考虑的一个实施方式的反应过程中,消耗aps和荧光素并产生amp和氧化荧光素,而atp硫化酶和荧光素酶保持恒定。本发明不限于所使用的荧光素酶的类型。尽管某些公开的实施方案使用萤火虫荧光素酶,但本领域已知的任何荧光素酶可用于所公开的方法中。
122.根据本发明,已经发现辅酶a通过防止荧光素酶的降解/失活来使得荧光素酶/荧光素对或复合物保持稳定,这具有增加本发明靶核酸检测反应的atp再生酶/荧光素酶放大环的信号强度的作用。因此,本文提供了增加链延伸反应中atp再生酶/荧光素酶放大环的信号强度的方法,包括:进行本文所述的本发明laces靶核酸检测方法;并且以有效地增加atp再生酶/荧光素酶放大环的信号强度的辅酶a与荧光素酶的比例,将辅酶a添加到链延伸混合物中。
123.因此,在一些实施方式中,可以以有效地增加链延伸反应中atp再生酶/荧光素酶放大环的信号强度的辅酶:荧光素酶的比例,将将本文使用的辅酶a的量添加到本发明链延伸混合物和溶液中。在一些实施方式中,本文中考虑使用的合适的辅酶a:荧光素酶的比例可以选自由以下组成的组:1:1、1:2、1:5、1:10、1:20、1:30、1:40、1:50、1:60、1:70、1:80、1:
flexi dna聚合酶;可从epicentre biotechnologies获得的phi.29dna聚合酶;可从stratagene获得的pfuultra
tm
热启动dna聚合酶;可从novagen获得的kod hifi dna聚合酶等。
127.可用的dna聚合酶也已经以如下多种方式中的任一种进行了修饰:例如以降低或消除外切核酸酶活性(许多天然dna聚合酶干扰例如测序应用的校对外切酶功能),以通过制备诸如重组klenow片段的蛋白酶消化的酶片段来简化生产等。如所指出的,聚合酶也已被修饰以赋予聚合酶-dna-核苷酸复合物中标记核苷酸的特异性、持续合成能力和改进的保留时间(例如,hanzel等的wo 2007/076057的polymerases for nucleotide analogue incorporation和rank等的wo2008/051530的polymerase enzymes and reagents for enhanced nucleic acid sequencing),以改变分支部分和易位(例如,pranav patel等于2009年9月4日提交的序列号12/584,481,题为“engineering polymerases and reaction conditions for modified incorporation properties”的美国专利申请),以提高光稳定性(例如,keith bjornson等于2009年3月30日提交的序列号12/384,110,题为“enzymes resistant to photodamage”的美国专利申请),并且以提高表面固定化酶的活性(例如,hanzel等的wo 2007/075987的active surface coupled polymerases和hanzel等的wo 2007/076057的protein engineering strategies to optimize surface attached proteins)。任何这些可用的聚合酶都可以根据本发明进行修饰,以减少分支部分的形成,提高封闭聚合酶-dna复合物的稳定性,和/或改变反应速率常数。
128.作为用于突变以减少分支部分、增加闭合复合物稳定性或改变反应速率常数的优选底物的dna聚合酶包括:taq聚合酶、外切核酸酶缺陷型taq聚合酶、大肠杆菌dna聚合酶1、klenow片段、逆转录酶(图15的第3部分)、包括野生型phi-29聚合酶和此类聚合酶的衍生物(例如外切核酸酶缺陷型)的phi-29相关聚合酶、t7 dna聚合酶、t5 dna聚合酶、rb69聚合酶等。
129.此外,聚合酶可以出于应用特定的原因被进一步修饰,例如增加光稳定性(例如,在2009年3月30日提交的序列号12/384,110的美国专利申请所教导的),例如提高酶结合到表面时的活性(例如,在wo 2007/075987和wo 2007/076057中教导的),或者例如在引用的参考文献中教导并且在本领域中是常见的按原样包括纯化或处理标签。类似地,本文所述的修饰聚合酶可以与其他策略组合使用以提高聚合酶性能,例如用于控制聚合酶速率常数的反应条件(例如,在2009年3月30日递交的序列号12/414,191,题为“two slow-step polymerase enzyme systems and methods”的美国专利申请所教导的,出于所有目的以引用的方式全文并入本文)。
130.在本发明核酸靶序列检测方法的另一个实施方式中(如图11所示),荧光标记被连接到dntp或核苷酸类似物的末端磷酸盐(或焦磷酸离去基团上的另一个区域;ppi)。这种荧光标记的激发光谱至少部分与荧光素氧化产生的发光相匹配。该标记的核苷酸还可以任选地包括淬灭剂分子(可移除或不可移除地连接到核苷酸的碱基或糖上),其吸收光谱与荧光标记(连接到核苷酸的末端磷酸)的发射光谱重叠。用荧光标记和淬灭剂修饰的核苷酸在本文中称为淬灭核苷酸。因此,在核苷酸类似物与聚合酶相互作用时,聚合酶释放带有荧光团的焦磷酸盐(标记的焦磷酸盐),从而将荧光标记与淬灭剂分离。当分离时,淬灭剂将不能吸收荧光标记的发射光。然后标记的焦磷酸盐与生成atp酶发生反应并转化为现在被相同荧
光标记标记的atp(标记的atp)。然后,这种标记的atp将与荧光素酶相互作用,产生发光并释放标记的焦磷酸盐。产生的发光激发标记焦磷酸盐上的荧光标记,激发的荧光团在其特定发射范围内发光。产生的淬灭核苷酸对聚合酶具有提高的特异性,使得在荧光标记发射光谱范围内产生的光增加了生成的信号的特异性;因为已经掺入的核苷酸与背景中未与聚合酶反应的剩余核苷酸不同。对于该实施方式,每个核苷酸可以用相同的标记或不同的标记进行标记,或者仅一个、或仅两个、或仅三个核苷酸可以用相同的或不同的或任何其他标记组合进行标记。
131.在一个优选的实施方式中,核苷酸类似物通过向末端磷酸盐添加荧光团而被修饰(参见,例如,yarbrough等,j.biol.chem.,254:12069-12073,1979;出于所有目的通过引用并入本文),使得当核苷酸类似物掺入模板链时聚合酶产生ppi标记的离去基团(例如,ppi+fl)时,该标记的焦磷酸盐能够与腺苷5’磷酸化硫酸盐结合形成标记的atp(atp+fl),如图11所示。
132.替代的标记策略可以使用无机材料作为标记部分,例如荧光或发光纳米颗粒,例如纳米晶体,即量子点,由于它们的半导体组成和纳米尺度范围内的尺寸,它们具有固有的荧光能力(参见,例如,美国专利号6,861,155、6,699,723、7,235,361,出于所有目的通过引用并入本文)。这样的纳米晶体材料通常可从例如life technologies(carlsbad,加州)商业地获得。同样,此类化合物可以作为单独的标记基团或作为相互作用的基团或对存在,例如与其他无机纳米晶体或有机荧光团一起存在。在某些情况下可以使用荧光蛋白,例如绿色荧光蛋白(gfp、egfp)、蓝色荧光蛋白(ebfp、ebfp2、azurite、mkalama1)、青色荧光蛋白(ecfp、cerulean、cypet)和黄色荧光蛋白衍生物(yfp、citrine、venus、ypet)。本文还考虑使用产生多种颜色编码信号用于检测的多极荧光染料的荧光细胞条码,例如、krutzek等人curr protoc cytom.2011january;chapter:unit-6.31.(doi:10.1002/0471142956.cy0631s55.)中所述(出于所有目的,其通过引用整体并入本文)。
133.通过链连续延伸(faces)的荧光激活
134.在另一个实施方式中,在本文中称为通过链的连续延伸的荧光激活(faces),其中连接有荧光团和其中附接有淬灭剂分子的“淬灭核苷酸”用于本发明的方法和系统(其仅包括聚合酶)中(见图12)。在本文提供的这种方法中,使用外部光源来激发荧光团。当淬灭的核苷酸与聚合酶反应并由于引物-探针与靶核酸序列结合且未知样品被询问而被掺入延伸的核酸链中时,会释放标记的焦磷酸盐,产生荧光信号,该荧光信号与附接到模板链的标记的核苷酸类似物的数量成正比例。也即是,荧光信号与链延伸长度成正比。由于荧光标记与淬灭剂分子非常接近,未掺入延伸链中的淬灭核苷酸即使在激发下也不显示任何荧光发射。这些未掺入的dntp或核苷酸类似物的荧光发射将被淬灭,不会被检测为背景。
135.在其他实施方式中,本文所述的利用荧光标记的本发明系统也可以与外部激发一起使用。可以选择荧光标记,使其激发和发射波长远离发光光谱,从而不与荧光素酶反应发生耦合。荧光素酶反应仅用于回收标记的atp并产生标记的焦磷酸盐。最后,再次使用环,但是这次由聚合酶产生的标记焦磷酸盐被外部光源激发。
136.本领域技术人员可以容易地确定哪些仪器是合适的,确定这些分析是否需要多路复用或高样品通量,以及确定利用单独或与相应的淬灭剂(例如,不可去除的淬灭剂)提供满足相应核酸检测方法应用所需的特异性和灵敏度的荧光标记的类型。表1中列出的荧光
团可与列出的替代荧光团一起使用,这些荧光团表现出相似的交互式荧光团以及激发和发射光谱,并且可从不同的供应商处获得;然而,表2提供了示例性淬灭剂部分的列表。
137.在为不同类型的荧光团标记的核苷酸和检测仪器选择合适的荧光团/淬灭剂组合时可以遵循以下指南:
138.基于所使用的荧光分光光度计,选择可以被仪器的光学器件激发和检测的合适的荧光团标记。配备氩蓝光激光器的仪器最适合激发激发波长在500到540nm之间的荧光团,但是具有较长最大激发波长的荧光团不能被该光源良好地激发或者不被该光源激发。具有白光源的仪器(例如卤钨灯)使用滤光片进行激发和发射,并且能够以相同的效率激发和检测激发和发射波长在400到700nm之间的荧光团。对于使用发光二极管作为激发源和发射滤光片来检测各种荧光团的仪器来说也是如此。
139.如果该分析被设计为检测一种靶dna序列并且仅使用一种荧光标记,则fam、tet或hex(或表1中列出的它们的替代物之一)将是一种良好的用于标记相应核苷酸的荧光团。可以在所有可用的荧光分光光度计光谱仪上被激发和检测这些荧光团。此外,由于这些荧光团的亚磷酰胺衍生物的可用性和淬灭剂连接的对照孔玻璃柱的可用性,可以在自动化过程中完全合成具有这些标记的荧光核苷酸,具有相对便宜且较低劳动密集型制造的优点。
140.表1.荧光杂交探针的荧光标记
[0141][0142][0143]
a)cal和quasar荧光团可从biosearch technologies获得;b)vic和ned可从applied biosystems获得;c)cy染料可从amersham biosciences获得;d)oyster荧光团可从integrated dna technologies获得;e)lc(light cycler)荧光团可从roche applied science获得。
[0144]
如果该分析被设计用于检测两个或多个靶dna序列(多重核酸靶检测分析),并且因此将使用两种或多种荧光标记的核苷酸,则选择具有吸收和发射波长彼此充分分离(最小的光谱重叠)的荧光团。大多数仪器都可选择激发和发射滤光片,以最大限度地减少荧光团之间的光谱重叠。在发生光谱重叠的情况下,仪器由具有内置算法的软件程序支持,可以
efficiencies.j.phys.chem.100,5541-5553;出于所有目的通过引用整体并入本文)。通常,激发波长在500至550nm之间的荧光团比具有较长激发波长的荧光团更有效地被核苷酸淬灭。
[0153]
实现连续长核酸链延伸长度的方法
[0154]
为了增加检测到的可检测光信号(例如,发光和/或荧光),需要实现长核酸链延伸长度的能力,以便增加指示存在被询问的靶核酸的可检测光信号(例如,发光和/或荧光)信号。当前的链延伸方法在实现长核酸链延伸长度的能力方面受到限制。特别地,对于每个单独的链延伸事件,这种限制来自聚合酶对模板核酸的相对亲和力。在链延伸反应期间,聚合酶将最终从模板核酸(例如,dna或rna等)上脱落,从而在相应的核酸链延伸长度处终止dntp链延伸反应。
[0155]
根据本发明,以与用于反应混合物中的每种引物-探针的多个聚合酶相对应的量,可以将聚合酶添加到链延伸反应混合物中。
[0156]
在本发明的靶核酸检测连续核酸链延伸方法(例如,laces和faces)的特定实施方式中,特别是多个聚合酶用于对核酸样品中的每种相应靶模板核酸进行延伸的情况下,总核酸链延伸长度仅受限于在特定反应限制区域中提供的靶模板核酸的长度。例如,可以通过对样品中的每个单一靶核酸模板使用一个或多个聚合酶来实现本文所考虑的总核酸链延伸长度,最高可达整个染色体的长度,例如,5000万至最高大约3亿个碱基对(例如,300mbp)等。在本文考虑的其他某些实施方式中,通过本发明的链延伸核酸检测方法实现的核酸链延伸长度可以选自至少由以下各项组成的组:200bp、300bp、400bp、500bp、600bp、700bp、800bp、900bp、1000bp(即1kbp)、5kbp、10kbp、20kbp、30kbp、40kbp、50kbp、100kbp、200kbp、300kbp、400kbp、400kbp、400kbp、800kbp、900kbp、1000kbp(1mbp)、5mbp、10mbp、20mbp、50mbp、75mbp、100mbp、200mbp、300mbp、400mbp、500mbp、600mbp、700mbp、800mbp、900mbp、1000mbp。
[0157]
如本文所用,短语“多种聚合酶”、“多个聚合酶”或其语法变体是指用于在本发明核酸链延伸反应混合物中采用的每个相关引物-探针的聚合酶的数量。“多个聚合酶”中的聚合酶的数量可以选自至少由以下各项组成的组:在链延伸反应混合物中使用的每个引物-探针,2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、95、950、1000、10000、20000、30000、40000、50000、50000、60000、70000、80000、90000、100000、100000、100000、200000、300000、300000、400000、400000、500000、500000、500000、500000、500000、500000、500000、500000,500000、600000、700000、800000、900000、以及至少1000000个聚合酶。在连续延伸靶核酸模板的其他实施方式中,聚合酶与模板的比例选自至少由以下组成的组:链延伸反应混合物中使用的每个引物-探针与聚合酶2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、20:1、30:1、40:1、50:1、60:1、70:1、80:1、90:1、100:1、150:1、200:1、250:1、300:1、350:1、400:1、450:1、500:1、550:1、600:1、650:1、700:1、750:1、800:1、850:1、900:1、950:1、1000:1、10000:1、20000:1、30000:1、40000:1、50000:1、60000:1、70000:1、80000:1、90000:1、100000:1、200000:1、300000:1、400000:1、500000:1、600000:1、700000:1、800000:1、900000:1、以及至少1000000:1。多个聚合酶可以是相同类型聚合酶的同质集合,或者可以是2种或多种不同类型聚合酶的异质集合,例如3、4、5、6、7、8、9、10、20、30、40、50、多达100或多种不同的聚
合酶。
[0158]
在一些实施方式中,本发明的链延伸反应混合物在待在其中延伸的较大模板核酸样品内具有多个靶核酸模板。在特定的实施方式中,除了检测被询问的靶核酸的存在之外,可以使用本领域公知的校准方法来确定靶的拷贝数。例如,对照标准可以采用具有已知拷贝数的已知序列。本发明核酸检测反应(例如,laces和/或faces)的结果可以与对照标准进行比较以确定测试样品中靶核酸的拷贝数。
[0159]
在本发明的核酸靶检测方法的一些实施方式中,在特定的单独限制空间(confinement)(例如,液滴等)中提供酶连接物,使得在限制空间区域中可以存在少至一个至多个引物-探针、以及被询问的测试样品核酸模板;同时存在多个(例如,许多)聚合酶和相应的多种其他酶形成连接物(图9a)。在该实施方式中,当聚合酶从靶模板核酸脱落(解离)时(图9b),限制在特定靶核酸模板区域的许多其他聚合酶中的一者,在先前聚合酶在模板上停止或解离的位置处,有利地且相对立即地开始其链延伸(图9b)。也即是,利用第一聚合酶发生链延伸,直到第一聚合酶让位并从模板核酸上解离;然后利用第二聚合酶(不同于第一聚合酶)继续链延伸反应,直到第二聚合酶让位并从模板核酸上解离;然后利用第三聚合酶(不同于第二聚合酶,其可以是第一聚合酶或特定链延伸反应中多个聚合酶的另一聚合酶),直到第三聚合酶让位并从模板核酸上解离,以此继续。本领域技术人员将容易理解,使用这种方法,只要靶核酸检测反应正在运行,靶核酸模板不断被延伸。本领域技术人员也将容易理解,当使用本文公开的基本连续的延伸方法时,核酸链延伸长度仅受限于靶核酸长度和/或用于相应链延伸反应的反应限制空间区域的物理尺寸。
[0160]
因此,本文提供的本发明方法的特定实施方式利用连续链延伸靶核酸模板的方法。在该实施方式中,如本文所用的“连续”、“连续地延伸靶核酸模板”或“基本上连续地延伸靶核酸模板”并不意味着单个聚合酶能够连续地延伸对于整个长核酸链的延伸长度的特定靶核酸,而是指凭借多个聚合酶连续具有大量聚合酶可用于从先前的核酸酶从特定靶核酸模板上解离的位置接管下一个核苷酸的dntp链延伸,靶核酸模板的反应区域中的多个聚合酶,相互一起能够连续地延伸特定靶。
[0161]
在本发明的用于检测靶核酸序列的连续核酸链延伸方法的特定实施方式中,特别是多个聚合酶用于对核酸样品中的每种相应靶模板核酸进行延伸的情况下,总核酸链延伸长度仅受限于在特定反应限制区域中提供的靶模板核酸的长度。例如,可以通过对样品中的每个单一靶核酸模板使用一个或多个聚合酶来实现本文所考虑的总核酸链延伸长度,最高可达整个染色体的长度,例如,5000万至最高大约3亿个碱基对(例如,300mbp)等。在本文考虑的其他某些实施方式中,通过本发明的链延伸核酸检测方法实现的核酸链延伸长度可以选自至少由以下各项组成的组:200bp、300bp、400bp、500bp、600bp、700bp、800bp、900bp、1000bp(即1kbp)、5kbp、10kbp、20kbp、30kbp、40kbp、50kbp、100kbp、200kbp、300kbp、400kbp、400kbp、400kbp、800kbp、900kbp、1000kbp(1mbp)、5mbp、10mbp、20mbp、50mbp、75mbp、100mbp、200mbp、300mbp、400mbp、500mbp、600mbp、700mbp、800mbp、900mbp、1000mbp。
[0162]
由于靶模板核酸被多个聚合酶基本连续地延伸,因此反应不受单一酶实现特定核酸链延伸长度的能力的限制。这允许在本发明方法中使用具有更高特异性和低错误率的酶。根据本发明检测靶核酸的方法的特定实施方案,本文考虑在反应混合物中每个引物-探针使用多于一个(即,多个)聚合酶可以实现无限长的核酸链延伸长度。如本文所述,当一个
聚合酶从靶模板核酸上脱落时,另一聚合酶将从前一聚合酶停止的地方继续,这有利地改变了可以选择或优化聚合酶以在本发明方法中执行的方式。为此,本领域技术人员可以选择具有非常低错误率的聚合酶,即使该聚合酶也可能具有相对短的核酸链延伸长度。这为该特定实施方式提供了优势,因为选择用于本发明方法的聚合酶不需要长核酸链延伸长度和特异性。
[0163]
本发明的模板核酸还可以包括非天然核酸,例如pna、修饰的寡核苷酸(例如,包含不是典型生物rna或dna的核苷酸的寡核苷酸,例如2
’‑
o-甲基化的寡核苷酸)、修饰的磷酸骨架等。核酸可以是例如单链或双链的。
[0164]
如本文所用,短语“核苷酸类似物”是指可用于dna合成的修饰核苷酸(例如,诸如datp、dttp、dgtp、dctp和dutp的修饰的dntp)。用于本发明的核苷酸类似物可以是能够作为聚合酶底物并且针对选择性切割活性的任何合适的核苷酸类似物。已经表明,核苷酸可以被修饰并仍然用作聚合酶和其他酶的底物。在考虑核苷酸类似物的变体的情况下,可以通过活性分析来确定核苷酸类似物与聚合酶或与另一酶活性(例如外切核酸酶活性)的相容性。进行活性分析是简单明了的并且在本领域中是公知的。
[0165]
核苷酸类似物可以是例如在其多磷酸盐链中三个或多个磷酸盐上具有标记的核苷多磷酸盐,该核苷多磷酸盐在被掺入生长的链时被切割。多磷酸盐可以是纯多磷酸盐,例如-o
‑‑
po3-或焦磷酸盐(例如,ppi),或者多磷酸盐可以包括替代物。关于类似物和制备此类类似物的方法的更多细节可见于美国专利7,405,281、9,464,107等,出于所有目的这些专利通过引用将其全部并入本文。
[0166]
dntp有五种类型,即脱氧腺苷三磷酸(datp)、脱氧鸟苷三磷酸(dgtp)、脱氧胞苷三磷酸(dctp)、脱氧胸苷三磷酸(dttp)和脱氧尿嘧啶三磷酸(dutp)。代替datp,datpαs可以用作datp的替代物,因为它充当dna聚合酶的底物,而不是荧光素酶的底物。考虑用于本文的其他修饰核苷酸在本领域中是公知的,例如在jordheim等advances in the development of nucleoside and nucleotide analogues for cancer and viral diseases,nat.rev.drug discov.(2013)12:447-464所公开的,以及例如在guo等four-color dna sequencing with 3
′‑
o-modified nucleotide reversible terminators andchemically cleavable fluorescent dideoxynucleotides,proc.natl.acad.sci.u.s.a.(2008)105:9145-9150等所公开的(通过引用将其各自整体并入本文)。
[0167]
本文提供的本发明方法的其他实施方案实施了经修饰以提高对聚合酶的特异性并降低对荧光素酶的亲和力的核苷酸类似物。该实施方式的优点是避免了核苷酸直接与荧光素酶的非特异性相互作用(这会导致产生背景发光)。例如,荧光素酶可能使用脱氧三磷酸腺苷(datp)或dgtp,而不是使用atp。本领域技术人员可以容易地选择核苷酸类似物(包括对核苷酸的修饰),以降低其对荧光素酶的亲和力,同时提高其对聚合酶的特异性。
[0168]
在其他实施方式中,datpαs、dgtpαs、dctpαs、dttpαs用于代替datp、dgtp、dctp和dttp,这在本文中旨在减少核苷酸与聚合酶以外的酶(例如,荧光素酶)的非特异性反应。
[0169]
使用本文提供的聚合酶-atp硫化酶-荧光素酶的本发明串联3-酶系统和方法,仅当特异性询问引物-探针与靶序列结合并启动链延伸时才会产生指示特定询问靶核酸序列存在的发光信号,这将产生多个焦磷酸(ppi)离去基团,用atp再生酶/荧光素酶放大环。
[0170]
如本文所用,短语“离去基团”是指在相应的dntp掺入模板核酸链过程中当和/或
在通过本发明3酶聚合酶-atp硫化酶-荧光素酶反应切割时从相应dntp释放的多磷酸链。在本文的一个具体实施方式中,多磷酸盐是焦磷酸盐(ppi),它从dntp上切割下来(图1a和图1b),转化为atp(atp;图1b和1c),然后通过荧光素酶反应释放到反应混合物中(图1b和1c),用于随后通过反应环转换回atp(参见图1b、图1c、图2、图3和图10)。在本发明的靶核酸序列检测方法的其他实施方式中,离去基团是附有荧光标记的焦磷酸盐(ppi+fl);参见例如图11和图12。
[0171]
如本文所述,来自图1c的焦磷酸盐(ppi)(或来自图11和图12的ppi+fl)可以在atp硫化酶/荧光素酶放大环中多次环回到图1b。焦磷酸盐(ppi)可以被循环以放大每个dntp掺入到延伸序列中的事件的相应发光信号,焦磷酸盐(ppi)被循环的此处可以选自至少由以下各项组成的组:5、10、20、30、40、50、60、70、80、90、100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950、1000、10000、20000、30000、40000、50000、60000、70000、80000、90000、100000、200000、300000、400000、500000、600000、700000、800000、900000、以及至少1000000次。
[0172]
使用的反应条件也可以影响各种反应的相对速率。因此,控制反应条件可用于确保核酸链延伸反应成功地以高速率从模板产生可检测的光信号(例如,发光和/或荧光)信号。反应条件包括例如缓冲液的类型和浓度、反应的ph、温度、盐的类型和浓度、影响酶动力学的特定添加剂的存在,以及包括金属辅因子的各种辅因子的类型、浓度和相对量。在美国专利8,133,672中详细描述了对反应条件的操作以实现或增强聚合酶的两个慢步(slow-step)行为,该专利以引用的方式并入本文。
[0173]
酶促反应通常在缓冲液的存在下进行,缓冲液部分地用于控制反应混合物的ph。在某些情况下,缓冲液的类型会影响聚合酶反应的动力学,当需要这种动力学时,可能会导致两个慢步动力学。例如,在某些情况下,使用iris作为缓冲液对于获得两个慢步反应很有用。合适的缓冲液包括,例如,taps(3-{[三(羟甲基)甲基]氨基}丙磺酸)、bicine(n,n-双(2-羟乙基)甘氨酸)、iris(三(羟甲基)甲胺)、aces(n-(2-乙酰氨基)-2-氨基乙磺酸)、tricine(n-三(羟甲基)甲基甘氨酸)、hepes(4-2-羟乙基-1-哌嗪乙磺酸)、tes(2-{[三(羟甲基)甲基)]氨基}乙磺酸)、mops(3-(n-吗啉代)丙磺酸)、pipes(哌嗪-n,n'-双(2-乙磺酸))和mes(2-(n-吗啉代)乙磺酸)。
[0174]
反应的ph可以影响聚合酶反应的动力学,并且可以用作聚合酶反应条件之一以获得表现出两个慢步动力学的反应。可以将ph调节到产生两个慢步反应机制的值。ph通常在约6至约9之间。在一些实施方式中,ph在约6.5和约8.0之间。在其他实施方式中,ph在约6.5和7.5之间。在特定实施方式中,ph选自约6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4或7.5。
[0175]
可以调节反应的温度以确保反应的相对速率发生在适当的范围内。反应温度可能取决于聚合酶的类型或采用的选择性切割活性。本文所用的温度也可用于操纵和控制两种碱之间的氢键以及碱与反应混合物中的水的相互作用,从而控制反应组分的溶解度。
[0176]
在一些实施方式中,可以将添加剂(例如镁、辅酶a等)添加到反应混合物中,这将影响反应的动力学。在某些情况下,添加剂可以与酶的活性位点相互作用,例如作为竞争性抑制剂。在某些情况下,添加剂可以以影响反应动力学的方式与远离活性位点的部分酶相互作用。可以影响动力学的添加剂包括,例如,在分析反应中具有竞争性但非反应性的底物
或抑制剂,以调节反应速率,如美国实用专利8,252,911中所述的添加剂,处于全部目的该专利的全部公开内容以引用的方式全文并入本文中。
[0177]
作为另一示例,可以添加诸如氘的同位素以影响聚合酶反应中一个或多个步骤的速率。在某些情况下,由于氘同位素效应,氘可用于减缓聚合酶反应中的一个或多个步骤。通过改变聚合酶反应步骤的动力学,在一些情况下,可以实现如本文所述的两个慢步动力学。氘同位素效应可用于例如控制核苷酸的掺入速率,例如通过减慢掺入速率。也可以使用除氘之外的同位素,例如碳(例如,
13
c)、氮、氧、硫或磷的同位素。
[0178]
作为又一示例,可用于控制聚合酶反应动力学的添加剂包括添加有机溶剂。溶剂添加剂通常是水溶性有机溶剂。溶剂不需要在所有浓度下都是可溶的,但通常在用于控制聚合酶反应动力学的量下是可溶的。尽管不受理论束缚,但据信溶剂可影响聚合酶的三维构象,这可影响聚合酶反应中各个步骤的速率。例如,溶剂会影响涉及构象变化的步骤,例如异构化步骤。添加的溶剂也会影响迁移步骤,在某些情况下会减慢迁移步骤。在某些情况下,溶剂通过影响氢键相互作用起作用。
[0179]
可用于控制核苷酸链延伸中聚合酶反应的一个或多个步骤的速率的水混溶性有机溶剂包括例如醇、胺、酰胺、腈、亚砜、醚和酯和具有多个这些官能团的小分子。示例性溶剂包括醇类,例如甲醇、乙醇、丙醇、异丙醇、甘油和小分子醇。醇可以具有一个、两个、三个或多个醇基。示例性溶剂还包括小分子醚,例如四氢呋喃(thf)和二恶烷、二甲基乙酰胺(dma)、二甲亚砜(dmso)、二甲基甲酰胺(dmf)和乙腈。
[0180]
水混溶性有机溶剂可以以足以控制聚合酶反应动力学的任何量存在。溶剂的添加量通常小于溶剂重量或体积比体积的40%。在一些实施方式中,添加约0.1%至30%、约1%至约20%、约2%至约15%和约5%至12%的溶剂。控制动力学的有效量可以通过本文所述的方法和本领域已知的方法确定。
[0181]
控制聚合酶反应条件的另一方面涉及辅助因子的类型、水平和相对量的选择。例如,在聚合酶反应过程中,二价金属辅助因子(如镁或锰)将与酶-底物复合物相互作用,在活性位点的定义中发挥结构作用。对于聚合酶反应中金属辅因子相互作用的讨论,参见例如arndt等的biochemistry(2001)40:5368-5375。合适的条件包括美国专利8,257,954中描述的条件,出于所有目的,该专利通过引用整体并入本文。
[0182]
在本发明方法的一个具体实施方式中,聚合酶反应的速率和保真度通过调节dntp核苷酸类似物的浓度来控制,使得聚合酶在诸如底物浓度、光激发量、化学修饰水平等参数方面在接近理想的条件下运行。因此,本文预期聚合酶达到其最大核酸链延伸长度,例如大约数万个碱基对,类似于在天然环境中实现的dna合成长度。
[0183]
在另一实施方式中,如上所述,因为atp酶(例如,atp硫化酶)和聚合酶的速率可以根据酶的类型和来源而显著变化,因此本文采用的atp硫化酶反应产生的atp速率可以通过调节atp硫化酶浓度等反应条件单独调节。
[0184]
本发明包括用于检测和/或量化来自核酸样品的靶核酸序列的系统。该系统提供同时检测和/或定量来自被询问的核酸样品(例如,细胞dna、循环dna等)内的多个核酸模板的一个或多个靶序列。该系统可以结合本文所述的所有试剂和方法,并提供容纳样品所需的仪器,用来自发光反应的激发光照射样品,在链延伸过程中检测来自样品发出的光,以随着相应dntp被聚合酶掺入到期结合的模板核酸上借助于从dntp或dntp类似物切割的焦磷
酸离去基团(例如,ppi)从检测到的发光产生强度对时间的数据;因而检测和/或量化靶核酸序列的存在。
[0185]
如本文所用,短语“检测光”是指用于检测例如从荧光素酶反应发射的发光、从荧光团发射的荧光等的公知的方法。
[0186]
如本文所用,术语“atp再生酶/荧光素酶环”的语法变体(例如,atp硫化酶/荧光素酶环、agppase/荧光素酶环、ppdk/荧光素酶环等),一般指atp再生酶和荧光素酶之间的酶环(图1a至图1c和图2、图3),由此在荧光素酶催化的发光反应之后释放新的焦磷酸盐分子(ppi)(图1c)。这种新释放的ppi可以再次成为atp再生酶(例如,atp硫化酶、agppase、ppdk等)的底物,从而在atp再生酶(例如,atp硫化酶、agppase、ppdk等)和荧光素酶之间形成酶环(图1b和图1c)。如图1b-图1c所示,在这个环中,ppi被atp硫化酶回收并转化为atp(atp),然后可以被荧光素酶催化产生可检测的发光信号,同时再次释放ppi。这将产生来自焦磷酸离去基团的连续信号,从而充当由最近核苷酸的酶促掺入产生的荧光素酶信号的放大机制。
[0187]
在一个实施方式中,本文提供的用于检测靶核酸序列的系统通常包括在例如独特的液滴等内的具有一个或多个单一聚合酶、多种样品核酸模板和/或一种或多种引物(例如,引物-探针)。在特定实施方式中,这些反应被独特地限制,使得它们的发光信号可以在基因合成发生时分配给相应的核酸靶序列。在本文提供的其他实施方式中,例如在独特的限制空间、液滴等内,多个聚合酶与单个引物一起在被询问的样品核酸模板上使用。链延伸试剂通常包括两种或多种核苷酸类似物,优选四种dntp或对应于datp、dttp、dagp和dctp的核苷酸类似物。聚合酶将核苷酸或核苷酸类似物依次添加到从引物延伸的生长链中。每个添加的核苷酸或核苷酸类似物与模板核酸上的相应碱基互补,从而产生的生长链部分与模板互补。
[0188]
该系统包含发光试剂(例如萤火虫荧光素酶和荧光素),用于在相应dntps掺入模板链并进一步经历如图1b-图1c所示的atp反应(通过atp-硫化酶)和发光反应(例如,萤火虫荧光素酶+荧光素)。发光反应提供可检测的发光信号。
[0189]
该系统还包括检测光学器件,用于观察来自可检测光信号(例如,发光和/或荧光)的信号,该信号对应于在聚合酶介导的添加到模板链期间的各个dntp掺入事件。在一个实施方式中,检测光学器件同时观察多个单分子聚合酶核酸合成反应,从而通过从本发明的级联的3酶(聚合酶-atp硫化酶-荧光素酶)系统中用于形成的atp的离去基团(例如,焦磷酸盐;ppi)观察每个核苷酸或核苷酸类似物添加物的发光信号。对于每个观察到的核酸链延伸反应,检测光学器件同时观察来自产生与相应dntp相对应的相应发光反应的每个ppi离去基团的信号。
[0190]
该系统还包括计算机,其被配置为检测和/或量化来自由各个离去基团产生的发光反应的所观察的信号;由此所观察的信号用于检测和/或量化被询问的特定核酸序列的存在。计算机通常以信号数据的形式从检测光学器件接收关于所观察的信号的信息。计算机使用信号数据存储、处理和解释信号数据,以便检测和/或量化靶核酸序列的存在。
[0191]
可以与本发明一起使用的光学检测系统在例如美国专利8,802,424、7,714,303、和7,820,983中进行了描述,所述美国专利中的每一个出于所有目的以全文引用的方式并入本文中。
[0192]
用于执行本发明的过程的计算机的范围可以是从运行英特尔奔腾(intel pentium)或酷睿(duocore)处理器的例如pc或macintosh
tm
类型计算机的个人计算机,到工作站、实验室设备、或者运行unix、linux、windows
tm
或其他系统的高速服务器。本发明的逻辑处理可以完全由执行软件和/或固件逻辑指令的通用逻辑处理器(例如,cpu)来执行;或者完全由并入到也可以包括软件或固件元件的实验室或诊断系统或成像系统中的专用逻辑处理电路(例如,asic)来执行;或者由通用逻辑电路和专用逻辑电路的组合来执行。信号数据的数据格式可以包括任何适宜的格式,包括基于数字图像的数据格式(例如jpeg、gif、bmp、tiff)或其他核酸检测特定格式;此外可以采用基于视频的格式,例如avi、mpeg、mov、rmv或其他视频格式。本发明的软件过程通常可以用各种编程语言进行编程,包括例如matlab、c、c++、c#、net、visual basic、python、java、cgi等。
[0193]
在本发明的方法和系统的一些实施方式中,光学限制区域用于增强同时观察多个靶模板聚合酶链延伸反应的能力。通常,光学限制区域设置在基板上并用于仅向非常小的空间或体积提供电磁辐射或从非常小的空间或体积导出这种辐射。这样的光学限制区域可以包括结构限制区域(例如孔、凹槽、导管等),或者可以包括与其他组件结合的光学过程,以提供检测或从非常小的体积得出所发射的辐射(例如,发光等)。这种光学限制区域的示例包括利用例如基于全内反射(tir)的光学系统通过基板的透明部分以在基本内产生全内反射的角度的系统。
[0194]
在一个具体实施方式中,优选的光学限制区域是微液滴(例如,油包水乳液等),其可以包含如本文所述的用于检测靶核酸序列的单独的本发明核酸链延伸反应混合物。例如,核酸链延伸混合物反应成分可以以下方式进行分离:每个微液滴包含酶和相关试剂的一个聚合酶-atp硫化酶-荧光素酶集合、以及待询问的模板核酸的一个样品,由此每个信号检测单元集中在单个微液滴上。在本文中考虑每个微液滴是单个核酸靶检测反应室(cell),其包含单独的聚合酶-atp硫化酶-荧光素酶的3酶系统反应。微液滴反应室在本发明的核酸靶序列检测方法中也有利地用作微透镜以将光聚焦在相应的信号检测单元上。
[0195]
本发明的基板通常是刚性的,并且通常是平面的,但也不一定是刚性或平面的。在基板包括光学限制区域的阵列的情况下,基板的尺寸和形状通常可以与光学仪器接口以允许来自光学限制区域的光的照明并且运行测量来自光学限制区域的光。通常,基板也将被配置为与液体介质保持接触(例如包含试剂和基板和/或反应组分)以用于光学测量。
[0196]
在基板包括光学限制区域阵列的情况下,阵列可以包括在基板表面上的单行或多行的光学限制区域,其中当存在多个通道时,通道的数量通常为至少2个,更常见的超过10个,更常见的超过100个。光学限制区域的子阵列可以沿基板的x轴或y轴水平或对角地对齐。单独的限制可以以任何形式(例如排列成行和列)跨基板表面排列或排列在基板的表面上,以形成网格,或形成圆形、椭圆形、椭圆形、圆锥形、矩形、三角形或多面体图案。为了最小化相邻光学限制区域之间的最近邻距离,六边形阵列有时是优选的。
[0197]
光学限制区域阵列可以结合到提供易于分析、高通量或其他优点的结构中,例如微量滴定板等。这种设置在本文中也被称为“阵列的阵列”。例如,可以将子阵列结合到另一个阵列中(例如微量滴定板),其中板的每个微孔都包含光学限制区域的子阵列。
[0198]
根据本发明,在单个基板上超过100个、超过1000个、超过10,000个、超过100,000个或者超过1,000,000单独反应室(例如,微液滴等)的阵列中,提供限制区域的阵列(例如,
反应室、微液滴等)。此外,反应室阵列通常以相对高的密度包含在基板的表面上。这样的高密度通常包括以每mm2基板表面区域大于10个反应室的密度,优选地大于100个反应室,更优选地大于500或甚至大于1000个反应室,以及在许多情况下高达或大于100,000个反应室的密度存在的反应室。尽管在许多情况下,阵列中的反应室以规则的方式间隔开,例如,在给定的阵列中,2、5、10、25、50或100或多行和/或列的规则间隔的反应室,在某些优选情况下,以偏离标准行和/或列格式的阵列提供反应室的组织是有利的。在优选的方面,基板包括作为特定反应室的微液滴作为光学限制区域,以限定基板上的离散的链延伸反应区域。
[0199]
光学限制区域的阵列的总尺寸通常可以在几纳米到几毫米的厚度范围内,以及从几毫米到50厘米的宽度和/或长度。阵列可以具有大约几百微米到几毫米厚度的总体尺寸,并且可以具有取决于所需光学限制区域的数量的任何宽度或长度。
[0200]
可以调整各个限制区域之间的间距以支持将采用子阵列的特定应用。例如,如果预期应用需要阵列的暗场照明,而没有或具有来自光学限制区域的入射波长的低水平衍射散射,则可以将各个限制区域相对于入射波长彼此靠近放置。
[0201]
阵列中的单独限制区域可以提供小于约1000仄普托升(zeptolter)、小于约900仄普托升、小于约200仄普托升、小于约80仄普托升、小于约10仄普托升的有效观察体积。如果需要,可以提供小于1仄普托升的有效观察体积。在优选的方面,单独的限制区域产生有效的观察体积,该体积分辨以生理相关浓度或接近生理相关浓度存在的单独的分子(例如酶)。许多生化反应的生理相关浓度范围从微摩尔到毫摩尔,因为大多数酶的米氏常数都在这些范围内。因此,优选的光学限制区域阵列具有用于检测以高于约1微摩尔(um)、或更优选高于50um、或甚至高于100um的浓度存在的单个分子的有效观察体积。在特定实施方式中,典型的微液滴尺寸范围为10微米至200微米,因此典型的微液滴体积约为5皮升至20纳升。
[0202]
在光学限制区域内的化学或生物化学分析的上下文中,通常希望确保所关注的反应至少在限制区域的光学询问部分内发生,并且优选地使得仅链延伸反应的反应在单独的限制区域的询问部分内(例如,在微液滴等内)发生。本领域公知的多种方法通常可以用于在观察体积内提供单独的分子。多种这些方法在美国专利7,763,423中进行了描述,所述美国专利出于所有目的以全文引用的方式并入本文中,所述美国专利尤其描述了经过修饰的表面,所述经过修饰的表面被设计成将单独的分子以期望的密度固定到表面,使得大约一个、两个、三个或一些其它选择数量的分子预期落入给定观察体积内。通常,此类方法利用稀释技术以通过稀释表面上的偶联基团或稀释与所关注的分子相互作用的中间或最终偶联基团或这些的组合来在表面上提供相对低密度的此类基团。本文中还考虑使用这些稀释技术来提供一个、两个、三个或一些其它选择数量的laces链延伸反应以使其落入给定观察体积内而不会固定到表面,如将发生在本文中考虑的用于光学限制的微液滴反应室中。在一个具体的实施方式中,稀释技术用于在微液滴中提供本发明的单一链延伸反应,以用于本发明的laces链延伸方法。
[0203]
本发明的系统和方法可以通过使用本领域中公知的系统在经历本文中所阐述的3酶(聚合酶-atp硫化酶-荧光素酶)(例如,多磷酸标记;ppi+fl)之后监测来自核苷酸类似物的经过标记的离去基团的信号而产生经过改进的靶核酸序列测定。通常,信号数据由处理器接收。由处理器接收的信息可以直接来自检测光学器件,或者来自检测光学器件的信号
可以在由处理器接收之前由其它处理器处理。可以应用许多初始校准操作。这些初始校准步骤中的一些初始校准步骤可以在运行开始时仅执行一次或在运行期间在更连续的基础上执行。这些初始校准步骤可以包含如质心测定、比对、网格化、漂移校正、初始背景减除、噪声参数调整、帧速率调整等。这些初始校准步骤中的一些初始校准步骤(如分装)可以涉及如下文进一步讨论的从处理器返回到检测器/相机的通信。
[0204]
通常,将某种类型的光谱迹线测定、光谱迹线提取或光谱滤波器应用于初始信号数据。这些滤波步骤中的一些或全部滤波步骤可以任选地在过程中的稍后的某个点(例如,在脉冲标识步骤之后)执行。光谱迹线提取/光谱滤波器可以包含本领域中公知的多个降噪滤波器和其它滤波器。因为接收到的初始信号数据是由一系列相邻像素检测器捕获的光水平或光子计数,所以在这个阶段针对本文中所讨论的许多示例系统执行光谱迹线测定。例如,在一个示例系统中,针对每一帧处的单独的波导捕获来自位置的像素(或强度水平)。不同频率或光谱的光将落在位置中的多于一个位置上,并且通常存在一些重叠并且可能存在大量重叠。根据本发明的特定实施方式,光谱迹线提取可以使用如下文所讨论的各种类型的分析来执行,所述各种类型的分析为每个光谱迹线提供最高信噪比。
[0205]
作为光谱迹线测定的替代方案,本发明的方法还可以分析从多个像素位置处的强度水平得出的单个信号(这可以被称为经过求和的光谱信号或灰度光谱信号或强度水平信号)。然而,在许多情况下,已经发现光谱提取提供更好的snr(信噪比)并且因此在单独地对提取的光谱迹线进行某种程度的脉冲分析时提供脉冲检测。在另外的实施方式中,根据本发明的方法可以使用统计模型(如隐马尔可夫模型)来分析多个捕获到的像素数据。
[0206]
测定了来自进入atp再生酶/荧光素酶放大环反应的离去基团(例如,焦磷酸盐;ppi)的发光信号是否可以归类为显著信号脉冲或事件。在一些示例系统中,由于可用于检测的光子数量少并且由于检测速度,因此各种统计分析技术可以在测定是否已检测到显著脉冲时执行。
[0207]
如果信号被标识为显著脉冲或信号事件,则另外的任选的光谱曲线比较可以执行以验证光谱分配。在光谱迹线是在脉冲标识之前或期间测定的实施方式中,这个光谱曲线比较是任选的。为了进行这个测定,来自对应于离去基团(例如,焦磷酸盐;ppi)的通道的发光信号用于评估来自核苷酸标记的脉冲是否对应于掺入事件。
[0208]
如上所述,信号数据输入到处理系统,例如经过合适编程的计算机或其它处理器。信号数据可以直接从检测系统输入例如用于实时信号处理,或其可以从信号数据存储文件或数据库输入。在一些情况下,例如在寻求对检测系统的性能的即时反馈、调整检测或其它实验参数的情况下,将采用实时信号处理。在一些实施方式中,信号数据从检测系统存储在合适的文件或数据库中并且以反应前或非实时方式对其进行处理。
[0209]
与本发明结合使用的信号数据可以呈多种形式。例如,数据可以是表示在给定检测器或基于阵列的检测器的检测点处接收到的光学信号的强度值的数值数据。信号数据可以包括来自成像检测器(如ccd、emccd、iccd或cmos传感器)的图像数据。在特定实施方式中,为了检测来自单个分子的低量光子,考虑使用光电倍增管(pmt)和/或光子计数器单元以在本发明的方法中使用。在任一种情况下,根据本发明的特定实施方式使用的信号数据通常包含强度水平信息和光谱信息两者。在单独的检测器元件的上下文中,此种光谱信息通常将包含对在其上检测到强度的检测器部分(例如,像素)的定位或位置的标识。在图像
数据的上下文中,光谱图像数据通常将是在系统包含整体信号的光谱分辨率时从与用于成像系统和检测器的经过校准的光谱图像数据相关的图像数据得出的数据。光谱数据可以根据从检测器提取的图像数据获得,或可替代地,光谱数据的推导可以在检测器上发生,使得光谱数据将从检测器提取。
[0210]
对于上文所描述的测序方法,可以存在被检测系统检测到的不是来自掺入事件的信号的结果的一定量的光学信号。此种信号将表示系统中的“噪声”,并且可以从可以在监测到的反应的内部、在检测系统的内部和/或在所有上述的外部的多个来源得出。本发明的实践有利地减少了通常存在于现有技术方法中的这些总体噪声来源。
[0211]
在检测系统的内部但在反应混合物的外部的噪声来源可以包含例如渗入滤波光学器件的反射的激发辐射;来自底物或光学组件中的任何光学组件的散射激发或荧光辐射;相邻信号源的空间串扰;系统的任何或全部光学组件的自发荧光;来自检测器(例如,ccd)的读出噪声、增益寄存器噪声(例如,用于emccd相机)等。其它系统得出的噪声贡献可以来自数据处理问题,如背景校正误差、聚焦漂移误差、自动聚焦误差、脉冲频率分辨率、比对误差等。仍其它噪声贡献可以从在整个系统的外部的来源得出,包含环境光干扰、灰尘等。
[0212]
这些噪声成分在可以与掺入事件相关联的任何信号脉冲下面促成背景光子。因此,噪声水平通常将形成极限,据此可以测定任何信号脉冲都具有统计学意义。
[0213]
标识对整体信号数据的噪声贡献可以通过本领域中众所周知的多种方法来执行,包含例如在不存在所关注的反应的情况下进行信号监测,其中测定任何信号数据都不相关。可替代地并且优选地,基线信号从由系统产生的信号数据中估计并减去,使得在对所关注的反应进行测量时并与其同时进行噪声测量。基线的产生和应用可以通过多种手段来执行,将在下文更详细地描述所述多种手段。
[0214]
根据本发明,信号处理方法在如广泛应用于所有基于非显著脉冲的信号事件的噪声与可以以合理程度的置信度被认为与掺入事件相关联并且因此可以暂时地被标识为掺入事件的显著信号脉冲之间进行区分在本发明的上下文中,首先基于信号事件是否满足多个不同的脉冲标准中的任一脉冲标准关于所述信号事件是否构成显著信号脉冲来对此种信号事件进行分类。一旦被标识或分类为显著脉冲,就可以对信号脉冲进行进一步的评估以测定信号脉冲是否构成掺入事件。如应当理解的,基于如本文中总体阐述的各种参数,将特定信号事件调用为显著脉冲并且最终调用为掺入事件的基础将经受一定量的误差。一个此种信号脉冲标准是与所讨论的信号事件相关联的信号与所有背景噪声的水平的比率(“信噪比”或“snr”),其提供了置信度或统计显著性的度量,用所述度量可以将信号事件分类为显著信号脉冲。为了将显著脉冲信号与系统性或其它噪声贡献区分开,信号通常必须在多个量度中的一个或多个量度(包含例如信号强度、信号持续时间、时间信号脉冲形状、脉冲间隔和脉冲光谱特征)方面超过信号阈值水平。
[0215]
通过简化示例,信号数据可以输入到处理系统中。如果信号数据在信号强度和信号持续时间中的一个或多个方面超过信号阈值,则可以将其视为显著脉冲信号。类似地,如果采用另外的量度作为阈值,则可以在将特定信号事件标识为显著脉冲时将信号与此量度进行比较。如应当理解的,这个比较通常将涉及前述量度中的至少一个量度,并且优选地涉及至少两个此类阈值,并且在许多情况下,在标识显著脉冲中涉及前述阈值中的三个或所
有四个阈值。
[0216]
无论是在信号强度、信号持续时间、脉冲形状、间隔或脉冲光谱特征或这些的组合的方面,尽管在一些情况下,信号阈值可以从整体信号数据的百分比中标识出,但是此类阈值通常将基于来自先前实验数据的预期信号分布来测定,其中统计评价指示此种取阈值是合适的。具体地,在一些情况下,阈值信号强度和/或信号持续时间可以被设置成不包括除整体信号数据的一定分数或百分比之外的所有数据,从而允许实时设置阈值。再次,然而,在百分比或绝对信号值方面,阈值水平的标识通常将与先前的实验结果相关。在替代性方面,可以在给定评价的上下文中测定信号阈值。具体地说,例如,脉冲强度阈值可以基于绝对信号强度,但是此种阈值不会考虑信号背景水平的变化(例如,通过试剂扩散),所述变化可能会影响所使用的阈值,特别是在信号与背景水平相比相对弱的情况下。
[0217]
在依赖于掺入事件的实时检测的特别优选方面,显著信号脉冲的标识可以依赖于在信号强度和信号持续时间两个方面都横越阈值的信号分布。例如,当检测到在增加方向上越过较低强度阈值的信号时,监测来自同一组检测元件的随后的信号数据(例如,像素),直到信号强度在减小方向上越过相同或不同强度阈值。一旦检测到合适的强度的峰值,就将所述峰值在其期间超过一个或多个强度阈值的时间段的持续时间与持续时间阈值进行比较。在峰值包括足够的持续时间的足够强的信号的情况下,将所述峰值调用为显著信号脉冲。
[0218]
作为使用强度阈值和持续时间阈值的补充或替代方案,脉冲分类可以在将脉冲分类为显著时采用多个其它信号参数。此类信号参数包含例如脉冲形状、信号的光谱曲线(例如,脉冲光谱质心)、脉冲高度、脉冲扩散比、脉冲间隔、总信号水平等。
[0219]
在标识显著信号脉冲之后或之前,信号数据可以与特定信号类型相关。在与本发明结合使用的光学检测方案的上下文中,这通常表示产生信号数据的信号的特定光谱曲线。
[0220]
通过电调制(teem)实现靶富集
[0221]
本文还提供了从含核酸的样品中富集或分离靶核酸的方法,所述方法包括:
[0222]
a.在具有第一电极和第二电极的流体室中容纳包含离子和含核酸样品的电解液,其中至少一个电极附接有与靶核酸互补的多个捕获-探针(在图13-图19中描述),其中捕获-探针位于电极-溶液界面;
[0223]
b.向靠近电极-溶液界面的电解液施加退火-电压以通过该电极-溶液界面产生退火-ph水平(图19的上部分的循环x、y和z),其中退火-ph水平导致含核酸样品内的核酸与捕获-探针之间的任意数量的互补碱基对退火;
[0224]
c.向靠近电极-溶液界面的电解液施加变性-电压以通过电极-表面界面产生变性-ph水平(图19的上部分的循环x、y和z),其中变性-ph水平导致双链核酸变性,双链核酸包括捕获-探针对和靶核酸的杂交对,该杂交对比双链捕获-探针的全长短特定数量的碱基对或短特定范围的碱基对;以及
[0225]
d.在退火-电压和变性-电压之间调制电压,其中在最终应用相应的ph水平(例如退火或变性)之后,通过维持捕获-探针结合到电极上,从含核酸样品中富集或分离靶核酸(图19的上部分的循环z)。
[0226]
存在两个主要因素直接影响溶液中核酸(rna和dna)的结合动力学:温度和ph。迄
今为止,在现有技术中,温度一直是基因组学中使用的唯一因素。根据本发明,本发明的teem方法用电场和溶液中的离子运动代替了传统的现有技术基于温度的方法。这有利地在将基因组学分析中核酸处理的时间框架减少了几个数量级方面提供了质的飞跃。
[0227]
如本文所用的,短语“从含有核酸的样品中富集或分离”是指从含有核酸的样品中的其他核酸中物理分离所需的靶核酸(参见,例如,图19的上部分的循环z)。首次利用dna杂交和变性的电操作来富集、提取含核酸样品中的靶核酸和/或将含核酸样品中的靶核酸与其他核酸分离。根据本发明,电压、电场和相应的ph水平的调节允许精确捕获所需的靶核酸,同时允许在实施任何检测分析之前洗去样品中的非靶核酸。
[0228]
本发明的teem方法利用双电层的独特操作在溶液中的精确点产生精确的ph水平。例如,当电极与固体或液体离子导体(电解质)接触并在电极上施加电势时,反荷离子向电极移动,而共离子从表面排斥(见图18)。这会在电极-溶液界面处产生离子分布,从而产生ph分布或梯度(参见图18的带框绿色阴影区域标记的ph梯度;以及图19的循环x部分中的带框阴影区域)。这允许在溶液中的精确点(precise point)产生精确的ph水平,从而导致非常特定数量的核酸碱基对的杂交(即,退火;图19的循环x上部分的绿色阴影框区域)和变性(图19的循环x下部分的蓝色阴影框区域)。这种精确的控制在温度下是不可能的。
[0229]
如本文所述,(电解液的正离子的)正电荷分布在带负电的电极处最大,正电荷随着在空间维度上距电极上施加的负电荷的距离增加而减少。还例如,正电荷分布可以通过在带负电的电极处形成双电层的水合氢(h3o+)离子以及一些示例中的镁离子(mg2+)的积累形成,从而在靠近带负电的电极的双层区域中产生酸性ph环境。类似地,负电荷分布可以通过在带正电的电极处形成双电层的羟基(oh-)离子的积累形成,从而在靠近带正电的电极的双电层区域中产生碱性ph环境。
[0230]
本文提供的本发明teem核酸富集方法包括通过调制电场来调节溶液中的离子分布,其中完成一个循环的时间可以是微秒级到其他亚秒级持续时间,例如,取决于电导率、离子扩散速率、离子电荷和施加电压。根据本发明,所施加的净电荷被调制或交替(例如,调制施加在电极上的净负电荷和净正电荷),从而离子电荷分布(即,ph水平)同样被调制或交替。
[0231]
本发明的teem方法利用位于活性“双层”区域的界面中的表面附着的捕获-探针(图13-图16),其中通过调制所施加的电压/电场来控制ph分布。样品中的所有核酸通过布朗运动周期性地进入流体室的双层区域。在活性双层区产生至少两种ph分布;退火-ph水平(图19的上部分的循环x、y和z)和变性-ph水平(图19的下部分的循环x、y和z)。在一个具体实施方式中,退火-ph水平能够使任意数量的互补碱基对杂交。而变性-ph水平仅使超过特定阈值数(或范围)的一定数量(或范围)碱基对能够杂交或维持杂交,同时使低于阈值的若干互补碱基对变性。通过以特定频率调制所施加的电场,从而在变性-ph水平和退火-ph水平之间调节ph水平,使进入双层区域(具有精确控制的相应ph水平(或者在退火-ph水平或变性-ph水平))的靶核酸结合捕获-探针并保持与捕获-探针的结合,而不需要的核酸(例如,非靶核酸)不与捕获-探针结合或从捕获-探针变性。在一个实施方式中,每个循环需要大约一秒(例如,1kh)并且整个富集、分离和/或提取过程在大约50个循环中完成。
[0232]
本发明的teem方法的优点是它使得与靶核酸结合的非特异性引物不存在、无效或可忽略不计。这进而有利地在本发明的靶核酸检测方法中(特别是当与用于检测本文提供
的靶核酸的本发明laces方法组合使用时)产生非常少或没有背景噪声。本发明的teem方法提供的另一优点是不需要独立的信号来表明已经实现了完美的靶核酸(例如,sars-cov2等)杂交。一旦靶核酸富集或分离,它就可以通过本领域已知的任何方式检测;或通过本文提供的本发明laces方法。在特定实施方式中,在从未结合捕获-探针(本文也称为捕获/引物-探针)的材料中富集和/或分离靶核酸之后,在检测之前将含有核酸的样品洗去。
[0233]
如本文所用,在使用本发明的teem方法富集或分离靶核酸的上下文中,短语“检测靶核酸”是指采用任何公知的技术来检测一种特定核酸的存在。在捕获靶核苷酸之后,用于检测靶核酸存在的示例性方法包括选自下组的方法:laces、直接检测、pcr(包括但不限于5
’‑
核酸酶实时pcr)、滚环扩增、连接和pcr的组合,以及扩增后的检测步骤、标记探针、嵌入荧光染料等。
[0234]
用于检测靶核酸的其他合适的检测系统包括但不限于扫描电子显微镜、近场扫描光学显微镜(nsom)、全内反射荧光显微镜(tirfm)等。例如,在文献中可以找到应用此类技术来分析和检测表面上的纳米级结构的指南,如以下以引用的方式并入本文的参考文献所证明的:reimer等,编辑,scanning electron microscopy:physics of image formation and microanalysis,2nd edition(springer,1998);nie等,anal.chem.,78:1528-1534(2006);hecht等,journal chemical physics,112:7761-7774(2000);zhu等,editors,near-field optics:principles and applications(world scientific publishing,singapore,1999);drmanac,国际专利公开wo 2004/076683;lehr等,anal.chem.,75:2414-2420(2003);neuschafer等,biosensors&bioelectronics,18:489-497(2003);neuschafer等,美国专利序列号6,289,144等。特别感兴趣的是tirfm,例如,如neuschafer等的美国专利序列号6,289,144所公开的;以及如drmanac,国际专利公开wo2004/076683。
[0235]
在特定实施方式中,用于采用本发明方法检测靶核酸的本发明设备仪器(例如,图20中所示的一次性使用盒)包括三个基本组件:(i)用于存储样品、检测试剂和处理试剂(例如,探针、洗涤溶液)等并将它们转移到阵列的流体系统;(ii)保持或包括阵列、并且具有流通和电势(电压)控制能力的反应流体室或流动室;以及(iii)照明和检测系统(例如,与图20中所示的便携式设备结合的一次性使用盒)。在一个实施方式中,流体室或流动室具有能够调节电压的电压控制子系统。
[0236]
如本文所用,短语“含核酸样品”可以是其中包含核酸的任何生理材料。示例性的“含核酸样品”包括:细胞、唾液、尿液、血液、头发、精液、唾液、骨骼、组织牙齿、细胞裂解物、病毒、细胞-dna、基因组dna等。在特定实施方式中,可以通过介电泳分离或获得含核酸样品。例如,可以通过细胞裂解物的介电泳分离或获得细胞dna、基因组dna、病毒核酸或总核酸。
[0237]
本发明的方法包括在流体室中容纳电解液的步骤。如本文所用,短语“流体室”是指可容纳本文所述的任何溶液混合物(例如电解液、延伸混合物等)的封闭结构。在特定实施方式中,流体室可包括由电绝缘材料形成并具有一个或多个电极的内表面。如本文所用,短语“电解液”是指可包括以下一种或多种的离子溶液:离子,例如包括h+、oh-和mg2+等;以及模板核酸链延伸试剂,例如,包括引物-探针、聚合酶、核苷酸、以及一种或多种双链核酸分子。本发明的teem方法包括在包含电解液的流体室的电极之间施加或调制(通过施加的电压)电场的步骤,以产生既使双链核酸变性又使单链核酸退火的电解液的调制后的ph水
平(例如,变性-ph水平和退火-ph水平)。
[0238]
如本文所用,术语“电极”是指公知的导体,电流通过其进入或离开物体、物质或区域。电极通常用于与电路的非金属部分接触。如本领域公知的,对于电子宏观尺度电路需要有两个极性,因此需要两个电极。在本文提供的本发明方法和芯片/寡核苷酸阵列的特定实施方式中,第二电极可以被接地。在其他实施方式中,至少一个电极(例如,第一电极)或两个电极可以具有附着于其上的捕获-探针和/或引物。例如,在一个实施方式中,正电极可能在活性区域和负电极处产生低ph,这可以对应于活性“双层”区域的高ph。已经发现,基于ph水平的变性和杂交基本上是对称的;即,为了实现双链核酸的变性,可以同时应用较低的ph水平和较高的ph水平。
[0239]
如本文所用,短语“电极-溶液界面”是指溶液(例如,电解液)与流体室内的一个或多个电极接触的位置。
[0240]
如本文所用,短语“靠近电极-溶液界面”是指相对靠近电极-溶液界面的电解液区域(参见图18的带框深色阴影区域标记的ph梯度)。施加的电场在电解液中产生“双层”空间离子分布,包括电吸引到带相反电荷的电极的第一层第一离子和电吸引到第一层的第二层第二离子。离子分布取决于电极的尺寸和几何形状,以及施加在电极上的电压(例如,电场的大小),以及电解液中的离子浓度。在一些实施方式中,例如,本发明的方法可以包括选择和/或调整所施加的变性和退火-电场的幅度和持续时间的过程。在一些实施方式中,可以通过跨电极施加直流电压来产生直流电场。在其他实施方式中,可以施加ac电场,例如,其还可以包括dc偏压。例如,可以通过使用施加的外部变性和退火-电场操纵电解液溶液(例如电解液溶液)中的“双层”来产生和控制电荷的空间分布,从而提供相应的场控退火-ph水平和变性-ph水平。在其他实施方式中,可以产生多种电场模式(dc或ac,基于不同的波形、频率、幅度)和序列以影响两条或多条链的结合动力学。
[0241]“双层”是指当物体置于液体中时围绕物体的表面(描述为图18中的在正离子顶部分层的一排负离子)的两个平行的层,例如,第一层和第二层。第一层(stern层)包括正或负的表面电荷,并且由直接吸附到物体上的离子形成,例如本发明teem方法中的正电极或负电极。第二层(扩散层)由吸引到表面的离子组成,以电屏蔽第一层。扩散层由与物体(例如电极)松散结合的自由离子组成。根据溶液的离子浓度和表面上的电荷(或施加的电压),双层可以延伸至微米。它是电解液溶液内的区域,其中由各自的变性和退火-电压和电场产生变性-ph水平和退火-ph水平(参见图18的带框深色阴影区域标注的ph梯度)。
[0242]
在特定实施方式中,捕获-探针(或捕获/引物-探针)位于电极-溶液界面处。如本文所用,短语“捕获-探针”是指可以结合感兴趣的相应的靶核酸的单链或部分单链核苷酸(在图13-图16中描绘为红色和绿色区域)。捕获-探针长度可以是5-500个或更多核苷酸;或在其他实施方式中可以是5-400、5-300、5-200、5-150、5-100、5-90、5-80、5-70、5-60、5-50、5-40、5-30、5-25、5-20、5-15、10-500、10-400、10-300、10-200、10-150、10-100、10-90、10-80、10-70、10-60、10-50、10-40、10-30、10-25、10-20、10-15、15-500、15-400、15-300、15-200、15-150、15-100、15-90、15-80、15-70、15-60、15-50、15-40、15-30、15-25、15-20、20-500、20-400、20-300、20-200、20-150、20-100、20-90、20-80、20-70、20-60、20-50、20-40、20-30、20-25、25-500、25-400、25-300、25-200、25-150、25-100、25-90、25-80、25-70、25-60、25-50、25-40或25-30个核苷酸长度。在特定实施方式中,捕获-探针还在核酸链延伸反
应中用作引物,在本文中称为“捕获/引物-探针”,例如在本文提供的本发明laces方法中进行的捕获/引物-探针。
[0243]
如本文所用,短语“捕获/引物-探针”是指具有可结合感兴趣的相应的靶核酸的区域的单链或部分单链核苷酸;并且还用作在相应的靶核酸模板上引发核酸链延伸反应的引物(在图14-图16的每一个中描绘为捕获-探针的绿色区域)。在其他实施方式中,捕获/引物-探针可以具有可结合感兴趣的相应的靶核酸的区域(图13的捕获/引物-探针的绿色区域);并且还包含一个区域,该区域用作在相应的靶核酸模板上引发核酸链延伸反应的引物(描绘为图13的捕获/引物-探针的深蓝色区域)。捕获/引物-探针长度可以是5-500个或更多核苷酸;或在其他实施方式中可以是5-400、5-300、5-200、5-150、5-100、5-90、5-80、5-70、5-60、5-50、5-40、5-30、5-25、5-20、5-15、10-500、10-400、10-300、10-200、10-150、10-100、10-90、10-80、10-70、10-60、10-50、10-40、10-30、10-25、10-20、10-15、15-500、15-400、15-300、15-200、15-150、15-100、15-90、15-80、15-70、15-60、15-50、15-40、15-30、15-25、15-20、20-500、20-400、20-300、20-200、20-150、20-100、20-90、20-80、20-70、20-60、20-50、20-40、20-30、20-25、25-500、25-400、25-300、25-200、25-150、25-100、25-90、25-80、25-70、25-60、25-50、25-40或25-30个核苷酸长度。
[0244]
如本文所用,短语“多个捕获-探针”或“多个捕获/引物-探针”是指多于一个探针。多个探针可以是任何基板(例如电极、芯片表面等)上的寡核苷酸阵列的形式。尽管在特定实施方式中使用平面阵列表面,但捕获-探针寡核苷酸阵列可以在几乎任何形状的表面上或在包括电极的多个表面上制造。捕获-探针和捕获/引物-探针被设计和构建为与被询问的特定靶核酸互补。在捕获-探针位于表面(例如电极等)上的特定实施方式中,表面(例如电极)上的捕获-探针或捕获/引物-探针的密度在每cm2约100至约1,000,000个寡核苷酸探针。
[0245]
本领域技术人员将认识到单个寡核苷酸探针可以用作引物-探针、捕获-探针和/或捕获/引物-探针,这取决于使用哪种本发明的方法。
[0246]
如本文所用,短语“捕获-探针的密度”或“捕获/引物-探针的密度”是指相应电极表面上的探针数量。在一些实施方式中,探针的密度通过每cm2寡核苷酸的数量来量化。在一个具体的实施方式中,相应电极上的寡核苷酸捕获-探针或捕获/引物-探针阵列是高密度阵列,其包括选自大于以下的密度:每cm2约100个、约1,000个、约2,000个、约3,000个、约4,000个、约5,000个、约6,000个、约7,000个、约8,000个、约9,000个、约10,000个、约15,000个、约20,000个、约30,000个、约40,000个、约50,000个、约60,000个、约70,000个、约80,000个、约90,000个、约100,000个、约150,000个、约00,000个、约250,000个、约300,000个、约400,000个、约500,000个、约600,000个、约700,000个、约800,000个、约900,000个、或者约1,000,000个寡聚核苷酸探针。
[0247]
在其他实施方案中,选择密度使得靶核酸的捕获在某个时间上限内完成,例如180s、160s、140s、120s、110s、100s、90s、80s、70s、60s、50s、40s、30s、25s、20s、15s、14s、13s、12s、11s、10s、9s、8s、7s、6s、5s、5s、3s、2s和1s。
[0248]
例如,取决于流体室和/或电极表面的相应物理尺寸,探针的密度可以使得预期的靶核酸在少于以下时间内被捕获:500s、400s、300s、200s、180s、120s、100s、90s、80s、70s、60s、50s、40s、30s、25s、20s、15s、10s、9s、8s、7s、6s、5s、4s、3s、2s以及1s。
[0249]
如本文所用,短语“调制”、“调制电压”、“调制电流”或其语法变体,当用于本发明方法中施加的电压(电流)的上下文中时,是指交替本文提供的本发明方法中的至少两种不同的电压(例如,在退火-电压和变性-电压之间),以允许双链碱基对的变性和退火。所施加的电压在电极和电解液溶液界面附近(或接近)产生电场,此处称为“电极-溶液界面”。所产生的特定电场导致溶液中的离子迁移,进而导致电极-溶液界面附近的相应ph水平有利于或导致核酸退火或变性,这取决于所施加的特定电压。
[0250]
因此,对于每个变性-电压,存在相应的相应变性-电场和相应的变性-ph水平。类似地,对于每个退火-电压,存在相应的相应退火-电场和相应的退火-ph水平。在特定实施方式中,所施加的退火-电压产生退火-电场和退火-ph水平,这进而促进互补核酸退火成双链。所施加的变性-电压产生促进互补核酸变性成单链的变性-电场和变性-ph水平。因此,所施加的交替电压和产生的相应调制电场产生在本文中提供的本发明的至少2种不同的ph水平(例如,退火-ph水平和变性-ph水平)。
[0251]
如本文所用,短语“退火-电压”是指在特定电解液溶液中促进或引起互补单链核酸退火成双链的电压。所施加的退火-电压产生相应的退火-电场和退火-ph水平,这进而促进或导致互补单链核酸退火成双链。
[0252]
如本文所用,短语“退火-ph水平”是指在特定电解液溶液中促进或引起互补核酸退火成双链的ph水平。在特定实施方式中,响应于施加到电解液溶液的特定退火-电场,通过在溶液中的离子迁移,产生相应的退火-ph水平。
[0253]
如本文所用,短语“使含有核酸的样品内的核酸与捕获-探针之间的任意数量的互补碱基对退火”是促进或引起特定长度的单链核酸退火,或允许双链核酸维持双链的ph水平条件的范围。
[0254]
如本文所用,短语“变性-电压”是指在特定电解液溶液中促进或引起互补双链核酸变性成单链的电压。所施加的变性-电压产生相应的变性-电场和变性-ph水平,这进而促进或导致互补双链核酸变性(或分离)成单链。
[0255]
如本文所用,短语“变性-ph水平”是指在特定电解液溶液中促进或导致互补双链核酸变性成单链的ph水平。在特定实施方式中,响应于施加到电解液溶液的特定变性-电场,通过在溶液中的离子迁移,产生相应的变性-ph水平。
[0256]
如本文所用,短语“比双链捕获-探针短的双链核酸的变性”或“包括捕获-探针和靶核酸的杂交对的双链核酸的变性,该双链核酸是比双链捕获-探针的全长短的特定数量的碱基对或特定范围的碱基对”是指只要变性的双链的长度短于双链捕获-探针或捕获/引物-探针的全长,促进或导致特定长度的双链核酸变性的ph水平条件的范围。在一个实施方式中,变性的双链核酸的长度是1-100个碱基对,其短于双链捕获-探针,对应于短于双链捕获-探针全长的“特定范围的碱基对”。在某些实施方式中,所应用的特定变性-电压、变性-电场和变性-ph水平不需要使少于引物-探针的精确数量的碱基对变性。在这些实施方式中,其可以是小于全长双链引物-探针的变性碱基对长度范围,本文称为“短于双链捕获-探针的全长的特定范围的碱基对”。这样做的原因是,对于与正在被分析的相应靶序列特异性互补的较长的引物-探针长度(例如长度为15、20、25、30、40、50或更多个核苷酸),其他非靶序列与引物-探针具有5、10、15、20或更多个相同核苷酸的统计学概率是极低的,使得取决于所选择的相应捕获/引物-探针的长度,探针-靶富集调制步骤中的变性-电压可以是将至
少5、10、15、20、25、30、35、40、45、50或更多个碱基对的双链核酸(短于杂交的引物-探针全长)变性的电压量。也即是,非靶核酸与捕获-探针或捕获/引物-探针匹配的11个或更多互补碱基对的统计学概率非常小,可以忽略不计。因此,在特定实施方式中,本文考虑使用的变性-电压的上限阈值可以是针对约20个或更多个核苷酸的捕获-探针或捕获/引物-探针,在1-5、1-10、1-15个碱基对范围内变性的电压。在该实施方式中,对于约25个或更多个的寡核苷酸的捕获-探针或捕获/引物-探针,可以使用在1-20个碱基对范围内变性的电压。
[0257]
在其他实施方式中,例如,如果捕获/引物-探针长度为20个核苷酸,则电场/电压阈值可以设置在使小于约10-15个碱基对的任何双链核酸变性,使得捕获靶核酸的特异性显著高于如果不调制变性-电压(例如,第二ph水平)和退火-电压(例如,第一ph水平)的情况。在该实施方式中,双链捕获-探针、引物-探针或捕获/引物-探针的全长为20个碱基对。
[0258]
在本发明teem核酸富集或分离方法的其他实施方式中,变性-ph水平导致具有与选自以下范围相对应的数量的互补碱基对的双链核酸变性:1到x-5个互补碱基对;1到x-10;1到x-15个互补碱基对;1到x-20个互补碱基对;1到x-25个互补碱基对;1到x-30个互补碱基对;1到x-35个互补碱基对;1到x-40个互补碱基对;1到x-245个互补碱基对;1到x-50个互补碱基对,其中x是相应捕获-探针的核苷酸长度。
[0259]
在使用25个核苷酸引物-探针的其他示例性实施方式中,可以选择施加的电压/电场,例如,以使1-20、1-15、1-10或1-5范围碱基对的双链变性,同时允许25个碱基对全长双链引物-探针保持杂交。在该实施方式中,双链捕获-探针、引物-探针或捕获/引物-探针的全长为25个碱基对。又例如,在使用20个核苷酸的引物-探针的实施方式中,可以选择施加的能量/电压,例如,以使1-15、1-10或1-5范围碱基对的双链变性,同时允许20个碱基对全长双链引物-探针保持杂交。在使用50个核苷酸的引物-探针的实施方式中,可以选择施加的能量/电压,例如,以使1-40、1-30、1-20、或1-10范围碱基对的双链变性,同时允许50个碱基对全长双链引物-探针保持杂交。
[0260]
因此,在其他实施方式中,选择的变性-电压可以是使在小于捕获-探针或引物-探针长度的核苷酸范围内的双链核酸(通过产生的ph水平)变性的量,选自:5-100、5-90、5-80、5-70、5-60、5-50、5-40、5-30、5-20、5-15、5-10、10-100、10-90、10-80、10-70、10-60、10-50、10-40、10-30、10-20、10-15、2-50、2-40、2-30、2-20、2-15、2-10、2-5、3-50、3-40、3-30、3-20、3-15、3-10、3-5、4-50、4-40、4-30、4-20、4-15、4-10个核苷酸以及更少。
[0261]
在其他特定实施方式中,尤其是在捕获/引物-探针长度等于或大于约20个核苷酸的情况下,可以选择在引物-探针富集步骤期间施加的能量/电压/电场,使得小于相应的捕获/引物-探针长度的任何双链碱基配对(在5bp-10bp、10bp-15bp、15bp-20bp、20bp-25bp等范围内)被变性。
[0262]
在其他实施方式中,可以选择在引物-探针调节的变性步骤期间施加的能量/电压/电场,使得比相应捕获/引物-探针小至少1bp开始的任何范围的双链碱基对将会被变性。例如,在使用25个核苷酸的引物-探针的实施方式中,所施加的能量/电压将使得24个碱基对的双链变性,同时允许25个碱基对全长双链引物-探针保持杂交。又例如,在使用20个核苷酸的引物-探针的实施方式中,所施加的能量/电压将使得19个及更少碱基对的双链变性,同时允许20个碱基对全长双链引物-探针保持杂交。在使用50个核苷酸的引物-探针的实施方式中,所施加的能量/电压将使得49个或更少碱基对的双链变性,同时允许50个碱基
对全长双链引物-探针保持杂交。在使用40个核苷酸的引物-探针的实施方案中,所施加的能量/电压将使小于20-30个双链碱基对范围的任何双链碱基对变性。
[0263]
在使用更长的引物-探针(例如,20个或更多个核苷酸)的实施方式中,所选择的变性-电压可以是使双链核酸变性的量比相应的捕获/引物-探针长度小1bp以上。例如,用于使杂交的双链核酸溶解/变性的变性-电压可以是使比相应捕获/引物-探针长度小2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50或更多bp的双链变性的电压量。
[0264]
在特定实施方式中,在富集或分离期间调制电场的总循环次数在以下范围内:1x102–
1x10
12
个总循环;1x103–
1x109个总循环;1x103–
1x108个总循环;1x103–
1x107个总循环;以及1x103–
1x106个总循环等。为了关联在本发明的teem方法中使用的时间和频率,1,000个总周期对应于0.2khz的调制电场频率持续5秒,0.1khz持续10秒,0.0666khz持续15秒,或0.05khz持续20秒;而10亿个总周期对应于200mhz持续5秒,100mhz持续10秒,66.6mhz持续15秒,或50mhz持续20秒。
[0265]
因此,本文所考虑的用于调制电场的频率在0.1khz至200ghz的范围内。在其他实施方式中,本位中所考虑使用的频率范围包括0.1khz至200ghz、0.1khz至100ghz、0.1khz至1ghz、0.1khz至100mhz、0.1khz至10mhz、0.1khz至1mhz、0.1khz至900khz、0.1khz至800khz、0.1khz至700khz、0.1khz至600khz、0.1khz至500khz、0.1khz至400khz、0.1khz至300khz、0.1khz至200khz、以及0.1khz至100khz等。在又一实施方式中,退火-电压和变性-电压之间的调制电压处于0.1-1000khz范围内的调制频率(例如,每秒100-1,000,000个周期)。
[0266]
用于调制电场(并且因此调制电极附近的溶液ph水平)的步骤的总秒数在以下范围内:1至500秒、1至400秒、1至300秒、1至200秒、1至100秒、1至90秒、1至80秒、1至70秒、1至60秒、1至50秒、1至40秒、1至30秒、1至25秒、1至20秒、1至15秒、以及1至10秒。在本文中所考虑的用于调制电场的其他时间范围是5至500秒、5至400秒、5至300秒、5至200秒、5至100秒、5至90秒、5至80秒、5至70秒、5至60秒、5至50秒、5至40秒、5至30秒、5至25秒、5至20秒、以及5至15秒。因此,本领域技术人员将理解,电场的调制频率可以根据相应的实施方式的特定时间内所需的循环总数而变化。
[0267]
如本文所用,短语“相应ph水平的最终应用”(例如,退火-或变性-ph水平)是指电场调制的最终循环;因此,核酸分别在捕获-探针上或从捕获-探针上退火和变性的最终循环。一旦电场的调节和相应的ph水平停止,只有靶核酸将保持与捕获-探针或捕获/引物-探针的结合。
[0268]
如本文所用,短语“保持与捕获-探针结合”是指在变性-电压、变性-电场和变性-ph水平被施加于反应混合物以变性并去除捕获-探针中的非靶核酸时,靶核酸保持其与捕获-探针序列的杂交状态。
[0269]
teem+laces
[0270]
在本发明teem方法的一个具体实施方式中,本发明的富集或分离靶核酸的方法与本发明的用于检测靶核酸存在的方法相结合使用。因此,本文提供的用于检测含核酸的样品中是否存在靶核酸序列的方法,包括:
[0271]
a.在具有第一电极和第二电极的流体室中容纳包含离子和含核酸样品的电解液,其中至少一个电极附接有与靶核酸互补的多个捕获/引物-探针,其中捕获/引物-探针位于
电极-溶液界面;
[0272]
b.向靠近电极-溶液界面的电解液施加退火-电压以通过该界面产生退火-ph水平,其中退火-ph水平导致含核酸样品内的核酸与捕获/引物-探针之间的任意数量的互补碱基对退火;
[0273]
c.向靠近电极-溶液界面的电解液施加变性-电压以通过界面产生变性-ph水平,其中变性-ph水平导致双链核酸变性,双链核酸包括捕获-探针对和靶核酸的杂交对,该杂交对比双链捕获-探针的全长短特定数量的碱基对或短特定范围的碱基对;以及
[0274]
d.在退火-电压和变性-电压之间调制,其中在最终应用相应的ph水平(例如退火或变性)之后,通过维持捕获/引物-探针结合到电极(例如,第一电极)上,从含核酸的样品中富集或分离靶核酸,其中结合的靶核酸是用于模板定向延伸合成的模板链;
[0275]
e.提供一种延伸混合物,该延伸混合物包含:(i)聚合酶,(ii)atp再生酶,(iii)发光酶(例如,萤火虫荧光素酶),以及(iv)聚合酶-atp再生酶-发光试剂溶液,该试剂溶液具有用于对生长中的核酸链进行模板定向延伸合成的组分,其中所述试剂溶液包括atp再生酶底物、发光底物、以及多种类型的dntp或核苷酸类似物,其中每种类型的核苷酸类似物具有可被聚合酶切割的离去基团,其中在各核苷酸类似物聚合酶依赖性地结合模板链时离去基团被切割;
[0276]
f.进行核酸延伸合成,使得如果捕获/引物-探针与靶核酸序列杂交,则一个或多个核苷酸类似物被顺序添加到模板链中,由此:a)核苷酸类似物与聚合酶结合,b)当核苷酸类似物上的离去基团被聚合酶切割时,核苷酸类似物被聚合酶掺入模板链上,其中通过atp再生酶产生atp将离去基团与atp再生酶底物结合,然后c)将atp与发光酶结合,其中在再生各离去基团时发光底物被发光酶催化产生发光;以及
[0277]
g.在发生核酸合成时检测来自发光的光,由此检测到的光指示存在特定靶核酸序列。在特定实施方式中,在提供步骤(e)的延伸反应混合物之前,从含核酸样品中洗掉未结合捕获/引物-探针的材料。
[0278]
在特定实施方式中(如图13所示),通过间隔序列(捕获-探针的红色部分)吸附到得电极的捕获/引物-探针(在图13的所用部分中以红色、绿色和蓝色描绘),包含能够结合rna-靶核酸序列的rna-捕获-探针病毒捕获序列(绿色区域)。在该实施方式中,捕获/引物-探针还包括3’端rna捕获-探针区域,其是能够从核酸模板链(例如,dna模板链)起始核酸链延伸反应的引物序列(深蓝色区域)。在该实施方式中,捕获/引物-探针的引物序列(深蓝色区域)与第三部分中列出的人工连接-dna模板链互补。更具体地,捕获/引物-探针的引物序列与人工dna序列区域(图13的第三部分的浅蓝色区域的dna模板序列)互补,该人工dna序列区域是与rna靶核酸序列的部分/区域(靠近与捕获-探针序列相结合的rna靶核酸序列的区域(在一些实施方式中,是上游或下游和/或中部靠近))互补的5’端人工dna序列区域(图13的第三部分的绿色区域的dna模板序列)。
[0279]
在该实施方式中,为了起始laces链延伸反应,通过捕获/引物-探针的捕获-探针区域(绿色区域)从样品中捕获rna靶核酸;所捕获的rna靶核酸的邻近区域进而结合/捕获人工连接dna模板链(位于图13的第三部分的绿色区域的dna模板链),进而进一步结合捕获/引物-探针的引物序列(图13的捕获/引物-探针的蓝色区域),以在核酸链延伸混合物中存在聚合酶的情况下起始laces链延伸。
[0280]
在本发明方法的某些实施方式中,本文只不过使用的捕获-探针、捕获/引物-探针、或引物-探针可以包括间隔序列,该间隔序列在探针中位于用于捕获相应靶核酸的起点部分之前(如图13至图16中捕获-探针的红色区域所示)。在特定实施方式中,间隔序列直接与电极结合,并在电极和捕获序列的起点之间提供寡核苷酸间隔(如图13至图16中捕获-探针的红色区域所示)。如本文所用,短语“间隔序列”是指本文描述的任何探针内的任何长度的寡核苷酸序列。在特定实施方式中,探针的间隔序列与电极结合。
[0281]
dial+teem
[0282]
在特定实施方式中,本发明的方法可以与介电泳技术集成而无需额外的制造工艺,例如,从而允许包括样品处理、纯化和制备步骤的低成本集成解决方案。例如,施加的电场最初可用于通过介电泳技术分离和浓缩总核酸;之后,使用本发明的teem方法来富集或分离所需的靶核酸。
[0283]
因此,本文还提供了用于从哺乳动物细胞样品中富集或分离靶核酸的方法,所述方法包括:
[0284]
a.在具有第一电极和第二电极的流体室中容纳包括离子和哺乳动物细胞样品的电解液;
[0285]
b.裂解细胞以形成细胞裂解物;
[0286]
c.向含有细胞裂解物的溶液施加不对称介电电场,其中来自细胞裂解物样品的总核酸被至少一个电极(例如,第一电极)捕获;
[0287]
d.从流体室中洗去未被捕获的细胞裂解物;
[0288]
e.将总核酸重悬到流体室中的包括离子的电解液溶液中,其中至少一个电极附接有与靶核酸互补的多个捕获-探针,其中捕获-探针位于电极-溶液界面;
[0289]
f.向靠近电极-溶液界面的电解液施加退火-电压以通过该电极-溶液界面产生退火-ph水平,其中退火-ph水平导致总核酸与捕获-探针之间的任意数量的互补碱基对退火;
[0290]
g.向靠近电极-溶液界面的电解液施加变性-电压以通过界面产生变性-ph水平,其中变性-ph水平导致双链核酸变性,双链核酸包括捕获-探针对和靶核酸的杂交对,该杂交对比双链捕获-探针的全长短特定数量的碱基对或短特定范围的碱基对;以及
[0291]
h.调制退火-电压和变性-电压,其中在最终应用相应的ph水平(例如退火或变性)之后,通过维持捕获/引物探针结合到电极上,从总核酸中富集或分离靶核酸。
[0292]
dial+teem
[0293]
本文还提供了用于从细胞裂解物样品中富集或分离靶核酸的方法,所述方法包括:
[0294]
a.在具有第一电极和第二电极的流体室中容纳解包括离子和细胞裂解物样品的电解液溶液;
[0295]
b.向含有细胞裂解物样品的溶液施加不对称介电电场,其中来自细胞裂解物样品的总核酸被至少一个电极(例如,第一电极)捕获;
[0296]
c.从流体室中洗去未被捕获的细胞裂解物;
[0297]
d.将总核酸重悬到流体室中的包括离子的电解液溶液中,其中至少一个电极附接有与靶核酸互补的多个捕获-探针,其中捕获-探针位于电极-溶液界面;
[0298]
e.向靠近电极-溶液界面的电解液施加退火-电压以通过该电极-溶液界面产生退
火-ph水平,其中退火-ph水平导致总核酸与捕获-探针之间的任意数量的互补碱基对退火;
[0299]
f.向靠近电极-溶液界面的电解液施加变性-电压以通过界面产生变性-ph水平,其中变性-ph水平导致双链核酸变性,双链核酸包括捕获-探针对和靶核酸的杂交对,该杂交对比双链捕获-探针的全长短特定数量的碱基对或短特定范围的碱基对;以及
[0300]
g.调制退火-电压和变性-电压,其中在最终应用相应的ph水平(例如退火或变性)之后,通过维持捕获/引物-探针结合到电极上,富集或分离靶核酸。
[0301]
在特定实施方式中,通过终止不对称介电电场将总核酸重新悬浮到流体室中。在某些实施方式中,通过在流体室内裂解哺乳动物细胞样品来获得细胞裂解物。在特定实施方式中,通过选自由以下组成的组的方法检测靶核酸:如本文进一步阐述的laces、直接检测、pcr、滚环扩增、连接和pcr的组合,以及扩增后的检测步骤、标记探针、嵌入荧光染料等。在特定实施方式中,在检测之前,从含核酸样品中洗去未结合到捕获/引物-探针的材料。在一个具体实施方式中,通过laces方法检测靶核酸。从以下中获得哺乳动物细胞样品:细胞、唾液、尿液、血液、毛发、精液、唾液、骨、组织、牙齿、细胞裂解物、病毒、细胞核酸或基因组核酸。
[0302]
如本文所用,短语“哺乳动物细胞样品”是指以任何形式包含在任何来源中或从任何来源获得的细胞。例如,细胞可以在组织、唾液、尿液、血液、毛发、精液、唾液、骨骼、牙齿等中。
[0303]
如本文所用,短语“裂解细胞以形成细胞裂解物”是指公知的通过例如去污剂、病毒、酶促或渗透机制分解细胞的过程,并且因此这会损害细胞的完整性。含有裂解细胞内容物的流体被称为“细胞裂解物”,并且被理解为也含有来自任何已降解病毒的核酸内容物。本文使用细胞裂解来破坏开放的细胞,以避免可能使dna变性的剪切力。
[0304]
如本文所用,短语“来自细胞裂解物样品的总核酸”是指从样品内的任何来源收集或分析的特定样品内的基本上所有核酸,包括细胞(例如,细胞dna)、病毒颗粒(例如病毒核酸)和/或体液(例如血液、血清、尿液等)。
[0305]
如本文所用,短语“从流体室洗去未被捕获的细胞裂解物”是指从流体室洗去细胞裂解物的未被电极结合或捕获的非核酸部分。
[0306]
如本文所用,短语“重新悬浮总核酸”是指允许所捕获的分子(在这种情况下是样品中的核酸)通过中断导致其捕获的条件而重新进入溶液的公知的过程。
[0307]
如本文所用,短语“不对称介电场”或“介电泳力”或其语法变体是在非均匀ac电场中作用在可极化粒子上的力(图17)。如本文所用,“介电泳”是部分响应介电力的运动。介电泳(dep)是一种基于极性或可极化粒子在非均匀电场中的诱导运动的非接触式操作技术,适用于生物大分子和微米级纳米粒子。dep对大分子产生力,这取决于施加的电场的频率以及粒子与周围介质的极化特性之间的差异(图17)。
[0308]
根据本发明,来自裂解物的核酸的介电分离(本文称为dial)用于将rna以及来自于样品中其他细胞的dna,与样品的所有其他组分分离。在此处使用的dial过程中,从受试者收集的样品与化学裂解缓冲液混合。在最初的化学裂解过程之后,溶液包含细胞裂解物和其他血液成分(脂质、蛋白质、小分子等)以及从细胞中释放到溶液中的病毒rna和其他核酸(dna、rna)。dial用于分离所有核酸(rna和dna),具体取决于核酸与样品中所有其他成分的不同物理特性。
[0309]
根据本发明的方法,dial过程使用与用于包括本发明的teem和laces方法在内的整个detail过程完全相同的芯片设计。因此,本发明的方法和设备(例如,寡核苷酸芯片和/或阵列)的优点是所有三个过程可以在一个微流体设备和/或流体室中执行,这允许样品被获得和/或进入设备的即刻快速护理点分析。
[0310]
通常存在两种类型的介电泳,正介电泳和负介电泳。在正介电泳中,粒子通过介电泳向强场区域移动。在负介电泳中,粒子通过介电泳向弱场区域移动。结构(moiety)是表现出正介电泳还是表现出负介电泳,取决于粒子是否比周围介质更易极化。
[0311]
结构的“介电性质”是至少部分地确定其对介电场的响应的性质。结构的介电特性包括其有效电导率及其有效介电常数。对于组成均匀的颗粒(例如聚苯乙烯珠),有效电导率和有效介电常数与电场频率无关。对于组成不均匀的结构(例如细胞或细胞裂解物),有效电导率和有效介电常数是考虑了细胞表面(膜)和内部(包括其细胞核酸)的有效电导率和有效介电常数的值,并且可以随电场的频率而变化。此外,结构在电场中的介电力取决于它的大小。因此,结构的总尺寸在本文中被认为是结构的介电性质。有助于其介电性质的结构的性质包括结构上的净电荷;结构的组成(包括结构上、结构内部、或整个结构的化学基团或化学结构的分布);结构的大小;结构的表面构型;结构的表面电荷;以及结构的构象。
[0312]
如本文所用,“行波介电泳”是结构响应行波电场的运动。短语“行波介电泳(dep)力”是指由于行波电场而在粒子或分子上产生的力。理想行波场的特征是ac电场分量的相位值分布,其是粒子位置的线性函数。可以通过将适当的ac信号施加到在芯片上适当布置的微电极来建立行波电场。为了产生行波电场,需要施加至少三种类型的电信号,每种电信号具有不同的相位值。产生行波电场的示例是使用四个相位正交信号(0、90、180和270度)来激励芯片表面上图案化的四个线性平行电极。这样的四个电极可用于形成基本的重复单元。根据应用,可能有两个以上的此类单元彼此相邻。这将在电极上方或附近的空间中产生行进电场。只要按照本领域公知的某些空间顺序顺序排列电极元件,施加相序信号将导致在靠近电极的区域中建立行进电场。
[0313]
dial+teem+laces
[0314]
本文还提供了一种综合性“detail”方法,该方法使用dial以及本发明的从哺乳动物细胞样品开始的teem和laces方法。例如,本文提供了一种用于从哺乳动物细胞样品中富集或分离靶核酸的方法,所述方法包括:
[0315]
a.在具有第一电极和第二电极的流体室中容纳包括离子和哺乳动物细胞样品的电解液;
[0316]
b.裂解细胞以形成细胞裂解物;
[0317]
c.向含有细胞裂解物的溶液施加不对称介电电场,其中来自细胞裂解物样品的总核酸被至少一个电极(例如,第一电极)捕获;
[0318]
d.从流体室中洗去未被捕获的细胞裂解物;
[0319]
e.将总核酸重悬到流体室中的包括离子的电解液溶液中,其中至少一个电极附接有与靶核酸互补的多个捕获-探针,其中捕获-探针位于电极-溶液界面;
[0320]
f.向靠近电极-溶液界面的电解液施加退火-电压以通过该电极-溶液界面产生退火-ph水平,其中退火-ph水平导致总核酸与捕获-探针之间的任意数量的互补碱基对退火;
[0321]
g.向靠近电极-溶液界面的电解液施加变性-电压以通过界面产生变性-ph水平,
其中变性-ph水平导致双链核酸变性,双链核酸包括捕获-探针对和靶核酸的杂交对,该杂交对比双链捕获-探针的全长短特定数量的碱基对或短特定范围的碱基对;以及
[0322]
h.在退火-电压和变性-电压之间调制,其中在最终应用相应的ph水平(例如退火或变性)之后,通过维持捕获/引物-探针结合到电极(例如,第一电极)上,从总核酸中富集或分离靶核酸,其中结合的靶核酸是用于模板定向延伸合成的模板链;
[0323]
i.提供一种延伸混合物,该延伸混合物包含:(i)聚合酶,(ii)atp再生酶,(iii)发光酶(例如,萤火虫荧光素酶),以及(iv)聚合酶-atp再生酶-发光试剂溶液,该溶液具有用于对生长中的核酸链进行模板定向延伸合成的组分,其中所述试剂溶液包括atp再生酶底物、发光底物、以及多种类型的dntp或核苷酸类似物,其中每种类型的核苷酸类似物具有可被聚合酶切割的离去基团,其中在各核苷酸类似物聚合酶依赖性地结合模板链时离去基团被切割;
[0324]
j.进行核酸延伸合成,使得如果捕获/引物-探针与靶核酸序列杂交,则一个或多个核苷酸类似物被顺序添加到模板链中,由此:a)核苷酸类似物与聚合酶结合,b)当核苷酸类似物上的离去基团被聚合酶切割时,核苷酸类似物被聚合酶掺入模板链上,其中通过atp再生酶产生atp将离去基团与atp再生酶底物结合,然后c)将atp与发光酶结合,其中在再生各离去基团时发光底物被发光酶催化产生发光;以及
[0325]
k.在发生核酸合成时检测来自发光的光,由此检测到的光指示存在特定靶核酸序列。
[0326]
在一个具体实施方式中,来自总核酸的未结合捕获/引物-探针的材料在提供步骤(1)的延伸反应混合物之前被洗去。
[0327]
本文还提供了一种用于在含生物分子的样品中识别或选择在预定阈值以上相互结合的生物分子对的方法,该方法包括:
[0328]
a.提供具有彼此非共价结合的至少一对生物分子的样品;以及
[0329]
b.将样品暴露于富集溶液,该富集溶液具有两个或多个可变和可调节的物理条件或化学条件,这些物理条件或化学条件调节生物分子的结合亲和力高于或低于预选阈值,其中所选择的可变和可调节条件一起操作以分离具有低于预选阈值水平的结合亲和力的一对生物分子,其中可以通过两种或多种可调节条件中的一种或多种来调节结合亲和力。在特定实施方式中,富集溶液是稳定的。
[0330]
如本文所用,术语“生物分子”或生物分子是指存在于生物体中的分子,这些分子对于一种或多种典型的生物过程,例如细胞分裂、形态发生或发育是必不可少的。生物分子包括大分子(或聚阴离子)(如蛋白质、碳水化合物、脂质和核酸)以及小分子(如初级代谢物、次级代谢物和天然产物)。此类材料的更通用名称是生物材料。生物分子是生物体的重要组成部分,这些生物分子通常是内源性的,在生物体内产生。示例性生物分子包括例如rna、dna、pna、合成寡核苷酸、肽、蛋白质、适体、有机小分子等。
[0331]
如本文所用,短语“富集溶液”是指具有提供其物理和化学条件的许多物理和化学组分的电解质溶液。在特定实施方式中,富集溶液是“稳定的富集溶液”。稳定的富集溶液是指预先选择的条件或两个或多个可变和可调节的物理或化学条件的值,使得在富集溶液中建立这些物理或化学条件后,它们不会改变并起作用以实现预选结合亲和力阈值,该阈值允许选择具有高于阈值的结合亲和力并且因此结合同源生物分子对的分子(例如,与其同
40、10-30、10-20、15-90、15-80、15-60、15-50、15-40、15-30、20-90、20-80、20-70、20-60、20-50、20-40以及20-30℃。
[0340]
在某些实施方式中,预选阈值是碱基个数选自由以下组成的组核苷酸的长度:5-20、5-30、5-40、5-50、10-20、10-30、10-40、10-50、10-60、10-70、10-80、10-90、10-100、20-100、20-90、20-80、20-70、20-60、20-50、20-40、20-30、5-100、10-100、30-100、40-100、50-100、60-100、70-100、80-100、90-100、15-150、10-200、5-300、20-200、20-300、20-400、20-500、20-600、20-700、20-800、20-900、20-1000、至少5、至少10、至少15、至少20、至少30、至少40、至少50、至少60、至少70、至少80、至少90、至少100、至少150、至少200、至少300、至少400、至少500、至少600、至少700、至少800、至少900、至少1000个核苷酸碱基。在一个具体实施方式中,预选阈值是12个碱基对的核苷酸碱基长度。
[0341]
在本发明方法的其他实施方式中,生物分子对是配体及其同源受体,或者抗体及其同源抗原;富集溶液包含的可变和可调节条件是选自以下范围的ph:ph 2
–
ph 10、ph 3
–
ph 9、ph 4
–
ph 8、ph 5
–
ph 7、ph 2
–
ph 9、ph 2
–
ph 8、ph 2
–
ph 7、ph 2
–
ph 6、ph 2
–
ph 5、ph 3
–
ph 10、ph 4
–
ph 10、ph 5
–
ph 10、ph 6
–
ph 10、以及ph 7
–
ph 10。在其他实施方式中,可变和可调节条件是选自由以下组成的组的范围内的温度:1-99、2-98、3-95、4-94、5-90、10-85、15-70、20-65、25-60、30-50、10-80、10-70、10-60、10-50、10-40、10-30、10-20、15-90、15-80、15-60、15-50、15-40、15-30、20-90、20-80、20-70、20-60、20-50、20-40以及20-30℃。92.根据权利要求90-91所述的方法,其中预选阈值是以kd值表示的结合亲和力,kd值选自由以下各项组成的组:10-4到10-6μm灵敏度)、10-7到10-9(nm灵敏度)、10-10到10-12(pm灵敏度)、以及10-13到10-15(fm灵敏度)。
[0342]
本文还提供了一种富集溶液,其包含两个或多个可变和可调节的物理或化学条件,这些物理或化学条件调节高于或低于预选阈值的生物分子的结合亲和力,其中选择可变和可调节的条件以分离彼此非共价结合的生物分子对,其中生物分子对的结合亲和力高于或低于预选阈值,其中结合亲和力受这两种或多种可调节条件中的一种或多种调节。
[0343]
微流控芯片和设备
[0344]
本文还提供了一种基于便携式仪器的诊断系统,用于检测病原体(例如,sars-cov-2病毒等),该系统将本文中提供的本发明的每个详细过程(例如,dial、teem和laces)集成在设备中并从样本采集时产生快速的护理点结果。在特定实施方式中,快速护理点结果发生在少于选自30、25、20、25、20、15、10、5分钟的时间内。在一个特定实施方式中,快速结果在不到5分钟内出现。本发明平台将本发明的lace和teem方法与本文提供的当前可用组分结合起来,以产生样品制备、富集、稳健突破信号放大分析的稳健而优雅的组合;以及具有低系统复杂性的用户友好型便携式设备,可实现与金标准的临床和中心实验室结果相媲美的结果。
[0345]
使用本文提供的本发明电子调制(teem)和基于信号放大的发光检测技术(lace),本发明设备和/或系统能够检测核酸(例如病毒rna),以产生金标准的特异性和灵敏度性能。本发明的设备使用一次性使用盒(参见图20),其中包括所有需要的试剂,重要的是,具有可防止交叉污染并直接处理含有人类核酸的样品(例如当前的标准鼻咽拭子以及口咽和鼻拭子等)的密封的废物容器,一旦消耗性一次性使用盒插入系统,操作员无需任何进一步的参与。
[0346]
本发明系统和设备平台相对于当前主流方法具有以下优点:
[0347]
·
集成的、单室级联样品纯化、目标富集、基于信号放大的发光检测反应,
[0348]
·
通过电子调制和基于信号放大的发光检测进行快速样品制备和富集,以及
[0349]
·
所有这些都在一个封闭的系统中,对污染控制的需求最少。
[0350]
因此,在特定实施方式中,本文提供了用于采用本发明方法检测靶核酸的本发明一次性使用盒设备仪器(例如,图20中所示的一次性使用盒)包括三个基本组件:(i)用于存储样品、检测和处理试剂(例如,探针、洗涤溶液)等并将它们转移到阵列的流体系统;(ii)保持或包括阵列、并且具有流通和电势(电压)控制能力的反应流体室或流动室;以及(iii)照明和检测系统(例如,与图20中所示的便携式设备结合的一次性使用盒)。在一个实施方式中,流体室或流动室具有能够调节电压的电压控制子系统。
[0351]
如本文所用,“一次性使用盒”是一种微流体结构,其包含用于在其中实施本发明的teem和laces方法的组分和试剂;并因此允许存在或不存在被询问的靶核酸。一次性使用盒可以是本文所述的任何芯片、流体芯片(dfluidic chip)、芯片设备、基板或阵列等。
[0352]
本文还提供了用于实施本发明方法的流体芯片设备,其可以与用于核酸链延伸的标准样品制备和检测平台兼容。在一个实施方式中,流体芯片设备可以包含其上至少具有第一金属电极的容器或流体室。不同的高度(例如,电极之间的距离)和电极的几何形状可用于扩散层和双电层的最大效率和工程设计。流体芯片设备可以与电信号源(例如,函数发生器)电接口,该电信号源可以包括在这种标准平台中,以在电极处提供施加的电压。
[0353]
可以运行芯片设备以实现本发明teem方法的电荷调制。例如,对于变性,可以例如基于电极配置和/或在电极上施加的电信号产生低ph和/或高ph。例如,对于退火和变性,可以产生不同的ph水平。可以在流体室中配置不同的室高度,以影响从样品中富集或分离靶核酸的速率。该设备可以包括入口和出口端口或区域。捕获-探针和捕获/引物-探针寡核苷酸可以附着到电极表面,而反应溶液可以保持静止,同时调节施加到电极的电压。
[0354]
在另一个实施方式中,用于执行本发明链延伸检测方法的流体芯片设备包括电绝缘的基板,该基板具有通道或多个通道,其构造成承载电解液,例如,包括连续的或间歇的流量。
[0355]
在其他实施方式中,本发明的系统中的合适芯片包括有源芯片。更具体地说,本发明的集成生物芯片系统中的至少一个芯片是有源芯片。有源芯片是包括微型结构的芯片,当从例如电源向它们提供能量时,这些结构可以产生物理力。因此,在本发明的方法中使用的施加的物理力需要能量源(有时称为“信号源”)(例如电压等),以及能够将能量转换为在本发明中有用的力类型的结构。因此,有源芯片被描述为至少部分地提供在本发明的方法中使用的物理力源的芯片。作为非限制性示例,可以将所施加的能量转换为可用于本发明中有用的力的类型的微型结构,可以是用于产生电泳力和介电泳力的电极、用于产生电磁力或磁泳力或磁力的电磁单元、以及用于产生声学力的压电换能器。根据它们所包含的微型结构的类型,其可以被称为例如电泳或介电泳芯片(包括电极)、电磁芯片(包括电磁单元)或声学芯片(包括压电换能器)。芯片还可以包括光学元件、微毛细管或尖端、加热元件(例如,金属线)、珀尔帖元件、微阀或微泵。
[0356]
可以在芯片表面上或内部构件物理力元件(例如,电磁单元、压电换能器或电极)来构建有源芯片,或者通过在芯片表面上应用功能层(例如寡核苷酸阵列或蛋白质阵列)来
制备例如无源芯片,或者使用两者的结合。可以在本发明的无源或有源芯片上提供的其他材料包括特异性结合成分,包括但不限于:核酸分子;酶、催化剂或底物(包括但不限于用于检测的酶、催化剂或底物);试剂,包括被提供为用于阻止一个或多个样品组分与芯片表面结合或相互作用的隔绝层、涂层、或物质层;复合物;以及甚至病毒和细胞。这些材料可任选地提供在本发明系统的芯片的孔或通道中。可用作涂层或层以防止一种或多种样品组分与芯片表面(包括芯片上的微尺度结构)发生非特异性或不良相互作用的材料可以形成芯片的“顶层”,并且可以是薄(小于100埃)的聚合物层、化合物(例如二氧化硅)、表面活性剂或生物分子(例如bsa)。
[0357]
有源芯片的示例包括但不限于:玻璃基板上的介电泳电极阵列(例如,wang等的dielectrophoretic manipulation of particles,ieee transaction on industry applications,vol.33,no.3,1997年五月/六月,660-669页);微制造生物电子芯片上的单独可寻址电极阵列(例如,cheng等的preparation and hybridization analysis of dna/rna from e.coli on microfabricated bioelectronic chips,nature biotechnology,vol.16,1998,541-546页);毛细管电泳芯片(例如,lichtenberg等的combination of sample-preconcentration and capillary electrophoresis on-chip,in micro total analysis systems 2000edited by a.van den berg等,307-310页);美国专利第6,029,518号中公开的声学力芯片;出于所有目的,它们中的每一个都通过引用整体并入本文。
[0358]
对于介电泳芯片,包括用于常规和行波介电泳的芯片,芯片上的电极可以是任何形状,例如矩形、城堡形、三角形、圆形等。电极可以排列成各种图案,例如螺旋形、平行形、交叉指形、多项式等。可以通过本领域已知的方法,例如电镀、溅射、光刻或蚀刻,在芯片上制造电极阵列。芯片的示例包括但不限于:玻璃基板上的介电泳电极阵列(例如,wang等的dielectrophoretic manipulation of particles,ieee transaction on industry applications,vol.33,no.3,1997年五月/六月,660-669页);微制造生物电子芯片上的单独可寻址电极阵列(例如,cheng等的preparation and hybridization analysis of dna/rna from e.coli on microfabricated bioelectronic chips,nature biotechnology,vol.16,1998,541-546页);毛细管电泳芯片(例如,lichtenberg等的combination of sample-preconcentration and capillary electrophoresis on-chip,in micro total analysis systems 2000edited by a.van den berg等,307-310页)。
[0359]
在本发明的一个实施方式中,集成生物芯片系统包括单个芯片。在这方面,单芯片集成生物芯片系统包括可以执行至少两个顺序任务(例如,至少teem和laces,或至少dial和teem;或dial、teem和laces)的有源芯片。优选地,单芯片系统的有源芯片包括不同的功能元件以执行至少两个顺序任务(例如,双电泳和调制电场等)。执行多于一种功能的芯片可以具有一种或多种不同功能元件(例如特异性结合成分、底物、试剂或不同类型的微尺度结构)的组合,包括至少提供在芯片上执行的过程或任务所用的一种或多种物理力来源的微尺度结构。在本发明的系统包括具有不同功能元件的芯片的实施方式中,具有不同功能元件的芯片区域可以非常接近,使得样品组分在不同功能元件之间自由且容易地扩散。在其他实施方式中,不同的功能元件至少部分地彼此散布。可替代地,在多力芯片中,不同的功能元件(特别是不同的物理力产生元件)可以设置在相对于彼此垂直定向的不同结构连接的基板中。
[0360]
在图26所示的特定实施方式中,本文提供了一种场仪器,包括:微处理单元;步进电机和电动致动器;以及光学检测器。微处理单元在本领域中是公知的并且可以包括任何数量的现成组件。光学检测器可以是基于中等ccd/cmos的检测器系统。在某些实施方式中,光路是短光路。
[0361]
本发明的试剂盒
[0362]
在本文所述方法的商业化中,用于构建本发明的捕获-探针和/或捕获/引物-探针阵列以及将其用于各种应用的某些试剂盒是特别有用的。一般而言,本发明的试剂盒可包括本文所述的任何寡核苷酸/探针阵列、和/或用于产生和/或使用此类捕获-探针阵列或芯片以实施本文提供的本发明方法的试剂和分子。
[0363]
在一个实施方式中,用于构建本发明的捕获-探针阵列的试剂盒包括但不限于具有附着有捕获-探针寡核苷酸的表面的支持物,捕获-探针具有针对正在被询问的特定靶核酸的识别序列(例如,sars-cov2序列)。这样的试剂盒可以进一步包括用于与这样的靶核酸进行链延伸反应的试剂。此类试剂包括聚合酶、逆转录酶(图15的第三部分)、dntp、引物、缓冲液等。
[0364]
用于应用本发明的靶核酸检测阵列的试剂盒包括但不限于用于确定存在靶核苷酸序列的试剂盒等。试剂盒通常包含具有表面的至少一种支持物,以及对于构件本发明的捕获-探针阵列或执行本发明中的laces或teem方法所必需或有用的一种或多种试剂。此类试剂包括但不限于核酸引物、探针(adaptor)、接头、酶(例如聚合酶)等,各自包装在容器中(例如但不限于小瓶、管或瓶)以及适用于商业分销的包装中(例如但不限于盒子、密封袋、泡罩包装和纸箱)。包装通常包含一个标签或包装插页,表明包装材料的用途。如本文所用,“包装材料”包括用于在试剂盒中分配试剂的包装中使用的任何物品,包括但不限于容器、小瓶、管、瓶子、袋子、泡罩包装、标签、标签、说明书和包装插页。
[0365]
在此类试剂盒的特定实施方式中,表面可以是具有离散区域阵列的平面表面。离散区域可以连接有捕获-探针,并且接头可以各自具有与捕获寡核苷酸互补的区域,使得多联体能够通过在捕获寡核苷酸和衔接子寡核苷酸的互补区域之间形成复合物而连接到离散区域。
[0366]
实施例
[0367]
实施例1
–
基于发光的靶核酸检测
[0368]
一旦从掺入的dntp中释放,焦磷酸盐(ppi)与atp硫化酶相互作用,后者将焦磷酸盐与腺苷5
’‑
磷酸硫酸盐(aps)结合,产生atp(图1b和图1c)。
[0369]
以上产生的atp(atp)用于结合萤火虫荧光素酶,萤火虫荧光素酶使用荧光素作为底物(图1c)。以atp(atp)作为辅助因子,萤火虫荧光素酶催化荧光素(图1c;以及图2、图3和图10)。作为酶催化的结果,荧光素被转化为氧化荧光素并产生发光(图1c)。作为反应的副产物,生成一磷酸腺苷和ppi。这导致在少量和有限的发光期间可检测到发光(图1c)。因此,作为dntp与dna聚合酶相互作用的结果,在由发光酶和发光底物产生的发光反应产生的发光时产生发光。在光消失之前检测到相应的发光。
[0370]
重复该dntp掺入过程直到检测到靶核酸序列和/或已达到所需核酸核酸链延伸长度。
[0371]
实施例2
–
影响发光产生的参数
[0372]
实施例2a-改变atp硫化酶、萤火虫荧光素酶和发光底物-dgtp-香豆素的各自浓度的影响
[0373]
在该反应中,除了由4个碱基(datp、dgtp、dttp、dctp)的混合物形成的20bp区域的起始序列之外,产生了由所有胞嘧啶碱基组成的300bp单链dna模板。除模板dna外,反应还包含与起始序列互补的引物寡核苷酸、dgtp-香豆素、atp硫化酶、腺苷5
’‑
磷酸硫酸盐、萤火虫荧光素酶(作为发光酶)和荧光素(作为发光底物)。图4-图6分别示出了atp硫化酶、萤火虫荧光素酶和发光底物、dgtp-香豆素的不同浓度的影响。从图4-图6中可以看出,从dgtp-香豆素(其是在末端磷酸盐处由香豆素标记的dgtp)开始,发现本文使用的聚合酶-atp硫化酶-萤火虫荧光素酶的这种串联三酶系统在最后一步产生发光。
[0374]
实施例2b
–
将atp硫化酶和aps添加到荧光素酶反应中的效果
[0375]
在该实验中使用了序列混合物的以下试剂:
[0376]
10x tae缓冲液17.5ul
[0377]
荧光素酶(1m tris中5mg/ml)(1:50)17.5ul
‑‑‑‑‑‑‑
250ng sigma
[0378]
cyc-luc(10mg/ml)(在1xtae中1:10)35ul
‑‑‑‑‑‑‑‑‑
5ug emd millipore
[0379]
atp(100mm)(1:5k)35ul
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
1.2um sigma
[0380]
coa(10mm)(1:20)35ul
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
2mm sigma
[0381]
mgcl2(10mm)=(每rxn2.5 ul)
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
1mm neb
[0382]
ppase 1x(=无稀释)(200u/ml)=0.5ul
‑‑‑‑‑‑‑‑‑‑
0.1u sigma
[0383]
asulf(300u/ml)=0.5ul
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
0.15u neb
[0384]
aps(10mm)=1ul
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
377um sigma
[0385]
为了研究atp硫化酶/荧光素酶信号放大环对荧光信号水平的影响,可以单独观察atp硫化酶-荧光素酶对。反应在1x tae缓冲液中进行,其中含有750ng荧光素酶、5μg cyc-luc荧光素、1.2μm atp、2mm辅酶a、1mm mgcl2、0.15单位atp硫化酶、377μm aps。焦磷酸酶的变化对应于0.1、0.005和0.002单位量。荧光素酶、atp、辅酶a、焦磷酸酶和aps获自sigma。atp硫化酶和mgcl2获自neb。
[0386]
最初将焦磷酸酶和mgcl2分配到384孔微孔板的相关孔中。然后制备缓冲液、荧光素酶和辅酶a的主混合物,混合并以等量分配到相关孔中。然后将cyc-luc荧光素添加到每个孔中,最后将atp添加到每个孔中。然后将板摇动15秒,然后从fluostar optima读板器进行测量。
[0387]
在该实施方式中,对应于单独使用荧光素作为底物的荧光素酶反应的标准反应在图7中显示为实线曲线。在图7中,实线曲线显示了常规荧光素酶反应所预期的发光信号的上升和衰减。在3000秒时,将atp硫化酶和aps添加到标准反应中,如图7所示,启动atp硫化酶/荧光素酶信号放大环并导致信号放大(参见图7,实线曲线开始于3000秒)。这些结果表明,本发明核酸靶序列检测方法产生的发光信号可以通过添加atp再生酶(本例中为atp硫化酶)及其同源atp再生酶底物(本例中为aps)而被放大,其启动atp硫化酶/荧光素酶信号放大环。
[0388]
执行了与标准反应类似的三个其他反应,其中以0.02x(1:50稀释)、0.05x(1:20稀释)和1x(不稀释)量的焦磷酸酶1x、以及1x mgcl2添加了不同相对稀释度的无机焦磷酸盐。如图7所示,添加无机焦磷酸酶后环路信号减弱(0.02x ppase虚线曲线和0.05x ppase虚线
曲线)。在较高浓度的无机焦磷酸酶中,环完全减少(1x ppase虚线曲线)。这表明由atp硫化酶/荧光素酶信号放大环放大的发光信号水平是由ppi的连续和重复产生的结果,而ppi可以被焦磷酸酶消除。
[0389]
实施例2c
–
向atp硫化酶/荧光素酶信号放大环反应添加辅酶a对发光信号的影响
[0390]
将辅酶a添加到atp硫化酶/荧光素酶信号放大环对发光信号水平的影响通过如实施例2b中那样运行标准荧光素酶反应来研究。反应在1xtae缓冲液中进行,其中含有750ng荧光素酶、5μg cyc-luc荧光素、1.2μm atp、2mm辅酶a、1mm mgcl2、0.15单位atp硫化酶、200μmaps。荧光素酶、atp、辅酶a和aps获自sigma。atp硫化酶和mgcl2获自neb。最初,将atp硫化酶、aps、辅酶a和mgcl2分配到384孔微孔板的相关孔中。然后制备缓冲液、荧光素酶和cyc-luc荧光素的主混合物,混合并以等量分配到相关孔中。然后将atp添加到每个孔中。然后将板摇动15秒,然后从fluostar optima读板器进行测量。
[0391]
包含荧光素酶、荧光素和atp的标准荧光素酶反应的发光结果显示在图8的深色实线曲线中。在图8中,深色实线曲线显示了常规荧光素酶反应所预期的发光信号的上升和衰减。虚线曲线显示了荧光素酶与atp硫化酶和aps的反应。图8的浅色曲线显示了荧光素酶-atp硫化酶与aps和辅酶a连接的情况。在aps和辅酶共同施用的这个例子中,发光信号水平更高,信号更持久。这些结果表明辅酶a对信号具有积极作用,据信这是通过防止对荧光素酶的损伤和稳定荧光素酶/荧光素对从而提高环效率而发生的。
[0392]
尽管已经参照本文中的示例性实施方式具体示出和描述了本实施方式,但是本领域普通技术人员可以理解的是在不背离下述权利要求所界定的本实施方式的精神和范围的情况下,对其做出各种形式和细节上的改变。本领域技术人员将仅使用常规实验认识到或者能够确定本文中描述的特定过程的很多等同物。这样的等同物被认为是在本发明的范围内并且被以下权利要求所覆盖。整个本技术引用的所有非专利文献出版物、专利和专利申请的内容均出于所有目的通过引用整体并入本文。可以为本发明及其实施方式选择那些专利、申请和其他文件的适当组件、过程和方法。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1