重链抗体的重链可变区的制造方法与流程
1.本发明涉及一种重链抗体的重链可变区的制造方法。
背景技术:
2.低分子抗体由于具有制造效率、药品开发设计的容易性、组织渗透性等优点,作为抗体医药和试剂的材料受到了关注。作为代表性的低分子抗体,可以列举fab、单链抗体(single chain antibody;scfv)、双链抗体(diabody)、重链抗体的重链可变区(variable domain of heavy chain of heavy chain antibody、vhh)等。骆驼科动物(双峰驼、单峰驼、大羊驼等)和鲨鱼等软骨鱼类的血清含有不具有轻链而只由重链构成的抗体(重链抗体;heavy-chain antibody)。该重链抗体的可变区为vhh。vhh是能够利用单结构域识别抗原的分子,是迄今为止发现的抗体分子中的最小单位。另外,具有多个结构域或人源化结构域的医药用vhh也在销售。
3.目前,在抗体的微生物学生产中主要使用大肠杆菌。然而,在利用大肠杆菌生产异种蛋白质时,如果高分子量分子的生产率低,则有因内毒素而导致产物污染、因内毒素除去处理而引起产物的产量降低等问题。在非专利文献1中记载了,短芽孢杆菌能够克服上述的大肠杆菌的缺点,利用短芽孢杆菌表达系统,能够生产scfv或fab、vhh。在专利文献1中记载了,有使用曲霉属等丝状菌制造vhh这样的报告。
4.枯草杆菌等芽孢杆菌属菌分泌apre、epr、wpra、mpr、nprb、bpr、npre、vpr、aprx等细胞外蛋白酶。在利用芽孢杆菌属菌的异种蛋白质生产中,已知这些细胞外蛋白酶是降低目标蛋白质的生产率的主要原因。在专利文献2中记载了利用缺损aprx等细胞外蛋白酶的芽孢杆菌属株,提高异种蛋白质的生产率。在非专利文献2中记载了,使细胞内和细胞外分子伴侣共表达并且使细胞壁结合型蛋白酶wpra钝化了的枯草杆菌株分泌生产来自纤维蛋白特异性单克隆抗体的scfv。另一方面,在非专利文献2中也记载了利用缺损7种细胞外蛋白酶的枯草杆菌株不能生产该scfv。
5.(专利文献1)日本特开2012-157315号公报
6.(专利文献2)日本特开2006-174707号公报
7.(非专利文献1)生物工程学,2017,95(11):649-651
8.(非专利文献2)appl environ microbiol,2002,p.3261-3269
技术实现要素:
9.本发明提供一种重链抗体的重链可变区的制造方法,其包括对芽孢杆菌属菌进行培养的步骤,该芽孢杆菌属菌导入有编码重链抗体的重链可变区的基因,并且缺损细胞外蛋白酶。
10.本发明还提供一种导入有编码重链抗体的重链可变区的基因并且缺损细胞外蛋白酶的芽孢杆菌属菌。
附图说明
11.图1是关于来自导入了vhh基因的细胞外蛋白酶单一缺损重组枯草杆菌株的培养上清液的sds-page像。箭头表示vhh蛋白质的条带位置。
12.图2是利用蛋白酶多重缺损株dpr9δsigf的医药vhh分子的表达。
13.图3是dpr9δsigf所表达的奥利组单抗(ozoralizumab)和卡普赛珠单抗(caplacizumab)的蛋白质印迹图像。﹡表示全长,<表示分解产物。
14.图4是枯草杆菌表达vhh(1zvh)的抗原(hewl)结合活性。
15.图5是关于导入了vhh基因的大肠杆菌株的培养物的蛋白质印迹图像。
具体实施方式
16.在本说明书中,“抗体”是指通过来自免疫球蛋白的抗原识别区能够与蛋白质等靶标特异性结合的分子。
17.在本说明书中,“vhh”是指重链抗体的重链可变区(variable domain of heavy chain of heavy chain antibody)。重链抗体在骆驼科动物、鲨鱼等软骨鱼类等中被发现。本说明书中的vhh例如来自骆驼科动物或鲨鱼,优选来自骆驼科动物。vhh是能够利用单结构域识别抗原的分子,是迄今为止发现的抗体分子中的最小单位。利用本发明制造的vhh可以含有1个以上的来自重链抗体的重链可变区,该vhh所含的重链可变区的个数没有限定。利用本发明制造的vhh所含的该重链可变区可以为来自天然的重链抗体的重链可变区,可以为其变体。利用本发明制造的vhh还可以包含来自该免疫球蛋白重链的重链可变区以外的片段(例如重链抗体的恒定区的片段、或来自人的片段、接头序列等)、用于稳定化的氨基酸变异等。利用本发明制造的vhh,作为抗原识别结构域,不具有来自免疫球蛋白轻链的可变区。例如,利用本发明制造的vhh不包括包含免疫球蛋白轻链可变区的单链抗体(例如scfv)。
18.在本说明书中,作为骆驼科动物,可以列举双峰驼、单峰驼、大羊驼、羊驼、骆马、原驼等,优选列举羊驼。
19.在本说明书中,核苷酸序列和氨基酸序列的同一性可以利用lipman-pearson法(science,1985,227:1435-1441)进行计算。具体而言,可以利用遗传信息处理软件genetyx-win的同源性分析(search homology)程序,将unit size to compare(ktup)设为2进行分析而算出。
20.在本说明书中,关于氨基酸序列或核苷酸序列的“至少85%的同一性”是指85%以上、优选90%以上、更优选93%以上、进一步优选95%以上、进一步优选96%以上、进一步优选97%以上、进一步优选98%以上、进一步优选99%以上、进一步优选99.5%以上的同一性。
21.在本说明书中,调控区与基因的“可操作连接”是指将基因和调控区以该基因能够在该调控区的控制下表达的方式连结。基因和调控区的“可操作连接”的方法对于本领域技术人员是众所周知的。
22.在本说明书中,关于基因的“上游”和“下游”是指该基因的转录方向的上游和下游。例如,“配置在启动子下游的基因”是指在dna有义链中在启动子的3’侧存在该基因,基因的上游是指dna有义链中的该基因的5’侧的区域。
23.在本说明书中,细胞中的蛋白酶的“缺损”是指该细胞中的该蛋白酶的活性与该细胞原本(非缺损株、例如野生株)的活性相比下降了。蛋白酶的“缺损”不仅包含蛋白酶蛋白质的表达下降或丧失,而且包含蛋白酶蛋白质的功能下降或丧失。缺损蛋白酶的细胞(蛋白酶缺损株)可以通过细胞中的该蛋白酶基因的部分或全部缺失或钝化(所谓的敲落或敲除等)而制作。关于本说明书中的蛋白酶缺损株,该蛋白酶的活性相对于野生株优选下降至50%以下,更优选下降至25%以下。
24.在本说明书中,对于细胞的功能、性状、特质所使用的术语“内源”是为了表示该功能、性状、特质原本就存在于该细胞中。相对而言,使用术语“外源”是为了表示不是原本存在于该细胞而是从外部导入的功能、性状、特质。例如,“外源”基因或多核苷酸是从外部导入细胞内的基因或多核苷酸。外源基因或多核苷酸可以来自与导入其的细胞同种的生物,也可以来自异种的生物(即异种基因或多核苷酸)。
25.在本说明书中,“芽孢杆菌属菌”是指芽孢杆菌科(bacillaceae)芽孢杆菌属(bacillus)的菌。作为芽孢杆菌属菌的例子,可以列举枯草杆菌(bacillus subtilis)、蜡样芽孢杆菌(bacillus cereus)、苏云金芽孢杆菌(bacillus thuringiensis)、巨大芽孢杆菌(bacillus megaterium)、解淀粉芽孢杆菌(bacillus amyloliquefaciens)、短小芽孢杆菌(bacillus pumilus)、地衣芽孢杆菌(bacillus licheniformis)等。其中,本说明书中的芽孢杆菌属菌不包括类芽孢杆菌科(paenibacillaceae)所属的类芽孢杆菌属(paenibacillus)或短芽孢杆菌属(brevibacillus)的菌。
26.本说明书所记载的枯草杆菌的基因的名称基于日本枯草杆菌功能分析网络(jafan:japan functional analysis network for bacillus subtilis)(bsorf db)中网络公开([bacillus.genome.ad.jp/]、2006年1月18日更新)的枯草杆菌基因组数据进行记载。本说明书所记载的枯草杆菌的基因编号表示bsorf db注册的基因编号。
[0027]
本发明提供一种重链抗体的重链可变区(vhh)的制造方法。
[0028]
本发明的发明人发现,利用缺损细胞外蛋白酶的芽孢杆菌属菌,能够以高产量制造vhh。
[0029]
利用本发明,能够以高产量制造vhh。本发明能够克服现有的利用大肠杆菌的抗体生产的产量低或内毒素所导致的污染的问题。另外,芽孢杆菌属菌在酶等有用物质生产中的使用卓有成效,并且也无害,因此本发明的方法其操作容易并且安全。
[0030]
本发明提供一种vhh的制造方法,其包括对芽孢杆菌属菌进行培养的步骤,该芽孢杆菌属菌导入有编码vhh的基因,并且缺损细胞外蛋白酶。
[0031]
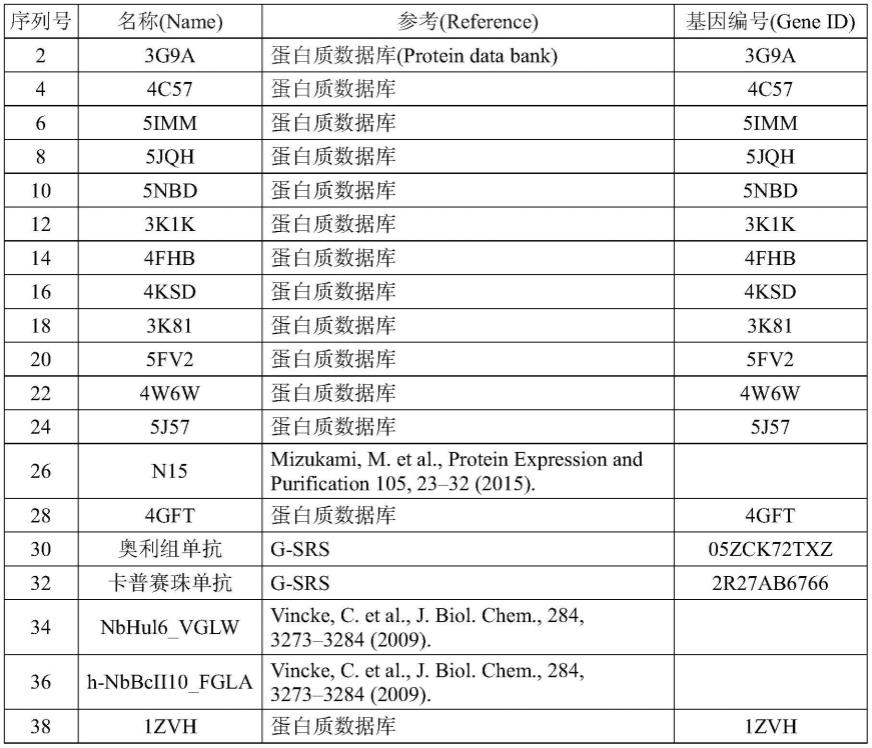
利用本发明制造的vhh如上述所规定的那样。作为利用本发明制造的vhh的更具体的例子,可以列举由序列号2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36和38的氨基酸序列构成的多肽。这些vhh的详细信息如表1所示。
[0032]
[表1]
[0033][0034]
作为利用本发明制造的vhh的其它例子,可以列举由与序列号2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36和38的氨基酸序列中的任意种至少85%相同的氨基酸序列构成的多肽。
[0035]
作为利用本发明制造的vhh的另外其它的例子,可以列举由序列号64、66、68、70、72、74、76、78、80、82、84、86、88、90、92、94、96、98、100、102、104、106、108、110、112、114、116、118、120、122、124、126、128、130、132、134、136和138的氨基酸序列构成的多肽。作为利用本发明制造的vhh的另外其它的例子,可以列举由与序列号64、66、68、70、72、74、76、78、80、82、84、86、88、90、92、94、96、98、100、102、104、106、108、110、112、114、116、118、120、122、124、126、128、130、132、134、136和138的氨基酸序列中的任意种至少85%相同的氨基酸序列构成的多肽。
[0036]
前述的编码vhh的基因(多核苷酸)可以按照常规方法制备。作为该编码vhh的基因的例子,可以列举由序列号1、3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93、95、97、99、101、103、105、107、109、111、113、115、117、119、121、123、125、127、129、131、133、135和137的核苷酸序列构成的多核苷酸、以及与这些中的任意种至少85%序列相同的多核苷酸。例如,编码vhh的基因的多核苷酸可以基于序列信息进行化学合成。或者,编码vhh的基因的多核苷酸可以从骆驼科动物的基因组dna中分离。对于所得到的基因,还可以进行突变导入。
[0037]
该编码vhh的基因可以与调控区可操作地连接。在本说明书中,“调控区”是具有控制配置于其下游的基因的细胞内的表达的功能,优选具有组成上表达或高表达配置于该下
游的基因的功能的区域。更具体而言,可以定义为存在于基因的编码区的上游并且具有rna聚合酶相互作用而控制该编码区的转录的功能的区域。优选本说明书中的调控区是指基因的编码区的上游200~600核苷酸左右的区域。调控区包括转录起始调控区和/或翻译起始调控区、或者转录起始调控区至翻译起始调控区的区域。转录起始调控区是包含启动子和转录起始位点的区域,翻译起始调控区是相当于与起始密码子一起形成核糖体结合部位的shine-dalgarno(sd)序列的部位(proc natl acad sci usa,1974,71:1342-1346)。
[0038]
作为该调控区的优选例,可以列举在芽孢杆菌属菌中发挥功能的调控区,例如来自芽孢杆菌属细菌的α-淀粉酶基因、蛋白酶基因、apre基因或spovg基因的调控区、芽孢杆菌ksm-s237株的纤维素酶基因(日本特开2000-210081号公报)的调控区、芽孢杆菌ksm-64株的纤维素酶基因(日本特开2011-10387公报)的调控区、以及来自金黄色葡萄球菌(staphylococcus aureus)的卡那霉素抗性基因或氯霉素抗性基因的调控区(均参照日本特开2009-089708号公报)等,但没有特别限定。作为该调控区的更优选的例子,可以列举芽孢杆菌ksm-s237株的纤维素酶基因的启动子(序列号39)、芽孢杆菌ksm-64株的纤维素酶基因的启动子(序列号40)、枯草杆菌spovg基因的启动子(序列号41)。另外,作为优选的调控区,可以列举与序列号39~41中的任意种具有至少85%的同一性并且具有控制基因的转录和翻译的功能的多核苷酸。
[0039]
另外,该编码vhh的基因也可以与编码具有使所表达的蛋白质向细胞外分泌的功能的分泌信号的序列(称为分泌信号序列)可操作地连接。作为该分泌信号序列的优选例,可以列举在芽孢杆菌属菌中发挥功能的分泌信号序列,例如来自芽孢杆菌属菌的分泌信号序列。作为来自芽孢杆菌属菌的分泌信号序列的优选例,可以将芽孢杆菌ksm-s237株的纤维素酶基因的分泌信号序列(序列号42)、芽孢杆菌ksm-64株的纤维素酶基因的分泌信号序列(序列号43)、枯草杆菌淀粉酶基因amye的分泌信号序列(序列号44)等。作为来自芽孢杆菌属菌的分泌信号序列的进一步的例子,可以列举与序列号42~44中的任意种具有至少85%的同一性并且具有使所表达的蛋白质向细胞外分泌的功能的多核苷酸。
[0040]
该编码vhh的基因除了含有开放读码框(orf)以外,还可以含有非翻译区域(utr)的核苷酸序列。例如,该基因可以含有上述的启动子、分泌信号序列和终止子。
[0041]
该基因向芽孢杆菌属菌的导入可以按照常规方法进行。例如可以将该基因或包含其的载体导入宿主芽孢杆菌属菌细胞内,再向该宿主细胞的基因组导入该基因。或者,也可以将包含该基因的表达载体导入宿主芽孢杆菌属菌细胞内。
[0042]
基因或载体向宿主芽孢杆菌属菌细胞内的导入例如可以应用感受态细胞法、电穿孔法、原生质体法、粒子枪法、peg法等公知的转化技术。
[0043]
作为导入该编码vhh的基因的宿主芽孢杆菌属菌,可以列举前述的芽孢杆菌科芽孢杆菌属的菌,其中优选枯草杆菌或其突变株。
[0044]
包含该编码vhh的基因的载体可以通过利用常规方法将该基因和根据需要含有调控区或分泌信号序列的多核苷酸插入任意的载体中并连接而构建。该载体的种类没有特别限定,可以为质粒、噬菌体、噬粒、黏粒、病毒、yac载体、穿梭载体等任意的载体。另外,该载体优选为在宿主细胞内能够扩增的载体,更优选为表达载体。作为优选的载体的例子,没有限定,可以列举:pha3040sp64、phsp64r或pasp64(日本专利第3492935号)、phy300plk(能够转化大肠杆菌和枯草杆菌双方的表达载体;jpn j genet,1985,60:235-243)、pac3
(nucleic acids res,1988,16:8732)等穿梭载体;pub110(j bacteriol,1978,134:318-329)、pta10607(plasmid,1987,18:8-15)等芽孢杆菌属细菌的转化能够利用的质粒等。还可以使用来自大肠杆菌的质粒(例如pet22b(+)、pbr322、pbr325、puc57、puc118、puc119、puc18、puc19、pbluescript等)。
[0045]
在本发明中,用于制造vhh的芽孢杆菌属菌除了导入了该编码vhh的基因以外,还缺损细胞外蛋白酶。该芽孢杆菌属菌中所缺损的细胞外蛋白酶优选为选自epr、wpra、bpr、vpr、apre、aprx和与它们相当的基因所编码的细胞外蛋白酶中的至少1种,更优选为选自epr、wpra、bpr、vpr、apre和apr所编码的蛋白酶中的至少1种,进一步优选为epr、wpra、bpr、vpr、apre或apr所编码的蛋白酶,进一步优选为wpra或bpr所编码的蛋白酶。
[0046]
epr、wpra、bpr、vpr、apre和aprx均为枯草杆菌基因。将这些基因的基因编号和所编码的蛋白质的功能示于表2。作为与epr、wpra、bpr、vpr、apre和aprx相当的基因,可以分别列举与epr、wpra、bpr、vpr、apre和aprx在核苷酸序列中具有至少85%的同一性并且(记载在表2中)编码相同功能的蛋白质的来自芽孢杆菌属菌的基因。这些基因可以在上述的bsorf db中检索。
[0047]
[表2]
[0048][0049]
本发明所使用的芽孢杆菌属菌也可以缺损除前述的epr、wpra、bpr、vpr、apre和aprx所编码的细胞外蛋白酶以外的其它细胞外蛋白酶。例如,本发明所使用的芽孢杆菌属菌可以缺损全部epr、wpra、mpr、nprb、bpr、npre、vpr、apre和aprx所编码的细胞外蛋白酶。本发明所使用的芽孢杆菌属菌还可以实施除细胞外蛋白酶缺损以外的其它改变,例如sigf等的σ因子缺失等。
[0050]
缺损细胞外蛋白酶的芽孢杆菌属菌可以按照常规方法制造。例如通过缺失或钝化该菌的基因组dna中编码细胞外蛋白酶的基因,能够制造缺损该细胞外蛋白酶的芽孢杆菌属菌。因此,在本发明的一个实施方式中,用于制造vhh的芽孢杆菌属菌缺失或钝化了选自epr或与其相当的基因、wpra或与其相当的基因、bpr或与其相当的基因、vpr或与其相当的基因、apre或与其相当的基因和aprx或与其相当的基因中的至少1种基因。优选该芽孢杆菌属菌缺失或钝化了选自epr、wpra、bpr、vpr、apre和aprx中的至少1种基因。更优选该芽孢杆菌属菌缺失或钝化了epr、wpra、bpr、vpr、apre或aprx。进一步优选该芽孢杆菌属菌缺失或钝化了wpra或bpr。
[0051]
作为使基因缺失或钝化的方法,可以列举:向该基因或其结构区导入突变等,例如该基因或其结构区的多核苷酸中的1个以上的核苷酸的置换或插入、或序列的部分或全部的敲除;通过其它序列向该基因的启动子区域的置换或插入而钝化该启动子;向该基因导
入反义核酸等。作为用于该导入突变的具体方法,可以列举紫外线照射、定点突变导入、soe-pcr法(重叠延伸剪接(splicing by overlap extension)pcr:gene,1989,77:61-68)、同源重组法等。所缺失或钝化的基因在基因组dna上的位置或核苷酸序列可以利用前述的bsorf db进行确认。
[0052]
在本发明中,使用按照前述的方法得到的导入了编码vhh的多核苷酸并且缺损细胞外蛋白酶的重组芽孢杆菌属菌。在该重组芽孢杆菌属菌的制备方法中,只要能够得到目标重组芽孢杆菌属菌,编码vhh的多核苷酸的导入和蛋白酶缺损处理的顺序没有特别限定。
[0053]
在本发明中,对前述的导入了编码vhh的多核苷酸并且缺损细胞外蛋白酶的重组芽孢杆菌属菌进行培养,制造目标vhh。该重组芽孢杆菌属菌按照一般的芽孢杆菌属菌的培养方法进行培养即可。例如,用于培养芽孢杆菌属菌的培养基含有菌的生长所需的碳源和氮源。作为碳源,例如可以列举葡萄糖、葡聚糖、可溶性淀粉、蔗糖、甲醇等。作为氮源,例如可以列举铵盐类、硝酸盐类、氨基酸、玉米浆(corn steep liquor)、蛋白胨、酪蛋白、肉提取物、大豆粕、马铃薯提取液等。根据需要,该培养基也可以含有其它营养素,例如无机盐(例如氯化钠、氯化钙、磷酸二氢钠、氯化镁)、维生素类、抗生物质(例如四环素、新霉素、卡那霉素、大观霉素、红霉素等)等。培养条件、例如温度、通气搅拌条件、培养基的ph和培养时间等可以根据菌种、特质、培养规模等适当选择。
[0054]
通过培养该重组芽孢杆菌属菌,vhh在细胞内表达。另外,在该vhh的基因与分泌信号连接的情况下,所表达的vhh分泌至细胞外。利用本发明的方法制造的vhh可以通过单独或适当组合使用用于蛋白质精制的一般方法、例如细胞的破碎、离心分离、硫酸铵沉淀、凝胶色谱、离子交换色谱、亲和色谱等而从培养液中回收。
[0055]
作为例示的实施方式,本发明还包含以下的物质、制造方法、用途、方法等。但是,本发明并不限定于这些实施方式。
[0056]
〔1〕一种重链抗体的重链可变区的制造方法,其中,所述方法包括对芽孢杆菌属菌进行培养的步骤,该芽孢杆菌属菌导入有编码重链抗体的重链可变区的基因,并且缺损细胞外蛋白酶。
[0057]
〔2〕如〔1〕所述的方法,其中,上述细胞外蛋白酶优选为选自epr、wpra、bpr、vpr、apre、aprx和与它们相当的基因所编码的细胞外蛋白酶中的至少1种,更优选为epr、wpra、bpr、vpr、apre或aprx所编码的细胞外蛋白酶,进一步优选为wpra或bpr所编码的细胞外蛋白酶。
[0058]
〔3〕如〔1〕或〔2〕所述的方法,其中,优选上述重链抗体的重链可变区由序列号2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、64、66、68、70、72、74、76、78、80、82、84、86、88、90、92、94、96、98、100、102、104、106、108、110、112、114、116、118、120、122、124、126、128、130、132、134、136或138的氨基酸序列、或与该序列至少85%相同的氨基酸序列构成。
[0059]
〔4〕如〔1〕~〔3〕中任一项所述的方法,其中,优选上述芽孢杆菌属菌为枯草杆菌或其突变株。
[0060]
〔5〕如〔1〕~〔4〕中任一项所述的方法,其中,优选缺损上述细胞外蛋白酶的芽孢杆菌属菌为编码该细胞外蛋白酶的基因缺失或钝化的芽孢杆菌属菌。
[0061]
〔6〕一种芽孢杆菌属菌,其中,所述芽孢杆菌属菌导入有编码重链抗体的重链可变
区的基因,并且缺损细胞外蛋白酶。
[0062]
〔7〕如〔6〕所述的芽孢杆菌属菌,其中,上述细胞外蛋白酶优选为选自epr、wpra、bpr、vpr、apre、aprx和与它们相当的基因所编码的细胞外蛋白酶中的至少1种,更优选为epr、wpra、bpr、vpr、apre或aprx所编码的细胞外蛋白酶,进一步优选为wpra或bpr所编码的细胞外蛋白酶。
[0063]
〔8〕如〔6〕或〔7〕所述的芽孢杆菌属菌,其中,优选上述重链抗体的重链可变区由序列号2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、64、66、68、70、72、74、76、78、80、82、84、86、88、90、92、94、96、98、100、102、104、106、108、110、112、114、116、118、120、122、124、126、128、130、132、134、136或138的氨基酸序列、或与该序列至少85%相同的氨基酸序列构成。
[0064]
〔9〕如〔6〕~〔8〕中任一项所述的芽孢杆菌属菌,其中,所述芽孢杆菌属菌优选为枯草杆菌或其突变株。
[0065]
〔10〕如〔6〕~〔9〕中任一项所述的芽孢杆菌属菌,其中,优选编码上述细胞外蛋白酶的基因缺失或钝化。
[0066]
实施例
[0067]
以下,利用实施例对本发明更具体地进行说明。但是,本发明的技术范围并不限定于这些实施例。
[0068]
材料
[0069]
(1)菌株
[0070]
利用枯草杆菌(bacillus subtilis)168株(以下称为168株),按照专利文献2所记载的方法制作细胞外蛋白酶基因(epr、wpra、mpr、nprb、bpr、npre、vpr、apre和aprx)的缺损株。以下,将所得到的细胞外蛋白酶单一缺损株分别记载为δepr、δwpra、δmpr、δnprb、δbpr、δnpre、δvpr、δapre和δaprx。另外,按照日本专利第4336082所记载的方法,使缺损全部上述9种细胞外蛋白酶基因的枯草杆菌株dpr9缺损参与芽孢形成的sigf基因。将所得到的细胞外蛋白酶多重缺损株记载为dpr9δsigf。
[0071]
大肠杆菌使用rosetta-gami 2(de3)plyss株(novagen)。
[0072]
(2)培养基
[0073]
·
lb培养基:1%bacto
tm
胰蛋白胨(tryptone)、0.5%bacto
tm
酵母提取物(yeast extract)、1%氯化钠。在平板培养基中添加1.5%的琼脂。根据需要添加四环素(50ppm)。
[0074]
·
dm3培养基:1%cmc(关东化学)、0.5%bacto
tm
酪蛋白氨基酸(casamino acids)、0.5%bacto
tm
酵母提取物(yeast extract)、8.1%琥珀酸二钠
·
6h2o、0.35%磷酸氢二钾、0.15%磷酸二氢钾、0.5%葡萄糖、20mm氯化镁、0.01%bsa、50ppm四环素。在平板培养基中添加1%的琼脂。
[0075]
·2×
l-mal培养基:2%bacto
tm
胰蛋白胨(tryptone)、1%bacto
tm
酵母提取物(yeast extract)、1%氯化钠、7.5%麦芽糖一水合物、7.5ppm硫酸锰、15ppm四环素。
[0076]
(3)试剂
[0077]
没有特别记述时,试剂使用wako公司制造的制品。
[0078]
实施例1利用蛋白酶缺损重组枯草杆菌生产vhh
[0079]
(1)基因的人工合成
[0080]
vhh基因(序列号1、3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35和37的多核苷酸,编码各序列号2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36和38的vhh)由thermo fisher公司人工合成。在人工合成基因中,作为用于将该基因插入质粒载体的序列,gcagctcttgcagca(序列号45)添加在各自的5’末端,tctattaaactagtt(序列号46)添加在各自的3’末端。
[0081]
(2)vhh表达用质粒的构建
[0082]
将重组质粒phy-s237(日本特开2014-158430)作为模板,利用使用序列号47(5
’‑
tgctgcaagagctgccggaaataaa-3’)以及序列号48(5
’‑
tctattaaactagttataggg-3’)的引物组和primestar max dna聚合酶(takara)的pcr,扩增质粒序列。使用in-fusion hd cloning kit(takara),将含有(1)的人工合成基因的dna导入所得到的pcr片段,构建分别含有(1)所示的人工合成vhh基因的vhh表达用质粒。将所构建的质粒按照下述(3)所示的方法导入dpr9δsigf中。
[0083]
对于编码序列号26的vhh的基因,按照以下的方法将启动子区域变更为来自枯草杆菌spovg基因的区域。将含有序列号25的基因的vhh表达用质粒作为模板,利用使用序列号49(5
’‑
gatccccgggaattcctgttataaaaaaagg-3’)和序列号50(5
’‑
atgatgttaagaaagaaaacaaagcag-3’)的引物组以及primestar max dna聚合酶(takara)的pcr,扩增质粒序列。将168株的基因组作为模板,利用使用序列号51(5
’‑
gaattcccggggatctaagaaaagtgattctgggagag-3’)和序列号52(5
’‑
ctttcttaacatcatagtagttcaccaccttttccc-3’)的引物组的pcr,扩增来自spovg基因的启动子dna。使用in-fusion hd cloning kit(takara),将所得到的启动子dna导入质粒序列中,构建与spovg启动子连接的含有序列号25的vhh基因的vhh表达用质粒。按照下述(3)所示的方法将所构建的质粒分别导入蛋白酶单一缺损株δepr、δwpra、δmpr、δnprb、δbpr、δnpre、δvpr、δapre和δaprx中。
[0084]
(3)重组枯草杆菌的制作
[0085]
向枯草杆菌株的质粒导入利用以下所示的原生质体法进行。将甘油中保存的各种枯草杆菌植菌于1ml的lb液体培养基,以30℃、210rpm振荡培养一晩。第二日,将该培养液10μl植菌于新的1ml的lb液体培养基,以37℃、210rpm振荡培养约2小时。将该培养液回收至1.5ml管中,以1,2000rpm离心5分钟,将除去上清液的粒料悬浮在含有溶酶菌(lysozyme)(sigma)4mg/ml的smmp 500μl中,以37℃培养1小时。接着,以3,500rpm离心10分钟,将除去上清液的粒料悬浮在smmp 400μl中。将该悬浮液33μl与各种质粒混合,再添加40%peg 100μl并旋涡混合。向该液体中添加smmp 350μl并倒转混合,以30℃、210rpm振荡1小时后,全部涂布在dm3琼脂培养基板上,以30℃进行2~3日培养。
[0086]
(4)vhh生产
[0087]
将(3)所制作的重组枯草杆菌植菌于1ml的含有50ppm四环素的lb培养基,以32℃往复振荡一晩,制成前培养液。对于蛋白酶单一缺损株,将前培养液在放入试验管中的5ml的2
×
l-mal培养基上进行1%接种,以30℃振荡培养72小时。对于dpr9δsigf,将前培养液在放入具挡板三角烧瓶内的20ml的2
×
l-mal培养基上进行1%接种,以30℃振荡培养72小时。培养结束时,将1ml的培养液在微型管中以4℃、15,000rpm进行5分钟离心,回收上清液。
[0088]
(5)sds-page
[0089]
将(4)所得到的培养上清液与含有50mm dtt的laemmli sample buffer(bio-rad)
等量混合后,以99℃进行5分钟热处理,制备样品。凝胶使用mini-protein tgx stain-free(bio-rad)。在各孔中涂布5μl的样品后,以210v进行25分钟电泳。分子量标记使用precision plus protein unstained standard(bio-rad)。利用chemidoc mp imaging system检测蛋白质的条带。利用以溶酶菌标品(sigma-aldrich)为基础制成的校正曲线,对检测到的蛋白质进行定量。蛋白质的定量使用bio-rad公司制造的软件image lab。
[0090]
(6)蛋白质印迹法
[0091]
利用sds-page凝胶,使用trans-blot turbo mini pvdf transfer packs(bio-rad)和trans-blot turbo system(bio-rad),将蛋白质转录于pvdf膜。抗体使用6
×‑
his标签单抗(6
×‑
his tag monoclonal antibody)(3d5)、hrp(invitorogen),抗体反应使用ibind western system(invitrogen)。使用1-step ultra tmb-blotting solution(thermo scientific)检测目标蛋白质。使用以浓度已知的his-n15精制蛋白质(序列号26)为基础制成的校正曲线,对蛋白质进行定量。蛋白质的定量使用bio-rad公司制造的软件image lab。
[0092]
(7)分子间相互作用测定
[0093]
利用使用biacore t200(ge healthcare)的分子间相互作用测定,对利用dpr9δsigf生产的1zvh(序列号38)的抗原结合活性进行分析。传感器芯片使用series s sensor chip cm5,电泳缓冲液(running buffer)使用hbs-ep+。利用25mm磷酸na、ph6.5缓冲液将hewl(溶酶菌,来自蛋清;wako)调节至0.7g/l,制备抗原溶液。利用乙酸水溶液(ph4.0、4.5、5.0或5.5)对该抗原溶液进行100倍稀释,从而调节至7μg/ml,作为底物使用。将利用电泳缓冲液稀释至8.6nm、26nm、78nm、230nm或700nm的1zvh作为样品。使用该底物和样品,在biacore t200附带的控制软件上设定或施行以下的项目,监测hewl与1zvh间的结合。施行immobilisation ph scouting,对最适于向传感器芯片的固定化的ph进行研究。判断最适ph条件为ph5.5。利用aim for immobilized level,将目标设为150ru,利用胺偶联法,将溶酶菌固定于流路(flow path)2。另外,流路(flow path)1实施blank immobilization。在流路(flow path)2-1监测底物与样品的结合。再生液(regeneration solution)使用10mm甘氨酸-盐酸(glycine-hcl)(ph1.5)。结合监测时的接触时间(contact time)为120sec,流速(flow rate)为30μl/min,解离时间(dissociation time)为120sec,再生(regeneration)的接触时间(contact time)为30sec,稳定期(stabilization period)为120sec。使用所得到的传感图,进行动力学(kinetics)分析。反应模式选择1:1binding。
[0094]
(8)结果
[0095]
将关于来自细胞外蛋白酶单一缺损重组枯草杆菌株δepr、δwpra、δmpr、δnprb、δbpr、δnpre、δvpr、δapre和δaprx的培养上清液的sds-page图像示于图1。图中的“+”表示抗体的条带(图中用箭头表示)的强度。在δepr、δwpra、δbpr、δvpr、δapre和δaprx中vhh高表达。其中,δwpra和δbpr中的vhh表达显著高。根据这些结果,显示epr、wpra、bpr、vpr、apre和aprx的缺损影响了枯草杆菌中的vhh表达。
[0096]
表3显示细胞外蛋白酶多重缺损重组枯草杆菌株dpr9δsigf中的序列号2、4、6、8、10、12、14、16、18、20、22、24、26和28的vhh的表达量。利用蛋白质印迹法对序列号4和序列号28的表达进行定量,利用sds-page对剩余的表达进行定量。利用dpr9δsigf能够生产各种vhh。另外,图2显示dpr9δsigf中的序列号30、32的医药vhh分子(奥利组单抗和卡普赛珠单
抗)、以及序列号34、36的医药用人源化vhh分子(nbhul6_vglw和h-nbbcii10_fgla)的表达量。图3显示dpr9δsigf所表达的奥利组单抗和卡普赛珠单抗的蛋白质印迹图像。dpr9δsigf能够以全长表达全部4种医药vhh分子(参照图2和图3)。根据这些结果,显示蛋白酶缺损枯草杆菌株能够表达连接有多个vhh、人源化vhh和vhh的分子等。
[0097]
[表3]
[0098]
vhh序列号(g/l)3g9a20.314c5740.35imm60.885jqh80.415nbd100.393k1k120.514fhb141.764ksd160.113k81180.865fv2200.194w6w220.165j57240.12n15260.494gft280.02
[0099]
图4显示dpr9δsigf的培养上清液和精制中得到的组分的电泳图像(左)以及(7)中测得的精制后的vhh(1zvh、序列号38)的抗原(hewl)结合活性(右)。在电泳中,将dpr9δsigf培养上清液(s)供于填充有ni-nta琼脂糖(agarose)(wako)的柱,得到通过柱的组分ft。接着,将清洗缓冲液(30mm咪唑、0.25m nacl、10mm tris ph8.0)供于柱,得到通过柱的组分w。之后,将洗脱缓冲液(500mm咪唑、0.5m nacl、20mm tris ph7.5)供于柱,得到通过柱的组分e。利用不含dtt的laemmli sample buffer(bio-rad)对所得到的s和组分ft、w、e进行处理。另外,利用含有50mm dtt的laemmli sample buffer(bio-rad)对组分e进行处理。将处理过的样品供于sds-page。与利用不含dtt的缓冲液进行了处理的组分e(非还原e)相比,在利用含有dtt的缓冲液进行了处理的组分e(还原e)中,条带向上方移动。根据该结果,显示在枯草杆菌所表达的vhh内形成了二硫键。另外,如图4右所示,通过分子间相互作用测定,观察到所表达的vhh对固定在浓度依赖性传感器上的抗原的响应(response)值上升,因此保持了抗原结合活性。根据该结果,显示使用枯草杆菌能够生产活性型vhh。
[0100]
比较例1利用重组大肠杆菌的vhh生产
[0101]
(1)重组大肠杆菌的制作
[0102]
利用使用表4所示的引物和primestar max dna聚合酶(takara)的pcr,扩增含有实施例1(1)所示的人工合成基因(序列号1、3、5、7和9的多核苷酸,编码各序列号2、4、6、8和10的vhh)的dna。利用nco i和hind iii消化pet22b,使用in-fusion hd cloning kit导入所得到的pcr片段,构建质粒。将所构建的质粒与rosetta-gami 2(de3)plyss株的感受态细胞混合,在冰上静置10分钟后,以42℃进行1分钟处理,从而导入大肠杆菌株中。
[0103]
[表4]
[0104][0105]
(2)vhh生产
[0106]
将(1)所制作的重组大肠杆菌植菌于含有2ml的50ppm氨苄西林钠的lb培养基上,以30℃往复振荡一晩,制成前培养液。将20μl的前培养液植菌于2ml的overnight express
tm instant tb medium上,以30℃进行24小时培养。
[0107]
(3)sds-page和蛋白质印迹法
[0108]
利用(2)所得到的培养物,通过离心进行集菌。将所得到的菌体再悬浮在与供于离心的培养液等量的pbs缓冲液中,向其中添加含有50mm dtt的laemmli sample buffer(bio-rad),制备样品。按照与实施例1(5)相同的方法将所得到的样品供于sds-page。蛋白质印迹法按照与实施例1(6)相同的方法进行。
[0109]
(4)结果
[0110]
将关于大肠杆菌株培养物的sds-page图像示于图5。作为蛋白质定量的结果,任意株均为15mg/l以下的生产率。与dpr9δsigf株中的vhh表达量(表3)进行比较时,显示枯草杆菌的vhh生产率为大肠杆菌的20倍以上。
[0111]
实施例2利用蛋白酶缺损重组枯草杆菌的vhh生产
[0112]
作为vhh基因,使用序列号63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93、95、97、99、101、103、105、107、109、111、113、115、117、119、121、123、125、127、129、131、133、135和137的多核苷酸(编码各序列号64、66、68、70、72、74、76、78、80、82、84、86、88、90、92、94、96、98、100、102、104、106、108、110、112、114、116、118、120、122、124、126、128、130、132、134、136和138的vhh:分别称为vhh1~38),除此以外,按照与实施例1(1)和(2)相同的方法构建vhh表达用质粒。将所构建的质粒按照实施例1(3)所示的方法导入dpr9δsigf中。按照与实施例1(4)相同的方法培养所制作的重组枯草杆菌,使vhh表达。
[0113]
利用elisa对由重组枯草杆菌表达的vhh进行定量。elisa按照his标签抗体板(his tag antibody plate)(genscript公司)的手册进行。将上述所得到的重组枯草杆菌的培养物的上清液用pbs稀释至2万倍,将100μl稀释液加入his标签抗体板(his tag antibody plate)的各孔中,以4℃静置一晩。利用添加有tween(注册商标)20 0.05%的pbs(pbst)将孔清洗3次,接着,添加用pbst稀释5000倍的peroxidase-conjugated affinipure goat anti-alpaca igg、vhh区(jackson immunoresearch 128-035-232)100μl,室温下静置30分钟。之后,利用pbst将孔清洗3次,添加3,3',5,5'-四甲基联苯胺(tmb[elisa用];东京化成工业)100μl,室温下静置20分钟。添加tmb停止液(stop solution)(seracare life sciences)50μl使反应停止后,测定各孔的450nm的吸光度。按照ni-nta琼脂糖(富士胶片和
光纯药)的手册,将浓度已知的vhh1的elisa的吸光度作为指标,算出蛋白质浓度。
[0114]
表5显示重组枯草杆菌株dpr9δsigf中的vhh1~38的表达量。vhh1~38均由重组枯草杆菌株生产。
[0115]
[表5]
[0116]
vhh序列号表达量(g/l) vhh序列号表达量(g/l)vhh164》2 vhh201021.2vhh2661.7 vhh21104》2vhh368》2 vhh22106》2vhh4702.0 vhh23108》2vhh572》2 vhh24110》2vhh674》2 vhh25112》2vhh7761.1 vhh26114》2vhh8781.0 vhh27116》2vhh9801.2 vhh281181.65vhh1082》2 vhh291201.15vhh1184》2 vhh301220.16vhh12861.94 vhh311241.74vhh13880.45 vhh321260.39vhh14901.67 vhh331280.1vhh1592》2 vhh341300.11vhh1694》2 vhh351320.08vhh1796》2 vhh36134》2vhh18981.04 vhh371360.37vhh191001.9 vhh381381.13
[0117]
※
》2表示2g/l以上。校正曲线上限以外。
[0118]
以上,对本发明的实施方式进行了说明,但能够理解的是这些并没有将本发明限定于所说明的特定的实施方式的意图。在本发明的范围内进行的各种其它的变更和修正对于本领域技术人员是清楚的。本说明书所引用的文献和专利申请正如其在本说明书中完全记载的那样,作为参考而被引用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1