用于治疗慢性移植物抗宿主病的抗体的制作方法
fms-oncogene and of the cytokine,csf-1,during mouse embryogenesis),pampfer s等人,biol reprod 1992,46(1),48-57(expression of the csf-1receptor(c-fms proto-oncogene product)in the human uterus and placenta;jokhi pp等人,lab invest1993,68(3),308-320(expression of the csf-1receptor(c-fms product)by cells at the human uteroplacental interface);kauma sw等人,j clin endocrinol metab 1991,73(4),746-751(csf-1and c-fms expression in human endometrial tissues and placenta during the menstrual cycle and early pregnancy),byrne j cell biol 1981 91(3pt1)848-53,hofstetter w等人,bone 1995,17,(2),145-151;tanaka s等人,1993,j clin invest,91:257-63;weir ec等人,1993,j bone miner res,8(12)1507-18。
6.配体csf-1与csf-1受体的结合导致受体通过其酪氨酸激酶结构域的作用在一个或多个酪氨酸残基上磷酸化。可以检测到这种磷酸化,因为存在只能与磷酸化后的受体结合的抗体(例如,来自cell signaling technology的phospho-m-csf-receptor(tyr546)抗体#3083)。
7.慢性移植物抗宿主病(cgvhd)(供体来源的造血细胞对受体组织的免疫反应)是同种异体造血干细胞移植(hsct)的一种严重的、可能危及生命的并发症。据估计,大约40%的移植接受者会出现cgvhd,估计影响美国的14,000名患者,并且可持续数年。慢性gvhd通常表现在多个器官系统中,皮肤和粘膜通常受累,其特征是纤维化组织的发展。移植物抗宿主病(gvhd)是一种免疫介导的疾病,对移植相关的发病率和死亡率有很大影响。gvhd的总发病率保持在30%至60%之间,死亡率为约50%。急性和慢性gvhd是复杂的临床现象,需要新的有希望的治疗方法。慢性移植物抗宿主病(cgvhd)仍然是同种异体造血干细胞移植(hsct)后发病率和非复发死亡率的主要原因。cgvhd通常表现为多器官病理,这通常发生在hsct后的第一年,但也可能在hsct后的第一年之后发展(jagasia 2015)。cgvhd的治疗目前基于类固醇施用。虽然随着时间的推移,生存结果的改善已经取得了进展,但目前可用的疗法与显著的毒性相关,并且许多目前可用的补救疗法与增加的免疫抑制、感染性并发症和移植物抗白血病(gvl)效应的潜在损失有关。因此,对于为cgvhd开发更新的治疗策略以改善hsct接受者的长期移植后结果和生活质量存在未满足的需求(hill 2018)。
8.艾克利单抗是一种对csf-1r具有高亲和力的人源化igg4单克隆抗体(mab)。艾克利单抗可以通过与csf-1r结合并阻断其两种已知配体集落刺激因子1(csf-1)和白细胞介素34(il-34)的激活来影响tam的迁移、增殖、分化和存活。
9.虽然对cgvhd的病理生理学认识正在兴起,但对cgvhd患者的治疗几乎没有有意义的发展。目前,对于强的松作为治疗的主要支柱仍然存在长期依赖。类固醇施用可以缓解症状并延缓疾病进展;然而,这种方法与显著的毒性和耐药性的出现有关(flowers和martin2015,macdonald 2017)。尽管缺乏临床证据支持这些药物与皮质类固醇联合后的额外疗效,但减少皮质类固醇剂量的努力已导致它们与其他免疫抑制剂(例如环孢菌素、他克莫司和西罗莫司)联合用于一线或二线治疗(miklos 2017)。
10.大约50%至60%的cgvhd患者在初始全身治疗后2年内需要二次治疗。尽管在药物的最佳选择方面没有达成共识,但它们通常包括利妥昔单抗或伊马替尼(flowers和martin 2015)。2017年,btk抑制剂(依鲁替尼)成为首个fda批准的治疗成人cgvhd
患者的疗法,适用于接受过≥1线治疗的患者。依鲁替尼的副作用是显著的,在cgvhd患者中依鲁替尼的关键评估中,38%的患者因不良事件停药,31%的患者减少剂量。此外,研究人员指出,由于参与临床开发计划的患者的器官系统受累,他们并未将依鲁替尼给予大部分cgvhd患者。最近对cgvhd的了解导致针对参与疾病相关炎症信号传导途径的激酶(例如btk、jak1/2和syk)的干预措施,其正在评估中。
11.针对这些途径的非临床和患者样品相关研究显示出有希望的结果(macdonald 2017)。
12.艾克利单抗基于其抑制csf-1r的高亲和力具有提供治疗cgvhd和其他硬皮病况的免疫治疗方法的潜力。硬皮病有一系列表现和多种治疗意义。它包括局限性硬皮病、系统性硬化症、硬皮病样病症和sine硬皮病(smith,2000)。虽然局限性硬皮病是一种罕见的与纤维化相关且表现仅限于皮肤的皮肤病,但系统性硬化症是一种多系统疾病,具有内脏器官受累的不同风险和不同的皮肤病程度。系统性硬化症可以是弥漫性的或局限的。局限性系统性硬化症也称为crest(钙质沉着症、雷诺氏食管功能障碍、指端硬化症、毛细血管扩张症)。硬皮病样病症被认为与工业环境暴露有关。在sine病中,有内脏器官受累而没有皮肤变化。硬皮病和特别是系统性硬化症的主要表现是不适当的过度胶原合成和沉积、内皮功能障碍、痉挛、塌陷和纤维化闭塞。这些患有包括硬化和肺部受累的慢性gvhd患者通常难以治疗并且与不良结果相关,因此这些患者(特别是那些需要二线或更多线治疗的患者)的发病率和死亡率仍然很高。因此,开发治疗慢性gvhd和这些相关病况的新药物仍然是一个未满足的医疗需求。
技术实现要素:
13.csf-1r活性抑制剂在治疗硬化病况和慢性宿主抗移植物疾病方面具有活性。艾克利单抗是一种抗csf-1r抗体或其抗原结合片段,其包含重链和/或轻链,其中重链的可变结构域包含具有针对cdr-h1在seq id no:4中给出的序列的cdr、具有针对cdr-h2在seq id no:5中给出的序列的cdr和具有针对cdr-h3在seq id no:6中给出的序列的cdr中的至少一个;其中轻链的可变结构域包含具有针对cdr-l1在seq id no:1中给出的序列的cdr、具有针对cdr-l2在seq id no:2中给出的序列的cdr和具有针对cdr-l3在seq id no:3中给出的序列的cdr中的至少一个。
14.在一些实施方案中,抗csf-1r抗体或其抗原结合片段包含重链和轻链,其中重链的可变结构域包含三个cdr并且cdr-h1的序列与seq id no:4中给出的序列具有至少60%的同一性或相似性,cdr-h2的序列与seq id no:5中给出的序列具有至少60%的同一性或相似性,以及cdr-h3的序列与seq id no:6中给出的序列具有至少60%的同一性或相似性;并且其中轻链的可变结构域包含三个cdr并且cdr-l1的序列与seq id no:1中给出的序列具有至少60%的同一性或相似性,cdr-l2的序列与seq id no:2中给出的序列具有至少60%的同一性或相似性以及cdr-l3的序列与seq id no:3中给出的序列具有至少60%的同一性或相似性。
15.在一些实施方案中,抗csf-1r抗体或其抗原结合片段包含重链,其中重链包含seq id no:23中给出的序列;和轻链,其中轻链包含seq id no:15中给出的序列。
16.在一些实施方案中,抗csf-1r抗体或抗csf-1抗体或其抗原结合片段选自具有全
长重链和轻链的完整抗体分子、fab、修饰的fab’、fab’、f(ab’)2、fv、vh、vl及其scfv片段。
17.在一些实施方案中,抗csf-1r抗体或其抗原结合片段含有包含seq id no:27中给出的序列的重链和包含seq id no:19中给出的序列的轻链。
18.在一些实施方案中,抗csf-1r抗体或其抗原结合片段交叉阻断包含针对cdr-l1的序列seq id no:1、针对cdr-l2的seq id no:2、针对cdr-l3的seq id no:3、针对cdr-h1的seq id no:4、针对cdr-h2的seq id no:5和针对cdr-h3的seq id no:6中给出的6个cdr的抗体的结合。
19.在一些实施方案中,本文定义的抗csf-1r是艾克利单抗。
20.在一些实施方案中,艾克利单抗的给药是0.3mg/kg q2w、1mg/kg q2w或3mg/kg q4w。在一些实施方案中,艾克利单抗的施用用于预防或治疗硬化性皮肤病况。在一些实施方案中,艾克利单抗的施用用于预防或治疗慢性移植物抗宿主病。
21.本公开内容的细节在以下所附描述中阐述。尽管与本文所述的方法和材料相似或等效的方法和材料可以用于本技术的实践或测试,但现在描述说明性的方法和材料。在冲突的情况下,以本说明书(包括定义)为准。此外,材料、方法和示例仅是说明性的而不是限制性的。本公开内容的其他特征、目的和优点将从描述和权利要求中变得明显。在说明书和所附权利要求中,单数形式也包括复数形式,除非上下文另有明确规定。除非另有定义,否则本文使用的所有技术和科学术语具有与本公开内容所属领域的普通技术人员通常理解的相同含义。
22.贯穿本技术引用的所有参考文献(包括文献参考、已授权专利、已公布专利申请和共同未决专利申请)的内容在此通过引用明确地整体并入本文。本文引用的参考文献不承认为本技术的现有技术。
23.附图简要说明
24.专利或申请文件包含至少一幅彩色绘图。专利局将根据请求和支付必要的费用后提供本专利或专利申请出版物的彩色附图副本。
25.图1显示了根据本发明用抗csf-1r抗体或其抗原结合片段治疗cgvhd的一般示意图。
26.图2显示了cgvhd中csf-1r信号传导的途径。
27.图3显示了根据本发明的临床试验的一般示意图。
28.图4显示了根据本发明的各种实施方案处理的各种群组。
29.图5显示在抗csf-1r抗体或其抗原结合片段的1mg/kg q2w(每两周)剂量下诱导cgvhd中的反应的csf-1r抑制的第一个证据。
30.图6显示在抗csf-1r抗体或其抗原结合片段的3mg/kg q2w(每两周)剂量下诱导cgvhd中的反应的csf-1r抑制的证据。
31.图7显示了抗体浓度和单核细胞计数(包括循环cd14
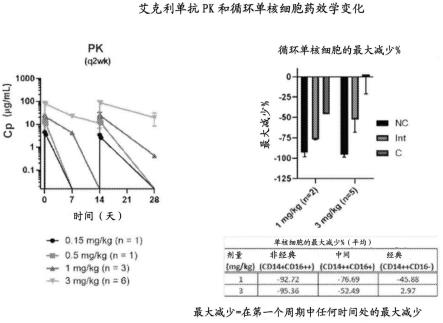
+
cd16
+
非经典和cd14
++
cd16
+
中间单核细胞动力学)与在健康志愿者和患者中观察到的一致。显示在3mg/kg q2wk的剂量下,患者在在低谷时仍有循环抗体,其在《3mg/kg的剂量下无法检测到,类似地在右侧注意到非经典单核细胞的显著减少,与中间和经典相比时明显更显著。
32.图8显示了在多次治疗后在几个器官系统中观察到的反应。
33.图9显示了艾克利单抗剂量递增和扩展。
34.图10显示了慢性gvhd的特征。
35.图11显示了患者的人口统计和特征。
36.图12显示了跨cgvhd器官系统的反应。
37.图13显示了在各种间隔下施用不同剂量的艾克利单抗后的症状控制。
38.图14显示了大多数患者中的瀑布图和改进的lee症状评分。
39.图15显示了艾克利单抗的总结和正在进行的试验。
40.发明详述
41.在一些实施方案中,本技术涉及使用抗csf-1r抗体或其结合片段治疗移植物抗宿主病。在一些实施方案中,抗csf-1r抗体是艾克利单抗。在一些实施方案中,抗csf-1r抗体或其抗原结合片段包含重链和/或轻链,其中重链的可变结构域包含具有针对cdr-h1在seq id no:4中给出的序列的cdr、具有针对cdr-h2在seq id no:5中给出的序列的cdr和具有针对cdr-h3在seq id no:6中给出的序列的cdr中的至少一个;其中轻链的可变结构域包含具有针对cdr-l1在seq id no:1中给出的序列的cdr、具有针对cdr-l2在seq id no:2中给出的序列的cdr和具有针对cdr-l3在seq id no:3中给出的序列的cdr中的至少一个。
42.在一些实施方案中,抗csf-1r抗体或其抗原结合片段包含重链和轻链,其中重链的可变结构域包含三个cdr并且cdr-h1的序列与seq id no:4中给出的序列具有至少60%的同一性或相似性,cdr-h2的序列与seq id no:5中给出的序列具有至少60%的同一性或相似性,以及cdr-h3的序列与seq id no:6中给出的序列具有至少60%的同一性或相似性;并且其中轻链的可变结构域包含三个cdr并且cdr-l1的序列与seq id no:1中给出的序列具有至少60%的同一性或相似性,cdr-l2的序列与seq id no:2中给出的序列具有至少60%的同一性或相似性以及cdr-l3的序列与seq id no:3中给出的序列具有至少60%的同一性或相似性。
43.在一些实施方案中,抗csf-1r抗体或其抗原结合片段包含重链,其中重链包含seq id no:23中给出的序列;和轻链,其中轻链包含seq id no:15中给出的序列。
44.在一些实施方案中,该抗体具有包含seq id no:27中给出的序列的重链和包含seq id no:19中给出的序列的轻链。还提供了抗csf-1r抗体或其结合片段,其中重链和轻链与包含seq id no:27中给出的序列的重链和包含seq id no:19中给出的序列的轻链至少80%(优选85%、90%、95%或98%)相同或相似。
45.在一个实施方案中,轻链具有seq id no:19中给出的序列或由其组成,重链具有seq id no:27中给出的序列或由其组成。在另一个实施方案中,轻链具有seq id no:19的序列或由其组成和重链具有seq id no:27的序列或由其组成,其中seq id no:27的位置453的氨基酸赖氨酸缺失或删除。
46.本公开内容还提供了由本公开内容的抗体(特别是包含重链序列gh2(seq id no:27)和/或轻链序列gl7(seq id no:19)的抗体969.g2)结合的人csf-1r的特定区域或表位。
47.在一些实施方案中,抗csf-1r抗体或抗csf-1抗体或其抗原结合片段选自具有全长重链和轻链的完整抗体分子、fab、修饰的fab’、fab’、f(ab’)2、fv、vh、vl及其scfv片段。
48.在一些实施方案中,抗csf-1r抗体或其抗原结合片段含有包含seq id no:27中给出的序列的重链和包含seq id no:19中给出的序列的轻链。
49.在一些实施方案中,抗csf-1r抗体或其抗原结合片段交叉阻断包含针对cdr-l1的
序列seq id no:1、针对cdr-l2的seq id no:2、针对cdr-l3的seq id no:3、针对cdr-h1的seq id no:4、针对cdr-h2的seq id no:5和针对cdr-h3的seq id no:6中给出的6个cdr的抗体的结合。
50.在一些实施方案中,抗csf-1r抗体或其抗原结合片段通过结合与其阻断的抗体相同的表位来交叉阻断结合。
51.在一些实施方案中,抗csf-1抗体或其抗原结合片段通过结合与其阻断的抗体相同的表位来交叉阻断结合。
52.在一些实施方案中,抗csf-1r抗体或抗csf-1抗体或其抗原结合片段或csf-1r抑制剂每周施用一次。
53.在一些实施方案中,抗csf-1r抗体或抗csf-1抗体或其抗原结合片段或csf-1r抑制剂每两周施用一次。在一些实施方案中,抗csf-1r抗体或抗csf-1抗体或其抗原结合片段或csf-1r抑制剂每周施用两次。
54.在一些实施方案中,抗csf-1r抗体或抗csf-1抗体或其抗原结合片段或csf-1r抑制剂每周施用3次。
55.在一些实施方案中,抗csf-1r抗体或其抗csf-1抗体抗原结合片段或csf-1r抑制剂以约0.1mg/kg至约30mg/kg的剂量施用。
56.在一些实施方案中,抗csf-1r抗体或其抗csf-1抗体抗原结合片段或csf-1r活性抑制剂以约0.1mg/kg至约10mg/kg的剂量施用。在一些实施方案中,抗csf-1r抗体或其抗csf-1抗体抗原结合片段或csf-1r活性抑制剂以约0.1mg/kg至约10mg/kg的剂量施用用于治疗慢性移植物抗宿主病。
57.在一些实施方案中,抗csf-1r抗体或抗csf-1抗体或其抗原结合片段或csf-1r活性抑制剂以约0.1mg/kg、0.5mg/kg、1mg/kg、1.5mg/kg、3mg/kg、5mg/kg、6mg/kg、7.5mg/kg或约10mg/kg的剂量施用。
58.在一些实施方案中,艾克利单抗以每周0.15mg/kg的剂量施用。在一些实施方案中,艾克利单抗以每周0.5mg/kg的剂量施用。在一些实施方案中,艾克利单抗以每周1.0mg/kg的剂量施用。在一些实施方案中,艾克利单抗以每周3.0mg/kg的剂量施用。在一些实施方案中,艾克利单抗以每两周0.15mg/kg的剂量施用。在一些实施方案中,艾克利单抗以每两周0.5mg/kg的剂量施用。在一些实施方案中,艾克利单抗以每两周1.0mg/kg的剂量施用。在一些实施方案中,艾克利单抗以每两周3.0mg/kg的剂量施用。在一些实施方案中,艾克利单抗以每三周0.15mg/kg的剂量施用。在一些实施方案中,艾克利单抗以每三周0.5mg/kg的剂量施用。在一些实施方案中,艾克利单抗以每三周1.0mg/kg的剂量施用。在一些实施方案中,艾克利单抗以每三周3.0mg/kg的剂量施用。在一些实施方案中,艾克利单抗以每四周0.15mg/kg的剂量施用。在一些实施方案中,艾克利单抗以每四周0.5mg/kg的剂量施用。在一些实施方案中,艾克利单抗以每四周1.0mg/kg的剂量施用。在一些实施方案中,艾克利单抗以每四周3.0mg/kg的剂量施用。在一些实施方案中,每周根据循环经典单核细胞水平增加或减少剂量。
59.优选地,抗csf-1r抗体或抗csf-1抗体或其抗原结合片段或csf-1r抑制剂每两周施用一次。优选地,抗csf-1r抗体或抗csf-1抗体或其抗原结合片段或csf-1r抑制剂以1mg/kg的剂量施用。优选地,抗csf-1r抗体或抗csf-1抗体或其抗原结合片段或csf-1r抑制剂以
3mg/kg的剂量施用。优选地,抗csf-1r抗体或抗csf-1抗体或其抗原结合片段或csf-1r抑制剂以每两周1mg/kg的剂量施用。
60.在一些实施方案中,csf-1r抑制剂被施用并减少循环的经典单核细胞。在一些实施方案中,csf-1r抑制剂被施用并耗竭循环的经典单核细胞。在一些实施方案中,csf-1r抑制剂被施用并完全耗竭经典单核细胞的水平。在一些实施方案中,csf-1r抑制剂的初始施用以预定百分比耗竭经典单核细胞的水平。在一些实施方案中,csf-1r抑制剂的初始施用以预定百分比耗竭经典单核细胞的水平,并且一旦经典单核细胞水平增加,就发生csf-1r抑制剂的后续施用。在一些实施方案中,csf-1r抑制剂的初始施用以预定百分比耗竭经典单核细胞的水平,并且一旦经典单核细胞的水平增加到预定百分比,就发生csf-1r抑制剂的后续施用。在一些实施方案中,至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或100%。
61.在一些实施方案中,该方法提供人中慢性移植物抗宿主病(cgvhd)的治疗,该方法包括向有需要的人施用药学有效量的艾克利单抗。在一些实施方案中,本文的治疗方法针对硬皮病。在一些实施方案中,治疗方法针对预防或减轻慢性移植物抗宿主病(cgvhd)的症状。在一些实施方案中,cgvhd是肝脏cgvhd。在一些实施方案中,cgvhd是肾cgvhd。在一些实施方案中,cgvhd是食道cgvhd。在一些实施方案中,cgvhd是胃cgvhd。在一些实施方案中,本文的治疗方法针对局限性硬皮病、系统性硬化症、硬皮病样病症和sine硬皮病。在一些实施方案中,本文的治疗方法针对系统性硬化症。在一些实施方案中,本文的治疗方法针对系统性硬化症,其中系统性硬化症是弥漫性的或局限性的。在一些实施方案中,本文的治疗方法针对crest(钙质沉着症、雷诺氏食管功能障碍、指端硬化症、毛细血管扩张症)。硬皮病样病症被认为与工业环境暴露有关。在sine病中,有内脏器官受累而没有皮肤变化。硬皮病和特别是系统性硬化症的主要表现是不适当的过度胶原合成和沉积、内皮功能障碍、痉挛、塌陷和纤维化闭塞。在一些实施方案中,细胞移植是造血细胞移植。在一些实施方案中,gvhd是急性gvhd。在一些实施方案中,gvhd是慢性gvhd。在一些实施方案中,gvhd是硬皮病gvhd。在一些实施方案中,gvhd是类固醇抗性gvhd。在一些实施方案中,gvhd是耐环孢菌素的gvhd。在一些实施方案中,gvhd是难治性gvhd。在一些实施方案中,ghvd是口腔gvhd。在一些实施方案中,口腔gvhd是网状口腔gvhd。在一些实施方案中,口腔gvhd是侵蚀性口腔gvhd。在一些实施方案中,口腔gvhd是溃疡性口腔gvhd。在一些实施方案中,口腔gvhd是口腔的gvhd。在一些实施方案中,口腔gvhd是口咽区的gvhd。在一些实施方案中,口腔gvhd是咽区的gvhd。在一些实施方案中,口腔gvhd是食道区域的gvhd。在一些实施方案中,口腔gvhd是急性口腔gvhd。在一些实施方案中,口腔gvhd是慢性口腔gvhd。在一些实施方案中,患者表现出一种或多种gvhd症状。在一些实施方案中,患者已接受或将接受同种异体骨髓或造血干细胞移植。
62.不受任何理论的束缚,单核细胞/巨噬细胞的存在提供了积极和消极的效果。不受任何理论的束缚,已发现单核细胞/巨噬细胞在本文讨论的病况中具有积极和消极效果,并且在一些实施方案中,所述病况是本文讨论的硬化性皮肤病况和/或慢性移植物抗宿主病。在一些实施方案中,如果允许以减少的量存在,循环经典单核细胞的存在具有有益效果。允许单核细胞/巨噬细胞水平在csf-1r抑制剂/抗体施用之间增加,允许治疗利用循环单核细胞/巨噬细胞的积极效果,同时避免消极效果。在一些实施方案中,抗体抑制单核细胞增殖。
在一些实施方案中,当使用描述的测定法(例如,美国专利号8,206,715b2)将单核细胞增殖的量减少至少50%时,认为抗体“抑制单核细胞增殖”。在一些实施方案中,抗体将单核细胞增殖的量减少至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或100%。在一些此类实施方案中,认为该抗体将单核细胞增殖抑制至少50%、至少60%、至少70%等。
63.人单核细胞在各种疾病背景下表现出促炎特征。通过cd14的表达鉴定人单核细胞。它们可以根据cd16表达(高亲和力fc受体)进一步分类。cd16-细胞被称为经典单核细胞,因为它们通常占健康个体中总单核细胞的约90%。cd16+细胞似乎在许多炎性疾病中扩增,并且响应于趋化因子表现出优先迁移穿过内皮层。因此,它们通常被称为非经典或促炎单核细胞(非经典(cd14+/cd16+)单核细胞和经典(cd14+/cd16-)单核细胞)。
64.在一些实施方案中,施用本发明的csf-1r抑制剂使循环单核细胞减少至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或100%。在一些这样的实施方案中,认为该抗体抑制单核细胞增殖至少50%、至少60%、至少70%等。在一些实施方案中,在施用后续剂量的csf-1r抑制剂之前允许循环单核细胞的水平增加至少5%、至少10%、至少15%、至少约20%、至少约25%、至少约30%、至少约40%、至少约50%。在一些实施方案中,在施用后续剂量的csf-1r抑制剂之前,允许循环单核细胞的水平增加1周。在一些实施方案中,在施用后续剂量的csf-1r抑制剂之前,允许循环单核细胞的水平增加2周。在一些实施方案中,在施用后续剂量的csf-1r抑制剂之前,允许循环单核细胞的水平增加3周。在一些实施方案中,在施用后续剂量的csf-1r抑制剂之前,允许循环单核细胞的水平增加4周。
65.在一些实施方案中,单核细胞是非经典的。在一些实施方案中,单核细胞是经典的。在一些实施方案中,单核细胞是经典和非经典单核细胞的组合。在一些实施方案中,单核细胞是经典单核细胞和中间单核细胞的组合。
66.在一些实施方案中,csf-1r抑制剂是艾克利单抗。在一些实施方案中,csf-1r抑制剂根据以下剂量方案施用。在一些实施方案中,剂量方案最大化循环巨噬细胞的益处并且最小化消极效果。在一些实施方案中,剂量与以下剂量方案相反地增加。
[0067][0068]
在一些实施方案中,本发明的方法针对硬化性皮肤病况的治疗,其中患者在一种或多种先前治疗中取得进展。在一个实施方案中,硬化性皮肤病况是活动性慢性移植物抗宿主病。在一个实施方案中,患者在至少两种先前治疗中取得进展。在一个实施方案中,先前治疗是依鲁替尼。在一个实施方案中,先前治疗中的至少一种是依鲁替尼。
[0069]
在一些实施方案中,本发明的方法涉及cgvhd的治疗,其中患者在一种或多种先前
治疗中取得进展。在一个实施方案中,患者在至少两种先前治疗中取得进展。在一个实施方案中,先前治疗是依鲁替尼。在一个实施方案中,先前治疗中的至少一种是依鲁替尼。
[0070]
在一个实施方案中,艾克利单抗与可用于治疗移植物抗宿主病的一种或多种额外药剂一起施用,所述额外药剂选自强的松、甲基强的松、口服不可吸收的皮质类固醇例如布地奈德或二丙酸倍氯米松、免疫调节剂例如环孢菌素、他克莫司、霉酚酸酯、替洛米松、imuthiol、抗胸腺细胞球蛋白、抗tnf药物、硫唑嘌呤、肌苷5
’‑
单磷酸脱氢酶抑制剂、偶氮二碳化物(azodiacarbonide)、双吲哚马来酰亚胺viii、布喹那、苯丁酸氮芥、ctla-4ig、皮质类固醇、环磷酰胺、脱氧精胍菌素、地塞米松、糖皮质激素、来氟米特、巯基嘌呤、6-巯基嘌呤、甲氨蝶呤、甲基强的松龙、咪唑立宾、咪唑立宾单磷酸盐、muromonab cd3、吗替麦考酚酯、okt3、rho(d)免疫球蛋白、维生素d类似物、mc1288)、达珠单抗、英夫利昔单抗、利妥昔单抗、托珠单抗、阿仑单抗、甲氨蝶呤、抗胸腺细胞地尼白介素(antithymocyte denileukin diftitox)、campath-1h、角质形成细胞生长因子、阿巴西普、remestemcel-l辛二酰苯胺异羟肟酸、喷司他丁、沙利度胺、甲磺酸伊马替尼、环磷酰胺、氟达拉滨、okt3、美法仑、thiopeta和淋巴细胞免疫球蛋白、抗胸腺细胞和球蛋白
[0071]
核酸、多肽
[0072]
cdr-l1:lasediydnla(seq id no:1)
[0073]
cdrl2:yasslqd(seq id no:2)
[0074]
cdr-l3:lqdseypwt(seq id no:3)
[0075]
cdr-h1:gfslttygmgvg(seq id no:4)
[0076]
cdr-h2:niwwdddkyynpslkn(seq id no:5)
[0077]
cdr-h3:igpikyptapyryfdf(seq id no:6)
[0078]
大鼠ab 969 vl区:diqmtqspas lsaslgetvs ieclasediy dnlawyqkkp gksphlliyy asslqdgvps rfsgsgsgtq yslkinsles edaatyfclq dseypwtfgg gtklelk(seq id no:7)
[0079]
大鼠ab 969 vl区:gacatccaga tgacacagtc tccagcttcc ctgtctgcat ctctgggaga aactgtctcc atcgaatgtc tagcaagtga ggacatttac gataatttag cgtggtacca gaagaagcca ggaaaatctc ctcacctcct catctattat gcaagtagct tgcaagatgg ggtcccatca cggttcagtg gcagtggatc tggcacacag tattctctca aaatcaacag cctggaatct gaagatgctg cgacttattt ctgtctacag gattctgagt atccgtggac gttcggtgga ggcaccaagc tggaattgaa a(seq id no:8)
[0080]
大鼠ab 969 vl区,信号序列加下划线且为斜体:信号序列加下划线且为斜体:
[0081]
大鼠ab 969 vl区,信号序列加下划线且为斜体:
[0082]
大鼠ab 969 vh区:qvtlkesgpg ilqpsqtlsl tctfsgfslt tygmgvgwir qpsgkglewlaniwwdddky ynpslknrlt iskdtsnnqa flkltnvhts dsatyycarigpikyptapy ryfdfwgpgt mvtvs(seq id no:11)
[0083]
大鼠ab 969 vh区:caggttactc tgaaagagtc tggccctggg atattgcagc cctcccagac cctcagtctg acttgcactt tctctgggtt ttcactgacc acttatggta tgggtgtggg ctggattcgt cagccttcag ggaagggtct ggagtggctg gcaaacattt ggtgggatga tgataagtat tacaatccat ctctgaaaaa ccggctcaca atctccaagg acacctccaa caaccaagca ttcctcaagc tcaccaatgt acacacttca gattctgcca catactactg tgctcggata gggccgatta aatacccgac ggccccctac cggtactttg acttctgggg cccaggaacc atggtcaccg tctcg(seq id no:12)
[0084]
大鼠ab 969 vh区,信号序列加下划线且为斜体:信号序列加下划线且为斜体:
[0085]
大鼠ab 969 vh区,信号序列加下划线且为斜体:信号序列加下划线且为斜体:
[0086]
969 gl7 v区:diqmtqspss lsasvgdrvt itclasediy dnlawyqqkp gkapklliyy asslqdgvps rfsgsgsgtd ytltisslqp edfatyyclq dseypwtfgg gtkveik(seq id no:15)
[0087]
969 gl7 v区:gacatacaga tgactcagtc accctcaagc ctgagtgcca gtgtgggaga cagggtgaca atcacctgtc tggcctccga ggatatctac gataacctgg catggtatca gcagaaacct ggaaaggctc ccaagctcct gatttattat gcctcctctc tccaagacgg cgttccatct cggttcagcg gaagcggctc cgggacggat tacacactga caattagctc tctgcaaccg gaggattttg ctacttacta ctgcctgcaa gactccgaat acccatggac cttcggtggt ggcaccaaag tggaaatcaa g(seq id no:16)
[0088]
969 gl7 v区,信号序列加下划线且为斜体:信号序列加下划线且为斜体:
[0089]
969 gl7 v区,信号序列加下划线且为斜体:斜体:
[0090]
969 gl7轻链(v+恒定):diqmtqspss lsasvgdrvt itclasediy dnlawyqqkp gkapklliyy asslqdgvps rfsgsgsgtd ytltisslqp edfatyyclq dseypwtfgg gtkveikrtv aapsvfifpp sdeqlksgta svvcllnnfy preakvqwkv dnalqsgnsq esvteqdskd styslsstlt lskadyekhk vyacevthqg lsspvtksfn rgec(seq id no:19)
[0091]
969 gl7轻链(v+恒定):gacatacaga tgactcagtc accctcaagc ctgagtgcca gtgtgggaga cagggtgaca atcacctgtc tggcctccga ggatatctac gataacctgg catggtatca gcagaaacct ggaaaggctc ccaagctcct gatttattat gcctcctctc tccaagacgg cgttccatct cggttcagcg gaagcggctc cgggacggat tacacactga caattagctc tctgcaaccg gaggattttg ctacttacta ctgcctgcaa gactccgaat acccatggac cttcggtggt ggcaccaaag tggaaatcaa gcgtacggta gcggccccat ctgtcttcat cttcccgcca tctgatgagc agttgaaatc tggaactgcc tctgttgtgt gcctgctgaa taacttctat cccagagagg ccaaagtaca gtggaaggtg gataacgccc tccaatcggg taactcccag gagagtgtca cagagcagga cagcaaggac agcacctaca gcctcagcag caccctgacg ctgagcaaag cagactacga gaaacacaaa gtctacgcct gcgaagtcac ccatcagggc ctgagctcgc ccgtcacaaa gagcttcaac aggggagagt gt(seq id no:20)
[0092]
969 gl7轻链(v+恒定),信号序列加下划线且为斜体:信号序列加下划线且为斜体:
[0093]
969 gl7轻链(v+恒定),信号序列加下划线且为斜体:
[0094]
[0095]
969 gh2 v区:evtlkesgpa lvkptqtltl tctfsgfslt tygmgvgwir qppgkalewl aniwwdddky ynpslknrlt iskdtsknqv vltmtnmdpv dtatyycari gpikyptapy ryfdfwgqgt mvtvs(seq id no:23)
[0096]
969 gh2 v区:gaagtgacac tcaaggagtc tggacccgct ctggtgaaac caacccaaac actcactttg acatgtactt ttagtggctt ctcattgact acctatggaa tgggcgtggg atggatcaga cagccacctg gcaaggctct ggaatggctg gccaacatct ggtgggatga cgacaagtac tataacccgt ccctgaaaaa ccggctgacc attagcaagg atacttctaa aaatcaagtg gtgctgacca tgacaaatat ggatcccgtt gacaccgcaa cctactactg cgcccgcatt ggtcccataa agtaccctac ggcaccttac cgatatttcg acttttgggg ccaagggaca atggttactg tctcg(seq id no:24)
[0097]
969 gh2 v区,信号序列加下划线且为斜体:信号序列加下划线且为斜体:
[0098]
969 gh2 v区,信号序列加下划线且为斜体:信号序列加下划线且为斜体:
[0099]
969 gh2重链(v+恒定
–
hu igg4p):evtlkesgpa lvkptqtltl tctfsgfslt tygmgvgwir qppgkalewl aniwwdddky ynpslknrlt iskdtsknqv vltmtnmdpv dtatyycari gpikyptapy ryfdfwgqgt mvtvssastk gpsvfplapc srstsestaa lgclvkdyfp epvtvswnsg altsgvhtfp avlqssglys lssvvtvpss slgtktytcn vdhkpsntkv dkrveskygp pcppcpapef lggpsvflfp pkpkdtlmis rtpevtcvvv dvsqedpevq fnwyvdgvev hnaktkpree qfnstyrvvs vltvlhqdwl ngkeykckvs nkglpssiek tiskakgqpr epqvytlpps qeemtknqvs ltclvkgfyp sdiavewesn gqpennyktt ppvldsdgsf flysrltvdk srwqegnvfs csvmhealhn hytqkslslslgk(seq id no:27)
[0100]
969 gh2重链(v+恒定
–
hu igg4p,外显子加下划线):
[0101][0101][0102]
969 gh2重链(v+恒定
–
hu igg4p),信号序列加下划线且为斜体:
[0103]
969 gh2重链(v+恒定
–
hu igg4p,外显子加下划线),信号序列加下划线且为斜体:
[0104]
[0105]
人vk12-1-(1)o12jk4受体框架:diqmtqspsslsasvgdrvtitcrasqsissylnwyqqkpgkapklliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyycqqsystpltfgggtkveik(seqidno:31)
[0106]
人vk12-1-(1)o12jk4受体框架:gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcaccatcacttgccgggcaagtcagagcattagcagctatttaaattggtatcagcagaaaccagggaaagcccctaagctcctgatctatgctgcatccagtttgcaaagtggggtcccatcaaggttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaagattttgcaacttactactgtcaacagagttacagtacccctctcactttcggcggagggaccaaggtggagatcaaa(seqidno:32)
[0107]
人vh23-12-70jh3受体框架:qvtlkesgpalvkptqtltltctfsgfslstsgmrvswirqppgkalewlaridwdddkfystslktrltiskdtsknqvvltmtnmdpvdtatyycariafdiwgqgtmvtvs(seqidno:33)
[0108]
人vh23-12-70jh3受体框架:caggtcaccttgaaggagtctggtcctgcgctggtgaaacccacacagaccctcacactgacctgcaccttctctgggttctcactcagcactagtggaatgcgtgtgagctggatccgtcagcccccagggaaggccctggagtggcttgcacgcattgattgggatgatgataaattctacagcacatctctgaagaccaggctcaccatctccaaggacacctccaaaaaccaggtggtccttacaatgaccaacatggaccctgtggacacagccacgtattactgtgcacggatagcttttgatatctggggccaagggacaatggtcaccgtctct(seqidno:34)
[0109]
csf-1r的氨基酸序列:mgpgvlllllvatawhgqgipviepsvpelvvkpgatvtlrcvgngsvewdgppsphwtlysdgsssilstnnatfqntgtyrctepgdplggsaaihlyvkdparpwnvlaqevvvfedqdallpclltdpvleagvslvrvrgrplmrhtnysfspwhgftihrakfiqsqdyqcsalmggrkvmsisirlkvqkvipgppaltlvpaelvrirgeaaqivcsassvdvnfdvflqhnntklaipqqsdfhnnryqkvltlnldqvdfqhagnyscvasnvqgkhstsmffrvvesaylnlsseqnliqevtvgeglnlkvmveaypglqgfnwtylgpfsdhqpepklanattkdtyrhtftlslprlkpseagrysflarnpggwraltfeltlryppevsviwtfingsgtllcaasgypqpnvtwlqcsghtdrcdeaqvlqvwddpypevlsqepfhkvtvqslltvetlehnqtyecrahnsvgsgswafipisagahthppdeflftpvvvacmsimallllllllllykykqkpkyqvrwkiiesyegnsytfidptqlpynekwefprnnlqfgktlgagafgkvveatafglgkedavlkvavkmlkstahadekealmselkimshlgqhenivnllgacthggpvlviteyccygdllnflrrkaeamlgpslspgqdpeggvdyknihlekkyvrrdsgfssqgvdtyvemrpvstssndsfseq
dldkedgrpl elrdllhfss qvaqgmafla skncihrdva arnvlltngh vakigdfgla rdimndsnyi vkgnarlpvk wmapesifdc vytvqsdvws ygillweifs lglnpypgil vnskfyklvk dgyqmaqpaf apkniysimq acwalepthr ptfqqicsfl qeqaqedrre rdytnlpsss rsggsgssss eleeessseh ltcceqgdia qpllqpnnyq fc(seq id no:35)
[0110]
csf-1r的氨基酸序列:mrhtnysfspwhgftihrakfiqsqdyqcsalmggrkvmsisirlkvqk(seq id no:36)
[0111]
csf-1r的氨基酸序列:(snp v32g,a245s,h247p,v279m,位置加下划线)ipviepsvpelvvkpgatvtlrcvgngsvewdgppsphwtlysdgsssilstnnatfqntgtyrctepgdplggsaaihlyvkdparpwnvlaqevvvfedqdallpclltdpvleagvslvrvrgrplmrhtnysfspwhgftihrakfiqsqdyqcsalmggrkvmsisirlkvqkvipgppaltlvpaelvrirgeaaqivcsassvdvnfdvflqhnntklaihqqsdfhnnryqkvltlnldqvdfqhagnyscvasnvqgkhstsmffrvvesaylnlsseqnliqevtvgeglnlkvmveaypglqgfnwtylgpfsdhqpepklanattkdtyrhtftlslprlkpseagrysflarnpggwraltfeltlryppevsviwtfingsgtllcaasgypqpnvtwlqcsghtdrcdeaqvlqvwddpypevlsqepfhkvtvqslltvetlehnqtyecrahnsvgsgswafipisagahthppde(seq id no:37)
[0112]
mgpgvlllll vatawhgqgi pviepsvpel vvkpgatvtl rcvgngsvew dgppsphwtl ysdgsssils tnnatfqntg tyrctepgdp lggsaaihly vkdparpwnv laqevvvfed qdallpcllt dpvleagvsl vrvrgrplmr htnysfspwh gftihrakfi qsqdyqcsal mggrkvmsis irlkvqkvip gppaltlvpa elvrirgeaa qivcsassvd vnfdvflqhn ntklaipqqs dfhnnryqkv ltlnldqvdf qhagnyscva snvqgkhsts mffrvvesay lnlsseqnli qevtvgegln lkvmveaypg lqgfnwtylg pfsdhqpepk lanattkdty rhtftlslpr lkpseagrys flarnpggwr altfeltlry ppevsviwtf ingsgtllca asgypqpnvt wlqcsghtdr cdeaqvlqvw ddpypevlsq epfhkvtvqs lltvetlehn qtyecrahns vgsgswafip isagahthpp de(seq id no:38)
[0113]
csf-1r
[0114]
如本文所用,术语“集落刺激因子-1受体”或“csf1r”是指充当csf1和白细胞介素34(il34)的细胞表面受体并在造血前体细胞尤其是单核吞噬细胞例如巨噬细胞和单核细胞的存活、增殖和分化的调节中起重要作用的酪氨酸蛋白激酶。它促进响应il34和csf1的促炎趋化因子的释放,从而在先天免疫和炎症过程中发挥重要作用。csf1r还在破骨细胞增殖和分化的调节、骨吸收的调节中发挥重要作用,并且是正常骨骼和牙齿发育所必需的。正常男性和女性的生育能力以及怀孕期间乳腺中乳管和腺泡结构的正常发育都需要csf1r。它还促进肌动蛋白细胞骨架的重组,调节膜褶皱的形成、细胞粘附和细胞迁移,并促进细胞侵袭。
[0115]
csf1是一种控制巨噬细胞的产生、分化和功能的细胞因子,csf1r介导这种细胞因子的大部分(如果不是全部)生物学效应。
[0116]
如本文所用,术语“ab969.g2”是指特异性结合csf1-r的抗体,并且包含(a)包含分别如seq id no:1、seq id no:2和seq id no:3所定义的cdr1、cdr2和cdr3的轻链,和(b)包含分别如seq id no:4、seq id no:5和seq id no:6所定义的cdr1、cdr2和cdr3的重链。该ab969.g2抗体先前已在pct/ep2014/068050中描述。
[0117]
术语“特异性结合csf1r”、“特异性结合至csf1r”和如本文所用的等同物在提及抗体时是指抗体将以足够的亲和力和特异性结合csf1r以实现生物学上有意义的效果。选择
的抗体通常对csf1r具有结合亲和力,例如,该抗体可以以100nm至1pm的kd值结合csf1r。抗体亲和力可以通过基于表面等离子共振的测定,例如biacore测定;酶联免疫吸附测定(elisa);和例如,竞争测定(例如ria的)来确定。在本发明的含义内,特异性结合csf1r的抗体也可以结合另一分子;例如作为非限制性实例在双特异性抗体的情况下。
[0118]
制剂和治疗方法
[0119]
本文公开的任何抗体(例如,抗csf-1r抗体或抗csf-1抗体)可用于本公开内容的方法、试剂盒或组合物。
[0120]
在一些实施方案中,本公开内容的药物组合物包含抗csf-1r抗体或抗csf-1抗体或其抗原结合片段或csf-1r活性抑制剂和药学上可接受的承载体。
[0121]
在某些实施方案中,本文所述的组合用于治疗皮肤病况。在一些实施方案中,该方法涉及使用抗csf-1r抗体或其结合片段用于治疗系统性硬皮病、全身性硬皮病、局部性硬皮病、局限性硬皮病、线状硬皮病、crest综合征、弥漫性硬皮病、限制性硬皮病(circumscribed morphea)、钙质沉着症、雷诺现象、食管运动障碍、指硬皮病、毛细血管扩张症、sine硬化症和/或弥漫性硬皮病。
[0122]
在一些实施方案中,该方法涉及使用抗csf-1r抗体或其结合片段用于治疗急性移植物抗宿主病(agvhd)。在一些实施方案中,该方法涉及使用抗csf-1r抗体或其结合片段用于治疗慢性移植物抗宿主病(cgvhd)。
[0123]
在一些实施方案中,治疗被鉴定为患有cgvhd的人患者的方法包括确定患者中经典单核细胞的初始水平。在一些实施方案中,治疗被鉴定为患有cgvhd的人患者的方法包括确定患者中经典单核细胞的初始水平,然后施用有效剂量的艾克利单抗或抗csf-1r抗体;并在随后的时间段内确定经典单核细胞的第二水平。在一些实施方案中,治疗被鉴定为患有cgvhd的人患者的方法包括确定患者中经典单核细胞的初始水平,然后施用有效剂量的艾克利单抗或抗csf-1r抗体;并在随后的时间段内确定经典单核细胞的第二水平,和如果经典单核细胞的第二水平大于预定百分比,则继续用艾克利单抗或抗csf-1r抗体治疗。在一些实施方案中,治疗被鉴定为患有cgvhd的人患者的方法包括确定患者中经典单核细胞的初始水平,然后施用有效剂量的艾克利单抗或抗csf-1r抗体;并在随后的时间段中确定经典单核细胞的第二水平,和如果初始经典单核细胞水平与第二经典单核细胞水平之间的比率大于预定百分比,则继续用艾克利单抗或抗csf-1r抗体治疗。在一些实施方案中,本技术涉及治疗cgvhd的方法,包括用治疗有效量的艾克利单抗治疗有需要的患者,其中艾克利单抗靶向致病性单核细胞衍生的巨噬细胞。在一些实施方案中,本技术涉及治疗cgvhd的方法,该方法包括用治疗有效量的艾克利单抗治疗有需要的患者,其中艾克利单抗靶向致病性单核细胞衍生的巨噬细胞并且最低限度地影响非经典单核细胞。在一些实施方案中,本技术涉及治疗cgvhd的方法,该方法包括用治疗有效量的艾克利单抗治疗有需要的患者,其中艾克利单抗靶向致病性单核细胞衍生的巨噬细胞并且最低限度地影响中间单核细胞。
[0124]
一种治疗人中移植物抗宿主病(gvhd)的方法,包括向有需要的人施用艾克利单抗或抗csf-1r抗体,其中该抗体以由循环经典单核细胞的水平确定的剂量施用。一种治疗人中移植物抗宿主病(gvhd)的方法,包括向有需要的人施用艾克利单抗或抗csf-1r抗体,其中所述抗体以由循环中间单核细胞的水平确定的剂量施用。一种治疗人移植物抗宿主病(gvhd)的方法,包括向有需要的人施用艾克利单抗或抗csf-1r抗体,其中该抗体以由循环
非经典单核细胞的水平确定的剂量施用。
[0125]
术语“治疗”、“医治”和“医疗”旨在包括减轻或消除病症、疾病或病况;或与病症、疾病或病况相关的一种或多种症状;或减轻或根除病症、疾病或病况本身的原因。如本文所用,“预防”或“防止”描述减少或消除疾病、病况或病症的症状或并发症的发作。
[0126]
如本文所用,术语“减轻”意在描述降低病症的体征或症状的严重程度的过程。重要的是,体征或症状可以在不被消除的情况下得到缓解。在一个优选的实施方案中,本文公开的药物组合物的施用导致体征或症状的消除,然而,消除不是必需的。预计有效剂量会降低体征或症状的严重程度。例如,如果cgvhd的严重程度在多个位置中的至少一个内降低,则可在多个位置发生的病症诸如cgvhd的体征或症状得到缓解。
[0127]
治疗本文列出的病况可导致预防本文所述病况(包括慢性移植物抗宿主病(cgvhd))的发生或降低cgvhd的严重程度。症状的减轻也可以称为“消退”。优选地,治疗后,严重程度相对于治疗前降低5%或更多;更优选地,严重程度降低10%或更多;更优选地,降低20%或更多;更优选地,降低30%或更多;更优选地,降低40%或更多;甚至更优选地,降低50%或更多;最优选地,降低超过75%或更多。严重程度可以通过任何可重复的测量方法来测量。严重程度可以测量为感兴趣区域的直径或根据各种医师量表测量。
[0128]“药物组合物”或“治疗组合物”是含有适合用于施用至受试者的形式的活性成分(例如本文公开的抗csf-1r抗体或抗csf-1抗体或其抗原结合片段或csf-1r活性抑制剂)的制剂。在一些实施方案中,药物组合物是散装或单位剂型。单位剂型是多种形式中的任一种,包括例如胶囊、iv袋、片剂、气雾剂吸入器上的单泵或小瓶。单位剂量组合物中的活性成分(例如,所公开的化合物或其盐、水合物、溶剂化物或异构体的制剂)的量是有效量并且根据所涉及的具体治疗而变化。本领域技术人员将理解,有时需要根据患者的年龄和病况对剂量进行常规变化。剂量还将取决于施用途径。考虑了多种途径,包括口服、肺部、直肠、肠胃外、透皮、皮下、静脉内、肌肉内、腹膜内、吸入、口腔、舌下、胸膜内、鞘内、鼻内等。本公开内容的化合物的局部或透皮施用的剂型包括粉剂、喷雾剂、软膏剂、糊剂、乳膏剂、洗剂、凝胶剂、溶液剂、贴剂和吸入剂。在一个实施方案中,将活性化合物在无菌条件下与药学上可接受的承载体以及所需的任何防腐剂、缓冲剂或推进剂混合。
[0129]
如本文所用,“活性成分”是指在相关剂量下具有药理作用例如治疗作用的成分。
[0130]“药学上可接受的承载体”是指可用于制备药物组合物的承载体,该药物组合物通常是安全的、无毒的并且在生物学上或其他方面均无不良影响,并且包括可用于兽医用途以及人药物用途的赋形剂。例如,药学上可接受的承载体本身不应诱导产生对接受组合物的个体有害的抗体并且不应是有毒的。合适的承载体可以是大的、缓慢代谢的大分子,例如蛋白质、多肽、脂质体、多糖、聚乳酸、聚乙醇酸、聚合氨基酸、氨基酸共聚物和无活性的病毒颗粒。
[0131]
可以使用药学上可接受的盐,例如无机酸盐,例如盐酸盐、氢溴酸盐、磷酸盐和硫酸盐,或有机酸盐,例如乙酸盐、丙酸盐、丙二酸盐和苯甲酸盐。
[0132]
治疗组合物中的药学上可接受的承载体可以另外包含液体,例如水、盐水、甘油和乙醇。此外,辅助物质,例如润湿剂或乳化剂或ph缓冲物质,可存在于此类组合物中。这样的承载体能够将药物组合物配制成片剂、丸剂、糖衣丸、胶囊、液体、凝胶、糖浆、浆液和悬浮液,以供患者摄取。
[0133]
适合施用的形式包括适合肠胃外施用的形式,例如通过注射或输注,例如通过推注或连续输注。当产品用于注射或输注时,它可以采用油性或水性媒介物中的悬浮液、溶液剂或乳剂的形式,并且它可以包含配方剂,例如悬浮剂、防腐剂、稳定剂和/或分散剂。可替代地,抗体分子可以是干燥形式,用于在使用前用适当的无菌液体重构。
[0134]
一旦配制,本公开内容的组合物可以直接施用至受试者。
[0135]
在某些实施方案中,最终制剂的ph与抗体或片段的等电点(pi)的值不相似,例如如果制剂的ph为7,则8-9或更高的pi可能是适当的。尽管不希望受理论束缚,但认为这最终可提供具有改进稳定性的最终制剂,例如抗体或片段保留在溶液中。
[0136]
在一个实例中,处于4.0至7.0范围内的ph的药物制剂包含:1至200mg/ml的根据本公开内容的抗体、1至100mm的缓冲液、0.001至1%的表面活性剂,a)10至500mm的稳定剂,b)10至500mm的稳定剂和5至500mm的张度剂,或c)5至500mm的张度剂。
[0137]
本公开内容的药物组合物可以通过任何数量的途径施用,包括但不限于口服、静脉内、肌肉内、动脉内、髓内、鞘内、心室内、透皮、经皮(例如,参见wo98/20734),皮下、腹膜内、鼻内、肠内、局部、舌下、阴道内或直肠途径。无痛皮下喷射器(hypospray)也可用于施用本公开内容的药物组合物。通常,治疗组合物可以制备为可注射剂,作为液体溶液或悬浮液。也可以制备适合在注射前溶解或悬浮在液体媒介物中的固体形式。
[0138]
组合物的直接递送通常通过皮下、腹膜内、静脉内或肌内注射来实现,或递送至组织的间质空间。也可以将组合物施用到病灶中。剂量治疗可以是单剂量方案或多剂量方案。
[0139]
应当理解,组合物中的活性成分将是抗体分子。因此,它很容易在胃肠道中降解。因此,如果组合物要通过使用胃肠道的途径施用,则组合物将需要包含保护抗体免于降解但一旦抗体从胃肠道吸收就释放抗体的试剂。
[0140]
remington's pharmaceutical sciences(mack publishing company,n.j.1991)中对药学上可接受的承载体进行了详尽的讨论。
[0141]
在一个实施方案中,该制剂被提供为用于包括吸入的局部施用的制剂。
[0142]
合适的可吸入制剂包括可吸入粉剂、含有推进气体的计量气雾剂或不含推进气体的可吸入溶液。根据本公开内容的含有活性物质的可吸入粉剂可以仅由上述活性物质或上述活性物质与生理学上可接受的赋形剂的混合物组成。
[0143]
这些可吸入粉剂可以包括单糖(例如葡萄糖或阿拉伯糖)、二糖(例如乳糖、蔗糖和麦芽糖)、寡糖和多糖(例如葡聚糖)、多元醇(例如山梨糖醇、甘露糖醇和木糖醇)、盐(例如氯化钠、碳酸钙)或它们彼此的混合物。适合使用单糖或二糖,使用乳糖或葡萄糖,特别是但不限于它们的水合物形式。
[0144]
用于沉积在肺中的颗粒需要小于10微米的颗粒尺寸,例如1-9微米,例如0.1至5μm,特别是1至5μm。活性成分(例如抗体或片段)的粒径是最重要的。
[0145]
可用于制备可吸入气雾剂的推进气体是本领域已知的。合适的推进气体选自烃例如正丙烷、正丁烷或异丁烷和卤代烃例如甲烷、乙烷、丙烷、丁烷、环丙烷或环丁烷的氯化和/或氟化衍生物。上述推进气体可以单独使用或以其混合物使用。
[0146]
特别合适的推进气体是选自tg 11、tg 12、tg 134a和tg 227的卤代烷烃衍生物。在上述卤代烃中,tg134a(1,1,1,2-四氟乙烷)和tg227(1,1,1,2,3,3,3-七氟丙烷)及其混合物是特别合适的。
[0147]
含推进气体的可吸入气雾剂还可以包含其他成分,例如助溶剂、稳定剂、表面活性剂(surfactant)、抗氧化剂、润滑剂和用于调节ph的工具。所有这些成分都是本领域已知的。根据本公开内容的含推进气体的可吸入气雾剂可含有多至5重量%的活性物质。根据本公开内容的气雾剂含有例如0.002至5重量%、0.01至3重量%、0.015至2重量%、0.1至2重量%、0.5至2重量%或0.5至1重量%的活性成分。
[0148]
可替代地,向肺局部施用也可以通过液体溶液或悬浮液制剂的施用,例如使用装置诸如雾化器,例如连接到压缩机的雾化器(例如,连接到由pari respiratory equipment,inc.,richmond,va.制造的pari master(r)压缩机的pari lc-jet plus(r)雾化器)。
[0149]
本公开内容的抗体可以分散在溶剂中递送,例如以溶液或悬浮液的形式。它可以悬浮在适当的生理溶液例如盐水或其他药理学上可接受的溶剂或缓冲溶液中。本领域已知的缓冲溶液每1ml水可含有0.05mg至0.15mg依地酸二钠、8.0mg至9.0mg nacl、0.15mg至0.25mg聚山梨醇酯、0.25mg至0.30mg无水柠檬酸和0.45mg至0.55mg柠檬酸钠以达到约4.0至5.0的ph。悬浮液可以使用例如冻干抗体。
[0150]
治疗性悬浮液或溶液制剂也可以包含一种或多种赋形剂。赋形剂是本领域熟知的并且包括缓冲液(例如柠檬酸盐缓冲液、磷酸盐缓冲液、乙酸盐缓冲液和碳酸氢盐缓冲液)、氨基酸、尿素、醇、抗坏血酸、磷脂、蛋白质(例如血清白蛋白)、edta、氯化钠、脂质体、甘露醇、山梨醇和甘油。溶液或悬浮液可以封装在脂质体或可生物降解的微球中。制剂通常将采用无菌制造工艺以基本上无菌的形式提供。
[0151]
这可以包括通过过滤用于制剂的缓冲溶剂/溶液的生产和灭菌,在无菌缓冲溶剂溶液中无菌悬浮抗体,以及通过本领域普通技术人员熟悉的方法将制剂分配到无菌容器中。
[0152]
根据本公开内容的可雾化制剂可以例如以包装在箔封套中的单剂量单位(例如,密封的塑料容器或小瓶)的形式提供。每个小瓶包含在一定体积(例如2ml)的溶剂/溶液缓冲液中的单位剂量。
[0153]
本文公开的抗体可能适合通过雾化递送。
[0154]
还设想本公开内容的抗体可以通过使用基因疗法来施用。为了实现这一点,将在合适的dna组分的控制下编码抗体分子的重链和轻链的dna序列引入患者,使得抗体链从dna序列表达并原位组装。
[0155]
药物组合物合适地包含治疗有效量的抗csf-1r抗体或抗csf-1抗体或其抗原结合片段或csf-1r活性抑制剂。如本文所用,术语“治疗有效量”是指治疗、改善或预防靶向的疾病或病况或表现出可检测的治疗、药理学或预防效果所需的治疗剂的量。例如,对于本文所公开的任何抗体,治疗有效量可以最初在细胞培养测定(例如肿瘤细胞的)中或在动物模型(通常是大鼠、小鼠、兔、狗、猪或灵长类动物)中估计。动物模型也可用于确定合适的浓度范围和施用途径。然后可以使用此类信息来确定用于人施用的有用剂量和途径。
[0156]
治疗/预防功效和毒性可以通过细胞培养物或实验动物中的标准药学程序来确定,例如,ed
50
(对50%的群体治疗有效的剂量)和ld
50
(对50%的群体致死的剂量)。毒性与治疗作用的剂量比是治疗指数,其可表示为比率,ld
50
/ed
50
。优选的是表现出大治疗指数的药物组合物。剂量可以在这个范围内变化,这取决于所使用的剂型、患者的敏感性和施用途
径。
[0157]
调整剂量和施用以提供足够水平的活性剂或维持所需效果。可以考虑的因素包括疾病状态的严重程度、受试者的一般健康状况、受试者的年龄、体重和性别、饮食、施用时间和频率、药物相互作用、反应敏感性和耐受性/对治疗的反应。一般而言,剂量应足以减缓和优选降低病况的严重程度。剂量范围可以是每天约0.01mg/kg到每天约10mg/kg。在一些实施方案中,剂量可以在约0.1mg/kg、0.5mg/kg、1mg/kg、1.5mg/kg或3mg/kg的范围内变化。在一些实施方案中,剂量将在约0.1mg/天至约5mg/kg的范围内。药物组合物可以方便地以单位剂量形式存在,其每剂量含有预定量的本公开内容的活性剂。
[0158]
根据本公开内容的抗体(例如,抗csf-1r抗体或抗csf-1抗体)的治疗剂量在体内没有显示出明显或有限的毒理学作用。
[0159]
在某些实施方案中,每天、隔天、每周、每2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周、16周、17周、18周、19周或每20周或每月施用艾克利单抗或抗csf-1r抗体。
[0160]
术语“抗体”根据其在本领域中的公知含义使用。本公开内容的抗体分子可以包括具有全长重链和轻链的完整抗体分子或其结合片段,并且可以是但不限于fab、修饰的fab、fab’、修饰的fab’、f(ab’)2、fv、单结构域抗体(例如vh或vl或vhh)、scfv、双价、三价或四价抗体、bis-scfv、双抗体、三抗体、四抗体和上述任何抗体的表位结合片段(参见例如holliger和hudson,2005,nature biotech.23(9):1126-1136;adair和lawson,2005,drug design reviews-online 2(3),209-217)。产生和制造这些抗体片段的方法在本领域中是众所周知的(参见例如verma等人,1998,journal of immunological methods,216:165-181)。用于本公开内容的其他抗体片段包括在国际专利申请wo05/003169、wo05/003170和wo05/003171中描述的fab和fab’片段。多价抗体可以包含多种特异性,例如双特异性或可以是单特异性的(参见例如wo92/22853、wo05/113605、wo2009/040562和wo2010/035012)。
[0161]
如本文所用的抗体的结合片段是指能够以将该片段表征为对抗原特异的亲和力结合抗原的片段。
[0162]
在一个实施方案中,根据本公开内容的抗体作为csf-1r结合抗体融合蛋白提供,其包含免疫球蛋白部分,例如fab或fab’片段,和直接或间接与其连接的一个或两个单结构域抗体(dab),例如如在wo2009/040562、wo2010/035012、wo2011/030107、wo2011/061492和wo2011/086091中描述的,其均通过引用并入本文。
[0163]
在一些实施方案中,融合蛋白包含双结构域抗体,例如作为可变重链(vh)和可变轻链(vl)配对,任选地通过二硫键连接。在一些实施方案中,融合蛋白的fab或fab’元件与一个或多个单结构域抗体具有相同或相似的特异性。在一个实施方案中,fab或fab’与一个或多个单结构域抗体具有不同的特异性,也就是说融合蛋白是多价的。在一个实施方案中,根据本公开内容的多价融合蛋白具有白蛋白结合位点,例如其中的vh/vl对提供白蛋白结合位点。
[0164]
本公开内容的抗体分子的恒定区结构域(如果存在的话)可以根据抗体分子的提出的功能和特别是可能需要的效应子功能来选择。例如,恒定区结构域可以是人iga、igd、ige、igg或igm结构域。特别地,当抗体分子旨在用于治疗用途并且需要抗体效应子功能时,可以使用人igg恒定区结构域,尤其是igg1和igg3同种型。可替代地,当抗体分子用于治疗
目的并且不需要抗体效应子功能时,可以使用igg2和igg4同种型。
[0165]
本领域技术人员还将理解,抗体可以经历多种翻译后修饰。这些修饰的类型和程度通常取决于用于表达抗体的宿主细胞系以及培养条件。此类修饰可包括糖基化、甲硫氨酸氧化、二酮哌嗪形成、天冬氨酸异构化和天冬酰胺脱酰胺的变化。一种常见的修饰是由于羧肽酶的作用,羧基末端碱性残基(例如赖氨酸或精氨酸)的丢失(如harris,rj.journal of chromatography 705:129-134,1995中所述)。因此,抗体重链的c端赖氨酸可能不存在。
[0166]
如本文所用,术语“人源化抗体”是指抗体或抗体分子,其中重链和/或轻链含有移植到接受者抗体(例如人抗体)的重链和/或轻链可变区框架中的来自供体抗体(例如鼠单克隆抗体)的一个或多个cdr(如果需要,包括一个或多个修饰的cdr)(参见例如us5,585,089;wo91/09967)。对于综述,参见vaughan等人,nature biotechnology,16,535-539,1998。在一个实施方案中,不是转移整个cdr,而是将来自上文描述的任何一种cdr的仅一个或多个特异性决定残基转移到人抗体框架中(参见例如,kashmiri等人,2005,methods,36:25-34)。在一个实施方案中,仅将来自上文所述的一种或多种cdr的特异性决定残基转移至人抗体框架。在另一个实施方案中,仅将来自上文所述的每个cdr的特异性决定残基转移到人抗体框架中。当cdr或特异性决定残基被移植时,考虑到cdr所来源的供体抗体的类别/类型,可以使用任何合适的受体可变区框架序列,包括小鼠、灵长类动物和人框架区。
[0167]
如本文所用,应用于一个或多个感兴趣的值的术语“约”和“大约”是指与所述的参考值相似的值。在某些实施方案中,术语“约”或“大约”是指在任一方向上(大于或小于)落入所述的参考值的25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更少之内的值的范围,除非另有说明或从上下文中可以明显看出(除了该数字将超过可能的值的100%的情况外)。例如,当在纳米颗粒组合物的脂质组分中的给定化合物的量的上下文中使用时,“约”可以表示所述值的+/-10%。
[0168]
权利要求和说明书中使用的冠词,例如“一个”、“一种”和“该”,可以表示一个或多于一个,除非有相反指示或从上下文中明显看出。如果组成员的一个、多于一个或所有存在于给定产品或过程中、在给定产品或过程中使用或以其他方式与给定产品或过程相关,则认为满足了在组的一个或多个成员之间包含“或”的权利要求或描述,除非有相反指示或从上下文中明显看出。本公开内容包括其中组中的恰好一个成员存在于给定产品或过程中、在给定产品或过程中使用或以其他方式与给定产品或过程相关的实施方案。本公开内容包括其中组成员的多于一个或所有存在于给定产品或过程中、在给定产品或过程中使用或以其他方式与给定产品或过程相关的实施方案。
[0169]“治疗”或“医治”是一种用于获得有益或期望结果包括临床结果的方法。有益或期望的临床结果可以包括以下一项或多项:减少由疾病引起的一种或多种症状;(ii)减少疾病程度和/或稳定疾病(例如,延缓疾病的恶化);(iii)延缓疾病的传播;(iv)延缓或减缓疾病的发作或复发和/或疾病的进展;(v)改善疾病状态和/或提供疾病的缓解(无论是部分还是全部)和/或减少治疗疾病所需的一种或多种其他药物的剂量;(vi)提高生活质量,和/或(vii)延长生存期。
[0170]“延迟”疾病或病况的发展是指推迟、阻碍、减缓、延缓、稳定和/或延期疾病或病况的发展。这种延迟可以是不同的时间长度,这取决于疾病或病况的历史和/或被治疗的受试者。“延迟”疾病或病况的发展的方法是与不使用该方法相比,在给定时间范围内降低疾病
或病况发展的概率和/或在给定时间范围内降低疾病或病况的程度的方法。这种比较通常基于临床研究,使用统计学上显著数量的受试者。可以使用标准方法检测疾病或病况的发展,例如常规身体检查、乳房x线照相术、成像或活组织检查。发展也可以指最初可能无法检测到的疾病或病况进展,并且包括发生、复发和发作。
[0171]
还应注意,术语“包括”旨在是开放的并且允许但不要求包括额外的元件或步骤。当本文使用术语“包括”时,术语“基本上由
……
组成”和“由
……
组成”因此也被涵盖和公开。在整个说明书中,在组合物或组合被描述为具有、包括或包含特定组分或步骤的情况下,预期组合物或组合也基本上由所述组分组成或由所述组分组成。类似地,在方法或过程被描述为具有、包括或包含特定过程步骤的情况下,该过程也基本上由所述的处理步骤组成或由所述的处理步骤组成。此外,应该理解,步骤的顺序或执行某些动作的顺序是无关紧要的,只要本发明保持可操作。此外,可以同时进行两个或更多个步骤或动作。
[0172]
在给出范围的地方,包括端点。此外,应理解,除非另有说明或从上下文和本领域普通技术人员的理解中明显看出,表示为范围的值可以具有在公开内容的不同实施方案中所述的范围内的任何特定值或子范围,达到范围的下限的单位的十分之一,除非上下文另有明确说明。
[0173]
在技术上适当的情况下,可以组合本发明的实施方案。本文具体和明确列举的任何实施方案可以单独或与一个或多个进一步的实施方案组合形成免责声明的基础。
[0174]
本文引用的所有出版物和专利文件都通过引用并入本文,就好像每个这样的出版物或文件被具体地和单独地指示通过引用并入本文一样。对出版物和专利文件的引用并不意味着承认任何是相关的现有技术,也不构成对其内容或日期的任何承认。
实施例
[0175]
包括以下实施例以说明本发明的实施方案。本领域技术人员将理解,在不脱离本发明的精神和范围的情况下,可以对本文描述的特定实施方案进行改变并且仍然获得类似的结果。
[0176]
实施例1:艾克利单抗在cgvhd的治疗中的安全性和功效
[0177]
临床试验评估了抗csf-1r(ab535;艾克利单抗)在多达30名已接受至少两种先前治疗线的慢性移植物抗宿主病(cgvhd)患者中的安全性和初步功效。所有接受测试的患者均接受过依鲁替尼、类固醇和钙调神经磷酸酶抑制剂的先前治疗,已纳入三个剂量组:一名患者每两周接受0.15mg/kg治疗(q2w,队列1),一名患者接受0.5mg/kg q2w的剂量(队列2),和三名患者接受1.0mg/kg q2w(队列3)。
[0178]
截至数据截止日期,所有可评估患者均观察到反应,未报告剂量限制毒性(dlt)。在队列3(1mg/kg q2w)中给药的三名患者中,一名患者最近清除了dlt期,两名患者经历了部分反应,并且所有三名患者仍在接受治疗。在接受使用依鲁替尼和(鲁索替尼)和kd025两者(两个目前正在研究用于治疗cgvhd的药物)的先前治疗后,队列2中的患者经历部分反应并且目前正处于接受抗csf-1r抗体或其抗原结合片段治疗的第9个月。第一名患者(队列1)实现了短暂的部分反应,但随后由于归因于其肝脏cgvhd的进展的升高的肝功能测试(lft)而停止治疗。将探索3mg/kg q2w剂量的队列4现已开放注册。
[0179]
数据表明,csf-1r阻断可以预防和治疗cgvhd动物模型中的疾病。初步数据提供了
第一个临床证据,表明靶向csf-1r依赖性巨噬细胞可能使cgvhd患者受益。迄今为止,抗csf-1r抗体或其抗原结合片段是安全且耐受良好的,未观察到剂量限制性毒性。在试验的第1阶段部分正在进行剂量递增。优选的初始给药方案是每两周施用1mg/kg的艾克利单抗抗csf-1r抗体或其抗原结合片段。
[0180]
该试验的初步结果强调了抗csf-1r抗体或其抗原结合片段用作需要有效的替代品的cgvhd患者的有效疗法的潜力。看到患有这种难以治疗的疾病的患者中活性的早期迹象是非常令人鼓舞的。其他患者以1mg/kg和3mg/kg进行评估。
[0181]
实施例2.csf-1r人源化抗体艾克利单抗(sndx-6352)用于2线或更多线全身治疗后的慢性移植物抗宿主病的研究
[0182]
慢性移植物抗宿主病(cgvhd)是同种异体造血细胞移植后发病率和晚期非复发死亡率的主要原因,并且通常与长期免疫抑制有关。对类固醇反应不足的患者(pts)几乎没有有效的治疗选择,并且代表了未满足的医疗需求。可用的疗法与显著的毒性、免疫抑制和感染风险增加有关。临床前研究表明,csf-1/csf-1r是参与介导cgvhd的供体来源的巨噬细胞的扩增和浸润的关键调节途径。艾克利单抗(axa)是对csf-1r具有高亲和力的人源化全长igg4抗体。不受任何理论束缚,艾克利单抗通过与csf-1r结合并通过其两种已知配体csf-1和il34阻断其活化来影响单核细胞和巨噬细胞的迁移、增殖、分化和存活。它提供了用于治疗这些患者的新的治疗选择。
[0183]
方法:1/2期剂量递增和剂量扩展研究评估了艾克利单抗在》6岁的患有活动性症状性cgvhd的患者中的安全性、耐受性、药代动力学(pk)/药效学(pd)和功效,尽管先前的≥2条线的治疗。第一阶段的终点是安全性、耐受性、pk和pd,主要目标是确定最佳生物剂量;第二阶段研究的主要终点是6个月的总体反应率(cr+pr)。患者以28天的周期给药。
[0184]
结果:12名患者已参加1期研究。入组时的中位年龄为58岁(范围为29-73岁),8名患者为男性。患者在中位数为5个先前治疗线(范围4-9)中失败。剂量包括0.15mg/kg(n=1)、0.5mg/kg(n=1)、1mg/kg(n=3)、每2周(q2w)3mg/kg(n=6)和3mg/kg q4w(n=1)。其中,5pts(42%)仍在接受艾克利单抗治疗。所有患者的中位周期数为5(范围1-12)。在开始剂量为3mg/kg q2w且仍在研究中的3名患者中,有2名患者减少了剂量;1名减少至2mg/kg q4w和1名减少至1mg/kg q2w。七名患者(58%)因以下原因停药:不良事件(3mg/kg q2w,n=2);因创伤性跌倒而死亡(1mg/kg q2w,n=1);研究者决定(0.5mg/kg q2w,n=1);进行性cgvhd(1和0.15mg/kg q2w,每个n=1);和不依从性(3mg/kg q2w,n=1)。
[0185]
处于3mg/kg q2w的剂量下的6名患者中有2名(17%)报告了治疗紧急不良事件,被认为是剂量限制性毒性(dlt):1名具有ctcae 4级肌酸激酶增加,在第1个剂量后出现肌炎症状,第2个剂量出现淀粉酶/脂肪酶升高,导致第3个剂量延迟》2周。后一名患者以1mg/kg q2w重新开始治疗,并在5个周期后继续治疗。
[0186]
4名患者(1名0.15mg/kg和3名3mg/kg q2w,33%)具有≥3级的相关治疗紧急不良事件:天冬氨酸氨基转移酶升高(n=2);肌酸磷酸激酶增加(n=2);和γ-谷氨酰转移酶增加(n=2)。这种生化升高可能是与axa的作用机制一致并且当无症状不与肝炎、胰腺炎或横纹肌溶解症的临床表现相关时,对kupffer细胞的csf-1r阻断导致这些酶的清除受到抑制的结果。眶周水肿在2名患者中被观察到(≤2级);没有观察到额外的csf-1ri类别效应相关的teae。
[0187]
根据2014nih cgvhd共识标准定义的临床反应已在所有剂量水平下的7名患者(58%)中观察到;中位反应时间为12周。在食道(n=1/1)、眼睛(n=3/10)、关节/筋膜(n=5/9)、嘴(n=1/7)和皮肤(n=3/8)中观察到器官特异性反应。应答者接受的先前治疗包括依鲁替尼(6名患者)、鲁索替尼(5名患者)和kd025(3名患者);3名有反应的患者接受了所有这些。六名患者(50%)报告了lee症状评分的至少7分的改善。初步的pk曲线和药效学终点(包括循环cd14
+
cd16
+
非经典和cd14
++
cd16
+
中间单核细胞动力学)与在健康志愿者和患者中观察到的一致。
[0188]
结论:这些数据表明,艾克利单抗具有临床活性,具有可接受的安全性特征谱和在活动性cgvhd患者中观察到的反应。该研究正在3mg/kg q4w下进行和2期研究在1mg/kg q2w的剂量下进行。
[0189]
实施例3:艾克利单抗(ab535)的临床试验
[0190]
虽然对cgvhd的病理生理学认识正在兴起,但对cgvhd患者的治疗几乎没有有意义的发展。目前,仍然存在对于强的松作为治疗的主要支柱的长期依赖。类固醇施用可以缓解症状并延缓疾病进展;然而,这种方法与显著的毒性和耐药性的出现有关(flowers和martin2015,macdonald 2017)。尽管缺乏临床证据支持这些药物与皮质类固醇联合后的额外疗效,但减少皮质类固醇剂量的努力已导致它们与其他免疫抑制剂(例如环孢菌素、他克莫司和西罗莫司)在一线或二线背景下联合使用(miklos 2017)。大约50%至60%的cgvhd患者在初始全身治疗后2年内需要二次治疗。尽管在药物的最佳选择方面没有达成共识,但它们通常包括利妥昔单抗或伊马替尼(flowers和martin2015)。2017年,btk抑制剂(依鲁替尼)成为用于该疗法的首个fda批准的疗法。依鲁替尼的副作用是显著的,在cgvhd患者中依鲁替尼的关键评估中,38%的患者因不良事件停药,31%的患者减少剂量。此外,由于参与临床开发计划的患者的器官系统受累,没有将依鲁替尼给予大部分cgvhd患者。最近对cgvhd的了解导致针对参与疾病相关炎症信号传导途径的激酶(例如btk、jak1/2和syk)的干预措施,其正在评估中。针对这些途径的非临床和患者样品相关研究显示出有希望的结果(macdonald 2017)。艾克利单抗基于其抑制csf-1r的高亲和力具有提供治疗cgvhd的免疫治疗方法的潜力。它目前正在cgvhd患者的1/2期研究中进行评估。
[0191]
慢性移植物抗宿主病(cgvhd)仍然是同种异体造血干细胞移植(hsct)后发病率和非复发死亡率的主要原因。cgvhd通常表现为多器官病理,这通常发生在hsct后的第一年,但也可能在hsct后的第一年之后发展(jagasia 2015)。
[0192]
目前cgvhd的治疗基于类固醇施用,尽管通常使用了许多其他方法,包括额外的免疫抑制剂、紫外线b(uvb)光疗和体外光置换术(ecp),但没有一种方法被证明是明显有效的。
[0193]
通过抑制集落刺激因子1受体(csf-1r)阻止其分化和存活来靶向致病性单核细胞衍生的巨噬细胞已被证明在动物系统中非常有效。
[0194]
艾克利单抗是一种针对csf-1r的人源化igg4单克隆抗体(mab),具有通过阻断巨噬细胞活性来治疗cgvhd的潜力。目前在cgvhd患者中进行的艾克利单抗1/2期研究的数据表明,艾克利单抗具有生物学和临床活性,可诱导器官特异性反应和症状改善,没有明显的不良事件。这些数据支持对艾克利单抗的进一步评估。
[0195]
研究纳入标准
[0196]
要获得参与本研究的资格,参与者必须满足以下所有条件:
[0197]
年龄
[0198]
签署知情同意书时,患者必须年满6岁。
[0199]
参与者类型和疾病特征
[0200]
患者是患有需要全身免疫抑制的活动性cgvhd的同种异体hsct接受者。
[0201]
根据2014年nih关于cgvhd临床试验标准的共识发展项目(2014nih consensus development project on criteria for clinical trials in cgvhd)(jagasia 2015),活动性cgvhd被定义为存在cgvhd的体征和症状。
[0202]
在至少2线的全身治疗后患有难治性或复发性活动性cgvhd的患者。
[0203]
患者必须已记录根据nih 2014共识标准定义的进展性疾病(在器官特异性算法或整体评估方面),或医生认为需要新的全身治疗线的活动性、有症状的cgvhd。
[0204]
患者可能有持续的活动性急性和cgvhd表现(重叠综合征),如2014年nih关于cgvhd临床试验标准的共识发展项目所定义。
[0205]
诊断评估
[0206]
karnofsky表现量表≥60(如果年龄在16岁或以上);lansky表现评分≥60(如果年龄《16岁)
[0207]
随机分组前14天内评估的足够器官和骨髓功能如下:
[0208]
中性粒细胞绝对计数≥1.5
×
109/l,进入研究后1周内无生长因子)
[0209]
血小板计数≥50
×
109/l(进入研究后2周内不输血)
[0210]
总胆红素、alt和天冬氨酸氨基转移酶(ast)≤正常上限(uln)
[0211]
对于疑似患有肝脏cgvhd的患者,alt和ast≤3x uln且总胆红素≤uln
[0212]
根据成人患者中的cockcroft-gault公式和儿科患者中的schwartz公式,肌酐清除率(crcl)≥50ml/min/1.73m2。
[0213]
性别
[0214]
男性和/或女性参与者。
[0215]
男性或女性使用避孕药具应符合当地有关参与临床研究的避孕方法的法规。
[0216]
男性患者:未禁欲并打算与有生育能力的女性伴侣发生性行为的未绝育男性患者从筛查开始到整个研究干预治疗期的总持续时间和在最后一剂研究干预后90天内必须使用男性避孕套和杀精剂。然而,周期性禁欲、安全期避孕法和体外射精法不是可接受的避孕方法。男性患者在此期间应避免捐献精子。
[0217]
女性患者:绝经后状态或女性绝经前患者的阴性尿或血清妊娠测试的证据。如果女性在没有其他医疗原因的情况下闭经12个月,则将被视为绝经后女性。以下针对特定年龄的要求适用:
[0218]
如果《50岁的女性在停止外源性激素治疗后闭经12个月或更长时间,并且如果她们的黄体生成素和促卵泡激素水平在机构的绝经后范围内或接受了手术绝育(双侧卵巢切除术或子宫切除术),则她们会被视为绝经后的。
[0219]
如果年龄≥50岁的女性在停止所有外源性激素治疗后闭经12个月或更长时间、在最后一次月经》1年前具有放射诱发的绝经、在最后一次月经》1年前具有化疗诱发的绝经或接受手术绝育(双侧卵巢切除术、双侧输卵管切除术或子宫切除术),则她们将被视为绝经
后的。
[0220]
未禁欲并打算与未绝育的男性伴侣发生性行为的有生育能力的女性患者从筛查开始到整个研究干预治疗期的总持续时间和在最后一剂研究干预后90天内必须使用至少1种高效避孕方法。有生育能力的女性患者的未绝育男性伴侣在此期间必须使用男性避孕套加杀精剂。在此之后停止节育应与负责的医生讨论。周期性禁欲、安全期避孕法和体外射精法不是可接受的节育方法。女性患者在此期间还应避免母乳喂养。
[0221]
评估cgvhd患者中在0.3mg/kg q2w、1mg/kg q2w和3mg/kg q4w下艾克利单抗的总体缓解率(orr)。
[0222]
根据2014年nih关于cgvhd临床试验标准的共识发展项目定义的前6个周期中的orr。
[0223]
评估临床获益的次要指标。
[0224]
根据2014年nih关于cgvhd临床试验标准的共识发展项目定义的研究的orr。
[0225]
反应持续时间(dor)定义为从pr或cr的最佳反应到记录的cgvhd进展、开始新治疗或因任何原因死亡的时间(定义1)。
[0226]
dor定义为从pr或cr的初始反应到记录的cgvhd进展、开始新治疗或因任何原因死亡的时间(定义2)。
[0227]
持续反应率(srr)
[0228]
器官特异性反应率基于2014年nih关于cgvhd临床试验标准的共识发展项目。基于针对cgvhd的改进的nih反应算法的关节和筋膜反应率。评估包括1)具有改良的lee症状量表评分的≥5分改善的患者的比例;2)皮质类固醇的平均日剂量(或等同物)的百分比减少;3)进入研究后停止使用皮质类固醇的患者的比例;4)钙调神经磷酸酶抑制剂的平均日剂量(或等同物)的百分比减少;5)进入研究后停止使用钙调神经磷酸酶抑制剂的患者的比例。
[0229]
次要-pk/药效学
[0230]
评估艾克利单抗在cgvhd患者中的血浆群体pk(pop pk)谱。艾克利单抗pk参数和可能解释药物暴露中的变异性的患者因素
[0231]
为了评估艾克利单抗的药效学特征,测量了集落刺激因子1(csf-1)、白细胞介素34(il-34)水平相对于基线的变化及其与cgvhd反应的关联。为了确定或评估具有反应的单核细胞水平的变化,测量了循环单核细胞数量和表型(cd14/16)相对于基线的变化。
[0232]
确定或评估具有反应的单核细胞水平的基线。测量了基线循环单核细胞数和表型(cd14/16)。
[0233]
次要-免疫原性
[0234]
测量抗药物抗体(ada)的存在。
[0235]
药效学
[0236]
评估艾克利单抗治疗后生物标志物的变化。测量了外周循环中免疫细胞(包括自然杀伤(nk)细胞、t细胞、b细胞)的频率。为了确定或评估具有反应的循环炎症生物标志物的变化,测量循环炎症生物标志物的相对于基线的变化。为了确定或评估具有反应的基线循环炎症生物标志物,测量了基线循环炎症生物标志物。测量了具有皮肤和肺部cgvhd的患者中的额外评估、在艾克利单抗前和3个艾克利单抗治疗周期后在皮肤或肺活检中(具有皮肤受累的患者的可选皮肤/肺活检同意)皮肤巨噬细胞、朗格汉斯细胞和树突状细胞中的相
对于基线的变化。
[0237]
功效
[0238]
为了探索临床益处的可能的其他证据,测量了基于lee cgvhd活动性评估患者自我报告的症状活动变化。确定第7周期第1天和第1年ffs患者的比例。ffs定义为从随机化到死亡或cgvhd的明确进展或潜在恶性肿瘤的复发或添加另一种全身免疫抑制治疗或因毒性停止研究治疗的时间。总生存期(os);反应时间;下次治疗时间;评估医师报告的结果;根据医师报告的全局cgvhd活动性评估的cgvhd严重程度的变化。
[0239]
整体设计
[0240]
2期、开放标签、随机、多中心研究,以评估艾克利单抗在患有复发性或难治性活动性cgvhd的患者中在3个不同剂量水平下的疗效、安全性和耐受性,这些患者因疾病进展、不耐受性或毒性而接受过至少2种先前的全身治疗线。根据nih 2014共识标准定义的疾病进展,在器官特异性算法或整体评估或活动性、有症状的cgvhd或需要额外或新的全身治疗线的那些方面。
[0241]
该研究由3个时期组成:筛选、治疗和随访。在整个研究过程中,对患者进行评估。入组时,符合条件的患者被随机分配至3个剂量组之一(艾克利单抗每2周[q2w]0.3mg/kg、1mg/kg q2w和3mg/kg q4w)。患者在随机化/入组后3天内开始治疗(第1周期第1天),并将在4周(28天)治疗周期内从第1周期第1天开始接受艾克利单抗治疗,直至疾病进展(如nih 2014共识标准所定义)、撤回同意或不可接受的毒性。治疗停止后,患者将在最后一剂研究药物后30天接受治疗结束(eot)访问,并在最后一剂研究药物后60天和90天接受2次进一步的安全性和疾病评估访问。
[0242]
simon的最佳2阶段设计在每个剂量队列中实施。在第一阶段,27名患者被随机分配到3个剂量组中的每一个。为了限制患者对无效剂量的潜在暴露并避免需要暂停应计(accrual),初始无效分析基于早期终点(即前3个周期中的总体反应)。评估每个剂量的无效和不可接受的毒性,并且无效和不可接受的毒性的停止界限如下:
[0243]
·
基于前3个周期的反应的无效评估:当队列中的每个患者有机会完成3个周期的治疗时,将进行此评估。如果≤6名患者在前3个周期对艾克利单抗产生反应,则可能因无效而停止随机分配至该剂量水平。
[0244]
·
基于前6个周期的反应的无效评估:当队列中的每个患者有机会完成6个周期的治疗时,将进行此评估。如果≤9名患者对艾克利单抗产生反应,则因无效而停止随机分配至该剂量水平。
[0245]
·
安全性评估:只要有无效分析,就会进行安全性评估,不可接受毒性的界限是27名患者中有≥8名出现毒性事件,定义为归因于研究药物的任何严重或重度(≥3级)的teae。被认为与治疗相关并导致医疗干预或住院的2级事件被视为毒性事件。在评估来自中期分析的数据时,研究随机化不会暂停。独立数据监测委员会将评估数据切割时可用的所有数据,并根据预先确定的无效和毒性界限确定患者不应再注册的剂量。不符合无效或安全界限的剂量将继续在研究的第二阶段进行评估,其中另外43名患者被纳入该剂量水平。当所有患者都有机会完成6个艾克利单抗治疗周期时,进行最终疗效分析。根据nih 2014 cgvhd标准定义,如果≥29名患者对艾克利单抗有反应(pr或cr),则认为剂量水平是成功的。参加q2w方案的患者可能有资格在研究期间更改为q4w方案。参加0.3mg/kg q2w方案的
患者可能有资格将其剂量增加至1mg/kg q2w。治疗反应标准每4周和在eot就诊或在使用2014年nih关于cgvhd临床试验标准的共识发展项目的研究干预停止时进行评估:cr、pr、缺乏反应(未改变、混合或进展)。
[0246]
患者数量:
[0247]
·
在第1阶段,27名患者被纳入每个治疗组(0.3mg/kg q2w、1mg/kg q2w和3mg/kg q4w)。
[0248]
·
在第2阶段,另外43名患者被纳入已通过第1阶段的无效性和安全性评估的每个治疗组。
[0249]
给药组和治疗持续时间:
[0250]
有3个给药组:0.3mg/kg q2w、1mg/kg q2w和3mg/kg q4w。总研究时间为16个月,具体如下:
[0251][0252][0253]
给药方法:
[0254]
患者将根据他们被随机分配到的给药队列以如下剂量和方案静脉内接受艾克利单抗:
[0255]
·
0.3mg/kg q2w
[0256]
·
1mg/kg q2w
[0257]
·
3mg/kg q4w
[0258]
不受任何特定理论的束缚,已经对用不同艾克利单抗q2w给药方案治疗的患者群体中的时间平均非经典单核细胞(ncmc)和中间单核细胞(immc)的分布进行了pk/药效学建模模拟。模型表明,在0.15mg/kg q2w时,ncmc和immc都处于或接近基线,而在0.5mg/kg q2w时,ncmc下降《25%,immc接近基线。1mg/kg q2w剂量产生的计数对于ncmc和immc均减少约50%,而3mg/kg q2w导致ncmc和immc在2周给药间隔内完全减少。在3mg/kg q4w时,模型表明ncmc和immc水平在1mg/kg q2w和2mg/kg q4w之间的时间平均下降。虽然单核细胞计数作为反应概率的药效学标志物的临床相关性仍有待确定,但循环单核细胞水平是csf-1r抑制的直接生物学读数,并可用于指导剂量和时间表的优化。预计0.3mg/kg q2w的剂量会导致时间平均ncmc和immc的一些但相对最小的降低,从而产生足够的剂量范围以为任何后续研究的最佳给药方案提供更多确定性。
[0259]
患者内剂量递增
[0260]
纳入0.3mg/kg q2w剂量水平的未经历任何≥2级治疗相关teae、已经历明确进展以及另外需要额外或改变全身治疗的患者可将其剂量增加到1mg/kg q2w而不管时机。
[0261]
如果宣布0.3mg/kg剂量水平无效,则在决定停止纳入该剂量水平后,患者可能会
将其剂量增加到1mg/kg q2w。剂量增加应仅在新周期开始时发生。
[0262]
给药方案的变化
[0263]
纳入q2w方案的患者如果符合提供的标准,他们的给药方案可能会更改为q4w。
[0264]
如果在从q2w到q4w的方案更改之后,患者进展,他们可能会返回到q2w方案。在从q2w到q4w方案的变化点(反之亦然),剂量强度必须保持不变,即紧接变化前的剂量强度必须等于紧接变化后的剂量强度。
[0265]
纳入1mg/kg q2w剂量方案的患者
[0266]
已接受评估并达到持续至少20周的pr/cr或未进展的患者可以将其剂量方案从q2w更改为q4w。他们将通过从1mg/kg进行到2mg/kg来维持其剂量强度。他们的新剂量是2mg/kg q4w。
[0267]
纳入0.3mg/kg q2w剂量方案的患者
[0268]
已接受评估并达到持续至少20周的pr/cr或未进展的患者可以将其剂量方案从q2w更改为q4w。他们将通过从0.3mg/kg进行到0.6mg/kg来维持其剂量强度。他们的新剂量是0.6mg/kg q4w。
[0269]
已从0.3mg/kg q2w增加至1mg/kg q2w剂量方案的患者
[0270]
如果患者经历pr/cr或在剂量增加至1mg/kg q2w后未进展,并且他们的最佳反应维持20周,他们可能会将其剂量方案从q2w更改为q4w。他们将通过从1mg/kg进行到2mg/kg来维持其剂量强度。他们的新剂量是2mg/kg q4w。
[0271]
剂量减少水平
[0272][0273]
下表详细说明了由于ast、alt、胆红素、ck、淀粉酶或脂肪酶升高而导致的艾克利单抗的剂量调整指南。
[0274]
ast、alt、胆红素、ck、淀粉酶和脂肪酶:基于给药当天(给药前2天内)实验室结果的艾克利单抗剂量调整指南
[0275][0276]
[0277][0278]
注意:等级是根据ctcae 5.0
[0279]
其他非血液学毒性:艾克利单抗的剂量调整指南
[0280][0281][0282]
注意:等级是根据ctcae 5.0
[0283]
血液学毒性
[0284]
遵循血液学毒性表中的指南用于基于计划给药时的血液学状态确定剂量调整。
[0285]
血液学毒性:艾克利单抗的剂量修改指南
[0286][0287]
注意:等级是根据ctcae 5.0
[0288]
艾克利单抗输注相关反应
[0289]
如果患者经历艾克利单抗输注相关反应,他们可以按照所提供的指导继续进行研究干预治疗。先前经历过输注相关反应的患者将在每个后续艾克利单抗剂量前约30至60分钟接受25至50mg静脉注射或口服等效的苯海拉明和650mg静脉注射或口服等效的对乙酰氨基酚/扑热息痛的术前用药方案。
[0290]
表中概述了艾克利单抗输注相关反应的治疗修改。
[0291]
艾克利单抗的输注相关反应
[0292][0293]
注意:等级是根据ctcae 5.0
[0294]
如果2级输注相关反应在实施指示的修改(包括将输注速率降低50%)后没有改善或恶化,研究者可以考虑使用皮质类固醇治疗,并且应在当天停止输注。在下一个周期,需要施用抗组胺药和退热药的口服术前用药。不允许使用预防性类固醇。如果患者在较慢的50%输注速率下出现2级或更高级别的第二次输注相关反应,无论是否在强制性术前用药中添加了进一步药物,都应停止输注,并将患者从艾克利单抗治疗中移除。
[0295]
艾克利单抗剂量水平的随机化
[0296]
使用交互式反应技术(irt)以1:1:1的随机化比例将所有患者集中分配到艾克利单抗剂量。患者分配根据cgvhd的严重程度(轻度/中度相对于重度)和至少一种以下疗法的先前使用(先前治疗相对无先前治疗)进行分层:依鲁替尼、鲁索替尼和kd025。
[0297]
施用程序
[0298]
艾克利单抗药物产品必须用输注袋中提供的0.9%盐水溶液(氯化钠注射液)稀释至50ml。不应向含有艾克利单抗的输注溶液中添加其他药物。
[0299]
制备艾克利单抗输注溶液所需的剂量基于以千克(kg)为单位的患者的体重。所有患者应在给药前3天内称重。如果与最后一次剂量计算所用的体重相比,患者体重减轻或增加》10%,则必须重新计算研究干预量。对于体重变化《10%,重新计算艾克利单抗剂量的决
定可以根据机构实践。
[0300]
功效评估
[0301]
最好由完成c1d1评估的同一医疗保健提供者完成所有cgvhd评估。至少,c7d1评估应由执行c1d1评估的同一医疗保健提供者执行。此外,任何导致cgvhd治疗改变的评估都必须由pi或主治医师确认。
[0302]
根据2014年nih共识定义的反应确定
[0303]
根据2014年nih关于cgvhd临床试验标准的共识发展项目(lee2015)的定义,对医生评估的整体反应进行评估。cr定义为每个器官或部位所有表现的消退,pr定义为至少1个器官或部位的改善,而任何其他器官或部位没有进展。表9包含工作组提出的cr、pr和进展的共识定义,用于评估器官特异性反应以及全局反应确定。
[0304]
基于临床医生评估的慢性gvhd临床研究的反应确定
[0305]
[0306][0307]
儿科患者的反应测定
[0308]
没有对儿科患者进行特殊评估。然而,对于较年轻的患者或无法依从的患者,pft评估将包括脉搏血氧定量和如临床指示的吸气相和呼气相ct扫描以评估空气滞留。
[0309]
医师报告的全局和器官特异性cgvhd活动性评估
[0310]
使用医师报告的全局和器官特异性cgvhd活动性评估表评估nih 2014共识标准定义的cgvhd严重程度的变化。临床医生将提供4分分类量表(无慢性gvhd、轻度、中度、重度)上的当前总体慢性gvhd严重程度的主观评估(独立于记录的nih全局严重程度评分)以及他们的自上次评估以来cgvhd变化的评估。关键器官评估包括皮肤、口腔、肝脏、上消化道和下消化道、食道、肺、眼睛和关节/筋膜(jagasia 2015,lee 2015)。
[0311]
患者报告的cgvhd活动性评估(修改后的lee cgvhd症状量表)
[0312]
使用cgvhd lee症状量表(lee 2002)评估患者报告的症状活动性的变化,该量表已被2005年和2014年nih共识会议推荐用于捕获cgvhd症状。
[0313]
lee cgvhd症状问卷要求患者指出他们在过去7天内由于可能受慢性gvhd影响的7个领域(皮肤、眼睛和口腔、呼吸、饮食和消化、肌肉和关节能量、情绪困扰)的症状而经历的“烦恼”的程度(lee 2002)。已发表的证据支持其对cgvhd严重程度的有效性、可靠性和敏感性(lee 2015,merkel 2016,teh 2020)。
[0314]
药代动力学
[0315]
使用经过验证的酶联免疫吸附试验(elisa)确定血浆样品中的艾克利单抗水平。
[0316]
药效学和生物标志物
[0317]
收集生物标志物样品是本研究的一部分。进行并从参与本研究的所有患者中收集用于免疫相关分析生物标志物研究的以下血液样品:
[0318]
·
血液免疫参数水平,其可能包括ifnγ、il-1β、il-4、il-5、il-6、il-8、il-10、il-12p70、tnfα、csf1和il-34。与pk、安全性终点相比,从基线的变化。
[0319]
·
循环经典和非经典单核细胞水平以及与pk、安全性终点相比从基线的变化。
[0320]
·
分析循环免疫细胞亚群(包括cd8+t细胞、cd4+t细胞、b细胞、nk细胞)的数量,以及与pk和安全终点相比从基线的变化。
[0321]
·
此外,样品被储存起来,并且可以对被认为在免疫调节中发挥作用的生物标志物变体进行分析,包括但不限于用于rna、血清分析物或组织生物标志物的紧急候选基因/全基因组分析,以评估它们与观察到的对艾克利单抗的临床反应的关联。
[0322]
·
在患有皮肤或肺部cgvhd的患者中,通过免疫组织化学(ihc)和/或基因表达分析评估艾克利单抗之前和艾克利单抗治疗2个周期(c3d1)后皮肤和/或经支气管肺活检中巨噬细胞、朗格汉斯细胞和树突状细胞的变化。(具有皮肤/肺受累的患者需要获得可选的皮肤活检/肺活检同意)。
[0323]
免疫原性评估
[0324]
在从所有患者收集的血浆样品中评估针对艾克利单抗的抗体。
[0325]
筛选血浆样品中与艾克利单抗结合的抗体,并报告确认的阳性样品的滴度。进行其他分析以验证针对艾克利单抗的抗体的稳定性和/或进一步表征艾克利单抗的免疫原性。
[0326]
针对艾克利单抗的抗体的检测和表征使用经过验证的测定法进行。为检测针对艾克利单抗的抗体而收集的所有样品还具有用于对艾克利单抗血浆浓度进行评估的匹配样品,以使得能够解释抗体数据。可以进一步表征和/或评估抗体的中和研究干预活性的能力。
[0327]
karnofsky/lansky性能状态
[0328]
karnofsky/lansky表现状态允许将患者关于其功能障碍分类为从0到100的等级。分数越低,大多数严重疾病的生存率越差。该评分可用于比较不同疗法的有效性并评估个体患者的预后。karnofsky量表设计用于16岁及以上的患者,lansky量表设计用于16岁以下的患者(lansky 1987)。karnofsky量表是在肿瘤学环境中被广泛使用的经过验证的工具,尤其是hsct(schag 1984,crooks 1991,o'toole和golden 1991)。karnofsky和lansky性能状态列于表中。
[0329]
karnofsky/lansky性能状态
[0330][0331][0332]
参考资料
[0333]
alexander,k.a.,r.flynn,k.e.lineburg,r.d.kuns,b.e.teal,s.d.olver,等人
chronic graft-versus-host disease symptom scale as assessed by cognitive interviews.biol blood marrow transplant 22(4):752-758.
[0346]
miklos,d.,c.s.cutler,m.arora,e.k.waller,m.jagasia,i.pusic,等人(2017).ibrutinib for chronic graft-versus-host disease after failure of prior therapy.blood 130(21):2243-2250.
[0347]
o'toole,d.m.和a.m.golden(1991).evaluating cancer patients for rehabilitation potential.west j med 155(4):384-387.
[0348]
schag,c.c.,r.l.heinrich,p.a.ganz(1984).karnofsky performance status revisited:reliability,validity,and guidelines.j clin oncol 2(3):187-193.
[0349]
teh,c.,l.onstad,s.j.lee(2020).reliability and validity of the modified 7-day lee chronic graft-versus-host disease symptom scale.biol blood marrow transplant 26(3):562-567.
[0350]
thall,p.f.,r.m.simon,e.h.estey(1995).bayesian sequential monitoring designs for single-arm clinical trials with multiple outcomes.stat med 14(4):357-379.
[0351]
等价物
[0352]
本发明的一个或多个实施方案的细节在以上所附描述中阐述。尽管与本文所述的那些相似或等效的任何方法和材料都可以用于本发明的实践或测试,但是现在描述优选的方法和材料。本发明的其他特征、目的和优点将从说明书和权利要求中变得明显。在说明书和所附权利要求中,单数形式包括复数指示物,除非上下文另有明确规定。除非另有定义,本文使用的所有技术和科学术语与本发明所属领域的普通技术人员通常理解的含义相同。
[0353]
在不背离本发明的精神或本质特征的情况下,本发明可以以其他特定形式体现。前述描述仅出于说明的目的而呈现,并不旨在将本发明限制为所公开的精确形式,而是由所附权利要求限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1