可自愈合的强韧型脂肽表面活性素水凝胶及其制备方法
本发明涉及高分子水凝胶制备技术领域,具体涉及一种可自愈合的强韧型脂肽表面活性素水凝胶及其制备方法。
背景技术:
皮肤创面敷料是为了保护伤口不受外部环境的影响,在愈合过程中起到保护创面修复的作用。目前临床上使用最广泛的创面敷料主要是纱布、棉等传统型敷料。这种敷料价格低廉,能提供一些保护,但它们在使用中存在着许多缺点,如创面新生组织极易与纱布粘连,在换药时导致二次创伤,为患者带来痛苦;由于在愈合过程中起被动作用,无法对不断变化的伤口状况做出反应;不利于伤口渗出液的吸收;不能有效阻止细菌、真菌的感染;不能以一种可控或可持续的方式输送药物。理想的皮肤创面敷料不仅能够覆盖和保护创面,还能够维持创面湿润环境、有效缓释药物、促进组织修复、减少瘢痕形成、促进创面愈合。此外,理想的皮肤敷料应该接近或超过人体皮肤所提供的功能,能够提供如同自体皮肤一样的屏障功能,并能够促进皮肤修复。
在现有的新型创面敷料中,明胶来源的水凝胶敷料不仅具有很高的含水量,可以保持伤口环境的湿润、大量吸收伤口渗液,还具有较低的细胞毒性和良好的生物相容性,是目前研究最多的创面敷料之一。然而研究发现,纯明胶水凝胶敷料机械性能差,无法满足临床治疗的要求。尽管市场上已经有各种水凝胶敷料产品,但该领域仍在进行研究,目的是进一步改进水凝胶敷料,以优化患者舒适度、临床疗效和伤口愈合等多个方面。
将天然明胶改造成一种可以化学交联的甲基丙烯酸酯化明胶,再按照理想化皮肤敷料的要求,与脂肽活性素结合,研制由柔性网络和刚性网络两部分组成的复合水凝胶,具有自愈合性能,同时能够协同增强其水凝胶机械性能。
技术实现要素:
本发明的目的是提供一种可自愈合的强韧型脂肽表面活性素水凝胶及其制备方法,该水凝胶生物相容性好、无毒、可降解、自愈合、机械性能优,可用于保护创面修复,尤其适用于糖尿病慢性难愈合皮肤伤口愈合的治疗。
本发明所采用的技术方案为:
可自愈合的强韧型脂肽表面活性素水凝胶的制备方法,其特征在于:
所述方法包括以下步骤:
步骤一:水浴环境下,明胶粉末加入到预热的dpbs溶液中搅拌至完全溶解,加入甲基丙烯酸酐搅拌均匀,反应结束后恒温透析、冷冻干燥后得甲基丙烯酸酯化明胶粉末;
步骤二:将光引发剂加入到脂肽表面活性素溶液中,混合搅拌,得到基液;
步骤三:将步骤一得到的甲基丙烯酸酯化明胶粉末加入到步骤二得到的基液中,搅拌均匀,得到甲基丙烯酸酯化明胶和脂肽表面活性素混合溶液;
步骤四:将甲基丙烯酸酯化明胶和脂肽表面活性素混合溶液置于模具中,紫外线照射交联,得到甲基丙烯酸酯化明胶/脂肽表面活性素水凝胶,即可自愈合的强韧型脂肽表面活性素水凝胶。
步骤一中,10g明胶粉末和8ml甲基丙烯酸酐加入到100mldpbs溶液中,甲基丙烯酸酯化明胶的最终质量浓度为10-20%。
步骤一中,水浴温度为50℃,预热的dpbs溶液的预热温度为50℃。
步骤一中,恒温透析的截留透析袋的截留分子量为8~14kda,冷冻干燥操作为-80℃冷冻2天后置真空冷冻干燥机内冻干。
步骤二中:
脂肽表面活性素的最终浓度为25-100μg/ml;
光引发剂的最终浓度为0.5%,光引发剂为2-hydroxy-4’-(2-hydroxyethoxy)-2-methylpropiophenone,irgacure2959。
步骤三中,甲基丙烯酸酯化明胶粉末的添加浓度分别为10%-20%。
步骤四中,紫外线照射交联的条件为:紫外线波长为300-400nm,紫外线照射时间为1-5min。
如所述的制备方法制得的可自愈合的强韧型脂肽表面活性素水凝胶。
所述水凝胶包括柔性网络和刚性网络;
柔性网络为脂肽表面活性素羧基与甲基丙烯酸酯化明胶侧链氨基之间形成的氢键;
刚性网络为甲基丙烯酸酯化明胶侧链形成的共价键。
如所述的可自愈合的强韧型脂肽表面活性素水凝胶的应用,其特征在于:
所述水凝胶作为皮肤创面敷料,能够通过调节巨噬细胞表型从m1型向m2型转化和促进血管生成,促进糖尿病皮肤伤口愈合。
本发明具有以下优点:
(1)本发明中所选用的明胶是天然生物材料,脂肽表面活性素为枯草芽孢杆菌发酵产物,价格低廉、安全可靠、绿色环保,在实际操作中,通过光照即可形成可愈合的强韧型水凝胶结构,操作简单;
(2)本发明制备的可愈合的强韧型水凝胶物相容性好、无毒、可降解、自愈合、机械性能优,可用于糖尿病慢性难愈合皮肤伤口愈合的治疗。具有较强的力学性能,压缩模量可达到1.72mpa,可自愈合。且具有促进糖尿病大鼠皮肤伤口愈合的功能,在11天伤口完全愈合。
附图说明
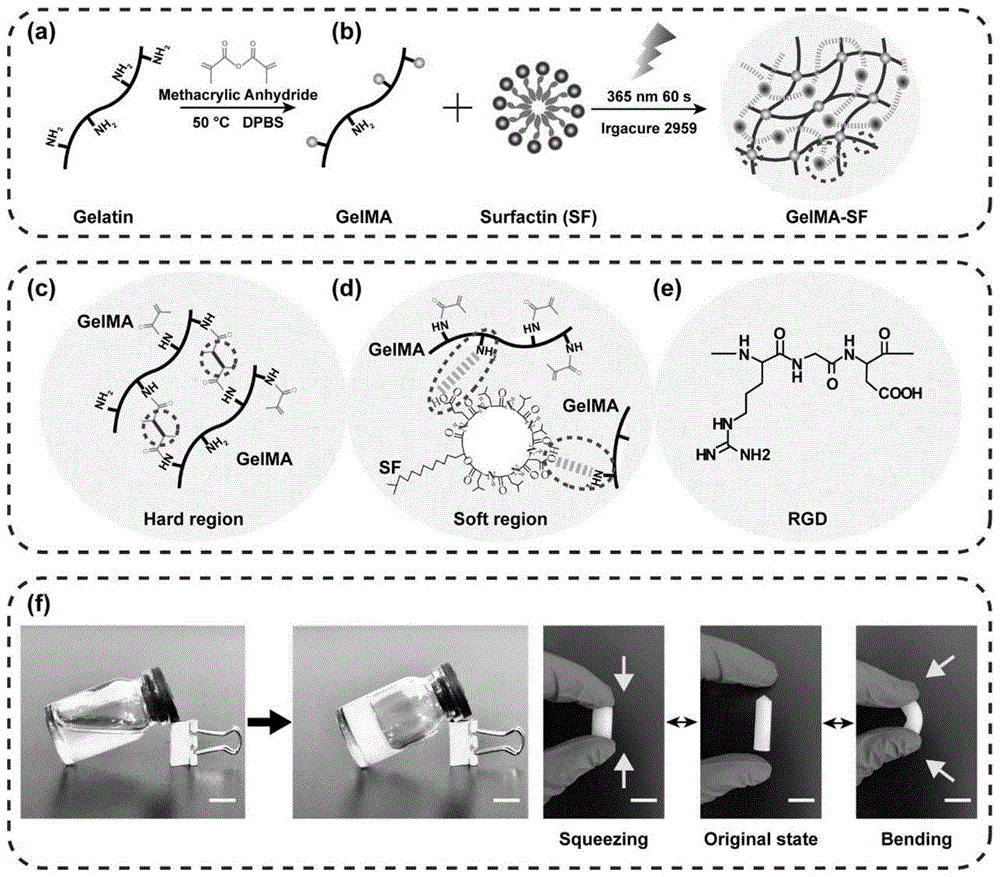
图1为水凝胶制备的流程图。(a)制备甲基丙烯酸酯化明胶(gelma)的原理图;(b)制备甲基丙烯酸酯化明胶/脂肽表面活性素水凝胶(gelma-sf);(c)甲基丙烯酸酯化明胶(gelma)侧链形成的共价键,形成刚性网络;(d)甲基丙烯酸酯化明胶侧链氨基和脂肽表面活性素羧基之间形成的氢键,形成柔性网络;(e)明胶主链上的精氨酸-甘氨酸-天冬氨酸(rgd)结构域;(f)可愈合的强韧型脂肽表面活性素水凝胶(gelma-sf)照片,原始、挤压、弯曲示意图。
图2为可愈合的强韧型脂肽表面活性素水凝胶性能表征。(a)可愈合的强韧型脂肽表面活性素水凝胶的形态学变化;(b)傅立叶变换红外光谱;(c)25℃时的动态粘弹性性能;(f)-(h)25℃时的力学性能;(i)自愈合性能。
图3为可愈合的强韧型脂肽表面活性素水凝胶的机械性能表征。不同浓度配比的甲基丙烯酸酯化明胶(gelma)和脂肽表面活性素水凝胶(sf)的压缩应力-应变曲线(a);拉伸应力-应变曲线(b);压缩模量(c);拉伸模量(d)。
图4为可愈合的强韧型脂肽表面活性素水凝胶的孔径和生物相容性表征。(a)表面形貌的扫描电镜图像;(b)孔径数据;(c)生物相容性能力;(d)细胞活力。
图5为可愈合的强韧型脂肽表面活性素水凝胶的溶胀性能表征。
图6为可愈合的强韧型脂肽表面活性素水凝胶的水蒸气透过性能表征。
图7为可愈合的强韧型脂肽表面活性素水凝胶的体内生物相容性表征。
图8为可愈合的强韧型脂肽表面活性素水凝胶的体内降解性能表征。
图9为可愈合的强韧型脂肽表面活性素水凝胶的创面愈合能力评价。(a)第0、4、7和11天各组代表性大鼠的伤口图;(b)伤口愈合率。
图10为可愈合的强韧型脂肽表面活性素水凝胶的创面愈合质量评价。(a)皮肤h&e和masson染色图;(b)表皮厚度和胶原面积定量分析。
图11为可愈合的强韧型脂肽表面活性素水凝胶的体内促血管生成性能表征。(a)皮肤免疫组化和免疫荧光组化cd31染色图;(b)皮肤免疫组化和免疫荧光组化cd31阳性细胞定量分析。
图12为可愈合的强韧型脂肽表面活性素水凝胶的体外巨噬细胞极化性能表征。
图13为可愈合的强韧型脂肽表面活性素水凝胶的体内巨噬细胞极化性能表征。(a)皮肤免疫荧光组化dapi、cd68、inos、cd206染色图;(b)cd68+/inos+、cd68+/cd206+阳性细胞定量分析;(c)inos+/cd206+阳性细胞定量分析。
具体实施方式
下面结合具体实施方式对本发明进行详细的说明。
本发明涉及一种可自愈合的强韧型脂肽表面活性素水凝胶的制备方法,所述方法包括以下步骤:
步骤一:水浴环境下,明胶粉末加入到预热的dpbs溶液中搅拌至完全溶解,加入甲基丙烯酸酐搅拌均匀,反应结束后恒温透析、冷冻干燥后得甲基丙烯酸酯化明胶粉末;
步骤二:将光引发剂加入到脂肽表面活性素溶液中,混合搅拌,得到基液;
步骤三:将步骤一得到的甲基丙烯酸酯化明胶粉末加入到步骤二得到的基液中,搅拌均匀,得到甲基丙烯酸酯化明胶和脂肽表面活性素混合溶液;
步骤四:将甲基丙烯酸酯化明胶和脂肽表面活性素混合溶液置于模具中,紫外线照射交联,得到甲基丙烯酸酯化明胶/脂肽表面活性素水凝胶,即可自愈合的强韧型脂肽表面活性素水凝胶。
步骤一中:
10g明胶粉末和8ml甲基丙烯酸酐加入到100mldpbs溶液中,甲基丙烯酸酯化明胶的最终质量浓度为10-20%;
浴温度为50℃,预热的dpbs溶液的预热温度为50℃;
恒温透析的截留透析袋的截留分子量为8~14kda;
冷冻干燥操作为-80℃冷冻2天后置真空冷冻干燥机内冻干。
步骤二中:
脂肽表面活性素的最终浓度为25-100μg/ml(如25μg/ml、50μg/ml和100μg/ml);
光引发剂的最终浓度为0.5%,光引发剂为2-hydroxy-4’-(2-hydroxyethoxy)-2-methylpropiophenone,irgacure2959。
步骤三中,甲基丙烯酸酯化明胶粉末的添加浓度分别为10%-20%(如10%、15%和20%)。
步骤四中,紫外线照射交联的条件为:紫外线波长为300-400nm,紫外线照射时间为1-5min。
上述制备方法的主要制备原理为甲基丙烯酸酯化明胶和脂肽表面活性素混合液中加有光引发剂,紫外线照射使得甲基丙烯酸酯化明胶侧链通过共价键交联形成刚性网络,脂肽表面活性素羧基与甲基丙烯酸酯化明胶侧链氨基之间通过氢键形成柔性网络。两层网络彼此交错,形成互穿网络。
制得的可自愈合的强韧型脂肽表面活性素水凝胶包括柔性网络和刚性网络;柔性网络为脂肽表面活性素羧基与甲基丙烯酸酯化明胶侧链氨基之间形成的氢键;刚性网络为甲基丙烯酸酯化明胶侧链形成的共价键。所述水凝胶作为皮肤创面敷料,能够通过调节巨噬细胞表型从m1型向m2型转化和促进血管生成,促进糖尿病皮肤伤口愈合。该水凝胶具有较强的力学性能,压缩模量可达到1.72mpa,可自愈合;具有促进糖尿病大鼠皮肤伤口愈合的功能,在11天伤口完全愈合。
以下结合附图对本发明的制备方法以及最终产物的性能检测进行进一步详细说明:
1材料与方法
1.1材料:
胶原粉末、甲基丙烯酸酐购自美国sigma-aldrich公司,脂肽表面活性素购自日本wako公司,光引发剂irgacure2959购自上海麦克林公司,dmem细胞培养基、胎牛血清(fbs)购自以色列biologicalindustries公司,cck-8试剂盒购自日本dojindolaboratories公司,青霉素-链霉素购自苏州新赛美公司,所有抗体购自美国biolegend公司。
1.2方法
1.2.1甲基丙烯酸酯化明胶制备
取猪皮明胶10g,加入到100ml预热的dpbs溶液中,50℃水浴搅拌至明胶完全溶解后,以0.5ml/min的速度缓慢滴加8ml甲基丙烯酸酐,边滴加边50℃水浴搅拌反应2h,反应结束后加入500ml预热的dpbs终止反应。将反应后的溶液放入12-14kda的透析袋中40℃透析7天以除去未反应的单体。透析结束后将甲基丙烯酸酯化明胶溶液冻干,干燥储存备用。
1.2.2甲基丙烯酸酯化明胶/脂肽表面活性素(gelma-sf)水凝胶制备
2.5mg光引发剂加入到500μl脂肽表面活性素溶液中,50℃水浴搅拌至完全溶解后,加入上述制备的甲基丙烯酸酯化明胶,50℃水浴溶解6h,搅拌均匀,得到甲基丙烯酸酯化明胶(gelma)和脂肽表面活性素(sf)混合溶液。之后,将甲基丙烯酸酯化明胶和脂肽表面活性素混合溶液置于模具中,波长为365nm的紫外线照射1min形成交联,得到gelma-sf水凝胶。
1.2.3gelma-sf水凝胶性能表征
傅里叶变换红外光谱用来测定gelma-sf水凝胶的化学键,扫描电子显微镜用来测定水凝胶的表面形貌和孔隙大小。
将水凝胶置于500μlpbs溶液中,在37℃放置24h后,从pbs溶液中取出样品,用滤纸吸去游离的液体,记录水凝胶的重量为ws。用分析天平在不同时间点测定水凝胶的吸水量,直至达到平衡。冻干后,水凝胶的重量记录为wd。根据下面的公式(1)计算溶胀率:
根据astm,e96-05标准进行水凝胶的水蒸气透过率测定。将水凝胶密封在一个直径2.7cm的渗透瓶的圆形开口上,瓶中装有20ml蒸馏水。记录初始重量,记录水凝胶的重量为wb,将渗透瓶置于35℃恒温培养箱中的干燥器中,由饱和碳酸钾溶液控制相对湿度为43%。渗透瓶在24小时内的重量损失表示通过水凝胶的水蒸气量。24小时后对渗透瓶称重,记录水凝胶的重量为wa。s为被测水凝胶的暴露面积(cm2),t为曝光时间(h)。根据下面的公式(2)计算溶胀率:
1.2.4gelma-sf水凝胶力学性能表征
水凝胶的压缩和拉伸性能通过力学试验机测定,压缩测试时水凝胶样品尺寸为φ7mm×2mm,以10mm/min的速率压缩至最大应力的95%,拉伸测试时测试时水凝胶样品尺寸为10mm×10mm×1mm,以20mm/min的速率拉至断裂。以所测试样品的初始横截面积和初始长度计算压缩和拉伸应力-应变曲线、压缩和拉伸模量。
1.2.5gelma-sf水凝胶流变学和自愈合性能表征
水凝胶的流变学性能通过振荡频率扫描法测定,水凝胶样品尺寸为φ7mm×2mm,置于旋转流变仪中,25℃下,在频率0.1~100rad·s-1范围内进行扫描,设定应变0.5%,记录储能模量(g’)和损耗模量(g”)的变化。
水凝胶的自愈合性能通过应变幅度扫描法测定,在应变0.01%~1000%范围内分析水凝胶的临界应变值,在临界应变值附近,切换小应变(γ=1%,每间隔60s)到大应变(γ=500%,每间隔60s),并在固定频率(1rad·s-1)下进行5个周期的测定,得到水凝胶的自愈合性能。水凝胶的宏观自愈合实验是将水凝胶切割成两半,在室温下将凝胶断裂面密切接触,观察水凝胶愈合情况。
1.2.6gelma-sf水凝胶细胞生物相容性表征
水凝胶的细胞生物相容性是通过与人脐静脉内皮细胞(huvec)的直接接触实验进行测定的。选择对数生长期的huvec细胞,待长满培养瓶后,用胰蛋白酶消化单层细胞,用含10%胎牛血清的dmem培养基配成1×105cells/ml单细胞悬液接种于96孔板中,在37℃、5%co2、100%湿度条件下培养24h。然后,将灭菌的水凝胶(φ7mm×2mm)置入孔中。在植入后第1天和第4天,使用活/死试剂盒检测细胞活力,在荧光显微镜下测定。为了进一步评估gelma-sf水凝胶的细胞毒性,进行了cck-8实验。与上述细胞处理方案相同,cck-8处理1h后将100μ的溶液转移到96孔板上,用酶标仪在450nm波长处测定吸光度。
1.2.7gelma-sf对巨噬细胞表型调控的表征
水凝胶对巨噬细胞表型的调控通过流式细胞术测定。选择对数生长期的raw264.7细胞,待长满培养瓶后,用胰蛋白酶消化单层细胞,用含10%胎牛血清的dmem培养基配成5×105cells/ml单细胞悬液接种于6孔板中,在37℃、5%co2、100%湿度条件下培养24h。加入终浓度为1μg/ml脂多糖(lps)继续培养细胞12h。之后,更换新培养基,加入水凝胶继续培养12h。刮下细胞吸入1.5mlep管,dpbs溶液清洗2遍,破膜10min,加入trustainfcxtm封闭10min,细胞计数保证每个样品细胞数量约为1×106,加入荧光一抗f4/80-pe,cd86-fitc,cd206-fitc,染色30min后dpbs溶液清洗2遍进行流式细胞术检测。用f4/80阳性率定量成熟的巨噬细胞总量,f4/80阳性细胞中cd86阳性率定量细胞m1型极化程度、cd206阳性率定量细胞m2型极化程度。
1.2.8i型糖尿病大鼠模型构建
健康成年sd雄性大鼠,适应性喂养7天后,禁食12h称重。腹腔注射链脲佐菌素(stz),stz给药剂量为60mg/kg。观察一周后,禁食8h后通过尾静脉采血测定sd大鼠血糖水平。血糖水平超过16.7mmol/l作为大鼠建模成功的标准。
1.2.9全层皮肤损伤模型构建
浓度为1.5%的戊巴比妥钠以50mg/kg的剂量通过腹腔注射麻醉大鼠,麻醉成功后,将大鼠俯卧位固定于实验台,使用电动脱毛刀将背部毛发剃短,用棉球蘸取7%硫化钠,在所需部位薄涂一层,5分钟后用纱布蘸取生理盐水擦去脱落的被毛,用纱布擦干,75%酒精消毒。之后用无菌的皮肤活检打孔器在大鼠背上制造一个直径7mm的圆形伤口,伤口深至筋膜层。每只大鼠用记号笔做好标记,方便记录,然后大鼠于室内单笼单只饲养,保证室内空气新鲜流通,温度适宜,并保持水和饲料的充足供应。观察所有实验动物,每天称重,任何感染或有感染迹象的实验动物立即分离,并且从实验中排除。
1.2.10动物实验给药和记录
将造模成功的大鼠,随机分为untreated组、sf组、gelma-egf组、gelma组、gelma-sf组,造模后立即上药处理,记为第0天。untreated组不做任何处理。sf组每天上药一次,浓度为100μg/ml,每次50μl。gelma组在第0天伤口上滴加50μl20%gelma溶液;gelma-egf组在第0天伤口上滴加50μl含100μg/mlegf的20%gelma溶液;gelma-sf组在第0天伤口上滴加50μl含100μg/mlsf的20%gelma溶液,之后在伤口处用紫外线交联固化。每天于相同时间点,使用相机为伤口拍照,以直尺作为参照物,通过imagej1.5.2图像分析程序计算伤口面积,平行测定3次,并计算大鼠伤口的愈合速率。计算公式为:
伤口愈合率(%)=未愈合创面面积/原始创面面积×100%
1.2.11gelma-sf水凝胶体内降解和生物相容性验证
水凝胶的体内降解和生物相容性实验是在i型糖尿病大鼠体内进行的。首先,将大鼠麻醉、脱毛、消毒,之后在大鼠背部制造一个切口皮下植入水凝胶(φ7mm×2mm)。在植入后第1、4、7、14和21天后处死大鼠,拍摄皮下组织中的水凝胶照片,并对取出的水凝胶进行称重记录。为了研究水凝胶的局部炎症反映情况,我们将水凝胶周围的皮下组织固定、包埋并进行组织学h&e染色。
1.2.12组织学和免疫组化分析
大鼠处死后,剪下面积约为10×10mm的伤口及周边皮肤,部分组织固定在10%多聚甲醛中,用于病理检测,另一部分组织用于免疫组化和免疫荧光实验。对伤口处组织切片进行he染色,观察伤口处再上皮化速度和表皮厚度。对伤口处组织切片进行masson染色,观察伤口处胶原沉积情况。对伤口处组织切片进行免疫荧光分析,观察伤口处m1型和m2型巨噬细胞的表达情况。其中,cd68作为成熟小鼠巨噬细胞的标记物,inos作为m1型巨噬细胞的标记物,cd206作为m2型巨噬细胞的标记物。观察伤口处血管新生的情况,其中cd31作为血管内皮细胞的标记物。
2实验结果
2.1gelma-sf水凝胶的构建
制备gelma-sf水凝胶的流程如图1所示。水凝胶由柔性网络和刚性网络两部分组成,柔性网络是脂肽表面活性素羧基与甲基丙烯酸酯化明胶侧链氨基之间形成的氢键,刚性网络结构是甲基丙烯酸酯化明胶侧链形成的共价键。形成的刚性网络为水凝胶提供了合适的硬度和强度,而柔性网络通过高效的能量耗散机制使其坚韧和可愈合。这种双重交联构成了可调的互穿聚合物网络,使水凝胶在外力导致水凝胶变形或破裂时,能够防止渗出物渗漏和病原体感染。同时,gelma链上的精氨酸-甘氨酸-天冬氨酸(rgd)结构域能够促进细胞与生物材料之间的有效粘附。
2.2gelma-sf水凝胶的红外光谱、流变学和自愈合特性
如图2a所示,与gelma水凝胶相比,合成的gelma-sf水凝胶颜色从半透明变成透明,说明sf与gelma之间存在大量的相互作用。通过红外光谱(图2b)结果可知,gelma-sf水凝胶内部没有形成共价键而是形成了稳定的氢键。
流变学实验结果表明,在γ=1%范围内,gelma-sf水凝胶的储能模量(g′)均大于损耗模量(g”),没有出现交叉痕迹,表明形成了稳定的水凝胶(图2c-e)。随着sf浓度的增加,gelma-sf水凝胶的储能模量(g′)呈不断增大的趋势,表明与对照组gelma水凝胶相比,gelma-sf水凝胶具有更强的机械性能。
在对水凝胶进行循环反复压缩时,水凝胶能够自修复被破坏的网络结构。在宏观切割/愈合实验中,将柱状gelma-sf水凝胶切成两部分。然后,给两部分轻轻施加外部压力1min后,让两部分相互接触,实验结果发现两部分在水平、倾斜和垂直的角度上均能够相互粘附并支撑自己的重量。结果表明,gelma-sf水凝胶具有良好的自愈合能力。
2.3gelma-sf水凝胶的力学性能
通过拉伸和压缩试验对gelma-sf水凝胶的力学性能进行了系统的表征。结果表明,gelma-sf水凝胶的压缩性(图3a)和延伸性(图3b)可以通过改变sf和gelma的浓度比例来调节,随着sf和gelma浓度的提高,水凝胶的压缩模量逐渐增大,而拉伸模量逐渐减小。当gelma浓度为20%,sf浓度为100μg/ml时,水凝胶具有最接近皮肤和软组织的机械性能。
2.4孔隙率、溶胀、水蒸气透过性能和细胞生物相容性
根据扫描电镜结果可知(图4a),随着sf浓度的增加,gelma-sf水凝胶的孔隙率逐渐减小,表明gelma-sf水凝胶内的交联密度随sf浓度的增加而增大。理论上,孔隙率越小,溶胀和水蒸气透过能力会降低,但在本研究中,与gelma水凝胶相比,gelma-sf水凝胶具有更大的溶胀率和水蒸气透过率,这对于伤口愈合敷料有重要意义(图5,图6)。总的来说,当gelma浓度为20%,sf浓度为100μg/ml时,水凝胶各项指标最适合作为新型的伤口愈合敷料。
创面愈合敷料的先决条件之一是具有良好的细胞相容性,确保材料对细胞无毒,对创面无害。通过水凝胶直接接触法测定了对huvec细胞的毒性作用,结果表明,当gelma浓度为20%,sf浓度为100μg/ml时,水凝胶具有很好的细胞生物相容性,不会对细胞产生明显毒性(图4b)。
2.5体内降解和生物相容性
基于体外细胞相容性的实验结果,我们进一步表征了gelma-sf水凝胶经皮下植入在糖尿病大鼠体内的生物相容性(图7)。gelma-sf水凝胶在皮下植入7天后(植入早期),水凝胶周围的皮肤组织显示微弱的炎症反应。gelma-sf水凝胶处理组炎症细胞密度与gelma组几乎相同,但纤维包膜厚度较gelma水凝胶处理组更薄。植入后21天,gelma-sf水凝胶处理组炎症细胞密度明显小于gelma水凝胶处理组和植入后7天的gelma-sf水凝胶处理组。而gelma-sf水凝胶处理组在植入后21天,纤维包膜厚度低于同期gelma水凝胶处理组和植入后7天的gelma-sf水凝胶处理组,表明gelma-sf水凝胶能够与宿主组织很好地结合,在体内调节炎症反应。同时,结果表明gelma-sf水凝胶能够在体内有效的降解(图8)。
2.6i型糖尿病大鼠伤口愈合治疗
在构建的i型糖尿病大鼠全层皮肤损伤模型中,当gelma浓度为20%,sf浓度为100μg/ml时,伤口具有最快的愈合速率,能够在11天内完全愈合,且具有最快的再上皮化速率和最多的胶原沉积,表明gelma-sf水凝胶能够促进糖尿病伤口愈合的速度和质量(图9,图10)。
2.7gelma-sf水凝胶促进血管生成
为了评价gelma-sf水凝胶促进伤口愈合的机制,我们分析了伤口皮肤组织的血管内皮细胞进行cd31标记特异性。免疫组化和免疫荧光结果表明,gelma-sf水凝胶处理组具有最多的cd31阳性表达,说明新生血管最多,这表明gelma-sf水凝胶能为血管形成提供了良好的3d微环境支架(图11),这种特性在糖尿病慢性伤口愈合过程中是至关重要的。
2.8gelma-sf水凝胶促进巨噬细胞极化
在整个伤口愈合的过程中,巨噬细胞的行为往往起着至关重要的作用。在伤口愈合早期,巨噬细胞主要呈现促炎表型m1型,即经典活化的巨噬细胞,通过分泌促炎因子吞噬病原体和细胞碎片来协调伤口愈合事件。而在伤口愈合后期,巨噬细胞主要呈现抗炎表型m2型,即替代活化的巨噬细胞,通过分泌抑炎因子抑制炎症,并促进组织修复和重塑。在这过程中,m1/m巨噬细胞的表型极化对愈合过程至关重要。然而,在糖尿病创面中,m1巨噬细胞向m2巨噬细胞的表型极化过程受损,导致伤口处巨噬细胞长期停留在m1型,导致慢性炎症的发生。这导致了延迟的再上皮化速率、肉芽组织形成和血管新生受阻。因此,对于糖尿病伤口愈合的治疗,开发能够调节巨噬细胞表型极化的创面敷料具有重要意义。
根据流式细胞术检测了gelma-sf水凝胶对raw264.7表型极化的影响。单独暴露于lps处理下的raw264.7细胞作为阴性对照,其余各组在lps处理后分别用gelma-sf水凝胶或gelma水凝胶处理(图12)。结果表明,raw264.7在lps处理12h后成功诱导为m1表型(f4/80+/cd86+)。之后经gelma-sf水凝胶处理12h,raw264.7细胞向m2表型显著极化(f4/80+/cd206+)。而对照组gelma水凝胶处理无极化能力。结果表明,gelma-sf水凝胶能在体外调节巨噬细胞表型从m1向m2的转变。
为了进一步研究gelma-sf水凝胶对巨噬细胞表型的调控作用,将伤口处皮肤组织分别用cd68(成熟巨噬细胞标记物)、cd206(m2巨噬细胞标记物)和inos(m1巨噬细胞标记物)抗体特异性标记,进行免疫荧光染色(图13)。结果表明,gelma-sf水凝胶处理组的m1/m2巨噬细胞比例显著低于其他处理组,说明gelma-sf水凝胶在促进巨噬细胞表型转变方面有更好的效果,能够通过促进伤口部位巨噬细胞表型从m1向m2转,从而加速糖尿病创面愈合。
本发明的内容不限于实施例所列举,本领域普通技术人员通过阅读本发明说明书而对本发明技术方案采取的任何等效的变换,均为本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!