一种高产谷胱甘肽毕赤酵母菌株G3-SA及其应用
一种高产谷胱甘肽毕赤酵母菌株g3
‑
sa及其应用
技术领域
1.本发明属于生物合成技术领域,具体涉及一种高产谷胱甘肽毕赤酵母菌株g3
‑
sa及其应用。
背景技术:
2.谷胱甘肽是一种三肽活性物质,广泛存在于动物、植物和微生物中,具有保护和调节细胞内氧化还原平衡的作用。其分子量为307.33,由谷氨酸、半胱氨酸及甘氨酸组成,在各种生物的体内含量各不相同,其中在酵母和动物内脏中含量较高。gsh在临床领域也上发挥着广泛的作用,在肝病、肾病以及心血管疾病上都具有显著的疗效。
3.gsh的主要特征是由于其具有一个γ酰胺键和一个巯基基团。在大多数原核和真核生物中由两步反应生成,第一步由谷氨酸和半胱氨酸在gsh1的作用下生成谷氨酰半胱氨酸,之后该产物再与甘氨酸在gsh2的作用下反应生成gsh,第一步反应的酶是生成gsh的关键酶,受产物的反馈抑制,两步酶皆是atp依赖型,反应均需消耗1分子的atp。
4.已报道的gsh合成方法有化学合成法、酶转化法和发酵法。化学合成法采用三种原料利用化学工艺合成gsh,成本高昂,且对环境有污染。酶法采用三种原料、atp及酶反应生成gsh,此法核心是筛选出具有高活性的合成酶,但成本高,目前大多还在研究中。发酵法是微生物利用廉价的原料来生长积累高浓度的gsh,之后进行下一步的分离纯化。成本低、纯度高、无污染,是目前生产gsh的主要方法。
5.为此,已经尝试利用多种微生物实现对gsh的生产。在此方面的研究中,前人经常采用诱变或者基因工程来提高酶的活性,或者通过优化发酵条件提高前体的利用。由于酵母中gsh含量较高,遗传背景清晰,所以经常被用作生产gsh的优良宿主。目前主要工业生产以发酵法为主,生产宿主为酵母、大肠等。毕赤酵母由于具有食品安全级微生物的状态,且外源表达以整合为主,无需高昂的诱导剂,成为高密度发酵生产外源蛋白以及其他生物产品的优良宿主。
6.限制gsh的发酵产量的因素有三个,gsh合成酶的活性、半胱氨酸及atp的供应。半胱氨酸可以通过外源添加补充,但过量的半胱氨酸会导致合成时期atp的供应不足。
7.alfafara等研究发现半胱氨酸(cys)是提高gsh的关键氨基酸。但在进行高密度发酵生产时,细胞通过代谢合成的cys远不能满足合成gsh的需要。因此外源添加cys是一种有效策略,而且也确实得到了gsh的大规模生产。然而当cys过量添加时,使得充当能量载体的atp成为gsh生产的限制因素。为解决此问题,liang等通过直接添加atp使gsh产量提高11%,atp属于昂贵原料,放大生产不现实。又如wang等研究利用柠檬酸盐作为辅能量底物促进nadh的产生,进而通过电子传递链加强atp的产生,使菌株sam和gsh产量及其联产产量提高27.5%,然而这种方法不能提高足够的atp来满足高gsh的生产需要。
8.利用传统代谢工程提高atp的供给对于高耗能反应的进行是良好的策略。据报道,在毕赤酵母表达vhb蛋白,增加菌体摄氧能力,进而提高atp的供应,使得sam的产量相较对照提高19倍。tani等发现来自酿酒酵母的adk是amp转化至atp的限速步骤,后来在harit利
用毕赤酵母产sam的研究中也得到了证实。
9.综上,atp是谷胱甘肽合成的主要限制因子,如何提高atp的供应,有效提升谷胱甘肽的产量,是本领域亟需解决的技术问题。
技术实现要素:
10.发明目的:研究发现添加atp或者代谢改造促进atp的再生均对谷胱甘肽的合成有促进作用,但存在成本高昂或效果有限的问题。为了克服现有技术中存在的该问题与不足,本发明提供一种高产谷胱甘肽毕赤酵母菌株g3
‑
sa及其应用,增强了胞内gsh的合成,对于促进谷胱甘肽的合成或者其余耗能产物的生产具有普遍的意义。
11.技术方案:为实现上述目的,本发明采用的技术方案为:
12.本发明的一个目的是,提供一种高产谷胱甘肽毕赤酵母菌株g3
‑
sa,以毕赤酵母为宿主,异源表达来源于酿酒酵母的谷胱甘肽合成酶scgsh1和scgsh2基因及腺苷激酶scadk1基因,获得的工程菌命名为毕赤酵母菌株g3
‑
sa。
13.进一步的,所述毕赤酵母选用毕赤酵母pichia pastoris gs115,该菌株购自淼灵质粒平台。
14.进一步的,所述谷胱甘肽合成酶scgsh1和scgsh2基因、所述腺苷激酶scadk1基因的核苷酸序列分别如seq.no.01~seq.no.03所示。
15.本发明的另一个目的是,提供一种高产谷胱甘肽毕赤酵母菌株g3
‑
sa的构建方法:以毕赤酵母为宿主,首先异源表达来源于酿酒酵母的谷胱甘肽合成酶scgsh1(gene id:853344)和scgsh2(gene id:854108)基因,获得的工程菌命名为g3;再以g3为宿主,异源表达来源于酿酒酵母的腺苷激酶scadk1(gene id:851812)基因,获得的工程菌命名为毕赤酵母菌株g3
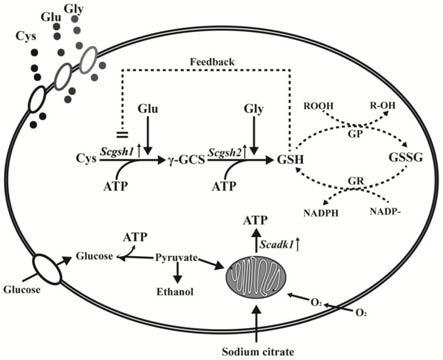
‑
sa。
16.更进一步的,具体方法为以pgapza为初始质粒,采用bglⅱ与bamhⅰ酶切,并将插入了xbaⅰ的片段插入其中,所构质粒命名为pgapzt。在pgapzt的bglⅱ与xbaⅰ之间插入p
aox1
序列。scadk1基因(gene id:851812)经s.cerevisiae by4741基因组pcr扩增后获取,所得片段连接在pgapzt中并用sacⅰ线性化电转至g3菌株中,所得菌株经含有2mg/l zeocin的ypd平板筛选后,所得菌株名为为g3
‑
sa。
17.进一步的,所述腺苷激酶scadk1基因的异源表达的发酵过程中,在发酵时间15
‑
16h时外源添加4g/l的柠檬酸钠。
18.本发明的另一个目的是,提供一种上述高产谷胱甘肽毕赤酵母菌株g3
‑
sa的构建方法过程中得到的质粒。
19.本发明的另一个目的是,提供编码如上述的高产谷胱甘肽毕赤酵母菌株g3
‑
sa的基因。
20.本发明的另一个目的是,提供一种制备谷胱甘肽的方法,采用上述的高产谷胱甘肽毕赤酵母菌株g3
‑
sa,或上述方法构建的高产谷胱甘肽毕赤酵母菌株g3
‑
sa,通过发酵方法合成谷胱甘肽。
21.本发明的另一个目的是,提供由上述方法制备得到的谷胱甘肽。
22.有益效果:本发明提供的一种高产谷胱甘肽毕赤酵母菌株g3
‑
sa及其应用,与现有技术相比,具有以下优势:本发明以毕赤酵母gs115为宿主,异源表达来源于酿酒酵母的
scgsh1和scgsh2基因,获得了gsh的过量生产,将工程菌命名为g3;在此基础上,异源表达来源于酿酒酵母腺苷激酶scadk1,旨在增强发酵过程中的能量供应。目前谷胱甘肽摇瓶水平最高产量可达(465.50
±
29.90)mg/l,胞内谷胱甘肽得率为(16.87
±
0.63)mg/l/od。对所构工程菌g3
‑
sa进行5l发酵罐发酵,谷胱甘肽在56h最高产量为4810mg/l,胞内谷胱甘肽得率为19.87mg/l/od以为gsh的工业生产提供新思路。
附图说明
23.图1为实施例1中g3菌株构建电泳图;
24.其中,a中m为5kb marker;1,2为scgsh1基因pcr扩增;
25.b中m为5kb marker;1,2为scgsh2基因pcr扩增;
26.c中m为5kb marker;1,2为g2菌株提基因组验证引物验证(g2是构建的以毕赤酵母gs115为宿主,仅表达了scgsh1基因的工程菌);
27.d中m为5kb marker;1,2为g3菌株提基因组验证引物验证。
28.图2为实施例2中g3
‑
sa电泳验证图;其中,m:dl2000 marker;1:g3基因组验证,2、3、4:工程菌基因组pcr验证。
29.图3为实施例3中g3
‑
sa摇瓶发酵结果图;
30.图4为实施例4中柠檬酸钠添加对g3
‑
sa胞内gsh和atp含量影响;其中,a
‑
柠檬酸钠添加时间优化,b
‑
柠檬酸钠添加浓度优化,c
‑
胞内atp的变化曲线。
31.图5为实施例5中g3
‑
sa在5l发酵罐的发酵结果。
32.图6为对比例1中g3菌株摇瓶发酵结果图;其中,a
‑
生物量,b
‑
gsh浓度,c
‑
gsh得率,d
‑
添加氨基酸前体时菌株发酵结果图。
33.图7为本发明的方法原理示意图。
具体实施方式
34.本发明通过在毕赤酵母中异源表达scgsh1和scgsh2以强化谷胱甘肽的合成路径,所构菌株命名为g3,再异源表达来自酿酒酵母的scadk1基因,对宿主细胞进行内源代谢改造,并结合外源柠檬酸钠的添加,有效增强胞内atp的供应,进一步增强了胞内gsh的合成。
35.下面结合附图和实施例对本发明作更进一步的说明。
36.实施例
37.根据下述实施例,可以更好的理解本发明。然而,本领域的技术人员容易理解,实施例所描述的具体的物料配比、工艺条件及其结果仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。
38.实施例1:g3菌株构建
39.p3质粒构建:本专利构建以p
gap
为启动子、t
aox1
为终止子的组成型表达菌株。首先以gap
‑
f/gap
‑
r(序列见表1)为引物扩增出基因组上的p
gap
启动子序列。采用saci及bamhi酶切ppic 3.5k以去除p
aox1
片段并用p
gap
序列代替得到组成型表达的质粒,将其命名为ppickt。以s.cerevisiae by4741的基因组为模板,分别以gsh1f/gsh1r(序列见表1)、gsh2f/gsh2r(序列见表1)pcr扩增出目的基因scgsh1和scgsh2片段(基因序列如seq.no.01、seq.no.02所示)分别连接至ppickt中,构成p1和p2质粒。并采用yzgf/yzgr(序
列见表1)验证后做接下来的构建。后用g1f/g1r(序列见表1)和tf/tr(序列见表1)分别扩增p1质粒上的p
gap
‑
scgsh1与t
aox1
片段,后采用诺唯赞c113多片段同源重组连接试剂盒连接入p2质粒中,获得同时含有scgsh1和scgsh2表达单元的质粒pp
‑
p
gap
‑
scgsh1
‑
scgsh2,即p3质粒。并经验证引物yzggf/yzggr验证后即可构建。
40.g3菌株构建:以上构建质粒过程均转化至大肠杆菌jm109感受态细胞中,在含有100mg/l的氨苄青霉素(amp)lb抗性平板上进行筛选,获得的转化子经菌落pcr验证及测序,得到正确的转化子。将质粒ppickt、p1及p3均用sali线性化后采用根据手册(invitrogen)通过电转法将线性化质粒转化至毕赤酵母,涂布于含有md组氨酸缺陷型平板,于30℃下孵育2~3d。将长出的菌落点至高质量浓度g418(4mg/ml)中,长出的较大的菌落并提基因组验证后即可获得含有高拷贝基因数的目的菌株即为g3菌株,如图1所示。
41.实施例2:g3
‑
sa菌株构建
42.pgapzt
‑
scadk1质粒构建:在本研究中,我们以pgapza为出发质粒,对其进行改造,将改造后的质粒命名为pgapzt。首先以zxf/zxr(序列见表1)为引物以pgapza为模板进行pcr扩增,使回收的产物x片段启动子前端带有xbaι,终止子末端带有nheι酶切位点。采用bglⅱ及bamhi酶切pgapza以去除中间片段,用x片段代替得到含有同尾酶的质粒,将其命名为p
gap
zx。
43.以ztf/ztr为上下游引物以ppicza为模板进行pcr扩增以获得p
aox1
片段,采用bglⅱ及xbaι酶切pgapzx载体并与p
aox1
片段连接,得到含有p
aox1
的质粒,将其命名为pgapzt,该质粒可以将单个或多个目的基因的表达盒整合至染色体的p
aox1
位置处,并用引物yzf/yzr(序列见表1)验证后即可使用。分别以s.cerevisiae by4741及的基因组为模板,以引物sadkf/sadkr(序列见表1)pcr扩增出目的基因scadk1片段(基因序列如seq.no.03所示)采用c113试剂盒连接至pgapzt中,得到表达质粒pgapzt
‑
scadk1。并经引物yz2f/yz2r(序列见表1)验证后即可进行下面的构建
44.g3
‑
sa菌株构建:以上构建质粒过程均转化至大肠杆菌jm109感受态细胞中,在含有25μg/ml zeocin的低盐lb抗性平板上进行筛选,获得的转化子经菌落pcr验证及天霖生物科技有限公司测序,即得到正确的转化子。使毕赤酵母gs115成为感受态细胞,获得毕赤酵母g3菌株,再以毕赤酵母g3菌株成为感受态细胞,采用saci线性化上述重组质粒p
gap
zt
‑
scadk1,将质粒根据手册(invitrogen)电转至毕赤酵母g3菌株中,以获得g3
‑
sa。将电转产物涂布于ypdz培养基中,于30℃下孵育2~3d。将长出的菌落点至含有高质量浓度zeocin(2mg/ml)ypd培养基中,长出的重组菌提基因组验证后,即可获得含有高拷贝基因数的目的菌株,如图2所示。
45.表1引物序列
[0046][0047][0048]
实施例3:g3
‑
sa菌株摇瓶发酵
[0049]
摇瓶水平的发酵培养基为ypd培养基,包括:葡萄糖20g/l,酵母粉10g/l,蛋白胨20g/l。
[0050]
摇瓶发酵:种子培养基即ypd培养基及发酵培养基均为ypd培养基。将菌株从甘油管挑至ypd平板上划线,30℃培养2~3d,长出的单菌落挑至含有10ml种子培养基的摇瓶中,30℃培养16~18h,之后以初始od为0.2接种至发酵培养基中220rpm培养30h,并在初始时添加浓度分别为10mm谷氨酸、10mm半胱氨酸、10mm甘氨酸的混合液。发酵30h后,收集菌体,上清液用于测乙醇、甘油及葡萄糖。用40%乙醇溶液220rpm震荡孵育2h,离心后,上清中即含
有高浓度的gsh。
[0051]
摇瓶发酵的结果如图3所示,从图中可以看出,酿酒酵母来源的腺苷激酶的表达并没有显著影响细胞的生长。但是在添加终浓度为10mm的氨基酸时,腺苷激酶的表达对于gsh的合成有促进作用。相较于g3菌株和空质粒对照组g3
‑
zt菌株,g3
‑
sa产量最高为(387.95
±
10.47)mg/l,较对照g3(321.65
±
8.50mg/l)提高20.61%。且胞内的得率也相应提高,提高至(15.83
±
0.29)mg/l/od。
[0052]
实施例4:添加柠檬酸钠的g3
‑
sa菌株摇瓶发酵及胞内atp含量的变化
[0053]
方法同实施例3,区别是在发酵到12时添加4g/l的柠檬酸钠。
[0054]
摇瓶发酵的结果如图4所示,对柠檬酸钠的添加条件进行探究,其中,图4a是柠檬酸钠添加时间的优化,图4b是柠檬酸钠添加浓度的优化,图4c是胞内atp的变化曲线。通过代谢改造提高能量供应对提高胞内gsh积累有显著作用。基于此,我们尝试內源与外源组合以增强gsh的合成。对g3
‑
sa菌株添加柠檬酸钠优化试验,最终表明在发酵时间12h添加浓度为4g/l的柠檬酸钠效果最好,产量可提升至465.5
±
29.90mg/l,较对照g3
‑
sa(387.95
±
10.47mg/l)提升16.66%。
[0055]
之后探究了各重组菌株及添加柠檬酸钠后胞内atp含量的变化,结果如下图4a所示,添加柠檬酸钠后菌株16
‑
28h内胞内的atp的含量均比对照要高,这是由于柠檬酸钠的加入,强化了三羧酸循环路径,从而提高胞内atp的含量。其中在atp含量20h达到了最高值,之后迅速下降,这可能是由于在此时期菌体生长进入平台期,此时大量的gsh被合成,消耗了大量的atp。综上,摇瓶中柠檬酸钠的添加或利用代谢改造增强胞内atp的供应可以有效解除氨基酸过量情况下atp不足的限制。
[0056]
实施例5:g3
‑
sa菌株发酵罐发酵
[0057]
5l发酵罐培养基(g/l):葡萄糖50,酵母粉5,(nh4)2so
4 11,k2hpo
4 7,mgso45,cacl
2 0.5,kcl 0.5。
[0058]
发酵罐发酵:将种子培养基培养16~18h,以10%的接种量接入5l发酵罐中。待培养基ph降至5.5时,流加50%氨水使发酵过程ph始终维持在5.5。每升培养基中含有10ml ptm1,待初始培养基中的糖降至5g/l时,补加700g/l的葡萄糖,使乙醇浓度始终在3g/l以下。当发酵16h时,添加4g/l的柠檬酸钠。发酵时间达至48h时,投料终浓度为25mm谷氨酸、25mm半胱氨酸、25mm甘氨酸混合液。定时取样,测其生物量、谷胱甘肽浓度、甘油、还原糖及乙醇浓度。
[0059]
发酵罐发酵的结果如图5所示,g3
‑
sa菌株菌体生物量在44h达到稳定期,此时的生物量od600达到257.0,较摇瓶发酵水平的生物量od600(24.71)提高10.40倍,同时葡萄糖在16h时被迅速消耗尽,剩余量为0.36g/l。gsh作为初级代谢产物伴随菌体生长积累,在投料氨基酸前体混合液之前在44h达到1060mg/l。在此时投料氨基酸溶液,谷胱甘肽的合成效率迅速增加,在56h时gsh的产量达至最高为4810mg/l,较摇瓶水平最高产量(465.50
±
29.90)mg/l提高了10.33倍,胞内gsh得率为19.87mg/l/od。
[0060]
对比例1:g3菌株摇瓶发酵
[0061]
方法同实施例3,区别是添加的菌株为g3菌株。
[0062]
摇瓶发酵的结果如图6所示,对照菌株gs115生长情况较工程菌低一些,而两基因的转入对生长几乎无影响,其中,g1为空白对照组工程菌,是构建的以毕赤酵母gs115为宿
主,转化表达了空质粒的工程菌;g2是构建的以毕赤酵母gs115为宿主,仅表达了scgsh1基因的工程菌。g3的菌株30h gsh为141.96mg/l,,产量相较对照提高2.62倍。为提高gsh的合成效率,在发酵0h时添加了终浓度为10mm的甘氨酸、半胱氨酸和谷氨酸的混合液。从图6(d)中可以看出氨基酸前体的加入对菌株生长有一定抑制作用,可能是前体物质中的半胱氨酸对菌株有毒害作用所致,但前体的加入确实极大程度提高了菌体合成gsh的能力。在发酵30h,gsh产量为(302.27
±
5.06)mg/l,胞内得率为(11.79
±
0.35)mg/l/od,但这个水平不算很高,于是猜测可能是前体的添加使atp供应不足成为主要限制因子。
[0063]
综上可见,相较于g3菌株,本发明进一步异源表达了来源于酿酒酵母腺苷激酶scadk1,确实实现了增强发酵过程中的能量供应的目的,相较于g3菌株的摇瓶发酵水平,本发明的谷胱甘肽摇瓶水平最高产量可达(465.50
±
29.90)mg/l,胞内谷胱甘肽得率为(16.87
±
0.63)mg/l/od。进一步对所构工程菌g3
‑
sa进行5l发酵罐发酵,谷胱甘肽在56h最高产量为4810mg/l,胞内谷胱甘肽得率为19.87mg/l/od。无论是摇瓶发酵还是发酵罐发酵的结果都远远高出现有的技术水平,尤其是5l发酵罐发酵能力得到极大提升,这为gsh的工业生产提供新思路。
[0064]
以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1