一种去细胞基质微载体及其制备方法
本发明涉及一种细胞培养材料及其制备方法,特别涉及一种去细胞基质微载体及其制备方法。
背景技术:
微载体(三维微载体)具有微米级的尺寸(1-1000μm)、较大的比表面积、负载能力强等特点,可增强细胞的黏附、浸润和迁移,已被广泛应用于可注射水凝胶、细胞及分子载体、3d打印支架等。制备微载体常用材料有甲基丙烯酰化明胶(gelma),壳聚糖,海藻酸盐,聚乳酸(pla),甲基丙烯酰化透明质酸(hama),聚乙二醇二丙烯酸酯(pegda),胶原,乳酸-羟乙醇酸共聚物(plga)等。cn111333898a公开了一种高度多孔明胶微载体的制备方法,以edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)和nhs(n-羟基琥珀酰亚胺)与明胶微载体冷冻交联形成具有优良生物相容性的高度多孔明胶微载体,同时采用冷冻交联,冻干的方法合成高度多孔的微载体。该微载体采用来源于生物体内的明胶,是一种生物相容性的单一组分多孔微载体。
基于去细胞基质(decellularizedextracellularmatrix,decm,又称为脱细胞基质)的水凝胶来源于组织/器官,由组织经脱细胞操作去除免疫源性物质获得,具有较高的生物活性和生物相容性,保留了原组织所含蛋白质(胶原蛋白、纤连蛋白、层粘连蛋白等)、多糖(甘聚糖、蛋白多糖、糖蛋白等)和一些生长因子。相比合成材料,decm可更好模拟原生组织微环境的组成、微观结构和生物力学特性,可促进培养组织的生长和再生。已有多种不同来源的去细胞基质的制备方法,其制备方法相对成熟。将去细胞基质材料制作成微载体,可结合二者优势,使该三维细胞载体具有较强的生物活性和组织特异性,便于功能性组织工程支架的制备。然而decm一般为凝胶态,流动性较差。一般使用液氮冷冻后研磨制备得到微粒。
cn109837240a公开了一种应用微流控芯片制备海藻酸钙-脂肪脱细胞基质微载体的方法。其方法具体如下:取人脂肪组织反复冻融后乳化得到纳米脂肪,并离心去除上层油和下层水,取中间层采用pbs缓冲液、胰蛋白酶-edta消化液、异丙醇、混合酶溶液进行脱细胞处理,再用α-淀粉酶水溶液和醋酸浸泡萃取离心取上清液,并与海藻酸钠溶液等体积混合作为分散相通入微流控芯片,将含有span-80的正癸醇作为连续相通入微流控芯片,获得包裹有正癸醇的脱细胞基质-海藻酸钠液滴,最后通入含有cacl2的正癸醇溶液进行交联过夜,洗涤去正癸醇后即获得海藻酸钙-脂肪脱细胞基质微载体。该方法中,只是萃取细胞成分,主要还是使用海藻酸钙作为载体骨架。
如何制备得到均一的decm微载体,是一项具有挑战性的工作。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供一种去细胞基质微载体及其制备方法。
本发明所采取的技术方案是:
本发明的第一个方面,提供:
一种去细胞基质微载体的制备方法,包括:
1)低于10℃环境下,配制去细胞基质溶胶,得到水相;
2)将油性液体加入适量乳化剂,得到油相;
3)控制水相和油相的温度为低温环境,混合制备得到w/o乳液;
4)升温至10℃以上,使水相凝胶化,得到油相包裹的微载体;
5)洗涤去除油相,得到去细胞基质微载体。
在一些实例中,所述水相中,去细胞基质的添加量为0.5~10w/v%,0.5~5.0w/v%,0.5~2.0w/v%。以保证可以造成具有一定流动性的水相为准,不同来源的细胞基质,有不同的使用上限。
在一些实例中,所述油相中,乳化剂的添加量为0~20v/v%。
在一些实例中,所述油性液体由液体石蜡、食用油中的一种或多种的混合物组成,并可在低温环境,如低于10℃保持为液态。不同的油相具有不同的表面张力,实验数据表明,在相同的乳化剂添加量下葵花籽油得到的微载体粒径相比液体石蜡的会更大。
在一些实例中,所述乳化剂由司盘、吐温中的一种或多种的混合物组合。乳化剂的添加可维持未成胶微载体的稳定,添加乳化剂可避免成胶前微载体的融合带来的粒径分布宽的问题。
在一些实例中,升温至不超过40℃使水相凝胶化,优选30~38℃下水相凝胶化。在10~38℃之间,温度越高,凝胶化的速度越快。温度过高,会导致天然蛋白活性受损。过低则凝胶化的时间过长。
在一些实例中,所述水相中还添加有交联剂、细胞因子、生物相容的水相溶质中的至少一种。
在一些实例中,使用微流控芯片混合制备得到w/o乳液。
在一些实例中,所述微流控芯片中油相与水相的流速比为(1~50):1。通过调节流速比,可获得不同粒径分布的微载体。
在一些实例中,所述交联剂选自1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、n-羟基琥珀酰亚胺、转谷氨酰胺酶、甲醛、京尼平和戊二醛。
在一些实例中,所述细胞因子选自促进血管化的因子、促进轴突生长的因子、神经生长因子(ngf)、脑源性神经营养因子(bdnf)。
在一些实例中,促进血管化的因子为血管内皮生长因子(vegf)。
在一些实例中,所述交联剂选自1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、n-羟基琥珀酰亚胺、转谷氨酰胺酶、甲醛、京尼平和戊二醛。
在一些实例中,所述细胞因子选自促进血管化的因子、促进轴突生长的因子、神经生长因子(ngf)、脑源性神经营养因子(bdnf)。
在一些实例中,所述生物相容的水相溶质选自海藻糖、壳聚糖、透明质酸、明胶、胶原、丙烯酸双键端基改性明胶或透明质酸中的至少一种。
在一些实例中,所述去细胞基质源自周围神经、脊髓、脑、小肠粘膜下层、皮肤、脐带、胎盘或羊膜。
本发明的第二个方面,提供:
一种细胞培养基质,添加有本发明第一个方面所述制备方法制备得到的去细胞基质微载体。
本发明的有益效果是:
本发明的一些实例,提供了一种简便的去细胞基质微载体的制备方法,制备得到的微载体大小均匀,具有高度生物相容性,且成分和结构与体内环境高度相似,非常适用于细胞的培养。
本发明的一些实例,可以方便地调节微流控芯片的参数,制备得到不同粒径的微载体。
本发明的一些实例,可以方便地在水相中添加需要的细胞因子、生物相容的高分子、药物等,满足特定细胞培养的需要。
本发明的一些实例,通过对制备得到的微载体进行一步的交联,可以提高其力学强度,满足生物3d打印等的特殊要求。
附图说明
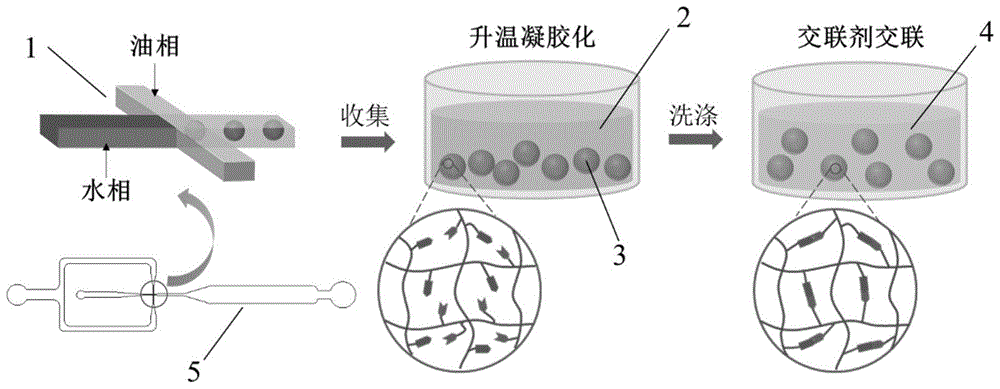
图1是本发明一些实例的去细胞基质微载体的制备流程示意图;其中,1、微流控芯片聚焦流式狭窄区域结构,2、油相,3、含去细胞基质的微载体,4、交联溶液,5、微流控芯片结构。
图2是实施例2制备本发明去细胞基质微载体过程中观察到的光学显微镜图;
图3是实施例3制备本发明去细胞基质微载体过程中观察到的光学显微镜图及统计的粒径分布柱状图;
图4是实施例4制备得到的去细胞基质微载体光学显微镜图;
图5是实施例4制备得到的去细胞基质微载体扫描电镜图;
图6是实施例5制备得到的去细胞基质微载体光学显微镜图。
具体实施方式
下面结合实例,进一步说明本发明的技术方案。
液滴微流控芯片具有很高的可控性、灵活性及可设计性,可高通量和可控地操纵液滴的生成,实现快速乳化,适用于多种材料微载体的制备,已成为一种化学、生物和材料科学研究中的通用工具。方便比较起见,以下实施例中使用液滴微流控芯片来制备微载体。当然,也可以使用周知的方法制备微载体。
以下实施例中使用的微流控芯片采用如下方法制备得到:
采用软光刻法制备的微流控芯片5,芯片含借助剪切聚焦产生微载体的聚焦流式狭窄区域结构1,水相通道截面高度和宽度为50μm或100μm。
采用过网筛或通过微孔膜的方式获得粒径分布较窄的微载体,所述过滤孔径为10~500μm。
图1为本发明一些实例的去细胞基质微载体的制备流程示意图。
实施例1:
1)配制水相:水相为0.5%w/v(g/l)去细胞基质制备的溶胶,组织来源为猪来源的周围神经,使用调节并维持ph=7,于低于10℃环境下配制;
2)配制油相:油相为添加10%v/vspan-80的液体石蜡;
3)低于10℃环境下,采用注射泵分别经由水相入口及油相入口将水相及油相注射进入微流控芯片,水相通道截面高度和宽度为50μm,水相流速为1.000μl/min,油相流速为3.3μl/min;
4)收到得到的乳液并在37℃条件下凝胶化,凝胶化后,洗涤三次,得到去细胞基质微载体。
去细胞基质微载体长期保存时,储存于-40℃的冰箱中。
实施例2:
1)配制水相:水相为1.0%w/v(g/l)去细胞基质制备的溶胶,组织来源为猪来源的周围神经,使用调节并维持ph=7,于低于10℃环境下配制;
2)配制油相:油相为液体石蜡;
3)低于10℃环境下,采用注射泵分别经由水相入口及油相入口将水相及油相注射进入微流控芯片,水相通道截面高度和宽度为50μm,水相流速为31.25μl/min,油相流速为100.0μl/min;
4)收集得到的乳液并在37℃条件下凝胶化,凝胶化完成后洗去油相。
得到的去细胞基质微载体置于光学显微镜下观察,如图2所示。从图2可以看出,制备得到的去细胞基质微载体为球形,粒径较为均一,包裹结构完整。
实施例3:
1)配制水相:水相为1.0%w/v(g/l)去细胞基质制备的溶胶,组织来源为猪来源的周围神经,使用调节并维持ph=7,于低于10℃环境下配制;
2)配制油相:油相为液体石蜡;
3)低于10℃环境下,采用注射泵分别经由水相入口及油相入口将水相及油相注射进入微流控芯片,水相通道截面高度和宽度为50μm,水相流速为31.25μl/min,油相流速为166.7μl/min;
4)收集得到的乳液并在37℃条件下凝胶化;
5)得到的去细胞基质微载体置于光学显微镜下观察,并由imagej软件统计微载体直径并作出粒径分布柱状图,如图3所示;
6)充分洗去油相,将得到的微载体浸泡于含有100mmedc与50mmnhs的50mm吗啉乙磺酸缓冲溶液中充分交联4h,交联完成后,洗涤去除残留的交联剂。
将交联的去细胞基质微载体储存于-40℃冰箱中备用。从图3可以看出,制备得到的去细胞基质微载体粒径分布较窄,包裹充分,呈现球形。
实施例4:
1)配制水相:水相为1.0%w/v(g/l)去细胞基质制备的溶胶,组织来源为猪来源的周围神经,使用调节并维持ph=7,于低于10℃环境下配制;
2)配制油相:油相为添加10%v/vspan-80的液体石蜡;
3)低于10℃环境下,采用注射泵分别经由水相入口及油相入口将水相及油相注射进入微流控芯片,水相通道截面高度和宽度为100μm,水相流速为33.33μl/min,油相流速为100.0μl/min;
4)收集得到的乳液并在37℃条件下凝胶化,凝胶化完成后充分洗去油相;
得到的去细胞基质微载体置于光学显微镜下观察,如图4所示,微载体大部分可维持球形。干燥后,扫描电镜图如图5所示。从图中可以看出,充分洗涤去除油相后,可得到具有微纳米纤维结构的微载体。
实施例5:
1)配制水相:水相为1.0%w/v(g/l)去细胞基质制备的溶胶,组织来源为猪来源的周围神经,使用调节并维持ph=7,于低于10℃环境下配制;
2)配制油相:油相为添加10%v/vspan-80的葵花籽油;
3)低于10℃环境下,采用注射泵分别经由水相入口及油相入口将水相及油相注射进入微流控芯片,水相通道截面高度和宽度为100μm,水相流速为33.33μl/min,油相流速为100.0μl/min;
4)收集得到的乳液并在37℃条件下凝胶化,凝胶化完成后洗去油相;
得到的去细胞基质微载体置于光学显微镜下观察,如图6所示。在葵花籽油中也可得到微载体,但是与液体石蜡相比形状较为不规则。
对比例1:
同实施例1,不同之处在于水相的配制和乳液的制备过程中,温度为常温(20~25℃)。结果显示由于通道堵塞无法有效制备得到去细胞基质微载体。
- 还没有人留言评论。精彩留言会获得点赞!