一种引物组合、探针组合及其在检测猪病毒中的应用、检测试剂、试剂盒及检测方法与流程
[0001]
本发明涉及生物检测技术领域,具体涉及一种引物组合、探针组合及其在检测猪病毒中的应用、检测试剂、试剂盒及检测方法。
背景技术:
[0002]
非洲猪瘟(african swine fever,asf)是由非洲猪瘟病毒(african swine fever virus,asfv)引起猪的一种急性、热性、高度接触性动物传染病,临床上以高热、网状内皮系统出血和高死亡率为特征,易感猪群的病死率高达100%。世界动物卫生组织(oie)将非洲猪瘟列为法定报告动物疫病,我国将其列为一类动物疫病。2018年8月我国首例非洲猪瘟确诊,随后多地暴发了非洲猪瘟疫情,给我国生猪养殖业带来了沉重打击。
[0003]
口蹄疫(foot-and-mouth disease, fmd)是由口蹄疫病毒(fmdv)感染引起的一种急性、热性、高度接触性传染病,主要侵害偶蹄动物,偶见于人和其它动物。在我国又被称为“口疮”、“蹄癀”和“五号病”。该病的主要特征是口腔黏膜、舌面、鼻镜、乳头、蹄叉及附蹄周边皮肤形成或发生水疱,水疱易破溃,液体溢出形成烂斑。病畜感染期间的大量排毒、低感染剂量、传播途径多以及可通过气溶胶长距离传播的能力等因素,导致该病具有高度传染性,被认为是偶蹄动物中最具传染性的传染病,对国内外养殖业造成了严重的经济损失。
[0004]
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,prrs)是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,prrsv)引起的猪rna病毒病,俗称“猪蓝耳病”。其造成猪的繁殖与呼吸障碍,给国内的养猪业造成了巨大的损失,严重威胁我国的动物卫生安全。prrsv 容易变异、毒株多样、感染时间长,因此防控难度较大。我国在 1995 年底开始暴发猪繁殖与呼吸综合征,自 2006 年夏季以来,我国流行以变异美洲型病毒为病原的高致病性猪繁殖与呼吸道综合征(hp-prrs),导致大量的猪只发病和死亡,造成了严重的经济损失。与以往在我国流行的 prrsv相比,hp-prrsv可致猪发病更严重,发病率和死亡率也更高,临床症状更典型。猪瘟又称古典猪瘟 ( classical swine fever,csf) ,是由猪瘟病毒( classical swine fever virus,csfv) 引起的一种急性、烈性、高度接触性传染病。以感染猪发病急、持续高热、全身出血、和白细胞减少为特征,任何品种、性别和年龄的猪只都能够感染该病,且具有较强的传染性。csfv于19世纪在美国被首次报道以来,对世界养猪业的健康发展造成了严重的影响,除北美洲和大洋洲外几乎遍及全世界,是危害养猪业安全的重要疫病之一。国内在以免疫为主的防控措施下,典型 csf 的发生大大减少,往往以非典型出现,临床症状出现多样性,与其他疾病难以区分,仅靠传统的临床检查、病理剖检难以做出准确诊断,需依靠实验室检测才能确诊。
[0005]
伪狂犬病(pseudorabies,pr),是由疱疹病毒科、α-疱疹病毒亚科、疱疹病毒属的伪狂犬病病毒(pseudorabies virus,prv)引起,prv属疱疹病毒科α-疱疹病毒亚科,能引起多种动物发生以发热、奇痒、脑脊髓炎为主要特征的传染病,猪为其储存宿主,并可引起猪
的潜伏感染。该病毒可感染各个年龄段的猪,主要表现为妊娠母猪的流产、死胎及木乃伊胎,新生仔猪出现神经症状,成年猪的呼吸道症状等。猪群一旦发生 prv 感染,病毒很难被清除,被定义为极难防疫的自然疫源性疾病。我国目前使用的伪狂犬弱毒疫苗均为bartha-k61株,bartha-k61株病毒缺失了ge基因,伪狂犬弱毒疫苗的使用可以有效的控制伪狂犬疫情,但是使用疫苗后并不能清除猪体内原来存在的prv,也不能防止后续的prv感染。为便于区分猪体内原来存在的prv和疫苗毒,通常将猪体内原来存在的prv称为prv野毒。在感染猪体内,prv可以形成终身的潜伏感染,并且一旦激活,就能够造成prv野毒的广泛传播。
[0006]
非洲猪瘟、口蹄疫、猪瘟、高致病性猪繁殖与呼吸综合征、猪伪狂犬病是危害国内猪养殖业的重要动物疫病,并给养猪业造成了严重的经济损失。非洲猪瘟自传入我国以来,党中央、国务院高度重视非洲猪瘟防控工作,为有效控制疫情蔓延,《国务院办公厅关于加强非洲猪瘟防控工作的意见》中制定“规范生猪产地检疫管理”“支持开展无疫区建设”“强化出入境检疫”等措施。《国家中长期动物疫病防治规划(2012—2020年)》中指出,口蹄疫、猪瘟、高致病性猪繁殖与呼吸综合征、猪伪狂犬病为优先防治动物疫病,同时开展种畜禽重点疫病净化,到2020年原种猪场达到猪瘟、高致病性猪繁殖与呼吸综合征、猪伪狂犬病净化标准。
[0007]
目前针对以上五种猪病的检测方法包括病毒的分离与鉴定、传统的聚合酶链式反应(pcr)/反转录-聚合酶链式反应(rt-pcr)、序列测定、间接免疫荧光抗体试验(ifa)、酶联免疫吸附试验(elisa)等。但这些方法在实际应用中仍存在限制和不足,如病毒的分离鉴定、ifa对实验室及人员水平要求较高;传统的pcr/rt-pcr检测时间过长,且操作过程中易交叉污染,产生假阳性;elisa方法虽技术成熟,但敏感性及特异性有待提高。近些年,环介导等温扩增(lamp)、重组酶聚合酶扩增(rpa)等核酸恒温扩增技术得到迅猛发展,这些方法以其操作的简便性和快捷性受到很多青睐,作为核酸快速检测技术已被应用于多种疫病,且已有商业化的产品。但由于这些方法无法实现多重靶标检测以及气溶胶污染、非特异性扩增等问题,并未在临床实验室广泛应用。
[0008]
实时荧光定量pcr技术以其特异性强、灵敏度高、速度快等优点在基因表达水平分析、病原体基因的定性和定量检测等方面得到广泛应用,并且已经成为当前病毒核酸快速检测的主要方法。但单一的病毒检测相对费时费力,且成本较高,而多重荧光定量pcr技术可利用一次反应,同时检测、鉴别出多种病原体,在临床混合感染的诊断上具有独特优势和很高的实用价值。目前多重荧光定量pcr技术仍以双重靶标或者三重靶标为主,四重或五重靶标荧光定量pcr方法很少。虽然有学者建立了五重或以上靶标荧光定量pcr方法,但都是基于染料法荧光pcr,由于存在假阳性的问题,因此很难应用于临床样品检测。
[0009]
目前可单一检测asfv、fmdv、csfv、hp-prrsv及prv野毒的荧光定量pcr方法较多见,但可同时检测以上五种猪病毒的taqman探针五重荧光定量pcr方法尚未见报道。
技术实现要素:
[0010]
本发明的目的在于提供一种引物组合在检测猪病毒中的应用。
[0011]
本发明的另一个目的在于提供一种探针组合在检测猪病毒中的应用。
[0012]
本发明的另一个目的在于提供一种猪病毒的检测试剂。
[0013]
本发明的另一个目的在于提供一种猪病毒的检测试剂盒。
0.13pmol/μl,fmdv检测引物的浓度为0.35-0.45pmol/μl,csfv检测引物浓度为0.15-0.25 pmol/μl,hp-prrsv检测引物的浓度为0.35-0.45 pmol/μl,prv野毒检测引物的浓度为0.35-0.45pmol/μl。
[0023]
在一些较佳的实施方式中,所述探针组合中asfv检测探针的浓度为0.08-0.12pmol/μl,fmdv检测探针的浓度为0.58-0.62 pmol/μl,csfv检测探针的浓度为0.18-0.22 pmol/μl,hp-prrsv检测探针的浓度为0.38-0.42 pmol/μl,prv野毒检测探针的浓度为0.38-0.42 pmol/μl。
[0024]
第五方面,本发明提供一种猪病毒的试剂盒,包括第四方面任意一项所述的检测试剂;所述引物组合和探针组合分开包装;所述引物组合和探针组合制备成混合液。
[0025]
在一些较佳的实施方式中,还包括荧光定量pcr预混液、阳性对照品和阴性对照品。
[0026]
在一些较佳的实施方式中,所述荧光定量pcr预混液包括无rna酶双蒸水和多重预混液,所述多重预混液至少包括反转录酶、dna聚合酶混合物、dntps、mgcl2、rna酶抑制剂。
[0027]
在一些较佳的实施方式中,所述阳性对照品包括asfv基因质粒标准物质、fmdv标准抗原、csfv核酸标准物质、hp-prrsv核酸标准物质以及prv野毒标准毒株混合液;所述阴性对照品包括无rna酶双蒸水。
[0028]
第六方面,本发明提供一种猪病毒的检测方法,使用如第五方面任一项所述的试剂盒,包括:对待检测样品和阳性对照品分别进行核酸提取以获得样品核酸和阳性对照品核酸;将荧光定量pcr预混液、引物组合和探针组合按预设体积比例配置获得五重荧光定量pcr反应液;将所述样品核酸、阳性对照品核酸以及阴性对照品分别作为模板与所述五重荧光定量pcr反应液反应进行pcr扩增;实时记录所述pcr扩增过程中的ct值和扩增曲线以获得检测结果;所述检测方法所针对的检测样本包括血液、组织或饲料样品。
[0029]
在一些较佳的实施方式中,所述预设体积比例为:荧光定量pcr预混液:引物组合和探针组合=41:49~44:46。
[0030]
在一些较佳的实施方式中,所述模板与所述五重荧光反应液的比例为1:9。
[0031]
与现有技术相比,本发明的有益效果:建立五种猪病毒联检方法,可对asfv、fmdv、csfv、hp-prrsv及prv野毒五种重大猪病单管快速检测,可实现这五种病毒的高通量筛查,极大提高了检测效率,同时减少试剂用量,从而节约成本,并且缩短了检测时间,极大地减少了工作量;提供能实现五种猪病毒联检的检测试剂,采用优化的引物组合、探针组合,使试剂和采用该试剂的试剂盒能特异、灵敏地检测asfv、fmdv、csfv、hp-prrsv及prv五种猪常见病毒。
[0032]
可简单快速地在单反应管中平行准确检测不同类型核酸的五种猪病毒感染,实现了单管pcr同时检测dna病毒和rna病毒;采用one step rt-qpcr反应,反转录反应和qpcr反应在同一反应管内连续进行,操作
简单,且一次加样检测可大大地降低加样带来污染的可能性。
附图说明
[0033]
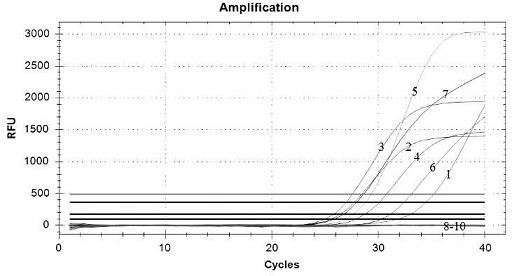
图1:asfv引物、检测探针筛选的荧光定量pcr扩增结果图;图2:fmdv引物、检测探针筛选的荧光定量pcr扩增结果图;图3:csfv引物、检测探针筛选的荧光定量pcr扩增结果图;图4:hp-prrsv引物、检测探针筛选的荧光定量pcr扩增结果图;图5:prv野毒引物、检测探针筛选的荧光定量pcr扩增结果图;图6:五重荧光定量pcr方法标准曲线图;其中:1-texas red:asfv;2-cy5:fmdv;3-fam:csfv;4-vic:hp-prrsv;5-cy5.5:prv野毒;图7:五重荧光定量pcr方法的特异性验证结果图;其中:1:asfv;2:fmdv-a;3:fmdv-o;4:fmdv-asiaⅰ;5:prrsv-jxa1;6:csfv;7:prv-容a;8:prrsv-lv;9:prrsv-vr2332;10:tgev-pedv-porv;11:prv-bartha k61,12:jev。
具体实施方式
[0034]
以下结合实例,对本发明作进一步说明,但本发明的保护范围并不仅限于此。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂公司购买得到。
[0035]
实施例1:本实施例提供一种五种猪病毒联检方法。具体的,建立五重荧光定量pcr检测方法以建立五种猪病毒联检方法。
[0036]
1. 引物和taqman探针的设计将genbank公布的不同非洲猪瘟病毒(asfv)毒株的b646l基因序列(登录号:mn393476.1、mn715134.1、mn172368.1、lr743116.1、mk333180.1、mh910495.1、mn886932.1、mn336500.2);口蹄疫病毒(fmdv)毒株的3d基因序列(登录号:fj175661.1、gu384683.1、dq989323.1、dq989308.1、fj175662.1、fj175665.1、mf372126.1、dq989320.1);猪繁殖与呼吸综合征病毒(prrsv)毒株的nsp2基因序列(登录号:nc_043487.1、ef635006.1、ef112445.1、ef641008.1、ay150564.1、mh500776.1、mn119307.1、kp771777.1);猪瘟病毒(csfv)毒株的5
´
utr基因序列(登录号:ay259122.1、hq380231.1、ay382481.1、kp233071.1、ky290453.1、kx064281.1、jx262391.1、hq148061.1、gu592790.1、gq923951.1);猪伪狂犬病病毒(prv)毒株的ge基因序列(登录号:fj605132.1、jf797219.1、jf797219.1、ku937306.1、jf460026.1、af171937.1、af403049.1、kp098534.1、eu561349.1)。用beacon designer 8软件分别对上述不同病毒的保守区域设计引物和探针各3组,将设计得到的引物和探针分别进行blast验证(http://blast.ncbi.nlm.nih.gov/),确保其特异性。探针的5
´
端标记不同的荧光基团,以实现5通道同步检测,具体的,asfv检测探针的5
´
端标记的荧光报告基团为texas-red;fmdv检测探针的5
´
端标记的荧光报告基团为cy5;csfv检测探针的5
´
端标记的荧光报告基团为fam;hp-prrsv检测探针的5
´
端标记的荧光报告基团为vic;prv野毒检测探针的5
´
端标记的荧光报告基团为cy5.5。
[0037]
asfv的正向引物(asfv-f)、反向引物(asfv-r)和检测探针(asfv-p)的核苷酸序列
如表1所示:如表1所示:fmdv的正向引物(fmdv-f)、反向引物(fmdv-r)和检测探针(fmdv-p)的核苷酸序列如表2所示:
csfv的正向引物(csfv-f)、反向引物(csfv-r)和检测探针(csfv-p)的核苷酸序列如表3所示:hp-prrsv的正向引物(hp-prrsv-f)、反向引物(hp-prrsv-r)和检测探针(hp-prrsv-p)的核苷酸序列如表4所示:
prv野毒的正向引物(prv野毒-f)、反向引物(prv野毒-r)和检测探针(prv野毒-p)的核苷酸序列如表5所示:2. 毒株和临床样品本发明中使用非洲猪瘟病毒(asfv)b646l基因质粒标准物质(国家二级标准物质,编号
gbw(e)091034)、猪瘟病毒(csfv,c株)核酸标准物质(国家二级标准物质,编号gbw(e)091014)、猪伪狂犬病毒(prv)标准毒株(容a株)(购自中国兽医药品监察所)、猪繁殖与呼吸综合征病毒欧洲株(prrsv lv)核酸标准物质(国家二级标准物质,gbw(e)090928)、猪繁殖与呼吸综合征病毒美洲变异株(prrsv jxa1)核酸标准物质(国家二级标准物质,gbw(e)090929)、猪繁殖与呼吸综合征病毒美洲经典株(prrsv vr2332)核酸标准物质(国家二级标准物质,gbw(e)090930);口蹄疫病毒(fmdv)a型、o型、asia i 型标准抗原购自中国农业科学院兰州兽医研究所;猪伪狂犬活疫苗(bartha-k61株)(购自武汉科前生物股份有限公司)、猪传染性胃肠炎病毒-猪流行性腹泻病毒-猪轮状病毒(g5型)三联活疫苗(弱毒华株+弱毒cv777株+nx株)(购自吉林正业生物制品股份有限公司)、猪乙型脑炎活疫苗(sa14-14-2株)(购自中牧实业股份有限公司);临床样品:收集于北京地区养猪场250份临床样品,包括血液样品100份,组织样品50份,饲料样品100份;asfv阳性样本核酸:从猪asfv阳性血液中提取血液样本核酸6份,从猪asfv阳性组织中提取组织样本核酸9份,采用磁珠法进行核酸提取,按照tguide s32磁珠法病毒dna/rna提取试剂盒(购自天根生化科技(北京)有限公司,货号dp604)操作说明书进行的核酸提取,由本实验室保存;fmdv模拟临床样品:选择临床采集的fmdv阴性的18份猪血液样品分别与不同浓度的a型和o型fmdv标准抗原混合,制备fmdv模拟临床样本,其中制备得a型fmdv模拟阳性样本9份(稀释10倍、100倍、1000倍各3份),o型fmdv模拟阳性样本9份(稀释10倍、100倍、1000倍各3份)。
[0038]
3. 病毒基因组的提取使用tguide s32磁珠法病毒dna/rna提取试剂盒(购自天根生化科技(北京)有限公司,货号dp604),根据产品说明书进行病毒dna/rna提取,提取的dna和rna置于-80℃冰箱保存备用。
[0039]
4. 扩增模板的制备和定值asfv、fmdv-o型、csfv、hp-prrsv(jxa1)、prv野毒分别选用非洲猪瘟病毒b646l基因质粒标准物质、fmdv-o型标准抗原、猪瘟病毒(csfv,c株)核酸标准物质、猪繁殖与呼吸综合征病毒美洲变异株(prrsv jxa1)核酸标准物质及猪伪狂犬病毒(prv)标准毒株经按上述步骤3进行核酸提取、数字pcr定值后的核酸为扩增模板,其浓度分别为5.8
×
10
4 copies/μl、8.1
×
10
4 copies/μl、5.1
×
10
4 copies/μl、9.7
×
10
4 copies/μl、7.6
×
10
4 copies/μl,置于-80℃冰箱保存备用。
[0040]
(1)asfv、prv野毒核酸数字pcr定值:ddpcr反应体系包括2
×
ddpcr supermix 10μl,dna模板2μl,正向引物(10pmol/μl)1.8μl,反向引物(10pmol/μl)1.8μl,检测探针(10pmol/μl)0.5μl,dnase-free water(无dna酶水)3.9μl,总体积为20μl。其中,asfv和prv野毒正向引物、反向引物及检测探针如表6所示。
[0041]
将配置的ddpcr反应液转入微滴生成卡中,利用微滴生成仪生成微滴;将微滴转入pcr板中,置于pcr仪中按如下反应程序进行扩增:95℃预变性10min;94℃变性30s,52℃退火30s(注:asfv退火温度为52℃,prv退火温度为60℃),40个循环;98℃酶失活10min;4℃保存,升降温速率2℃/s。
[0042]
扩增完成后将pcr板置于微滴分析仪中进行荧光读取,计算目的核酸片段含量。
[0043]
(2)fmdv、csfv、hp-prrsv核酸数字pcr定值:rt-ddpcr反应体系包括supermix5μl,reverse transcriptase(逆转录酶)2μl ,300mm dtt 1μl,dna模板2.2μl,正向引物(10pmol/μl)1.8μl,反向引物(10pmol/μl)1.8μl,检测探针(10pmol/μl)0.5μl,dnase-free water 9.5μl,总体积为22μl。具体的,supermix是用于高效 pcr 扩增的 dna 聚合酶、盐、镁离子和 dntp 的即用型混合物,其中,fmdv、csfv、hp-prrsv 正向引物、反向引物及检测探针如表7所示。
[0044]
将配置的ddpcr反应液转入微滴生成卡中,利用微滴生成仪生成微滴;将微滴转入pcr板中,置于pcr仪中按如下反应程序进行扩增:42℃反转录1h,95℃预变性10min;95℃变性30s,55℃退火30s(注:fmdv、hp-prrsv退火温度为55℃,csfv退火温度为60℃),40个循环;98℃酶失活10min;4℃保存,升降温速率2℃/s。
[0045]
扩增完成后将pcr板置于微滴分析仪中进行荧光读取,计算目的核酸片段含量。
[0046]
5. 引物、检测探针筛选分别采用荧光定量pcr方法以步骤3制备的asfv、fmdv、csfv、hp-prrsv、prv野毒核酸为模板,利用步骤1设计合成的五种病毒的引物和检测探针进行扩增,根据其ct值的大小筛选最优引物/检测探针,ct值越小的引物/检测探针为最优引物/检测探针。
[0047]
筛选引物/检测探针所用pcr反应体系组分为:多重预混液5μl,模板2μl,正向引物(10pmol/μl)0.4μl,反向引物(10pmol/μl)0.4μl,探针(10pmol/μl)0.4μl,rnase-free water(无rna酶水) 11.8 μl,总体积为20 μl。其中,多重预混液至少包括反转录酶、dna聚合酶混合物、dntps、mgcl2、rna酶抑制剂,于本实施例中,多重预混液为购买的新型一步法多重rt-qpcr预混液(4
ⅹ
reliance one-step multiplex rt-qpcr supermix)。
[0048]
筛选引物/检测探针所用pcr反应条件为:50℃反转录5min,95℃预变性10 min;95℃变性10s,57℃退火延伸30s,40个循环;通过比较asfv、fmdv、csfv、hp-prrsv、prv野毒五种病毒的a、b、c 3组引物/检测探针(即实施例1所设计的)对特定浓度的扩增模板进行荧光定量pcr扩增ct值的高低,选择最佳引物/检测探针组合。如图1所示的asfv引物、检测探针筛选的荧光定量pcr扩增结果图中c组的ct值最低,为22.86,因此选c组为asfv最佳引物/检测探针组合;如图2所示的fmdv引
物、检测探针筛选的荧光定量pcr扩增结果图中a组的ct值最低,为24.07,因此选a组为fmdv最佳引物/检测探针组合;如图3所示的csfv引物、检测探针筛选的荧光定量pcr扩增结果图中a组的ct值最低,为19.96,因此选a组为csfv最佳引物/检测探针组合;如图4所示的hp-prrsv引物、检测探针筛选的荧光定量pcr扩增结果图中a组的ct值最低,为23.52,因此选c组为hp-prrsv最佳引物/检测探针组合;如图5所示的prv野毒的引物、检测探针筛选的荧光定量pcr扩增结果图中c组的ct值最低,为21.07,因此选c组为prv野毒最佳引物/检测探针组合。
[0049]
筛选得到的最优引物/检测组合如表8所示:6.五重荧光定量pcr引物、检测探针浓度的确定步骤3制备的asfv、fmdv、csfv、hp-prrsv、prv野毒核酸各取10μl,均匀混合后为pcr扩增模板,以上述步骤5筛选出的最优引物/检测探针组合作为引导,进行五重荧光定量pcr检测。
[0050]
筛选引物浓度所用pcr反应体系组包括:多重预混液5μl,混合模板2μl,具体的,混合模板包括阳性对照品核酸、样品核酸和阴性对照品,asfv-p(10 pmol/μl)0.4μl、fmdv-p(10 pmol/μl)0.4μl、csfv-p(10 pmol/μl)0.4μl、hp-prrsv-p(10 pmol/μl)0.4μl以及prv野毒-p(10 pmol/μl)0.4μl,asfv、fmdv、csfv、hp-prrsv以及prv野毒 f/r(50 pmol/μl)各0.05-0.3μl,以0.05μl为梯度递增进行正交试验,其余用rnase-free water(无rna酶水)补齐至20 μl。
[0051]
筛选引物浓度所用pcr反应条件为:50℃反转录5min,95℃ 预变性10 min;95℃变性10s,57℃退火延伸30s,40个循环;以ct值、相对荧光单位(rfu)、扩增效率、重复性和平台期等因素作为综合判定依据,具
体的,判定选择ct值低、rfu值相近、扩增效率高、扩增曲线有明显的平台期以及重复性好的引物浓度,确定最佳引物终浓度为:asfv-f(0.125 pmol/μl)、asfv-r(0.125 pmol/μl)、fmdv-f(0.375 pmol/μl)、fmdv-r(0.375 pmol/μl)、csfv-f(0.25 pmol/μl)、csfv-r(0.25 pmol/μl)、hp-prrsv-f(0.375 pmol/μl)、hp-prrsv-r(0.375 pmol/μl)、prv野毒-f(0.375 pmol/μl)、prv野毒-r(0.375 pmol/μl)。
[0052]
步骤3制备的asfv、fmdv、csfv、hp-prrsv、prv野毒核酸各取10μl,均匀混合后为pcr扩增模板,以上述步骤5筛选出的最优引物/检测探针组合作为引导,进行五重荧光定量pcr检测。
[0053]
筛选检测探针浓度所用pcr反应体系组分为:多重预混液5μl,混合模板2μl,其中,混合模板为前述asfv、fmdv、csfv、hp-prrsv、prv野毒核酸各取10μl均匀混合后的混合液,asfv-f(10 pmol/μl)0.25μl、asfv-r(10 pmol/μl)0.25μl 、fmdv-f(10 pmol/μl)0.75μl、fmdv-r(10 pmol/μl)0.75μl 、csfv-f(10 pmol/μl)0.5μl、csfv-r(10 pmol/μl)0.5μl、hp-prrsv-f(10 pmol/μl)0.75μl、hp-prrsv-r(10 pmol/μl)0.75μl、prv野毒-f(00 pmol/μl)0.75μl、prv野毒-r(10 pmol/μl)0.75μl,asfv、fmdv、csfv、hp-prrsv以及prv野毒探针各(10 pmol/μl)0.2-1.4μl,以0.2μl为梯度递增进行正交试验,其余用rnase-free water补齐至20 μl。
[0054]
筛选引物浓度所用pcr反应条件为:50℃反转录5min,95℃ 预变性10 min;95℃变性10s,57℃退火延伸30s,40个循环。
[0055]
以ct 值、相对荧光单位(rfu)、扩增效率、重复性和平台期等因素作为综合判定依据,具体判定规则与引物浓度判定规则相同,确定最佳检测探针终浓度为:asfv-p(0.1 pmol/μl)、fmdv-p(0.6 pmol/μl)、csfv-p(0.2 pmol/μl)、hp-prrsv-p(0.4 pmol/μl)、prv野毒-p(0.4 pmol/μl)。
[0056]
7.五重荧光定量pcr退火温度的优化步骤3制备的asfv、fmdv、csfv、hp-prrsv、prv野毒核酸各取10μl,均匀混合后为pcr扩增模板,进行五重荧光定量pcr扩增。退火温度分别设置为50.6℃、51.3℃、52.6℃、54.5℃、56.9℃、58.9℃、60℃、60.6℃,筛选最佳退火温度。
[0057]
筛选退火温度所用pcr反应体系组分为:多重预混液5μl,混合模板2μl,其中,混合模板为前述步骤3制备的asfv、fmdv、csfv、hp-prrsv、prv野毒核酸各取10μl的均匀混合物,asfv-f(10 pmol/μl)0.25μl、asfv-r(10 pmol/μl)0.25μl 、asfv-p (10 pmol/μl)0.2μl、fmdv-f(10 pmol/μl)0.75μl、fmdv-r(10 pmol/μl)0.75μl 、fmdv-p(10 pmol/μl)1.2μl 、csfv-f(10 pmol/μl)0.5μl、csfv-r(10 pmol/μl)0.5μl、csfv-p(10 pmol/μl)0.4μl、hp-prrsv-f(10 pmol/μl)0.75μl、hp-prrsv-r(10 pmol/μl)0.75μl、hp-prrsv-p(10 pmol/μl)0.8μl、prv野毒-f(10 pmol/μl)0.75μl、prv野毒-r(10 pmol/μl)0.75μl、prv野毒-p(10 pmol/μl)0.8μl,rnase-free water 3.6μl,总体积20μl。
[0058]
筛选引物浓度所用pcr反应条件为:50℃反转录5min,95℃ 预变性10 min;95℃变性10s,50.6℃~60.6℃退火延伸30s,40个循环。
[0059]
根据不同退火温度下asfv、fmdv、csfv、hp-prrsv、prv野毒ct值和相对荧光单位(rfu)大小进行综合判定,选择最佳退火温度,结果如表9所示,退火温度在56.9℃时,asfv、fmdv、csfv、hp-prrsv、prv野毒扩增ct值相对较小且rfu相差较小,因此五重荧光定量pcr的
最佳退火温度为56.9℃。
[0060]
8. 五重荧光定量pcr检测方法的建立在上述引物和检测探针的引导下建立五重荧光定量pcr检测方法,检测体系见表10:表10 五重荧光定量pcr反应体系试剂体积(μl)多重预混液5asfv-f(10pmol/μl)0.25asfv-r(10pmol/μl)0.25asfv-p(10pmol/μl)0.2fmdv-f(10pmol/μl)0.75fmdv-r(10pmol/μl)0.75fmdv-p(10pmol/μl)1.2csfv-f(10pmol/μl)0.5csfv-r(10pmol/μl)0.5csfv-p(10pmol/μl)0.4hp-prrsv-f(10pmol/μl)0.75hp-prrsv-r(10pmol/μl)0.75hp-prrsv-p(10pmol/μl)0.8prv野毒-f(10pmol/μl)0.75prv野毒-r(10pmol/μl)0.75prv野毒-p(10pmol/μl)0.8rnase-free双蒸水3.6模板2合计20反应条件为:50℃反转录5min,95℃ 预变性10 min;95℃变性10s,56.9℃退火延伸
30s,40个循环。
[0061]
实施例2:五重荧光定量pcr检测方法灵敏度验证将实施例1制备的经数字pcr定值后的asfv(5.8
×
10
4 copies/μl)、fmdv(8.1
×
10
4 copies/μl)、csfv(5.1
×
10
4 copies/μl)、hp-prrsv(9.7
×
10
4 copies/μl)、prv野毒(7.6
×
10
4 copies/μl)核酸各取10μl混合均匀(浓度分别为:1.16
×
10
4 copies/μl、1.62
×
10
4 copies/μl、1.02
×
10
4 copies/μl、1.94
×
10
4 copies/μl、1.52
×
10
4 copies/μl)后进行10倍、100倍、1000倍、10000倍系列稀释后作为模板进行五重荧光定量pcr检测,每个梯度重复3次,计算五重荧光定量pcr方法的最低检测限和线性关系。扩增结果如图6和表11所示,asfv即texas red通道标准曲线(编号1-texas red)回归方程为y=
ꢀ-
3.251x+40.547,相关系数(r2)为0.990,扩增效率(e)为103.1%,稀释1000倍仍能全部检出,即最低检测限为11.6 copies/μl;fmdv即cy5通道标准曲线(编号2-cy5)回归方程为y=
ꢀ-
3.407x+35.813,相关系数(r2)为0.997,扩增效率(e)为96.6%,稀释10000倍仍能全部检出,即最低检测限为1.62 copies/μl;csfv即fam通道标准曲线(编号3-fam)回归方程为y=
ꢀ-
3.529x+37.614,相关系数(r2)为0.997,扩增效率(e)为92%,稀释1000倍仍能全部检出,即最低检测限为10.2 copies/μl;hp-prrsv即vic通道标准曲线(编号4-vic)回归方程为y=
ꢀ-
3.168x+40.203,相关系数(r2)为0.996,扩增效率(e)为106.9%,稀释10000倍仍能全部检出,即最低检测限为1.94 copies/μl;prv野毒即cy5.5通道标准曲线(编号5-cy5.5)回归方程为y=
ꢀ-
3.286x+35.025,相关系数(r2)为0.996,扩增效率(e)为101.5%,稀释10000倍仍能全部检出,即最低检测限为1.52 copies/μl。以上结果表明五重荧光定量pcr方法相关系数(r2)均在0.99以上,扩增效率均在90%~110%之间,表明asfv、fmdv、csfv、hp-prrsv、prv野毒标准品的起始模板数和ct值之间均呈现良好的线性关系,且具有较高的灵敏度。
[0062]
表11 五重荧光定量pcr方法最低检测限稀释倍数asfvfmdvcsfvhp-prrsvprv野毒03/33/33/33/33/3103/33/33/33/33/31003/33/33/33/33/310003/33/33/33/33/3100001/33/32/33/33/3实施例3 :五重荧光定量pcr检测方法特异性验证将fmdv(a型、o型、亚洲ⅰ型)、prrsv(lv株、jxa1株、vr2332株)、csfv(c株)、prv标准毒株、prv疫苗株(bartha
ꢀ-
k61株)、tgev-pedv-porv按实施例1步骤3进行核酸提取后同asfv阳性样本核酸共同做为模板,进行五重荧光定量pcr检测。
[0063]
检测结果如图7所示,除asfv(编号1)、fmdv-a(编号2)、fmdv-o(编号3)、fmdv-亚洲ⅰ(编号4)、prrsv-jxa1(编号5)、csfv(编号6)、prv野毒(编号7)检出外,其他病毒(编号8-10)均未检出,表明该方法与其他病毒无交叉反应,可特异性地检测asfv、fmdv、hp-prrsv、csfv及prv野毒。
[0064]
实施例4 :五重荧光定量pcr检测方法重复性验证将实施例1制备的经数字pcr定值后的asfv(5.8
×
10
4 copies/μl)、fmdv(8.1
×
10
4 copies/μl)、csfv(5.1
×
10
4 copies/μl)、hp-prrsv(9.7
×
10
4 copies/μl)、prv野毒(7.6
×
10
4 copies/μl)核酸各取10μl混合均匀(浓度分别为:1.16
×
10
4 copies/μl、1.62
×
10
4 copies/μl、1.02
×
10
4 copies/μl、1.94
×
10
4 copies/μl、1.52
×
10
4 copies/μl)后进行10倍、100倍、1000倍、10000倍系列稀释后作为模板进行五重荧光定量pcr检测,每个梯度重复3次且不同时间段检测3次,计算ct值变异系数,评估该方法的组内和组间重复性。
[0065]
检测结果如表12所示,五重荧光定量pcr方法asfv、fmdv、csfv、hp-prrsv、prv野毒组内重复性、组间重复性的变异系数均小于5%,说明该方法组内重复性和组间重复性良好。
[0066]
实施例5:猪病毒的检测试剂检测试剂包括如实施例1所提供的引物组合和/或探针组合。
[0067]
实施例6:五重荧光定量pcr检测试剂盒组成及应用
试剂盒包括荧光定量pcr预混液、实施例4所提供的检测试剂、阳性对照品、阴性对照品。其中:(1)荧光定量pcr预混液:含有多重预混液、rnase-free 双蒸水;多重预混液至少包括反转录酶、dna聚合酶混合物、dntps、mgcl2、rna酶抑制剂,于本实施例中,多重预混液采用购自bio-rad,货号12010176的4
×
reliance one-step multiplex supermix。
[0068]
(2)检测试剂:包括实施例5设计的检测试剂;具体的,可以是独立包装的各引物及探针,也可以是分开包装的引物组合和探针组合,还可以是配置好的含有引物组合和探针组合的混合液。当试剂盒中的检测试剂为分开包装的引物组合和探针组合时,或者为配置好的含有引物组合和探针组合的混合液时,多重预混液、无rna酶双蒸水、各引物、检测探针的浓度和体积比均按表10中的浓度和体积比配置。
[0069]
(3)阳性对照品:为非洲猪瘟病毒(asfv)b646l基因质粒标准物质、o型口蹄疫病毒(fmdv)标准抗原、猪瘟病毒(csfv,c株)核酸标准物质、猪繁殖与呼吸综合征病毒美洲变异株(prrsv jxa1)核酸标准物质、猪伪狂犬病病毒(prv)标准毒株混合液。本发明中所用的阳性对照品中的非洲猪瘟病毒(asfv)、猪瘟病毒(csfv)高致病性猪繁殖与呼吸综合征病毒(hp-prrsv)均采用国家认证的核酸标准物质,即非洲猪瘟病毒b646l基因质粒标准物质、猪瘟病毒(csfv,c株)核酸标准物质、猪繁殖与呼吸综合征病毒美洲变异株(prrsv jxa1)核酸标准物质,并且通过数字pcr对以上标准物质及o型口蹄疫病毒(fmdv)标准抗原、猪伪狂犬病病毒(prv)标准毒株的目的核酸片段含量进行标定,以此为阳性对照可实现从核酸提取、扩增及结果读取等等整个检测过程的监测。
[0070]
(4)阴性对照品:rnase-free 双蒸水,购自生工生物工程(上海)有限公司,货号b541018。
[0071]
试剂盒的应用包括以下步骤:(1)核酸提取:按所用的商品化核酸提取试剂盒说明书进行核酸提取,同时提取阳性对照品与检测样品的核酸,分别获得阳性对照品核酸与样品核酸。
[0072]
(2)五重荧光定量pcr反应液的配制:根据待检测样本总数,设定所需要的pcr反应管的管数为n,则n=样品数+阴性对照1管+阳性对照1管,且当样品数每满7份,多配制1份。五重荧光定量pcr单份18μl反应体系配制为pcr预混液8.6μl,引物组合与探针组合共9.4μl;将配制的反应液分装至荧光定量pcr反应管中,每管18μl。
[0073]
(3)加样:将阴性对照品与步骤(1)提取的样品核酸、阳性对照品核酸各取2μl,分别加入相应的反应管中,盖好管盖,混匀,瞬时离心,应避免气泡。
[0074]
(4)pcr扩增:将步骤(3)中的反应管置于荧光定量pcr仪中进行扩增,反应条件为:50℃反转录5min,95℃ 预变性10 min;95℃变性10s,56.9℃ 退火延伸30s,40个循环。
[0075]
(5)结果判定:1)阳性对照品ct值<30且呈现“s”型扩增曲线,阴性对照品无ct值且无扩增曲线,当满足以上要求时实验成立。
[0076]
2)样品在asfv-p的5
´
端所标记的荧光报告基团所对应的通道texas red在40个循环内即ct值≤40,且出现“s”型扩增曲线,则认为asfv阳性;样品在fmdv-p的5
´
端所标记的荧光报告基团所对应的通道cy5在40个循环内即ct值≤40,且出现“s”型扩增曲线,则认为fmdv阳性;
样品在csfv-p的5
´
端所标记的荧光报告基团所对应的通道fam在40个循环内即ct值≤40,且出现“s”型扩增曲线,则认为csfv阳性;样品在hp-prrsv-p的5
´
端所标记的荧光报告基团所对应的通道vic在40个循环内即ct值≤40,且出现“s”型扩增曲线,则认为hp-prrsv阳性;样品在prv野毒-p的5
´
端所标记的荧光报告基团所对应的通道cy5.5在40个循环内即ct值≤40,且出现“s”型扩增曲线,则认为prv阳性;3)样品在texas red、cy5、fam、vic、cy5.5通道无ct值或“s”型扩增曲线,则判定为阴性。
[0077]
实施例7:五重荧光定量pcr检测试剂盒临床应用将本实验室收集的来自北京地区养猪场的250份临床样品(血液样品100份,组织样品50份,饲料样品100份)和实施例1制备的fmdv模拟临床样品18份,按实施例1步骤3进行核酸提取后,以及本实验室保存的asfv阳性样本核酸15份(阳性血液核酸6份,阳性组织核酸9份)采用包含有实施例5所提供的五重荧光定量pcr检测试剂盒进行检测,并与商品化试剂盒或标准方法进行比较,计算符合率。
[0078]
检测结果如表13和表14所示,五重荧光定量pcr方法asfv 15份阳性样本核酸全部检出,与《非洲猪瘟病毒检测操作规程(试行)》“非洲猪瘟核酸检测技术(方法一)”规定的实时荧光pcr检测方法符合率为100%;fmdv 18份模拟临床样品全部检出、检测出csfv 13份阳性、hp-prrsv 26份阳性,与商品化试剂盒(猪瘟/高致病性蓝耳/口蹄疫核酸检测试剂盒pcr-荧光探针法,购自广州达安基因生物科技有限公司)符合率100%;检测出prv野毒 7份阳性,与商品化试剂盒(猪伪狂犬病毒(ge基因)实时荧光pcr检测试剂盒,购自北京世纪元亨动物防疫技术有限公司)符合率100%。以上结果表明本发明试剂盒临床样品检测效果良好。
[0079]
*为模拟临床阳性样品综上,本发明提供了一种引物组合、探针组合及其在检测猪病毒中的应用、检测试剂、试剂盒及检测方法,可在单管中同时检测asfv、fmdv、prrsv、csfv及prv野毒五种不同核酸类型猪病毒,操作快速简单、特异性强、灵敏度高、重复性好、符合率高,可应用于asfv、fmdv、prrsv、csfv及prv野毒的准确检疫与筛查,有利于生猪健康养殖和疫病的监测与防控。
[0080]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1