一种副溶血弧菌裂解酶、其编码基因及其应用
1.本发明涉及生物技术领域,具体涉及一种副溶血弧菌裂解酶、其编码基 因及其在裂解副溶血弧菌中的应用。
背景技术:
2.副溶血弧菌(v.parahaemolyticus)是一种嗜盐性革兰氏阴性菌,是 世界范围内重要的食源性致病菌,主要分布在海洋环境中。食用受副溶血弧 菌污染的海产品会引起肠胃功能紊乱产生腹泻、恶心的症状,在严重的情况 下会导致死亡。副溶血弧菌已经成为水产养殖业的一种生物危害,人类通过 使用抗生素来防止污染。随着抗生素的使用导致细菌多重抗生素耐药性的迅 速蔓延,使抗生素再起作用。随着广泛耐药的细菌性病原体的出现,噬菌体 疗法和其他替代或额外的治疗方式重新受到重视。噬菌体是抗生素很有前途 的替代品,因为它们能够消化细菌细胞壁的肽聚糖,促进其渗透裂解。
3.噬菌体是地球上最丰富的生物实体,噬菌体的广泛性和多样性为筛选各 种目的的噬菌体提供了广泛的资源,不仅包括抗菌治疗,而且还包括消毒、 感染控制、检测和诊断等。细菌存在的地方都发现了噬菌体,多达70%的海 洋细菌可能被噬菌体感染。早在青霉素被发现之前,噬菌体就被用来控制微 生物种群。此外,噬菌体是高度免疫原性的药物,可降低其重复使用的有效 性。噬菌体抑菌被认为是一种环境友好的做法,在减少和控制水产养殖中耐 药副溶血性弧菌方面具有巨大潜力。
4.目前,关于噬菌体裂解酶的应用主要是裂解革兰氏阳性菌,比如金黄色 葡萄球菌、李斯特菌、肠球菌等;在革兰氏阴性菌的细胞结构中,其肽聚糖 层外存在一层细胞外膜结构,该结构阻碍噬菌体裂解酶进入细菌,无法裂解 细菌,因此细胞外膜松散剂可以作为透膜剂协助裂解酶进入革兰氏阴性菌发 挥裂菌作用。
技术实现要素:
5.本发明所要解决的技术问题是提供一种副溶血弧菌裂解酶及其编码基 因和应用。
6.本发明解决上述技术问题的技术方案如下:一种副溶血弧菌裂解酶,所 述副溶血弧菌裂解酶的氨基酸序列如seq id no:1所示。
7.本发明还提供了一种副溶血弧菌裂解酶编码基因,该基因编码具有seqid no:1所示序列的蛋白质。
8.进一步,所述副溶血弧菌裂解酶编码基因的核苷酸序列如seq id no:2 所示。
9.本发明还提供了一种重组载体,包括上述副溶血弧菌裂解酶编码基因。
10.所述重组载体为将上述编码基因插入出发载体(如pet
‑
28a(+))的多克 隆位点得到的重组表达载体。
11.本发明还提供了一种转化体,包括上述重组载体。
12.转化体可以为重组菌,例如,将上述编码基因插入出发载体(如 pet
‑
28a(+)载体)
的多克隆位点得到的重组表达载体转化至大肠杆菌,得到 重组菌。
13.本发明还提供了上述副溶血弧菌裂解酶在裂解副溶血弧菌中的应用。
14.本发明的有益效果是:本发明提供了一种副溶血弧菌裂解酶及其编码基 因,该副溶血弧菌裂解酶能够裂解副溶血弧菌,对副溶血弧菌的特异性高、 裂解效率高,且副溶血弧菌的宿主谱广泛。
附图说明
15.图1为本发明副溶血弧菌噬菌体f23s1电镜图;
16.图2为本发明副溶血弧菌噬菌体f23s1在不同moi值条件下对副溶血弧 菌f23裂菌能力结果图;
17.图3为本发明纯化的副溶血弧菌裂解酶的sds
‑
page图,其中为阴性对 照;mv为marker;16和37分别为iptg诱导过程中的培养温度;npe和dpe 分别为超声处理后的天然蛋白提取物和变性蛋白提取物;strain no.1为 escherichia.coli de3;strain no.2:escherichia.coli ec+;
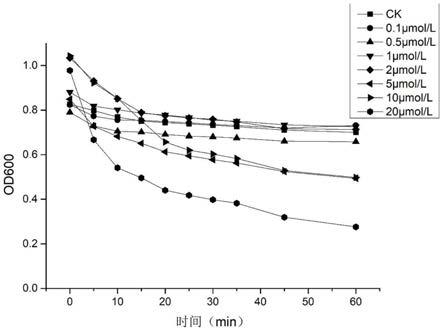
18.图4为不同浓度的副溶血弧菌裂解酶对副溶血弧菌f23的抑菌效果;
19.图5为副溶血弧菌裂解酶的宿主谱。
具体实施方式
20.以下结合附图及具体实施例对本发明的原理和特征进行描述,所举实例 只用于解释本发明,并非用于限定本发明的范围。
21.实施例1副溶血弧菌裂解酶的制备
22.1.1副溶血弧菌噬菌体f23s1的分离纯化及形态学观察
23.将从海鲜市场取样的样品与培养至对数期的副溶血弧菌f23过夜培养 12h~18h,经0.22μm微孔滤膜过滤,得到噬菌体原液。使用双层平板法纯 化噬菌体,连续纯化直到双层平板出现的噬菌斑大小、透明度一致,即为纯 化好的噬菌体,命名为副溶血弧菌噬菌体f23s1。将副溶血弧菌噬菌体f23s1 采用磷钨酸负染色后,置于投射电子显微镜下观察噬菌体形态,具体操作步 骤如下:铜网浸没于噬菌体液中10min之后用滤纸吸去多余液体,再将铜网 置于磷钨酸染料中染色自然晾干至完全干燥,制备好的铜网在透射电子显微 镜下观察噬菌体形态。
24.结果如图1所示:该噬菌体经透射电镜鉴定为长尾噬菌体。它有一个二 十面体的头和一条不可收缩且弯曲的长尾巴。头直径104.49nm,尾长157.26 nm。
25.1.2副溶血弧菌噬菌体f23s1的裂解曲线
26.取对数期副溶血弧菌菌液,连续十倍梯度稀释至105cfu/ml,取上述副 溶血弧菌噬菌体f23s1液连续十倍梯度稀释至108pfu/ml、107pfu/ml、10
6 pfu/ml、105pfu/ml、104pfu/ml、103pfu/ml,102pfu/ml,分别按照moi=1000、 100、10、1、0.1、0.01、0.001加入对应的实验组,并加入100μl105cfu/ml 的副溶血弧菌菌液混匀;另设阳性对照组加入100μl 105cfu/ml菌液, 100μl lb肉汤培养基;阴性对照组200μl lb肉汤培养基;酶标仪设定 参数,λ=600nm,t=37℃,开机之后要预热30min,每隔1h测定od600 值的变化。
27.通过感染副溶血性弧菌f23进一步研究了副溶血弧菌噬菌体f23s1的裂 解能力。
结果如图2所示,不同moi值的噬菌体对宿主细菌的抑制作用较对 照组显著。前3h的吸收值与初始值基本一致,说明该噬菌体在这段时间内 完全抑制了宿主细菌的生长。3h后,宿主菌生长缓慢,说明噬菌体f23s1 具有较强的裂解作用,但不能完全杀死宿主菌。
28.1.3副溶血弧菌噬菌体f23s1宿主谱测定
29.实验选择23株副溶血弧菌(atcc17802 atcc33846 f6 f7 f22 f23 vp27 vp33 vp41 vp44 460 461 469 470 474 475 485 486 056 0514 h128 h256 h512) 1株沙门氏菌(0819001)1株大肠杆菌(atcc25922)来做副溶血弧菌噬菌 体f23s1的宿主谱分析,具体步骤如下:
30.分别培养上述菌株至对数期。取100μl对数期上述菌液与100μl噬 菌体原液(噬菌体原液的制备方法为:取副溶血弧菌f23接种于5ml新鲜lb肉汤培养基中,37℃培养6h左右,取100μl上述菌液于20ml新鲜 lb肉汤培养基中,再加入100μl,4℃保存的噬菌体f23s1,混匀后37℃ 振荡培养箱中培养12h~18h使噬菌体增殖;取5ml增殖液于离心管中, 8000r/min离心15min去除细菌碎片,上清液用0.22μm滤膜过滤得噬菌 体原液)与3.8ml含有0.7%琼脂的lb肉汤培养基混合,倒入15ml下层 lb琼脂培养基(该培养基的成分为:胰蛋白胨10.0g/l、酵母提取物5.0g/l、 氯化钠10.0g/l、琼脂10.0g/l、ph值7.3
±
0.2;该培养基的使用方法 为:称取上述成分的lb琼脂培养基35.0g,加热搅拌溶解于1000ml蒸馏 水中,分装于试管或其它合适的容器中,121℃高压灭菌15min备用)上; 静置晾干约10min,待上层培养基凝固后,放入37℃恒温恒湿培养箱培养, 隔夜观察。
31.通过23种不同的副溶血性弧菌和少量沙门氏菌、大肠杆菌测定了f23s1 噬菌体的寄主范围。结果如下表1所示,副溶血弧菌噬菌体f23s1对副溶血 性弧菌有广泛的寄主范围,可不同程度地溶解57%(13/23)的分离株。对沙门 氏菌0819001和大肠杆菌atcc 25922均无裂解活性。副溶血弧菌噬菌体 f23s1对副溶血性弧菌具有高度特异性。
32.表1 副溶血弧菌噬菌体f23s1宿主谱的测定
33.[0034][0035]
1.4副溶血弧菌裂解酶编码基因获取
[0036]
取1ml副溶血弧菌噬菌体f23s1原液,加入脱氧核糖核酸酶dnaseⅰ(1 mg/ml)20μl,核糖核酸酶rnasea(10mg/ml)20μl,用小型涡旋仪涡 旋2min,37℃温育40min;加入20μl 2mol/l zncl2,37℃温育7min, 离心,10000r/min,1min;弃上清,加入500μl tes buffer,吹吸后至 澄清透明的状态,无白色颗粒物,65℃,15min(打散),加入10μl蛋 白酶k(20mg/ml),用枪头轻轻吹吸,上下颠倒,50℃温育1h,每隔10min 上下颠倒一下,此时溶液是澄清的。温育后冷却,加入60μl预冷的3mol/l ch3cook提前放4℃,用醋酸调ph至5.2),冰上放置15min,离心12000r/min, 10min,4℃,取上清,加入600μl苯酚/氯仿/异戊醇(体积比为:25: 24:1),上下轻柔反复颠倒200次,离心12000r/min,10min,常温,取 上层液体,加入1倍体积(约600μl)的异丙醇在
‑
20℃沉淀dna,上下颠 倒后,有絮状物即是dna,放置过夜。之后冷冻离心,4℃,12000r/min, 10min,弃上清,加入1ml70%(体积比)乙醇洗一次,吹吸,在12000r/min, 10min离心,弃上清,再离心1min,管子要按同一个方向,用白枪头小心 吸取
剩余乙醇,放在37℃培养箱至少风干40min,再加20μlte在常温 下溶解dna,静置30min。测序工作交于测序公司完成。
[0037]
应用ncbi的在线软件基本局部比对搜索工具blast protein对预测的 裂解酶相关基因进行逐个检索分析,得到副溶血弧菌噬菌体f23s1中存在的 副溶血弧菌裂解酶基因orf52,其核苷酸序列如seq id no:2所示:
[0038]
atggtcaagcaatggctatttacatgggtgctcgctttattggtgctgccgttctcttcgg ctgcatctttagttagcaacactcagtacgacaagtacatctacagggcatgggaagagtacgta ccagagacacaatgctggttatggctgaaggcgcaatactatcaagagagtttgctggacccgga agctactagccatgtgggagcgatgggattagctcagatcatgccgggaacgtggatagatgtta gtaagaaacttaagttcaatcctagagcatcaccgtacgaccctaagctctctatcgaagccgga gcgttctacttacgctaccagtggtcacagtggagagccaagcggacctttgaggatagaatcag tttagcctttgccggatacaacgctggcttaggcaacatactaaaagcacagcgcctgtcagggg gtcgggcagactggaagtcgattagttactttctaccggaggtcacgggagagagcagcaaagag actatccaatatgttgagcgtatctttcgctggaaaaagcaactggacgaacaccgaagttgtgc agtttactaa(seq id no:2)
[0039]
1.5重组质粒构建
[0040]
将预测得到的orf52在c端加上his标签,设计引物在orf52两侧引 入xho i和nco i限制性内切酶序列,将该片段与空载体pet28b(+)用xho i 和nco i 37℃双酶切过夜,将酶切产物在琼脂糖凝胶电泳上验证后回收,将 orf52与pet28b的双酶切产物混合,用t4 dna连接酶在16℃条件下过夜连 接,连接产物采用热击法转化至dh5α感受态细胞。挑取单菌落于lb培养 基中,过夜培养后送去测序,将序列正确的确定为阳性转化子。
[0041]
其中引物为orf52
‑
f和orf52
‑
r,核苷酸序列分别如seq id no:3和seq id no:2所示:
[0042]
orf52
‑
f:cgccatatgttggataaggtaatcggagtc(seq id no:3)
[0043]
orf52
‑
r:ccgctcgaggccgagggtgataacaat(seq id no:4)
[0044]
1.6重组副溶血弧菌裂解酶诱导表达与纯化
[0045]
将已经转化的感受态细胞加到含卡那霉素(50μg/ml)的lb琼脂培养基上 均匀涂开,37℃过夜培养。挑取含重组质粒的单菌落接种于含卡那霉素 (50μg/ml)的5ml lb培养基中,37℃过夜培养。取200μl转接于20ml 含抗性的lb培养基中,37℃培养至od600nm=0.6
‑
0.8,加入iptg(终 浓度1mm)后16℃过夜培养。用pbs重悬菌体,超声破碎细胞,分别取样 进行sds
‑
page验证表达情况。将镍柱平衡至室温,用洗涤液平衡后,将 收集的上清样品过柱,用含20mm咪唑的缓冲液冲洗镍柱,用250mm咪唑 的洗脱液洗脱目的蛋白,透析去除多余的咪唑,取样进行sds
‑
page检 测,其sds
‑
page图谱如图3所示。溶血弧菌裂解酶的氨基酸序列如seq id no:1所示:
[0046]
met val lys gln trp leu phe thr trp val leu ala leu leu val leu
[0047]
pro phe ser ser ala ala ser leu val ser asn thr gln tyr asp lys
[0048]
tyr ile tyr arg ala trp glu glu tyr val pro glu thr gln cys trp
[0049]
leu trp leu lys ala gln tyr tyr gln glu ser leu leu asp pro glu
[0050]
ala thr ser his val gly ala met gly leu ala gln ile met pro gly
[0051]
thr trp ile asp val ser lys lys leu lys phe asn pro arg ala ser
[0052]
pro tyr asp pro lys leu ser ile glu ala gly ala phe tyr leu arg
[0053]
tyr gln trp ser gln trp arg ala lys arg thr phe glu asp arg ile
[0054]
ser leu ala phe ala gly tyr asn ala gly leu gly asn ile leu lys
[0055]
ala gln arg leu ser gly gly arg ala asp trp lys ser ile ser tyr
[0056]
phe leu pro glu val thr gly glu ser ser lys glu thr ile gln tyr
[0057]
val glu arg ile phe arg trp lys lys gln leu asp glu his arg ser
[0058]
cys ala val tyr。
[0059]
实施例2副溶血弧菌裂解酶对副溶血弧菌f23的抗菌效果
[0060]
采用浊度法检测,接种宿主菌副溶血弧菌f23于lb液体培养基中过夜 生长,按1:100转接于25ml培养基中振荡培养3h,加入氯仿至终浓度0.5% (v/v),温和震荡后静置15min,采用无菌去离子水离心洗涤3次,将沉淀 重悬于含有0.1%triton x
‑
100的50mm tris
‑
hcl(ph 8.2)缓冲液中,并 调整od600nm为0.8
‑
1.0,将50μl裂解酶(终浓度为20、10、5、2、1、 0.5、0.1μm)加入至200μl细菌重悬液中,使用相同体积的含0.1%triton x
‑
100的trishcl缓冲液代替裂解酶作为对照,在600nm处测定其od值。结 果如图4所示,不同浓度的裂解酶均可有效裂解副溶血弧菌f23。
[0061]
实施例3副溶血弧菌裂解酶的宿主谱
[0062]
将实施例1中的23种副溶血弧菌和大肠杆菌和沙门氏菌分别进行副溶 血弧菌裂解酶的宿主谱验证,接种不同的菌于lb液体培养基中过夜生长, 按1:100转接于25ml培养基中振荡培养3h,加入氯仿至终浓度0.5%(v/v), 温和震荡后静置15min,采用无菌去离子水离心洗涤3次,将沉淀重悬于含 有0.1%triton x
‑
100的50mm tris
‑
hcl(ph 8.2)缓冲液中,并调整od600nm 为0.8
‑
1.0,将50μl裂解酶(终浓度为0.1μm)加入至200μl细菌重悬 液中,使用相同体积的含0.1%triton x
‑
100的tris
‑
hcl缓冲液代替裂 解酶作为对照,作用30min时观察并测定od600nm值,结果如图5所示, 副溶血弧菌裂解酶对23株不同种类的副溶血弧菌均有抑菌效果。
[0063]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明 的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发 明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1