一种快速提取革兰氏阴性菌基因组DNA的试剂盒及提取方法与流程
一种快速提取革兰氏阴性菌基因组dna的试剂盒及提取方法
技术领域
[0001]
本发明属于分子生物学技术领域,特别涉及一种快速提取革兰氏阴性菌基因组dna的试剂盒及提取方法。
背景技术:
[0002]
食品安全是全球高度关注的、直接关系民生的公共卫生安全问题,而食源性致病细菌是导致食品安全问题事件频发的主要原因之一,及时准确地检测出食品中的致病菌,加强对有害病菌的筛选和检测,有效防止食品污染,是控制食品中病原菌污染和各类传染病蔓延的根本措施。
[0003]
dna提取技术是食源性致病细菌的生物传感器检测技术的第一步骤,也是最关键的步骤,是否获得高纯度的dna,将直接关系下游实验的安全与成败。目前常用的细菌基因组dna提取方法主要有碱裂解法、酚-氯仿法等,这些方法普遍存在产物不纯、操作繁琐等问题,且无法摆脱对高速离心机的依赖。生物磁珠以其颗粒小、比表面积大、偶联容量大、悬浮稳定性好、有利于偶联反应顺利进行等优点,在核酸提取中备受青睐。
[0004]
常用的细菌基因组dna提取方法多采用酚、氯仿等有机试剂进行抽提,该方法存在有机试剂污染,无法摆脱对高速离心机的依赖,且存在产物不纯不高提取效率低等缺点。目前,商品化核酸提取试剂盒的使用具有方便、快捷、无需有机溶剂酚仿提取等优点,替代了传统的核酸提取方法。尤其是新近发展起来的基于磁珠的提取方法使得核酸纯化过程大为简化,是目前公认的核酸纯化的最佳方法,已经在欧美国家获得了广泛的应用,拥有巨大的市场。然而,已有的各种磁珠提取法对核酸的提取效率差别较大,因此有必要对磁珠法提取核酸技术进行改进。
[0005]
高效的提取革兰氏阴性菌基因组dna,为及时准确地检测出食品中的致病菌提供重要的技术保障,对促进我国食品安全具有重要意义。
技术实现要素:
[0006]
本发明的目的之一是提供一种快速提取革兰氏阴性菌基因组dna的试剂盒,利用该试剂盒提取的革兰氏阴性菌基因组dna片段完整性好、产率高、纯度高。
[0007]
本发明的目的之二是提供一种快速提取革兰氏阴性菌基因组dna的试剂盒的提取方法,在保证革兰氏阴性菌充分裂解的前提下缩短了提取时间,为提高提取效率提供保障。为了实现上述目的,本发明采取以下技术方案:一种快速提取革兰氏阴性菌基因组dna的试剂盒,包括多种工作液,各工作液的具体配制如下:工作液a中ctab质量浓度为0.5-1.0%,nacl浓度为1.5-3.5mol/l,triton-x-100质量浓度为1.0~2.0%,tris-hcl的浓度为50-120mmol/l,其ph7.0-8.0,edta浓度为8-25mmol/l,聚乙烯吡咯烷酮pvp质量浓度为0.5~1%,溶剂为无菌去离子水;工作液b中nacl浓度为1.0-2.0mol/l,异硫氰酸胍浓度为3-4.5mol/l,核糖核酸酶a浓
度为0.3-0.45mg/ml,柠檬酸钠浓度为0.07-0.lmol/l,溶剂为无菌去离子水;工作液c为乙醇溶液,其体积分数为60-75%;工作液d中tris-hcl浓度为10-15mmol/l,其ph7.0-8.0, 溶菌去离子水,工作液d的 ph为7.5-8.0;磁珠结合液中nacl浓度为0.5-1.5mol/l、盐酸胍浓度为1.2~1.8mol/l、无水乙醇体积比为20~30%、异丙醇体积比为30~60%,聚乙二醇质量分数为3%~10%的,聚乙二醇分子量为6000至8000,将磁珠悬浮在其中,所述磁珠结合液的ph值为5.0~6.5。
[0008]
所述磁珠为单分散、超顺磁性氧化硅纳米磁珠,磁珠粒径200-300nm,浓度为10 mg/ml。
[0009]
一种快速提取革兰氏阴性菌基因组dna的试剂盒的提取方法,主要包括细菌裂解、磁珠吸附、洗涤、洗脱步骤,具体如下:步骤一,取500μl 经30h培养的革兰氏阴性菌培养液加入离心管中,然后加入300μl工作液a,混匀,70℃裂解10分钟,使溶液澄清;步骤二,向上述离心管中加入300μl工作液b,上下颠倒用力混匀,室温静止5min,12000r/min离心5min;步骤三,吸取200μl离心后的水相上清液至另一干净离心管中,然后加入10μl磁珠结合液,混合均匀后室温静置3-5min,将离心管在磁力架上放置5min,磁分离至完全澄清,吸弃上清,将离心管从磁力架上取出;步骤四,加入500μl工作液c,混匀,将离心管在磁力架上放置3min,磁分离至完全澄清,尽量吸弃工作液c,然后从磁力架上取出离心管;步骤五,重复步骤四1次;步骤六,将离心管置于55℃恒温箱中干燥5-10min,至离心管内无残留液体;步骤七,加入100μl工作液d,混匀,悬浮磁珠,将离心管置于60-70℃水浴锅中8-10min;步骤八,从水浴锅中取出离心管,并置于磁力架上2min,待磁珠完全吸至离心管壁上后,小心吸取上清至新的离心管中,即获得dna产物。
[0010]
与现有技术相比,本发明具有以下优势:许多研究将生物样本的裂解与结合置于同一步骤中进行,虽然这种方法在理论上可缩短核酸提取时间,但是在裂解液与结合液的混合溶液环境中,核酸游离受杂质影响较大,导致核酸提取难度增大、效率降低 。本发明中工作液a的合理复配体系,可使生物样本充分裂解,裂解反应温度控制在60~70℃,裂解时间优选为10min,在保证革兰氏阴性菌充分裂解的前提下缩短了提取时间,为提高提取效率提供保障。同时,工作液b提供的高盐环境可破坏蛋白质的二级结构,使核酸-蛋白质复合物中的蛋白质迅速变性而与dna分离,达到清除蛋白质释放出游离核酸的目的。最后实现磁珠对dna的高效吸附,有效降低了杂质对核酸提取的影响,进而提高核酸提取效率和核酸纯度。使得本试剂盒提取出来的革兰氏阴性菌基因组dna片段完整性好、产率高、纯度高,更适合于pcr检测、核酸杂交及构建dna文库等下游分子生物学实验。具体阐述如下:相比现有技术,本发明工作液a针对革兰氏阴性菌的特性,该体系中表面活性剂与pvp、edta的合理复配体系,可以快速有效的裂解细菌,对样本中的蛋白质、脂类、碳水化合物、盐等杂质的沉降解离具有优异的效果,特别是对于革兰氏阴性菌等细胞壁含脂多糖的生物样
本,可有效提高核酸提取效率和核酸提取纯度。同时,该体系提供生物相容性较好的缓冲环境,防止基因组dna被破坏。
[0011]
工作液b体系中的异硫氰酸胍及高盐环境可破坏蛋白质的二级结构,使核酸-蛋白质复合物中的蛋白质迅速变性而与dna分离,达到清除蛋白质释放出游离核酸的目的。同时,工作液b中的核糖核酸酶a可以快速有效的降解体系中的rna,去除rna污染,进一步增加磁珠对dna的吸附量。
[0012]
磁珠对dna的高效吸附是本发明的关键技术。乙醇沉淀是回收样品中核酸的最常用方法,但是乙醇沉淀对样品中核酸回收率较低,异丙醇对dna的沉淀效率虽高于乙醇,但异丙醇沉淀的弊端是会沉淀大量的蛋白质和盐,影响产物纯度。本发明通过反复实验,摸索得到最佳的磁珠结合液复配体系的最佳比例及反应条件,该体系创造了高盐、低ph的疏水环境,该磁珠结合液增强了核酸与磁珠表面的疏水作用,促进磁珠对核酸的吸附作用,从而增强核酸提取效率。由于dna分子是带负电荷的,该体系中的na+可中和dna分子上的负电荷,使dna易于聚集沉淀,增加磁珠对dna的吸附量。同时,体系中的高盐浓度可破坏核酸表面亲水膜,形成疏水环境,利于核酸在磁珠表面的牢固吸附,以便有效地去除样本中残留的蛋白质、脂类、碳水化合物、盐等杂质。
[0013]
本发明的提取方法步骤简单,可快速完成整个提取流程,节约成本,适合高通量提取实验。
[0014]
本发明中所需其他试剂均为常规无毒试剂,成本低,提高了实验安全性。
附图说明
[0015]
图1为本发明方法提取的福氏志贺氏菌和出血性大肠埃希氏菌o157:h7基因组dna的琼脂糖凝胶电泳图:泳道1,2是提取的福氏志贺氏菌o157:h7基因组dna;泳道3,4是出血性大肠埃希氏菌提取的基因组dna,永道m为takara公司的dl5000 dna marker;图2为三种不同方法提取的大肠杆菌(o157:h7)基因组dna的琼脂糖凝胶电泳图,泳道1是酚-氯仿抽提法提取的出血性大肠埃希氏菌o157:h7基因组dna,泳道2是市售试剂盒法提取的出血性大肠埃希氏菌o157:h7基因组dna,泳道3是本发明试剂盒提取的出血性大肠埃希氏菌o157:h7基因组dna,泳道m是dl5000 dna marker。
具体实施方式
[0016]
本发明将通过以下实施例作进一步说明。
[0017]
本发明所述的工作液a、工作液b、工作液c和工作液d,为便于区分表述不同步骤所用缓冲液不同而命名,字母a、b、c、d本身没有含义。
[0018]
实施例1,一种快速提取革兰氏阴性菌基因组dna的试剂盒,包括多种工作液,各工作液的具体配制如下:(1)工作液a:质量浓度为0.8%的ctab、2.5mol/l nacl、质量浓度为2% triton-x-100、80mmol/l tris-hcl (ph7.0-8.0)、15mmol/l edta、质量浓度为1%pvp,溶剂为无菌去离子水。
[0019]
(2)工作液b:2.0mol/l nacl、4.0mol/l异硫氰酸胍、0.45mg/ml核糖核酸酶a、0.07mol/l柠檬酸钠,溶剂为无菌去离子水。
[0020]
(3)工作液c为乙醇溶液,其体积分数为70%。
[0021]
(4)工作液d:15mmol/l tris-hcl,其ph7.0-8.0;溶剂为无菌去离子水,ph8.0。
[0022]
(5)磁珠结合液:1.5mol/l nacl、1.2mol/l盐酸胍、体积比为20%的无水乙醇、体积比为30%的异丙醇、质量分数为7%的聚乙二醇8000,将10 mg/ml磁珠悬浮在其中,使用的磁珠为单分散、超顺磁性氧化硅纳米磁珠,磁珠粒径200-300nm,得ph 5.0的磁珠结合液。
[0023]
实施例2,一种快速提取革兰氏阴性菌基因组dna的试剂盒,包括多种工作液,各工作液的具体配制如下:(1)工作液a:质量浓度为0.5%的ctab、3.5mol/l nacl、质量浓度为1%的triton-x-100、50mmol/l tris-hcl (ph7.0-8.0)、25mmol/l edta、质量浓度为1%pvp,溶剂为无菌去离子水。
[0024]
(2)工作液b:1.5mol/l nacl、3.0mol/l异硫氰酸胍、0.40mg/ml核糖核酸酶a、0.1mol/l柠檬酸钠,溶剂为无菌去离子水。
[0025]
(3)工作液c为乙醇溶液,其体积分数为60%。
[0026]
(4)工作液d:15mmol/l tris-hcl,其ph7.0-8.0;溶剂为无菌去离子水,ph8.0。
[0027]
(5)磁珠结合液:0.5mol/l nacl、1.8mol/l盐酸胍、体积比为30%无水乙醇、体积比为60%异丙醇,质量分数为3%聚乙二醇7000,将10 mg/ml磁珠悬浮在其中,使用的磁珠为单分散、超顺磁性氧化硅纳米磁珠,磁珠粒径200-300nm,ph 5.0。
[0028]
实施例3,一种快速提取革兰氏阴性菌基因组dna的试剂盒,包括多种工作液,各工作液的具体配制如下:(1)工作液a:质量浓度为1.0%的ctab、1.5mol/l nacl、质量浓度为1% 的triton-x-100、120mmol/l tris-hcl (ph7.0-8.0)、8mmol/l edta、质量浓度为0.5%pvp,溶剂为无菌去离子水。
[0029]
(2)工作液b:1.0mol/l nacl、4.5mol/l异硫氰酸胍、0.3mg/ml核糖核酸酶a、0.08mol/l柠檬酸钠,溶剂为无菌去离子水。
[0030]
(3)工作液c为乙醇溶液,其体积分数为75%。
[0031]
(4)工作液d:10mmol/l tris-hcl,溶剂为无菌去离子水,ph8.0。
[0032]
(5)磁珠结合液:1.0mol/l nacl、1.5mol/l盐酸胍、体积比为20%无水乙醇、体积比为45%的异丙醇、质量分数为10%聚乙二醇6000,将10 mg/ml磁珠悬浮在其中,使用的磁珠为单分散、超顺磁性氧化硅纳米磁珠,磁珠粒径200-300nm,ph 5.0。
[0033]
上述实施例中所述的单分散、超顺磁性氧化硅纳米磁珠,可以采用专利号为:zl 2015 10488579.5,名称为:“作为磁标记材料的二氧化硅包覆四氧化三铁纳米团簇及其制备方法”中公开的磁珠。
[0034]
实施例4,用上述实施例1制备的提取革兰氏阴性菌基因组dna的试剂盒提取福氏志贺氏菌基因组dna的提取方法,主要包括细菌裂解、磁珠吸附、洗涤、洗脱步骤,具体如下:(1)取500μl 经30h培养的福氏志贺氏菌培养液加入离心管中,然后加入300μl工作液a,混匀,70℃裂解10分钟,使溶液澄清。
[0035]
(2)向上述离心管中加入300μl工作液b,上下颠倒用力混匀,室温静止5min,12000r/min离心5min。
[0036]
(3)吸取200μl离心后的水相上清液至另一干净离心管中,然后加入10μl磁珠结合
液,混合均匀后室温静置3-5min,将离心管在磁力架上放置5min,磁分离至完全澄清,吸弃上清,将离心管从磁力架上取出。
[0037]
(4)加入500μl工作液c,混匀,将离心管在磁力架上放置3min,磁分离至完全澄清,尽量吸弃工作液c,然后从磁力架上取出离心管。
[0038]
(5)重复步骤四1次。
[0039]
(6)将离心管置于55℃恒温箱中干燥5-10min,至离心管内无残留液体。
[0040]
(7)加入100μl工作液d,混匀,悬浮磁珠,将离心管置于60-70℃水浴锅中8-10min。
[0041]
(8)从水浴锅中取出离心管,并置于磁力架上2min,待磁珠完全吸至离心管壁上后,小心吸取上清至新的离心管中,即获得dna产物。
[0042]
实施例5,用上述实施例1制备的提取革兰氏阴性菌基因组dna的试剂盒提取出血性大肠埃希氏菌o157:h7基因组dna的提取方法,主要包括细菌裂解、磁珠吸附、洗涤、洗脱步骤,具体如下:(1)取500μl 经30h培养的出血性大肠埃希氏菌o157:h7培养液加入离心管中,然后加入300μl工作液a,混匀,70℃裂解10分钟,使溶液澄清。
[0043]
(2)向上述离心管中加入300μl工作液b,上下颠倒用力混匀,室温静止5min,12000r/min离心5min。
[0044]
(3)吸取200μl离心后的水相上清液至另一干净离心管中,然后加入10μl磁珠结合液,混合均匀后室温静置3-5min,将离心管在磁力架上放置5min,磁分离至完全澄清,吸弃上清,将离心管从磁力架上取出。
[0045]
(4)加入500μl工作液c,混匀,将离心管在磁力架上放置3min,磁分离至完全澄清,尽量吸弃工作液c,然后从磁力架上取出离心管。
[0046]
(5)重复步骤四1次。
[0047]
(6)将离心管置于55℃恒温箱中干燥5-10min,至离心管内无残留液体。
[0048]
(7)加入100μl工作液d,混匀,悬浮磁珠,将离心管置于60-70℃水浴锅中8-10min。
[0049]
(8)从水浴锅中取出离心管,并置于磁力架上2min,待磁珠完全吸至离心管壁上后,小心吸取上清至新的离心管中,即获得dna产物。
[0050]
(9)琼脂糖凝胶电泳法检测本发明方法中实施例4和实施例5提取的两种革兰氏阴性菌基因组dna,泳道1,2是提取的福氏志贺氏菌基因组dna;泳道3,4是提取的出血性大肠埃希氏菌o157:h7基因组dna,永道m为takara公司的dl5000 dna marker。结果显示所获得基因组dna产物平行性好,条带清晰,无拖尾和杂带,表明提取的基因组dna完整性好,无其它dna污染(图1所示)。
[0051]
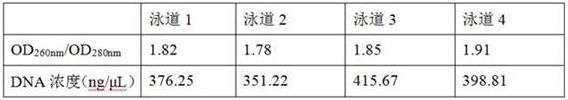
(10)紫外-可见光分光光度计对提取的4份基因组dna回收产物进行od值检测,纯度用od
260nm
/od
280nm
比值来衡量,检测结果显示使用本发明方法提取得到的基因组dna产物含量高且纯度良好、浓度大,如表1所示。
[0052]
表1本发明试剂盒革兰氏阴性菌基因组dna提取结果
对比例分别用酚-氯仿抽提法和市售试剂盒法提取出血性大肠埃希氏菌o157:h7基因组dna,步骤分别按照各自的说明书进行,提取的基因组dna采用琼脂糖凝胶电泳分析。图2为三种不同方法提取的基因组dna的琼脂糖凝胶电泳图,泳道1是酚-氯仿抽提法提取的出血性大肠埃希氏菌o157:h7基因组dna,泳道2是市售试剂盒法提取的出血性大肠埃希氏菌o157:h7基因组dna,泳道3是本发明试剂盒提取的出血性大肠埃希氏菌o157:h7基因组dna,泳道m是dl5000 dna marker。从图2中可以看出,本发明试剂盒提取得到的基因组dna产物与其他两种方法相比,条带清晰,无拖尾和杂带,提取的基因组dna完整性好,纯度高。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1