一种AureobasidinA高产菌株及其应用的制作方法
本发明涉及微生物制药技术领域,具体涉及一种aureobasidina高产菌株及其应用。
背景技术:
aureobasidina是一种由9个氨基酸分子组成的环脂肽类抗生素,最早在1991年由日本kazutohtakesako团队从黑酵母aureobasidiumpullulans的培养液中分离获得。后续研究证实aureobasidina具有非常强的抗真菌能力,其在0.1~0.5μg/ml的低浓度下即可对酵母产生毒性。对其敏感的真菌种类包括:出芽酵母(saccharomycescerevisiae)、粟酒裂殖酵母(schizosaccharomycespombe)、光滑念珠菌(candidaglabrata)、构巢曲霉(aspergillusnidulans)和黑曲霉(aspergillusniger)。aureobasidina的作用机制是抑制真菌生长所依赖的肌醇磷酰胺(inositolphosphorylceramide,ipc)合成酶的活性,干扰鞘脂合成,从而进一步杀死菌株。但是,aureobasidina不会破坏dna、rna和蛋白质的合成。
目前,有关aureobasidina生产技术的报道较少。1991年,kazutohtakesako团队最先从对马岛的叶子中分离到了aureobasidiumpullulans菌种,经发酵培养后aureobasidina的产量约为140μg/ml,此后未见aureobasidina的产量提升的报道。aureobasidina因其较强的抗真菌活性,应用领域由潜在人用药逐步扩大到生物农药,因此,aureobasidina高水平生产技术开发具有重要意义。
技术实现要素:
本发明提供一种aureobasidina高产菌株,其分类命名为出芽短梗霉(aureobasidiumpullulans),并已于2020年10月14日保藏于中国微生物菌种保藏管理委员会普通微生物中心(地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所),保藏编号为:cgmccno.20887。
本发明还提供一种aureobasidina的制备方法,其包括将上述菌株进行发酵的步骤。
具体地,上述发酵温度可以为15-27℃(例如15、20、21、21、23、24、25、26、27℃),特别是23-26℃。
具体地,上述发酵ph可以为1.5-8.0(例如1.5、2、3、4、5、6、7、8),特别是6-8。
具体地,上述发酵时间可以为1-15天(例如1、2、3、4、5、6、7、8、9、10、12、14、15天),特别是6-9天。
具体地,上述发酵的菌种接种量可以为0.5%-10%(例如0.5%、0.6%、0.7%、0.8%、0.9%、1%、1.5%、2%、2.5%、3%、4%、5%、6%、7%、8%、9%、10%),特别是0.5%-5%。
具体地,上述发酵的培养基可以包含:葡萄糖、酵母基础氮源、聚胨、硫酸铵;更具体地,上述发酵的培养基可以包含:葡萄糖40-80g/l(例如40、50、55、60、65、70、80g/l),酵母基础氮源10-30g/l(例如10、15、16、18、20、22、24、25、30g/l),聚胨20-40g/l(例如20、25、26、28、30、32、34、35、40g/l),硫酸铵2-10g/l(例如2、3、4、5、6、7、8、9、10g/l),余量为水。
具体地,上述制备方法还可以包括(在发酵前)菌种扩大培养的步骤。
具体地,上述扩大培养温度可以为15-27℃(例如15、20、21、21、23、24、25、26、27℃),特别是23-26℃。
具体地,上述扩大培养ph可以为1.5-8.0(例如1.5、2、3、4、5、6、7、8),特别是6-8。
具体地,上述扩大培养时间可以为6-60小时(例如6、12、18、24、30、36、42、48、54、60小时),特别是20-54小时。
具体地,上述扩大培养的培养基可以包含:葡萄糖、酵母基础氮源;更具体地,上述扩大培养的培养基可以包含:葡萄糖10-30g/l(例如10、15、16、18、20、22、24、25、30g/l),酵母基础氮源2-10g/l(例如2、3、4、5、6、6.7、7、8、9、10g/l),余量为水。
具体地,上述制备方法还可以包括(在发酵后)将发酵液提取的步骤。
本发明还提供一种上述菌株的发酵液。
具体地,上述发酵液的制备方法包括将上述菌株进行发酵的步骤;更具体地,发酵参数具有本发明上述相应定义。
具体地,上述方法还可以包括灭活步骤,例如在70℃水浴加热下灭活。
本发明还提供一种上述菌株的发酵液的澄清液体(例如上清液、滤液等,其中已不包含发酵液中的固体物质(例如菌体))。
具体地,上述澄清液体的制备方法包括将上述发酵液(例如通过离心、过滤、沉降等)进行固液分离的步骤。
本发明还提供一种上述澄清液体的浓缩物。
具体地,上述浓缩物可以为固体粉末。
具体地,上述浓缩物的制备方法包括将澄清液体进行提取、浓缩的步骤。
具体地,上述提取可以采用溶剂提取法,提取溶剂可以为乙酸乙酯。
本发明还提供一种上述菌株的菌悬液。
具体地,上述菌悬液的制备方法包括将上述菌株的菌体(例如通过将上述菌株的发酵液进行固液分离得到)分散于溶剂(例如水)的步骤。
具体地,上述菌悬液中菌体可以为活菌,也可以为灭活菌体。
本发明还提供一种抗菌剂,其包含上述发酵液、澄清液体、浓缩物、菌悬液中的至少一种。
具体地,上述抗菌剂至少可以抗真菌(例如,出芽酵母(saccharomycescerevisiae)、粟酒裂殖酵母(schizosaccharomycespombe)、光滑念珠菌(candidaglabrata)、构巢曲霉(aspergillusnidulans)和黑曲霉(aspergillusniger)等)。
具体地,上述抗菌剂可以为药物、农药、日用品等形式。
本发明还提供上述菌株及其发酵产品(例如发酵液、发酵液的上清液、该上清液的浓缩物、菌悬液等)在aureobasidina的制备中的应用。
本发明还提供上述菌株及其发酵产品(例如发酵液、发酵液的澄清液体、该澄清液体的浓缩物、菌悬液等)在抗菌剂(特别是抗真菌剂)的制备中的应用。
本发明以从浙江杭州莫干山风景区土壤样品中分离到的黑酵母aureobasidiumpullulans作为原始出发菌株,经复合诱变筛选获得aureobasidina高产菌种,该菌种的生产能力较原始菌种显著提高,aureobasidina的发酵水平可达990μg/ml以上,其为相同培养条件下原始菌种的13.75倍,较其他公开报道水平也有显著提高,可用作aureobasidina工业化生产菌株,大幅度降低aureobasidina规模化生产成本。此外,该菌株的发酵液、菌悬液、发酵液的澄清液体及其浓缩物均具备较强的抗真菌活性,可用于抗真菌剂的制备。
附图说明
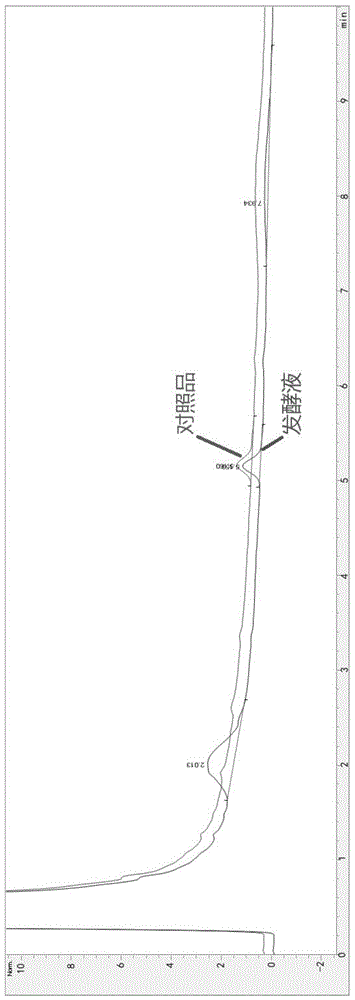
图1所示为本发明实施例原始菌种发酵液与对照品溶液hplc对比图。
图2所示为本发明实施例对照品溶液的正离子质谱图。
图3所示为本发明实施例原始菌种发酵液主峰的正离子质谱图。
图4所示为本发明实施例制备获得高产菌株与原始菌株aureobasidina产量对比。
图5所示为本发明实施例原始菌种与制备所得高产菌种发酵液hplc对比图。
具体实施方式
除非另有定义,本发明中所使用的所有科学和技术术语具有与本发明涉及技术领域的技术人员通常理解的相同的含义。
在本发明中,“发酵液”是指液体培养基接入微生物菌种,经过一段时间培养后所得混合物,其中包含微生物菌体及其代谢产物、未利用的培养基成分(可能的话)等。
在本发明中,“接种量”是指加入种子液的体积和接种后培养液体积的比例。
本文所引用的各种出版物、专利和公开的专利说明书,其公开内容通过引用整体并入本文。
以下将结合具体实施方式详细说明本发明内容,但本发明的范围不限于此。
以下具体实施例中,如无具体说明,使用的试剂和仪器都是本领域常用试剂和仪器,可以通过商购的方式获得;所使用的方法为本领域常规方法,本领域技术人员根据实施例内容可以知道如何具体实现所述方法,并实现相应的结果。
下面实施例中所用培养基配方组成如下:
pda固体培养基:为美国bd公司生产成品培养基,使用前称量36g,加1000ml纯化水溶解,ph自然。
液体种子培养基:葡萄糖20g/l,酵母基础氮源6.7g/l,余量为水,消毒前ph为6.5。
发酵培养基:葡萄糖60g/l,酵母基础氮源20g/l,聚胨30g/l,硫酸铵5g/l,余量为水,消毒前ph为6.5。
实施例1:aureobasidina原始产生菌的获取
土壤样品取自浙江省杭州市莫干山风景区腐化树叶下层,取样量5g,用无菌水梯度稀释后均匀涂布到同时添加50μg/ml氨苄青霉素钠和50μg/ml硫酸链霉素的pda培养基上,于25℃、60%相对湿度的恒温恒湿厢内倒置培养3天。取独立单菌落分布的平板,用无菌牙签将奶油状菌落分别点种到新鲜的加有80μg/ml氨苄青霉素钠和80μg/ml硫酸链霉素的pda培养基上,于25℃、60%相对湿度的恒温恒湿厢内倒置培养9天,每天观察。对前期为奶油白色但后期变黑的菌落并编号,并在净化操作台内分别单独制片,镜检。挑选镜检呈酵母状的对应编号菌落,接种到发酵培养基中,于25℃、250rpm的恒温恒湿摇床内震荡培养6天,获得发酵液。发酵液以白色念珠菌为检定菌,采用滤纸片法进行筛选测定,最终获得一株对白色念珠菌有明显抗性的黑酵母aureobasidiumpullulans。该菌种经连续5轮纯化后,保藏于申请人的菌种保藏管理中心,内部编号a.pullulanshdcc101-r13。
形态生长特征:
将分离纯化的a.pullulanshdcc101-r13菌株接种于pda固体培养基上,于25℃、60%相对湿度的恒温恒湿厢内倒置培养,3天后肉眼可见奶油色菌落,表面光滑;7天开始菌落部分变成墨绿色;12天后菌落表面及外周可见丝状菌丝,颜色棕黑,盖玻片压片镜检未见游离孢子。
将分离纯化的a.pullulanshdcc101-r13菌株接种于pda固体培养基上,分别置于4℃、10℃、15℃、20℃、25℃、27℃、30℃、32℃、37℃,60%相对湿度的恒温恒湿厢内倒置培养,观察菌落大小,发现其适合生长温度范围为15~27℃,最佳生长温度为23~25℃。
将分离纯化的a.pullulanshdcc101-r13菌株接种于不同ph液体种子培养基中,发现其在1.5~8.0ph范围内均可以生长良好。
实施例2:a.pullulanshdcc101-r13菌株产aureobasidina能力确认
将分离纯化的a.pullulanshdcc101-r13菌株接种于pda固体培养基,于25℃、60%相对湿度的恒温恒湿厢内倒置培养7天。用接种环取适量菌苔,接种于100ml无菌液体种子培养基,置于25℃,220rpm摇床上培养48h。镜检无杂菌后,用移液器吸取种子液0.4ml接种到含有40ml发酵培养基的250ml三角瓶中,共接种5瓶发酵培养基,置于25℃,220rpm摇床上培养8天。发酵培养结束后,取发酵液4ml,用1倍体积无水乙醇混匀后超声浸泡20min,再次混匀后3000rpm离心15min,取上清液用0.45μm膜过滤后分别送hplc和lc-ms检测,与aureobasidina对照品进行对比确认。结果发现发酵液在rt5.152min有明显出峰,与aureobasidina对照品的rt5.149一致(如图1所示)。进一步的lc-ms分析确定该峰主要成分相对分子量为1100.7(如图2、图3所示),与aureobasidina吻合。依据aureobasidina对照品标识含量,计算出5瓶发酵液中aureobasidina的效价分别为63.3μg/ml、69.2μg/ml、76.4μg/ml、72.1μg/ml、71.6μg/ml,平均值为70.5μg/ml。
实施例3:aureobasidina高产菌种制备与验证
1)以hdcc101-r13为原始出发菌株,接种到pda固体培养基,于25℃、60%相对湿度的恒温恒湿厢内倒置培养5天,得到新鲜种源。
2)取生长好的固体培养菌苔1皿,用无菌钢签将菌苔刮下,转移到加有玻璃珠和15ml无菌生理盐水的三角瓶中,包扎好置于摇床上振荡打散30min,得到分散良好的菌悬液。
3)取制备好的菌悬液诱变处理后均匀涂布到添加有特定抗性试剂的pda固体培养基上,于25℃、60%相对湿度的恒温恒湿厢内倒置培养4天,然后点种到新鲜的添加有特定抗性试剂的pda固体培养基上,于25℃、60%相对湿度的恒温恒湿厢内倒置培养7天。
4)取培养好的点种菌落,每颗菌落单独用钢签刮下,接种到含有25ml液体种子培养基的三角瓶中,将菌落在瓶壁上充分碾碎后洗至培养基中,包扎好置于25℃,220rpm摇床上培养48h。然后每瓶种子单独用移液器各吸取种子液0.4ml接种到含有40ml发酵培养基的250ml三角瓶中,共接种发酵瓶424瓶(其中对照10瓶)。所有发酵瓶置于25℃,220rpm摇床上培养8天。
7)发酵培养结束后,取发酵液1ml,用4倍体积无水乙醇混匀后超声浸泡20min,再次混匀后14000rpm离心10min,取上清液送hplc检测。最终获得一株高产菌株,aureobasidina效价为990.6μg/ml。该菌种已于2020年10月14日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmccno.20887。
实施例4:aureobasidina高产菌种复筛验证
1)以上述筛选到的aureobasidina高产菌种为试验菌株(f0代),接种到pda固体培养基,于25℃、60%相对湿度的恒温恒湿厢内倒置培养4天,得到分离单菌落(f1代)。
2)取培养好的分离单菌落,用牙签分别点种到含特定抗性试剂的pda固体平板,于25℃、60%相对湿度的恒温恒湿厢内倒置培养4天,得到点种单菌落(f2代)。如此连续点种传代5轮,得到f5代点种单菌落。
3)取培养好的f5代点种单菌落,每颗菌落单独用钢签刮下,接种到含有25ml液体种子培养基的三角瓶中,将菌落在瓶壁上充分碾碎后洗至培养基中,包扎好置于25℃,220rpm摇床上培养48h。然后每瓶种子单独用移液器吸取种子液0.4ml接种到含有40ml发酵培养基的250ml三角瓶中。共接种发酵瓶40瓶,置于25℃,220rpm摇床上培养8天。
4)发酵培养结束后,取发酵液1ml,用4倍体积无水乙醇混匀后超声浸泡20min,再次混匀后14000rpm离心10min,取上清液送hplc检测。结果发现,40瓶发酵样品,最低效价为878.8μg/ml,最高效价为1087.0μg/ml,平均效价为993.2μg/ml。
通过该实施例,说明本发明所提供的aureobasidina高产菌种具备生产能力强、遗传稳定性好的优点,可以用作aureobasidina的工业化生产菌种。
实施例5:aureobasidina高产菌种发酵液抗真菌活性初步测评
1)将aureobasidina高产菌种接种于pda固体培养基,于25℃、60%相对湿度的恒温恒湿厢内倒置培养7天。用接种环取适量菌苔,接种于100ml无菌液体种子培养基,置于25℃,220rpm摇床上培养48h。用移液器吸取种子液0.4ml接种到含有40ml发酵培养基的250ml三角瓶中,置于25℃,220rpm摇床上培养8天得到发酵液,所有发酵液合并70℃水浴加热1h灭活,待用。
2)将灭活的发酵液转移到无菌离心杯中14000rpm离心15min,分别收集菌体和上清液。菌体用无菌水清洗两次后再用9倍重量的无菌水重悬后得到菌悬液。上清液用3倍体积乙酸乙酯浸泡萃取后旋转蒸发浓缩,去除乙酸乙酯后得到固体粉末(浓缩物)。
3)白色念珠菌(candidaalbicans)接种到酪胨琼脂斜面,30℃培养4天后,将菌苔用无菌生理盐水洗下,用玻璃珠打散,作为检定用菌悬液。
4)取灭菌好并冷却至50℃的酪胨琼脂培养基,分别按0.01%(w/v)、0.02%(w/v)、0.05%(w/v)、0.1%(w/v)、0.2%(w/v)、0.5%(w/v)、1%(w/v)、2%(w/v)、5%(w/v)比例加入上述灭活发酵液、菌悬液、上清液、浓缩物,对照组按相应比例加入无菌生理盐水,充分摇晃溶解/混匀后倒制平板,凝固后待用。
5)取凝固好的平板,每片平板上接种50μl白色念珠菌检定用菌悬液,涂布均匀,于30℃、60%相对湿度恒温恒湿厢内培养7~14天,观察并统计菌落生长情况。每个试验组做5个重复,各试验组白色念珠菌生长情况统计如下表所示。
表1aureobasidina高产菌种发酵液抗真菌活性初步测评结果
备注:“+++”为平皿上铺满菌苔,表示检定菌生长旺盛;
“++”为平皿上稀疏菌落(<100cfu/皿=,表示检定菌可以生长;
“+”为平皿上极少小菌落(<3cfu/皿),表示检定菌生长受到显著抑制;
“-”为平皿上无菌落生长,表示检定菌生长完全受到抑制。
该实施例结果表明,该aureobasidina高产菌种灭活发酵液、上清液、菌悬液、浓缩物对白色念珠菌生长均有不同程度的抑制作用,其中浓缩物的抑制作用最为明显,发酵液和上清液次之。这说明aureobasidina高产菌种灭活发酵液、上清液、菌悬液、浓缩物在抗真菌剂领域均具有较好的开发前景。
需要说明的是,尽管在本文中已经对上述各实施案例进行了描述,但并非因此限制本发明的专利保护范围。因此,基于本发明的创新理念,对本文所述实施案例进行的变更和修改,或利用本发明说明书内容所作的等效结构或等效流程变换,直接或间接地将以上技术方案运用在其他相关技术领域,均包括在本发明的专利保护范围之内。
本发明中仅按一定顺序列出方法的步骤并不构成对方法步骤顺序的任何限制。
- 还没有人留言评论。精彩留言会获得点赞!