一种与植物抗逆性相关的蛋白PHD-Finger17及其编码基因与应用
一种与植物抗逆性相关的蛋白phd
‑
finger17及其编码基因与应用
技术领域
1.本发明属于生物技术领域,具体涉及一种与植物抗逆性相关的蛋白phd
‑
finger17及其编码基因与应用。
背景技术:
2.水稻作为喜温作物对低温较敏感,从种子发芽到成熟的整个生长发育期间都存在低温冷害,具体表现为种子发芽不良、生育受抑制和拖延、减数分裂期和花粉形成期低温引起不育、开花期的拖延和授精不良、结实率下降等,所以低温会破坏性地降低其产量。水稻作为最主要的粮食作物,养育了中国2/3的人口,水稻的安全生产直接关系到我国的粮食安全。目前,水稻的低温冷害在世界上许多国家均有发生,全世界有1500万hm2以上的稻作面积受到低温威胁,低温灾害导致我国每年粮食减产3
‑
5亿吨,因此培育耐低温水稻品种是水稻育种工作的重要方向。
3.植物耐低温胁迫是一个复杂的遗传性状,受多个基因/数量性状基因座控制。与其他农艺性状相比,水稻低温耐受性的遗传研究进展缓慢,目前只鉴定出少数耐低温基因,但随着生物信息学、遗传学、现代分子生物学的飞速发展以及转基因技术的日趋成熟,通过现代基因工程技术进行分子育种已成为改良水稻耐冷性的一种快速有效途径之一。
技术实现要素:
4.本发明的第一个目的是提供phd
‑
finger17蛋白的新用途。
5.本发明提供了phd
‑
finger17蛋白在如下1)或2)中的应用:
6.1)调控植物耐逆性;
7.2)培育耐逆性降低的转基因植物;
8.所述phd
‑
finger17蛋白为a1)或a2)或a3)或a4):
9.a1)氨基酸序列是序列3所示的蛋白质;
10.a2)在序列3所示的蛋白质的n端或/和c端连接标签得到的融合蛋白质;
11.a3)将序列3所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与植物耐逆性相关的蛋白质;
12.a4)将序列3所示的氨基酸序列具有90%同一性、来源于水稻且与植物耐逆性相关的蛋白质。
13.本发明的第二个目的是提供与phd
‑
finger17蛋白相关的生物材料的新用途。
14.本发明提供了与phd
‑
finger17蛋白相关的生物材料在如下1)或2)中的应用:
15.1)调控植物耐逆性;
16.2)培育耐逆性降低的转基因植物;
17.所述生物材料为下述a1)至a8)中的任一种:
18.a1)编码phd
‑
finger17蛋白的核酸分子;
19.a2)含有a1)所述核酸分子的表达盒;
20.a3)含有a1)所述核酸分子的重组载体;
21.a4)含有a2)所述表达盒的重组载体;
22.a5)含有a1)所述核酸分子的重组微生物;
23.a6)含有a2)所述表达盒的重组微生物;
24.a7)含有a3)所述重组载体的重组微生物;
25.a8)含有a4)所述重组载体的重组微生物。
26.上述应用中,a1)所述核酸分子为如下b1)或b2)或b3)或b4)所示的基因:
27.b1)序列1所示的基因组dna分子;
28.b2)序列2所示的cdna分子;
29.b3)与b1)或b2)限定的核苷酸序列具有75%或75%以上同一性,且编码权利要求1中所述的phd
‑
finger17蛋白的cdna分子或基因组dna分子;
30.b4)在严格条件下与b1)或b2)或b3)限定的核苷酸序列杂交,且编码权利要求1中所述的phd
‑
finger17蛋白的cdna分子或基因组dna分子。
31.上述应用中,所述调控植物耐逆性为降低植物耐逆性;所述耐逆性为耐冷性。
32.所述降低植物耐逆性体现为:在冷胁迫处理下,植物中phd
‑
finger17蛋白含量和/或活性越高或phd
‑
finger17基因表达量越高,植物的耐冷性越低;进一步体现为:在冷胁迫处理下,植物中phd
‑
finger17蛋白含量和/或活性越高或phd
‑
finger17基因表达量越高,植物的根长越短、地上部分长度越短、鲜重越低、相对导电率越高、脯氨酸含量越低、可溶性糖含量越低。
33.本发明的第三个目的是提供m1或m2所示的物质在如下3)或4)中的应用:
34.3)提高植物耐逆性;
35.4)培育耐逆性提高的转基因植物;
36.m1、抑制或降低植物中phd
‑
finger17蛋白活性或者含量的物质;
37.m2、抑制或降低植物中phd
‑
finger17蛋白编码核酸表达的物质或敲除植物中phd
‑
finger17蛋白编码核酸的物质;
38.所述phd
‑
finger17蛋白为a1)或a2)或a3)或a4):
39.a1)氨基酸序列是序列3所示的蛋白质;
40.a2)在序列3所示的蛋白质的n端或/和c端连接标签得到的融合蛋白质;
41.a3)将序列3所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与植物耐逆性相关的蛋白质;
42.a4)将序列3所示的氨基酸序列具有90%同一性、来源于大豆且与植物耐逆性相关的蛋白质。
43.上述应用中,所述耐逆性为耐冷性。所述提高植物耐逆性体现为:在冷胁迫处理下,植物中的phd
‑
finger17基因缺失,植物的耐冷性提高;进一步体现为:在冷胁迫处理下,植物中的phd
‑
finger17基因缺失,植物的根长变长、地上部分长度变长、相对导电率变低、脯氨酸含量变高、存活率变高。
44.本发明的第四个目的是提供一种培育耐逆性提高的转基因植物的方法。
45.本发明提供的培育耐逆性提高的转基因植物的方法包括如下步骤:降低受体植物
中phd
‑
finger17蛋白的含量和/或活性,得到转基因植物;所述转基因植物的耐逆性高于所述受体植物。
46.进一步的,所述转基因植物的耐逆性高于所述受体植物具体体现在如下y1)
‑
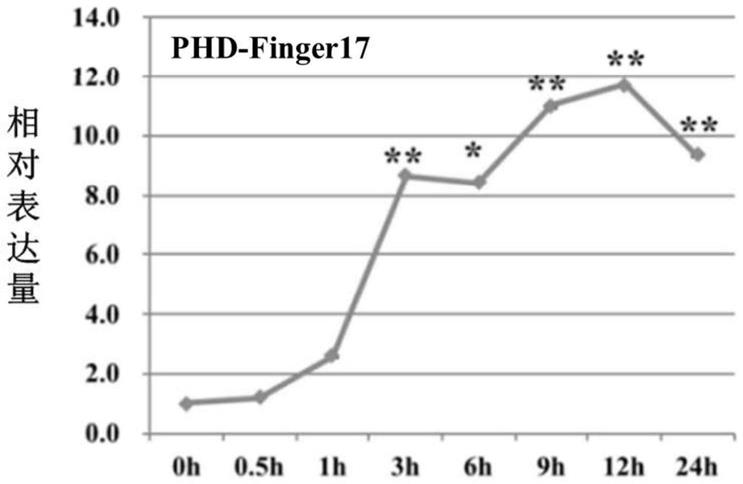
y5)中的任一种:
47.y1)所述转基因植物的根长高于所述受体植物;
48.y2)所述转基因植物的地上部分长度高于所述受体植物;
49.y3)所述转基因植物的相对导电率低于所述受体植物;
50.y4)所述转基因植物的脯氨酸含量高于所述受体植物;
51.y5)所述转基因植物的存活率高于所述受体植物。
52.所述降低受体植物中phd
‑
finger17蛋白的含量和/或活性的方法通过对所述受体植物中phd
‑
finger17蛋白的编码基因进行敲除或抑制或沉默来实现。
53.更进一步的,敲除所述受体植物中的phd
‑
finger17蛋白的编码基因的物质为crispr/cas9系统;所述crispr/cas9系统中sgrna的靶序列为序列5所示的dna分子。
54.本发明的第五个目的是提供一种特异sgrna或含有所述sgrna编码基因的表达盒、载体、宿主细胞、工程菌或转基因植物细胞系,所述sgrna的靶序列为序列5所示的dna分子。
55.本发明的第六个目的是提供一种培育耐逆性降低的转基因植物的方法。
56.本发明提供的培育耐逆性降低的转基因植物的方法包括如下步骤:提高受体植物中phd
‑
finger17蛋白的含量和/或活性,得到转基因植物;所述转基因植物的耐逆性低于所述受体植物。
57.进一步的,所述转基因植物的耐逆性低于所述受体植物具体体现在如下x1)
‑
x6)中的任一种:
58.x1)所述转基因植物的根长低于所述受体植物;
59.x2)所述转基因植物的地上部分长度低于所述受体植物;
60.x3)所述转基因植物的鲜重低于所述受体植物;
61.x4)所述转基因植物的相对导电率高于所述受体植物;
62.x5)所述转基因植物的脯氨酸含量低于所述受体植物;
63.x6)所述转基因植物的可溶性糖含量低于所述受体植物。
64.所述提高受体植物中phd
‑
finger17蛋白的含量和/或活性的方法为在受体植物中过表达phd
‑
finger17蛋白。
65.更进一步的,所述过表达的方法为将phd
‑
finger17蛋白的编码基因导入受体植物中。
66.上述任一所述方法或应用中,所述耐冷性为萌发期耐冷性和/或幼苗期耐冷性。
67.上述任一所述方法或应用中,所述植物为双子叶植物或单子叶植物;进一步的,所述单子叶植物为禾本科植物;更进一步的,所述禾本科植物为水稻。
68.本发明提供了phd
‑
finger17蛋白在调控植物耐逆性中的应用。本发明将编码phd
‑
finger17蛋白的dna分子导入目的植物,得到phd
‑
finger17超量表达水稻,通过实验证明:该phd
‑
finger17超量表达水稻的耐冷性低于受体植物,说明phd
‑
finger17超量表达降低了植物对冷胁迫的耐受性。本发明还将目的植物中编码phd
‑
finger17蛋白的dna分子敲除,得到phd
‑
finger17基因敲除水稻,通过实验证明:该phd
‑
finger17基因敲除水稻的耐冷性高
towards an ideal technique for cloning pcr fragments.nucleic acids res.2006;34(18):e122中,公众可从申请人(黑龙江八一农垦大学)处获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
81.下述实施例中的野生型水稻品种“日本晴”为水稻基因组测序品种,具体信息记录于美国生物技术信息中心(https://www.ncbi.nlm.nih.gov/assembly/gcf_001433935.1),公众可从申请人(黑龙江八一农垦大学)处获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
82.实施例1、phd
‑
finger17的克隆
83.一、phd
‑
finger17基因cds区的克隆
84.1、引物的设计
85.应用primer premier 5.0设计phd
‑
finger17克隆引物。引物序列如下:
86.phd
‑
finger17
‑
f:5
’‑
atggggaagggaggggaagg
‑3’
;
87.phd
‑
finger17
‑
r:5
’‑
ctagacaccttcagttccttg
‑3’
。
88.2、phd
‑
finger17的克隆
89.选取成熟的、饱满的水稻种子(日本晴),经过42℃下处理3
‑
5天以打破休眠。使用10%naclo灭菌30分钟,无菌蒸馏水清洗5遍后置于黑暗条件下浸种1天,然后将萌动的水稻种子转移至30℃环境中黑暗催芽培养1天,再将萌发的水稻苗转移到yoshida溶液中在28℃、12h光照(光照强度250μmol m
‑2s
‑1),25℃、12h黑暗条件下培养至三叶期。取三叶期幼苗叶片,采用trizol(invitrogen公司)提取总rna,反转录获得cdna,以获得的cdna为模板,采用phd
‑
finger17
‑
f和phd
‑
finger17
‑
r引物进行pcr扩增,得到pcr产物,并对其进行测序。
90.pcr扩增得到大小为2400bp的片段,其核苷酸序列如序列2所示,该片段包含phd
‑
finger17的cds区序列。
91.实施例2、phd
‑
finger17在冷胁迫下的表达模式分析
92.对实施例1中的三叶期水稻幼苗进行4℃冷处理,分别在处理0h、0.5h、1h、3h、6h、9h、12h和24h后取地上部组织,采用trizol法提取总rna,采用反转录试剂盒superscript
tm iii reverse transcriptase kit(invitrogen,carlsbad,ca,usa)反转录获得cdna。将获得的cdna稀释5倍,以稀释后的cdna为模板,采用phd
‑
finger17
‑
qrt
‑
f和phd
‑
finger17
‑
qrt
‑
r引物进行rt
‑
pcr。同时以水稻的延伸因子1
‑
α基因(elongation factor 1
‑
gene,osa
‑
elf1
‑
α)为内参基因。检测所用引物序列如下:
93.phd
‑
finger17
‑
qrt
‑
f:5
’‑
tgtgcagggtgtgctggatt
‑3’
;
94.phd
‑
finger17
‑
qrt
‑
r:5
’‑
cctttgacgactttgtgattgttg
‑3’
;
95.osa
‑
elf1
‑
α
‑
f:5
’‑
gcacgctcttcttgctttcac
‑3’
;
96.osa
‑
elf1
‑
α
‑
r:5
’‑
tcttgtcagggttgtagccgac
‑3’
。
97.qrt
‑
pcr检测结果如图1所示。结果表明:冷胁迫处理后,phd
‑
finger17表达量呈上升趋势,并在冷胁迫处理12h时达到最高,说明phd
‑
finger17的表达受冷胁迫诱导。
98.实施例3、phd
‑
finger17超量表达水稻的获得及耐冷性分析
99.一、phd
‑
finger17植物超量表达载体构建
100.1、以水稻日本晴的cdna为模板,采用phd
‑
finger17
‑
u
‑
f和phd
‑
finger17
‑
u
‑
r引物进行pcr扩增,得到phd
‑
finger17的cds序列。引物序列如下(下划线代表载体构建时所需的
接头序列,其中u为user酶切位点):
101.phd
‑
finger17
‑
u
‑
f:5
’‑
ggcttaauatggggaagggaggggaagg
‑3’
;
102.phd
‑
finger17
‑
u
‑
r:5
’‑
ggtttaau ctagacaccttcagttccttggaa
‑3’
。
103.2、用限制性内切酶paci和nt.bbvci对pcambia330035su载体进行双酶切,得到载体酶切产物。将获得的载体酶切产物、user酶(neb,m5505s)和步骤1获得的phd
‑
finger17片段在37℃下孵育20min,利用user酶对phd
‑
finger17片段的尿嘧啶处进行切割,形成可与pcambia330035su载体互补的粘性末端,然后25℃下孵育20min,得到重组表达载体pcambia330035su
‑
phd
‑
finger17,并送交测序。
104.测序结果表明:pcambia330035su
‑
phd
‑
finger17为在pcambia330035su载体的两个paci酶切位点间插入序列2所示的dna分子,且保持pcambia330035su载体的其他序列不变后得到的载体。
105.二、phd
‑
finger17超量表达水稻的获得及鉴定
106.1、采用冻融法将步骤一获得的pcambia330035su
‑
phd
‑
finger17转化根癌农杆菌eha105,得到重组菌pcambia330035su
‑
phd
‑
finger17/eha105。
107.2、采用农杆菌介导法将重组菌pcambia330035su
‑
phd
‑
finger17/eha105菌液侵染水稻品种“日本晴”的胚性愈伤组织20min,然后将愈伤组织转接到共培养培养基(含20mg/l乙酰丁香酮的nb培养基,ph5.2)。
108.3、25℃黑暗培养2
‑
4天后取愈伤组织,用含500mg/l头孢霉素的无菌水溶液清洗,然后接种至筛选培养基(含15mg/l固杀草和100mg/l阿莫西林克拉维酸钾的nb培养基,ph5.8)。
109.4、32℃、24h光照条件下培养6周后取愈伤组织,接种至分化培养基(含30g/l山梨醇、2g/l酪蛋白水解物、100mg/l阿莫西林克拉维酸钾、2mg/l kt和0.02mg/l naa的ms培养基,ph5.8),首先在25℃、黑暗的条件下培养5
‑
7天,然后转移至26℃、16h光照/8h黑暗的条件下培养至愈伤组织表面有绿点产生。
110.5、将有绿点的愈伤组织转移至新的分化培养基,在26℃、16h光照/8h黑暗的条件下培养至幼苗再生芽长度约为2cm。
111.6、将幼苗转移至生根培养基(含100mg/l阿莫西林克拉维酸钾的ms培养基,ph5.8),在26℃、16h光照/8h黑暗的条件下培养至株高为10
‑
15cm且根系发达,得到再生植株(t0代)。
112.7、将再生植株(t0代)移栽到事先拌好的培养基质(培养基质的组成:1质量份草炭土+1质量份君子兰土+3质量份土壤),浇水,先放置在暗光条件下培养3
‑
5天,然后移至户外正常培养。
113.8、取再生植株的叶片,提取基因组dna,采用bar
‑
277
‑
f和bar
‑
277
‑
r组成的引物对(以bar基因为靶基因)进行pcr鉴定,得到pcr鉴定阳性的再生植株(图2a)。引物序列如下:
114.bar
‑
277
‑
f:5
’‑
tgggcagcccgatgacagcgaccac
‑3’
;
115.bar
‑
277
‑
r:5
’‑
accgagccgcaggaaccgcaggagt
‑3’
。
116.9、分别取pcr鉴定阳性的再生植株的嫩叶,提取总rna并反转录合成cdna。以cdna为模板,采用phd
‑
finger17
‑
qrt
‑
f和phd
‑
finger17
‑
qrt
‑
r组成的引物对进行rt
‑
pcr,同时以水稻的延伸因子1
‑
α基因(osa
‑
elf1
‑
α)为内参基因。
117.rt
‑
pcr鉴定结果如图2b所示。从图中可以看出:七个转基因株系在转录水平上,phd
‑
finger17表达量均高于野生型。
118.10、将rt
‑
pcr鉴定阳性的再生植株自交,每个单株分别收获t1代种子,按照步骤9的方法对t1代种子长成的植株进行rt
‑
pcr鉴定;将rt
‑
pcr鉴定阳性的t1代植株进行自交,每个单株分别收获t2代种子,按照步骤9的方法对t2代种子长成的植株进行rt
‑
pcr鉴定;对于某一t1代植株来说,如果其自交得到的t2代植株均为rt
‑
pcr鉴定阳性,该t1代植株为一个纯合的转基因植株,该t1代植株及其自交后代为一个纯合的转基因株系,直至获得t3代phd
‑
finger17转基因水稻纯合体株系。随机选取t3代phd
‑
finger17转基因4个水稻纯合体株系phd
‑
finger17
‑
2、3、4、5用于下述耐冷性分析。
119.三、phd
‑
finger17超量表达水稻的耐冷性分析
120.1、phd
‑
finger17超量表达水稻萌发期的耐冷性分析
121.选取饱满的野生型水稻品种日本晴(wt)、t3代phd
‑
finger17超量表达水稻纯合体株系phd
‑
finger17
‑
3和phd
‑
finger17
‑
5种子,蒸馏水清洗后30℃浸种、催芽3~5天,至破胸露白。然后将种子移栽到yoshida溶液中培养,对照组培养条件(未冷处理)为28℃、16h光照,22℃、8h黑暗,实验组培养条件(冷处理)为10℃、16h光照,10℃、8h黑暗。培养7天,分别拍照并统计根长和茎高(地上部分长度)。实验重复三次,每种处理各株系采用30株植株。
122.结果如图3所示。从图中可以看出:对照组的phd
‑
finger17超量表达水稻的表型、根长和地上部分与野生型水稻无显著性差异。冷胁迫后抑制了野生型水稻和phd
‑
finger17超量表达水稻的生长(图3a),但t3代phd
‑
finger17超量表达水稻纯合体株系phd
‑
finger17
‑
3和phd
‑
finger17
‑
5的地上部分长度和根长均低于野生型(图3b和图3c),其中野生型水稻品种日本晴(wt)、t3代phd
‑
finger17超量表达水稻纯合体株系phd
‑
finger17
‑
3和phd
‑
finger17
‑
5的平均地上部分长度分别为2.3cm、1.5cm和2.0cm,野生型水稻品种日本晴(wt)、t3代phd
‑
finger17超量表达水稻纯合体株系phd
‑
finger17
‑
3和phd
‑
finger17
‑
5的平均根长分别为2.3cm、1.8cm和2.1cm。
123.2、phd
‑
finger17超量表达水稻幼苗期的耐冷性分析
124.选取饱满的野生型水稻品种日本晴(wt)、t3代phd
‑
finger17超量表达水稻纯合体株系phd
‑
finger17
‑
3和phd
‑
finger17
‑
5种子,蒸馏水清洗后30℃浸种、催芽3~5天,至破胸露白。将发芽的种子播种到湿润的育秧土中,培养至三叶期后进行幼苗期冷处理,冷处理方法如下:在4℃培养箱中培养3天,恢复培养6天。冷处理后拍照并统计地上部分长度、根长和鲜重;在冷处理前和冷处理3天后,取水稻幼苗相同部位的叶片,采用紫外分光光度法参考文献“mir535 negatively regulates cold tolerance in rice”中的方法测定脯氨酸和可溶性糖含量,每个指标测定30个样本;使用电导率仪参考文献“mingzhe sun,yang shen,junkai yang,xiaoxi cai,hongyu li,yanming zhu,bowei jia xiaoli sun.mir535 negatively regulates cold tolerance in rice.molecular breeding,2020,40(1):14”中的方法测定冷处理前后水稻叶片相对电导率。相对电导率(%)=浸提液电导(r1)/浸提液电阻(r2)
×
100%。实验重复三次,每种处理各株系采用30株植株。
125.结果如图4所示。从图中可以看出:冷处理后野生型水稻和phd
‑
finger17超量表达水稻都逐渐失绿甚至死亡,但野生型水稻恢复后长势明显优于phd
‑
finger17超量表达水稻(图4a)。野生型水稻品种日本晴(wt)、phd
‑
finger17超量表达水稻纯合体株系phd
‑
finger17
‑
3和phd
‑
finger17
‑
5的平均地上部分长度分别为19.8cm、12.5cm和15.2cm;野生型水稻品种日本晴(wt)、phd
‑
finger17超量表达水稻纯合体株系phd
‑
finger17
‑
3和phd
‑
finger17
‑
5的平均根长分别为13cm、8cm和10.5cm;phd
‑
finger17超量表达水稻的地上部分长度和根长显著低于野生型(图4b,c)。野生型水稻品种日本晴(wt)、t3代phd
‑
finger17超量表达水稻纯合体株系phd
‑
finger17
‑
3和phd
‑
finger17
‑
5的平均鲜重分别为390mg、200mg和310mg,phd
‑
finger17超量表达水稻的鲜重显著低于野生型(图4d)。野生型水稻品种日本晴(wt)、t3代phd
‑
finger17超量表达水稻纯合体株系phd
‑
finger17
‑
3和phd
‑
finger17
‑
5的平均相对电导率分别为50%、72%和65%,phd
‑
finger17超量表达水稻的相对电导率显著高于野生型(图4f)。野生型水稻品种日本晴(wt)、t3代phd
‑
finger17超量表达水稻纯合体株系phd
‑
finger17
‑
3和phd
‑
finger17
‑
5的平均脯氨酸含量分别为198μg/g、132μg/g和148μg/g;野生型水稻品种日本晴(wt)、t3代phd
‑
finger17超量表达水稻纯合体株系phd
‑
finger17
‑
3和phd
‑
finger17
‑
5的平均可溶性糖含量分别为2.6mg/g、2.15mg/g和2.1mg/g;phd
‑
finger17超量表达水稻中的脯氨酸含量和可溶性糖含量显著低于野生型(图4e、g)。
126.综上所述,phd
‑
finger17超量表达降低了水稻对冷胁迫的耐受性。
127.实施例4、phd
‑
finger17基因敲除水稻的获得及耐冷性分析
128.一、crispr
‑
phd
‑
finger17基因敲除载体构建
129.1、sgrna靶序列
130.根据phd
‑
finger17基因序列,通过在线网站optimized crispr design(https://zlab.bio/guide
‑
design
‑
resources)设计用于构建crispr
‑
phd
‑
finger17的sgrna靶序列,设计的sgrna靶序列如下:ggactgaacccaccttccgac(序列5)。
131.2、合成两条单链引物phd
‑
finger17
‑
sgrna
‑
f/r,退火合成双链sgrna,与经bbsi消化的psgr
‑
cas9
‑
os载体连接,连接产物转化大肠杆菌感受态,获得中间载体psgr
‑
cas9
‑
phd
‑
finger17。
132.phd
‑
finger17
‑
sgrna
‑
f:tggcggactgaacccaccttccgac;
133.phd
‑
finger17
‑
sgrna
‑
r:aaacgtcggaaggtgggttcagtcc。
134.3、采用hindiii与ecori双酶切中间载体psgr
‑
cas9
‑
phd
‑
finger17,获得sgrna
‑
cas9表达盒片段,与hindiii、ecori消化过的pcambia1300载体连接,获得crispr
‑
phd
‑
finger17基因敲除载体,并送交测序。
135.测序结果表明:crispr
‑
phd
‑
finger17基因敲除载体为在pcambia1300载体的hindiii、ecori酶切位点间插入序列4所示的dna分子,且保持pcambia1300载体的其他序列不变后得到的载体。
136.二、phd
‑
finger17基因敲除水稻的获得及鉴定
137.1、采用冻融法将步骤一获得的crispr
‑
phd
‑
finger17基因敲除载体转化根癌农杆菌eha105,得到重组菌crispr
‑
phd
‑
finger17/eha105。
138.2、采用农杆菌介导法将重组菌crispr
‑
phd
‑
finger17/eha105菌液侵染水稻品种“日本晴”的胚性愈伤组织20min,然后将愈伤组织转接到共培养培养基(含20mg/l乙酰丁香酮的nb培养基,ph5.2)。
139.3、25℃黑暗培养2
‑
4天后取愈伤组织,用含500mg/l头孢霉素的无菌水溶液清洗,然后接种至筛选培养基(含40mg/l潮霉素和100mg/l阿莫西林克拉维酸钾的nb培养基,
ph5.8)。
140.4、32℃、24h光照条件下培养6周后取愈伤组织,接种至分化培养基(含30g/l山梨醇、2g/l酪蛋白水解物、100mg/l阿莫西林克拉维酸钾、2mg/l kt和0.02mg/l naa的ms培养基,ph5.8),首先在25℃、黑暗的条件下培养5
‑
7天,然后转移至26℃、16h光照/8h黑暗的条件下培养至愈伤组织表面有绿点产生。
141.5、将有绿点的愈伤组织转移至新的分化培养基,在26℃、16h光照/8h黑暗的条件下培养至幼苗再生芽长度约为2cm。
142.6、将幼苗转移至生根培养基(含100mg/l阿莫西林克拉维酸钾的ms培养基,ph5.8),在26℃、16h光照/8h黑暗的条件下培养至株高为10
‑
15cm且根系发达,得到再生植株(t0代)。
143.7、将再生植株(t0代)移栽到事先拌好的培养基质(培养基质的组成:1质量份草炭土+1质量份君子兰土+3质量份土壤),浇水,先放置在暗光条件下培养3
‑
5天,然后移至户外正常培养。
144.8、取再生植株的叶片,提取基因组dna,采用crispr
‑
cj
‑
phd
‑
finger17
‑
f和crispr
‑
cj
‑
phd
‑
finger17
‑
r组成的引物进行pcr扩增,并将pcr产物送公司测序。引物序列如下:
145.crispr
‑
cj
‑
phd
‑
finger17
‑
f:5
’‑
ggtgagggttaagaatatggggc
‑3’
;
146.crispr
‑
cj
‑
phd
‑
finger17
‑
r:5
’‑
gtctgtcgtgtctgaatcaatagtagg
‑3’
。
147.由于水稻是二倍体植株,当cas9发挥作用开始剪切特定的基因时,同一个细胞内的两条同源染色体上的两个等位基因都有可能被编辑,产生同样类型或不同类型的突变,将一个植株中两个等位基因看成是两个基因编辑事件。纯合突变体指的是该植株的两条同源染色体的phd
‑
finger17基因发生了相同的突变。
148.最终得到不同编辑类型的phd
‑
finger17基因纯合突变体植株crispr
‑
phd
‑
finger17
‑
1、crispr
‑
phd
‑
finger17
‑
2和crispr
‑
phd
‑
finger17
‑
5。
149.测序结果表明:
150.与野生型水稻品种“日本晴”的基因组dna相比,phd
‑
finger17基因纯合突变体crispr
‑
phd
‑
finger17
‑
1的差异仅在于对应于序列2所示的phd
‑
finger17基因cds区序列的第1246位发生了一个碱基c的缺失突变。
151.与野生型水稻品种“日本晴”的基因组dna相比,phd
‑
finger17基因纯合突变体crispr
‑
phd
‑
finger17
‑
2的差异仅在于对应于序列2所示的phd
‑
finger17基因cds区序列的第1247位和第1248位之间发生了一个碱基a的插入突变。
152.与野生型水稻品种“日本晴”的基因组dna相比,phd
‑
finger17基因纯合突变体crispr
‑
phd
‑
finger17
‑
5的差异仅在于对应于序列2所示的phd
‑
finger17基因cds区序列的第1250位发生了一个碱基a的缺失突变,且第1251位发生了一个碱基g的缺失突变。
153.各突变体的突变情况如图6所示。
154.9、将成功基因编辑的再生植株自交,每个单株分别收获t1代种子,按照步骤8的方法对t1代种子长成的植株进行pcr扩增与测序鉴定;将测序鉴定成功编辑的t1代植株进行自交,每个单株分别收获t2代种子,按照步骤8的方法对t2代种子长成的植株进行pcr扩增与测序鉴定;对于某一t1代植株来说,如果其自交得到的t2代植株均为鉴定成功编辑,该t1代植
株为一个纯合的基因编辑植株,该t1代植株及其自交后代为一个纯合的转基因株系,直至获得t3代phd
‑
finger17基因敲除水稻纯合株系。随机选取t3代phd
‑
finger17基因敲除水稻纯合株系crispr
‑
phd
‑
finger17
‑
1和crispr
‑
phd
‑
finger17
‑
2用于下述耐冷性分析。
155.三、phd
‑
finger17基因敲除水稻的耐冷性分析
156.1、phd
‑
finger17基因敲除水稻萌发期的耐冷性分析
157.选取饱满的野生型水稻品种日本晴(wt)、t3代phd
‑
finger17基因敲除水稻纯合株系crispr
‑
phd
‑
finger17
‑
1、t3代phd
‑
finger17超量表达水稻纯合体株系phd
‑
finger17
‑
4种子为实验材料,按照实施例3步骤三的1中的方法进行耐冷性分析。
158.结果如图7所示(crispr
‑
1代表crispr
‑
phd
‑
finger17
‑
1,ox
‑
4代表phd
‑
finger17
‑
4)。从图中可以看出:冷处理后,t3代phd
‑
finger17基因敲除水稻纯合株系crispr
‑
phd
‑
finger17
‑
1的地上部分长度和根长显著高于野生型,其中野生型水稻品种日本晴(wt)、t3代phd
‑
finger17基因敲除水稻纯合株系crispr
‑
phd
‑
finger17
‑
1的平均地上部分长度分别为2.2cm和2.5cm,野生型水稻品种日本晴(wt)、t3代phd
‑
finger17基因敲除水稻纯合株系crispr
‑
phd
‑
finger17
‑
1的平均根长分别为2.1cm和2.3cm。对照组的crispr
‑
phd
‑
finger17
‑
1水稻株系的表型、根长和地上部分长度与野生型水稻品种日本晴无显著性差异。
159.2、phd
‑
finger17基因敲除水稻幼苗期的耐冷性分析
160.选取饱满的野生型水稻品种日本晴(wt)、t3代phd
‑
finger17基因敲除水稻纯合株系crispr
‑
phd
‑
finger17
‑
1和crispr
‑
phd
‑
finger17
‑
2、t3代phd
‑
finger17超量表达水稻纯合体株系phd
‑
finger17
‑
3和phd
‑
finger17
‑
4种子为实验材料,按照实施例3步骤三的2中的方法进行耐冷性分析。
161.结果如图8所示(crispr
‑
1代表crispr
‑
phd
‑
finger17
‑
1,crispr
‑
2代表crispr
‑
phd
‑
finger17
‑
2、ox
‑
2代表phd
‑
finger17
‑
2、ox
‑
4代表phd
‑
finger17
‑
4)。从图中可以看出:冷胁迫处理后野生型水稻和phd
‑
finger17基因敲除水稻纯合株系crispr
‑
phd
‑
finger17都逐渐失绿甚至死亡,但t3代phd
‑
finger17基因敲除水稻纯合株系crispr
‑
phd
‑
finger17
‑
1和crispr
‑
phd
‑
finger17
‑
2水稻恢复后长势明显优于野生型(图8a);冷处理后,野生型水稻品种日本晴(wt)、t3代phd
‑
finger17基因敲除水稻纯合株系crispr
‑
phd
‑
finger17
‑
1和crispr
‑
phd
‑
finger17
‑
2的平均存活率分别为68%、78%和76%,phd
‑
finger17基因敲除水稻的存活率显著高于野生型(图8d);野生型水稻品种日本晴(wt)、t3代phd
‑
finger17基因敲除水稻纯合株系crispr
‑
phd
‑
finger17
‑
1和crispr
‑
phd
‑
finger17
‑
2的平均脯氨酸含量分别为200μg/g、225μg/g、215μg/g,phd
‑
finger17基因敲除水稻中的脯氨酸含量显著高于野生型(图8b);野生型水稻品种日本晴(wt)、t3代phd
‑
finger17基因编辑纯合体株系crispr
‑
phd
‑
finger17
‑
1和crispr
‑
phd
‑
finger17
‑
2的相对导电率分别为38%、32%和33%,phd
‑
finger17基因敲除水稻的相对电导率显著低于野生型(图8c)。
162.综上所述,phd
‑
finger17基因缺失提高了植物对冷胁迫的耐受性。
163.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1