一组IL-11单克隆抗体及其医药用途的制作方法
一组il-11单克隆抗体及其医药用途
技术领域
1.本发明属于肿瘤、炎症以及组织纤维化治疗和分子免疫学领域,涉及il-11抗体及其用途,具体地,本发明涉及到多种il-11单克隆抗体。
背景技术:
2.白细胞介素-11(il-11),又称脂肪生成抑制因子,是一种细胞因子,于1990年首次克隆(paul sr,et al.(1990)proc.natl.acad.sci.87:7512)。il-11基因位于人类19号染色体和小鼠7号染色体上(morris jc,et al.(1996)exp hematol24:1369;mckinley d,et al.(1992)genomics 13:814),人和鼠的il-11在氨基酸序列上有88%的同源性。虽然il-11富含脯氨酸残基并缺乏半胱氨酸残基,但该细胞因子对热稳定,熔点温度在90℃左右(czupryn m,et al.(1995)ann ny acad sci 762:152)。il-11的结构特征是由两对反平行的α-螺旋组成了四螺旋束基序,其构象呈上-上-下-下排列(putoczki,tl,et al.(2014)acta crystallographica d 70:2277)。il-11可刺激巨核细胞生成以及增加血小板计数,重组人il-11(neumega)被美国食品药品监督管理局批准用于化疗诱导的血小板减少症的治疗(neben ty,et al.(1993)blood 81:901;gordon ms,et al.(1996)blood 87:3615)。
3.il-11是白介素-6(il-6)细胞因子家族的成员,它通过与广泛表达的信号转导受体gp130和非信号转导的特异性受体(il-11r)的相互作用,影响细胞内信号转导通路(matadeen r,et al.(2007)structure 15:441)。il-11受体α链(il-11rα)与il-11低亲和力结合(亲和力常数kd为10-50nmol/l),并负责配体结合的特异性(hilton dj,et al.(1994)embo j.13,4765)。il-11/il-11ra复合物触发两个gp130分子的结合,导致高亲和力受体(kd 0.4-3.0nmol/l)的形成(yin t,et al.(1993)j.immunol.151:2555),并通过janus激酶/stat3、erk/ras、mtor/pi3k等信号通路转导信号(hilton dj,et al(1994)embo j.13:4765;david j,et al.(1997)blood 90:4403;dahmen h,et al.(1998)biochem.j.331:695)。il-11分子中有三个位点参与和受体亚基的相互作用。位点-i由ab-环(ab-loop)末端的氨基酸以及d-螺旋(d-helix)羧基末端的氨基酸构成,与il-11rα链的相互作用有关。位点-ii,由来自a-螺旋和c-螺旋的氨基酸组成,而位点-iii由d-螺旋的氨基末端部分和ab-环起始部位的残基组成。位点-ii和位点-iii参与了和gp130的结合(grotzinger j,et al.(1997)proteins 27:96;tacken i,et al.(1999)eur.j biochem.265:645;harmegnies d,et al(2003)biochem.j.375:23;barton va,et al.(1999)jbc 274:5755)。
4.il-11是一种多效细胞因子,对造血系统和非造血系统,包括肝、胃肠道、肺、心脏、中枢神经系统、骨、关节和免疫系统显示出多种作用(schwertschlag us,et al.(1999)leukemia 13:1307)。il-11信号机制突变或缺陷与许多疾病有关,包括头盖骨缝合线过早闭合,牙齿异常,如多生牙或延迟萌牙(nieminen,et al.(2011)american j of human genetics 89:67),溃疡性结肠炎(klein w,et al.(2002)genes&immunity 3:494),hirschsprung病(haase mg,et al.(2018)gene 677:163;kim lh,et al.(2015)
neurogastroenterology&motility 27:1371),以及慢性阻塞性肺疾病(klein w,et al.(2004)electrophoresis 25:804)。另一方面,il-11的表达升高与人类各种造血和上皮源性癌症有关。黑色素瘤、肝脏、乳腺、胃、结肠和非小细胞肺癌等肿瘤细胞能够产生il-11(putoczki tl,et al.(2013)cancer cell 24:257;luis-ravelo d,et al.(2013)oncogene 33:5090;furugaki k,et al.(2011)clin.exp.metastasis 28:649;gao yb,et al.(2103)j.cancer res.clin.oncol.139:669;putoczki tl,et al.(2015)immunotherapy 7:441)。il-11可以通过直接作用于癌细胞和间接作用于肿瘤微环境来促进癌症发展,包括促进血管生成、缺氧条件下肿瘤细胞的生存、对细胞凋亡和化疗的拮抗,以及促进骨和软组织(如肝和肺)中早期微转移癌细胞的生长和存活(johnstone cn,et al.(2015)cytokine&growth factor reviews 26:489)。相反,抑制il-11信号可以显著降低肿瘤负荷(putoczki tl,et al.(2013)cancer cell 24:257),针对il-11或其同源受体(il-11rα和gp130)的抗体在一些癌症的小鼠模型中有效(kapina ma,et al.(2011)plos one 6:e21878)。考虑到gp130基因敲除小鼠胚胎的致死性,靶向il-11或il-11rα可能比靶向gp130产生更少的副作用(yoshida k,et al.(1996)proc.natl.acad.sci.93:407)。
5.在肝脏疾病中观察到明显的il-11上调,并发现il-11能够通过激活肝星状细胞(肝内肌成纤维细胞的前体),促进肝纤维化(tsuchida t,et al(2017)nat.rev.gastroenterol.hepatol.14:397)。对于患有非酒精性脂肪性肝炎(nash)或原发性胆道胆管炎的患者,il-11抗体治疗对肝纤维化、炎症和脂肪变性有显著的有益作用(cook sa,et al.(2020)annu.rev.med.71:263)。il-11升高也与哮喘、特发性肺纤维化和硬皮病相关性肺间质疾病有关(lindahl ge,et al.(2013)respir.res.14:80;ng b,et al.(2019)sci.transl.med.11:eaaw1237;strikoudis a,et al.(2019)cell rep.27:3709),而且il-11表达水平与纤维化程度正相关,与肺功能呈负相关。在小鼠肺纤维化模型中,抗il-11治疗可显著降低和逆转肺胶原蛋白水平,并具有抗炎作用(minshall e,et al.(2000)j.allergy clin.immunol.105:232)。用特异性抗体阻断il-11信号,可以减轻肺结核感染小鼠的组织病理学以及中性粒细胞对肺组织的浸润,并降低肺部il-11和其他不属于th1轴的关键炎性细胞因子的水平(kapina ma,et al.(2011)plos one 6:e21878)。
6.尽管il-11是一种多功能细胞因子,在正常细胞信号传导和各种病理状态中发挥着不同的作用,但il-11基因缺失的个体仅导致头骨和牙齿轻微的发育异常,而在身体的其他方面表现健康且寿命正常,说明靶向il-11信号通路在临床治疗上的副作用可能非常有限,因此具有较高的安全性。
技术实现要素:
7.针对以上问题,本发明采用杂交瘤技术获得了一组抗il-11单克隆抗体,这些抗体在阻断il-11与其受体α链(il-11rα)或者与其功能受体复合物il-11rα/gp130的相互作用方面具有优异效果,并成功对其进行了人源化改造。这些抗体在制备应用于阻断或调节il-11信号传导、以及治疗癌症、炎症以及组织纤维化的相关药物方面有巨大的应用前景。
8.本发明提供的鼠源或人源化il-11抗体或功能性片段,包括了重链序列和轻链序列。抗人il-11鼠源抗体,重链可变区、轻链可变区的氨基酸序列信息如下:10c2重链可变区、轻链可变区的氨基酸序列分别为seq id no:1、2;16e12重链可变区、轻链可变区的氨基
酸序列分别为seq id no:3、4;18b6重链可变区、轻链可变区的氨基酸序列分别为seq id no:5、6;16f3重链可变区、轻链可变区的氨基酸序列分别为seq id no:7、8;14e1重链可变区、轻链可变区的氨基酸序列分别为seq id no:9、10;6b9重链可变区、轻链可变区的氨基酸序列分别为seq id no:11、12;26a6重链可变区、轻链可变区的氨基酸序列分别为seq id no:13、14;14f6重链可变区、轻链可变区的氨基酸序列分别为seq id no:15、16;4a2重链可变区、轻链可变区的氨基酸序列分别为seq id no:17、18;1d12重链可变区、轻链可变区的氨基酸序列分别为seq id no:19、20;抗体重链、轻链的cdr1、cdr2、cdr3氨基酸序列信息如下:10c2重链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:21、22、23,其轻链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:24、25、26;16e12重链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:27、28、29,其轻链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:30、31、32;18b6重链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:33、34、35,其轻链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:36、37、38;16f3重链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:39、40、41,其轻链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:42、43、44;14e1重链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:45、46、47,其轻链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:48、49、50;6b9重链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:51、52、53,其轻链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:54、55、56;26a6重链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:57、58、59,其轻链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:60、61、62;14f6重链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:63、64、65,其轻链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:66、67、68;4a2重链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:69、70、71,其轻链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:72、73、74;1d12重链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:75、76、77,其轻链cdr1、cdr2、cdr3氨基酸序列分别为seq id no:78、79、80。
9.进一步,抗人il-11抗体或片段经过改造后,成为人源化抗体。
10.分离的核酸分子,其编码上述的抗体或功能性片段。
11.抗人il-11人源化抗体10c2重链可变区氨基酸序列为seq id no:81,其轻链可变区氨基酸序列为seq id no:82;人源化抗体16e12重链可变区氨基酸序列为seq id no:83,其轻链可变区氨基酸序列为seq id no:84。
12.本发明公开了对上述人源化抗体10c2和16e12序列的进一步改造,目的是为了进一步提高抗体的人源化程度以及去除潜在的脱酰胺化和异构化位点。
13.表达载体,包含上述抗体的核酸分子。
14.药物组合物,其包含上述的抗体或其功能片段,以及药用载体。
15.上述的抗体或其功能性片段,核酸分子、表达载体、宿主细胞、药物组合物在制备il-11抗体免疫功能药物的用途。
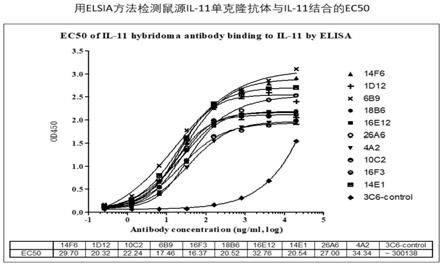
16.本专利采用重组的il-11作为抗原,免疫小鼠后,将小鼠脾脏细胞与骨髓瘤细胞融合获得杂交瘤细胞。通过对大量杂交瘤细胞进行多次克隆及筛选,得到多个单克隆杂交瘤细胞株。这些杂交瘤细胞株可以分泌产生与il-11特异性结合的单克隆抗体(图1),这些单克隆抗体能够有效阻断il-11与il-11rα或者与il-11rα/gp130的结合(图2,图3),并能显著抑制il-11诱导的转录因子stat3的磷酸化(图4)。进一步地,通过rt-pcr(reverse transcription-polymerase chain reaction,逆转录聚合酶链式反应)克隆编码抗体轻链
和重链可变区的基因,采用互补决定簇嫁接方法(complementarity-determining regions graft,cdr-graft)构建人源化抗体,并通过对抗体cdr序列的突变以及亲和力测试,进一步提高人源化抗体的人源化程度。体外功能实验表明,人源化il-11抗体能特异性结合il-11蛋白(图5),可阻断il-11与il-11rα或者与il-11rα/gp130结合(图6、图7),并能显著抑制il-11诱导的转录因子stat3的磷酸化(图8)。本专利中使用的阳性对照(positive control)采用了专利us20200031918a1中的3c6抗体序列。与阳性对照相比,本专利中获得的抗体与il-11结合的亲和力更高,阻断il-11与其受体结合的活性更强,抑制il-11诱导的转录因子stat3的磷酸化作用更显著。
附图说明
17.图1:用elsia方法检测鼠源il-11单克隆抗体与il-11结合的ec50
18.图2:用elsia方法检测鼠源il-11单克隆抗体阻断il-11与il-11rα/gp130结合的ic50
19.图3:用facs方法检测鼠源il-11单克隆抗体阻断il-11与细胞表面il-11rα/gp130受体结合的ic50
20.图4:用报告基因方法检测鼠源il-11单克隆抗体抑制il-11诱导的转录因子stat3磷酸化的ic50
21.图5:用elsia方法检测人源化il-11抗体与il-11结合的ec50
22.图6:用elsia方法检测人源化il-11抗体阻断il-11与il-11rα/gp130结合的ic50
23.图7:用facs方法检测人源化il-11抗体阻断il-11与细胞表面il-11rα/gp130受体结合的ic50
24.图8:用报告基因方法检测人源化il-11抗体抑制il-11诱导的转录因子stat3磷酸化的ic50
具体实施方式
25.实施例1
26.鼠源杂交瘤抗体的制备
27.用重组人il-11作为抗原,与等体积完全弗氏佐剂(sigma,cat no:f5581)充分乳化后,经皮下免疫6-8周龄balb/c小鼠(购自上海灵畅生物科技有限公司),抗原免疫量为20μg/只。随后每隔2周,用相同剂量的抗原与不完全弗氏佐剂(sigma,cat no:f5506)充分乳化后,经皮下免疫小鼠三次。免疫三次后测定小鼠血清效价。融合前3天经腹腔进行加强免疫。以peg hybri-max(sigma,cat no:7181)作为融合剂,将小鼠脾脏细胞与sp2/0细胞按照4:1的比例混合。将融合后的细胞加入到96孔板中(1
×
10^5细胞/孔),每孔含有0.1ml 1x hat培养基(invitrogen,cat no:21060-017)。在第3天加入0.1ml ht(invitrogen,cat no:11067-030)培养基,在第7天吸掉96孔板中的培养基,补加0.2ml新鲜的ht培养基。在第9天,收取上清液进行elisa和facs检测。
28.实施例2
29.与il-11结合抗体的elisa筛选
30.用il-11包被96孔elisa板(corning,cat no:9018),置4度过夜。用洗涤缓冲液
(pbs+0.05%tween20)洗涤3次后,加入封闭缓冲液(pbs+1%bsa)(bsa购自sigma,cat no:v90093)孵育1小时;洗涤96孔板3次;加入杂交瘤上清孵育1小时,洗涤3次;每孔加入100μl 1:10000倍稀释的羊抗鼠igg二抗(thermo,cat no:31432),室温孵育1小时后洗涤3次;每孔加入100μl tmb(北京百奥赛博,cat no:es-002)显色3分钟,再加入100μl/孔的终止液(2n h2so4)终止反应,用tecan spark酶标仪测定各样品的od450信号。
31.实施例3
32.能够阻断il-11/il-11rα复合物与gp130结合的抗体的elisa筛选。
33.采用竞争elisa筛选能够阻断il-11/il-11rα复合物与gp130结合的杂交瘤抗体。用羊抗人igg抗体(goat anti-human igg,jackson,cat no:109-005-008)包被96孔elisa板,孵育过夜,用洗涤缓冲液(pbs+0.05%tween 20)洗涤3次后,加入
34.200μl封闭缓冲液,孵育1小时;洗涤3次后加入100μl 1ug/ml携带人fc标签的gp130(gp130-hfc),室温孵育1小时;预先将杂交瘤上清与终浓度为10ng/ml带生物素标记的il-11(il-11-biotin)在4℃孵育30分钟,继续向混合液中加入终浓度为80ng/ml的il-11rα,4℃孵育30分钟;将混合液加入96孔elisa板中,室温孵育1小时;洗涤3次后加入二抗avidin hrp(invitrogen,cat no:18-4100-51),孵育30分钟,加入tmb显色3分钟,用100μl/孔的终止液(2n h2so4)终止反应,用tecan spark酶标仪测定各样品的od450信号。
35.杂交瘤的亚克隆。用有限稀释法,对能够阻断il-11/il-11rα复合物与gp130结合的杂交瘤进行亚克隆,随后再重复采用elisa方法进行检测筛选,进而获得阳性杂交瘤单克隆。将阳性单克隆杂交瘤置50ml无血清培养基中(invitrogen,cat no:12045-076)培养9天,离心收取上清液。用protein a亲和层析纯化单克隆抗体。纯化后的抗体样品经超滤离心管(millipore,cat no:acs500024)换液浓缩后,用bca方法测定蛋白浓度,用鳌试剂(厦门鲎试剂生物科技股份有限公司)检测抗体样品的内毒素含量。用elisa检测纯化的抗体样品与il-11的结合及其阻断il-11/il-11rα复合物与gp130结合的活性。具体结果见表1-2和图1-2。
36.表1.用elsia方法检测il-11杂交瘤抗体与il-11结合的ec50
[0037][0038]
表2.用elsia方法检测il-11杂交瘤抗体阻断il-11结合il-11rα/gp130的ic50
[0039][0040]
实施例4
[0041]
阻断il-11与细胞表面il-11rα/gp130受体复合物结合的抗体筛选。
[0042]
用培养基配制浓度为80μg/ml的抗体溶液,再用培养基进行5倍浓度的系列稀释,制备10个稀释浓度的抗体溶液。取25μl各稀释浓度的抗体溶液加入到96孔u底板中。用培养基配制浓度为40ng/ml的il-11-biotin溶液,取25μl il-11-biotin溶液加入到上述96孔板
中,混匀,置4℃避光孵育1小时。用培养基悬浮293t-il-11rα-gp130细胞,细胞密度为4
×
10^6/ml。取50μl细胞悬液加入到上述96孔板中(2
×
10^5细胞/孔),混匀,置4℃避光孵育1小时。在室温下,将96孔板以1500rpm速度离心3分钟,弃上清。各孔加入200μl facs缓冲液(pbs+3%fbs),混匀,室温下1500rpm离心3分钟,弃上清。重复洗涤两次。用facs缓冲液1:4000稀释携带pe标记的抗生物素抗体(pe anti-biotin,biolegend,cat no:409004),取100μl加入到96孔板,混匀,置4℃避光孵育30分钟。将96孔板以1500rpm速度离心3分钟,弃上清。加入facs缓冲液,洗涤三次。将细胞重悬于200μl facs缓冲液,用bd c6流式细胞仪检测293t-il-11rα/gp130细胞的pe信号。il-11抗体阻断il-11与细胞表面il-11rα/gp130受体复合物结合的检测结果见表3和图3。
[0043]
表3.用facs方法检测il-11杂交瘤抗体阻断il-11结合293t-il-11rα/gp130细胞的ic50
[0044][0045]
实施例5
[0046]
具有阻断il-11信号传导功能的抗il-11单克隆抗体的筛选
[0047]
用rpmi1640培养基悬浮dld1-il-11r-pstat3-luc细胞,细胞密度为1x10^6cell/ml。取50μl细胞悬液加入96孔板中(5x10^4细胞/孔),置37℃过夜培养。用培养基配制浓度为4ng/ml的il-11以及80μg/ml抗体溶液。再用培养基对上述抗体溶液进行5倍浓度的系列稀释,制备10个稀释浓度的抗体溶液。取30μl il-11溶液分别与30μl系列稀释的il-11抗体溶液混合,置室温孵育1小时。取50μl上述混合溶液,加入到dld1-il-11r-pstat3-luc细胞96孔培养板中,置37℃培养4.5小时。在96孔板中加入25μl bright-glo(promega,cat no:e2620),混匀,置室温避光孵育3分钟,用tecan spark酶标仪测定各样品的发光信号(rfu)。il-11单克隆抗体抑制il-11诱导的转录因子stat3磷酸化的测试结果见表4和图4。
[0048]
表4.il-11杂交瘤抗体抑制il-11诱导的转录因子stat3磷酸化的ic50
[0049][0050]
实施例6
[0051]
il-11抗体可变区基因的克隆
[0052]
用trizon(cwbiotech,cat no:cw0580)裂解il-11单克隆杂交瘤细胞株,提取杂交瘤细胞的总rna。用hifi script cdna合成试剂盒(cwbiotech,cat no:cw2569)将杂交瘤细胞的rna反转录为cdna。以cdna为模板,用简并引物通过pcr方法(kettleborough et al.(1993)eur j immunology 23:206-211;strebe et al.(2010)antibody engineering 1:3-14)扩增抗体的重链和轻链的可变区基因。将pcr扩增产物连接到t/a载体后,转化dh5a感受态细胞,涂板并置37℃过夜培养。从培养板上挑取单克隆,扩大培养后抽提质粒,测定抗体的基因序列。根据kabat方法分析抗体序列中的互补决定簇(cdr)和骨架区。抗体的重链
和轻链的可变区以及cdr氨基酸序列编号见表5。
[0053]
表5.il-11杂交瘤抗体序列
[0054]
[0055]
[0056]
[0057]
[0058]
id no:82。16e12人源化抗体重链和轻链可变区的氨基酸序列号分别为seq id no:83和seq id no:84(表6)。将10c2和16e12人源化抗体构建为igg4亚型。
[0065]
合成编码16e12和10c2人源化抗体轻链和重链的核酸片段,并插入到表达载体pcdna3.1。用抗体轻链和重链表达质粒各0.1mg共转染200毫升293细胞(细胞密度为1
×
10^6),在37度振摇培养6天,离心收集上清液,用protein a纯化人源化抗体,纯化后的人源化抗体用于活性检测。
[0066]
为了进一步提高16e12抗体的人源化程度以及去除潜在的脱酰胺化和异构化位点,我们对上述16e12人源化抗体的cdr序列进行了突变。突变的抗体表达纯化后,用biacore测定了其与il-11的亲和力(见表7),结果表明,人源化抗体n54s,n54q,g55v,g55a,n60a,e61q,k64q,n65g,l94h位点的突变并不影响其与il-11的结合。
[0067]
表6.il-11人源化抗体序列
[0068][0069]
实施例8
[0070]
人源化抗体及其突变体的亲和力检测
[0071]
测定方法包括如下步骤:以氨基偶联的方式将anti-human igg固定于cm5芯片上,接着以10μl/min的流速捕获人源化抗体。切换流速到30μl/min,将不同浓度的il-11抗原(50nm,25nm,12.5nm,6.25nm,3.125nm,1.5625nm)依次流经样品通道和参比通道,结合时间为3min,解离时间为20min。最后用ph1.7的甘氨酸缓冲液再生芯片。人源化抗体亲和力测定具体结果见表7。
[0072]
表7.人源化il-11抗体及其突变体与il-11抗原的亲和力。
[0073]
antibodycdr突变位点ka(1/ms)kd(1/s)kd(m)hu10c2wild type1.47e+062.20e-051.49e-11hu16e12wild type2.96e+064.66e-051.58e-11hu16e12k64q n65g3.68e+065.76e-051.57e-11hu16e12e61q n65g2.35e+068.54e-053.63e-11
hu16e12n60a n65g2.81e+067.51e-052.68e-11hu16e12n65g2.78e+065.25e-051.89e-11hu16e12n54q2.78e+061.01e-043.63e-11hu16e12n54s2.86e+067.00e-052.45e-11hu16e12g55v2.41e+069.32e-063.87e-12hu16e12g55a2.96e+063.56e-051.20e-11hu16e12l94h2.09e+063.91e-061.87e-12
[0074]
实施例9
[0075]
人源化il-11抗体的活性检测
[0076]
采用elisa和facs检测纯化的人源化抗体样品与il-11的结合,及其阻断il-11与il-11rα/gp130结合的活性,具体方法参考实施例1-4。用报告基因方法检测il-11人源化抗体抑制il-11诱导的转录因子stat3磷酸化的ic50,具体方法参考实施例5。本专利中使用的阳性对照(positive control)采用了专利us20200031918a1中的3c6抗体序列。人源化抗体的活性测定结果见表8-11和图5-8。
[0077]
表8.用elsia方法检测il-11人源化抗体与il-11结合的ec50
[0078] hu10c2-higg4hu16e12-higg4control-3c6ec50(ng/ml)65.8562.4122477
[0079]
表9.用elsia方法检测il-11人源化抗体阻断il-11与il-11rα/gp130结合的ic50
[0080] hu10c2-higg4hu16e12-higg4control-3c6
[0081][0082]
表10.用facs方法检测il-11人源化抗体阻断il-11与293t-il-11rα/gp130细胞结合的ic50
[0083] hu10c2-higg4hu16e12-higg4control-3c6ic50(ng/ml)81.1167.924194
[0084]
表11.il-11人源化抗体抑制il-11诱导的转录因子stat3磷酸化的ic50
[0085] hu10c2-higg4hu16e12-higg4control-3c6ic50(ng/ml)4.8581.159177.5
[0086]
以上实施例的结果表明,本发明所述的抗体或者抗原结合片段,能够有效阻断il-11与其受体结合、调节il-11活性、抑制il-11的信号传导。这些抗体在开发用于预防和治疗肿瘤以及肝和肺组织纤维化相关药物方面具有良好的应用前景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1