一种水貂IFN-ε成熟肽的制备方法
一种水貂ifn
‑
ε
成熟肽的制备方法
技术领域
1.本发明涉及一种干扰素的制备方法,特别涉及一种水貂ifn
‑
ε成熟肽的制备方法。本发明属于生物技术领域。
背景技术:
2.干扰素(interferon,ifn)是一类具有广泛生物学活性的蛋白质,具有调节机体免疫功能、抗病毒等作用,是机体防御系统的重要组成部分。自从isaacs和lindenmann发现干扰素以来已经有50多年的历史,人们对ifn的研究、开发及应用从未停止过。目前,ifn已被证实在人医临床上对多种病毒病的辅助治疗效果显著。2003kotenko等根据ifn蛋白家族基于它们的基因序列、染色体定位和受体特异性分为三型,即ⅰ型、ⅱ型和ⅲ型干扰素,ⅰ型包括ifn
‑
α、β、ω、ε、κ、δ、τ、ζ等,ⅱ型干扰素由单基因家族ifn
‑
γ构成,又称为免疫干扰素。1999年首次报道了人的ε
‑
干扰素(ifn
‑
ε),其主要在肺脏、脑、小肠和生殖系统组织中表达,之后老鼠、猪、犬的ifn
‑
ε基因逐步被报道。ifn
‑
ε被认为在生殖功能中起到重要作用,在哺乳动物胎盘保护病毒感染及早期胎盘发育有重要作用。截止目前,只有人、恒河猴、牛和犬的ifn
‑
ε的生物学功能有相关报道,还未见水貂(mustela vison)ifn
‑
ε基因克隆和表达方面的相关研究报道。
3.近几年我国毛皮动物产业发展较迅速,是国际上少数毛皮动物养殖业发达的国家之一,由于水貂犬瘟热、细小病毒病和阿留申病毒病等危害养貂业传染病时常发生,造成严重经济损失。这些病毒性传染病发病急,死亡率高,普通药物治疗效果不理想,因此研制开发具有抗病毒活性的基因工程干扰素制剂,是一种理想的选择。
技术实现要素:
4.本发明的目的之一在于提供一种优化后的水貂ifn
‑
ε成熟肽的编码核苷酸序列。
5.本发明的目的之二在于提供一种水貂ifn
‑
ε成熟肽的制备方法。
6.为了达到上述目的,本发明采用了以下技术手段:
7.本发明的一种优化后的水貂ifn
‑
ε成熟肽的编码核苷酸序列,所述的核苷酸序列如seq id no.1所示。
8.进一步的,本发明还提出了所述的核苷酸序列在制备水貂ifn
‑
ε成熟肽中的应用。
9.更进一步的,本发明还提出了一种水貂ifn
‑
ε成熟肽的制备方法,包括以下步骤:
10.(1)合成优化后的水貂ifn
‑
ε成熟肽的编码核苷酸序列,如seq id no.1所示,与ta克隆载体连接构建得到含有优化后的水貂ifn
‑
ε成熟肽的编码核苷酸序列的载体;
11.(2)设计用于扩增水貂ifn
‑
ε成熟肽基因的引物,引物序列如下:
12.上游:5
’–
cggggtaccgacgacgacgacaag ttagaactgaaactg
‑3’
;
13.下游:5
’‑
ccgctcgag tcaaacaatggtccag;
14.以稀释后的含有优化后的水貂ifn
‑
ε成熟肽的编码核苷酸序列的载体溶液为模板,采用上述引物进行pcr扩增,pcr产物回收纯化后,与表达载体连接并转化e.coli.感受
态细胞中,经pcr及酶切鉴定后,得到含有优化后的水貂ifn
‑
ε成熟肽的编码核苷酸序列的表达载体;
15.(3)将步骤(2)中得到的含有优化后的水貂ifn
‑
ε成熟肽的编码核苷酸序列的表达载体转化bl21(de3)感受态细胞,当菌液od
600
数值达到0.4~0.6时加入iptg诱导表达,37℃恒温摇床培养;
16.(4)培养结束后,取出菌液,离心,去除上清液体保留沉淀;用pbs对沉淀进行重悬后,离心去除上清液体保留沉淀,用1/10原菌液体积的pbs进行重悬,应用ni
‑
nta纯化蛋白,纯化后的蛋白即为水貂ifn
‑
ε成熟肽,置
‑
80℃冻存,。
17.其中,优选的,步骤(1)中所述的ta克隆载体为pmd18
‑
t载体。
18.其中,优选的,步骤(2)中所述的表达载体为pet
‑
32a表达载体。
19.其中,优选的,步骤(2)中水貂ifn
‑
ε成熟肽基因扩增反应体系为:10
×
eхtaq buffer2.5μl,2.5mmol/μl dntp4μl,25pmol/μl上、下游引物各1μl,25pmol taq dna聚合酶1μl,加入3μl稀释100倍后的pmd18
‑
t/miifn
‑
ε质粒溶液为模板,用灭菌去离子水补足25μl;反应条件为:将25μl反应液混匀后,于pcr仪上进行扩增,循环参数为95℃预变性5min,94℃45s,53℃45s,72℃50s,34个循环后72℃延伸10min。
20.按照所述的方法制备得到的水貂ifn
‑
ε成熟肽也在本发明的保护范围之内。
21.最后,本发明还提出了所述的水貂ifn
‑
ε成熟肽在制备抗病毒制剂中的用途。
22.相较于现有技术,本发明的有益效果是:
23.本发明构建了含有优化后的编码水貂ifn
‑
ε成熟肽基因的重组表达载体,并在大肠杆菌中成功表达。对其抗病毒活性进行分析,结果显示,得到的重组水貂ifn
‑
ε成熟肽具有明显的抗病毒活性。
附图说明
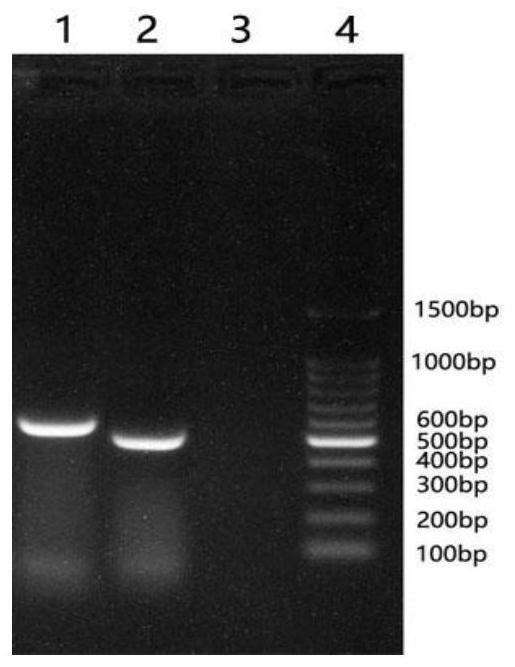
24.图1为pcr扩增ifn
‑
ε结果;
25.其中:1.水貂ifn
‑
ε基因扩增;2.ifn
‑
ε成熟肽基因扩增;3.阴性对照;4.100bp dnamarker;
26.图2为minkifn
‑
ε基因的核酸序列和氨基酸序列;
27.注:下划线为信号肽编码序列;
28.图3为编码水貂ifn
‑
ε成熟肽基因序列与大肠杆菌密码子优化后的基因序列比对;
29.图4为水貂ifn
‑
ε基因在大肠杆菌中的表达及纯化;
30.其中:1.蛋白分子量marker;2.未诱导对照;3.重组mmiifn
‑
ε在大肠杆菌中表达全菌;4.裂解后离心沉淀;5.裂解离心上清;6.表达产物纯化
31.图5为ifn
‑
εwestern bloting鉴定;
32.1.蛋白marker;2.空载体对照;3.未诱导对照;4,5.ifn
‑
ε诱导样品。
具体实施方式
33.下面结合具体实施例对本发明作进一步说明,但本发明不限于以下实施例。本领域技术人员应该理解的是,在不偏离本发明的精神及范围下可对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
34.实施例1水貂ε
‑
干扰素成熟肽基因(miifn
‑
ε)的克隆及表达
35.1材料与方法
36.1.1实验材料
37.1.1.1菌种e.coli.dh5α感受态菌株由本实验室保存;
38.1.1.2试剂pmd18
‑
t载体、extaq聚合酶、amv反转录酶及植物血凝素(pha)购自宝生物工程(大连)有限公司;rpmi1640购自gibco公司,淋巴细胞分离液购自中国医学科学院;trizol细胞裂解液购invitrogen公司;胶回收试剂盒购自杭州博日科技有限公司;引物由生工生物工程(上海)公司合成。
39.1.1.3实验动物6月龄水貂购自中国农业科学院特产研究所毛皮动物养殖基地;
40.1.2方法
41.1.2.1引物设计与合成
42.根据genbank上发表的肉食兽ifn
‑
εcdna全序列设计扩增引物,引物序列如下:
43.ifn
‑
εf:5
’‑
atgattaacaagcattt
‑3’
;
44.ifn
‑
εr:5
’‑
ttatttgcttagctttctt
‑3’
。
45.1.2.2水貂ifn
‑
ε诱生
46.无菌采取健康水貂外周抗凝血分离淋巴细胞,细胞用含25μg/mlpha(植物血凝素)、300μl犬瘟热病毒cdv3疫苗株(tcid
50
=10
5.6
)和10%小牛血清的rpm
‑
1640培养液悬浮,取细胞悬液计数,按计数结果将细胞悬液稀释至1
×
107个/ml浓度,置37℃co2培养箱培养12
‑
24h。
47.1.2.3水貂ifn
‑
ε基因扩增及序列分析
48.收集诱导的淋巴细胞,用trizol reagent重悬。加入1/5trizol体积氯仿,混匀后静止3min,12000r/min离心10min,吸取上清,加入1/2trizol体积的异丙醇,混匀后放置
‑
20℃沉淀1h,12000r/min离心15min,将沉淀用75%乙醇洗涤1次,倒置控干后用9.5μl的0.1%的depc处理的灭菌水溶解沉淀,即获得淋巴细胞总rna。
49.采用rt
‑
pcr方法扩增ε
‑
干扰素基因。具体操作如下:在9.5μl的rna溶液中加入1μloligo(dt)
15
引物(50pmol/μl),混匀后置70℃水浴锅作用5min后立即冷却,依次加入10mmol/l dntp 5μl,amv buffer 4μl,rnase inhibitor0.5μl,amv 1μl充分混匀后置pcr仪上42℃1h,95℃3min灭活反转录酶,冷却后直接用于pcr反应。
50.pcr反应体系:10
×
eхtaq buffer 2.5μl,2.5mmol/μl dntp 2μl,上、下游引物(25pmol/μl)各1μl,25pmol,taq dna聚合酶(2u/μl)0.125μl,加入17.375μl灭菌去离子水。将25μl反应液混匀后,于pcr仪上进行扩增,循环参数为95℃预变性5min,94℃45s,52.5℃50s,72℃1min,32个循环后72℃延伸6min,扩增完毕后,取6μl于1.5%琼脂糖凝胶电泳观察结果。用胶回收目的基因,构建ta克隆,经pcr、酶切和测序鉴定,所扩增序列即为目的基因。pcr扩增结果见图1,测序结果见图2。
51.1.2.1成熟肽基因扩增及表达载体构建
52.根据软件预测(signalp4.0 server),预测水貂ifn
‑
ε基因编码的前21个氨基酸为信号肽序列,水貂ifn
‑
ε成熟肽基因(miifn
‑
ε基因)片段长501p,编码167个氨基酸。对原序列进行大肠杆菌表达密码子优化并基因合成,其核苷酸序列如seq id no.1所示,与pmd18
‑
t载体连接构建得到含有优化后的成熟肽基因的载体,命名为pmd18
‑
t/miifn
‑
ε。优化密码
子基因序列与原序列比对结果见图3。
53.设计用于扩增水貂ifn
‑
ε成熟肽基因的引物,引物序列如下:上游引物:5
’–
cggggtaccgacgacgacgacaagctggaactgaaactg
‑3’
(划线部分为kpni酶切位点);下游引物:5
’‑
ccgctcgagttatttagacagttta(划线部分为xhoi酶切位点)。
54.成熟肽基因pcr扩增反应体系:10
×
eхtaq buffer2.5μl,2.5mmol/μl dntp4μl,上、下游引物(25pmol/μl)各1μl,25pmol taqdna聚合酶(2.5u/μl)1μl,加入3μl稀释100倍后的pmd18
‑
t/miifn
‑
ε质粒溶液为模板,用灭菌去离子水补足25μl。将25μl反应液混匀后,于pcr仪上进行扩增,循环参数为95℃预变性5min,94℃45s,53℃45s,72℃50s,34个循环后72℃延伸10min。pcr产物于1.5%琼脂糖凝胶电泳观察结果,结果如图1所示。
55.pcr产物经1.5%琼脂糖凝胶电泳回收纯化后,再经kpni和xhoi双酶切。回收小片段;用t4dna连接酶将目的基因片段与表达载体pet
‑
32a(kpni和xhoi双酶切纯化产物)连接并转化e.coli./bl21感受态细胞中,经pcr及酶切鉴定(kpni和xhoi双酶切)后,初步鉴定为阳性的克隆送生工生物工程(上海)公司测序,应用dnastar软件对测序结果进行分析,正确的重组质粒命名为pet
‑
32a/miifn
‑
ε。
56.1.2.2 miifn
‑
ε基因在大肠杆菌中的表达及纯化
57.将1.2.1中鉴定为阳性的pet
‑
32a/miifn
‑
ε质粒转化bl21(de3)感受态细胞,经pcr和双酶切鉴定为阳性的克隆保菌,经测序鉴定为阳性的菌,当菌液od
600
数值达到0.4~0.6时取出菌液1ml作为未诱导对照,剩余9ml菌液加入iptg22.5μl诱导表达,终浓度1mmol/l,未诱导菌液与诱导菌液同时放置到37℃恒温摇床(摇动幅度185转)5
‑
6小时后取出。
58.菌液取出后,10000r/min离心2min,去除上清液体保留沉淀。用pbs对沉淀进行重悬后,10000r/min离心2min去除上清液体保留沉淀。诱导菌液与未诱导菌液沉淀用1/10原菌液体积进行重悬,取出100μl诱导菌液作为全菌对照。将诱导重悬菌液进行2
‑
3次冻融。对诱导菌液进行超声破碎,破碎功率为400w。超声3秒停止6s超声破碎到菌液不挂壁为止。超声破碎后的菌液12000r/min离心10min。吸取上清,沉淀用100μl重悬。对照样品、全菌样品、上清样品、沉淀样品分别与sds
‑
page蛋白上样缓冲液(1
×
)1︰1混匀煮沸5min,直接用于sds
‑
page电泳检测。
59.采用15%的分离胶、4.5%的浓缩胶进行sds
‑
page电泳,sds
‑
page结果如图4所示,iptg诱导株在19kda左右表达出了一条特异蛋白带,与预测分子量大小一致,蛋白产量约占菌体总蛋白的30%。经蛋白可溶性分析,所表达蛋白以可溶形式存在。sd s
‑
page做鉴定正确后进一步做western
‑
blot分析。电转条件为200ma恒流转印1h40min,转印结束后先封闭2h,然后以鼠抗6
×
h is的单抗为一抗,以羊抗鼠igg
‑
hrp为二抗分别于37℃反应1h,最后用显色试剂盒显色,结果见图4。结果只在19kda处有一特异反应带,与sds
‑
page结果相一致,结果见图5。挑取含有阳性重组质粒pet32a/mifn
‑
ε的e.coli bl21表达菌株单菌落,大体积诱导收集菌体,应用ni
‑
nta纯化蛋白,产物浓缩后经sds
‑
page电泳后染色,结果显示杂蛋白很少,纯度达到90以上,纯化效果良好。纯化后的蛋白置
‑
80℃冻存。
60.实施例2水貂ifn
‑
ε成熟肽(miifn
‑
ε)的抗病毒活性测定
61.实施例1制备得到的纯化后的重组水貂ifn
‑
ε成熟肽,采用细胞病变抑制法在wish/vsv系统上测定其抗病毒活性,以抑制50%细胞病变(cpei
50
)的最高干扰素稀释度为1个活性单位(u)。
62.采用细胞病变抑制法,以能抑制50%细胞病变的干扰素最高稀释度作为一个单位,每次测定设干扰素参考标准品对照。将wish细胞接种于96孔培养板,置于37℃,5%co2温箱中培养12~18h,长成单层后,去除营养液,依次加入稀释的ifn检品,每个稀释度各加两孔。同时设不同稀释度的ifn标准品对照,细胞对照和病毒对照。37℃,5%co2温箱孵育过夜。去除ifn溶液,用100tcid
50
的vsv(水疱性口炎病毒,vesicular stomatitis virus)攻击(细胞对照孔加入不含病毒的营养液),再培养1~2d。待病毒对照孔细胞全部或75%以上出现明显病变时,在倒置显微镜下观察结果。观察结果显示,加入100tcid
50
的vsv病毒进行攻毒,24h后观察可见对照孔完全出现严重病变,在其孔中发现水疱性口炎病毒在wish细胞上的典型病变,任何都不加的细胞对照显示正常。
63.应用wish/vsv系统微量细胞病变抑制法测定浓缩后的miifn
‑
ε表达产物,在加入高于4
‑4浓度的miifn
‑
ε重组蛋白,病变被完全抑制;经过多3次实验重复测得重组miifn
‑
ε样品抗病毒活性为0.23
×
104iu/mg。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1