一种融合蛋白的构建及其降解聚合物的方法和应用
本发明涉及一种融合蛋白的构建及其降解聚合物的方法和应用,属于酶工程技术领域。
背景技术:
废纸回收利用在减少污染、改善环境、节约资源与能源方面产生了巨大的经济效益与环境效益,是实现造纸工业可持续发展以及社会可持续发展的重要方向之一。然而,废纸回收利用率的提高,以及制浆造纸白水循环系统的封闭程度不断的提高,导致胶黏物不断积累。废纸循环利用过程中胶黏物的去除和控制已经成为一个越来越迫切的问题。胶黏物通常用来描述二次纤维回收过程中各种各样的沉积物,分为原生胶黏物和二次胶黏物两种。原生胶黏物存在于纸浆中,在造纸碎浆和后续处理过程中以固体形态分散在纸浆中,由于具有一定的黏性,容易在纸浆中发生沉积,造成生产事故;二次胶黏物以溶解形式分散在纸浆中且不具有粘性,由于造纸过程中助剂的添加,同时纸浆的物理化学环境发生变化时,二次胶黏物会失稳形成较大黏性聚集体,导致在纸浆中发生沉积,造成生产事故。纸浆中二次胶黏物的浓度比原生胶黏物多,并且具有更大的控制难度和更严重的危害性,因此,对二次胶黏物的控制尤为重要。
具有高效、专一、对环境无污染等优势的生物酶法在聚酯等聚合物控制中的应用受到国内外造纸行业的重视。在诸多生物酶法处理中,酯酶的效果最为显著。角质酶最初被认为是一种降解角质并产生大量脂肪酸单体的酯酶。而后研究发现角质酶是一种多功能酶,可水解可溶性酯、不溶性甘油三酯和各种聚酯。实验证实,角质酶对胶黏物的主要聚酯成分聚丙烯酸酯pea和聚醋酸乙烯酯pvac有一定的降解作用,可以通过水解这两种底物的酯键使得其不会再与其他成分相聚集。但是聚酯在水相环境中主要以固体形式存在,因此酶的催化活性中心与长链聚酯的结合能力有限,造成了降解效率的低下。
技术实现要素:
鉴于上述由于角质酶与聚酯物质的结合能力有限,而造成的对胶黏物降解率低下的问题,若能提高酶与底物的结合效率,将会提高酶对底物的降解效率。因此,本发明通过构建锚定肽和角质酶的融合蛋白来去除造纸过程中产生的胶黏物。
本发明提供了一种融合角质酶,将角质酶和锚定肽通过连接肽融合而成。
在一种实施方式中,在角质酶的n端或c端融合锚定肽和连接肽。
在一种实施方式中,所述锚定肽来源于家蚕、黑腹果蝇、大肠杆菌、维氏芽孢杆菌和/或中华鲎。
在一种实施方式中,编码所述锚定肽的核苷酸序列如seqidno.2-6所示,或氨基酸序列经过取代、缺失或添加一个或几个氨基酸衍生的具有锚定肽活性的突变体。
在一种实施方式中,所述角质酶来源于特异腐质霉,或氨基酸序列经过取代、缺失或添加一个或几个氨基酸衍生的具有角质酶活性的突变体。
在一种实施方式中,编码所述角质酶的基因的核苷酸序列如seqidno.1所示。
在一种实施方式中,编码所述连接肽的核苷酸序列如seqidno.7-12任一所示。
在一种实施方式中,所述融合角质酶的组合方式为:seqidno.1-no.7-no.2、seqidno.2-no.12-no.1、seqidno.1-no.10-no.3、seqidno.3-no.11-no.1、seqidno.1-no.8-no.6、seqidno.1-no.9-no.4、或seqidno.1-no.10-no.5。
本发明提供了一种降解聚合物的方法,利用所述融合蛋白清除聚合物。
在一种实施方式中,所述聚合物包括聚丙烯酸酯pea和聚醋酸乙烯酯pvac。
在一种实施方式中,将所述融合蛋白添加至含有聚合物的体系中,在ph5.0-9.0、20-70℃下反应。
本发明提供了一种重组菌,其所述重组菌表达所述融合角质酶。
在一种实施方式中,以大肠杆菌、枯草芽孢杆菌或酵母为宿主。
在一种实施方式中,将锚定肽和连接肽linker的核苷酸序列通过megawhop技术按相应顺序插入到已经含有角质酶基因序列的相应表达载体上,将重组表达载体转化入大肠杆菌,或芽孢杆菌,或酵母中。
本发明提供了所述融合蛋白,或所述重组菌在降解造纸胶黏物以及类似物中的应用。
在一种实施方式中,所述造纸胶黏物包括聚丙烯酸酯pea和聚醋酸乙烯酯pvac。
本发明的有益效果:
本发明通过表达角质酶和聚酯锚定肽的融合蛋白,提高了角质酶对胶黏物模式底物的处理效果;利用本发明的方法,用融合蛋白酶液处理胶黏物的模式底物pea和pvac,与等量的角质酶相比降解效果分别提高了24%~210.7%和83.8~503.8%。
附图说明
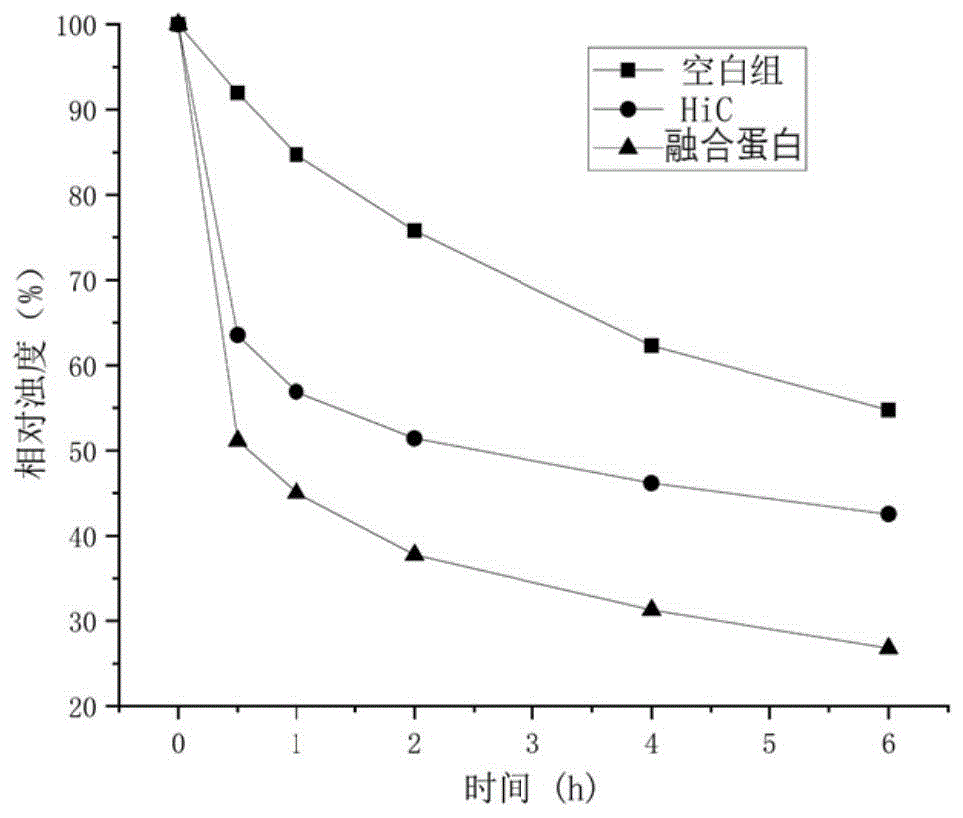
图1为pea相对浊度变化图;
图2为pvac相对浊度变化图。
具体实施方式
下述实施例中涉及的大肠杆菌jm109、大肠杆菌bl21(de3)购自生工生物工程(上海)股份有限公司,pet-20b(+)质粒购自novagen公司,pea和pvac购自上海sigma公司。
下述实施例中涉及的培养基如下:
lb培养基:胰蛋白胨10g/l,酵母粉5g/l,氯化钠10g/l;
tb培养基:胰蛋白胨12g/l,酵母粉24g/l,甘油5g/l,kh2po42.31g/l,k2hpo4·3h2o16.43g/l。
下述实施例中涉及的检测方法如下:
角质酶的酶活测定方法:在37℃下,采用连续分光光度法测定酶活力。
反应总体积为1.5ml,包括30μl发酵粗酶液和1470μl含50mmol/l硫磺脱氧胆酸钠和50mmol/l对硝基苯丁酸酯(pnpb)的tris-hcl缓冲液(ph8.0),在波长405nm处,记录对硝基酚的生成速率;
酶活的定义为:在37℃,每分钟将对硝基苯丁酸酯催化水解生成1μmol对硝基酚所需要的酶量即为一个酶活力单位(1u)。
所述的角质酶来自h.insolens或氨基酸序列经过取代、缺失或添加一个或几个氨基酸衍生的具有角质酶活性的突变体。
所列锚定肽或氨基酸序列经过取代、缺失或添加一个或几个氨基酸衍生的具有结合活性的突变体。
所列linker为间隔螺旋,或氨基酸序列经过取代、缺失或添加一个或几个氨基酸衍生的突变体。
实施例1:基因工程菌的构建
(1)根据ncbi中来源于h.insolens的角质酶序列(如seqidno.1所示),将其连接至载体pet20b(+)上,构建得到质粒pet20b(+)-hic(重组质粒的构建方法可参考文献:孙益荣,吴敬,宿玲恰.特异腐质霉角质酶在大肠杆菌中的表达和发酵优化[j].食品与机械,2018(4).);
(2)根据锚定肽序列(如seqidno.2、seqidno.3、seqidno.4、seqidno.5、seqidno.6所示)和间隔螺旋序列(连接肽linker,如seqidno.7、seqidno.8、seqidno.9、seqidno.10、seqidno.11、seqidno.12所示),根据pet20b(+)-hic基因序列设计引物,并利用pcr扩增基因锚定肽与linker基因;
(3)以步骤(2)回收的片段作为megaprimer,用megawhop将锚定肽和linker基因与角质酶基因序列融合,插入到表达载体上pet20b(+)-hic-anchor,将pcr产物转化进大肠杆菌jm109提取质粒测序;
(5)测序成功后将质粒转化进大肠杆菌bl21中,得到含有融合角质酶的基因工程菌大肠杆菌bl21/pet20b(+)-hic-anchor(构建得到的重组菌具体见表1)。
实施例2:基因工程菌的发酵产酶
将实施例1中构建得到的基因工程菌接种于液体lb培养基(含100mg/l氨苄青霉素)生长8-10h,按5ml/100ml接种量将种子接入tb液体发酵培养基(含100mg/l氨苄青霉素);大肠杆菌在25℃摇床培养发酵48h后,将一定体积发酵液于4℃、12000rpm离心15min,取发酵上清或破壁上清,即为融合蛋白的发酵粗酶液。
测定粗酶液的酶活,结果如表1所示:
表1重组菌产酶酶活
实施例3:融合蛋白对pea的降解效果
具体步骤如下:
1、pea溶液的配制:取1gpea至丙酮中,用丙酮定容至100ml,摇匀得浓度为1%的溶液,备用。
2、于25ml具塞三角瓶中,加入用tris-hcl缓冲液(50mm,ph8.0)稀释的终浓度20u/ml的融合蛋白溶液,以及浓度0.1%的pea溶液,终体积为10ml。在ph5.0-9.0、50℃条件下反应。利用分光光度计测定反应体系的浊度变化。空白对照组不加酶,实验组为hic处理组和融合蛋白处理组。
3、绘制反应体系的相对浊度变化图,判断pea的处理情况。
由于pea不溶于水,因此当底物溶液加入反应体系后溶剂丙酮会溶于水,pea会析出,反应体系变浑浊。一部分底物会沉淀,导致浊度下降;当底物被酶降解时浊度也会下降。浊度下降的越明显,证明酶解效果越好。
如图1所示,空白组的浊度由于沉降原因会稳定在71.4%。hic组的浊度在反应2小时后趋于稳定,最终体系的相对浊度稳定在56.4%。融合蛋白组的浊度在2小时后趋于稳定,最终体系的相对浊度稳定在24.8%~52.8%,比hic组的降解效率提高了24%~210.7%。
表2pea相对浊度
实施例4:融合蛋白对pvac的降解效果
具体步骤如下:
1、pvac溶液的配制:取1gpvac至甲醇中,用甲醇定容至100ml,摇匀得浓度为1%的溶液,备用。
2、于25ml具塞三角瓶中,加入用tris-hcl缓冲液(50mm,ph8.0)稀释过20u/ml终浓度的融合蛋白溶液,以及浓度0.1%的pvac溶液,终体积为10ml。在ph5.0-9.0、20-70℃条件下反应。利用分光光度计测定反应体系的浊度变化。利用分光光度计测定反应体系的浊度变化。空白对照组不加融合蛋白,实验组为hic处理组和融合蛋白处理组。
3、绘制反应体系的相对浊度变化图,判断pvac的处理情况。
由于pvac不溶于水,因此当底物溶液加入反应体系后溶剂甲醇会溶于水,pvac会析出,反应体系变浑浊。由于pvac和pea的聚集能力不同,在较低浓度下pea不会聚集,因此底物粒径不会变大,下沉缓慢,酶解后的浊度会下降;而较低浓度下的pvac会聚集,底物粒径变大,下沉迅速。酶解后由于酯键断裂,底物无法聚集,因此浊度下降会变缓慢。因此浊度下降的越慢,证明酶解效果越好。
如图2所示,空白组的浊度由于底物聚集和沉降原因,相对浊度稳定在12.2%。hic组由于酶水解了底物的酯键导致底物无法聚集,因此最终浊度稳定在20.2%。融合蛋白组的最终浊度稳定在26.9%~60.5%,比hic组的降解效率提高了83.8~503.8%。
表3pvac相对浊度
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
sequencelisting
<110>江南大学
<120>一种融合蛋白的构建及其降解聚合物的方法和应用
<130>baa200856a
<160>12
<170>patentinversion3.3
<210>1
<211>588
<212>dna
<213>humicolainsolens
<400>1
atggatcaattgggtgctattgaaaacggacttgaatcaggatcagctaacgcctgtcct60
gatgccattcttatttttgccagaggttcaactgaacctggaaacatgggaattaccgtt120
ggaccagctttagccaacggtttagaatctcatattcgtaacatttggattcaaggtgtt180
ggaggtccatacgatgccgccttagctactaactttcttcctcgtggtacttcacaagcc240
aacattgatgaaggaaagagattatttgccttggccaaccaaaagtgtccaaacacccca300
gttgttgcgggtggctactcacaaggggccgctttaattgctgccgccgtttccgaatta360
tccggagctgttaaggaacaagttaagggagttgccttgtttggttacactcaaaacttg420
caaaacagaggtggtattcctaactaccctagagaaagaactaaggtattctgtaacgtt480
ggtgacgctgtttgtaccggaactttaattattactcctgctcatctttcatacaccatt540
gaagcccgtggagaagccgctagatttcttcgtgatcgtattcgtgct588
<210>2
<211>195
<212>dna
<213>silkworm
<400>2
atgaacttcagcagggccctgttctacgtgttcgccgtgttcctggtgtgcgccagcgtg60
atggccgcccccgagcccaggtggaagatcttcaagaagatcgagaaggtgggccagaac120
atcagggacggcatcatcaaggccggccccgccgtggccgtggtgggccaggccgccacc180
atcgcccacggcaag195
<210>3
<211>189
<212>dna
<213>drosophilamelanogaster
<400>3
atgaacttctacaagatcttcgtgttcgtggccctgatcctggccatcagcatcggccag60
agcgaggccggctggctgaagaagctgggcaagaggatcgagaggatcggccagcacacc120
agggacgccaccatccagggcctgggcatcgcccagcaggccgccaacgtggccgccacc180
gccaggggc189
<210>4
<211>72
<212>dna
<213>escherichiacoli
<400>4
gacgtggagggcatcggcgacgtggacctggtgaactacttcgaggtgggcgccacctac60
accttcaacaag72
<210>5
<211>138
<212>dna
<213>bacillusveronii
<400>5
gccatcaagctggtgcagagccccaacggcaacttcgccgccagcttcgtgctggacggc60
accaagtggatcttcaagagcaagtactacgacagcagcaagggctactgggtgggcatc120
tacgaggtgtgggacagg138
<210>6
<211>135
<212>dna
<213>tachypleuschinensis
<400>6
tactcccgttgccaattacagggattcaattgtgttgtgcgttcctatgggcttccaacg60
atcccctgttgtcgtggcttgacctgccgtagttatttcccaggttccacatacgggcgt120
tgccaacgctattaa135
<210>7
<211>30
<212>dna
<213>人工序列
<400>7
gccgccgccgccgccgccgccgccgccgcc30
<210>8
<211>51
<212>dna
<213>人工序列
<400>8
gctgaggcagcagcgaaggaagctgctgcaaaagaggctgcggcgaaagcc51
<210>9
<211>84
<212>dna
<213>人工序列
<400>9
atggcaatagccgccggaggcacaaaccctaatcccaatcccaaccccacccctactccc60
acacccacccctactccaccccct84
<210>10
<211>72
<212>dna
<213>人工序列
<400>10
ccccccggcggcaacaggggcaccaccaccaccaggaggcccgccaccaccaccggcagc60
agccccggcccc72
<210>11
<211>33
<212>dna
<213>人工序列
<400>11
gccatgggcggcggcggcagcggcggcggcagc33
<210>12
<211>75
<212>dna
<213>人工序列
<400>12
cccacccccacccccacccccaccacccccacccccacccccacccccacccccaccccc60
acccccacccccacc75
- 还没有人留言评论。精彩留言会获得点赞!