一种外泌体circRNAPVT1的用途
技术领域:
本发明属于生物医学技术领域,具体涉及一种外泌体circrnapvt1的用途,外泌体作为胃癌诊断标志物,其应用方法包括选择应用对象,收集数据,实验验证和统计分析的工艺步骤。
背景技术:
:
根据globocan数据库显示,胃癌(gastriccancer,gc)已成为全球第5大常见癌症和第3大癌症死亡原因,严重威胁人类生活与健康。胃癌具有起病隐匿、易转移、早期易漏诊和高复发率的特点,很多患者确诊时已处于胃癌进展期,预后较差。而临床上常用的癌胚抗原cea、糖链抗原ca19-9、ca72-4等肿瘤标记物用于筛查胃癌时的特异性和敏感性不足。所以,引入新的更可靠的非侵入性胃癌诊断标志物非常迫切。
20世纪80年代初,trams等人在网织红细胞的成熟过程中发现了外泌体(exosome),其是大多数细胞(包括血小板、t细胞和癌细胞)经过“内吞-融合-外排”等一系列调控过程形成的具有双层膜机构的囊泡,直径约50-150nm。近年来,大量的研究发现几乎所有类型的细胞都能分泌这种在细胞间信息交流具有重要作用的囊泡,并且证实其在肿瘤的发生发展中发挥着重要的作用。由于外泌体具有较好的分泌特性和稳定的囊泡状结构,并且含有大量疾病特异性的蛋白质和核酸等成分,可在多种体液中检测到,基于此,外泌体内成分有望成为新型肿瘤诊断分子标志物。
环状rna(circularrna,circrna)是一类不同于传统线性rna的非编码rna分子,最早于1976年在rna病毒中被发现,由于当时技术的局限,circrna仅仅被认为是一类由外显子转录本发生错误剪接形成的低丰度rna,导致对其的研究不够深入。近几年来,随着高通量测序技术的广泛应用和生物信息学的快速发展,circrna被发现能稳定、丰富、普遍的存在于哺乳动物中,并且在机体内存在的circrna在不同的组织中或同一组织但机体处于不同的疾病发展阶段时会差异表达,具有细胞表型特异性和发育阶段特异性。circrna不具有5’末端帽子和3’末端多聚polya尾巴结构,而是由二者连接形成共价闭合的环状结构,在细胞内表达更加稳定,且不易被核酸外切酶降解。2015年,在外泌体中检测到了circrna的存在,并且发现circrna在多种疾病尤其是肿瘤中发挥着重要的调控作用,其高度保守性和较强的稳定性,在肿瘤疾病诊断方面具有极大的潜力。例如,中国专利201911358263.9公开的circrnapvt1及肽段在肿瘤生长预测、转移预测、预后评估和治疗中的应用。在以往的研究中,关于外泌体内的circrna在胃癌中的调控作用已被广泛研讨,但外周血中的循环外泌体内的circrna对于胃癌的分子诊断的意义尚不清楚。因此,寻找新的合适的外泌体内circrnas,并探讨其作为诊断和判断胃癌病情的生物标志物的可能性,对于辅助临床进行胃癌筛查及诊断至关重要。
技术实现要素:
:
本发明的目的在于克服现有技术存在的缺陷,寻求设计一种外泌体circrnapvt1作为胃癌诊断标志物的用途及其应用方法,其应用步骤包括选择应用对象,收集数据,实验验证和统计分析。
为了实现上述目的,本发明涉及的外泌体circrnapvt1的用途为作为胃癌诊断标志物。
本发明涉及的外泌体circrnapvt1在ncbi中的命名为circrnapvt1或hsa_circ_0001821。
本发明涉及的外泌体circrnapvt1(序列号:seqidno.1)的核苷酸序列片段为:gcctgatcttttggccagaaggagattaaaaagatgcccctcaagatggctgtgcctgtcagctgcatggagcttcgttcaagtattttctgagcctgatggatttacagtgatcttcagtggtctggggaataacgctggtggaaccatgcactggaatgacacacgcccggcacatttcaggatactaaaagtggttttaagggaggctgtggctgaatgcctcatggattcttacagcttggatgtccatgggggacgaaggactgcagctggctgagagggttgagatctctgtttacttagatctctgccaacttcctttgggtctccctatggaatgtaagaccccgactcttcctggtgaagcatctgatgcacgttccatccggcgctcagctgggcttgag,其上游引物序列circrnapvt1-f(序列号:seqidno.2)为:cgactcttcctggtgaagcatctgat,下游引物序列circrnapvt1-r(序列号:seqidno.3)为:tacttgaacgaagctccatgcagc。
本发明将将血浆外泌体circrnapvt1作为胃癌诊断的标志物,采用血浆/血清外泌体提取试剂盒分离提取外泌体,采用实时荧光定量聚合酶链式反应(qrt-pcr)技术分析胃癌特异性的circrnapvt1在胃癌患者个体和良性胃病及健康个体血浆外泌体中的表达和差异,证明胃癌组外泌体circrnapvt1相对表达量较对照组明显升高(p<0.05),外泌体circrnapvt1对胃癌的诊断性能优于传统的血清生物标志物,并且其对不同临床病理特征分组的胃癌患者具有一定的诊断价值,对于筛查胃癌以及病情判断也具有较高的诊断价值,能够将外泌体circrnapvt1作为诊治胃癌的分子标志物。
本发明与现有技术相比,应用工艺简单,应用效果明显,采用的外泌体易得,使用安全可靠,无不良效果反映,应用环境友好。
附图说明:
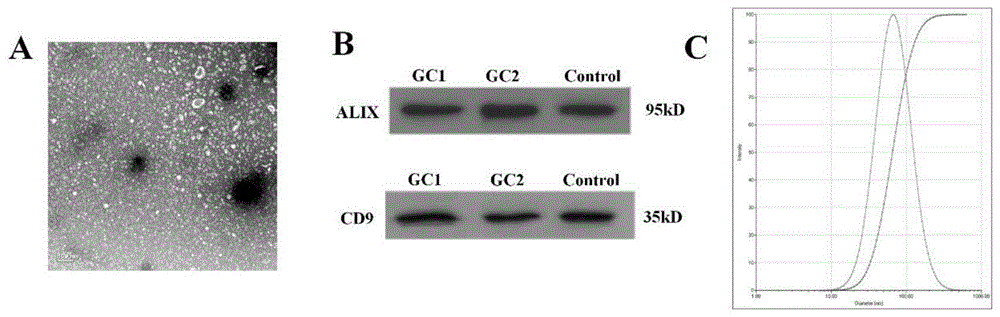
图1为本发明实施例1步骤3涉及的外泌体特征鉴定结果示意图,其中,a为透射电镜鉴定结果示意图、b为westernblot(蛋白印迹法)鉴定结果示意图、c为nta粒度仪鉴定结果示意图。
图2为本发明实施例1步骤4涉及的外泌体circrnapvt1预实验相对表达量结果示意图,其中,方框的上限、下限和方框内的线分别表示第75百分位、第25百分位和中值*p<0.05、**p<0.01。
图3为本发明实施例1步骤4涉及的胃癌组与对照组的外泌体circrnapvt1、血清ca72-4、cea和ca19-9的相对表达水平示意图,方框的上限、下限和方框内的线分别表示第75百分位、第25百分位和中值*p<0.05、**p<0.01。
图4为本发明实施例1步骤4涉及的外泌体circrnapvt1筛查胃癌的roc曲线图。
图5为本发明实施例1步骤4涉及的传统肿瘤标志物单项和联合诊断的roc曲线图。
图6为本发明实施例1步骤4涉及的外泌体circrnapvt1区分胃癌患者肿瘤直径是否<5cm的roc曲线图。
图7为本发明实施例1步骤4涉及的外泌体circrnapvt1区分胃癌患者处于ⅰ~ⅱ期或ⅲ~ⅳ期的roc曲线图。
图8为本发明实施例1步骤4涉及的外泌体circrnapvt1区分胃癌患者是否发生腹膜转移的roc曲线图。
图9为本发明实施例1步骤4涉及的外泌体circrnapvt1区分胃癌患者是否发生淋巴结转移的roc曲线图。
具体实施方式:
下面通过实施实例并结合附图对本发明做进一步描述。
实施例1:
本实施例涉及外泌体circrnapvt1作为胃癌诊断标志物的应用过程:
1.选择应用对象
根据纳入标准和排除标准选择研究对象,包括胃癌组和对照组,选取2019年5月至2020年5月于青岛市青岛大学附属医院确诊为胃癌的50例患者为胃癌组,其中,男27例,女23例,年龄为42~79岁,平均为61.60±9.66岁,将同时期于本院行胃镜检查,病理为良性病变的20例患者,均经诊断排除胃癌,浅表胃炎12例,胃息肉8例,以及20例健康体检者(血常规、生化、肿瘤标志物等项目未见明显异常)作为对照组,其中,男18例,女22例,年龄未38~74岁,平均为58.43±8.24岁,胃癌组和对照组的年龄、性别均无统计学差异,均采集外周血分离血浆作为实验样本;依据美国癌症联合委员会(americanjointcommitteeoncancer,ajcc)和国际抗癌联盟(unionforinternationalcancercontrol,uicc)2009年制定的恶性肿瘤tnm分期标准对胃癌病人进行分期,其中,ⅰ~ⅱ期22例,ⅲ~ⅳ期28例;
纳入标准:所有胃癌组患者均经组织病理学检查确诊为原发性胃癌,且未合并其他恶性肿瘤或器官功能衰竭,3个月内均未经历急性感染、急性心脑血管疾病及严重创伤,均未接受任何肿瘤相关手术、放化疗及免疫治疗史;
排除标准:生命体征不平稳者、孕期及哺乳期患者和rna类病毒感染者(如流感病毒,甲肝、丙肝、戊肝肝炎病毒等);患有其他可能影响circrna表达水平的测定的疾病(如神经系统疾病、缺血性脑卒中等);可引起ca72-4、cea及ca19-9指标变化的一些常见疾病(慢性肝炎、胰腺炎等);
2.收集数据
采用回顾性分析的方法,利用本院的医院信息系统(hospitalinformationsystem,his)和实验室信息系统(laboratoryinformationsystem,lis)收集胃癌组患者的信息,包括:标本编号、姓名、年龄、性别、住院登记号、标本收集日期、标本时段(术前或术后标本)、手术日期、确定诊断、肿瘤大小、分化程度、tnm分期、有无淋巴结转移、有无肝转移、有无腹膜转移和传统肿瘤标志物(ca72-4、cea、ca19-9)结果;
3.实验
选取在胃癌研究中得到功能学证实的circrnapvt1为靶点,基因及内参基因引物序列如下表所示:
3.1血浆样本收集与处理
在使用任何治疗前,收集所有研究对象的乙二胺四乙酸(ethylenediaminetetraaceticacid,edta)外周血5ml,经过3000×g,离心5min,分离血浆,分装于rnase-free的离心管中,置于-80℃冷冻保存;
将解冻的或新鲜的血浆,在4℃的条件下经过3000×g离心10min以及10000×g离心20min后,弃沉淀,保留上清,作为样本;
3.2外泌体提取及鉴定
(1)在无菌条件下,将样本和血浆外泌体提取试剂盒置于室温(15-25℃),进行解冻预处理;
(2)向装有预处理样品的离心管中,加入4倍体积的1×pbs溶液,充分混匀;
(3)在pbs稀释后的样品中,继续加入相应量的41202-a试剂,盖紧离心管盖,涡旋振荡1min,放置于4℃冰箱静置2h;
(4)取出离心管,在4℃条件下经过10000×g离心60min,弃上清(尽可能吸净上清液),收集富含外泌体的沉淀物;
(5)吸取1×pbs溶液,均匀吹打沉淀物,待沉淀物充分悬浮于1×pbs溶液后,将悬液转移至新的1.5ml离心管中;
(6)将1.5ml离心管在4℃条件下经过12000×g离心2min,弃沉淀,保留上清液,上清液为富含外泌体颗粒的外泌体溶液样品,置于-80℃冰箱中保存;
(7)应用透射电镜、nta粒度仪(nanoparticletrackinganalysis)和westernblot(蛋白印迹法)对提取的外泌体特征进行鉴定,如图1a所示,外泌体为一侧凹陷的半球形结构;如图1b所示,cd81和alix蛋白分别为定位于外泌体膜上和膜内的蛋白标志物,经westernblot验证可成功显现;如图1c所示,nta显示外泌体粒径约60-150nm;
3.3外泌体总rna提取
(1)在无菌条件下,将样本和rna提取试剂盒置于室温(15℃-25℃),进行解冻与处理;
(2)从-80℃冰箱中取出外泌体溶液样品,解冻后在4℃条件下经过12000×g离心10min,去除杂质,取250ul转至1.5ml的离心管中,加入750μltrizol试剂和20μl冰醋酸,手动剧烈振荡至混匀,得到匀浆样品;
(3)将匀浆样品置于15-30℃的环境中孵育5min,以便核酸蛋白复合体完全解离,在每750μltrizol试剂匀浆样品中加入0.2ml氯仿,盖紧管盖,手动剧烈振荡管体15sec后,置于15-30℃的环境中孵育2-3min,在4℃条件下经过12000×g离心15min,匀浆样品分为呈红色酚氯仿相的下层,呈无色水相的中间层和上层;rna全部分配于水相中,水相的体积大约是trizol的60%;
(4)将水相转移到新离心管中,并加入500μl异丙醇,混匀以沉淀其中的rna,混匀后置于15-30℃的环境中孵育10min,在4℃条件下经过12000×g离心10min,离心前不可见的rna沉淀在管底部和侧壁上形成胶状沉淀块;
(5)移去上清液,按照750μltrizol试剂匀浆样品中加入至少1ml75%乙醇的标准,清洗rna沉淀块,振荡后,在4℃条件下经过7500×g离心5min;
(6)去除乙醇,在空气中干燥rna沉淀块5-10min,先加入无rna酶的水用枪反复吹打几次,然后在55-60℃的环境中孵育10min,将获得的a260/280比值小于1.6的rna溶液保存于-80℃冰箱;
不能真空离心干燥,rna沉淀块不能完全干燥,否则将大大降低rna的可溶性;
3.4反转录反应
(1)在无菌条件下,取出样本和反转录pcr置于冰上融解备用;
(2)按照比试剂用量稍大(样本数n+2)的体积在冰上配制反应液,以保证分装配制反应液的准确性,配制比例参考说明书;
(3)采用t100tmthermalcyclerpcr仪进行rt-pcr反应,反应条件位:25℃、10min;55℃、15min;85℃、5min;
(4)得到cdna样本,置于4℃环境中保存;
3.5real-timepcr反应
(1)在无菌条件下,融解引物,预热荧光定量pcr仪;
(2)按照比试剂用量稍大(样本数n+2)的体积在冰上配制反应液,以保证分装配制反应液的准确性,配制比例参考说明书,加入cdna样本时用加样器反复吹打,得到pcr样本;
(3)将pcr样本同时上机检测,反应条件为:95℃、2min(预变性);95℃、15sec(变性),60℃、30sec(退火),共40个循环;60℃收集荧光信号;
(4)通过扩增曲线和熔解曲线衡量反应特异性和扩增效率,根据反应结果调整引物浓度和pcr反应条件;
4.统计分析
使用spss23.0软件进行数据统计分析,通过δct法计算circrna的表达水平,δct值越高代表circrna的表达水平越低,计量资料用(x±s)表示,组间比较用t检验;计数资料用例数(n)或百分比(%)表示,组间比较用2检验;用graphpadprism5.0软件和spss23.0软件绘制roc曲线并作图;以p<0.05为差异有统计学意义;其分析结果如下:
4.1预实验结果
在预实验中,选取胃癌组5例血浆样本、对照组10例(良性胃病者5例,健康体检者5例)血浆样本,目的基因为circrnapvt1,内参基因为gadph,参照步骤3进行实验,如图2所示,目的基因circrnapvt1在胃癌组血浆外泌体中的相对表达量较对照组均明显升高(均p<0.05),在对照组的血浆外泌体中的表达量无明显差异;
4.2胃癌组和对照组中外泌体circrnapvt1相对表达量结果
如图3所示,胃癌组血浆外泌体circpvt1的相对表达水平明显高于对照组,且差异具有统计学意义(p<0.05);胃癌组的血清ca72-4、cea和ca19-9水平也明显高于对照组,且差异均具有统计学意义(均p<0.05);结果表明,外泌体circrnapvt1能够达到筛查胃癌的效果;
4.3血浆外泌体circrnapvt1对筛查胃癌的roc曲线分析
如图4所示,roc(receiveroperatingcharacteristic)曲线分析血浆外泌体circrnapvt1的曲线下面积(areaunderthecurve,auc)值为0.934,95%可信区间(confidenceinterval,ci)为0.886~0.982;如图5所示,胃癌传统血清标志物的auc值分别为:ca72-40.666、cea0.796、ca19-90.664,传统血清标志物的联合auc值为0.867;结果表明,外泌体circrnapvt1对胃癌的诊断性能优于传统的血清生物标志物;
4.4胃癌组血浆外泌体circrnapvt1相对表达量与胃癌患者临床病理参数的相关性
血浆外泌体circrnapvt1表达水平与临床病理特征如下表所示:
注:差异具有统计学意义(p<0.05)以粗体来表示;血浆外泌体circrnapvt1的表达水平与性别、肿瘤直径、tnm分期、淋巴结转移和腹膜转移显著相关(均p<0.05),结果表明,血浆外泌体circrnapvt1的表达水平与胃癌患者多项临床病理参数有关;
4.5血浆外泌体circrnapvt1对区分不同分组胃癌患者的roc曲线分析
roc曲线分析血浆外泌体circrnapvt1对于区分不同分组胃癌患者的诊断价值图6-9所示,对于区分肿瘤直径是否<5cm,circrnapvt1的auc值为0.782,95%可信区间(ci)为0.651~0.914;对于区分胃癌患者处于ⅰ~ⅱ期或ⅲ~ⅳ期,circrnapvt1的auc值为0.765,95%可信区间(ci)为0.629~0.901;对于区分胃癌患者是否发生腹膜转移,circrnapvt1的auc值为0.850,95%可信区间(ci)为0.722~0.977;对于区分胃癌患者是否发生淋巴结转移,circrnapvt1的auc值为0.695,95%可信区间(ci)为0.549~0.840;结果表明,对于区分不同分组的胃癌患者,血浆外泌体circrnapvt1具有诊断价值。
本实施例涉及的血浆外泌体提取试剂盒为hiefftmquickexosomeisolationkit(forserum/plasma)(翊圣,中国);rna提取试剂盒为trizollsreagent(invitrogenlifetechnologies,美国);反转录pcr为goldenstartmrt6cdnasynthesiskitver.2(擎科,中国);real-timepcr为2×tsingkemasterqpcrmix-sybr(+udg)(擎科,中国);-80℃冰箱为panasonic(日本);高速冷冻离心机为thermo(美国);biodrop紫外分光光度计为柏点(英国);t100tmthermalcyclerpcr仪为bio-rad(美国);cfxconnecttmreal-timesystem荧光定量pcr仪为bio-rad(美国)。
- 还没有人留言评论。精彩留言会获得点赞!