多能干细胞分化为自然杀伤细胞的培养液及分化方法与流程
1.本发明属于干细胞治疗技术领域的干细胞分化技术,具体涉及一种多能干细胞分化为自然杀伤细胞的培养液及分化方法。
背景技术:
2.自然杀伤细胞(nk细胞)是先天免疫系统中主要的淋巴细胞,具有抗肿瘤和抗病毒感染的作用。近年来的临床研究表明nk细胞过继免疫疗法对多种癌症具有疗效且不会引起移植物抗宿主病,因而具有广阔的应用前景。
3.nk细胞免疫治疗需要大量的nk细胞,目前nk细胞主要来源有:
①
自体/异体外周血分离得到的nk细胞(pb
‑
nk),
②
自体/异体脐带血分离得到的nk细胞(ucb
‑
nk),
③
胚胎干细胞分化/诱导多能干细胞分化得到的nk细胞(hesc
‑
nk/ipsc
‑
nk),
④
nk细胞系如nk
‑
92。
4.自体外周血分离得到的nk细胞容易受到病人自身hla分子的抑制而削弱细胞的杀伤能力,且从病人体内通常难以分离到足够的nk细胞用于临床治疗。
5.异体外周血虽然能够提供大量的nk细胞,但由于捐献者不同,分离得到的nk细胞在数量上和细胞杀伤能力上都存在较大差异。且pb
‑
nk细胞不易基因修饰。
6.ucb
‑
nk不易扩增,且ucb
‑
nk不成熟,杀伤力弱。
7.nk
‑
92细胞系存在多倍体,增殖不可控,具有潜在的致瘤性。
8.hesc和ipsc能分化得到均一的,基因型明确的,功能与pb
‑
nk相似的nk细胞,消除了pb
‑
nk存在的捐献者差异性。且通过对hesc和ipsc进行基因修饰,可以容易地得到基因修饰的hesc
‑
nk和ipsc
‑
nk。因而具有临床应用前景。
9.目前将hesc/ipsc分化成nk细胞主要有三种方法:
10.①
将hesc/ipsc与基质细胞共培养,分化形成造血祖细胞,分离造血祖细胞,将造血祖细胞与基质细胞共培养,分化形成nk细胞。整个分化过程需要47~55天。
11.②
将hesc/ipsc铺到96孔板中形成eb球,分化形成造血祖细胞,然后将eb球转入24孔板或6孔板中,分化形成nk细胞。整个分化过程需要27
‑
46天。
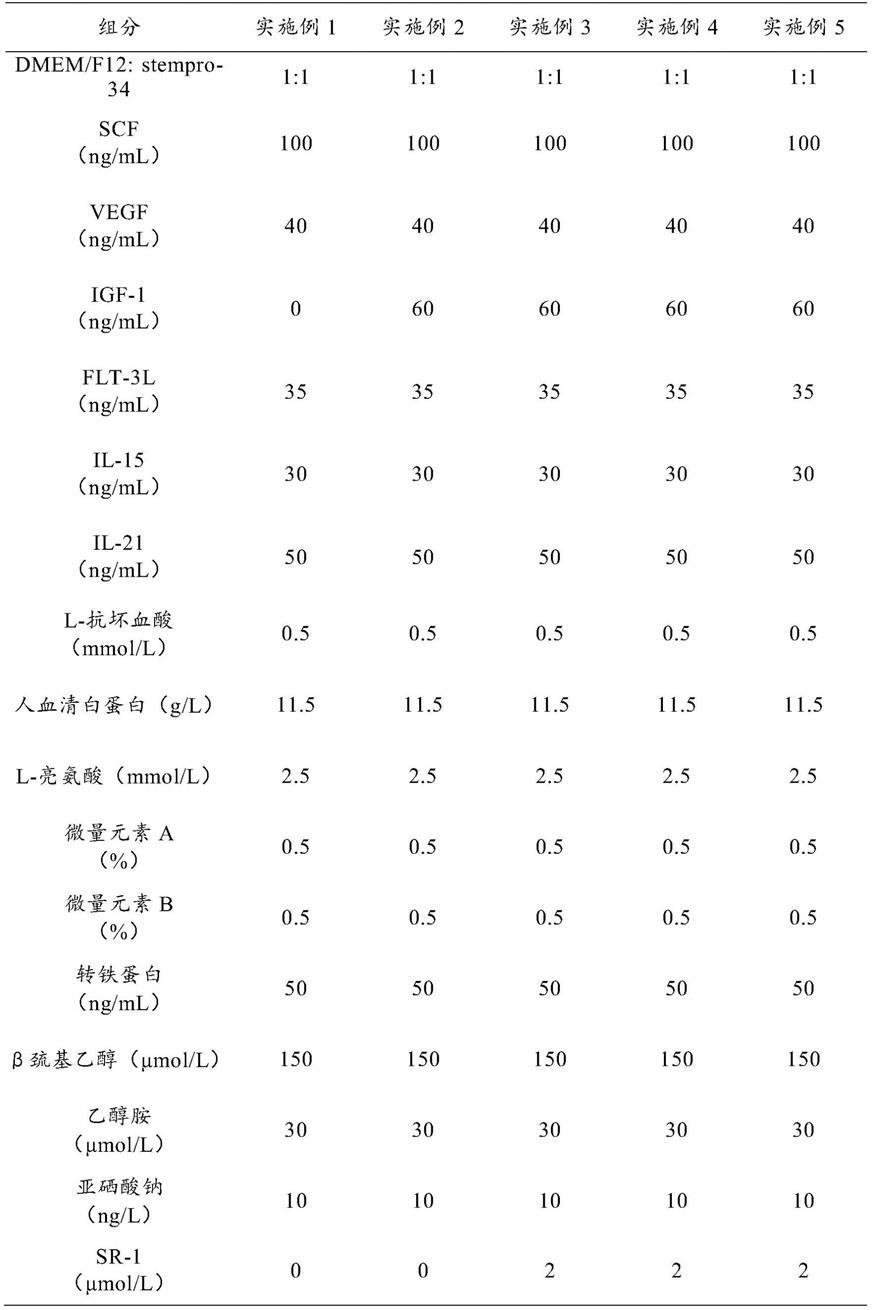
12.③
将hesc/ipsc单细胞铺到培养皿中,待ips克隆长到合适大小后,加入生长因子刺激细胞分化形成造血祖细胞,分离造血祖细胞,加入生长因子刺激nk细胞分化,得到nk细胞。整个分化过程需要48天。
13.方法
①
需要将hesc/ipsc与动物来源的基质细胞共培养,且在分化过程中需要添加fbs等动物源成分,因而不适用于临床治疗。
14.方法
②
分化过程操作繁琐且需要添加人血清,不利于大规模制备。
15.方法
③
虽然分化过程简单,且无血清无动物源成分,符合临床制备条件,但得到的nk细胞杀伤力比pb
‑
nk弱。
16.由于hesc取自人体胚胎,受到伦理道德的限制,且目前可应用的胚胎干细胞系有限,因而难以应用于未来的临床细胞治疗中。
17.而诱导多功能干细胞技术是干细胞应用领域的一项新技术,于2007年诞生,该技
术通过向体细胞中导入转录因子,将体细胞诱导成具有胚胎干细胞类似功能的诱导多功能干细胞,诱导多功能干细胞具有无限增殖能力,能够分化为各组织器官细胞。由于它来源于人体自身的体细胞,避免了伦理道德的限制和免疫排斥反应,因此,采用多能干细胞分化制备nk细胞在未来临床细胞治疗领域有较大的应用前景。
技术实现要素:
18.针对现有nk细胞分化技术中存在的含有动物源成分、操作繁琐、分化周期长,nk细胞产量低,不成熟,细胞杀伤力弱等技术问题,本发明提供一种由多能干细胞分化为nk细胞的可大大缩短分化周期、提高nk细胞产量的无动物源成分培养液。本发明还提供一种无需eb球培养、无需造血干细胞/祖细胞分选、所用试剂不含动物源成分的易于工业化大规模生产的适用于临床治疗的nk细胞分化方法。
19.本发明的多能干细胞分化为自然杀伤细胞的培养液,包括:体积比为1:0.9~1.3的dmem/f12培养基和血细胞培养基(stempro
‑
34),以及诱导因子、l
‑
抗坏血酸、l
‑
谷氨酰胺、l
‑
亮氨酸、人血清白蛋白、转铁蛋白、β
‑
巯基乙醇、亚硒酸钠、乙醇胺、微量元素a和微量元素b。
20.所述诱导因子包括细胞生长因子、ahr抑制剂、去乙酰化酶抑制剂或foxo1抑制剂中的一种或多种。
21.所述微量元素a包含cuso4·
5h2o、znso4·
7h2o、selenite
·
2na和ferric citrate;
22.所述微量元素b包含mnso4·
h2o、na2sio3·
9h2o、molydbic acid,ammonium salt、nh4vo3、niso4·
6h2o和snci2。
23.所述细胞生长因子包括干细胞因子(scf)、血管内皮细胞生长因子(vegf)、胰岛素样生长因子i(igf
‑
1)、fms样酪氨酸激酶3配体(flt
‑
3l)、白介素15(il
‑
15)或(il
‑
21)中的一种或多种,所述细胞生长因子为人源重组细胞生长因子;所述人血清白蛋白和转铁蛋白为人源重组蛋白;所述ahr抑制剂选用stemreginin
‑
1(sr
‑
1);所述去乙酰化酶抑制剂选用戊丙酸(valproic acid,vpa);所述foxo1抑制剂选用as1842856。
24.所述微量元素a包含1.6mg/ml cuso4·
5h2o、863mg/ml znso4·
7h2o、17.3mg/ml selenite
·
2na和1155.1mg/ml ferric citrate;
25.所述微量元素b包含0.17mg/ml mnso4·
h2o、140mg/m na2sio3·
9h2o、1.24mg/ml molydbic acid,ammonium salt、0.65mg/ml nh4vo3、0.13mg/ml niso4·
6h2o和0.12mg/ml snci2。
26.所述干细胞因子浓度为8~200ng/ml,所述血管内皮细胞生长因子浓度为4~100ng/ml,所述胰岛素样生长因子i浓度为10~100ng/ml,所述fms样酪氨酸激酶3配体浓度为2~50ng/ml,所述白介素15浓度为2~50ng/ml,所述白介素21浓度为5~125ng/ml,所述l
‑
抗坏血酸浓度为0.1~1mmol/l,所述人血清白蛋白浓度为10~15g/l,所述l
‑
谷氨酰胺浓度为5~10mmol/l,所述l
‑
亮氨酸浓度为0.5~5mmol/l,所述转铁蛋白浓度为10~100ng/ml,所述β巯基乙醇浓度为20~250μmol/l,所述乙醇胺浓度为10~100μmol/l,所述亚硒酸钠浓度为5~25ng/l,所述微量元素a浓度为0.1~1%,所述微量元素b浓度为0.1~1%,所述ahr抑制剂浓度为0.5~5μmol/l,所述去乙酰化酶抑制剂浓度为0.5~5μmol/l,所述
foxo1抑制剂浓度为6~100nmol/l。
27.在本发明一较佳实施例中,dmem/f12培养基和血细胞培养基的体积比为1:1,所述干细胞因子浓度优选16~100ng/ml,更优选100ng/ml;所述血管内皮细胞生长因子浓度优选8~60ng/ml,更优选40ng/ml;所述胰岛素样生长因子i浓度优选10~80ng/ml,更优选60ng/ml;所述fms样酪氨酸激酶3配体浓度优选4~40ng/ml,更优选35ng/ml;所述白介素15浓度优选6~40ng/ml,更优选30ng/ml;所述白介素21浓度优选10~100ng/ml,更优选50ng/ml;所述l
‑
抗坏血酸浓度优选0.1~0.8mmol/l,更优选0.5mmol/l;所述人血清白蛋白浓度优选10~13g/l,更优选11.5g/l;所述l
‑
谷氨酰胺浓度优选5~8mmol/l,更优选6mmol/l;所述l
‑
亮氨酸浓度优选0.5~3.5mmol/l,更优选2.5mmol/l;所述转铁蛋白浓度优选10~70ng/ml,更优选50ng/ml;所述β巯基乙醇浓度优选50~200μmol/l,更优选150μmol/l;所述乙醇胺浓度为10~50μmol/l,更优选30μmol/l;所述亚硒酸钠浓度优选5~20ng/l,更优选10ng/l;所述微量元素a浓度优选0.1~0.8%,更优选0.5%;所述微量元素b浓度优选0.1~0.8%,更优选0.5%;所述ahr抑制剂浓度优选0.5~3.5μmol/l,更优选2μmol/l;所述去乙酰化酶抑制剂浓度优选0.5~3.5μmol/l,更优选2μmol/l;所述foxo1抑制剂浓度优选10~50nmol/l,更优选30nmol/l。
28.在本发明一较佳实施例中,本发明的多能干细胞分化为自然杀伤细胞的培养液,同时包括胰岛素样生长因子i、白介素15、ahr抑制剂、去乙酰化酶抑制剂vpa,foxo1抑制剂as1842856和人血清白蛋白。
29.所述胰岛素样生长因子i浓度为10~100ng/ml,优选10~80ng/ml,更优选60ng/ml;所述白介素15浓度为2~50ng/ml,优选6~40ng/ml,更优选30ng/ml;所述ahr抑制剂的浓度为0.5~5μmol/l,优选为0.5~3.5μmol/l,更优选2μmol/l;所述去乙酰化酶抑制剂vpa浓度为0.5~5μmol/l,优选0.5~3.5μmol/l,更优选2μmol/l;所述foxo1抑制剂as1842856浓度为6~100nmol/l,优选10~50nmol/l,更优选30nmol/l;所述人血清白蛋白浓度为10~15g/l,优选10~13g/l,更优选11.5g/l。
30.所述培养液中的各组分可协同诱导多能干细胞定向分化为nk细胞。其中,dmem/f12和血细胞培养基stempro
‑
34混合作为无血清的基础培养基,dmem/f12含有体积比为1:1的dmem培养基和f12培养基,营养成分丰富;血细胞培养基stempro
‑
34可长期维持nk细胞和造血细胞的表型基因和细胞活性。使nk细胞表达cd16、cd56、nkg2a、nkg2d、nkp44、nkp46等功能相关受体复合物。所述细胞生长因子为人源重组细胞生长因子,用于促进nk细胞分化、增殖和成熟。l
‑
抗坏血酸作为培养基中的辅助因子,提供抗氧化环境。人血清白蛋白为细胞因子转运提供载体。l
‑
谷氨酰胺、l
‑
亮氨酸、微量元素a和微量元素b为血液淋巴细胞,尤其是nk细胞提供丰富的能量来源,能够参与蛋白质的合成和核酸代谢,促进细胞存活及快速增殖。所述ahr抑制剂选用stemreginin
‑
1(sr
‑
1),可促进造血干细胞增殖,促进nk前体细胞向成熟nk细胞分化;所述去乙酰化酶抑制剂选用valproic acid(vpa),通过调控染色质的开放结构程度,促使白介素15、白介素21、胰岛素样生长因子i等刺激nk细胞分化、增殖、成熟的细胞因子更好的发挥作用;所述foxo1抑制剂选用as1842856,可抑制转录因子foxo1的活性,解除其对细胞周期的抑制作用,促进造血干细胞向nk细胞分化并促进nk细胞增殖与成熟。
31.本发明的多能干细胞分化为自然杀伤细胞的分化方法,包括如下步骤:
32.步骤s1,将多能干细胞接种到基质胶(matrigel)包被的细胞培养板上,用多能干细胞分化为自然杀伤细胞的培养液对多能干细胞进行定向分化培养得到造血前体细胞;
33.步骤s2,将步骤1)得到的造血前体细胞中贴壁细胞消化成单细胞,离心收集细胞,用多能干细胞分化为自然杀伤细胞的培养液将细胞重悬为单细胞悬液,接种并继续悬浮培养得到自然杀伤细胞(nk细胞)。
34.具体地,
35.步骤s1,将多能干细胞接种到基质胶包被的6孔细胞培养板上,于35~39℃优选37℃、3~7%co2优选5%co2、10~50%细胞密度优选30%条件下,用所述多能干细胞分化为自然杀伤细胞的培养液对单层贴壁多能干细胞进行定向分化培养3~7天优选5天,定向分化培养期间每1~3天优选2天更换一次所述多能干细胞分化为自然杀伤细胞的培养液。
36.初次使用所述多能干细胞分化为自然杀伤细胞的培养液时,添加rock抑制剂;所述rock抑制剂为y
‑
27632,所述rock抑制剂浓度为2~50μmol/l,优选4~25μmol/l,更优选10μmol/l。
37.步骤s2,将步骤1)得到的造血前体细胞用消化酶(tryplee)消化成单细胞,离心收集细胞,用所述多能干细胞分化为自然杀伤细胞的培养液将细胞重悬后按1000~5000细胞/ml优选5000细胞/ml的细胞密度接种到搅拌培养瓶中继续悬浮培养,于35~39℃优选37℃、3~7%co2优选5%co2条件下培养7~14天优选9天得到自然杀伤细胞;
38.继续悬浮培养期间,前3天搅拌转速为80
‑
100rpm,此后搅拌转速为100
‑
160rpm,每1~3天优选3天更换一半培养液。
39.所述多能干细胞通过诱导多能干细胞技术重编程外周血单核细胞得到。
40.本发明的nk细胞分化方法第一步先将多能干细胞在培养皿中细胞贴壁培养分化3~7天产生造血前体细胞,之后将第一步分化的造血前体细胞消化成单细胞接种到搅拌瓶中进行悬浮培养,进一步分化7~14天即可得到成熟nk细胞,操作简单,人工成本低,易于工业自动化。
41.对培养得到的nk细胞进行细胞类型鉴定后,包括nk细胞特征性蛋白表达(流式细胞术分析)、体外分泌干扰素γ和杀伤肿瘤细胞鉴定,即可低温贮藏或者用于医学研究。
42.本发明通过培养液和分化方法得到的nk细胞表达cd45+cd56+表面标志物,其它表面标志物包括但不限于如cd161、cd16、cd94、nkg2a、nkg2d、nkp44、nkp46,不表达cd3表面标志物。本发明培养液采用无动物源成分,化学成分明确的培养液,分化的nk细胞通过过继性免疫疗法应用于临床细胞治疗,其适应症包括但不限于恶性血液肿瘤如多发性急性白血病、恶性淋巴瘤、恶性骨髓瘤;各种实体瘤包括但不限于乳腺癌、非小细胞肺癌、结直肠癌、卵巢癌、肝细胞癌、胰腺癌、膀胱癌和肾腺癌。
43.本发明的积极进步效果在于:本发明所述培养液通过在传统nk细胞分化培养液的基础上创新性的添加igf
‑
1、ahr抑制剂、去乙酰化酶抑制剂、foxo1抑制剂等成分,可以更高效的诱使多能干细胞朝nk细胞分化,提高了nk细胞的产量。经所述方法,可在较短时间内将多能干细胞定向分化培养得到nk细胞。所述nk细胞分化方法无动物源成分、nk细胞产量高、分化工艺简单,分化周期缩短为14天,与现有的nk细胞分化技术相比,大大提高了nk细胞的产量,缩短了nk分化的周期,简化了nk分化的工艺,降低了制备成本。且制备的nk细胞具有临床应用前景。
附图说明
44.图1为多能干细胞的显微镜照片;
45.图2为本发明培养得到的nk细胞的显微镜照片;
46.图3
‑
1和图3
‑
2为本发明培养得到的nk细胞的特征性蛋白表达的流式细胞术鉴定结果;
47.图4为本发明nk细胞分化培养液中添加igf
‑
1、sr
‑
1、vpa、as1842856四诱导因子中一种或者多种与不添加此四诱导因子中任何一种的最终nk细胞分化效率(以分化结束悬浮细胞中cd56+nk细胞百分比计算)比较结果。
具体实施方式
48.下面将结合具体实施例对本发明作进一步的说明。
49.实施例1~5利用多能干细胞分化培养nk细胞
50.一、培养液
51.实施例1~5的培养液包括由dmem/f12培养基和血细胞培养基stempro
‑
34混合而成的基础培养基,以及添加在基础培养基中的添加组分。各实施例的dmem/f12培养基和血细胞培养基stempro
‑
34的混合的体积比例、添加组分及其含量如表1所示。
52.表1培养液的组分及含量
53.[0054][0055]
备注:表1所述各物质均为市场上购得
[0056]
其中,微量元素a采用厂家corning,货号25
‑
021
‑
ci;微量元素b采用厂家corning,货号25
‑
022
‑
ci。
[0057]
实施例1的培养液中不添加igf
‑
1、sr
‑
1、vpa、as1842856中任何一种诱导因子,实施例2的培养液仅添加igf
‑
1,实施例3的培养液添加igf
‑
1和sr
‑
1,实施例4的培养液添加igf
‑
1、sr
‑
1和vpa,实施例5的培养液添加igf
‑
1、sr
‑
1、vpa、as1842856四种诱导因子。
[0058]
二、培养过程
[0059]
实施例1~5分别使用表1所示的对应的培养液按照以下步骤分化培养nk细胞:
[0060]
1、将多能干细胞接种到matrigel包被的6孔板中,待细胞密度达到10~50%,换nk分化培养液(2ml/孔)诱导细胞分化(若培养液存放于4℃冰箱中,需提前取出室温预热20分钟),于37℃,5%co2的孵箱里贴壁分化培养5天,培养液每2天更换一次,产生造血前体细胞。初次使用培养液时,添加rock抑制剂,添加的rock抑制剂浓度为10μmol/l。更换培养液时,不再添加rock抑制剂。
[0061]
多能干细胞的显微镜照片如图1所示。
[0062]
2、将6孔板置于无菌操作台中,轻轻晃动6孔板,用吸引泵吸去上清液,用dpbs润洗细胞2次,加1ml/well tryple消化液将造血前体细胞消化成单细胞悬液,将细胞悬液转入离心管中,加入等体积的nk分化培养液,200g,3分钟离心,用吸引泵吸去上清液,用新鲜的nk分化培养液重悬后按1000~5000细胞/ml的细胞密度接种到一次性搅拌瓶中,继续放入孵箱中培养9天,搅拌转速80~160rpm/分钟,培养液每3更换一半培液。培养得到的nk细胞的显微镜照片如图2所示。
[0063]
三、实验结果
[0064]
经过14天的分化,收集悬浮细胞进行流式检测,比较添加igf
‑
1、sr
‑
1、vpa、as1842856四诱导因子中一种或者多种与不添加此四诱导因子中任何一种的条件下nk细胞分化效率与nk细胞得率,检测结果如图4和下表2。
[0065]
表2 nk分化培养液中添加四诱导因子与不添加四诱导因子的nk细胞得率对比(以分化结束时每个初始ipsc细胞得到的cd56+nk细胞个数计算)
[0066]
[0067]
实施例1的悬浮细胞中含有12%的cd56+cd45+cd3
‑
nk细胞,每1个ips细胞得到400个nk细胞,实施例2的悬浮细胞中含有30%的cd56+cd45+cd3
‑
nk细胞,每1个ips细胞得到600个nk细胞。实施例3的悬浮细胞中含有46%的cd56+cd45+cd3
‑
nk细胞,每1个ips细胞得到900个nk细胞。实施例4的悬浮细胞中含有65%的cd56+cd45+cd3
‑
nk细胞,每1个ips细胞得到1500个nk细胞。实施例5的悬浮细胞中含有91%的cd56+cd45+cd3
‑
nk细胞,每1个ips细胞得到2000个nk细胞。实验结果充分说明了在nk分化培养液中添加igf
‑
1、sr
‑
1、vpa、as1842856四个诱导因子可以显著提高nk分化的效率,提高nk细胞产量。
[0068]
效果实施例1实施例1~5所得nk细胞流式细胞术检测特征性蛋白的表达(流式细胞术法)
[0069]
将分化结束得到的悬浮细胞离心,去上清。用facs buffer洗涤细胞1次。用cd3,cd45,cd56抗体与细胞避光孵育30分钟后用facs buffer洗涤细胞1次,流式细胞仪检测cd3,cd45,cd56表达情况。所用抗体购买自bd公司。
[0070]
图3
‑
1为本发明分化的nk细胞同时表达cd45cd56表面标志物,图3
‑
2为本发明分化的nk细胞不表达cd3表面标志物。
[0071]
本发明在现有文献的nk细胞分化培养液的基础上,通过创新性的引入igf
‑
1、sr1、vpa、as1842856四个可促进多能干细胞向nk细胞分化的细胞生长因子及小分子抑制剂,可显著提高nk细胞分化的效率。相比于现有的通过多能干细胞分化nk细胞的专利如cn 110691844 a、cn 110023491a,本发明所用试剂不含动物源成分、批次差异小,得到的nk细胞可用于临床治疗;相比于现有文献(dan s.kaufman,et al.stem cells translational medicine 2013;2:274
–
283),在未进行nk细胞扩增的条件下,本发明每个ips细胞可产出2000个nk细胞,而文献中每个ips细胞只能产出0.77个nk。因此,相比于现有的绝大多数通过多能干细胞分化nk细胞的方法,本发明nk细胞产量高、分化周期短(本发明只需要14天,现有的其他方法需要27
‑
55天),操作简单、成本低、易于大规模工业化制备。且本发明的原料多能干细胞由诱导多功能干细胞技术诱导外周血单核细胞得到,不会引起道德争议,因此得到的nk细胞具有较大的临床应用前景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1