一株海洋真菌及其在生产邻苯二甲酸二丁酯中的应用
本发明涉及微生物领域,特别是涉及一株海洋真菌及其在生产邻苯二甲酸二丁酯中的应用。
背景技术:
国内外研究已经证明动、植物和微生物可产生具有生理活性的邻苯二甲酸二丁酯(dbp),曲新颜等在海洋来源的放线菌代谢产物中分离出抗肿瘤活性成分dbp,首次发现其对小鼠乳腺癌细胞(温敏型tsft210)g0/g1期细胞周期具有抑制作用,抑制浓度为3.6μmol/ml;宋瑞清等发现炭团菌的代谢产物dbp对樟子松枯梢病菌具有较高的抑制作用,在自然环境下具有较高的稳定性;ei-naggar在链霉菌(streptomyces)代谢物中分离出的dbp具有抗菌性能和抑制水解酶α-糖苷酶、β-糖苷酶和α-甘露糖酶、β-甘露糖酶的作用。现有技术中,尚无从meira属海洋真菌中分离得到邻苯二甲酸二丁酯(dbp)的报道。
技术实现要素:
本发明的目的是提供一株海洋真菌meirasp.jin353以及使用所述菌株制备邻苯二甲酸二丁酯的方法,以解决上述现有技术存在的问题,拓展邻苯二甲酸二丁酯的制备方法。
为实现上述目的,本发明提供了如下方案:
本发明提供一种海洋来源真菌meirasp.jin353,属于meirasp.,所述真菌已保藏于中国典型培养物保藏中心,保藏日期为2020年9月11日,保藏编号为cctccno:m2020481,保藏地址为中国武汉大学,所述真菌的形态结构:在pda,yma,ypga培养基上边缘呈白色,中间呈棕色,表面粗糙干燥,中央皱缩。
本发明还提供一种邻苯二甲酸二丁酯的制备方法,利用所述真菌进行发酵制备邻苯二甲酸二丁酯。
优选的,所述的发酵方法为固态发酵。
优选的,所述邻苯二甲酸二丁酯的制备方法的具体步骤包括:
(1)将北冰洋来源海洋真菌meirasp.jin353进行活化,固态发酵方法发酵,得到发酵产物;
(2)将发酵产物用乙酸乙酯超声浸提,得到萃取液,萃取液经低压浓缩蒸干,得到粗提物;
(3)粗提物通过中压制备色谱法进行初级分离,得到粗品;
(4)将粗品利用半制备高效液相色谱分离获得邻苯二甲酸二丁酯纯品。
优选的,所述步骤(1)中,真菌meirasp.jin353活化过程是:从-80℃冰箱取出冻干保存管,以0.1%的接种量接入100ml已灭菌的pdb培养基中,30℃、180rpm摇床培养72h。
优选的,所述步骤(1)中,真菌meirasp.jin353发酵过程是:将5ml已经活化的meriasp.jin353菌株接种至20g初始加水量为90%的大米固态培养基,30℃静置培养11天。
优选的,所述步骤(2)具体为:发酵产物用乙酸乙酯超声浸提,每次浸提30min,共浸提三次。收集每次浸提后的乙酸乙酯,用旋转蒸发仪低压浓缩蒸干,获得抗菌物质的粗提物。
优选的,所述步骤(3)具体为:粗提物通过中压制备色谱法进行粗分离,色谱柱填料为硅胶粉,流动相为石油醚/乙酸乙酯,经高效液相色谱法检测合并含邻苯二甲酸二丁酯组分。
优选的,所述步骤(4)具体为:利用半制备高效液相色谱仪对中压制备后获得的含邻苯二甲酸二丁酯组分进行分离和制备,色谱柱为hypersilbdsc8(10mm×250mm,10μm),流动相为80%甲醇/20%水,流速0.8ml/min,时间为30min。
本发明还提供所述的海洋真菌在制备邻苯二甲酸二丁酯中的应用。
本发明公开了以下技术效果:
本发明首次从海洋真菌meirasp.jin353固态发酵生产邻苯二甲酸二丁酯,为今后海洋微生物代谢产物的研究方向提供了新思路。也为今后开发结构新颖、作用机制独特的化合物奠定基础。
本发明提供了一种从海洋真菌meirasp.jin353固态发酵生产邻苯二甲酸二丁酯的新方法,具有发酵周期短、发酵成本低廉等特点,为今后制备具有较强抑菌作用的邻苯二甲酸二丁酯提供了原材料。具有一定的理论价值和应用价值。
本发明邻苯二甲酸二丁酯的制备过程简单易操作,与传统化学合成的方法相比方法简单,成本低,而且生产过程绿色无污染。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
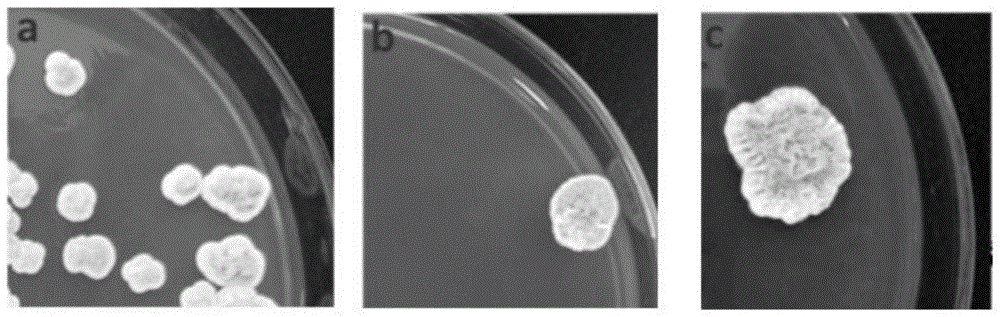
图1为菌株meirasp.jin353在不同培养基培养25d的菌落形态(a:pda,b:yma,c:ypga);
图2为菌株meirasp.jin353的系统发育树;
图3为粗提物的抑菌效果图;
图4为纯品化合物的hplc检测结果;
图5为邻苯二甲酸二丁酯化合物的质谱;
图6为邻苯二甲酸二丁酯化合物的氢谱;
图7为邻苯二甲酸二丁酯化合物的碳谱。
具体实施方式
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本申请说明书和实施例仅是示例性的。
关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
如无特殊说明,本发明所采用的实验方法均为常规方法,所用实验器材、材料、试剂等均可从商业途径获得。
实施例1
真菌形态学鉴定与26srdna序列分析
对真菌进行形态学鉴定,显示其在pda,yma,ypga培养基上边缘呈白色,中间呈棕色,表面粗糙干燥,中央皱缩。结果如图1所示。
在真菌培养基中挑取菌体于50ultakaralysisbufferformicroorganismtodirectpcr(codeno.9164)中变性后离心,取上清作为模板。反应条件:80℃,15min。使用takarafungiidentificationpcrkit(codeno.rr178),进行pcr扩增目的片段。pcr体系如表1所示,pcr反应的条件:94℃预变性5min;94℃变性0.5min,55℃退火0.5min,72℃延伸1min,此阶段30个循环;72℃延伸5min;扩增产物4℃保存。用5μlpcr扩增后的产物在1%的琼脂糖凝胶内电泳,在100v的恒压下电泳时间为20min,再用uvp凝胶成像系统来观察并对成像进行分析。使用takaraminibestagarosegeldnaextractionkitver.4.0(codeno.9762)切胶回收目的片段进行dna测序。目的片段进行dna测序,测序结果如seqidno.1所示。在ncbi核酸数据库中通过blast进行分析并绘制系统发育树,结果如图2所示。经分析可以确定该菌株为梅拉菌属(meira),命名为meirasp.jin353。
表1真菌pcr扩增体系
实施例2化合物的分离纯化
(1)meriasp.jin353菌株的活化和扩大培养
将实验室保藏的meriasp.jin353菌株以0.1%的接种量接入100ml已灭菌的pdb培养基中,30℃、180rpm摇床培养72h。
将已经活化的meriasp.jin353菌株菌悬液5ml接种至20g初始加水量为90%的大米固态培养基,共接种20瓶大米固态培养基,30℃静置培养11天。
(2)活性物质粗提液的制备
将发酵11天后得到的发酵物用乙酸乙酯萃取,每瓶中加入200ml的乙酸乙酯,对粗提物进行超声浸提,每次浸提30min,共浸提3次。收集每次浸提后的乙酸乙酯,用旋转蒸发仪低压浓缩蒸干,获得抗菌物质的粗提物,用天平称得粗提物的质量,将粗提物浓度配制成50mg/ml,对金黄色葡萄球菌做抑菌试验。
(3)抑菌试验
以金黄色葡萄球菌为指示菌测定抗菌活性,使用平板打孔法,向孔内加入300μl粗提物,将培养皿放入37℃培养箱内培养,24h后将培养皿取出,观察孔内粗提液是否抑制孔周围金黄色葡萄球菌的生长,并测量抑菌圈的直径,从而确定粗提物的抑菌活性。
发酵粗提物为红色油状物。50mg/ml的粗提物对金黄色葡萄球菌的抑菌直径达到27.47±0.36mm。结果见图3。
(4)中压制备色谱分离
色谱柱填料为硅胶粉,硅胶柱层析的洗脱剂为石油醚和乙酸乙酯,洗脱梯度为100:0,98:2,96:4,94:6,92:8,90:10,80:20(v/v),每个梯度洗脱20min。收集过程中每10ml收集到一个试管中。将收集后的样品用薄层层析检测,薄层层析所用的展开剂为石油醚和乙酸乙酯,比例为9:1,观察样品在薄层板上的斑点位置确定样品是否合并。将合并后的组分分别测试其抑菌活性。
(5)抗菌物质的高效液相色谱分离
利用hplc仪将经过中压制备色谱分离柱层析分离收集的活性峰更进一步的分离纯化。反相色谱柱使用的是hypersilbdsc8。本实验流动相选择水和甲醇,进行线性洗脱。将硅胶柱层析后收集到的样品用高效液相色谱分析,用半制备高效液相色谱对活性成分进行分离,得到纯度较高的峰,用于后期化合物的鉴定。反向分析色谱条件:流速:0.8ml/min;等度洗脱:80%甲醇/20%水;时间:30min。结果见图4。
实施例3化合物的结构鉴定
用精确质量飞行时间质谱液质联用仪分析分子量,图5为化合物正离子扫描质谱图,由图可知,正离子扫描301.1125处可得准分子离子峰[na+m]+,故化合物的分子量为278。1h-nmr图谱见图6。13c-nmr图谱见图7。结合碳谱和氢谱,再根据该化合物的分子量,确定该化合物的分子式是c16h22o4,结构式如式(ⅰ)所示。
表2化合物的1hnmr和13cnmr数据
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
序列表
<110>大连民族大学
中国极地研究中心(中国极地研究所)
<120>一株海洋真菌及其在生产邻苯二甲酸二丁酯中的应用
<160>1
<170>siposequencelisting1.0
<210>1
<211>584
<212>dna
<213>人工序列(artificialsequence)
<400>1
tcccttagtaacggcgagtgaagcgggaatagctcaaatttgaaagctggcagcaatgtc60
cgcgttgtaatctagagaagtgttttccgtgctggaccatagatatgttccttggaatag120
gatgtcatagagggtgagaaccccgtacatgctatggacgcccagtgctttgtgatacac180
tttcgaagagtcgagttgtttgggaatgcagctcaaaatgggtggtaaattccatctaaa240
gctaaatattggggagagaccgatagcaaacaagtaccgtgagggaaagatgaaaagcac300
tttggaaagagagttaaacagtacgtgaaattgtcaaaagggaagcgcttcaagtcagat360
atggctttgaatgttcagcctttaggtgtattcattttttgtcaggccagcatcgatttt420
gaacgtcggataagggtagaaagaacgtagcatactctcgggtatgtgttatagcttttt480
actggatacgacgatcgggatcgaggttcgcagcacacccttttttgggcaggtcttcgg540
acactttttgtgcttaggatgctggcgtaatggcttgaagcgac584
- 还没有人留言评论。精彩留言会获得点赞!