1.本发明属于生物医学技术领域,特别是涉及一种源自布拉迪酵母的酵母多肽及其制备方法和应用。
背景技术:2.布拉迪酵母是由法国科学家亨利
•
布拉德于1923年首次从荔枝和山竹果中分离出的一种热带酵母,也称布拉迪酵母菌,是一种单细胞真菌,属酿酒酵母亚种。布拉迪加酵母是为数不多的酵母益生菌之一,与酿酒酵母相比,布拉迪酵母在37℃、39℃、45℃及胃酸环境下1h的存活率更高,在胆盐环境的耐受性也显著高于酿酒酵母,此外,布拉迪酵母的抗氧化功能也更强。布拉迪酵母具有丰富的代谢产物,其分泌的多胺有助于提高消化酶活性,从而促进肠道对营养物质的吸收。布拉迪酵母通过肠道的过程中至少会分泌1500多种物质,具有促进肠道有益菌的增殖,抑制有害菌生长、调节肠道菌群平衡,增强机体免疫力等功能。因此,布拉迪酵母被广泛应用于医药、食品、保健品以及饲料加工。
3.多肽是广泛存在于自然界生物体中的一种小分子蛋白类类物质,其来源十分广泛,目前已在动植物以及微生物等生物体中发现了3250多种肽。其中已经发现了21种真菌物种能发酵产生多肽。部分免疫多肽具有广谱抗菌作用,例如对猫狗上常见的大肠杆菌、金黄色葡萄球菌等致病菌具有较强的杀菌作用,其独特的破膜杀菌机制使其不易产生耐药性,是潜在的抗生素替代品之一,例如在宠物腹泻、术后伤口、以及细菌性疾病引起的感染中使用可以很大程度上替代抗生素,有利于猫狗的长期健康。目前大部分研究报道的多肽都由细菌(革兰氏阳性菌和阴性菌)分泌,部分益生菌分泌的多肽产品虽然对治疗猫狗等动物的腹泻具有良好的效果,但长期饲喂容易导致外源益生菌在肠道内的定植,进而破坏肠道固有菌群的平衡,所以长期饲喂细菌类益生菌存在让动物产生一定依赖性的风险。相比细菌类益生菌,布拉迪酵母作为为数不多的酵母益生菌,属于“过胃菌”,不会在肠道内定植,一般会在48小时内代谢完毕,具有副作用小的先天优势。但是,目前关于布拉迪酵母多肽的研究甚少。
技术实现要素:4.为了克服现有技术的不足,本发明的目的是提供一种源自布拉迪酵母的酵母多肽及其制备方法和应用。
5.一种源自布拉迪酵母的酵母多肽,名为ftp
‑
21,其全序列为:swlsggfklkksvvkrfklcycrrfcvf,seq id no:1。
6.所述的多肽的制备方法,化学人工合成或者提取自布拉迪酵母cncm i
‑
1079的发酵产物。
7.所述的制备方法,自布拉迪酵母cncmi
‑
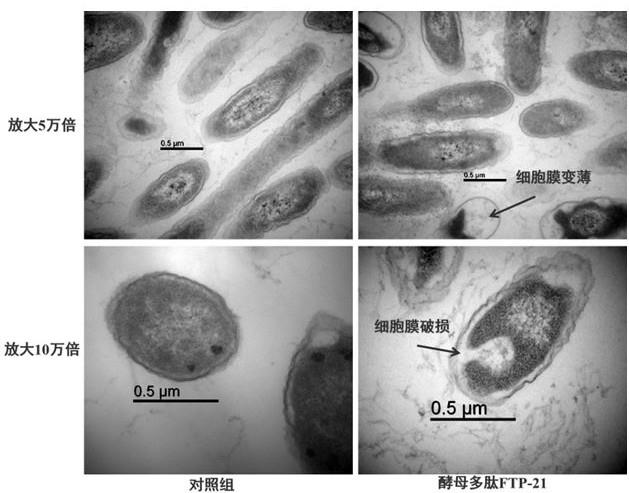
1079的发酵产物提取步骤如下:选用布拉迪酵母cncmi
‑
1079作为发酵微生物,选择玉米和石榴皮提取物作为发酵底物,调整发酵参数为:温度25℃,湿度75%,ph值中性偏酸性的发酵罐中发酵24
‑
48小时;真空冻干干燥机冻
干获取酵母粉,利用机械研磨破碎酵母细胞,再进行热处理以及乙醇沉淀提取酵母蛋白类物质,用阴离子交换纯化得到多肽ftp
‑
21。
8.所述的多肽的用途,用于选择性的杀菌或者抑菌,包括e. coli k 88、e. coli k 12、salmonella atcc13076、s. aureus atcc25923、c. perfringens atcc13124;选择性的保留益生菌,包括 lactobacillus acidophilus atcc4356、bifidobacterium longum atcc27533。
9.所述的多肽的用途,用于调理犬猫肠道菌群以及促进营养吸收的饲料添加剂。
10.所述的多肽的用途,用于制备改善犬猫炎症的免疫调控饲料添加剂。
11.本发明的有益效果:本发明的酵母多肽ftp
‑
21为α螺旋阳离子多肽,提取自布拉迪酵母发酵产物,分子量小,净电荷高,稳定性好,溶解性强,易消化吸收,并具有选择性的抗菌活性和安全性高等特点。该酵母多肽ftp
‑
21抗菌谱广,对e. coli k 88、 e. coli k 12、 salmonella atcc13076、 s. aureus atcc25923、c. perfringens atcc13124等致病菌具有杀菌抑菌作用、对lactobacillus acidophilus atcc4356、bifidobacterium longum atcc27533等益生菌无杀菌作用等优点。该酵母多肽ftp
‑
21还具有细胞毒性小、能发挥免疫调控作用改善猫泪痕以及减少眼睛分泌物等炎症现象等优点,可用于改善犬猫软便、腹泻,减轻便臭。
附图说明
12.图1是sds
‑
page电泳图谱及其目的条带酵母多肽ftp
‑
21;泳道1为marker;泳道2为阴离子交换色谱纯化后的酵母发酵产物样品1;泳道3为阴离子交换色谱纯化后的酵母发酵产物样品2;泳道4为阴离子交换色谱纯化后的酵母发酵产物样品3。
13.图2是酵母多肽ftp
‑
21的结构图。
14.图3是透射电镜(tem)观察酵母多肽ftp
‑
21处理后的大肠杆菌k88的细胞形态。
15.图4是不同溶度的酵母多肽ftp
‑
21的细胞毒性(ldh释放率),以上结果为6次独立重复实验平均值。
具体实施方式
16.下面结合附图和实施例对本发明作进一步阐述。
17.实施例1、酵母发酵产物的制备以及多肽ftp
‑
21的提取与鉴定选用布拉迪酵母cncm i
‑
1079作为发酵微生物,选择玉米和石榴皮提取物作为发酵底物,调整发酵参数为:温度25℃,湿度75%,ph值中性偏酸性的发酵罐中发酵24
‑
48小时。发酵产物的检测结果如下表1:
18.真空冻干干燥机冻干获取酵母粉。利用机械研磨破碎酵母细胞,再进行热处理以及乙醇沉淀提取酵母蛋白类物质。收集好酵母样品之后,用阴离子交换纯化酵母粉发酵的多肽,具体步骤如下:装柱,加入10体积的低盐缓冲液,至紫外吸收值稳定,将酵母样品注射至柱内,调整流速为1ml/min,继续加入10体积的低盐缓冲液至紫外吸收值稳定,用0.5mol/l的nacl梯度洗脱,收集样品。用bradford试剂盒测定酵母多肽(蛋白质)浓度,并用低盐缓冲液将蛋白浓度调整为1mg/ml,取5μg样品用于sds
‑
page分析,其余样品用
‑
80℃低温保存。
19.上机,利用edman法进行小肽类蛋白测序。将纯化后的多肽样品ftp
‑
21固定在印有蛋白质斑点的pvdf膜放置在反应器中,编辑好样品名称、循环方法、循环数目、标准氨基酸以及样品进样量之后,在反应器里利用edman法降解多肽,调整hplc系统到最佳状态,通过hplc鉴定释放的氨基酸衍生物。对整个ftp
‑
21重复进行测序过程,直到建立整个可测量序列或预定数量的循环,最后分析数据。测定的ftp
‑
21其全序列为:swlsggfklkksvvkrfklcycrrfcvf,seq id no:1。随后,利用i
‑
tasser蛋白质结构分析工具建立ftp
‑
21分子结构的模型。
20.实验结果如下:如图1所示,在marker条带3.7kda处找到目的条带酵母多肽ftp
‑
21,其中编号样品1、样品2和样品3为三个重复。ftp
‑
21的分子如图2所示为典型的α螺旋结构。
21.实施例2 、酵母多肽ftp
‑
21的抗菌实验(mic)将细菌(大肠杆菌e. coli k 12、大肠杆菌e. coli k 88、沙门氏菌salmonella、金黄色葡萄球菌s. aureus、产气荚膜梭菌c. perfringens、双歧杆菌bifidobacterium longum和嗜酸乳杆菌lactobacillus acidophilus)接种于mh肉汤固体培养基上,培养至长出单菌落,挑取单菌落接种于 3ml mh肉汤培养基中,放入摇床培养至菌液浑浊,取 30μl 菌悬液转接至 3ml 新鲜 mh 肉汤培养基中,恒温震荡培养至od
600
=0.5左右;取菌悬液 10μl转接至10ml新鲜mh肉汤培养基中涡旋混匀,控制浓度在1
×
105—5
×
10
5 cfu/ml,用于 最小抑菌浓度(mic)和tem的测定;将抗菌免疫肽进行梯度稀释,至终浓度为1280、640、320、160、80、40、20、10、5、2.5、1.25、0.625、0.3125(μg/ml),共13个系列浓度的肽稀释液,先向
无菌96孔圆底板加入90μl制备好的细菌悬液,再逐一加入10μl相应浓度的肽稀释液或者抗生素稀释液,每种抗菌物质做三个重复,另外设阳性对照孔为不加抗菌物质,只加100μl菌悬液,阴性对照孔加100μl lb培养基;将96孔板置于37℃生化培养箱中保湿静置培养18
‑
24小时,培养完后观察各孔底部是否有细菌沉淀产生,无肉眼可见细菌沉淀的最小浓度可判定为抗菌物质的mic。
22.与此同时,取部分酵母多肽ftp
‑
21样品进行透射电镜(tem)试验,以大肠杆菌为试验对象,对照组(空白组),酵母多肽ftp
‑
21组,处理好的不同组别样品转移至透射电镜(型号:hitachi h
‑
7650)中观察。
23.涉及到多肽的序列具体如下:1)ftp
‑
21其全序列为:swlsggfklkksvvkrfklcycrrfcvf,seq id no:1;2)猪源免疫肽pmap
‑
23:riidllwrvrrpqkpkfvtvwvr;3)牛源免疫肽in:ilpwkwpwwpwrr
ꢀ‑
nh2;4)虫源免疫肽ca:kwklfkkiekvgqnirdgiikagpavavvgqatqiak;5)人源免疫肽ll
‑
37:llgdffrkskekigkefkrivqrikdflrnlvprtes。
24.注:mic是minimum inhibitory concentration缩写,指最低抑菌浓度,最低抑菌浓度是测量抗菌药物的抗菌活性大小的一个指标,指在体外培养细菌18至24小时后能抑制培养基内病原菌生长的最低药物浓度。数值越小,说明抑菌效果越好。
25.检测结果如下:如表2所示,酵母多肽ftp
‑
21具有一定的抗菌效果,与ll
‑
37相当尤其是对沙门氏菌和大肠杆菌,且ftp
‑
21对益生菌无明显抑制效果,其他多肽例如ll
‑
37也具有一定的抗菌效果,但对益生菌例如双歧杆菌也有一定的抑制作用,pmap
‑
23无明显抑菌效果,可能原因是其在体内主要发挥的是免疫调控功能。抗生素方面,金霉素抗菌效果较好,但对益生菌具有较高的杀伤作用。如图3所示,ftp
‑
21作用于大肠杆菌k88之后,细胞膜破裂,内容物外泄,说明ftp
‑
21对大肠杆菌主要通过破膜作用杀死细菌。
26.实施例3 、酵母多肽ftp
‑
21的细胞毒性将分离纯化的外周围血单核细胞(pbmcs) 用培养基rmpi1640稀释至1
×
106个/ml,按照每孔 90ul接种96孔板,同时设背景对照(100μl rmpi1640培养基),低水平对照孔(90μl细胞悬液+10μl pbs)和高水平对照孔(90μl细胞悬液+10μl 20%的tritonx
‑
100)。将96孔板于37℃,5% co2培养箱中静置培养 2h;加入10ul相应浓度的ftp
‑
21和ll
‑
37,终浓度分别为 512μg/ml、256μg/ml、128μg/ml、64μg/ml、32μg/ml、16μg/ml、8μg/ml,每个处理6个重复。培养箱中培养 24h后,向阳性对照孔中加入10μl 20%的tritonx
‑
100,并用移液器吹打混匀,继续培养15min;培养结束后,1500rpm 离心10min;离心后自各孔中小心吸取 60ul细胞上清转移到透明平底 96孔培养板相应孔中;每孔加入稀释好的乳酸脱氢酶(ldh)检测试剂30ul,室温避光震荡培养30min,酶标仪测定od492nm、od900nm,计算δod值。
27.ldh释放率按下面公式计算:ldh释放率(%)=100%*(δod试验
‑
δod阴性对照)/(δod阴性对照
‑
δod阳性对照)。
28.ftp
‑
21外周单核细胞的ldh释放率结果如图4所示,在浓度低于256μg/ml时,酵母多肽ftp
‑
21对外周单核细胞的ldh释放率都小于20%,结果表明酵母多肽ftp
‑
21的细胞毒性低。
29.实施例4、酵母发酵产物以及多肽ftp
‑
21的调控肠道改善消化的作用猫粮中添加0.5%酵母发酵产物(含多肽ftp
‑
21),选取12只家猫进行饲喂,持续饲喂14天,与饲喂之前相比,受试猫的便臭明显改善且无软便现象,饲喂期间,受试猫的粪便一直处于正常状态。此外,实施例2结果所示,低浓度的ftp
‑
21能够抑制肠道内致病菌例如大肠杆菌e. coli k 88的生长,同时对肠道益生菌例如双歧杆菌无明显抑制作用。
30.实施例5 、酵母发酵产物以及多肽ftp
‑
21的免疫调控作用猫粮中添加0.5%酵母发酵产物(含多肽ftp
‑
21),选取6只具有泪痕以及眼睛分泌物较严重的家猫进行饲喂,持续饲喂14天,与饲喂之前相比,5只猫的泪痕得到了不同程度的缓解,具体表现为出现泪痕的频率明显降低,与此同时,眼睛分泌物的数量也明显降低,粘稠度也有所降低。
31.以上列举的仅为本发明的若干具体实施例,需特别注意的是,本发明不只局限于以上的实施例,可以有很多其他变形,包括人工合成酵母多肽ftp
‑
21的其他近似结构,改变氨基酸数量和种类,但不影响核心序列的功能特性,还包括酵母多肽的其他提取方式。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是在本发明的保护范围之内。